ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 309-318
УДК 547.455.522
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
НА ОСНОВЕ ТИОЛСОДЕРЖАЩИХ АЦИЛГИДРАЗОНОВ
D-ГЕКСОЗ И ИХ МОДИФИКАЦИЯ ТИОЛИРОВАННОЙ
ПОЛИ(2-ДЕЗОКСИ-2-МЕТАКРИЛОИЛАМИНО-
D-ГЛЮКОЗОЙ)
© 2019 г. А. Ю. Ершовa,b, *, М. Ю. Васильеваa, М. Л. Левитa, И. В. Лагодаc,
В. А. Байгильдинd, Б. М. Шабсельсa, А. А. Мартыненковa, А. В. Якиманскийa,d
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. В. О. 31, Санкт-Петербург, 199004 Россия
*е-mail: ershov305@mail.ru
b Санкт-Петербургский государственный технологический институт
(технический университет), Санкт-Петербург, Россия
c Государственный научно-исследовательский испытательный институт военной медицины
Министерства обороны РФ, Санкт-Петербург, Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 9 августа 2018 г.
После доработки 9 августа 2018 г.
Принято к печати 13 августа 2018 г.
На основе меркаптоацетил-, 3-меркаптопропионил- и 2-меркаптобензоилгидразонов природных гексоз
(D-глюкоза, D-галактоза и D-манноза) и тиолированной поли(2-дезокси-2-метакрилоиламино-D-глюкозы)
разработан метод синтеза гликонаночастиц золота co средним размером частиц 15-30 нм и низким
значением индекса полидисперсности.
Ключевые слова: тиолсодержащие ацилгидразоны D-глюкозы и D-галактозы и D-маннозы, кольчато-
кольчатая таутомерия, поли(2-дезокси-2-метакрилоиламино-D-глюкоза, гликонаночастицы золота
DOI: 10.1134/S0044460X19020215
В последнее время интенсивно развивается ряд
солей благородных металлов (чаще всего, серебра
направлений, связанных с получением и исследо-
и золота) в присутствии восстанавливающих
ванием металлических гликонаночастиц в биоло-
агентов различной природы
[1-16]. При этом
гических и биомедицинских целях [1-17]. Благодаря
синтез исходных тиолсодержащих сахаров
-
своему уникальному химическому строению, имити-
многостадийный процесс, требующий, наряду с
рующему естественную клеточную поверхность,
введением самой тиолсодержащей функции,
повышенному сродству к природным гликопроте-
предварительной защиты гидроксильных групп
иновым молекулам, а также необычным опти-
углеводного фрагмента молекулы [17].
ческим свойствам, данные объекты находят
Ранее нами был предложен одностадийный
применение в качестве иммунохимических маркеров
метод синтеза тиолсодержащих углеводов, основан-
и биосенсоров [2-4], активно используются для
ный на прямом взаимодействии природных дисаха-
диагностики и лечения ряда онкологических
ридов c гидразидами тиолсодержащих кислот:
заболеваний [5-12], обладают бактерицидными и
меркаптоацетилгидразином, 3-меркаптопропионил-
противовирусными свойствами [13].
гидразином и
2-меркаптобензоилгидразином, а
Основной путь синтеза гликонаночастиц связан
также были получены гликонаночастицs Аg и Au
с взаимодействием тиолсодержащих углеводов и
на их основе [18-21]. Данный метод не предпо-
309
310
ЕРШОВ и др.
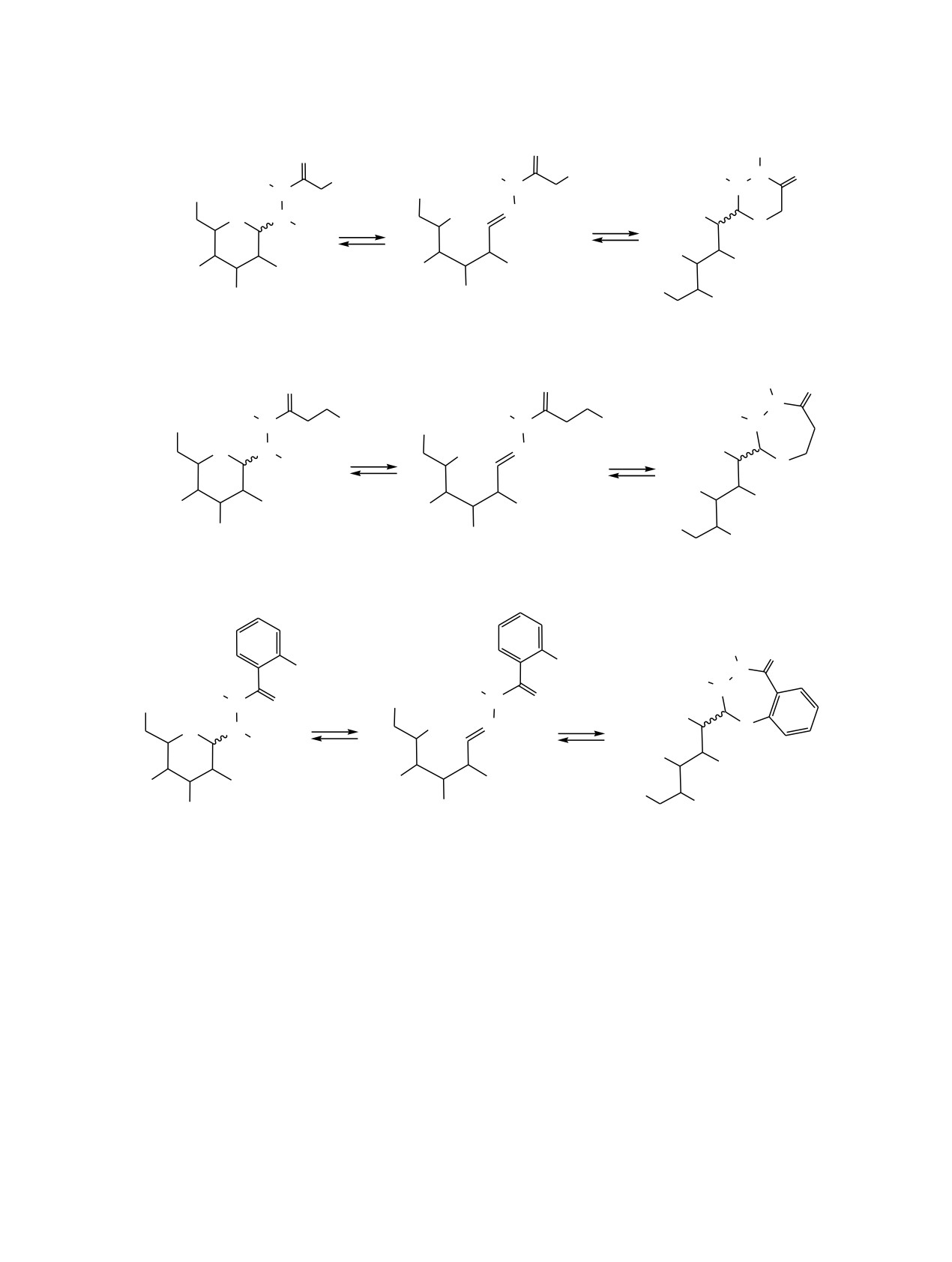
Схема 1.
O
H
O
H
SH
H
N O
H
SH
N
N
OH
N
OH
1
OH N
HO2
6
5
O 1 N
S
H
3
4
HO
4
3
OH
HO
2
OH
HO
OH
5
HO
6
OH
OH
OH
1aв
1aв
1aв
A
Б
B
O
O
H O
N
H
H
H
OH
SH
SH
N
N
N
OH
1
6
HO 2
5
O 1 N
OH N
H
S
3
4
2
3
HO
4
OH
HO
OH
HO
OH
5
HO
6
OH
OH
OH
2aв
2aв
2aв
A
Б
Г
H O
SH
SH
N
H
H
H
N
OH
N
O
1
OH
N
O
HO 2
6
OH N
S
5
O 1 N
H
3
HO
4
4
2
3
OH
HO
OH
HO
OH
5
HO
6
OH
OH
OH
3a, б
3a, б
3a, б
A
Б
Д
D-глюкоза (а), D-галактоза (б), D-манноза (в).
лагает предварительной защиты гидроксильных
тозы и D-маннозы с тиолсодержащими гидра-
групп исходного углевода, что в значительной
зидами.
степени упрощает синтез тиолсодержащих сахаров
Известно, что SH-ацилгидразоны сахаридов -
и гликонаночастиц благородных металлов на их
сложные в таутомерном плане системы,
основе.
способные к циклизации как в пиранозную форму
Целью данной работы было изучение
А, так и в 1,3,4-тиадиазиновую (1,3,4-тиадиазе-
возможности синтеза гликонаночастиц Аu на
пиновую) формы В, Г и Д, являющиеся
основе взаимодействия коллоидного золота с
результатом внутримолекулярных нуклеофильных
соединениями 1a-в, 2а-в и 3a, б, полученными
присоединений тиольной группы к связи C=N
нами ранее
[22-25] на основе взаимодействия
линейной структуры Б. При этом также
природных моносахаридов D-глюкозы и D-галак-
необходимо учитывать, что каждая из этих форм
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
311
Таблица 1. Таутомерный состав соединений 1a-3б в различных растворителях через 48 ч после растворения
Таутомерный состав, %
Форма в кристаллическом
№
D2O
ДМФА-d7
состоянии
A
Б
В, Г или Д
A
Б
В, Г или Д
1a
A
70
-
30
60
5
35
1б
В
15
-
85
35
10
55
1в
В
10
-
90
25
15
60
2a
A
85
5
10
75
10
15
2б
A
70
5
25
60
20
20
2в
A
75
5
20
70
10
20
3a
Д
25
5
70
-
-
100
3б
Д
15
5
80
-
-
100
способна существовать в виде двух простран-
Переход от продуктов конденсации моносаха-
ственных изомеров (α,β-изомеры формы А, Z',E'-
ридов с гидразидом тиогликолевой кислоты к
конформеры формы Б и R,S-диастереомеры форм
производным на основе гидразида 3-меркапто-
В, Г, и Д (схема 1).
пропионовой кислоты (соединения
2a-в) пред-
полагает вовлечение в таутомерное равновесие
Не вдаваясь в детальное обсуждение
семичленной
1,3,4-тиадиазепиновой формы Г,
установленных нами ранее [22-25] спектральных
являющейся результатом внутримолекулярного
различий между возможными формами, основанных
нуклеофильного присоединения тиольной группы
на использовании метода спектроскопии ЯМР 1H и
к связи C=N линейной структуры Б. Оказалось, что
13С, укажем лишь общие закономерности строения
для соединений
2a-в наблюдается заметное
соединений 1-3 в различных растворителях (табл. 1).
смещение кольчато-линейно-кольчатого таутомер-
ного равновесия между формами А, Б и Г в
В кристаллическом состоянии соединение 1а -
сторону пиранозной формы А; в этой форме
продукт конденсации D-глюкозы с гидразидом
соединения 2a-в существует в кристаллическом
тиогликолевой кислоты
- имеет циклическое
состоянии и она является превалирующей в
пиранозное строение А, тогда как производные D-
растворах всех применяемых растворителей (табл. 1).
галактозы
(1б) и D-маннозы
(1в) находятся в
кристаллическом состоянии в шестичленной 1,3,4-
2-Меркаптобензоилгидразоны D-глюкозы и D-
тиадиазиновой форме В. На это указывает
галактозы (соединения
3a, б) имеют в
различие в положении сигналов аномерного атома
кристаллическом состоянии циклическое
1,3,4-
С1 в спектрах ЯМР 13С, снятых в твердой фазе:
бензотиадиазепиновое строение Д. Эта же форма
89.98 (О,С,N-окружение) и 76.45 м. д. (S,С,N-
является единственной для соединений 3а и 3б в
окружение).
растворах апротонных полярных растворителей
(ДМCO-d6, ДМФА-d7). В растворах в D2O
В растворах соединений 1a-в в D2O реали-
соединения
3а и
3б претерпевают частичный
зуются варианты кольчато-кольчатых таутомерных
переход (15-25%) в пиранозную форму А, при
равновесий между пиранозной (А) и
1,3,4-
этом в обоих случаях реализуется вариант кольчато-
тиадиазиновой (В) формами, при этом положение
линейно-кольчатого таутомерного равновесия
равновесия определяется природой исходного
между формами А, Б и Д с явным преобладанием
моносахарида и варьируется в широких пределах -
последней.
от 70:30 до 10:90% форм А и В для соединений 1а
и 1в соответственно. Использование апротонных
Поскольку для всех исследованных продуктов
полярных растворителей (ДМCO-d6, ДМФА-d7)
конденсации гексоз с тиолсодержащими гидра-
приводит к частичной стабилизации линейного
зидами форма Б не являлась превалирующей и ее
таутомера Б (табл. 1).
доля в растворах не превышала 50%, термин «SH-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
312
ЕРШОВ и др.
Схема 2.
OH
HO
OH
O
HO
HO
OHOH
OH
HO
N
H
HO
O
H
H
N
O
N
OH
HO
O
O
H NN
N
(R)
H
H (R)
(R)
S
O
OH H O
S
S
HAuCl4
H
HO
O
1aв, 2ав, 3а, б
HO
OH
N N
(R) S
Au
S (R)
N
Na citrate
OH
HO
N
O
OH
H
S
S
O
H
HO
S
(R)
O (R)
H
H
(R)
N
N
N
O
H
O
N
OH
HO
O
N H
H
OH
O
H
N
OH
HO
HO
OH
HO
O OH
HO
OH
OH
4aв, 5ав, 6а, б
D-глюкоза (а), D-галактоза (б), D-манноза (в); R=CH2 (4a-в), CH2CH2 (5a-в), C6H4 (6a, б).
ацилгидразон» для подобных систем носит услов-
4в этот процесс занимает несколько суток, что
ный характер.
может быть связано с бóльшей стабильностью
шестичленной тиадиазиновой формы В этих
Синтез гликонаночастиц Au 4a-в, 5a-в и 6a, б
соединений по сравнению со стабильностью
осуществляли выдерживанием при комнатной
семичленных циклов Г и Д соединений 5a-в и 6a, б
температуре смеси водных растворов коллоидного
соответственно.
золота, полученного цитратным способом по
методу Туркевича [26] и соединений 1a-в, 2а-в и
Очевидно, что взаимодействие соединений 1-3
3а, б соответственно (схема 2). В течение всего
с коллоидным золотом осуществляется через
процесса образования гликонаночастиц Au 4a-6б
пиранозную форму А, поскольку серосодержащие
проводили визуальный контроль за ходом реакции,
1,3,4-тиадиазиновый В и 1,3,4-тиадиазепиновые Г
а также осуществляли анализ размера форми-
и Д циклы, в структуре которых не содержится
рующихся гликонаночастиц золота методом динами-
тиольной функции, не способны к такому
ческого светорассеяния (ДСР) и просвечивающей
взаимодействию. Возможность участия линейной
электронной микроскопии (ПЭМ).
гидразонной формы Б во взаимодействии с
коллоидным золотом также следует исключить из
Образование гликонаночастиц золота начи-
рассмотрения, поскольку содержание этой формы в
нается через несколько часов после смешивания
растворах в D2O для соединений 1-3 не превышает
растворов исходных соединений 1-3 с коллоидным
5% (табл. 1).
золотом, о чем можно судить визуально по
переходу окраски раствора от темно-красной в
Характерной особенностью гликонаночастиц
фиолетовую и завершается для
3-меркапто-
Au
4-6 является наличие в их электронных
пропионил- и 2-меркаптобензоилгидразонов гексоз
спектрах
полосы плазмонного резонанса,
5a-в и 6a, б, а также меркаптоацетилгидразона D-
максимум которой приходится на диапазон 525-
глюкозы 4а, уже через сутки. В случае меркапто-
530 нм (рис. 1а). Судя по данным ДСР и ПЭМ,
ацетилгидразонов D-галактозы и D-маннозы 4б и
средний диаметр полученных наночастиц
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
313
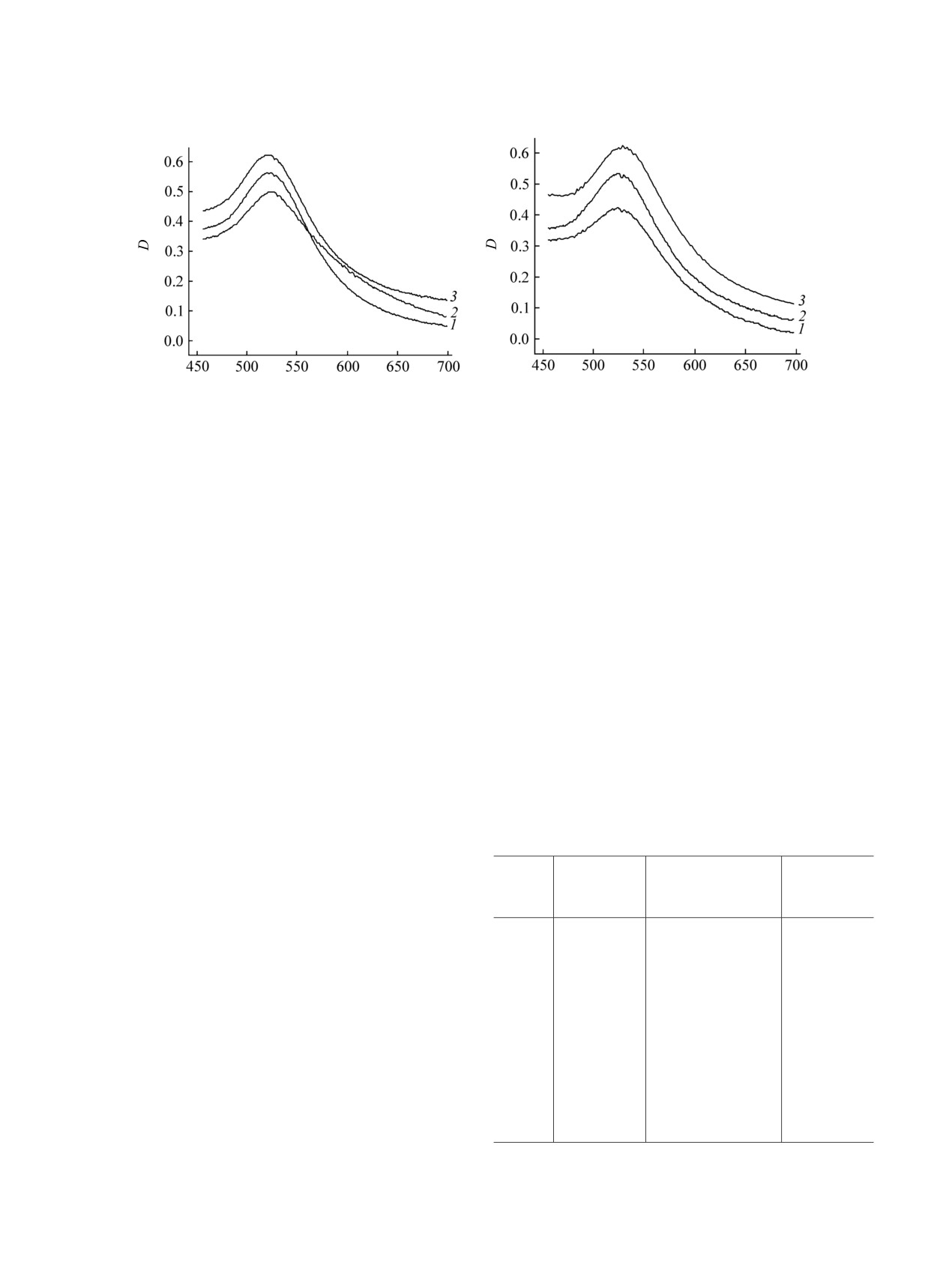
(а)
(б)
λ, нм
λ, нм
Рис. 1. (а) Электронные спектры гликонаночастиц Au на основе меркаптоацетилгидразона D-глюкозы 4a (1), 3-меркапто-
пропионилгидразона D-глюкозы
5a
(2),
2-меркаптобензоилгидразона D-глюкозы
6a
(3). (б) Электронные спектры
полимерсодержащих гликонаночастиц Au на основе меркаптоацетилгидразона D-глюкозы 10a (1), 3-меркаптопропионил-
гидразона D-глюкозы 10б (2), 2-меркаптобензоилгидразона D-глюкозы 10в (3).
составляет
18-22 нм и имеет узкий индекс
использовании в качестве стабилизатора натриевой
полидисперсности (табл. 2, рис. 2).
соли N-лаурилсаркозина, которую добавляли в
реакционную смесь при синтезе гликонаночастиц
Агрегативная устойчивость гликонаночастиц
Au 5а-в в молярном соотношении 1:1 от массы
Au
4-6 в значительной степени определяется
исходного тиолсодержащего углевода. Следует
строением исходного тиолсодержащего гидразида.
заметить, что полученные после добавления Na-N-
Так, гликонаночастицы Au
4a-в и
6a, б,
лаурилсаркозина коллоидные растворы глико-
полученные на основе продуктов конденсации
наночастиц Au 5a-в оказались устойчивыми при
гексоз с гидразидами тиогликолевой и 2-меркапто-
выдерживании в течение
3-4 недель, что
бензойной кислот оказались устойчивыми при
контролировалось
нами
оптическими
и
хранении в течение 3-4 недель и увеличение их
спектральными методами анализа.
диаметра, согласно данным ДСР, не превышало 5%.
Второй метод стабилизации основан на взаимо-
С другой стороны, гликонаночастицы Au 5a-в,
действии гликонаночастиц Au с тиолированной
полученные на основе продуктов конденсации D-
поли(2-дезокси-2-метакрилоиламино-D-глюкозой) 9,
глюкозы, D-галактозы и D-маннозы с гидразидом
3-меркаптопропионовой кислоты, претерпевают
заметную агрегацию уже через
2-3 сут после
Таблица 2. Данные о размерах, полидисперсности и
приготовления. Визуально это можно наблюдать
световому поглощению водных растворов гликонаночастиц
по переходу окраски раствора от фиолетовой до
Au 4a-6б через 72 ч после приготовления
бледно-голубой, а затем до полного обесцвечи-
вания раствора. Агрегация вышеуказанных глико-
Средний
Индекс поли-
Длина
№
диаметр, нм
дисперсности
волны, нм
наночастиц Au подтверждается также данными
ДСР и электронной спектроскопии по заметному
4а
21
0.60
528
смещению полосы плазмонного резонанса в
длинноволновую область. Аналогичная склонность
4б
19
0.22
525
к агрегации наблюдалась нами ранее [18] при
4в
16
0.22
527
изучении свойств гликонаночастиц Au, получен-
ных на основе продуктов конденсации D-лактозы и
5а
19
0.53
530
D-мальтозы с гидразидом 3-меркаптопропионовой
5б
19
0.43
525
кислоты.
5в
21
0.35
525
Для предотвращения агрегации полученных
6a
18
0.60
524
гликонаночастиц Au 5а-в нами рассмотрены два
подхода. Первый из них базируется на
6б
22
0.25
527
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
314
ЕРШОВ и др.
Схема 3.
OH
OH
HO
HO
O
O
HO
HO
OH
OH
NH
7
NH
CN
Ph
S
COOH
+
O
CN
O
CH2
HOOC
H2C
H2C
H
SCSPh
S
Me
2C
n
Me
Me
Me
7
8
9
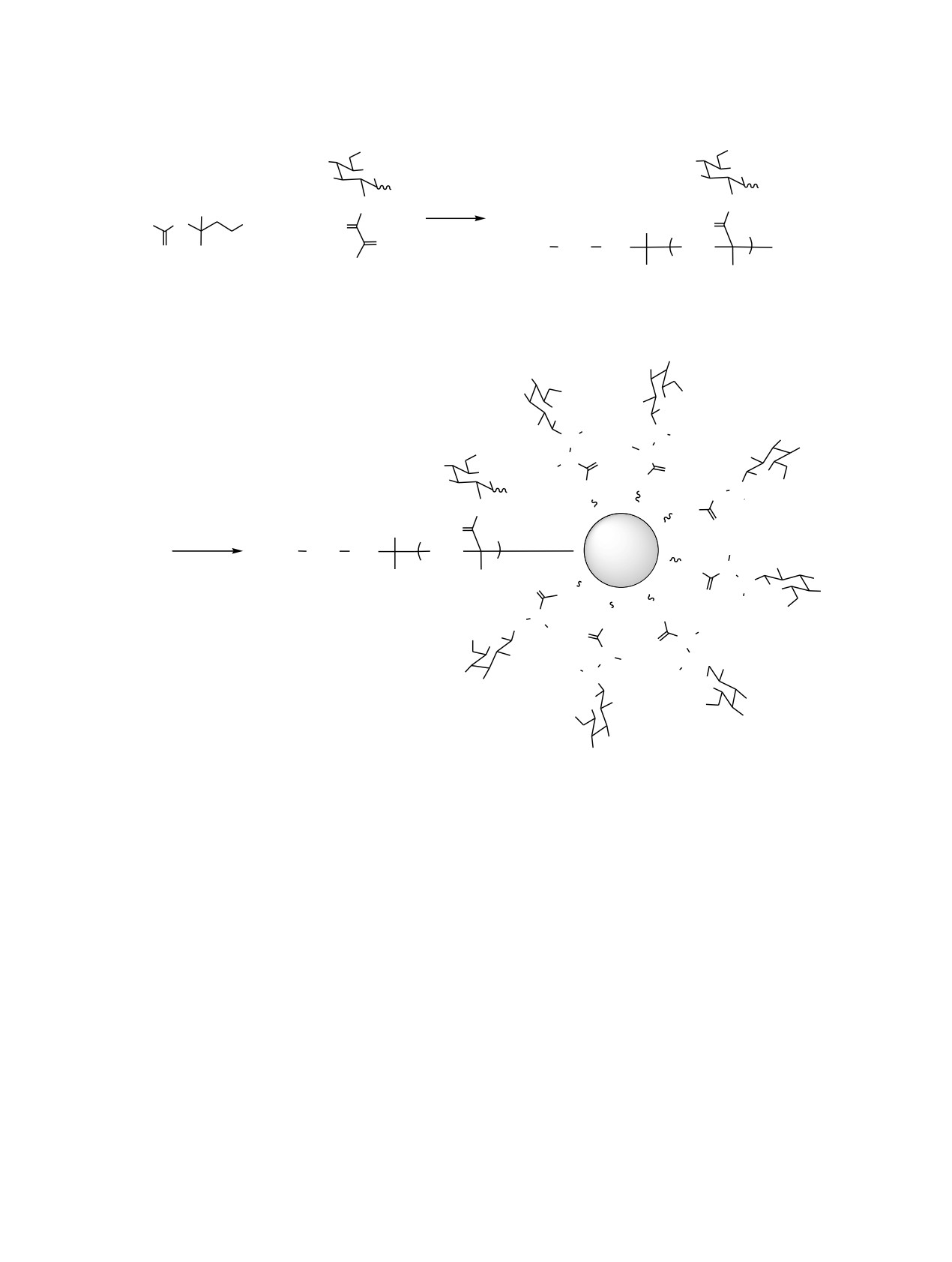
Схема 4.
OHOH
HO
HO
OH
OH
HO
O
O
H
N
OH
HO N
H
H
OH
OH
N
HO
N
O
HO
O
H
O
H
O
HO
(R)
OH
(R)
N
N
HO
NH
H
S
S
(R)
CN
O
S
O
9
4a, 5a, 6а
H
HOOC
H2C
H2C
H2C
S
Au
n
S
cyc-HeNH2
(R)
HO
N
Me
Me
S
OH
O
N
S
S
O
OH
(R)
O
H
(R)
H
HO
N
(R)
N
OH
H
H
O
O
N
O
OH
N H
N OH
H
HO
N
H
HO
O
O
OH
HO
OH
HO
OH
OH
OH
10aв
D-глюкоза (а-в), R=CH2 (a), R=CH2CH2 (б), R=C6H4 (в).
полученной из
2-дезокси-2-метакрилоиламино-D-
приводит к образованию поли(2-дезокси-2-
глюкозы
8 в условиях RAFT-полимеризации
метакрилоиламино-D-глюкозы)
9,
содержащей
(Reversible Addition-Fragmentation Chain-Transfer)
терминальную дитиобензоильную группировку.
с использованием 4-дитиобензоил-4-циановалери-
Согласно данным гель-проникающей хромато-
ановой кислоты 7 в качестве агента обратимой
графии, полимер 9 имел молекулярную массу Mn =
передачи цепи. Данная реакция рассмотрена нами
6100 и молекулярно-массовое распределение 1.05.
на примере гликонаночастиц Au 4а, 5а и 6а -
В спектре ЯМР 13С соединения 9, снятого в
производных меркаптоацетил-, 3-меркаптопропионил-
твердой фазе, наряду с сигналами основной цепи
и
2-меркаптобензоилгидразонов D-глюкозы
при 18.01 (CH3) и 45.95 (CH2) м. д., присутствуют
соответственно (схемы 3 и 4).
два сигнала аномерного атома С1 при 91.25 и
96.32 м. д., указывающие на наличие конфигура-
Радикальная полимеризация 2-дезокси-2-мета-
ционной α,β-изомерии пиранозного цикла в
крилоиламино-D-глюкозы 8 проходит в ДМФА при
примерном соотношении форм 6:1.
70°С в присутствии
4-дитиобензоил-4-циано-
валериановой кислоты
7, взятой в молярном
В литературе имеется ряд примеров снятия
соотношении 1:20 от массы исходного мономера, и
терминальной тиоацильной группировки углевод-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
315
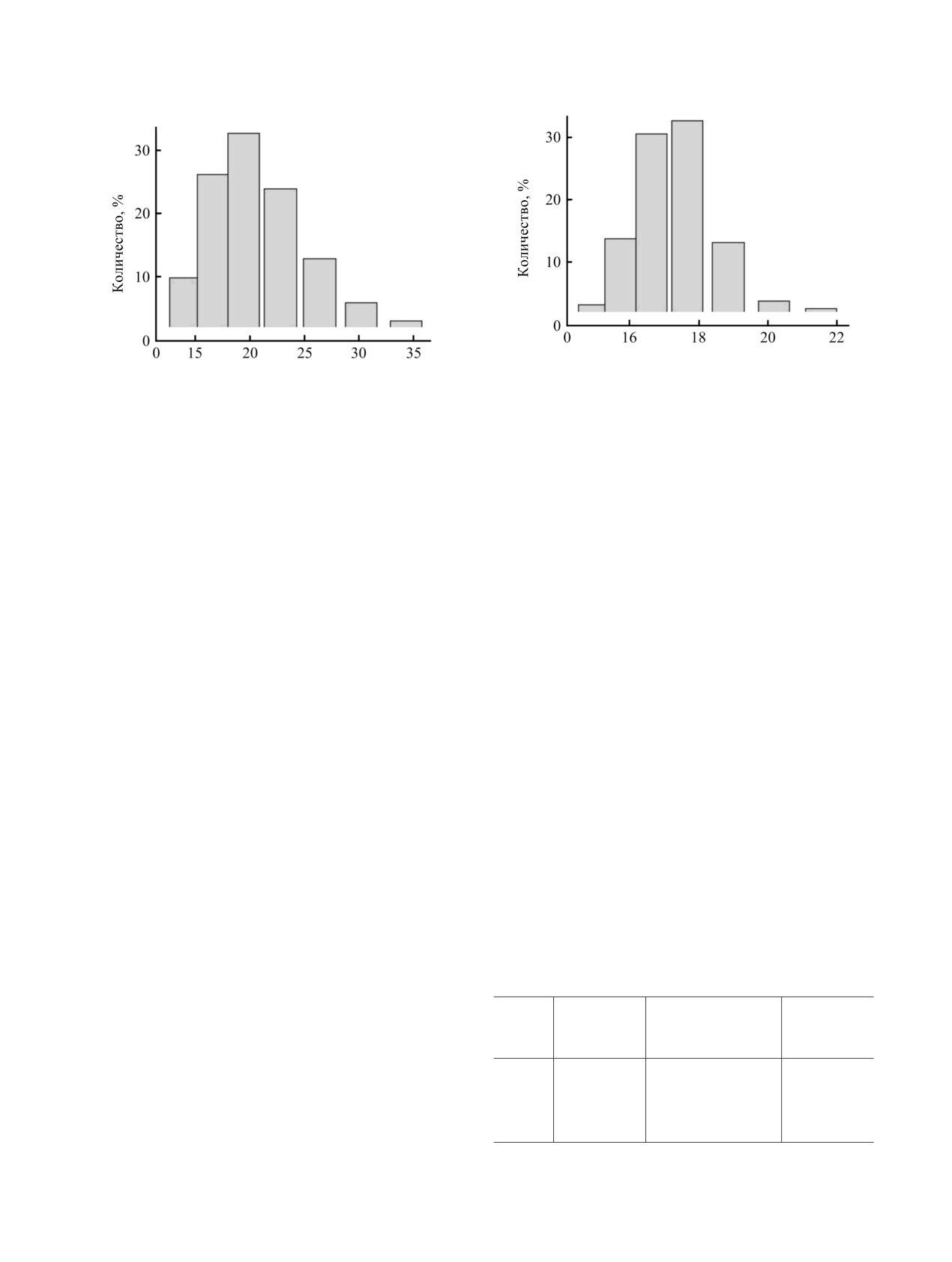
Диаметр частиц, нм
Диаметр частиц, нм
Рис. 3. Распределение по размерам полимерсодержащих
Рис. 2. Распределение по размерам гликонаночастиц
гликонаночастиц Au 10a на основе меркаптоацетил-
Au на основе меркаптоацетилгидразона D-глюкозы 4a.
гидразона D-глюкозы.
содержащих полимеров [27-35]. Это достигается
альдоз могут быть использованы синтетические
действием агентов различной природы: боргидрида
полисахариды, содержащие в своем составе
натрия [30, 31], первичных аминов [32], гидразина
функциональную тиольную группу. В этом случае
и его производных [33]. Образующиеся в ходе
углеводсодержащая макромолекула, входящая в
удаления тиоацильной группы тиолсодержащие
состав наночастицы, может выполнять функции
полимеры могут представлять интерес в после-
вектора молекулярного узнавания, направляя
дующей реакции алкеновой гидротиолизации с
иммобилизированные ею гликонаночастицы в
целью получения материалов как технического, так
определённый орган или ткань живого организма.
и биомедицинского профиля [35-37].
Кроме того, представляется также актуальным
Нами показано, что удаление тиобензоильной
изучение радиопротекторных свойств исходных
группы полимера 9 проходит количественно после
меркаптоацетил-, 3-меркаптопропионил- и 2-мер-
выдерживания его водного раствора с эквива-
каптобензоилгидразонов D-гексоз. Накопленные к
лентным количеством циклогексиламина в течение
настоящему моменту данные
[38] свидетель-
нескольких часов при 25°С. Полученный раствор
ствуют, что соединения, в структуре которых
тиолированной
поли(2-дезокси-2-метакрилоил-
содержатся дисульфидные или тиольные группы,
амино-D-глюкозы) затем добавляли в реакционную
обладают высокой профилактической радио-
смесь при синтезе гликонаночастиц Au 4а, 5а и 6а
защитной активностью. Такие вещества могут
в молярном соотношении 1:10 от массы исходного
применяться при лучевой терапии онкологических
тиолсодержащего моносахарида. Судя по данным
больных, а также для защиты клеток, не вовлечен-
ДСР и ПЭМ, диаметр полученных полимер-
ных в опухолевый рост от цитотоксического
содержащих гликонаночастиц 10а-в составляет 18-
действия
химиотерапевтических препаратов.
31 нм и имеет средний индекс полидисперсности
Между тем, широкое практическое применение
(табл. 3, рис. 3). При этом растворы соединений
10а-в оказались устойчивыми при выдерживании в
Таблица 3. Данные о размерах, полидисперсности и
течение 3-4 недель, и наблюдаемое увеличение их
световому поглощению водных растворов полимер-
диаметра, вызванное частичной агрегацией, не
содержащих гликонаночастиц Au 10a-в через 72 ч после
превышало 5%.
приготовления
Таким образом, предложен простой метод
Средний
Индекс поли-
Длина
№
синтеза гликонаночастиц Au на основе тиол-
диаметр, нм
дисперсности
волны, нм
содержащих ацилгидразонов D-глюкозы, D-
галактозы и D-маннозы. Показана принципи-
10а
18
0.57
527
альная возможность синтеза Au гликонаночастиц
10б
22
0.41
528
смешанно-лигандного типа, где наряду с
10в
31
0.67
531
исходными тиолсодержащими ацилгидразонами
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
316
ЕРШОВ и др.
серосодержащих препаратов ограничено их плохой
охлаждали до 25°С и использовали в синтезе глико-
переносимостью. Одним из способов снижения
наночастиц Au
4-6. Судя по данным ДРС и
токсичности и, тем самым, улучшения перено-
электронной спектроскопии, полученный раствор
симости серосодержащих радиопротекторов,
содержал основную фракцию коллоидного золота с
может являться включение в их состав фрагментов
диаметром частиц 12.0±0.50 нм и имел максимум
природных моно-, ди- и полисахаридов. Это будет
поглощения при длине волны 524 нм.
являться предметом наших дальнейших исследований.
Синтез гликонаночастиц золота
4а-6б. К
раствору 10 мл 0.0001 М. раствора коллоидного
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
золота по каплям при перемешивании добавляли
Элементный анализ проводили на анализаторе
раствор 0.0002-0.003 моля соединения 1a-в, 2а-в
Hewlett-Packard
185B. Спектры ЯМР
1Н и 13С
или 3а, б в 1 мл Н2О (в случае соединений 5a-в с
снимали на спектрометре Bruker AV-400 при
добавлением
0.02 г Na-N-лаурилсаркозина) и
рабочих частотах 400 и 100 МГц соответственно.
выдерживали полученную смесь при
25°С в
Спектры ЯМР 13С в твердой фазе снимали на
течение 48-72 ч. Контроль за протеканием реакции
спектрометре Bruker AМ-500 при рабочей частоте
осуществляли визуально по изменению окраски
125 МГц по стандартной методике с исполь-
раствора от темно-красной до фиолетовой, а также
зованием передачи поляризации и вращением под
с использованием методов ДРС, ПЭМ и электрон-
магическим углом с частотой
4.5
кГц.
ной спектроскопии.
Электронные спектры поглощения гликонано-
Синтез и физико-химические параметры 2-дез-
частиц золота регистрировали на спектро-
окси-2-метакрилоиламино-D-глюкозы 8 приведены
фотометре СФ-2000 в диапазоне длин волн 300-
в работе [34].
750 нм в кварцевой кювете толщиной
1 см.
Диаметр и индекс полидисперсности полученных
Синтез поли(2-дезокси-2-метакрилоиламино-
гликонаночастиц золота определяли методом
D-глюкозы) 9. К раствору 1.05 г (4.25 ммоль)
динамического светорассеяния на анализаторе
соединения 8 в 4.5 мл ДМФА добавляли 0.59 г
Malvern Zetasizer Nano-ZS с длиной волны
(0.21 ммоль) 4-дитиобензоил-4-циановалериановой
лазерного излучения 633 нм. Для определения
кислоты и
0.009 г
(0.053 ммоль) динитрила
морфологии гликонаночастиц золота исполь-
азобисизомасляной кислоты и выдерживали смесь
зовался метод просвечивающей электронной
при 70°С в течение 16 ч. Полимер 9 выделяли
микроскопии на микроскопе Jeol JEM 100 S.
осаждением в 150 мл Et2O и последующей сушкой
в вакууме. Очистку от низкомолекулярных
Определение молекулярных масс и моле-
примесей осуществляли методом диализа против
кулярно-массового распределения поли(2-дезокси-
воды с использованием мембран Orange Scientific с
2-метакрилоил-D-глюкозы)
9
осуществляли
размером пор
1000 Да и последующей
методом гель-проникающей
хроматографии на
лиофилизацией. Выход 0.66 г (63%), Mn
6100.
жидкостном хроматографе Agilent-1260 Infinity,
Спектр ЯМР 1Н (D2O), δ, м. д.: 1.04-1.26 м (3Н,
оснащенным рефрактометрическим, светорассе-
CH3), 3.49 м (2Н, Н3 + Н5), 3.84-3.91 м (4H, Н2 + Н4 +
ивающим и вискозиметрическим детекторами в
Н6), 5.1-5.3 м (1Н, Нα1 + Нβ1). Спектр ЯМР 13С
комбинации с двумя колонками Agilent PLgel
(твердая фаза), δС, м. д.: 18.01 (CH3), 45.95 (CH2),
MIXED-C (7.5×300 мм). Анализ проводили при 50°С,
55.65 (C2), 62.28 (C6), 72.06 (C4 + C5), 75.66 (C3),
в качестве подвижной фазы использовали ДМФА с
91.25 (Cα1), 96.32 (Cβ1), 178.98 (C=O).
0.1 М. LiBr со скоростью потока элюента 1 мл/мин.
Синтез полимерсодержащих гликонаночастиц
Синтез и физико-химические параметры тиол-
золота 10a-в. К раствору 0.015 г соединения 9 в
содержащих ацилгидразонов гексоз 1-3 приведены
2 мл Н2О добавляли 1.0 мл 0.001 М. раствора
в работах [22-25].
циклогексиламина. Выдерживали полученную
Получение раствора коллоидного золота. К
смесь при при 25°С в течение 3 ч, затем добавляли
200 мл 0.01 М. раствора HAuCl4 при 70°C при
0.003 моля соединения 1а, 2а или 3а. К получен-
перемешивании добавляли горячий раствор 0.10 г
ному раствору по каплям при перемешивании
трехводного цитрата натрия в 10 мл Н2О. Смесь
добавляли 10 мл 0.0001 М. раствора коллоидного
перемешивали в течение 20 мин при 75-80°С до
золота и выдерживали смесь при 25°С в течение 48-
образования темно-вишневого окрашивания, затем
72 ч. Контроль за протеканием реакции осущест-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
317
вляли с использованием методов ДРС, ПЭМ и
2016. Vol. 23. P. 365. doi 10.1038/cgt.2016.42
электронной спектроскопии.
13. Veerapandian M., Lim S.K., Nam H.M., Kuppannan G.,
Yun K.S. // Analyt. Bioanalyt. Chem. 2010. Vol. 398.
КОНФЛИКТ ИНТЕРЕСОВ
P. 867. doi 10.1007/s00216-010-3964-5
14. Perfezou M., Turner A., Merkoci A. // Chem. Soc. Rev.
Авторы заявляют об отсутствии конфликта
2012. Vol. 41. P. 2606. doi 10.1039/C1CS15134G
интересов.
15. Love J.C., Estroff L.A., Kriebel J.K., Nuzzo R.G.,
Whitesides G.M. // Chem. Rev. 2005. Vol. 105. P. 1103.
СПИСОК ЛИТЕРАТУРЫ
doi 10.1021/cr0300789
16. Pourceau G., del Valle-Carrandi L., Di Gianvincenzo P.,
1. Carbohydrate nanotechnology / Ed. K.J. Stine. New
Michelena O., Penades S. // RSC Adv. 2014. Vol. 4.
Jersey: John Wiley & Sons,
2016.
470 p. doi
P. 59284. doi 10. 1039/C4RA11741G
10.1002/9781118860212.ch3
17. Wang C. // Adv. Mater. Res. 2013. Vol. 643. P. 153. doi
Eds S.-C. Hung, M.M.L. Zulueta. Hoboken: John Wiley
18. Васильева М.Ю., Ершов А.Ю., Байгильдин В.А.,
& Sons, Inc.,
2016.
576 p. doi
10.1002/
Шабсельс Б. М., Лагода И.В., Якиманский А.В. //
9781119006435.ch16
ЖОХ. 2018. Т. 88. Вып. 6. С. 1027; Vasileva M.Yu.,
3. Engineered carbohydrate-based materials for biomedical
Ershov A.Yu., Baygildin V.A., Shabsels B.M., Lagoda I.V.,
applications: polymers, surfaces, dendrimers, nano-
Yakimansky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
particles, and Hydrogels / Ed. R. Narain. New Jersey:
N 6. P. 1205. doi 10.1134/S1070363218060257
2011.
424 p. doi
19. Ершов А.Ю., Васильева М.Ю., Лагода И.В.,
10.1002/9780470944349.ch6
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып.
6.
С. 1020; Ershov A.Yu., Vasileva M.Yu., Lagoda I.V.,
Istanbul: InTech Publisher,
2017.
164p. doi
Yakimansky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
10.5772/66194
N 6. P. 1199. doi 10.1134/S1070363218060245
5. Nanobiomaterials in cancer therapy: applications of
20. Ершов А.Ю., Васильева М.Ю., Лагода И.В.,
nanobiomaterials
/ Ed. A. Grumezescu. Oxford:
Байгильдин В.А., Наследов Д.Г., Кулешова Л.Ю.,
Elsevier Science Publishing Co Inc., 2016. 588 p. doi
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып. 1. С. 108;
10.1016 /B978-0-323-42863-7.00002-5
Ershov A.Yu., Vasileva M.Yu., Lagoda I.V., Baygil-
din V.A., Nasledov D.G., Kuleshova L.Yu., Yakiman-
6. Marin M.J., Schofield C.L., Field R.A., Russell D.A. //
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 1.
Analyst.
2015. Vol.
140. P.
59. doi
10.1039/
P. 103. doi 10.1134/S1070363218010164
C4AN01466A
21. Васильева М.Ю., Ершов А.Ю., Байгильдин В.А.,
7. de la Fuente J.M., Penades S. // Biochim. Biophys.
Лагода И.В., Кулешова Л.Ю., Штро А.А., Зарубаев В.В.,
Acta. 2006. Vol. 1760. N 4. P. 636. doi 10.1016/
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып. 1. С. 115;
j.bbagen.2005.12.001
Vasileva M.Yu., Ershov A.Yu., Baygildin V.A., Lagoda I.V.,
8. Barrientos A.G., de la Fuente J.M., Rojas T.C.,
Kuleshova L.Yu., Shtro A.A., Zarubaev V.V., Yakiman-
Fernandez A., Penades S. // Chem. Eur. J. 2003. Vol. 9.
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 1.
N 9. P. 1909. doi 10.1002/CHEM.200204544
P. 109. doi 10.1134/S1070363218010176
9. Vetro M., Safari D., Fallarini S., Salsabila K., Lahmann M.,
22. Ершов А.Ю., Лагода И.В., Якимович С.И., Зерова И.В.,
Penades S., Lay L., Marradi M., Compostella F. //
Пакальнис В.В., Мокеев М.В., Шаманин В.В.
//
Nanomedicine. 2017. Vol. 12. N 1. P. 13. doi 10.2217/
ЖОрХ. 2009. Т. 45. Вып. 5. С. 754; Ershov A.Yu.,
nnm-2016-0306
Lagoda I.V., Yakimovich S.I., Zerova I.V., Pakal’nis V.V.,
10. Bogart L. K., Pourroy G., Murphy C. J., Puntes V.,
Mokeev M.V., Shamanin V.V. // Russ. J. Org. Chem.
Pellegrino T., Rosenblum D., Peer D., Lévy R. // ACS
2009. Vol.
45. N
5. P.
740. doi
10.1002/chin.
Nano. 2014. Vol. 8. N 4. P. 3107. doi 10.1021/
201008197
nn500962q
23. Ершов А.Ю., Лагода И.В., Якимович С.И., Зерова И.В.,
11. Федотчева Т.А., Оленин А.Ю., Старостин К.М.,
Пакальнис В.В., Шаманин В.В. // ЖОрХ. 2009. Т. 45.
Лисичкин Г.В., Банин В.В., Шимановский Н.Л. //
Вып.
10. С.
1503; Ershov A.Yu., Lagoda I.V.,
Хим.-фарм. ж. 2015. Т. 49. № 4. С. 11; Fedotche-
Yakimovich S.I., Zerova I.V. Pakal’nis V.V., Sha-
va T.A., Olenin A.Yu., Starostin K.M., Lisichkin G.V.,
manin V.V. // Russ. J. Org. Chem. 2009. Vol. 45. N 10.
P. 1488. doi 10.1134/S107042800910011X
Vol. 49. N 4. P. 220. doi 10.1007/s11094-015-1260-6
24. Алексеев В.В., Ершов А.Ю., Черница Б.В., Доро-
12. Jazayeri M.H., Amani H., Pourfatollah A.A., Avan A.,
шенко В.А., Лагода И.В., Якимович С.И., Зерова И.В.,
Ferns G.A., Pazoki-Toroudi H. // Cancer Gene Therapy.
Пакальнис В.В., Шаманин В.В. // ЖОрХ. 2010. Т. 46.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
318
ЕРШОВ и др.
Вып. 6. С. 865; Alekseyev V.V., Ershov A.Yu., Chernitsa B.V.,
Langmuir. 2007. Vol. 23. N 9. P. 5056. doi 10.1021/
Doroshenko V.A., Yakimovich S.I., Lagoda I.V.,
la070089n
Pakal’nis V.V., Zerova I.V., Shamanin V.V. // Russ. J.
31. Spain S. G., Albertin L., Cameron N. R. // Chem.
Org. Chem. 2010. Vol. 46. N 6. P. 860. doi 10.1134/
Commun. 2006. P. 4198. doi 10.1039/b608383h
S1070428010060138
32. Shan J., Tenhu H. // Chem. Commun. 2007. P. 4580. doi
25. Ershov A.Yu., Lagoda I.V., Yakimovich S.I., Kulesho-
10.1039/b707740h
va L.Yu., Vasileva M.Yu., Korovina I.S., Shamanin V.V. //
33. Luan B., Friedrich T., Zhai J., Streltsov V.A., Lindsey B.W.,
Open Ass. Lib. J. 2016. Vol. 3. e2646. doi 10.4236/
Kaslin J., de Jonge M.D., Zhu J., Hughes T.C., Hao X. //
oalib.1102646
RSC Adv. 2016. N 6. P. 23550. doi 10.1039/c6ra02801b
26. Turkevich J. // Gold Bull. 1985. Vol. 18. P. 125. doi
34. Lu W., Ma W., Lu J., Li X., Zhao Y., Chen G. //
10.1007/BF03214694
Macromol. Rapid Commun. 2014. Vol. 35. P. 827. doi
27. Toyoshima M., Oura T., Fukuda T., Matsumoto E.,
10.1002/marc.201300905
Miura Y. // Polym. J. 2010. Vol. 42. P. 172. doi
35. Willcock H., O’Reilly R. K. // Polym. Chem. 2010. N 1.
10.1038/pj.2009.321
P. 149. doi 10.1039/b9py00340a
28. Li X., Bao M., Weng Y., Yang K., Zhang W., Chen G. //
J. Mater. Chem. (B). 2014. Vol. 2. P. 5569. doi 10.1039/
36. Lowe A.B. // Polym. Chem. 2010. N 1. P. 17. doi
c4tb00852a
10.1039/b9py 00216b
29. Parry A.L., Clemson N.A., Ellis J., Bernhard S.S.R.,
37. Hoyle С.E., Bowman C.N. // Angew. Chem. Int. Ed.,
Davis B.G. // J. Am. Chem. Soc. 2013. Vol. 135. N 25.
2010. Vol. 49. P. 1540. doi 10.1002/anie.200903924
P. 9362. doi 10.1021/ja4046857
38. Johnke R.M., Sattler J.A., Allison R.R. // Future Oncol.
30. Housni A., Cai H., Liu S., Suzie H., Pun S.H., Narain R. //
2014. Vol. 10. N 15. P. 2345. doi 10.2217/FON.14.175
Synthesis of Gold Glyconanoparticles Based on Thiol-Containing
Acylhydrazones of D-Hexoses and Their Modification
with Thyolated Poly(2-deoxy-2-methacryloylamino-D-glucose)
A. Yu. Ershova,b*, M. Yu. Vasilyevaa, M. L. Levita, I. V. Lagodac, V. A. Baygildind,
B. M. Shabselsa, A. A. Martynenkova, and A. V. Yakimanskya,d
a Institute of Macromolecular Compounds of the Russian Academy of Sciences,
Bol’shoy pr. V. O. 31, St. Petersburg, 199004 Russia
*e-mail: ershov305@mail.ru
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, Russia
c State Research Testing Institute of Military Medicine, Ministry of Defense of the Russian Federation, St. Petersburg, Russia
d St. Petersburg State University, St. Petersburg, Russia
Received August 9, 2018; revised August 9, 2018; accepted August 13, 2018
A method for the synthesis of gold glyconanoparticles with an average particle size of 15-30 nm and a low
polydispersity index value was developed on the basis of mercaptoacetyl-, 3-mercaptopropionyl- and 2-
mercaptobenzoylhydrazones of natural hexoses (D-glucose, D-galactose and D-mannose) and thiolated poly(2-
deoxy-2-methacryloylamino-D-glucose).
Keywords: thiol-containing acylhydrazones of D-glucose, D-galactose and D-mannose, ring-ring tautomerism,
poly(2-deoxy-2-methacryloylamino-D-glucose), gold glyconanoparticles
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019