ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 324-328
ПИСЬМА В
РЕДАКЦИЮ
УДК 542.91
ПИРАЗИН-2-ИЛИМИН МЕТИЛТРИФТОРПИРУВАТА
В РЕАКЦИЯХ ЦИКЛОКОНДЕНСАЦИИ
И ЦИКЛОПРИСОЕДИНЕНИЯ
© 2019 г. В. Б. Соколов, А. Ю. Аксиненко*
Институт физиологически активных веществ Российской академии наук,
Северный проезд 1, Черноголовка, 142432 Россия
Поступило в Редакцию 5 июля 2018 г.
После доработки 13 июля 2018 г.
Принято к печати 15 июля 2018 г.
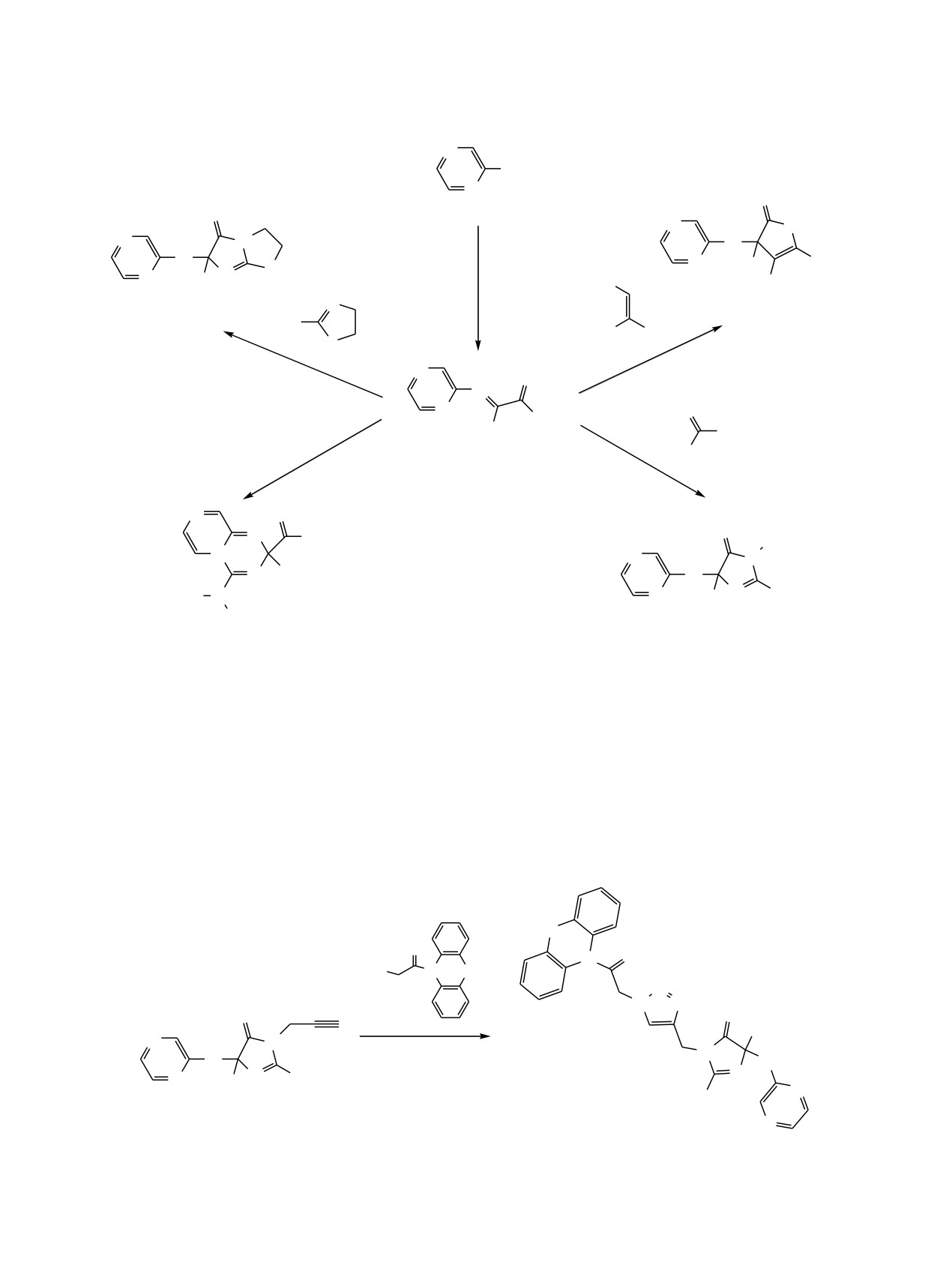
Изучены превращения пиразин-2-илимина метилтрифторпирувата в реакции циклоконденсации с
2-аминотиазолином, амидинами, аминокротонитрилом и аза-реакции Дильса-Альдера с цианаминами,
приводящие к пяти- и шестичленным трифторметилсодержащим гетероциклам. Показана возможность
использования продукта циклоконденсации пиразин-2-илимина метилтрифторпирувата - 4-(пиразин-2-
иламино)-1-(проп-2-ин-1-ил)-4-(трифторметил)-1Н-имидазол-5(4Н)-она - для модификации фенотиазина
медь-катализируемым алкин-азидным 1,3-диполярным циклоприсоединением.
Ключевые слова: пиразин-2-илимин метилтрифторпирувата, 2-аминотиазолин, бензамидины, амино-
кротонитрил, цианамины, фенотиазин, аза-реакция Дильса-Альдера, 1,3-диполярное циклоприсоединение
DOI: 10.1134/S0044460X19020239
Производные пиразина представляют перспек-
вору соединения 1 в бензоле пиридина, метил-
тивный класс биологически активных веществ
трифторпирувата 2 и SOCl2 (схема 1). Имин
3
широкого спектра действия[1, 2], среди которых
экзотермично взаимодействует с
1,3-бинуклео-
обнаружены ингибиторы перекисного окисления
филами
-
2-аминотиазолином
4,
2-аминокрото-
липидов
[3], гепатопротекторы
[4], антиту-
нитрилом
5 и бензамидинами
6а, б, образуя
беркулезные препараты [5], ингибиторы киназ [6-
соответствующие дигидроимидазотиазолон 8, ди-
8]. Целью настоящего исследования явилась экзо-
гидропиррол 9 и имидазолоны 10а, б с выходом 81-
и эндоциклическая модификация 2-аминопиразина
86%. В аза-реакции Дильса-Альдера с цианами-
трифторметилсодержащими пяти- и шестичлен-
нами
7а, б имин
1 проявляет свойства
1,4-
ными гетероциклами. Предпосылкой послужили
гетеродиена и при нагревании эквимольной смеси
полученные ранее данные о превращениях N-
реагентов в бензоле образуются пиразино[1,2-a]-
замещенных иминов метилтрифторпирувата в
[1,3,5]триазины 11а, б с выходом 79-82% (схема 1).
реакциях циклоконденсации
[9] и циклоприсо-
Соединения 8-11 - твердые вещества, состав и
единения [10-12], а также модификации лекар-
строение которых подтверждены данными
ственных препаратов, например рилузола,
элементного анализа и спектроскопии ЯМР, а для
фторсодержащими гетероциклами [13].
соединения
10б
- также химическими превра-
щениями. В спектрах ЯМР
19F полученных
В качестве прекурсора для синтеза производных
соединений характерными являются синглетные
2-аминопиразина 1 получен с выходом 82% ранее
сигналы CF3-группы в области -3-1 м. д.
неизвестный N-пиразин-2-илимин метилтрифтор-
пирувата
3 с использованием однореакторной
Пропаргилсодержащий имидазолон 10б оказался
методики последовательным прибавлением к раст-
удобным прекурсором для модификации азидо-
324
ПИРАЗИН-2-ИЛИМИН МЕТИЛТРИФТОРПИРУВАТА
325
Схема 1.
N
NH2
N
O
1
O
N
NH
H
N
N
N
H
CF3C(O)COOMe
N
2
CH3
N F3C
N S
N
F3C
Py, SOCl2
H2N
NC
N
8
9
H2N
CN
CH3
S
5
4
N
O
N
N
HN
OMe
NC NR2
F3C
Ph
7а, б
3
RHN
6а, б
N
O
N
O
OMe
R
N
N
N
H
N CF3
N
N
Ph
R
N
N
F3C
R
11а, б
10а, б
6, 10, R = H (а), пропин-1-ил (б); 7, 11, R = CH3 (а), пиперидин-1-ил (б).
содержащих фармакофоров, например феноти-
Спектр ЯМР 1Н конъюгата 13 представляет
азина, производные которого проявляют ког-
суперпозицию фенотиазинового и имидазоло-
нитивно-стимулирующие или пронейрогенные
нового фрагментов и характерных синглетных
свойства
[14-16]. Так, имидазолон
10б в
сигналов метиленовых групп спейсера в области
присутствии каталитических количеств Cu(I)
4.8 и 5.5 м. д.
взаимодействует с азидосодержащим фенотиа-
зином 12, образуя 1,4-замещенный 1,2,3-триазол 13
Таким образом нами предложен оригинальный
с выходом 86% (схема 2).
подход к эндо- и экзоциклической модификации
Схема 2.
S
O
N O
N3
N S
N
N N
O
O
12
CF3
N
N
H
Cu(I)
N
N
NH
N
Ph
N
N
F3C
N
Ph
10б
N
13
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 2 2019
326
СОКОЛОВ, АКСИНЕНКО
биологически активного 2-аминопиразина трифтор-
4-(Пиразин-2-иламино)-4-(трифторметил)-2-
метилсодержащими пяти- и шестичленными
фенил-1Н-имидазол-5(4Н)-он
(10а) получали
гетероциклами, основанный на превращениях пира-
аналогично. Выход 1.3 г (81%), т. пл. 203-205°С.
зин-2-илимина метилтрифторпирувата в реакциях
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 7.37-
циклоконденсации и циклоприсоединения
7.64 м (3H, CHAr), 7.68-7.81 c (2H, CHAr), 7.93 д
), 8.66 с (1Н,
(2H, CHAr, 3JHH = 7.1), 8.21 с (1H, CHAr
Азид 12 получали по методике [17], 2-амино-
NH), 12.25 с (1Н, NH). Спектр ЯМР 19F (CDCl3): δF
пиразин
1, метилтрифторпируват
2,
2-амино-
-1.91 м. д. Найдено, %: С 52.53; Н 3.37; N 21.63.
тиазолин 4, аминокротонитрил 5, бензамидины 6а,
C14H10F3N5O. Вычислено,%: C 52.34; H 3.14; N 21.80.
б, цианамины 7а, б (Aldrich) использовали без
4-(Пиразин-2-иламино)-1-(проп-2-ин-1-ил)-4-
предварительной очистки.
(трифторметил)-1Н-имидазол-5(4Н)-он
(10б)
Метил-3,3,3-тирфтор-2-(пиразин-2-илимино)-
получали аналогично. Выход 1.5 г (83%), т. пл. 211-
пропионат (3). К раствору 0.05 моля соединения 1
212°С. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 2.50
в
50 мл бензола при
20°С и перемешивании
т (1Н, ≡CH, 4JHH = 2.4), 4.41-4.79 м (2Н, CH2), 7.67-
последовательно прибавляли 0.1 моля пиридина и
7.93 м (3Н, CHAr), 7.99-8.30 м (5Н, CHAr), 8.59 с
0.05 моля соединения
2. Реакционную массу
(1Н, NH). Спектр ЯМР 19F (CDCl3): δF -1.74 м. д.
перемешивали 30 мин, затем прибавляли 0.05 моля
Найдено, %: С 56.65; Н 3.55; N 19.63. C17H12F3N5O.
SOCl2 и перемешивали еще 1 ч. Осадок отфиль-
Вычислено, %: C 56.83; H 3.37; N 19.49.
тровали, фильтрат упаривали, остаток кристалли-
Метил-4-(диметиламино)-2-(трифторметил)-
зовали из гексана. Выход 9.6 г (82%), т. пл. 89-91°С.
2Н-пиразино[1,2-a][1,3,5]триазин-2-карбоксилат
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 3.86 c (3H,
(11а). Смесь
0.05 моля имина
3 и 0.01 моля
MeO), 8.40 д. д (1H, CHAr, 3JHH = 2.2, 4JHH = 1.1),
цианамина 7a в 20 мл бензола кипятили 5 ч, затем
8.58 д (1H, CHAr, 3JHH = 2.2), 8.73 д (1H, CHAr, 4JHH =
упаривали. Остаток перекристаллизовывали из
1.1). Спектр ЯМР
19F (CDCl3): δF 6.06 м. д.
гексана. Выход 1.2 г (79%), т. пл. 122-124°С.
Найдено, %: С 41.34; Н 2.37; N 18.26. C8H6F3N3O2.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.83 с [6Н, (СН3)2N],
Вычислено, %: C 41.21; H 2.59; N 18.02.
3.82 с (3Н, CH3O), 6.99 с (2H, CHAr), 8.22 с (1H,
6-(Пиразин-2-иламино)-6-(трифторметил)-2,3-
CHAr). Спектр ЯМР 19F (CDCl3): δF -2.94 м. д.
Найдено, %: С 43.75; Н 3.78; N 23.27. C11H12F3N5O2.
дигидроимидазо[2,1-b]тиазол-5(6Н)-он
(8).
К
раствору (0.05 моль) имина 3 в 20 мл ДМФА при
Вычислено, %: C 43.57; H 3.99; N 23.10.
перемешивании прибавляли (0.05 моль) 2-амино-
Метил-4-(пиперидин-1-ил)-2-(трифторметил)-
тиазолина 4. Реакционную массу перемешивали
2Н-пиразино[1,2-a][1,3,5]триазин-2-карбоксилат
30 мин, затем выливали в 50 мл воды. Осадок
(11б) получали аналогично. Выход 1.4 г (82%), т.
отфильтровывали и перекристаллизовывали из
пл. 147-149°С. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
50%-ного этанола. Выход 1.3 г (86%), т. пл. 198-
Гц): 1.53-1.83 м (6Н, СН2), 2.98-3.30 м (4Н, СН2),
200°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.57-
3.83 c (3Н, CH3O), 6.92-7.04 м (2H, CHAr), 8.24 д
3.86 м (3Н, СН2), 3.92-4.05 м (1Н, СН2), 7.78-7.85 м
(1Н, CHAr, 4JHH = 0.7). Спектр ЯМР 19F (CDCl3): δF -
(1H, CHAr), 7.88-7.96 c (1H, CHAr), 8.64-8.76 c (1H,
2.54 м. д. Найдено, %: С 48.75; Н 4.51; N 20.63.
CHAr), 8.69 с (1Н, NH). Спектр ЯМР 19F (CDCl3): δF
C14H16F3N5O2. Вычислено, %: C 48.98; H 4.70; N 20.40.
-1.25 м. д. Найдено, %: С 48.56; Н 4.57; N 8.96.
C10H8F3N5OS. Вычислено, %: C 48.75; H 4.72; N
3-({1-[2-Оксо-2-(10Н-фенотиазин-10-ил)этил]-
1Н-1,2,3-триазол-4-ил}метил)-5-(пиразин-2-ил-
8.75.
амино)-5-(трифторметил)имидазолидин-2,4-дион
2-Метил-5-оксо-4-(пиразин-2-иламино)-4-(три-
(13). К раствору 0.5 ммоль имидазолона 10б в
фторметил)-4,5-дигидро-1Н-пиррол-3-карбо-
20 мл хлористого метилена прибавляли 0.5 ммоль
нитрил
(9) получали аналогично. Выход 1.2 г
азида 12 , 0.1 ммоль CuSO4 в 1 мл Н2О и 0.1 ммоль
(85%), т. пл. 212-213°С. Спектр ЯМР 1Н (CDCl3), δ,
аскорбата натрия в 1 мл Н2О. Реакционную смесь
м. д.: 1.19 с (3Н, СН3), 6.79-7.93 м (2H, CHAr), 7.24
перемешивали 6 ч при 40°С, затем промывали
с (1H, CHAr), 7.66 с (1Н, NH), 10.45 с (1Н, NH).
10 мл
1%-ного раствора водного аммиака.
Спектр ЯМР 19F (CDCl3): δF 0.86 м. д. Найдено, %:
Органический слой отделяли, хлористый метилен
С 46.44; Н 2.67; N 24.91. C11H8F3N5O. Вычислено,
упаривали, остаток хроматографировали на
%: C 46.65; H 2.85; N 24.73.
силикагеле (60 меш, метанол-хлороформ, 1:15).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 2 2019
ПИРАЗИН-2-ИЛИМИН МЕТИЛТРИФТОРПИРУВАТА
327
Выход 0.25 г (86%), т. пл. 223-225°С. Спектр ЯМР
N 2. P. 155. doi 10.1016/j.canlet.2005.06.017
1Н (ДМСО-d6), δ, м. д.: 4.80 с (2Н, CH2),5.36-5.61
7. Whelligan D.K., Solanki S., Taylor D., Thomson D.W.,
уш. с (2Н, CH2), 7.21-7.84 м (17Н, ), 8.81 с (1Н,
Cheung K.M.J., Boxall K., Mas-Droux C., Barillari C.,
Burns S., Grummitt C.G., Collins I., Aherne G.W.,
NH). Спектр ЯМР 19F (ДМСО-d6): δF 0.77 м. д.
Bayliss R., Hoelder S. // J. Med. Chem. 2010. Vol. 53.
Найдено, %: С 58.28; Н 3.31; N 19.48. C31H22F3N9O2S.
N 21. 7682. doi 10.1021/jm1008727
Вычислено, %: C 58.03; H 3.46; N 19.65.
8. Dubinina G.G., Platonov M.O., Golovach S.M., Bo-
Спектры ЯМР 1H и 19F записывали на спектро-
rysko P.O., Tolmachov A.O., Volovenko Y.M. // Eur. J.
метре Bruker DPX
200 при частоте
200.13 и
Med. Chem. 2006. Vol. 41. N 6. P. 727. doi 10.1016/
188.0 МГц относительно SiMe4 (внутренний эталон)
j.ejmech.2006.03.019
и CF3COOH (внешний эталон) соответственно. Тем-
9. Соколов В.Б., Аксиненко А.Ю., Епишина Т.А.,
пературы плавления определяли в стеклянном
капилляре.
2005. № 2. С. 462;
Sokolov V.B., Aksinenko A.Yu.,
Epishina T.A., Goreva T.V., Martynov I.V. // Russ.
Chem. Bull. 2005. Vol. 54. N 2. P. 472. doi 10.1007/
ФОНДОВАЯ ПОДДЕРЖКА
s11172-005-0281-9
Работа выполнена при финансовой поддержке
10. Aksinenko A.Yu., Goreva T.V., Epishina T.A., Trepalin S.V.,
Sokolov V.B. // J. Fluor. Chem. 2017. Vol. 201. P. 19.
Российского фонда фундаментальных исследо-
doi 10.1016/j.jfluchem.2017.07.015
ваний (грант
№ 16-03-00693) в рамках госу-
дарственного задания на 2018 г. (тема № 0090-2017-
11. Осипов С.Н., Коломиец А.Ф., Фокин А.В. // Изв. АН.
Сер. хим. 1988. № 1. С. 132;
Osipov S.N., Kolomiets A.F.,
0023).
Fokin A.V. // Russ. Chem. Bull. 1988. Vol. 37. N 1.
P. 122. doi 10.1007/BF00962670
КОНФЛИКТ ИНТЕРЕСОВ
12. Осипов С.Н., Коломиец А.Ф., Фокин А.В. // Усп. хим.
1992. Т. 61. № 8. С. 1457; Osipov S.N., Kolomiets A.F.,
Авторы заявляют об отсутствии конфликта
Fokin A.V. // Russ. Chem. Rev. 1992. Vol. 61. N 8.
интересов.
P. 798. doi 10.1070/RC1992v061n08ABEH000999
13. Соколов В.Б., Аксиненко А.Ю., Соколов А.В., Габ-
СПИСОК ЛИТЕРАТУРЫ
рельян А.В., Ефимова А.Д., Григорьев В.В. // Изв.
2017.
№ 1. C. 99; Sokolov V.B.,
1. Miniyar P.B., Murumkar P.R, Patil P.S., Barmade M.A.,
Aksinenko A.Yu., Gabrelian A.V., Efimova A.D.,
Bothara K.G. // Mini Rev. Med. Chem. 2013. Vol. 13.
GrigorievV.V. // Russ. Chem. Bull. 2017. Vol. 66. N 1.
N 11. P. 1607. doi 10.2174/1389557511313110007
P. 99. doi 10.1007/s11172-017-1706-y
2. Adams J., Kauffman M. // Cancer Invest. 2004. Vol. 22.
14. Sen S., De B., Mallik A. Roy B., Kumar D. // Indian J.
N 2. P. 304. doi 10.1081/CNV-120030218
Heterocycl. Chem. 2018. Vol. 28. N 2. P. 221.
3. Dubuissona M.L., Reesa J.F., Marchand-Brynaert J. //
Mini Rev. Med. Chem. 2004. Vol. 4. N 4. P. 421. doi
15. Yamashita M., Nonaka T., Arai T., Kametani F.,
10.2174/1389557043403927
Buchman V., Ninkina N., Bachurin S.O., Akiyama H.,
Goedert M., Hasegawa M. // FEBS Lett. 2009. Vol. 583.
4. Kim N.D., Kwak M.K., Kim S.G. // Biochem. Pharmacol.
N 14. P. 2419. doi 10.1016/j.febslet.2009.06.042
1997. Vol. 53. N 3. P. 261. doi 10.1016/S0006-2952(96)
00647-8
16. Bachurin S.O., Bovina E.V., Ustyugov A.A. // Med. Res.
Rev. 2017. Vol. 37. N 5. P. 1186. doi 10.1002/med.21434
5. Lian X., Wang S., Xu G., Lin N., Li Q., Zhu H. // Appl.
Surf. Sci. 2008. Vol. 255. N 2. P. 480. doi 10.1016/
17. Rusu R., Szumna A., Rosu N., Dumea C., Danac R. //
j.apsusc.2008.06.068
Tetrahedron. 2015. Vol. 71. N 19. P. 2922. doi 10.1016/
6. Hayward D.G., Fry A.M. // Cancer Lett. 2006. Vol. 237.
j.tet.2015.03.060
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 2 2019
328
СОКОЛОВ, АКСИНЕНКО
Methyl Trifluoropyruvate Pyrazin-2-ylimine
in Cyclocondensation and Cycloaddition Reactions
V. B. Sokolov and A. Yu. Aksinenko*
Institute of Physiologically Active Compounds of the Russian Academy of Sciences,
Severnyi Proyezd 1, Chernogolovka, 142432 Russia
*e-mail: alaks@ipac.ac.ru
Received July 5, 2018; revised July 13, 2018; accepted July 15, 2018
The transformations of methyl trifluoropyruvate pyrazin-2-ylimine in the cyclocondensation reactions with 2-
aminothiazoline, amidines, aminocrotonitrile and aza-Diels-Alder reactions with cyanamines, leading to five-
and six-membered trifluoromethyl-containing heterocycles, were studied. The possibility of using 4-(pyrazin-2-
ylamino)-1-(prop-2-yn-1-yl)-4-(trifluoromethyl)-1H-imidazol-5(4H)-one, the product of methyl trifluoro-
pyruvate pyrazin-2-ylimine cyclocondensation, for modification of phenothiazine by copper-catalyzed alkyne-
azide 1,3-dipolar cycloaddition was shown.
Keywords: methyl trifluoropyruvate pyrazin-2-ylimine, 2-aminothiazoline, benzamidines, aminocrotonitrile,
cyanamines, phenothiazine, aza-Diels-Alder reaction, 1,3-dipolar cycloaddition
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 2 2019