ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 350-356
УДК 547.46’052
РЕАКЦИЯ 1-(2-ОКСОЦИКЛОГЕКСИЛ)ЭТАН-1,1,2,2-
ТЕТРАКАРБОНИТРИЛА С α,β-НЕПРЕДЕЛЬНЫМИ
АЛЬДЕГИДАМИ
© 2019 г. В. П. Шевердовa, *, В. В. Давыдоваa, О. Е. Насакинa, М. А. Марьясовa,
П. Б. Дороватовскийb, В. Н. Хрусталевb,c
a Чувашский государственный университет имени И. Н. Ульянова, Московский пр. 15, Чебоксары, 428015 Россия
*e-mail: SheverdovVP@yandex.ru
b Национальный исследовательский центр «Курчатовский институт», Москва, Россия
c Российский университет дружбы народов, Москва, Россия
Поступило в Редакцию 6 сентября 2018 г.
После доработки 6 сентября 2018 г.
Принято к печати 17 сентября 2018 г.
Изучены реакции
1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила с кротоновым и коричным
альдегидом, 2-фурилакролеином, 3-фенил-2-пропиналем, 3-бутил-2-пропиналем, 2-фурилакролеином,
R-(-)-миртеналем. Показано, что эти реакции протекают через стадию образования
8a-
гидроксигексагидро-2H-хромен-3,3,4,4-тетракарбонитрила с последующим формированием
10-
иминотетрагидро-8a,4-(эпоксиметано)хромен-3,3,4(2H,4aH)-трикарбонитрила. На основании данных
рентгеноструктурного анализа сделано предположение о том, что стереохимические особенности
продуктов реакций определяются направлением их протекания.
Ключевые слова: 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрил, непредельные альдегиды, R-(-)-
миртеналь, конфигурация
DOI: 10.1134/S0044460X1903003X
Актуальность исследований 4-оксоалкан-1,1,2,2-
перспективных синтонов [2, 9]. Ранее нами было
тетракарбонитрилов обусловлена их высокой реак-
установлено, что
4-оксоалкан-1,1,2,2-тетракарбо-
ционной способностью, позволяющей получать из
нитрилы с акролеином образуют
4-формил-3-
них разнообразные карбо- и гетероциклы, в том
циклопентен-1,1,2-трикарбонитрилы [1]. Реакции с
числе полифункциональные органические соеди-
другими непредельными альдегидами более
нения класса пиранов [1-4], представляющих интерес
сложного строения изучены не были. Представ-
для изучения их биологической активности [5, 6].
лялось интересным изучить реакции
1-(2-
оксоциклогексил)этан-1,1,2,2-тетракарбонитрила с
Первые представители
4-оксоалкан-1,1,2,2-
аналогами акролеина: кротоновым и коричным
тетракарбонитрилов были получены реакцией
альдегидом,
2-фурилакролеином, R-(-)-мирте-
тетрацианоэтилена с кетонами в присутствии
налем, алкиналями. Установлено, что эти реакции
«молекулярного серебра» в качестве катализатора
в сравнении с реакцией с акролеином протекают по
[7]. Позже были предложены более доступные
другому направлению, общим структурным
катализаторы и на основании данных рентгено-
элементом образующихся соединений которого
структурных исследований было установлено, что
является фрагмент
10-иминотетрагидро-8a,4-
в реакции 4-оксоалкан-1,1,2,2-тетракарбонитрилов
(эпоксиметано)хромен-3,3,4(2H,4aH)-трикарбо-
с простейшими альдегидами образуются произ-
нитрила. Реакции 4-оксоалкан-1,1,2,2-тетракарбо-
водные диоксабицикло[3.2.1]октана [8].
нитрила с кротоновым и коричным альдегидом,
В ряду 4-оксоалкан-1,1,2,2-тетракарбонитрилов
2-фурилакролеином, R-(-)-миртеналем, алкиналями
1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрил
в этаноле проводили при комнатной температуре.
является одним из наиболее активных и
Выход целевых 10-иминотетрагидро-8а,4-(эпокси-
350
РЕАКЦИЯ 1-(2-ОКСОЦИКЛОГЕКСИЛ)ЭТАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛА
351
Схема 1.
R
R
HO
R
CN
CN
CN
O
O
CN
O
CN
O
CN
CNCN
CN
RCHO
CN
CN
CN
CN
CN
EtOH
OH
O
CN
NH
А
Б
1ад
R= CH3CH=CH (a), С6H5CH=CH (б), 2-Fu-CH=CH (в), C4H9C≡CH (г),C6H5C≡CH (д).
Схема 2.
O CN
H
CN
O
CNOHC
O NH
CN
CN
CN
H
CN
1e
метано)хромен-3,3,4(2H,4aH)-трикарбонитрилов
рентгеноструктурного анализа. В ИК спектрах
1а-д составил 88-95% (схема 1).
соединений
1а-е для фрагмента
10-имино-
тетрагидро-8a,4-(эпоксиметано)хромен-3,3,4(2H,4aH)-
Вероятно, что вначале происходит присоеди-
трикарбонитрила зафиксированы полосы погло-
нение
1-(2-оксоциклогексил)этан-1,1,2,2-тетра-
щения групп NH (3280-3434 см-1), C≡N (2243-
карбонитрила C(CN)2СН-кислотным фрагментом к
2254 см-1) и С=N (1714-1723 см-1). В спектрах
альдегидной группе с образованием интермедиата
ЯМР 1H сигналы протона NH проявляются в
А. Далее имеет место НО·····C=О взаимодействие
области
9.74-9.89 м. д. Спектры ЯМР
13С
и образование
10-иминотетрагидро-8a,4-(эпокси-
характеризуются наличием трех сигналов атомов
метано)хромен-3,3,4(2H,4aH)-трикарбонитрила Б.
углерода цианогрупп в области 110.11-113.10 м. д.
Интермедиат Б в результате НО···CN-взаимо-
и сигналов атома углерода С=NH в области 149.87-
действия превращается в конечные соединения 1а-д.
156.04 м. д.
В реакции
1-(2-оксоциклогексил)этан-1,1,2,2-
По данным РСА, соединения
1а,
1в и
1е
тетракарбонитрила с R-(-)-миртеналем получен
включают
трициклическую
систему
из
(2R,4S,4aR,8aR)-2-{(1R,5S)-6,6-диметилбицикло[3.1.1]-
сочлененных тетрагидропиранового, дигидрофура-
гепт-2-ен-2-ил}-10-иминотетрагидро-8a,4-(эпокси-
нового и циклогексанового циклов, принимающих
метано)хромен-3,3,4(2H,4aH)-трикарбонитрил
1е
конформации кресло, конверт и кресло
(схема 2 ).
соответственно (рис. 1, 2, табл.
1). Объемные
Строение соединений 1а-е определено методами
заместители при атоме углерода C2 в молекулах
ИК и ЯМР спектроскопии, а также методом
этих соединений занимают наиболее стерически
Таблица 1. Водородные связи в молекулах соединений 1а, 1в, 1еа
Соединение
D-H···A
d(D-H), Å
d(H···A), Å
d(D···A), Å
(DHA), град
1а
N12-H12···O1a
0.89(3)
2.24(3)
3.050(2)
152(2)
1в
N12-H12···O1b
0.90(2)
2.27(2)
3.070(2)
149(2)
1е
N12-H12···Oс
0.91(3)
2.30(3)
3.126(3)
151(3)
а Кристаллографические операции для генерации симметрически эквивалентных атомов: a -x+1, y+1/2, -z+1/2; b -x+1, y+1/2, -z+1/2;
c -x+1, y+1/2, -z+1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
352
ШЕВЕРДОВ и др.
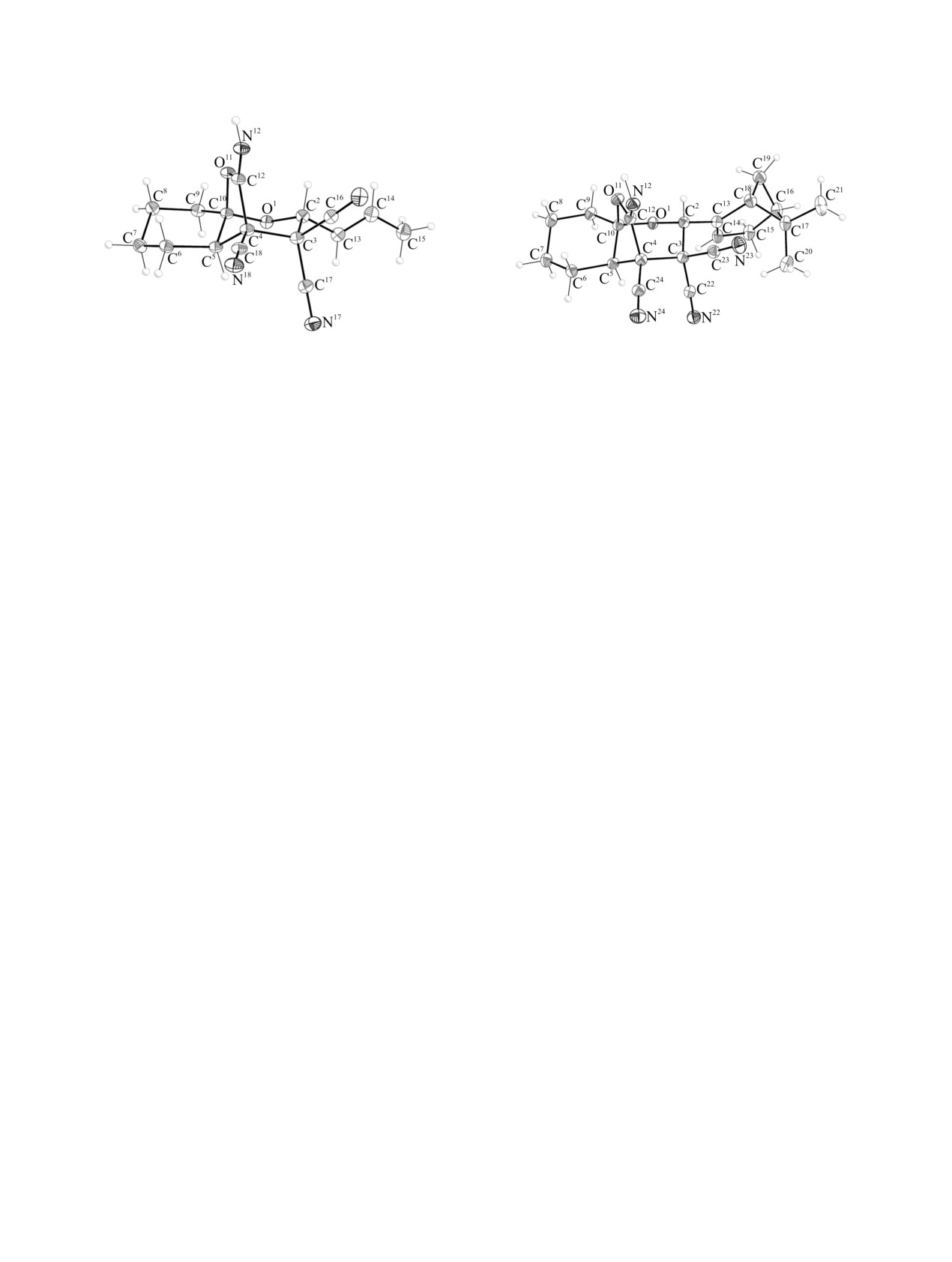
Рис.
1. Общий вид молекулы соединения
1а в
Рис.
2. Общий вид молекулы соединения
1е в
кристалле.
кристалле.
предпочтительное экваториальное положение.
2-(фуран-2-ил)винил)] и
1е
{R
=
2-(6,6-
Молекулы соединений 1а и 1в содержат четыре
диметилбицикло[3.1.1]гепт-2-ен-2-ил)} являются
(при атомах углерода C2, С4, С5 и C10), а
идентичными, можно предположить, что они
соединения 1е - шесть (при атомах углерода C2, С4,
определяются направлением реакции образования
С5, С10, С16 и C18) асимметрических центров.
этих соединений.
Кристаллы соединений
1а и
1в являются
рацематами и состоят из энантиомерных пар диа-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
стереомера с конфигурацией центров 2R,4S,5R,10R
(рис.
1). Кристалл соединения
1е хиральный,
Контроль за ходом реакции и чистотой
благодаря оптически активной молекуле исходного
синтезированных
соединений
осуществляли
R-(-)-миртеналя. Таким образом, выявлено, что
методом ТСХ на пластинах Silufol UV-254 (элюент -
молекула соединения
1е имеет абсолютную
этилацетат, проявление в УФ свете, парами иода
конфигурацию 2R,4S,5R,10R,16S,18R (рис. 2).
или термическим разложением). Температуры
плавления определяли на приборе Optimelt
В кристалле, молекулы соединений 1а, 1в и 1е
MPA100. ИК спектры регистрировали на Фурье-
образуют H-связанные цепочки вдоль направления
спектрометре ФСМ-1202 в тонком слое (суспензия
[010] за счет межмолекулярных водородных связей
в вазелиновом масле). Спектры ЯМР1Н и 13С
N-H···O (табл. 1, 2). Цепочки упакованы в стопки
регистрировали на спектрометре AVANCE 400 WB
вдоль кристаллографической оси a.
Bruker (400.13 и 100.61МГц соответственно) при
Таким образом, в результате исследования
293K в ДМСО-d6, внутренний стандарт - ТМС.
реакционной способности 1-(2-оксоциклогексил)-
Элементный анализ выполняли на CHN-анали-
этан-1,1,2,2-тетракарбонитрила по отношению к
заторе vario Micro cube.
α,β-непредельным альдегидам, замещенным в β-
Все синтезированные соединения при ком-
положении алкильными и арильными замес-
натной температуре хорошо растворимы в
тителями, установлено, что происходит образо-
полярных органических растворителях, таких как
вание
10-иминотетрагидро-8a,4-(эпоксиметано)-
ацетон, ацетонитрил, этилацетат, диметилфор-
хромен-3,3,4(2H,4aH)-трикарбонитрилов. Реакции
мамид, диметилсульфоксид; при нагревании
протекают в мягких условиях с высокими
растворяются в этаноле и пропан-2-оле; в воде не
выходами. Синтезированы новые представители
растворяются.
класса аннелированных тетрагидропиранов,
перспективные как синтоны органического синтеза
Общая методика получения соединений 1а-е.
и в качестве объектов для исследования их
К суспензии
2 ммоль
(452 мг)
1-(2-оксо-
биологической активности. Поскольку относи-
циклогексил)этан-1,1,2,2-тетракарбонитрила в 10 мл
тельные конфигурации вновь образующихся
этанола добавляли
2 ммоль соответствующего
асимметрических центров в
10-имино-2-R-
альдегида. Полученную смесь перемешивали при
тетрагидро-8a,4-(эпоксиметано)-хромен-3,3,4(2H,4aH)-
комнатной температуре до полного растворения
трикарбонитрилах 1а (R = проп-1-ен-1-ил), 1в [R =
(контроль методом ТСХ). Раствор выдерживали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
РЕАКЦИЯ 1-(2-ОКСОЦИКЛОГЕКСИЛ)ЭТАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛА
353
Таблица 2. Кристаллоструктурные данные для соединений 1а, 1в, 1е
Параметр
1а
1в
1е
Формула
C16H16N4O2
C19H16N4O3
C22H24N4O2
Молекулярная масса
296.33
348.36
376.45
Размеры монокристалла, мм
0.03×0.10×0.12
0.05×0.08×0.20
0.04×0.07×0.20
Сингония
Моноклинная
Моноклинная
Моноклинная
Пространственная группа
P21/c
P21/c
P21
a, Å
7.6959(15)
7.7601(16)
7.6801(15)
b, Å
10.264(2)
10.300(2)
10.420(2)
c, Å
19.118(4)
21.490(4)
12.340(3)
β, град
94.32(3)
96.03(3)
102.35(3)
V, Å3
1505.9(5)
1708.2(6)
964.7(4)
Z
4
4
2
dc, г/см3
1.307
1.355
1.296
F(000)
624
728
400
μ, мм-1
0.117
0.123
0.110
2θmax, град
61.86
62.09
62.10
Количество измеренных отражений
19006
13313
12895
Количество независимых отражений
3298
3786
4292
Rint
0.081
0.075
0.042
Количество отражений с I > 2σ(I)
2739
2932
3980
Количество уточняемых параметров
204
239
259
R1; wR2 [для отражений с I > 2σ(I)]
0.060; 0.147
0.052; 0.127
0.037; 0.092
R1; wR2 (все измеренные отражения)
0.072; 0.155
0.068; 0.139
0.041; 0.094
GOF по F2
1.056
1.041
1.054
Коэффициент экстинкции
0.057(5)
0.018(2)
0.081(8)
Tmin/Tmax
0.980/0.990
0.963/0.987
0.970/0.990
при комнатной температуре на воздухе в течение
J = 6.0 Гц), 2.02 т (2Н, СH2, J = 15.0 Гц), 1.79 д (3H,
10-15 ч для максимально полной кристаллизации
CH3, J = 8.0 Гц), 1.75-1.69 м (2H, CH2), 1.51-1.19 м
продукта реакции. Кристаллическое вещество
(2H, CH2), 1.06-0.98 м (2H, CH2). Спектр ЯМР 13С,
отфильтровывали, промывали 10 мл охлажденной
δС, м. д.: 155.98, 155.85, 137.89, 121.83, 112.53,
до 0-5°С смесью этанол-гексан (3:1).
110.63, 107.39, 74.23, 52.61, 45.98, 29.68, 25.29,
21.86, 20.78, 17.71, 17.67. Найдено, %: C 64.92; H
10-Имино-2-(проп-1-ен-1-ил)тетрагидро-8a,4-
5.38; N 18.84. C16H16N4О2. Вычислено, %: C 64.85;
(эпоксиметано)хромен-3,3,4(2H,4aH)-трикарбо-
H 5.44; N 18.91.
нитрил (1а). Выход 520 мг (88%), белое вещество,
т. пл. 162°С. ИК спектр, ν, см-1: 3434 (N-H), 2248
10-Имино-2-стирилтетрагидро-8a,4-(эпокси-
(C≡N), 1723 (C=N). Спектр ЯМР 1Н, δ, м. д.: 9.76 с
метано)хромен-3,3,4(2H,4aH)-трикарбонитрил
(1H, NН), 6.36-6.27 м (1H, CH), 5.62-5.56 м (1H,
(1б). Выход 520 мг (88%), белое вещество, т. пл.
CH), 4.87 д (1H, ОCH, J = 7.6 Гц), 2.80 к (1H, CH,
183-185°С. ИК спектр, ν, см-1: 3285 (N-H), 2254
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
354
ШЕВЕРДОВ и др.
(C≡N), 1714 (C=N). Спектр ЯМР 1Н, δ, м. д.: 9.85 с
9.89 с (1H, NН), 7.56-7.52 м (3H, Ph), 7.51-7.45 м
(1H, NН), 7.55 д (2H, Ph, J = 7.2 Гц), 7.43-7.35 м
(2H, Ph), 5.87 с (1H, OCH), 2.94 к (1H, CH, J =
(3H, Ph), 7.19 д (1H, CH, J = 7.2 Гц),6.32 д. д (1H,
6.0 Гц), 2.08-2.01 м (2H, CH2), 1.83-1.68 м (2H,
CH, J = 16.0, 7.2 Гц), 5.17 д (1H, CH, J = 7.2 Гц),
CH2), 1.52-1.42 м (2H, CH2), 1.29-1.19 м (2H, CH2),
2.87 к (1H, CH, J = 7.0 Гц), 2.06 т (2Н, CH2, J =
1.06-0.96 м (2H, CH2). Спектр ЯМР 13С, δС, м. д.:
14.0 Гц), 1.76 т 1.82-1.69 м (2Н, CH2), 1.52-1.21 м
155.8, 132.7, 131.5, 129.9, 120.1, 113.0, 111.5, 110.4,
(2H, CH2), 1.09-0.99 м (2H, CH2). Спектр ЯМР 13С,
108.6, 91.43, 80.6, 66.8, 53.3, 46.7, 46.2, 30.3, 26.1,
δС, м. д.: 155.83, 153.19, 138.84, 134.35, 131.30,
22.6, 21.6. Найдено, %: C 70.71; H 4.68; N 15.53.
129.56,
129.05,
127.36,
118.99,
112.53,
110.57,
C21H16N4О2. Вычислено, %: C 70.77; H 4.53; N
110.06, 107.55, 74.34, 46.05, 45.17, 52.70, 29.73,
15.72.
25.33, 21.90, 20.80. Найдено, %: C 70.47; H 5.01; N
(2R,4S,4aR,8aR)-2-{(1R,5S)-6,6-Диметилбицикло-
15.69. C21H18N4О2. Вычислено, %: C 70.38; H 5.06;
[3.1.1]гепт-2-ен-2-ил}-10-иминотетрагидро-8a,4-
N 15.63.
(эпоксиметано)хромен-3,3,4(2H,4aH)-трикарбо-
2-[2-(Фуран-2-ил)винил]-10-иминотетрагидро-
нитрил (1е). Выход 700 мг (93%), белое вещество,
8a,4-(эпоксиметано)хромен-3,3,4(2H,4aH)три-
т. пл. 170-172°С. ИК спектр, ν, см-1: 3269 (N-H),
карбонитрил (1в). Выход 635 мг (91%), белое
2251 (C≡N), 1717 (C=N). Спектр ЯМР 1Н, δ, м. д.:
вещество, т. пл. 156°С (разл.). ИК спектр, ν, см-1:
9.74 c (1H, NН), 6.08 д (1H, CH=C, J = 21 Гц), 4.80
д (1Н, ОСН, J = 8 Гц), 2.88-2.83 м (1Н, СН), 2.60 т
3285 (N-H), 2251 (C≡N), 1720 (C=N). Спектр ЯМР
1Н, δ, м. д.: 9.85 с (1H, NН), 7.66 д (1H, CH, 2-Fu,
(1Н, СН2, J = 7 Гц), 2.43-2.27 м (2Н, СН2), 2.10-
J = 1.6 Гц), 7.09 д (1Н,CH, 2-Fu, J = 16.0 Гц), 6.72 д
1.97 м (3Н, 2СН2), 1.78-1.69 м (3Н, 2СН2), 1.52-
(1H, CH, J = 2.8 Гц), 6.57 д (1H, CH, J = 3.6 Гц),
1.42 м (1Н, СН2), 1.28 д (3Н, СН3, J = 6 Гц), 1.20-
6.02 д. д (1H, CH, 2-Fu, J = 15.6, 7.2 Гц), 5.21 д (1H,
0.95 м (2Н, СН), 0.85 д (3Н, СН3, J = 42.0 Гц).
ОCH, J = 8.0 Гц), 2.85 к (1H, CH, J = 5.5 Гц), 2.05 т
Спектр ЯМР 13С, δС, м. д.: 156.04, 139.48, 138.71,
(2Н, СН2, J = 15.0 Гц), 1.81-1.70 м (2H, CH2), 1.52-
129.94, 128.48, 112.82, 111.36, 110.11, 107.81, 76.08,
1.21 м (2H, CH2), 1.08-0.98 м (2H, CH2). Спектр
53.11, 45.80, 32.12, 31.64, 31.19, 29.73, 25.75, 25.34,
ЯМР 13С, δС, м. д.: 155.92, 149.87, 144.80, 126.60,
21.58, 21.29, 21.13, 20.89. Найдено, %: C 70.21; H 6.49;
116.34, 112.86, 112.54, 112.28, 110.03, 107.58, 73.78,
N 14.79. C22H24N4О2. Вычислено, %: C 70.19; H
52.40, 29.68, 25.33, 21.87, 20.82. Найдено, %: C
6.43; N 14.88.
65.47; H 4.56; N 16.14. C21H16N4О2. Вычислено, %:
Рентгеноструктурное исследование соедине-
C 65.51; H 4.63; N 16.08.
ний 1а, 1в и 1е. Параметры элементарных ячеек и
интенсивности
отражений
измерены
на
2-(Гекс-1-ин-1-ил)-10-иминотетрагидро-8а,4-
синхротронной станции «БЕЛОК» Национального
(эпоксиметано)хромен-3,3,4(2Н,4аН)-трикарбо-
исследовательского центра «Курчатовский институт»
нитрил (1г). Выход 630 мг (90%), белое вещество,
с использованием двухкоординатного детектора
т. пл. 106-108°С. ИК спектр, ν, см-1: 3280 (N-H)
Rayonix SX165 CCD (100 K, λ = 0.80246 Å, φ-
2251 (C≡N), 1717 (С=N). Спектр ЯМР 1Н, δ, м. д.:
сканирование с шагом 1.0°). Обработка экспери-
9.79 с (1H, NН), 5.48 с (1H, OCH), 2.85 к (1Н, CH,
ментальных данных проведена с помощью
J = 6.0 Гц), 2.36 т (2H, CH2, J = 7.5 Гц), 2.01 т (2H,
программы iMOSFLM, входящей в комплекс
CH2, J = 15.0 Гц), 1.78-1.67 м (2H, CH2), 1.52-1.43
программ CCP4
[10]. Для полученных данных
м (2H, CH2), 1.40-1.32 м (2H, CH2), 1.31-1.21 м (2H,
проведен учет поглощения рентгеновского
CH2), 1.04-0.94 м (2H, CH2), 0.85 т (3Н, СН3, J =
излучения по программе Scala
[11]. Основные
7.5 Гц). Спектр ЯМР 13С, δС, м. д.: 155.8, 113.1,
кристаллоструктурные данные и параметры
111.5, 110.5, 108.4, 94.2, 72.2, 66.5, 53.1, 46.7, 46.5,
уточнения представлены в табл.
1. Структуры
30.9, 30.3, 27.9, 26.06, 22.6, 22.4, 21.5, 18.5, 14.6.
решены прямыми методами
и уточнены
Найдено, %: C 68.67; H 6.21; N 15.05. C19H20N4О2.
полноматричным методом наименьших квадратов
Вычислено, %: C 68.55; H 6.33; N 15.99.
в анизотропном приближении для нево-
по F2
10-Имино-2-(фенилэтинил)тетрагидро-8a,4-
дородных атомов. Атомы водорода иминогрупп
(эпоксиметано)хромен-3,3,4(2H,4aH)-трикарбо-
выявлены объективно в разностных Фурье-
нитрил (1д). Выход 680 мг (95%), белое вещество,
синтезах и уточнены изотропно с фиксированными
т. пл. 175-177°С. ИК спектр, ν, см-1: 3308 (N-H),
параметрами смещения
[Uизо(H)
=
1.2Uэкв(N)].
2243(С≡N), 1717 (C=N). Спектр ЯМР 1Н, δ, м. д.:
Положения
остальных
атомов
водорода
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
РЕАКЦИЯ 1-(2-ОКСОЦИКЛОГЕКСИЛ)ЭТАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛА
355
рассчитаны геометрически и включены в
P. 1757. doi 10.1007/s11178-006-0034-8
уточнение с фиксированными позиционными
2.
Ievlev M.Yu., Ershov O.V., Tafeenko V.A. // Org. Lett.
параметрами по модели наездника и изотропными
Vol. 18. N 8. P. 1940. doi 10.1021/acs.orglett.6b00867
параметрами смещения [Uiso(H) = 1.5Ueq(C) для
3.
Иевлев М.Ю., Ершов О.В., Васильев А.Н., Тафеенко
CH3-групп и Uiso(H) = 1.2Ueq(C) для остальных
В.А., Суражская М.Д., Насакин О.Е. // ЖорХ. 2017.
Т. 53. Вып. 7. С. 1019; Ievlev M.Y., Ershov O.V.,
групп]. Абсолютная конфигурация асимметри-
Vasil’ev A.N., Nasakin O.E., Tafeenko V.A.,
ческих центров в соединении
1е определена
Surazhskaya M.D.
// Russ. J. Org. Chem.
2017.
объективно на основании известной конфигурации
Vol. 53. N 7. P. 1030. doi 10.1134/S1070428017070119
исходной молекулы R-(-)-миртеналя. Все расчеты
4.
Ievlev M.Yu., Ershov O.V., Belikov M.Yu., Milovidova
проведены с использованием комплекса программ
A.G., Tafeenko V.A., Nasakin O.E. // Beilstein J. Org.
SHELXTL [12]. Таблицы координат атомов, длин
Chem. 2016. Vol. 12. P. 2093.doi 10.3762/bjoc.12.198
связей, валентных и торсионных углов и
5.
Марьясов М.А., Шевердов В.П., Насакин О.Е.,
анизотропных параметров смещения для соеди-
Махмудов Р.Р. // Хим.-фарм. ж. 2016. Т. 50. № 9.
нений 1а, 1в и 1е депонированы в Кембриджском
С. 56; Mar’yasov M.A., Sheverdov V.P., Nasakin O.E.,
банке структурных данных [CCDC 1862746 (1а),
Makhmudov R.R. // Pharm. Chem. J. 2016. Vol. 50. N 9.
1862710 (1в) и 1862711 (1е)].
P. 580. doi 10.1007/s11094-016-1494-y
6.
Ievlev M.Yu., Ershov O.V. // Chem. Heterocycl. Compd.
ФОНДОВАЯ ПОДДЕРЖКА
2016. Vol. 52. N 4. P. 213. doi 10.1007/s10593-016-
1864-0
Работа выполнена при финансовой поддержке
7.
Middleton W.J., Heckert R.E., Little E.L., Krespan C.J. // J.
Am. Chem. Soc. 1958. Vol. 80. N 11. P.
2783.
Программы повышения конкурентоспособности
doi 10.1021/ja01544a053
РУДН «5-100». Рентгеновские измерения были
8.
Каюков Я.С., Лукин П.М., Насакин О.Е., Хрусталев
проведены на оборудовании уникальной научной
В.Н., Нестеров В.Н., Антипин М.Ю., Шевердов
установки Курчатовский источник синхротронного
В.П. // ХГС. 1997. № 4. С. 497; Kayukov Ya.S., Lukin
излучения,
финансируемой
Министерством
P.M., Khrustalev V.N., Nesterov V.N., Antipin M.Yu.,
образования и науки РФ (идентификатор проекта
Sheverdov V.P. // Chem. Heterocycl. Compd.
1997.
RFMEFI61917X0007).
Vol. 33. N 4. P. 423. doi 10.1007/BF02321385
9.
Шевердов В.П., Ершов О.В., Насакин О.Е.,
КОНФЛИКТ ИНТЕРЕСОВ
Чернушкин А.Н., Тафеенко В.А. // ЖОрХ.
2002.
Т. 38. Вып. 7. С. 1043; Sheverdov V.P., Ershov O.V.,
Авторы заявляют об отсутствии конфликта
Nasakin O.E., Chernushkin A.N., Tafeenko V.A. // Russ.
интересов.
J. Org. Chem. 2002. Vol. 38. N 7. P. 1001. doi 10.1023/
A:1020801612443
10. Battye T.G., Kontogiannis L., Johnson O., Powell H.R.,
СПИСОК ЛИТЕРАТУРЫ
Leslie A.G.W. // Acta Crystallogr (D). 2011. Vol. 67.
P. 271. doi 10.1107/S0907444910048675
1. Шевердов В.П., Ершов О.В., Еремкин А.В., Насакин О.Е.,
Бардасов И.Н., Тафеенко В.А. // ЖОрХ. 2005. Т. 41.
11. Evans P. // Acta Crystallogr. (D). 2006. Vol. 62. P. 72.
Вып.
12. С.
doi 10.1107/S0907444905036693
12. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
V.A. // Russ. J. Org. Chem. 2016. Vol. 41. N 12.
P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
356
ШЕВЕРДОВ и др.
Reaction of 1-(2-Oxocyclohexyl)ethane-1,1,2,2-tetracarbonitrile
with α,β-Unsaturated Aldehydes
V. P. Sheverdova*, V. V. Davydovaa, O. E. Nasakina, M. A. Maryasova,
P. B. Dorovatovskiib, and V. N. Khrustalevb,c
a I. N. Ulyanov Chuvash State University, Moscoskii pr. 15, Cheboksary, 428015 Russia
*e-mail: SheverdovVP@yandex.ru
bNational Research Center “Kurchatov Institute”, Moscow, Russia
cRussian University of Peoples' Friendship, Moscow, Russia
Received September 6, 2018; revised September 6, 2018; accepted September 17, 2018
The reactions of 1-(2-oxocyclohexyl)ethane-1,1,2,2-tetracarbonitrile with crotonic and cinnamic aldehyde,
2-furylacrolein, 3-phenyl-2-propinal, 3-butyl-2-propinal, and R-(-)-myrtenal proceed through the stage of
formation of 8a-hydroxyhexahydro-2H-chromene-3,3,4,4-tetracarbonitrile followed by the formation of 10-
iminotetrahydro-8a,4-(epoxymethane)chromene-3,3,4(2H,4aH)-tricarbonitriles. By X-ray diffraction data, the
stereochemical features of the desired products are determined by the reaction direction.
Keywords:
1-(2-oxocyclohexyl)ethane-1,1,2,2-tetracarbonitrile, unsaturated aldehydes, R-(-)-myrtenal,
configuration
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019