ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 357-365
УДК 547.565.2:544.546
СИНТЕЗ ПРОИЗВОДНЫХ
3,5-ДИ-трет-БУТИЛ-1,2-ДИГИДРОКСИБЕНЗОЛА
И ИХ ВЛИЯНИЕ НА СВОБОДНОРАДИКАЛЬНОЕ
ОКИСЛЕНИЕ ГЕКСАНА И КИСЛОРОДАКТИВИРУЮЩУЮ
СПОСОБНОСТЬ НЕЙТРОФИЛОВ
© 2019 г. Г. А. Ксендзоваa, *, Н. И. Островскаяa, Г. Н. Семенковаb, В. Л. Сорокинb,
П. А. Шишкановаb, О. И. Шадыроa,b
a Научно-исследовательский институт физико-химических проблем Белорусского государственного университета,
ул. Ленинградская 14, Минск, 220050 Беларусь
b Белорусский государственный университет, Минск, Беларусь
Поступило в Редакцию 27 сентября 2018 г.
После доработки 27 сентября 2018 г.
Принято к печати 2 октября 2018 г.
Синтезированы С6-замещенные производные 3,5-ди-трет-бутил-1,2-дигидроксибензола, изучено их
влияние на радиационно-индуцированное свободнорадикальное окисление н-гексана и продукцию
активных форм кислорода и хлора в нейтрофилах. Показано, что введение фенилгидразоновой и
фенилазометиновой групп существенно увеличивает антиоксидантную активность производных
пирокатехина. Для шести соединений установлена способность предотвращать развитие оксидативного
стресса, обусловленного гиперпродукцией в нейтрофилах активных кислородных интермедиатов и
HOCl/OCl-.
Ключевые слова: активные формы кислорода и хлора, антиоксидантная активность, миелопероксидаза,
нейтрофилы, пространственно-экранированный пирокатехин, хемилюминесценция
DOI: 10.1134/S0044460X19030041
Известно, что гиперпродукция активных форм
лекарственных средств для лечения патологий,
кислорода и хлора с последующей за этим
обусловленных
протеканием
оксидативного
интенсификацией свободнорадикальных реакций
стресса в организме, представляется актуальной.
повреждения биомолекул в организме может быть
В настоящей работе осуществлен синтез ряда
причиной сердечно-сосудистых и онкологических
производных
4,6-ди-трет-бутил-2,3-дигидрокси-
заболеваний, иммунодефицита, ревматоидного
бензальдегида
[2], который проявляет высокую
артрита и иных патологий
[1]. Кроме того,
ингибиторную активность в отношении процессов,
продуцирование активных форм кислорода и хлора
протекающих с участием пероксидных и α-гидро-
и активация перекисного окисления липидов
ксиалкильных радикалов [3]. Наличие в структуре
сопровождают течение различных вирусных
этого соединения активной формильной группи-
инфекций [1]. Клинические и экспериментальные
ровки позволяет провести конденсации с различ-
исследования показали эффективность использо-
ными первичными алифатическими и аромати-
вания антиоксидантов в арсенале средств
ческими аминами и сформировать гибридные
химиотерапии заболеваний, обусловленных актива-
структуры с потенциально более высокими анти-
цией свободнорадикальных процессов в организме
радикальными и антиоксидантными свойствами.
[1]. Поэтому разработка рационального метода
направленного поиска эффективных регуляторов
В работе исследована антиоксидантная актив-
свободнорадикальных реакций и потенциальных
ность модельных соединений (4,6-ди-трет-бутил-
357
358
КСЕНДЗОВА и др.
3-фенилиминометил-1,2-дигидроксибензол 1, 2,4-
1,2-дигидроксибензола на антиоксидантную актив-
ди-трет-бутил-6-фенилиминометилфенол
2)
и
ность и на процессы образования активных форм
синтезированных образцов
3-13 в химической
кислорода и хлора в нейтрофилах.
(радиационно-индуцированное окисление гексана)
и биологических (генерация активных форм
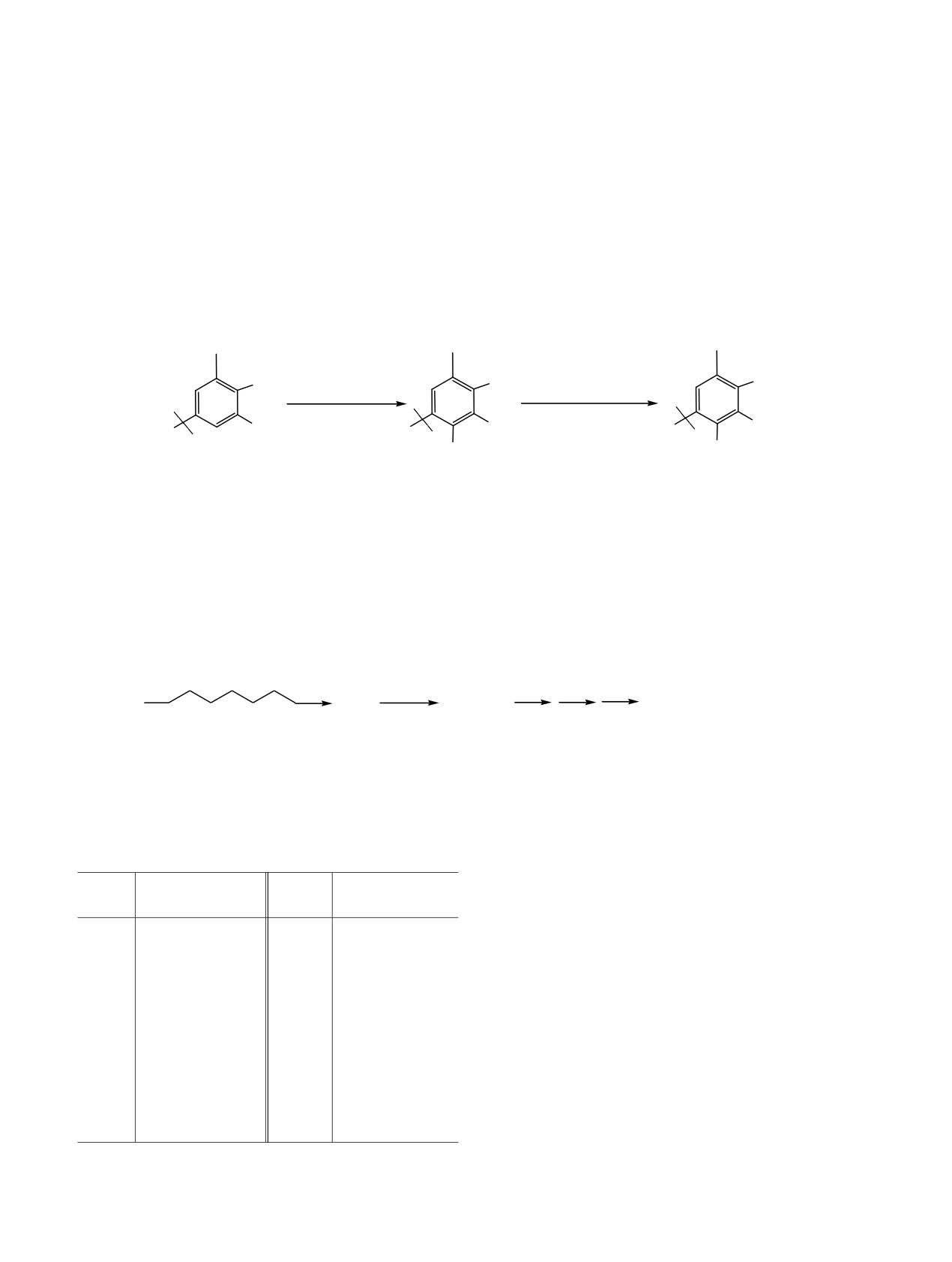
Синтез объектов исследования 3-13 осущест-
кислорода и хлора в нейтрофилах крови человека,
вляли
конденсацией
4,6-ди-трет-бутил-2,3-
галогенирующая активность миелопероксидазы)
дигидроксибензальдегида
с первичными али-
модельных системах, определена их цитотоксич-
фатическими и ароматическими аминами, а также
ность в отношении нейтрофилов. Выявлены зако-
с фенилгидразином в эквимолярных соотно-
номерности влияния структуры С6-заместителя
шениях при нагревании в спиртовой среде или
синтезированных производных 3,5-ди-трет-бутил-
толуоле (1).
____
__
__
__
__
OH
OH
OH
(1) C6H12N4, AcOH
RNH
2
(1)
(2) HClводн
MeOH, EtOH, толуол
OH
OH
OH
CHO
CH=NR
313
Антиоксидантные свойства синтезированных
очередь, в результате дальнейших превращений
соединений изучали на модели инициированного γ-
образуются соответствующие спирты и кетоны. В
излучением окисления н-гексана в присутствии
качестве основных продуктов при радиолизе н-
кислорода воздуха. При этом возникают
гексана в присутствии О2 образуются гексанолы и
пероксидные (ROO) радикалы, из которых, в свою
гексаноны (2) [4].
O2
(2)
Гексан-2-ол, гексан-3-ол,
C6H14
C6H13
C6H13OO
гексан-2-он, гексан-3-он
Таблица 1. Влияние производных 3,5-ди-трет-бутил-
Сумма выходов гексанолов и гексанонов в
1,2-дигидроксибензола 1-13 на суммарный радиационно-
присутствии различных добавок является показа-
химический выход продуктов окислительного
телем их антиоксидантной активности и, следо-
радиолиза н-гексана
вательно, эффективности их взаимодействия с
Выход,
Выход,
радикалами ROO. В табл. 1 приведены суммарные
№
№
×10-7 Дж/моль
×10-7 Дж/моль
выходы гексанолов и гексанонов, образующихся
при радиолизе н-гексана, в присутствии и в
–
2.42±0.14
8
0.92±0.06
отсутствие производных
3,5-ди-трет-бутил-1,2-
1
1.02±0.05
9
0.78±0.05
дигидроксибензола.
2
2.33±0.18
10
0.64±0.04
Как известно, ключевой реакцией в инги-
3
0.77±0.05
11
0.97±0.07
бировании фенолами процесса окисления орга-
нических веществ является взаимодействие их с
4
0.40±0.03
12
0.77±0.05
пероксидными радикалами с образованием резо-
5
1.03±0.06
13
2.37±0.14
нансно-стабилизированных феноксильных ради-
калов (PhO), которые затем расходуются в
6
0.39±0.03
14
1.73±0.13
реакциях рекомбинации друг с другом и с
7
0.85±0.05
15
1.07±0.06
радикалами ROO [5].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ ПРОИЗВОДНЫХ 3,5-ДИ-трет-БУТИЛ-1,2-ДИГИДРОКСИБЕНЗОЛА
359
ROO + PhОH → ROOH + PhО,
(3),
Для соединений, проявивших наиболее высокую
антиоксидантную активность в химической
PhО + ROO → Молекулярные продукты,
(4),
модельной системе, было проведено исследование
PhО + PhО → Молекулярные продукты.
(5).
их влияния на генерацию активных форм
Введение фенилгидразоновой и фенилазо-
кислорода и хлора нейтрофилами крови человека,
метиновой групп в 3,5-ди-трет-бутил-1,2-дигид-
галогенирующую активность миелопероксидазы и
роксибензол оказало существенное влияние на
способность утилизировать HOCl/OCl-. Кроме
повышение антиоксидантной активности. Высокую
того, была изучена жизнеспособность этих клеток
реакционную способность в отношении перок-
в присутствии анализируемых веществ.
сидных радикалов проявляют соединения 1, 3-12:
они снижают радиационно-химические выходы
Нейтрофилы являются основным источником
активных форм кислорода и хлора в организме
основных продуктов окисления н-гексана в 2.4-
6.2 раз. Эти соединения не уступают хорошо
человека и животных. Эти клетки распознают и
известному и применяемому в промышленности
уничтожают различные патогены, защищая
организм от инфекции
[8]. Их присутствие
антиоксиданту ионолу 15, исследованному ранее в
аналогичной модельной системе, и превосходят
преобладает в очаге воспаления на ранних стадиях
3,5-ди-трет-бутил-1,2-дигидроксибензол 14 [6, 7].
этого процесса. Фагоцитоз бактерий нейтрофилами
сопряжен с активацией НАДФН-оксидазы, в
Стоит также отметить, что введение фенилазо-
метиновой группы в монофенол (соединение 2) не
результате чего генерируются супероксидные
анион-радикалы (6), при дисмутации которых под
оказало влияния на антиоксидантную активность,
действием
фермента
супероксиддисмутазы
т. е. для проявления антиоксидантной активности
необходимо наличие пирокатехинового (соедине-
образуется Н2О2 (7) [9].
ния 1 и 2) и фенилазометинового (соединения 1 и
НАДФН + 2O2 → НАДФ+ + 2О- + Н+,
(6),
14) фрагментов. Возможно, OH-группа соединения
2О- + 2Н+ → Н2О2 + О2.
(7).
2 вовлечена во внутримолекулярную водородную
связь типа O-H⋅⋅⋅N, поэтому данное вещество не
Пероксид водорода и хлорид-ионы являются
проявляет активности в радикальных реакциях.
субстратами миелопероксидазы, функционирование
которой сопровождается продукцией хлорноватистой
Наиболее активными антиоксидантами оказались
кислоты (8), существующей при физиологических
вещества 4 и 6. При сравнении соединений 4 и 6 с
значениях рН среды в виде HOCl/OCl- [10].
соединением 1 (в нем отсутствует гидроксильная
группа в бензольном кольце фенилазометинового
Н2О2 + Cl- + H+ → НОСl + H2O.
(8)
фрагмента) и 1, 5, 7 (в них гидроксильная группа в
Именно HOCl/OCl- главным образом унич-
бензольном кольце фенилазометинового фрагмента
тожает чужеродный материал в организме. Еще
отсутствует или метилирована) видно, что наличие
одно важное значение этого окислителя состоит в
ОН-группы в пара- или орто-положении фенил-
том, что в микромолярных концентрациях HOCl/
азометинового фрагмента играет существенную
OCl- выполняет регуляторную роль, усиливая
роль в антиоксидантной активности производных
функциональную активность клеток [11]. Однако
3,5-ди-трет-бутил-1,2-дигидроксибензола. Такую
при высоких концентрациях хлорноватистая
высокую реакционную способность соединений 4
кислота и гипохлорит-ионы являются источником
и 6 в отношении пероксидных радикалов можно
свободных радикалов, которые модифицируют или
объяснить вероятным образованием феноксильных
разрушают жизненно важные биомолекулы, что
радикалов не только по ОН-группе пирокате-
может приводить к развитию ряда тяжелых
хинового, но и по дополнительной ОН-группе
патологических состояний [1, 12].
фенилазометинового фрагмента. Присутствие
дополнительной сульфгидрильной (соединения 9 и
Результаты исследования влияния производных
10), фенилгидразоновой
(3) и нитрогрупп
(12)
3,5-ди-трет-бутил-1,2-дигидроксибензола
на
также способствует повышению активности
процессы генерации активных форм кислорода и
соединений в отношении пероксидных радикалов.
хлора нейтрофилами представлены в табл.
2.
Cоединение 13 c адамантилазометиновой группой
Видно, что соединения
3,
4,
6,
9,
10 и
12
оказалось неактивным в радикальных реакциях,
значительно снижают люминолзависимую хеми-
вероятно, в связи с экранированием гидроксильных
люминесценцию стимулированных к фагоцитозу
групп объемным адамантильным заместителем.
нейтрофилов. Исключение составляет вещество 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
360
КСЕНДЗОВА и др.
Таблица 2. Влияние производных 3,5-ди-трет-бутил-1,2-дигидроксибензола на свободнорадикальные процессы в
клеточных и модельных системах и на жизнеспособность нейтрофилова
№
Rlum, %
Rluc, %
Rhal, %
Rlum-NaOCl, %
V, %
1
-4.80±2.17
45.45±4.90
75.28±3.27
70.93±2.80
83.50±1.41
3
34.10±5.47
47.12±4.65
96.33±0.58
10.58±3.38
94.36±6.22
4
52.29±4.52
48.68±3.90
96.84±0.31
71.13±1.58
82.34±10.42
6
40.00±4.01
45.28±2.96
85.44±1.02
43.30±4.58
91.95±1.36
9
74.92±3.18
-7.13±5.74
87.30±1.23
-17.30±2.92
88.19±4.23
10
62.76±1.02
44.21±3.58
44.11±7.72
1.44±1.34
96.95±5.12
12
38.78±3.74
39.22±3.58
74.83±2.34
65.43±1.01
99.91±13.29
14
96.96±2.47
97.52±2.47
71.99±3.48
63.17±0.25
94.26±2.94
а Rlum - степень ингибирования люминолзависимой хемилюминесценции, Rluc - степень ингибирования люцигенинзависимой хеми-
люминесценции, Rhal
- cтепень ингибирования галогенирующей способности миелопероксидазы, Rlum-NaOCl
- cтепень
ингибирования хемилюминесценции в системе люминол-NaOCl, V - жизнеспособность нейтрофилов.
Поскольку люминол является индикатором
как главного источника HOCl/OCl- в организме,
преимущественно хлорноватистой кислоты [13],
проводили, измеряя суммарную интенсивность
ингибирование люминолзависимой хемилюмине-
хемилюминесценции в системе миелопероксидаза-
сценции нейтрофилов связано с уменьшением
люминол-Н2О2-Cl-. Из данных табл. 2 видно, что
продукции HOCl/ОCl- этими клетками. Это может
все соединения эффективно ингибируют люминол-
быть обусловлено несколькими причинами, основ-
зависимую хемилюминесценцию в системе,
ными из которых являются: снижение активности
содержащей миелопероксидазу. Ингибирующий
миелопероксидазы, уменьшение концентрации
эффект анализируемых веществ уменьшается от
специфического субстрата миелопероксидазы
-
96.8 до 44.1% в следующей последовательности:
пероксида водорода, утилизация HOCl - продукта
3, 4 ˃ 6, 9 ˃ 1, 12 ˃ 10.
функционирования этого фермента.
Уменьшение выхода
люминолзависимой
хемилюминесценции в системе, содержащей
В табл.
2 приведены результаты влияния
миелопероксидазу, может быть связано как с
анализируемых веществ на люцигенинзависимую
ингибированием галогенирующей активности
хемилюминесценцию нейтрофилов. Из получен-
фермента, так и со способностью анализируемых
ных данных видно, что вещество 9 не влияет на
соединений утилизировать безрадикальным путем
этот процесс. Остальные соединения снижают
хлорноватистую кислоту, которая является
уровень
люцигенинзависимой
хемилюмине-
основным продуктом реакции, катализируемой
сценции на 39.2-48.7%. Изменение интенсивности
миелопероксидазой. Из табл.
2 видно, что
люцигенинзависимой
хемилюминесценции
соединения 4, 1, 12 на 70.9-65.4%, а вещество 6 на
коррелирует с продукцией Н2О2 клетками, так как
43.3% ингибирует интенсивность хемилюминесцен-
люцигенин используется в качестве индикатора
ции в системе люминол-NaOCl, что указывает на
супероксидных анион-радикалов
[14], которые
их способность утилизировать хлорноватистую
образуются при активации НАДФН-оксидазы.
кислоту безрадикальным путем. В то же время
Выход Н2О2 может снижаться в результате
соединения 3 и 10 практически не влияют, а 9
уменьшения активности НАДФН-оксидазы либо
незначительно усиливает выход хемилюмине-
из-за взаимодействия с Н2О2. Однако нами получены
сценции, вероятно, образуя новые радикальные
данные об отсутствии влияния анализируемых
продукты в изучаемой реакции. Сопоставление
соединений на выход хемилюминесценции в
результатов, полученных для систем люминол-
системе люминол-Н2О2, что исключает наличие их
NaOCl и миелопероксидаза-люминол-Н2О2-Cl-,
взаимодействия с пероксидом водорода.
позволяет заключить, что соединения 3, 4, 6, 9 и 10
Изучение влияния анализируемых веществ на
способны эффективно ингибировать галогениру-
галогенирующую способность миелопероксидазы,
ющую способность миелопероксидазы. Анализ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ ПРОИЗВОДНЫХ 3,5-ДИ-трет-БУТИЛ-1,2-ДИГИДРОКСИБЕНЗОЛА
361
влияния изучаемых веществ на жизнеспособность
ность эффективно подавлять активность миело-
клеток (табл.
2) свидетельствует о том, что
пероксидазы, практически не утилизируя при этом
наблюдаемые
эффекты не связаны с цито-
гипохлорит, характерна и для соединения 3.
токсическим действием этих веществ.
Таким образом, в нашей работе показано, что
Следует отметить, что мы не получили коли-
синтезированные производные 3,5-ди-трет-бутил-
чественной корреляции между антиоксидантной
1,2-дигидроксибензола
3-12 (в особенности
активностью анализируемых соединений в
соединения 4 и 6) проявляют высокую активность
радиационно-химическом и биохимических иссле-
в отношении пероксидных радикалов. Соединения
дованиях (табл.
1,
2),
xотя качественная
3, 4, 6, 9, 10 и 12, не оказывая цитотоксического
корреляция между этими эффектами нами
действия, снижают образование активных форм
обнаружена. Это может быть связано с рядом
кислорода и хлора в нейтрофилах. Соединения 3, 9
причин. Во-первых, клетки - это сложная много-
и
10 эффективно подавляют галогенирующую
компонентная система, в которой все процессы
активность миелопероксидазы, не утилизируя при
взаимосвязаны и регулируются множеством
этом HOCl/OCl-. Для соединений 1, 4, 6 и 12
внутриклеточных и внешних факторов. Изучаемые
выявлена способность взаимодействовать с
производные
3,5-ди-трет-бутил-1,2-дигидрокси-
гипохлоритом, не образуя при этом новых
бензола отличаются между собой по гидро-
радикальных продуктов. Из полученных данных
фобности, что может обусловливать их различную
следует, что синтезированные производные 3,5-ди-
проникающую способность через плазматическую
трет-бутил-1,2-дигидроксибензола 3, 4, 6, 9, 10 и
мембрану,
локализацию
в
определенных
12 можно рассматривать в качестве потенциальных
компартментах клетки и, как следствие,
ингибиторов оксидативного стресса в организме
взаимодействие с теми или иными биомолекулами.
человека. Это предполагает возможность их
Важнейшую роль в регуляции клеточных функций
дальнейшего использования в разработке
играют белки. Так, многие белки плазматических
лекарственных соединений для лечения патологий,
мембран являются рецепторами и запускают
связанных с развитием воспаления.
процессы внутриклеточной сигнализации, которые
контролируют ряд важнейших биохимических
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
реакций в клетке, в том числе и процессы
генерации активных форм кислорода и хлора в
В работе использовали
2,6-ди-трет-бутил-4-
нейтрофилах.
Белки-ферменты
выполняют
метилфенол (ионол, 15), н-гексан (97%), 2-гекса-
функцию катализаторов. Изменение структуры
нол,
2-гексанон,
3-гексанол,
3-гексанон фирмы
белковых молекул является ключевым фактором
«Sigma-Aldrich».
модификации их функций. В этой работе мы
Спектры ЯМР 1Н растворов в CDCl3 или ДМСО-
определяли интегральный отклик клеток на
d6 сняты на спектрометре Bruker ARX-400 с
воздействие производных 3,5-ди-трет-бутил-1,2-
рабочей частотой
400 МГц. Масс-спектры
дигидроксибензола (табл.
2). Отсутствие коли-
получены на спектрометре Schimadzu QP-5000 с
чественной корреляции между антиоксидантным
использованием методики прямого ввода образцов
действием анализируемых веществ в химической и
в ионный источник при температуре источника
биологических системах вероятно обусловлено
200°С и энергии ионизации 70 эВ. Температуры
большим разнообразием молекулярных мишеней
плавления определены на нагревательном столике
для этих соединений в нейтрофилах.
Boëtius. Контроль за ходом реакций и чистотой
Важнейшим регулятором функций белков
полученных соединений осуществляли методом
посредством модификации их структуры являются
тонкослойной хроматографии на пластинах Silufol
соединения, содержащие сульфгидрильные группы.
UV-254 в системе гексан-хлороформ-этилацетат
В нашей работе это соединения 9 и 10. Из табл. 2
(5:2:1), пластинки проявляли в парах иода.
видно, что эти соединения значительно снижают
Cоединения
1-3,
14 синтезированы по
галогенирующую активность миелопероксидазы и
методикам, описанным в работах [2, 7, 15].
при этом не взаимодействуют с гипохлоритом.
Можно предположить, что соединения
9 и
10
4,6-Ди-трет-бутил-3-(2-гидроксифенилими-
способны модифицировать этот фермент, снижая
нометил)-1,2-дигидроксибензол (4). Смесь 0.25 г
таким образом продукцию HOCl/OCl-. Способ-
(1 ммоль)
4,6-ди-трет-бутил-2,3-дигидроксибен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
362
КСЕНДЗОВА и др.
зальдегида и 0.11 г (1 ммоль) орто-аминофенола в
4,6-Ди-трет-бутил-3-(4-метилфенилимино-
20 мл абсолютного этанола кипятили 3 ч при
метил)-1,2-дигидроксибензол
(8). Смесь
2.5 г
перемешивании. Оставляли реакционную смесь на
(10 ммоль)
3,5-ди-трет-бутил-2-гидроксибенз-
ночь. Осадок отфильтровывали, промывали
альдегида и 1.07 г (10 ммоль) пара-толуидина в
абсолютным холодным этанолом. Выход 0.29 г
30 мл абсолютного метанола кипятили в течение
(85%), красный порошок, т. пл. 195-198°С. Спектр
30 мин и оставляли на ночь. Кристаллы
ЯМР 1H (CDCl3), δ, м. д.: 1.46 c (9H, CH3), 1.55 c
отфильтровывали, промывали петролейным
(9H, CH3), 6.89 с (1Н, СНAr), 6.95-7.25 м (5H, 4CHAr +
эфиром и перекристаллизовывали из этанола.
OH), 9.44 с (1H, СН=N). Масс-спектр, m/z (Iотн, %):
Выход
3.30 г
(96%), светло-красный порошок,
341 (87) [М]+. С21H27NO3.
т. пл. 186-187°С. Спектр ЯМР 1H (CDCl3), δ, м. д.:
1.48 c (9H, CH3), 1.55 c (9H, CH3), 2.23 c (3H, CH3),
4,6-Ди-трет-бутил-3-(2-метоксифенилимино-
6.84 с (1H, CHAr), 7.22-7.32 м (4H, CHAr), 9.39 с
метил)-1,2-дигидроксибензол (5). К раствору 0.5 г
(1H, CH=N). Масс-спектр, m/z (Iотн, %): 339 (72) [М]+.
(2 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
С22H29NO2.
альдегида в
10 мл абсолютного метанола
добавляли
0.26 г
(2 ммоль) орто-анизидина.
4,6-Ди-трет-бутил-3-(2-сульфанилфенилимино-
Полученную смесь кипятили 1 ч, затем охлаждали.
метил)-1,2-дигидроксибензол (9). Смесь 0.25 г
Осадок отфильтровывали и промывали холодным
(1 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
гексаном. Выход 0.27 г (74%), красный порошок,
альдегида и 0.125 г (1 ммоль) аминотиофенола в
т. пл. 140-142°С. Спектр ЯМР 1H (CDCl3), δ, м. д.:
15 мл абсолютного этанола кипятили 5 ч. После
1.47 c (9H, CH3), 1.53 c (9H, CH3), 4.02 c (3H,
удаления растворителя остаток перекристаллизо-
CH3O), 6.74 c (1H, CHAr), 7.04-7.32 м (4H, CHAr,
вывали из смеси гептан-этанол. Выход 0.28 г
ОН), 9.43 с (1H, СН=N). Масс-спектр, m/z (Iотн, %):
(78%), светло-желтый порошок, т. пл. 112-114°С.
355 (48) [М]+. С22H29NO3.
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.43 с (9H, CH3),
4,6-Ди-трет-бутил-3-(4-гидроксифенилимино-
1.53 с (9H, CH3), 3.67 уш. c (1H, SH), 6.13 с (1H,
метил)-1,2-дигидроксибензол (6). Смесь 0.25 г
OH), 6.85-7.48 м (5H, CHAr), 9.43 c (1H, CH=N).
(1 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
Масс-спектр, m/z (Iотн, %): 357 (77) [М]+. С21H27NO2S.
альдегида и 0.11 г (1 ммоль) пара-аминофенола в
4,6-Ди-трет-бутил-3-(2-сульфанилэтилимино-
25 мл абсолютного метанола кипятили при
метил)-1,2-дигидроксибензол
(10).
Раствор,
перемешивании 5 ч. После удаления растворителя
содержащий
0.195 г
(2 ммоль) цистеамина
осадок перекристаллизовывали из гептана. Выход
гидрохлорида, 0.50 г (2 ммоль) 4,6-ди-трет-бутил-
0.26 г (76%), светло-красный порошок, т. пл. 148-
2,3-дигидроксибензальдегида и 0.20 г (2 ммоль)
150°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 1.38 c
триэтиламина в
10 мл абсолютного метанола
(9H, CH3), 1.48 c (9H, CH3), 6.74 с (1H, CHAr), 6.94 д
перемешивали при комнатной температуре 6 ч.
(2H, CHAr, 3JHH = 7.0 Гц), 7.15 д (2H, CHAr, 3JHH =
Осадок отфильтровывали, метанол удаляли в
7.0 Гц), 8.17 с (1H, OH), 9.38 с (1H, CHAr), 9.80 с
вакууме, остаток промывали холодным этанолом и
(1H, OH). Масс-спектр, m/z (Iотн, %): 341 (79) [М]+.
перекристаллизовывали из гексана. Выход 0.44 г
С21H27NO3.
(72%), светло-оранжевый порошок, т. пл. 111-112°С.
4,6-Ди-трет-бутил-3-(4-метоксифенилимино-
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.45 с (9Н, СН3),
метил)-1,2-дигидроксибензол (7). К раствору 0.5 г
1.49 с (9Н, СН3), 2.92 уш. с (2Н, СН2), 3.83 уш. с
(2 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
(2Н, СН2), 6.71 уш. с (1H, OH), 7.30 с (1Н, СНAr),
альдегида в
10 мл абсолютного метанола
9.04 с (1H, CH=N). Масс-спектр, m/z (Iотн, %): 309
добавляли 0.25 г (2 ммоль) пара-анизидина. Через
(100) [М]+. С17H27NO2S.
30 мин смесь охлаждали, осадок отфильтровывали
и промывали на фильтре холодным гексаном.
4,6-Ди-трет-бутил-3-(4-бромофенилимино-
Выход 2.84 г (80%), ярко-красные кристаллы, т. пл.
метил)-1,2-дигидроксибензол
(11). К раствору
163-165°С. Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.48 с
0.25 г
(1 ммоль)
4,6-ди-трет-бутил-2,3-дигид-
(9H, CH3), 1.54 с (9H, CH3), 3.89 с (3Н, ОCH3), 6.48
роксибензальдегида в 10 мл абсолютного метанола
уш. с (1Н, ОН), 6.84 с (1Н, СНAr), 7.05 д (2H, CHAr,
добавляли 0.17 г (1 ммоль) пара-броманилина.
3JHH = 7.0 Гц), 7.32 д (2H, CHAr, 3JHH = 7.0 Гц), 9.38
Через 0.5 ч раствор охлаждали, осадок отфиль-
с (1Н, CH=N). Масс-спектр, m/z (Iотн, %): 355 (24)
тровывали и промывали его на фильтре холодным
[М]+. С22H29NO3.
гексаном. Выход
0.25 г
(62%), ярко-красные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ ПРОИЗВОДНЫХ 3,5-ДИ-трет-БУТИЛ-1,2-ДИГИДРОКСИБЕНЗОЛА
363
игольчатые кристаллы, т. пл. 195-196°С. Спектр
пламенно-ионизационным детектором. Условия
ЯМР 1H (CDCl3), δ, м. д.: 1.45 c (9H, CH3), 1.52 c
анализа: начальная температура - 60°С, скорость
(9H, CH3), 6.87 c (1H, CHAr), 7.18 д (2H, CHAr, 3JHH =
подъема до температуры
180°С
-
8 град/мин,
7.0 Гц), 7.60 д (2H, CHAr, 3JHH = 7.0 Гц), 9.39 с (1H,
температура испарителя
-
250°С, температура
CH=N). Масс-спектр, m/z (Iотн, %): 403 (34) [М - H]+,
детектора - 220°С, скорость газа-носителя (азота) -
405 (34) [М + H]+. C21H26BrNO2.
30 см/с.
4,6-Ди-трет-бутил-3-(3-нитрофенилимино-
Радиационно-химические выходы (G, 10-7 Дж/моль)
метил)-1,2-дигидроксибензол (12). Смесь 0.25 г
образования продуктов радиолиза н-гексана
(1 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
рассчитывали на линейных участках зависимостей
альдегида и 0.14 г мета-нитроанилина в 20 мл
их концентрации от поглощенной дозы методом
абсолютного этанола кипятили
3 ч, затем
наименьших квадратов. Ошибка определения
охлаждали. Осадок отфильтровывали, промывали
выхода не превышала 10%.
на фильтре водой, сушили и перекристаллизо-
Для биохимических исследований применяли
вывали из смеси гептан-i-PrOH (10:1). Выход 0.25 г
гепарин (Белмедпрепараты), декстран-500, гистопак-
(68%), светло-красные игольчатые кристаллы,
1077, среду RPMI-1640, люминол, люцигенин,
т. пл. 138-140°С. Спектр ЯМР 1H (CDCl3), δ, м. д.:
хемотаксический пептид fMLP (N-Formyl-Met-Leu-
1.45 с (9Н, СН3), 1.55 c (9Н, СН3), 6.24 уш. с (1Н,
Phe), пропидий иодид, тритон Х-100, NaOCl,
ОН), 6.92 с (1Н, СНAr), 7.58-7.66 м (2Н, СНAr), 8.10-
пероксид водорода (Sigma), спирт этиловый, среду
8.19 м (2Н, СНAr), 9.48 с (1Н, CH=N). Масс-спектр,
Эрла собственного приготовления, которая
m/z (Iотн, %): 370 (100) [М]+. C21H26N2O4.
включала: 0.12 моль/л NaCl, 5.4×10-3 моль/л KCl,
4,6-Ди-трет-бутил-3-(адамант-1-ил)илимино-
0.9×10-3 моль/л NaH2PO4∙2H2O, 0.8×10-3 моль/л
метил-1,2-дигидроксибензол (13). Смесь 0.125 г
MgSO4∙7H2O, 1×10-3 моль/л CaCl2, 5.6×10-3 моль/л
(0.5 ммоль) 4,6-ди-трет-бутил-2,3-дигидроксибенз-
глюкозы, 26.2×10-3 моль/л NaHCO3 (Анализ-Х).
альдегида, 0.075 г (0.5 ммоль) 1-адамантиламина,
Анализируемые соединения растворяли в этаноле.
15 мл толуола и каталитического количества TsOH
Контрольные образцы клеточных суспензий и
кипятили в течение 15 ч. После удаления толуола
модельных систем содержали этанол в таких же
остаток растворяли в 30 мл Et2O. Полученный
количествах, как и опытные пробы.
раствор промывали разбавленной Н2SO4, затем
Нейтрофилы выделяли из свежей крови
раствором NaHCO3 и водой. Растворитель удаляли
здоровых людей по стандартной методике в
в вакууме, остаток перекристаллизовывали из
градиенте плотности гистопака-1077 [16]. Клетки
толуола. Выход 0.12 г (62%), мелкокристалли-
ресуспензировали в среде RPMI-1640 (рН = 7.4).
ческий порошк оранжевого цвета, т. пл. 263°С
Полученная суспензия содержала не менее, чем
(разл.). Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.34 с (9Н,
96% нейтрофилов. Концентрация клеток в
СН3), 1.42 c (9Н, СН3), 1.65-2.34 м (15Н, 6СН2 +
анализируемой пробе составляла 1×106 в 1 мл. Для
3CH), 6.65 с (1Н, ОН), 7.29 с (1Н, СНAr), 8.92 с (1Н,
выделения миелопероксидазы суспензию нейтро-
CH=N). Масс-спектр, m/z (Iотн, %): 383 (39) [М]+.
филов подвергали трем циклам замораживания
C25H37NO2.
(при -20°С) и оттаивания (при 37°С), затем клетки
Для радиационно-химических испытаний
центрифугировали при
3000 об/мин в течение
использовали
10-3 М. растворы исследуемых
10 мин. Полученный супернатант, содержащий
соединений в н-гексане. Растворы облучали в
миелопероксидазу, отделяли от осадка и
герметичных стеклянных ампулах на установке
использовали для анализа.
MPX-γ-25M с источником 60Co. Мощность погло-
Генерацию активных форм кислорода и хлора
щенной дозы составляла 0.40±0.02 Гр/с. Интервал
нейтрофилами и миелопероксидазой изучали
используемых поглощенных доз 0.24-1.2 кГр.
хемилюминесцентным методом на биохемилю-
Анализ продуктов свободнорадикального окисления
минометре БХЛ-1 (Беларусь), включающем
н-гексана (гексан-2-ол, гексан-3-ол, гексан-2-он,
систему регистрации и обработки сигналов
гексан-3-он) осуществляли газохроматографическим
Uniсhrom (Беларусь). Для определения всех типов
методом на кварцевой капиллярной колонке
активных форм кислорода и хлора использовали
StabilWax-DA (l = 30 м, 0.32 мм ID, 0.5 мкм df) на
люминол в качестве эмиттера свечения. Для
хроматографе GC-17AAF/APC Shimadzu с
регистрации супероксидных анион-радикалов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
364
КСЕНДЗОВА и др.
применяли люцигенин. При работе с суспензией
Далее в кювету вносили пропидий иодид в
нейтрофилов измерения проводили в среде RPMI-
концентрации
4×10-6 моль/л и через
5 мин
1640, в случае миелопероксидазы - в среде Эрла
измеряли интенсивность флуоресценции Fd1 (λвозб =
при 37°С. Объем анализируемой пробы в обоих
530 нм, λрег = 640 нм) в течение 2 мин, затем клетки
случаях составлял 1 мл.
разрушали с помощью 0.2% Тритона Х-100 (Tr X-
100) и регистрировали флуоресценцию Ft1 в
Перед проведением анализа суспензию
течение последующих 3 мин. Жизнеспособность
нейтрофилов вместе с исследуемым веществом
клеток (V) в каждом образце определяли, как
(концентрация соединений 1, 3, 4, 6, 9, 10, 12 в
отношение числа живых клеток к числу всех
опытных пробах составляла 10-6 М.) инкубировали
клеток в пробе по формуле (10).
при 37°С в течение 20 мин, затем регистрировали
(Ft1 Ft2) (Fd1 Fd2)
интенсивность хемилюминесценции, обусловлен-
V =
100%.
(10)
ную действием на клетки fMLP. Раствор fMLP в
(Ft1 Ft2)
0.15 моль/л NaCl в концентрации 1×10-7 моль/л
Здесь V - жизнеспособность клеток в присутствии
вносили в суспензию клеток через 5 мин после
анализируемого вещества, Fd1 и Ft1 - параметры
начала адгезии.
интенсивности флуоресценции пропидий иодида в
Галогенирующую способность миелопероксидазы
отсутствие и в присутствии Tr Х-100
определяли измерением суммарной интенсивности
соответственно для опытного образца, Fd2 и Ft2 -
хемилюминесценции в системе, содержащей
параметры
интенсивности
флуоресценции
люминол (5×10-5 моль/л), Н2О2 (2×10-5 моль/л),
пропидий иодида в отсутствие и в присутствии Tr
миелопероксидазу при рН = 5.2 в среде Эрла в
Х-100 соответственно в растворе RPMI-1640. Для
течение
10 мин. Объем добавляемого супер-
удобства сравнения жизнеспособность для каждого
натанта, содержащего миелопероксидазу, составлял
образца V нормировали на жизнеспособность в
100 мкл, что соответствовало содержанию
контрольном образце V0 по формуле (11).
миелопероксидазы в 1×105 нейтрофилов в 1 мл.
(Ft1 Ft2) (Fd1 Fd2)
Перед измерением галогенирующей способности
V
=
100%.
(11)
миелопероксидазы супернатант, содержащий
V0
(Ft10 Ft2) (Fd10 Fd2)
фермент, инкубировали с анализируемым
Здесь V - жизнеспособность клеток в присутствии
веществом в течение 10 мин при 37°С.
анализируемого вещества, V0 - жизнеспособность
Для определения способности производных
клеток в контрольном образце, Fd1 и Ft1
-
пирокатехина влиять на свободнорадикальные
параметры
интенсивности
флуоресценции
процессы в реакции окисления люминола
пропидий иодида в отсутствие и в присутствии Tr
гипохлоритом или H2O2 изучали хемилюмине-
Х-100 соответственно для опытного образца, Fd10 и
сценцию в системах 5×10-6 М. NaOCl-5×10-5 М.
Ft10 интенсивность флуоресценции Fd1 и Ft1 для
люминол и 1×10-4 М. H2O2-5×10-5 М. люминол.
контрольных образцов, Fd2 и Ft2
параметры
Интегральную интенсивность хемилюминесценции
интенсивности флуоресценции пропидий иодида в
оценивали как площадь под кинетической кривой.
отсутствие и в присутствии Tr Х-100
Степень ингибирования хемилюминесценции (R)
соответственно в растворе RPMI-1640.
определяли по формуле (9).
При математической обработке результатов
определяли среднюю величину для группы
R = (1 Ii )
100%.
(9)
I0
независимых измерений (более трех). Полученные
данные представлены в работе как среднее
Здесь R - степень ингибирования хемилюмине-
значение ± произведение стандартного отклонения
сценции, Ii и I0
- суммарные интенсивности
и коэффициента Стьюдента для соответствующего
хемилюминесценции с учетом фонового свечения в
количества измерений (доверительная вероятность
опытном и контрольном образцах соответственно.
р = 0.95).
Жизнеспособность клеток оценивали флуоре-
сцентным методом на спектрофлуориметре СМ
КОНФЛИКТ ИНТЕРЕСОВ
2203 Солар (Беларусь) с использованием пропидий
иодида [17]. Суспензию фагоцитов инкубировали с
Авторы заявляют об отсутствии конфликта
производными пирокатехина в течение 1 ч при 37°С.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ ПРОИЗВОДНЫХ 3,5-ДИ-трет-БУТИЛ-1,2-ДИГИДРОКСИБЕНЗОЛА
365
СПИСОК ЛИТЕРАТУРЫ
N 11. P. 1842.
8. Тотолян А.А., Фрейдлин И.С. Клетки иммунной
1. Halliwell B., Gutteridge J.M.C. Free Radicals in
системы. СПб: Наука, 2000. Т. 1. С. 52.
Biology and Medicine. Oxford: University Press, 2015.
944 p.
2. Шадыро О.И., Сорокин В.Л., Ксендзова Г.А.,
Савинова О.В., Самович С.Н., Павлова Н.И., Поло-
10. Kettle A.J., Winterbourn C.C. // Redox Rep. 1997. Vol. 3.
зов Г.И., Бореко Е.И. // Хим.-фарм. ж. 2016. Т. 50.
N 2. P. 3. doi 10.1080/13510002.1997.11747085
№ 3. С. 20; Shadyro O.I., Sorokin V.L., Ksendzova G.A.,
11. Kuznetsova Т., Kulahava T., Zholnerevich I., Amaegberi N.,
Savinova O.V., Samovich S.N., Pavlova N.I., Polo-
Semenkova G., Shadyro O., Arnhold J. // Mol. Immunol.
zov G.I., Boreko E.I. // Pharm. Chem. J. 2016. Vol. 50.
2017. Vol. 87. P. 317. doi 10.1016/j.molimm.2017.05.007
N 3. P. 156. doi 10.1007/s11094-016-1414-1
12. Davies M.J., Hawkins C.L., Pattison D.I., Rees M.D. //
3. Ksendzova G.A., Samovich S.N., Sorokin V.L., Sha-
Antiox. Redox. Signal. 2008. Vol. 10. N 7. P. 1199. doi
dyro O.I. // Rad. Phys. Chem. 2018. Vol. 146. P. 115.
10.1089/ars.2007.1927
doi 10.1016/j.radphyschem. 2018.01.012
13. Рощупкин Д.И., Белакина Н.С., Мурина М.А.
//
4. Пикаев А.К. Современная радиационная химия. М.:
Биофизика. 2006. Т. 51. № 1. С. 99; Roshchupkin D.I.,
Наука, 1986. Т. 2. С. 325.
Belakina N.S., Murina M.A.
2006.
5. Рогинский
В.А.
Фенольные антиоксиданты.
Vol. 51. N 1. P. 79. doi 10.1134/S000635090601012X
Реакционная способность и эффективность. М.: Наука,
14. Li Y., Zhu H., Kuppusamy P., Roubaud V., Zweier J.L.,
1988. C. 19.
P. 2015.
6. Едимичева И.П., Островская Н.И., Полозов Г.И.,
Шадыро О.И. // ЖОХ. 2005. Т. 75. Вып. 4. С. 632;
15. Арсеньев М.В. Автореф. дис
канд. хим. наук.
Edimecheva I.P., Ostrovskaya N.I., Polozov G.I.,
Нижний Новгород, 2014. 26 с.
Shadyro O.I. // Russ. J. Gen. Chem. 2005. Vol. 75. N 4.
16. Бейум А. Выделение лимфоцитов, гранулоцитов и
P. 593. doi 10.1007/s11176-005-0278-y
макрофагов. Лимфоциты: выделение, фракциониро-
7. Масловская Л.А., Петрикевич Д.К., Тимощук В.А.,
вание и характеристика. М.: Медицина, 1980. С. 9.
Шадыро О.И. // ЖОХ. 1996. Т. 66. Вып. 11. С. 1893;
17. Kato F., Tanaka M., Nakamura K. // Toxicol. In Vitro.
Maslovskaya L.A., Petrikevich D.K., Timoshchuk V.A.,
1999. Vol. 13. N 6. P. 923. doi 10.1016/S0887-2333(99)
Shadyro O.I. // Russ. J. Gen. Chem. 1996. Vol. 66.
00078-8
Synthesis of 3,5-Di-tert-butyl-1,2-dihydroxybenzene Derivatives
and Their Effect on Free Radical Oxidation of Hexane
and Oxygen Activation Ability of Neutrophiles
G. A. Ksendzovaa, N. I. Ostrovskayaa, G. N. Semenkovab*, V. L. Sorokinb,
P. A. Shishkanovab, and O. I. Shadyroa,b
a Scientific Research Institute of Physical and Chemical Problems of Belarusian State University,
ul. Leningradskaya 14, Minsk, 220050 Belarus
*e-mail: ksja-bn@tut.by
b Belarusian State University, Minsk, Belarus
Received September 27, 2018; revised September 27; accepted October 2, 2018
C6-Substituted derivatives of 3,5-di-tert-butyl-1,2-dihydroxybenzene were synthesized, and their effect on
radiation-induced free radical oxidation of n-hexane and production of reactive oxygen and chlorine forms in
neutrophils were studied. The introduction of the phenylhydrazone and phenylazomethine groups was shown to
significantly increase the antioxidant activity of pyrocatechol derivatives. For six compounds, the ability to
prevent the development of oxidative stress due to overproduction of active oxygen intermediates and HOCl/OCl-
in neutrophiles was revealed.
Keywords: reactive oxygen and chlorine forms, antioxidant activity, myeloperoxidase, neutrophiles, sterically
hindered pyrocatechol, chemiluminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019