ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 377-384
УДК 547.751:547.732:544.527.22
СИНТЕЗ, ФОТО- И ИОНОХРОМНЫЕ СВОЙСТВА
ИНДОЛИЛ(ТИЕНИЛ)МАЛЕИМИДОВ С
ТЕРПИРИДИНОВЫМ РЕЦЕПТОРОМ
© 2019 г. Е. Н. Шепеленкоa, В. А. Подшибякинb, К. С. Тихомироваb,
А. Д. Дубоносовa, *, В. А. Бреньb, В. И. Минкинa,b
a Федеральный исследовательский центр Южный научный центр РАН, пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
*e-mail: aled@ipoc.sfedu.ru
b Научно-исследовательский институт физической и органической химии Южного федерального университета,
Ростов-на-Дону, Россия
Поступило в Редакцию 27 сентября 2018 г.
После доработки 27 сентября 2018 г.
Принято к печати 3 октября 2018 г.
Синтезированы индолил(тиенил)малеимиды с терпиридиновым рецептором в мостиковой части.
Облучение их растворов в толуоле светом с длиной волны 436 нм приводит к образованию циклических
изомеров. Обратная реакция раскрытия цикла происходит при фотолизе видимым светом (λ > 500 нм).
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)фенил}производные в растворах в ацетонитриле обладают свойствами
хромогенных naked-eye сенсоров на катионы Fe2+ (изменение окраски раствора с ярко-оранжевой на
красную).
Ключевые слова: индол, тиофен, малеимиды, терпиридин, фотохромные свойства, ионохромные свойства
DOI: 10.1134/S0044460X19030077
Молекулярные переключатели - это молекулы,
исходной, так и фотоиндуцированной форм и
способные к существованию в двух устойчивых
могут проявлять флуоресцентные, магнитные, хемо-
изомерных конфигурациях, между которыми
сенсорные и комплексообразующие свойства
возможны обратимые переходы при воздействии
[16-19]. Облучение их молекул УФ светом
света, тепла, электрического тока или при
приводит к гексатриен-циклогексадиеновой пере-
изменении ионного состава среды. В фотохромных
группировке открытой формы в циклический
переключателях осуществляется индуцируемая
изомер. Эти изомерные формы не перегруппиро-
облучением обратимая фотохимическая реакция
вываются друг в друга в отсутствие света и
[1-4]. Как правило, взаимопревращение изомеров
обладают различными физико-химическими харак-
сопровождается значительным изменением молеку-
теристиками. Химическая модификация дигетарил-
лярных характеристик - геометрических, электрон-
этенов путем введения в их состав лигандных
ных и, как следствие, физических свойств
-
групп открывает возможности получения фото-
электрических или спектрально-люминесцентных.
управляемых ионохромных систем (хемосенсоров),
В результате такие соединения используются для
у которых координация с ионами управляется при
нужд молекулярной электроники, оптической
помощи облучения светом [20-22].
записи информации, фотофармакологии, биовизу-
ализации, хемо- и биосенсорики [5-9]. Широко
C целью изучения влияния природы замести-
изучены спироциклические соединения, фульгиды,
телей в имидном мостиковом фрагменте дигетарил-
фульгимиды, хромены и азосоединения [10-15].
этенов на их фото(ионо)хромные и спектрально-
Важная роль в этом плане принадлежит ди-
люминесцентные свойства были синтезированы
гетарилэтенам, которые обладают значительной
новые малеимиды, содержащие терпиридиновые
устойчивостью к фотодеградации, характери-
заместители при пиррольном атоме азота. Фуран-
зуются высокой термической стабильностью как
2,5-дионы
1a-в были получены по ранее
377
378
ШЕПЕЛЕНКО и др.
Схема 1.
O
O
O
NH2
CH2NH2
MeO
R2
R3
N Me
S
R1
N
1aв
N
N
N
N
N
n-BuOH, DMAP, 8 ч
N
N
N
N
N
N
N
N
O
O
O
O
MeO
MeO
R2
R2
R3
R3
S
N Me S
N Me
R1
R1
2a, б
3aв
R1 = R2 = R3 = Me (a); R1 = CH2Ph, R2 = R3 = H (б); R1 = CH2Ph, R2 = R3 = Me (в).
разработанным нами методикам
[23,
24]. Их
длинноволновые полосы поглощения в области 455-
конденсация с
4-([2,2':6',2''-терпиридин]-4'-ил)-
464 нм (табл. 1). Спектральные данные свидетель-
анилином или
{4-([2,2':6',2''-терпиридин]-4'-ил)-
ствуют о существовании полученных соединений в
фенил}метанамином в n-BuOH в присутствии
открытой форме А [16, 21]. Малеимиды 2 и 3
диметиламинопиридина (DMAP) привела к
обладают в растворах малоинтенсивной флуоре-
малеимидам 2a, б, и 3a-в (cхема 1).
сценцией в диапазоне
515-526 нм. Спектры
возбуждения флуоресценции дигетарилэтенов 2, 3
В спектрах ЯМР 1Н соединений 2а и 3а в
хорошо совпадают с их спектрами поглощения,
области сильного поля регистрируются синглетные
свидетельствуя о принадлежности эмиссии исходной
сигналы протонов 2-метильной, 5-метоксильной и
нециклической форме.
N-метильной групп. Сигналы ароматических
протонов индольного и тиофенового циклов,
Малеимиды 2б и 3б с незамещенным тиофено-
бензильной группы, а также терпиридинового
вым заместителем не проявляют фотохромных
фрагмента регистрируются в области 6.33-8.80 м. д.
свойств. Аналогичное ингибирование фотохро-
В электронных спектрах поглощения мале-
мизма наблюдалось ранее для дигетарилэтенов с
имидов
2 и
3 в ацетонитриле наблюдаются
нафталимидными мостиковыми заместителями
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ, ФОТО- И ИОНОХРОМНЫЕ СВОЙСТВА ИНДОЛИЛ(ТИЕНИЛ)МАЛЕИМИДОВ
379
Таблица 1. Спектрально-флуоресцентные характеристики изомерных форм малеимидов 2, 3 в ацетонитриле (с = 8×
10-5 моль/л)
Открытая форма А
Циклическая форма Б
№
λmax, нм
Ifl,
λfl, нм
λmax, нм
(ε, л·моль-1·см-1)
(отн. ед.)
2a
464 (3750)
518
60
602
2б
460 (6250)
526
320
-
3a
455 (4750)
520
220
595
3б
457 (4050)
516
420
-
3в
455 (3600)
515
200
575
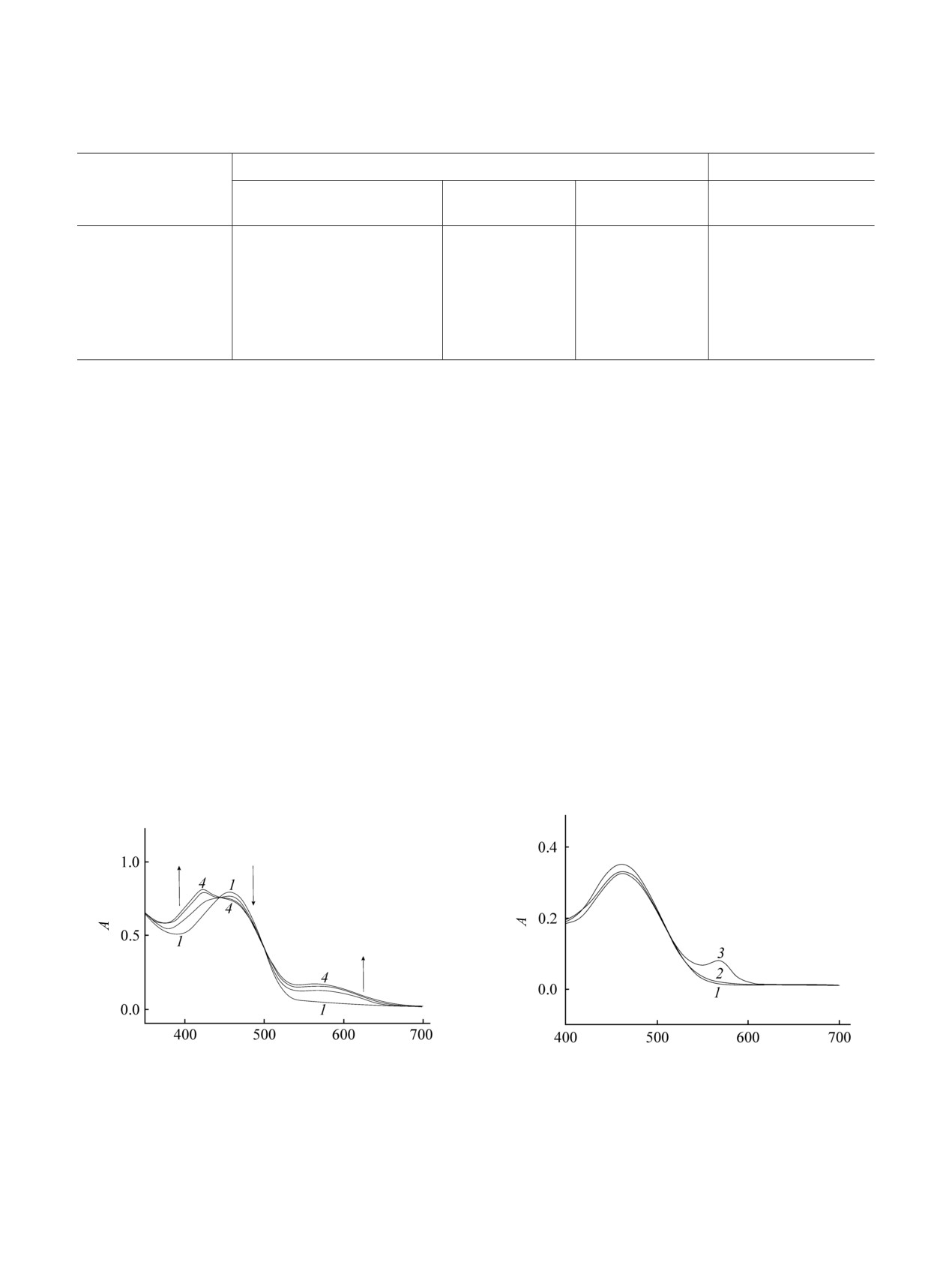
[25]. При облучении растворов соединений 2a и 3a,
Исследование взаимодействия полученных
в с 2,5-диметилтиофеновой группой светом (λ =
малеимидов
2a, б и
3a-в в ацетонитриле с
436 нм) в толуоле наблюдается появление новых
катионами Zn2+, Co2+, Cu2+, Ni2+, Pb2+, Hg2+, Fe2+ (в
длинноволновых полос поглощения в области 575-
виде перхлоратов) показало, что хромогенный
602 нм. Наблюдаемые спектральные изменения
naked-eye эффект [27] (изменение окраски раствора
свидетельствуют об образовании циклических
с ярко-оранжевой на красную) наблюдается только
изомеров Б (схема 2, табл. 1, рис.
1)
[16, 21].
для сопряженных структур
2a,
б при
Однако полной фотоконверсии исходной формы А
взаимодействии с ионами железа(II) (рис. 2). По-
в циклическую форму Б не происходит. При
видимому, наличие метиленовой группы CH2 в
продолжительном облучении устанавливается
мостиковом фрагменте дигетарилэтенов
3,
фотостационарное
состояние
с
малым
прерывающей
сопряжение,
препятствует
содержанием циклической формы (не более 5-
визуализации процесса комплексообразования.
10%), что, по-видимому, связано с конкуриру-
Характерное поглощение в области 565-575 нм
ющим эффективным процессом фотоиндуцирован-
соответствует образующемуся комплексу Fe2+ с
ного переноса электронной плотности в
терпиридиновым фрагментом [28, 29]. При этом,
возбужденном состоянии с терпиридинового
как и следовало ожидать, интенсивность исходной
фрагмента на пирролдионовую часть молекулы
флуоресценции снижается практически до нуля.
[26]. Облучение растворов после установления
Судя по данным спектров испускания,
фотостационарного состояния видимым светом
неокрашенные комплексы такого же типа
(λ
>
500 нм) приводит к быстрой обратной
образуются in situ в случае катионов цинка(II) и
изомеризации в открытые изомеры Б.
кобальта(II) (табл. 2).
λ, нм
λ, нм
Рис. 1. Электронные спектры поглощения малеимида
3в в толуоле (с = 2.2×10-4 моль/л) до (1) и после
Рис. 2. Cпектры поглощения малеимида 2a в MeCN (с =
облучения светом с длиной волны 436 нм в течение 10
8.0×10-5 моль/л) до (1) и после прибавления катионов
(2), 30 (3) и 60 мин (4).
Co2+ (2) и Fe2+ (3) (с = 4.0×10-4 моль/л).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
380
ШЕПЕЛЕНКО и др.
Схема 2.
N
N
N
N
N
N
h1
h2
N
N
O
O
O
O
MeO
MeO
Me
R2
R3
N
S
S
R3
N Me
R2
R1
R1
2a (А)
2a (Б)
N
N
N
N
N
N
h1
h2
N
N
O
O
O
O
MeO
MeO
Me
R2
R3
N Me S
N
S
R3
R2
R1
R1
3a, в (Б)
3a, в (А)
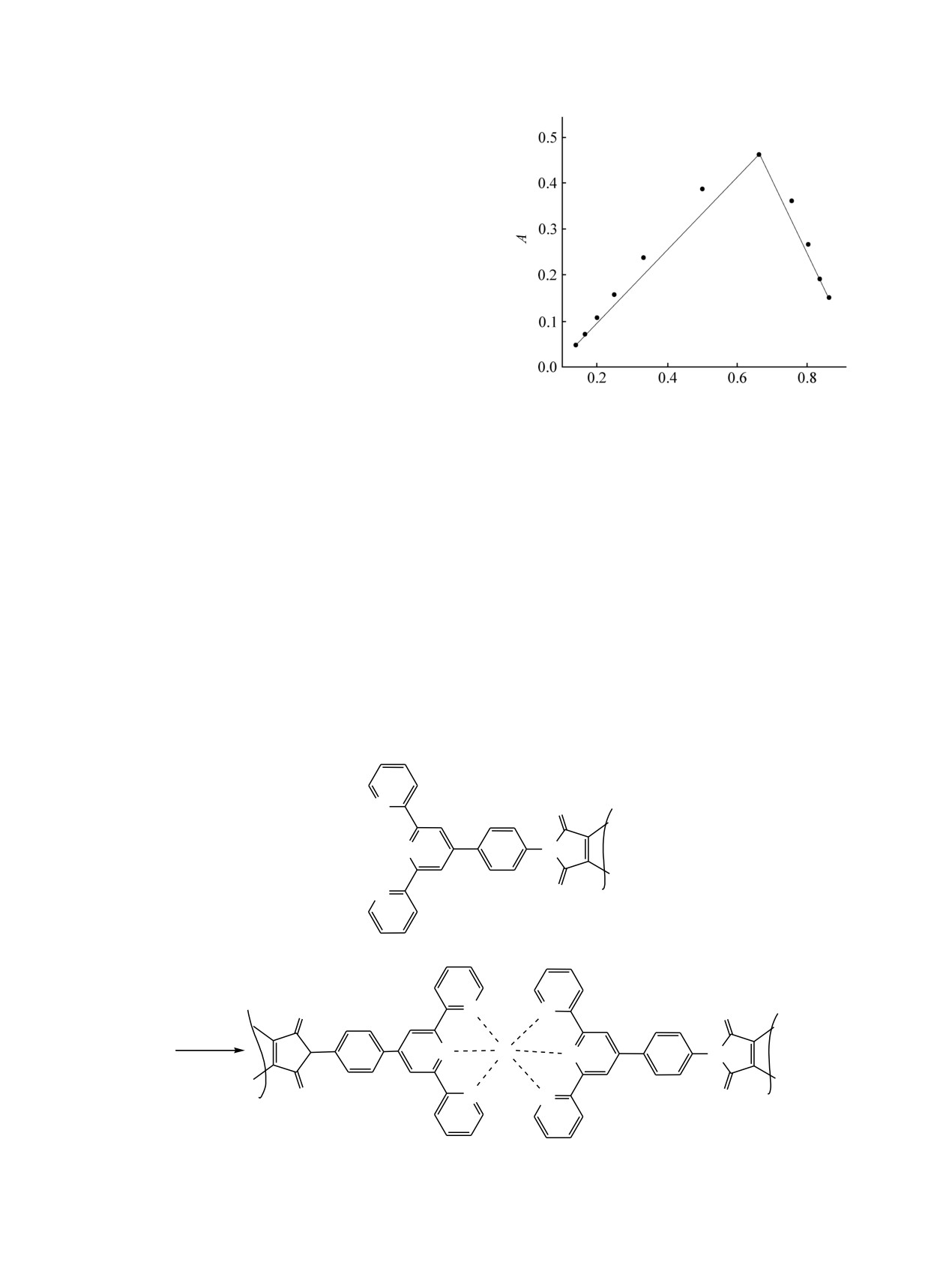
Таблица 2. Относительное изменение интенсивности
По данным спектрофотометрического титрования
флуоресценции (I/I0) малеимидов 2а и 2б (с = 5.0×
и метода изомолярных серий, соединение
2a
10-6 моль/л) в MeCN при добавлении катионов (с =
образует с катионами комплекс состава 2:1 (рис. 3).
2.5×10-5 моль/л)
Предполагаемое строение комплекса показано на
схеме 3.
№
Zn2+
Co2+
Cu2+
Ni2+
Pb2+
Hg2+
Fe2+
Таким образом, осуществлен синтез индолил
(тиенил)малеимидов с терпиридиновым рецепто-
2a
0.52
0.63
1.00
1.00
1.00
1.00
0.03
ром в мостиковой части. Полученные соединения
существуют в виде открытой формы А и обладают
2б
0.47
0.55
0.96
1.00
1.00
1.00
0.04
в растворах малоинтенсивной флуоресценцией в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ, ФОТО- И ИОНОХРОМНЫЕ СВОЙСТВА ИНДОЛИЛ(ТИЕНИЛ)МАЛЕИМИДОВ
381
спектральном диапазоне 575-602 нм. Облучение их
растворов в толуоле УФ светом приводит к
образованию циклических изомеров Б. Обратная
реакция раскрытия цикла происходит при
облучении видимым светом. Терпиридин-4'-
фенильные производные в отличие от терпиридин-
4'-бензильных проявляют naked-eye ионохромные
свойства по отношению к ионам железа(II)
(изменение окраски раствора с ярко-оранжевой на
красную).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР
1Н и
13С получены на
спектрометре Bruker DPX-250 (250 и 62.9 MГц
с2a/(с2a + сFe2+)
соответственно) в CDCl3 или в ДМСО-d6.
Рис. 3. График Джоба на длине волны поглощения 569 нм
Колебательные спектры записаны на приборе
соединения
2a и Fe2+ в ацетонитриле. Суммарная
концентрация [2a]+[Fe2+] = 4.0×10-4 моль/л.
Varian Excalibur 3100 FT-IR методом нарушенного
полного внутреннего отражения с использованием
кристалла ZnSe. Масс-спектры записаны на
производили при помощи ртутной лампы ДРШ-250
газовом хромато-масс-спектрометре Shimadzu
(250 Вт) с набором интерференционных свето-
GCMS-QP2010SE с прямым вводом образца,
фильтров для выделения линий ртутного спектра в
ионизация электронным ударом
(70
эВ).
кварцевой кювете (l
=
1 см). Температуры
Электронные спектры поглощения
сняты на
плавления определены в стеклянных капиллярах на
спектрофотометре Varian Cary
100. Спектры
приборе ПТП (М).
люминесценции измерены на спектрофлуориметре
Фуран-2,5-дионы
1a-в получали по ранее
Varian Cary Eclipse. Для приготовления растворов
разработанным нами методикам [23, 24].
использованы толуол и ацетонитрил спектральной
чистоты, перхлораты d-металлов и тетрабутил-
Общая методика синтеза малеимидов 2a, б и
аммониевые соли (Aldrich). Облучение растворов
3a-в. К раствору 0.35 ммоль соответствующего
Схема 3.
N
O
N
N
2
N
O
2a, б
O
N
N
O
Fe(ClO4)
2
N
Fe
N
N
O
N
N
O
(ClO4)2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
382
ШЕПЕЛЕНКО и др.
фуран-2,5-диона 1a-в в 8 мл n-BuOH добавляли
109.70, 112.12, 118.89, 118.89, 121.39, 121.39, 123.86,
0.35 ммоль 4-([2,2':6',2''-терпиридин]-4'-ил)анилина
123.86, 126.06, 126.56, 127.69, 127.69, 129.48, 129.48,
или 0.35 ммоль {4-([2,2':6',2''-терпиридин]-4'-ил)-
129.87, 132.14, 133.37, 133.41, 136.56, 136.88, 136.88,
фенил}метанамина и
1 мг
4-диметиламино-
137.80, 138.04, 139.12, 139.51, 149.19, 149.19, 149.89,
пиридина (DMAP). Реакционную смесь кипятили в
154.54, 156.01, 156.27, 171.02, 171.38. Масс-спектр,
течение
8 ч, затем охлаждали. Растворитель
m/z: 701 [M]+. Найдено, %: C 73.62; H 4.99; N 9.96.
отгоняли при пониженном давлении. Остаток
C43H35N5O3S. Вычислено, %: C 73.59; H 5.03; N
хроматографировали на силикагеле (элюент
-
9.98.
CHCl3-iPrOH, 5:1), затем перекристаллизовывали
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)бензил}-3-
из n-BuOH.
(1-бензил-5-метокси-2-метил-1H-индол-3-ил)-4-
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)фенил}-3-
(тиофен-3-ил)-1H-пиррол-2,5-дион
(3б). Выход
(2,5-диметилтиофен-3-ил)-4-(5-метокси-1,2-ди-
0.096 г (37%), оранжевый порошок, т. пл. 126-127°С
метил-1H-индол-3-ил)-1H-пиррол-2,5-дион
(2a).
(n-BuOH). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.27 с
Выход 0. 074 г (31%), оранжевый порошок, т. пл.
(3Н, Me), 3.54 с (3Н, OMe), 4.89 с (2Н, СН2), 5.32 с
135-136°С (n-BuOH). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
(2Н, СН2), 6.46-6.47 д (1H, ArH, J = 6.5 Гц), 6.72-
1.70 с (3Н, Me), 2.36 с (6Н, 2Me), 2.61 с (3Н, Me),
6.75 м (2H, ArH), 7.00-7.03 м (2H, ArH), 7.09-7.19
3.73 с (3Н, OMe), 6.41-6.42 д (1H, ArH, J = 6.4 Гц),
м (5H, ArH), 7.58-7.61 м (2H, ArH), 7.81-7.88 м
6.75-6.80 м (1H, ArH), 6.93 м (1H, ArH), 7.11-7.15
(5H, ArH), 8.01-8.04 м (1Н, ArH), 8.07-8.08 м (1Н,
м (1H, ArH), 7.32-7.37 м (2H, ArH), 7.68-7.72 м
ArH), 8.62-8.71 м (6Н, ArH). Масс-спектр, m/z: 749
(2H, ArH), 7.83-7.90 м (2H, ArH), 8.02-8.05 м (2Н,
[M]+. Найдено, %: C
75.17; H
4.79; N
9.35.
ArH), м 8.65-8.76 (6Н, ArH). Масс-спектр, m/z: 687
C47H35N5O3S. Вычислено, %: C 75.28; H 4.70; N
[M]+. Найдено, %: C 73.27; H
4.88; N
10.22.
9.34
C42H33N5O3S. Вычислено, %: C 73.34; H 4.84; N
10.18.
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)бензил}-3-
(1-бензил-5-метокси-2-метил-1H-индол-3-ил)-4-
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)фенил}-3-
(2,5-диметилтиофен-3-ил)-1H-пиррол-2,5-дион
(1-бензил-5-метокси-2-метил-1H-индол-3-ил)-4-
(3в). Выход 0.087 г (32%), оранжевый порошок,
(тиофен-3-ил)-1H-пиррол-2,5-дион
(2б). Выход
т. пл.
119-120°С (n-BuOH). Спектр ЯМР
1Н
0.090 г (35%), оранжевый порошок, т. пл. 156-157°С
(ДМСО-d6), δ, м. д.: 1.70 с (3Н, Me), 2.36 с (3Н,
(n-BuOH). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.31 c
Me), 2.61 с (3Н, Me), 3.73 с (3Н, OMe), 3.89 с (2Н,
(3Н, Me), 3.56 c (3Н, OMe), 3.35 c (2Н, СН2), 6.40-
СН2), 4.85 с (2Н, CH2), 6.41-6.42 м (1H, ArH), 6.86-
6.41 д (1H, ArH, J = 6.5 Гц), 6.75-6.80 м (1H, ArH),
6.87 м (1H, ArH), 6.95-7.01 м (2H, ArH), 7.22-7.38
6.99-7.06 м (2H, ArH), 7.12-7.21 м (3H, ArH), 7.27-
м (6H, ArH), 7.50-7.60 м (5H, ArH), 7.93-7.97 м
7.35 м (5H, ArH), 7.63-7.71 м (2H, ArH), 7.82-7.90
(1Н, ArH), 8.00-8.07 м (1Н, ArH), 8.66-8.80 м (6Н,
м (3H, ArH), 8.02-8.05 м (1Н, ArH), 8.09-8.14 м
ArH). Масс-спектр, m/z: 777 [M]+. Найдено, %: C
(1Н, ArH), 8.63-8.76 м (6Н, ArH). Масс-спектр, m/z:
75.62; H 4.99; N 9.09. C49H39N5O3S. Вычислено, %:
735 [M]+. Найдено, %: C 75.01; H 4.49; N 9.55.
C 75.65; H 5.05; N 9.00.
C46H33N5O3S. Вычислено, %: C 75.08; H 4.52; N
9.52.
ФОНДОВАЯ ПОДДЕРЖКА
1-{4-([2,2':6',2''-Терпиридин]-4'-ил)бензил}-3-
(2,5-диметилтиофен-3-ил)-4-(5-метокси-1,2-ди-
Работа выполнена в рамках базовой части
метил-1H-индол-3-ил)-1H-пиррол-2,5-дион
(3a).
государственного задания Министерства образования
Выход 0.095 г (39%), оранжевый порошок, т. пл.
и науки РФ в сфере научной деятельности (проект
148-150°С (n-BuOH). Спектр ЯМР 1Н (CDCl3), δ,
№ 4.6497.2017/8.9, задание № 4.5593.2017/6.7) и
м. д.: 1.64 c (3Н, Me), 2.34 с (3Н, Me), 2.37 с (3Н,
государственного задания Южного научного
Me), 3.54 с (3Н, Me), 3.66 с (3Н, OMe), 4.87 с (2Н,
центра РАН (№ 01201354239).
CH2), 6.33-6.87 м (3H, ArH), 7.08-7.11 м (1H, ArH),
7.30-7.35 м (2H, ArH), 7.59-7.62 м (2H, ArH), 7.85-
КОНФЛИКТ ИНТЕРЕСОВ
7.88 м (4H, ArH), 8.63-8.76 м (6Н, ArH). Спектр
Авторы заявляют об отсутствии конфликта
ЯМР 13C (CDCl3), δC, м. д.: 12.88, 15.04, 15.14,
интересов.
29.75, 30.11, 41.70, 55.33, 101.49, 103.27, 103.28,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ, ФОТО- И ИОНОХРОМНЫЕ СВОЙСТВА ИНДОЛИЛ(ТИЕНИЛ)МАЛЕИМИДОВ
383
СПИСОК ЛИТЕРАТУРЫ
Compd. 2016. Vol. 52. N 9. P. 658. doi 10.1007/s10593-
016-1946-z
1. Photon-Working Switches
/ Eds. Y. Yokoyama,
19. Harvey E.C., Feringa B.L., Vos J.G., Browne W.R.,
K. Nakatani. Tokyo: Springer,
2017.
464 p. doi
Pryce M.T. // Coord. Chem. Rev. 2015. Vol. 282-283.
10.1007/978-4-431-56544-4
P. 77. doi 0.1016/j.ccr.2014.06.008
2. Molecular Switches / Eds B.L. Feringa, W.R. Browne.
20. Zou Q., Jin J., Xu B., Ding Li., Tian H. // Tetrahedron.
Weinheim: Wiley, 2011. 824 p.
2011. Vol. 67. P. 915. doi 10.1016/j.tet.2010.12.019
3. Минкин В.И. // Изв. АН. Сер. хим. 2008. № 4. C. 673;
21. Shepelenko E.N., Karamov О.G., Podshibyakin V.A.,
Minkin V.I. // Russ. Chem. Bull. 2008. Vol. 57. N 4.
Revinskii Yu.V., Tikhomirova K.S., Dubonosov A.D.,
P. 687. doi 10.1007/s11172-008-0111-y
Bren V.A., Minkin V.I. // Arkivoc. 2017. N 5. P. 196. doi
4. Andreasson J., Pischel U. // Chem. Soc. Rev. 2015.
10.24820/ark.5550190.p010.262
Vol. 44. N 5. P. 1053. doi 10.1039/c4cs00342j
22. Dubonosov A.D., Bren V.A., Minkin V.I., Shepelenko E.N.,
5. Bazzicalupi C., Bianchi A., Garcia-Espana E., Delgado-
Tikhomirova K.S., Starikov A.G., Revinskii Yu.V. //
Pinar E. // Inorg. Chim. Acta. 2014. Vol. 417. P. 3. doi
Tetrahedron.
2015. Vol.
71. N.
46. P.
8817. doi
10.1016/j.ica.2014.03.001
10.1016/j.tet.2015.09.030
6. Velema W.A., Szymanski W., Feringa B. L. // J. Am.
23. Макарова Н.И., Левченко П.В., Ткачев В.В., Шепе-
Chem. Soc. 2014. Vol. 136. N 6. P. 2178. doi 10.1021/
ленко Е.Н., Метелица А.В., Рыбалкин В.П., Попо-
ja413063e
ва Л.Л., Брень В.А., Алдошин С.М., Минкин В.И. //
Изв. АН. Сер. хим. 2011. № 6. С. 1065; Makarova N.I.,
7. Zhang J., Zou Q., Tian H. // Adv. Mater. 2013. Vol. 25.
Levchenko P.V., Tkachev V.V., Shepelenko E.N.,
N 3. P. 378. doi 10.1002/adma.201201521
Metelitsa A.V., Rybalkin V.P., Popova L.L., Bren V.A.,
8. Natali M., Giordani S. // Chem. Soc. Rev. 2012. Vol. 41.
Aldoshin S.M., Minkin V.I. // Russ. Chem. Bull. 2011.
N 10. P. 4010. doi 10.1039/C2CS35015G
Vol. 60. N 6. P. 1090. doi 10.1007/s11172-011-0172-1
9. Wang G., Zhang J. // J. Photochem. Photobiol. 2012.
24. Макарова Н.И., Левченко П.В., Шепеленко Е.Н.,
Vol.
13.
N
4.
P.
299.
doi
10.1016/
Метелица А.В., Козырев В.С., Рыбалкин В.П.,
j.jphotochemrev.2012.06.002
Брень В.А., Минкин В.И. // Изв. АН. Сер. хим. 2011.
10. Klajn R. // Chem. Soc. Rev. 2014. Vol. 43. P. 148. doi
№ 9. С. 1866; Makarova N.I., Levchenko P.V.,
10.1039/C3CS60181A.
Shepelenko E.N., Metelitsa A.V., Kozyrev V.S., Rybal-
11. Photochromism: Molecules and Systems / Eds H. Dürr,
kin V.P., Bren V.A., Minkin V.I. // Russ. Chem. Bull.
H. Bouas-Laurent. Amsterdam: Elsevier, 2003. P. 314.
2011. Vol. 60. N 9. P. 1899. doi 10.1007/s11172-011-
12. Yokoyama Y. // Chem. Rev. 2000. Vol. 100. N 5.
0286-5
P. 1717. doi 10.1021/cr980070c
25. Тихомирова К.С., Подшибякин В.А., Шепеленко Е.Н.,
13. Organic Photochemistry and Photobiology / Eds A.
Ревинский Ю.В., Дубоносов А.Д., Брень В.А. // ХГС.
Griesbeck, M. Oelgemöller, F. Ghetti. Boca Raton;
2018. Т.
54.
№ 1. С.
32; Tikhomirova K.S.,
London; New York: CRC Press, 2012. P. 607.
Podshibyakin V.A., Shepelenko E.N., Revinskii Yu.V.,
Dubonosov A.D., Bren V.A.
// Chem. Heterocycl.
14. Mukhopadhyay A., Moorthy J.N.
// J. Photochem.
Photobiol. (C). 2016. Vol. 29. P. 73. doi 10.1016/
Compd. 2018. Vol. 54. N 1. P. 32. doi 10.1007/s10593-
j.jphotochemrev.2016.11.002
018-2226-x
15. Zhao X.Y., Wang M.Z. // Eur. Polymer J. 2006. Vol. 42.
26. Liu Z., He W., Guo Z. // Chem. Soc. Rev. 2013. Vol. 42.
N 2. P. 247. doi 10.1016/j.eurpolymj.2005.08.007
N 4. P. 1568. doi 10.1039/C2CS35363F
16. Irie M. // Chem. Rev. 2000. Vol. 100. N 5. P. 1685. doi
27. Kaur N., Kumar S. // Tetrahedron. 2011. Vol. 67. N 48.
10.1021/cr980069d
P. 9233. doi 10.1016/j.tet.2011.09.003
17. Irie M., Fukaminato T., Matsuda K., Kobatake S. //
28. Mukherjee S., Pal P., Bar M., Baitalik S. // J. Chem. Sci.
Chem. Rev. 2014. Vol. 114. N 24. P. 12174. doi
2018. Vol. 130. P. 84. doi 10.1007/s12039-018-1484-6
10.1021/cr500249p
29. Liang Z., Wang C., Yang J., Gao H., Tian Y., Tao X.,
18. Львов А.Г., Ширинян В.З. // ХГС. 2016. Т. 52. № 9.
Jiang M. // New J. Chem. 2007. Vol. 31. P. 906. doi
С. 658; Lvov A.G., Shirinyan V.Z. // Chem. Heterocycl.
10.1039/B701201M
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
384
ШЕПЕЛЕНКО и др.
Synthesis, Photo-, and Ionochromic Properties
of Indolyl(thienyl)maleimides with a Terpyridine Receptor
E. N. Shepelenkoa, V. A. Podshibyakinb, K. S. Tikhomirovab,
A. D. Dubonosova*, V. A. Brenb, and V. I. Minkina,b
a Federal Research Centre the Southern Scientific Centre of the Russian Academy of Sciences,
pr. Stachki 194/2, Rostov-on-Don, 344090 Russia
*e-mail: aled@ipoc.sfedu.ru
Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, Russia
Received September 27, 2018; revised September 27, 2018; accepted October 3, 2018
Indolyl(thienyl)maleimides with the terpyridine receptor were synthesized. Irradiation of their solutions in
toluene with light at λ = 436 nm leads to the formation of cyclic isomers. The reverse ring opening reaction
occurs during photolysis with visible light (λ > 500 nm). 1-{4-([2,2':6',2''-Terpyridin]-4'-yl)phenyl} derivatives
in acetonitrile solutions have the properties of chromogenic naked-eye sensors for Fe2+ cations.
Keywords: indole, thiophene, maleimides, terpyridine, photochromic properties, ionochromic properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019