ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 394-399
УДК 543.645.2;543.429.2;547.458.68
СУПРАМОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ
3-ЭПИ-2-ДЕЗОКСИЭКДИЗОНА
С ЦИКЛОДЕКСТРИНАМИ И ИХ
ПРОТИВОВОСПАЛИТЕЛЬНАЯ АКТИВНОСТЬ
© 2019 г. Б. С. Темиргазиевa,b, *, Б. И. Тулеуовa, М. А. Романоваa, Р. Б. Сейдахметоваa,
Т. М. Сейлхановc, О. Т. Сейлхановc, Л. К. Салькееваb, С. М. Адекеновa
a Международный научно-производственный холдинг «Фитохимия»,
ул. Газалиева 4, Караганда, 100009 Казахстан
*e-mail: b_a_h_a1990@mail.ru
b Карагандинский государственный университет имени Е. А. Букетова, Караганда, Казахстан
c Кокшетауский государственный университет имени Ш. Уалиханова, Кокшетау, Казахстан
Поступило в Редакцию 11 октября 2018 г.
После доработки 11 октября 2018 г.
Принято к печати 15 октября 2018 г.
Из надземной части колючелистника качимовидного (Acanthophyllum gypsophiloides Regel) выделен
экдистероид 3-эпи-2-дезоксиэкдизон. Методом спектроскопии ЯМР изучено комплексообразование
экдистероида с α-, β-, γ- и 2-гидроксипропил-β-циклодекстринами. Исследована противовоспалительная
активность полученных комплексов 3-эпи-2-дезоксиэкдизона с циклодекстринами.
Ключевые слова: 3-эпи-2-дезоксиэкдизон, циклодекстрины, супрамолекулярные комплексы, комплексы
включения
DOI: 10.1134/S0044460X19030090
Фитоэкдистероиды обладают анаболической,
обусловлен их циклической структурой и способ-
тонизирующей, адаптогенной, иммуностимулиру-
ностью за счет внутренней гидрофобной полости
ющей и гипогликемической активностью. Одной
образовывать супрамолекулярные комплексы
из причин недостаточного применения фито-
включения типа хозяин-гость (рецептор-субстрат)
экдистероидов в фармацевтике является их низкая
в водной среде [5-7].
растворимость в воде. Известно, что одним из
3-Эпи-2-дезоксиэкдизон 1 [3α,14α,22R,25-тетра-
эффективных способов повышения растворимости
гидрокси-5β(Н)-холест-7-ен-6-он, схема 1], выде-
в воде фармацевтических препаратов является
ленный ранее
[8] и достаточно подробно
супрамолекулярное комплексообразование последних
идентифицированный методами масс-спектромет-
с циклодекстринами [1]. Супрамолекулярная само-
сборка комплексов фитостероидов с циклодекстри-
Схема 1.
нами позволяет увеличить растворимость суб-
станции в воде, улучшить их биодоступность и
OH
21
физико-химическую стабильность, защитить от
22
24
18
20
биодеградации и снизить токсичность
[2-4].
25
23
28
12
H
Циклодекстрины являются сравнительно доступ-
17
19
11
13
16
OH
27
ными соединениями, производятся из возобновля-
14 15
8
1
9
емого сырья - крахмала. Наиболее распространен-
2
10
OH
3
5
ными являются α-, β-, γ-циклодекстрины, содер-
4
67
HO
жащие соответственно 6, 7 и 8 глюкопиранозных
H
звеньев. Повышенный интерес к циклодекстринам
O
1
394
СУПРАМОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ
395
Схема 2.
H3C
21
OH
11 12
H3C
2
1
19
CH3
18
20 22
23
10
13
26
3
24
9
14
25
H3C
21
H
CH3
HO
4
15
16
30
OH
6
HO
H3C OH
11 12H3
27
CH3
C
H
2
1
19
18
20 22
23
5
O
10
13
26
3
24
9
14
25
4
H
CH3
HO
15
16
30
6
HO
H327 OH
H
5
O
2
рии и спектроскопии ЯМР [9], был выбран нами
экдизоном 1, полученные в D2O, представлены в
для изучения в качестве субстрата супрамолекуляр-ной
табл. 1 и 2.
самосборки комплексов с α-, β-, γ- и 2-гидрокси-
Исследование супрамолекулярных комплексов
пропил-β-циклодекстринами и для последующего
α-циклодекстрина с экдизоном 1 показало, что в
биоскрининга их противовоспалительной
спектрах ЯМР практически отсутствуют сигналы
активности.
стероидной молекулы. Это свидетельствует об
Супрамолекулярные комплексы получены
отсутствии количественного взаимодействия
взаимодействием эквимолярных количеств
между α-циклодекстрином и экдизоном
1.
экдизона 1 и α-, β-, γ- и 2-гидроксипропил-β-
Вероятно, незначительные размеры гидрофобной
циклодекстринов в водно-этанольном растворе при
полости α-циклодекстрина в сравнении с другими
50°С в течение
5 ч. Исследование строения
аналогами, не позволили образоваться супрамоле-
супрамолекулярных комплексов методом
кулярному комплексу.
спектроскопии ЯМР 1Н основано на определении
Сопоставление интегральных интенсивностей
разницы в значениях химических сдвигов
1Н
сигналов протонов в спектрах ЯМР 1Н молекулы
субстрата (1) и рецепторов (циклодекстрины) в
экдизона 1 с β-, γ- и 2-гидроксипропил-β-цикло-
свободном состоянии и в составе комплексов в
декстринами в комплексах показало, что экдизон 1
результате межмолекулярного взаимодействия. По
с β-циклодекстрином образует комплексы
2
величине изменения химических сдвигов
состава 1:1, а с γ- и 2-гидроксипропил-β-цикло-
внутренних или внешних протонов циклодек-
декстринами - комплексы 3 и 4 состава 1:2. При
стринов можно выявить образование, соответ-
образовании супрамолекулярного комплекса
2
ственно, внутренних, внешних или смешанных
изменения химических сдвигов протонов
в
комплексов. Изменение химических сдвигов 1Н в
циклодекстриновой молекуле
∆δ1 произошли в
спектрах субстрата позволяет определить
одинаковой мере как для внутренних гидрофобных
направление вхождения последнего в полость
протонов Н3, Н5 и Н6, так и для находящихся на
циклодекстринов [10-12].
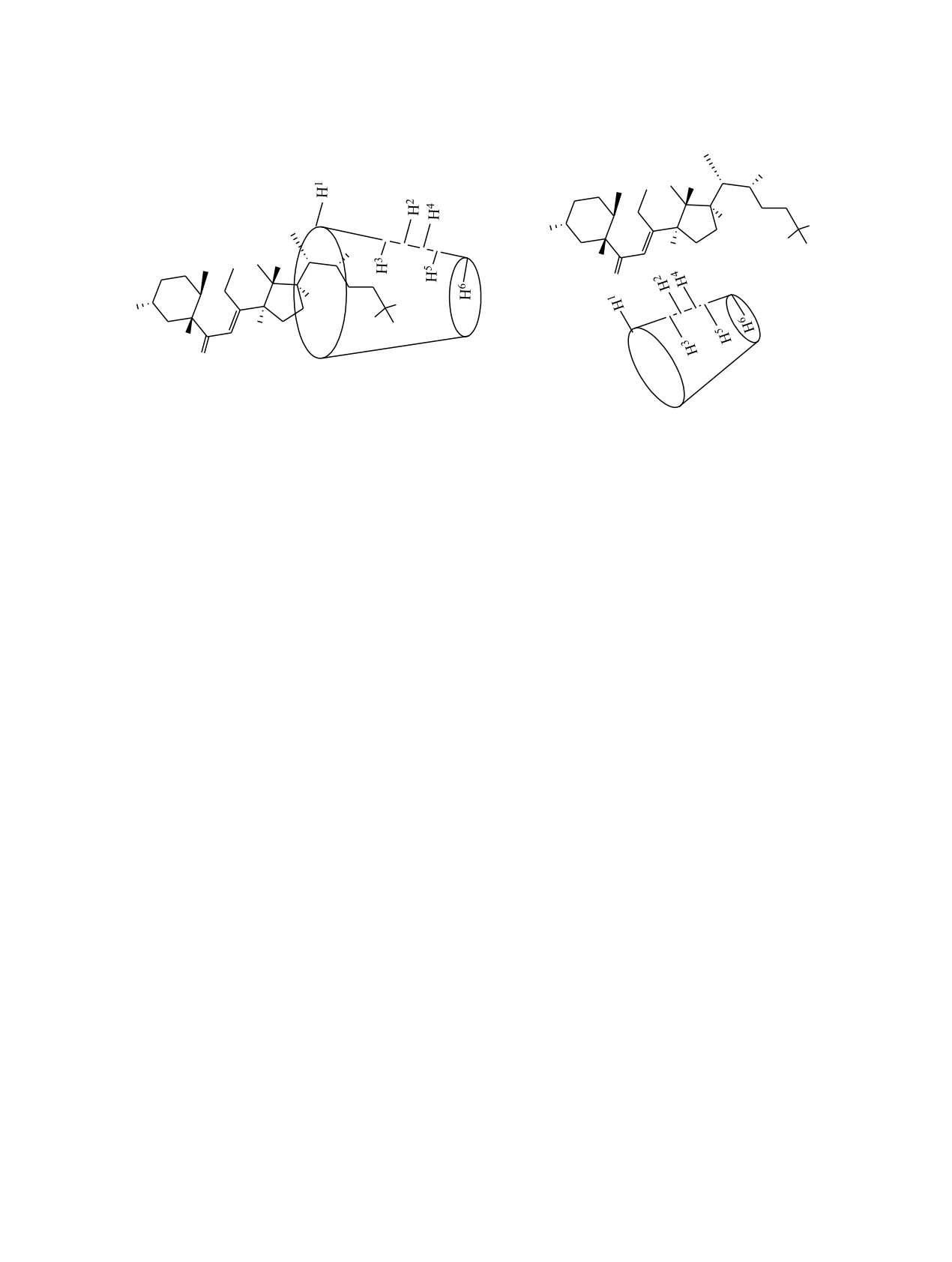
внешней гидрофильной поверхности протонов Н1,
Строение экдизона
1 было установлено на
Н2 и Н4 (нумерация атомов приведена на схеме 2).
основании результатов спектроскопии ЯМР 1Н и
В молекуле экдизона 1 наибольшие изменения в
13С в ДМСО-d6 (табл. 1). Правильность отнесения
спектрах ЯМР наблюдаются для протонов
сигналов одномерных спектров ЯМР 1Н и 13С была
стероидных колец Н7, Н15, Н16 и некольцевых
подтверждена данными двумерных корреляций
метинового Н22 и метильных протонов Н21, Н26 и
1Н-1Н TOCSY, 1Н-1Н ROESY, 1Н-13C HMQC и 1Н-
Н27. Эти результаты свидетельствуют о том, что
13C HMВC. Спектры ЯМР 1Н α-, β-, γ- и 2-
при супрамолекулярной самосборке происходит
гидроксипропил-β-циклодекстринов в свободном
образование как комплексов включения, так и
состоянии и супрамолекулярных комплексов с
комплексов без включения [12, 13]. Образуемые
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
396
ТЕМИРГАЗИЕВ и др.
Таблица 1. Химические сдвиги ядер 1Н и 13С экдизона 1 в свободном состоянии (δ0) и в составе комплексов 2 (δ1), 3
(δ2) и 4 (δ3)
δС, м. д.
δН, м. д.
№ атома
Группа
δ0
δ0
δ1
Δδ1 = δ1 - δ0
δ2
Δδ2 = δ2 - δ0
δ3
Δδ3 = δ3 - δ0
1ax
СН2
29.62
1.41
1.40
-0.01
1.41
0
1eq
1.46
-0.05
1.46
0
1.44
-0.02
1.41
2ax
СН2
28.73
1.54
1.56
0.02
1.48
-0.06
2eq
1.56
1.53
-0.03
1.59
0.03
1.52
-0.04
3
СН
63.22
3.40
3.44
0.04
3.59
0.19
3.37
-0.03
ОН
4.45
4ax
СН2
32.55
1.54
4eq
1.56
1.53
-0.03
1.59
0.03
1.52
-0.04
5
СН
47.65
2.23
2.27
0.04
2.25
0.02
2.30
0.07
6
СО
203.23
-
-
-
-
-
-
-
7
СН
120.76
5.60
5.84
0.24
5.75
0.15
5.83
0.23
8
С
165.91
-
-
-
-
-
-
-
9
СН
36.58
3.01
3.04
0.03
3.02
0.01
3.05
0.04
10
С
36.58
-
-
-
-
-
-
-
10
С
36.58
-
-
-
-
-
-
-
11ax
СН2
20.60
1.46
1.46
0
1.44
-0.02
11eq
1.56
1.53
-0.03
1.59
0.03
1.52
-0.04
12ax
СН2
31.00
1.56
1.53
-0.03
1.59
0.03
1.52
-0.04
12eq
1.95
1.92
-0.03
1.80
-0.15
1.92
-0.03
13
С
47.37
-
-
-
-
-
-
-
14
С
83.39
-
-
-
-
-
-
-
ОН
15ax
СН2
29.62
1.54
1.53
-0.01
1.56
0.02
1.48
-0.06
15eq
1.85
1.76
-0.09
1.79
-0.06
1.84
-0.01
16ax
СН2
21.58
1.56
16eq
1.83
1.76
-0.07
1.79
-0.04
1.81
-0.02
17
СН
47.37
1.95
1.92
-0.03
1.80
-0.15
1.92
-0.03
18
СН3
15.85
0.55
0.63
0.08
0.58
0.03
0.63
0.08
19
СН3
24.36
0.81
0.87
0.06
0.84
0.03
0.83
0.02
20
СН
42.35
1.56
1.53
-0.03
1.59
-0.03
1.52
-0.04
21
СН3
13.42
0.79
0.87
0.08
0.79
0
0.83
0.04
22
СН
72.87
3.34
3.44
0.10
3.57
0.23
3.37
0.03
ОН
4.17
23ax
СН2
24.58
1.18
1.23
-0.05
1.24
0.06
1.16
-0.02
23eq
1.31
1.27
-0.04
1.31
0
1.35
0.04
24ax
СН2
41.79
1.29
1.27
-0.02
1.31
0.02
1.27
-0.02
24eq
1.76
1.75
-0.01
1.76
0
1.76
0
ОН
4.47
25
С
69.33
-
-
-
-
-
-
-
ОН
26
СН3
30.53
1.01
1.09
0.08
1.08
0.07
1.08
0.07
27
СН3
26.27
1.03
1.09
0.06
1.08
0.05
1.08
0.05
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СУПРАМОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ
397
Схема 3.
H3C
21
OH
11 12
H3C
2
1
19
CH3
18
20 22
23
10
13
3
24
26
9
14
25
H3C
21
H
CH3
HO
4
15
16
30
OH
6
HO
H327 OH
11 12
H3C
CH3
H
2
1 19
18
20 22
23
5
13
O
10
26
3
24
25
9
14
H
CH3
HO
5
15
16
30
4
6
HO
H327 OH
H
5
O
3
4
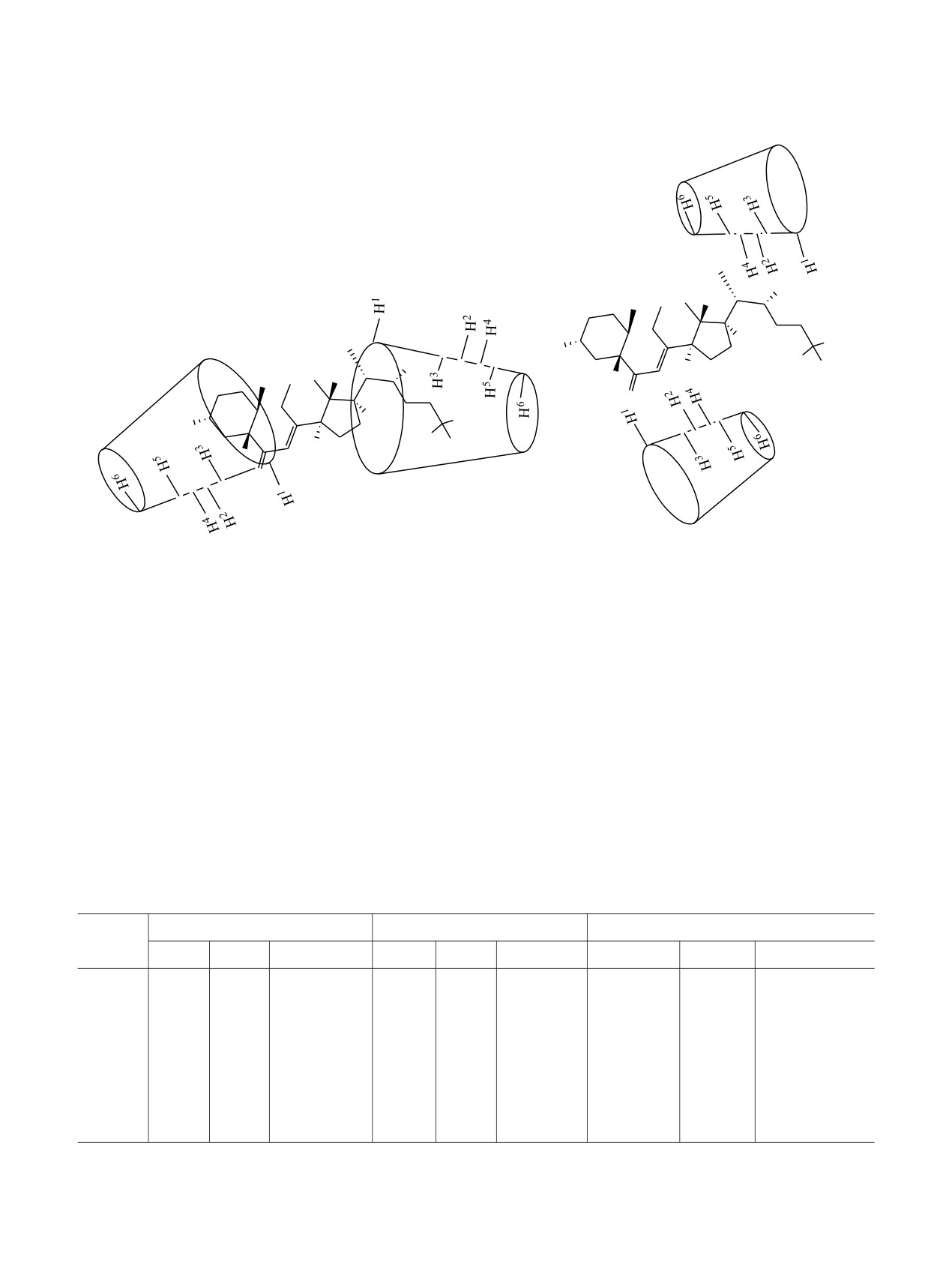
при этом водорастворимые агрегаты способны
данном комплексе на
1 молекулу стероида
солюбилизировать липофильные молекулы субстратов
приходится 2 молекулы γ-циклодекстрина, причем
через неинклюзивное комплексообразование [14].
в молекуле субстрата 1 наибольшие изменения
химических сдвигов наблюдаются для кольцевых и
В спектрах ЯМР 1Н супрамолекул комплекса 3
некольцевых протонов, наиболее вероятно
наибольшее изменение химических сдвигов при
образование комплекса включения 4 с вхождением
образовании комплексов происходит у гидрофоб-
стероидной молекулы разными концами в
ного внутриполостного протона Н3 цикло-декст-
циклодекстриновые полости. Изменения хими-
рина (нумерация атомов приведена на схеме
3).
ческих сдвигов внешних протонов γ-цикло-
Изменения в химических сдвигах наблюдаются для
декстрина возможны при взаимодействии с гид-
протонов как внешней, так и внутренней сферы γ-
роксигруппами и протонами экдизона
1,
циклодекстрина. В стероидной молекуле наи-
находящимися вне циклодекстриновой полости.
большие химические сдвиги протонов отмечены
для циклических стероидных протонов Н3, Н12 и
При использовании в качестве компонента
Н17, а также некольцевого протона Н22. Так как в
супрамолекулярной самосборки 2-гидроксипропил-
Таблица 2. Химические сдвиги ядер 1Н β-, γ- и 2-гидроксипропил-β-циклодекстринов в свободном состоянии (δ0) и в
составе комплексов 2 (δ1), 3 (δ2) и 4 (δ3)
β-Циклодекстрин
γ-Циклодекстрин
2-Гидроксипропил-β- циклодекстрин
№ атома
δ0, м. д.
δ1, м. д.
Δδ1 = δ1 - δ0
δ0, м. д.
δ2, м. д.
Δδ2 = δ2 - δ0
δ0, м. д.
δ3, м. д.
Δδ3 = δ3 - δ0
1
4.87
4.92
0.05
4.96
4.92
-0.04
4.92
4.92
0.00
2
3.45
3.49
0.04
3.51
3.51
0.00
3.48
3.48
0.00
3
3.77
3.81
0.04
3.78
3.70
-0.08
3.87
3.86
-0.01
4
3.39
3.44
0.05
3.44
3.43
-0.01
3.44
3.44
0.00
5
3.68
3.72
0.04
3.72
3.68
-0.04
3.72
3.72
0.00
6
3.68
3.72
0.04
3.72
3.68
-0.04
3.72
3.72
0.00
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
398
ТЕМИРГАЗИЕВ и др.
β-циклодекстрина, более гидрофилизированного по
Комплекс 2. Т. пл. 293-296°С (этилацетат-
сравнению с другими циклодекстринами из-за
метанол). ИК спектр (KВr), ν, см-1: 1030, 1165, 1647
наличия дополнительных
2-гидроксипропильных
(C=O), 2357, 2932, 3445 (OH).
фрагментов, в образованном супрамолекулярном
Комплекс
3. Т. пл. 314-317°С (этилацетат-
комплексе
4 практически не наблюдаются
метанол). ИК спектр (KВr), ν, см-1: 578, 1030, 1157,
изменения как для внутренних, так и для внешних
1377, 1655 (C=O), 2928, 3414 (OH).
протонов 2-гидроксипропил-β-циклодекстрина. В
молекуле экдизона
1 наибольшие изменения в
Комплекс 4. Т. пл. 350°С (разл.) (этилацетат-
химических сдвигах наблюдаются для протонов
метанол). ИК спектр (KВr), ν, см-1: 1022, 1061,
Н7, Н18 и Н26. В этом случае, вероятно, супра-
1377, 1651 (C=O), 2365, 2943, 3433 (OH).
молекулярная самосборка приводит к образованию
Исследование противовоспалительной актив-
комплексов без включения 4 за счет межмоле-
ности проводили по методике [15]. Исследуемые
кулярного взаимодействия гидроксильных групп
объекты изучали в дозе 25 мг/кг при пероральном
как со стороны стероидной молекулы, так и
введении в виде крахмальной слизи. Препарат
2-гидроксипропил-β-циклодекстрина.
сравнения Диклофенак натрия изучали в дозе
25 мг/кг. Статистическую обработку результатов
Все полученные комплексы
2-4 имели
проводили с использованием пакета программ
достаточную растворимость в воде.
Statistica 6.0. Межгрупповые отличия оценивали
непараметрическим U-критерием Манна-Уитни.
Результаты скринингового исследования противо-
Достоверными считались различия при достиг-
воспалительной активности комплексов
2-4
нутом уровне значимости p < 0.05.
показали, что комплекс 2 в дозе 25 мг/кг обладает
выраженной противовоспалительной активностью
Работа выполнена с соблюдением всех приме-
на модели острой экссудативной реакции и
нимых международных, национальных и
превышает по активности препарат сравнения
институциональных руководящих принципов по
Диклофенак натрия в 1.6 раза, тогда как комплекс
уходу и использованию животных.
3 показал слабую активность, а комплекс 4 и вовсе
не проявил противовоспалительную активность.
ФОНДОВАЯ ПОДДЕРЖКА
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Работа выполнена при финансовой поддержке
Комитета науки Министерства образования и науки
Спектры ЯМР 1Н и 13С записаны на спектро-
Республики Казахстан (проект № АР05133718).
метре Jeol JNM-ECA 400 (399.78 и 100.53 МГц
соответственно) в растворе ДМСО-d6 для экдизона
КОНФЛИКТ ИНТЕРЕСОВ
1 и в D2O для комплексов включения 2-4 при
комнатной температуре.
Авторы заявляют об отсутствии конфликта
интересов.
β-, γ- и
2-гидроксипропил-β-циклодекстрины
использовали производства компании «Fluka» с
СПИСОК ЛИТЕРАТУРЫ
чистотой 99%.
1. Dodziuk H. Cyclodextrins and their complexes:
Получение супрамолекулярных комплексов
chemistry, analytical methods, applications. Weinheim:
2-4. К 0.05 г (0.11 ммоль) экдизона 1, раство-
Wiley-VCH, 2006. 504 р.
ренного в 3 мл абсолютного этанола, добавляли
2. Rinaldi L., Binello A., Stolle A., Curini M., Cravotto G. //
0.124 г (0.11 ммоль) β-циклодекстринна [в случае
Steroids.
2015. Vol.
98. P.
58. doi
10.1016/
γ- или
2-гидроксипропил-β-циклодекстринов
j.steroids.2015.02.016
добавляли
0.142 г
(0.11 ммоль) или
0.182 г
3. Forgo P., Vincze I., Kover K.E. // Steroids.
2003.
(0.11 ммоль) вещества соответственно, растворен-
Vol. 68. P. 321. doi 10.1016/S0039-128X(03)00041-2
ного в
4 мл дистиллированной воды]. Смесь
4. Jover A., Budal R.M., Al-Soufi W., Meijide F., Tato J.V.,
перемешивали при 50°С в течение 8 ч. Осадок
Yunes R.A. // Steroids. 2003. Vol. 68. P. 55. doi
отфильтровывали, промывали этанолом и сушили
10.1016/S0039-128X(02)00115-0
в вакуумном шкафу при 40°С. Комплексы пред-
5. Yanga R., Chena J.-B., Dai X.-Y., Huang R., Xiao C.-F.,
ставляли собой белые порошкообразные вещества.
Gao Zh.-Y., Yang B., Yang L.-J., Yan S.-J., Zhang H.-B.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СУПРАМОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ
399
Qing Ch., Lin J. // Carbohydr. Polym. 2012. Vol. 89.
10. Nowakowski M., Ejchart A.
// J. Incl. Phenom.
N 1. P. 89. doi 10.1016/j.carbpol.2012.02.054
Macrocycl. Chem. 2014. Vol. 79. N 3. P. 337. doi
6. Yuan Ch., Jin Zh., Xu X. // Carbohydr. Polym. 2012.
10.1007/s10847-013-0356-4
Vol. 89. N 2. P. 492. doi 10.1016/j.carbpol.2012.03.033
11. Maheshwari A., Sharma M., Sharma D. // J. Incl.
7. Dandawate P.R., Vyas A., Ahmad A., Banerjee S.,
Phenom. Macrocycl. Chem. 2013. Vol. 77. N 1-4.
Deshpande J., Swamy K.V., Jamadar A., Dumhe-Klaire A.K.,
P. 337. doi 10.1007/s10847-012-0251-4
Padhye S., Sarkar F.H. // Pharm. Res. 2012. Vol. 29.
12. Hazra S., Hossain M., Kumar G.S. // J. Incl. Phenom.
N 7. P. 1775. doi 10.1007/s11095-012-0700-1
Macrocycl. Chem. 2014. Vol. 78. N 1-4. P. 311. doi
8. Саатов З., Горовиц М.Б., Мелибаев С., Абубакиров Н.К. //
10.1007/s10847-013-0301-6
ХПС. 1986. Т. 22. № 1. С. 77; Saatov Z., Gorovits M.B.,
13. Demarco P.V., Thakkar A.I. // J. Chem. Soc. Chem.
Melibaev S., Abubakirov N.K. // Chem. Nat. Compd.
Commun. 1970. N 1. P. 2. doi 10.1039/C29700000002
1986. Vol. 22. N 1. P. 71. doi 10.1007/BF00574584
14. Loftsson T., Masson M., Brewster M.E. // J. Pharm. Sci.
9. Тулеуов Б.И., Заварзин И.В., Шашков А.С.,
2004. Vol. 93. N 5. P. 1091. doi 10.1002/jps.20047
Чернобурова Е.И., Адекенов С.М. // Изв. АН. Сер.
хим. 2018. №4. С. 663; Tuleuov B.I., Zavarzin I.V.,
15. Руководство по экспериментальному (доклини-
Shashkov A.S., Chernoburov E.I., Adekenov S. M. //
ческому) изучению новых фармакологических
Russ. Chem. Bull. 2018. Vol. 67. N 4. P. 663. doi
веществ / Под ред. Р.У. Хамриева. М.: Медицина,
10.1007/s11172-018-2120-9
2005. 832 с.
Supramolecular Complexes of 3-Epi-2-deoxyecdysone
with Cyclodextrins and Their Anti-Inflammatory Activity
B. S. Temirgazieva,b*, B. I. Tuleuova, M. A. Romanovaa, R. B. Seidakhmetovaa,
T. M. Seilkhanovc, O. T. Seilkhanovc, L. K. Salkeevab, and S. M. Adekenova
a International Scientific and Production Holding “Phytochemistry”, ul. Gazalieva 4, Karaganda, 100009 Kazakhstan
*e-mail: b_a_h_a1990@mail.ru
b E. A. Buketov Karaganda State University, Karaganda, Kazakhstan
c Sh. Ualikhanov Kokshetau State University, Kokshetau, Kazakhstan
Received October 11, 2018; revised October 11, 2018; accepted October 15, 2018
The ecdysteroid 3-epi-2-deoxyecdysone was isolated from the aerial part of Acanthophyllum gypsophiloides
Regel. Complexation ability of ecdysteroid with α-, β-, γ- and 2-hydroxypropyl-β-cyclodextrins was studied by
NMR spectroscopy. Anti-inflammatory activity of the obtained complexes of 3-epi-2-deoxyecdysone with
cyclodextrins was investigated.
Keywords: 3-epi-2-deoxyecdysone, cyclodextrins, supramolecular complexes, inclusion complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019