ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 412-418
УДК 547.89:547.565
СИНТЕЗ И ИССЛЕДОВАНИЕ МЕДНЫХ КОМПЛЕКСОВ
НЕКОТОРЫХ АЗОМЕТИНОВЫХ ПРОИЗВОДНЫХ
МОНОБЕНЗОКРАУН-ЭФИРОВ
© 2019 г. Н. Ю. Садовская, В. Н. Глушко*, М. А. Барышникова, Д. А. Афанасьева,
М. Ю. Жила, С. К. Белусь
Институт химических реактивов и особо чистых химических веществ
Национального исследовательского центра «Курчатовский институт», Богородский вал 3, Москва, 107076 Россия
*e-mail: tetrazoli@yandex.ru
Поступило в Редакцию 11 октября 2018 г.
После доработки 23 октября 2018 г.
Принято к печати 25 октября 2018 г.
Синтезирован ряд новых азометиновых производных бензо-18-краун-6, бензо-15-краун-5 и анилина, а
также их комплексы с ацетатом меди(II). С помощью МТТ-теста определена противоопухолевая
активность полученных соединений. Проведена оценка влияния отдельных структурных элементов на
противоопухолевую активность соединений в целом.
Ключевые слова: краун-эфиры, медные комплексы, основания Шиффа, пиридинкарбоксальдегид,
противоопухолевая активность, МТТ-тест
DOI: 10.1134/S0044460X19030120
Краун-эфиры
- это макрогетероциклические
аминобензокраун-эфиры и их комплексы, которые
соединения, которые занимают одно из централь-
благодаря наличию высокочувствительной селек-
ных мест в различных областях науки и техники.
тивной сенсорной способности на катионы
Интерес к краун-эфирам связан, прежде всего, с их
металлов могут применяться в медицине, сельском
уникальной способностью к селективному комп-
хозяйстве и в ряде других областей [13].
лексообразованию, что позволяет применять их в
Известно, что основным способом получения
качестве катализаторов межфазного переноса в
азометинов (иминов, оснований Шиффа) является
органическом синтезе, селективных экстрагентов
конденсация альдегидов или кетонов с первич-
металлов в горнодобывающей промышленности, а
ными аминами. Азометиновые производные краун-
также для разделения радионуклидов [1]. Активно
эфиров, в частности бензо-15-краун-5, описаны
ведутся
исследования
биологического
и
ранее в ряде работ [14, 15]. В качестве исходных
медицинского потенциала
краун-эфиров и их
соединений использовали 4-амино-бензо-15-краун-5
комплексов с металлами. Являясь известными
и
2-гидрокси-4-метоксибензальдегид или
2-гид-
ионофорами, краун-эфиры способны проявлять
рокси-5-метоксибензальдегид. Синтез данных
антибактериальную, противогрибковую активность
иминов проводили в среде метанола или
[2-4]. В настоящее время проводятся исследования
безводного хлороформа [16].
по применению производных краун-эфиров в
качестве активных действующих соединений для
В данной работе нами синтезированы новые
химиотерапии опухолей, носителей лекарственных
производные краун-эфиров и медные комплексы
средств к раковой клетке, фотосенсибилизаторов
на их основе, а также исследована цитотоксическая
[5-8]. Доказано, что комплексы меди, кобальта,
и противоопухолевая активность полученных
никеля, палладия, рутения с органическими лиган-
соединений.
дами вызывают апоптоз раковых клеток [9-12].
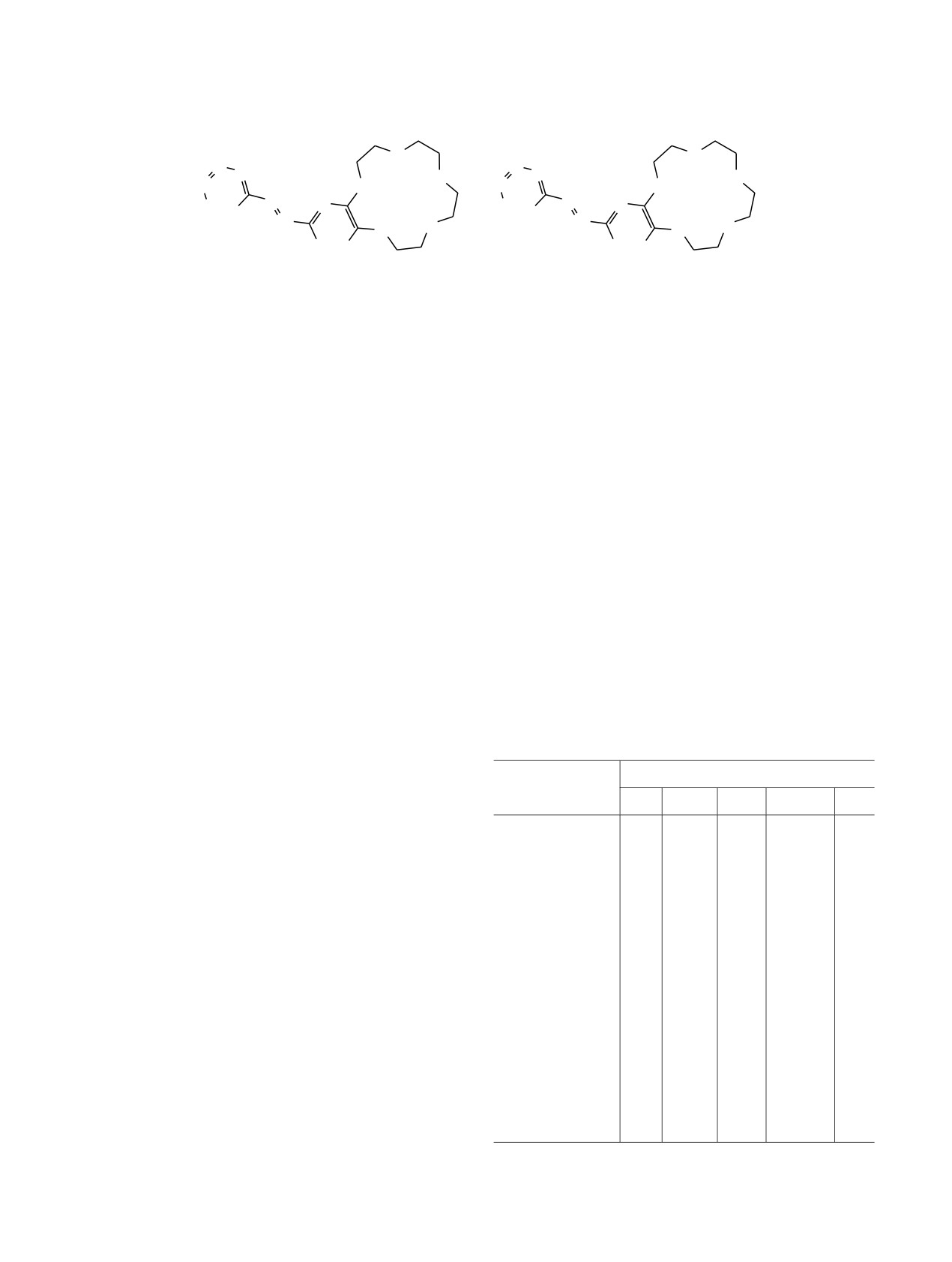
На первом этапе работы нами были получены
Наибольший интерес представляют краунсодер-
азометиновые производные бензо-15-краун-5 1 [N-
жащие имины, а именно пиридинилметилен-
(пиридин-4-илметиленамино)бензо-15-краун-5
1a,
412
СИНТЕЗ И ИССЛЕДОВАНИЕ МЕДНЫХ КОМПЛЕКСОВ
413
Схема 1.
O
N R
N R
(CH3COO)2Cu
+ RNH2
N
N
N
Cu(CH3COO)2
4
1a3a
O
N R
N R
(CH3COO)2Cu
+ RNH2
N
N
N
Cu(CH3COO)2
5
1б3б
O
O
*
*
O
O
O
*
R =
O
(1),
(2),
(3).
O
O
O
O
O
N-(пиридин-3-илметиленамино)бензо-15-краун-5 1б],
спектроскопии (COSY, 1Н-13С HSQC). Во всех
бензо-18-краун-6
2
{N-(пиридин-4-илметилен-
структурах, содержащих краун-эфирную груп-
амино)бензо-18-краун-6
2a,
N-(пиридин-3-ил-
пировку, в спектрах ЯМР
1Н наблюдаются
метиленамино)бензо-18-краун-6
2б
[17,
18]} и
характерные сигналы протонов СН2, а также
анилина 3 [N-(пиридин-4-илметиленамино)анилин
сигналы протонов ароматического кольца. Так, в
3a, N-(пиридин-3-илметиленамино)анилин
3б].
спектре соединения
1б дублет дублетов с
Исследования
производных
анилина,
не
химическим сдвигом
6.91 м. д. принадлежит
содержащих в своей структуре краун-кольца,
протону при атоме С9, дублеты при 7.00 и 7.04 м. д.
позволят нам оценить влияние этого структурного
принадлежат протонам при атомах углерода С12 и
элемента на противоопухолевую активность
С9 соответственно. Для структур с пара-
соединений в целом. Основания Шиффа получали
замещенным пиридиновым фрагментом в области
конденсацией 4-пиридинкарбоксальдегида 4 или 3-
слабого поля наблюдаются
2 сигнала, соот-
пиридинкарбоксальдегида 5 с соответствующими
ветствующие протонам при атомах углерода С2, С6
краун-эфирами 1, 2 и анилином 3 в среде этилового
(мультиплет, 7.79-7.85 м. д. для соединения 1а) и
спирта при мольном соотношении альдегид:краун-
С3, С5 (мультиплет, 8.68-8.77 м. д.). Согласно
эфир
=
1.2:1.0 (схема
1). Медные комплексы
данным спектроскопии HSQC, сигнал протона при
указанных соединений получали добавлением к
атоме С7 перекрывается сигналами протонов при
соответствующему азометину эквимолярного
атомах С3 и С5. Аналогичным образом проведено
количества ацетата меди в виде его метанольного
отнесение сигналов протонов в соединении 2a. Для
раствора с последующей выдержкой при повы-
мета-замещенного пиридинового фрагмента
шенной температуре.
дублет дублетов при 7.54 принадлежит протону
при атоме С5, дублет триплетов при 8.28 м. д.
Строение и состав синтезированных оснований
принадлежит протону при атоме С6, дублет
Шиффа были определены на основании данных
дублетов при 8.68 м. д. принадлежит протону при
элементного анализа, ЯМР и ИК спектроскопии.
атоме С4, и дублет при 9.03 м. д. соответствует
Отнесение сигналов было выполнено на основании
протону при атоме С9. Нумерация атомов
совокупности данных одномерной и двумерной
приведена на схеме 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
414
САДОВСКАЯ и др.
Схема 2.
5
O
5
O
6
6
C
C
C
4
C
O
O
N
O
C
O
7
9
7
9
C
C
C
C
3
C C
N C
2
N
2
N
O O
O O
13
C C
12
13
C C12
1a
1б
Исследование на цитотоксическую активность
зависимости не обнаружено. В случае 18-членных
проводили на
5 клеточных линиях опухолей
циклов активнее медный комплекс, полученный из
человека: карцинома толстой кишки HCT-116,
3-пиридинкарбоксальдегида, в случае 15-членных
карцинома простаты РС-3, карцинома легкого
циклов активнее медный комплекс, полученный из
А549, аденокарцинома молочной железы MCF-7,
4-пиридинкарбоксальдегида.
Выявлено,
что
Т-клеточный лимфобластный лейкоз Jurkat,
медные комплексы, содержащие в структуре 15-
полученных из Банка клеточных линий
членное краун-кольцо проявляют меньшую
активность, чем 18-членные. Медные комплексы с
Н.Н. Блохина. Для оценки противоопухолевой
основаниями Шиффа, производными анилина,
активности полученных соединений использовали
занимают промежуточное положение между
МТТ-тест [19].
комплексами, содержащими в структуре
15-
членное краун-кольцо и
18-членное, т. е.
Из
12 полученных и исследованных нами
активность медных комплексов, синтезированных
соединений
8 проявили противоопухолевую
из азометиновых производных аминокраун-эфиров
активность:
3a,
2a,
3a-Cu(CH3COO)2,
1a-Cu
и анилина, в зависимости от структуры возрастает
(CH3COO)2,
2a-Cu(CH3COO)2,
3б-Cu(CH3COO)2,
в ряду: 1 > 3 > 2.
1б-Cu(CH3COO)2,
2б-Cu(CH3COO)2. Степень
ингибирования роста клеток представлена в
Таким образом, были получены новые
таблице. Из полученных данных видно, что все
азометиновые производные ряда краун-эфиров и
медные комплексы синтезированных лигандов
проявили цитотоксическую активность, чего
Ингибирование роста клеток клеточных линий опухолей
нельзя сказать о самих лигандах, пиридин-
человека соединениями 1а-3б и комплексами меди на
содержащих азометиновых производных краун-
их основе
эфиров, которые неактивны в отношении исследу-
I, %
емых клеточных линий. Исключение составляет
№
лиганд 2a, содержащий в своей структуре 18-
РС-3
MCF-7
А549
НСТ-116
Jurkat
членный краун-эфирный цикл, который активен в
1a
8
16
14
39
44
отношении Т-клеточного лимфобластного лейкоза
1б
20
-2
9
-2
19
Jurkat и ингибирует рост раковых клеток на 58%.
2a
1
1
8
10
58
В результате проведенных исследований in vitro
отмечены некоторые закономерности зависимости
2б
17
2
11
4
24
структура-свойство для краунсодержащих осно-
3a
17
18
25
7
58
ваний Шиффа и их медных комплексов. В целом,
можно заключить, что сами лиганды не проявляют
3б
8
17
17
13
24
цитотоксической активности, за исключением
1a-Cu(CH3COO)2
50
65
54
15
60
соединений 3a и 2a, которые активны в отношении
1б-Cu(CH3COO)2
46
53
53
12
35
Jurkat. Все синтезированные медные комплексы
активны в той или иной степени в зависимости от
2a-Cu(CH3COO)2
68
80
65
26
89
их структурных особенностей. Установлено, что
2б-Cu(CH3COO)2
77
85
84
77
86
замещение по мета- и пара-положению пири-
динового структурного элемента влияет на
3a-Cu(CH3COO)2
71
77
73
29
87
активность медных комплексов, но четкой
3б-Cu(CH3COO)2
50
60
62
18
42
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ МЕДНЫХ КОМПЛЕКСОВ
415
медные комплексы на их основе, которые могут
4.15 м (4Н, СН2), 6.91 д. д (1Н, СН, J = 8.4, 2.3 Гц),
иметь широкую область применения, в частности в
7.00 д (1H, CH, J = 8.4 Гц), 7.04 д (1H, CH, J = 2.3
медицине. В ходе исследований было установлено,
Гц), 7.54 д. д (1Н, СН, J = 7.9, 4.8 Гц), 8.28 д. т (1Н,
что наибольшую цитотоксическую активность
СН, J = 7.9, 1.7 Гц), 8.68 д. д (1Н, СН, J = 4.8,
проявил комплекс на основе N-(пиридин-3-
1.7 Гц), 8.75 с (1Н, НС=N), 9.03 д (1H, CH, J =
илметиленамино)бензо-18-краун-6, который инги-
1.7 Гц). Найдено, %: С 64.51; Н 6.57; N 7.61.
бировал рост клеточных линий опухолей человека
C20H24N2O5. Вычислено, %: С 64.50; Н 6.53; N 7.52.
на 77-86%.
N-(Пиридин-4-илметиленамино)бензо-18-краун-
6 (2a). Выход 89%, порошок светло-зеленого цвета,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
т. пл. 63.9-64.7°С. ИК спектр, ν, см-1: 629 сл, 713
ср, 802 ср, 829 ср, 849 ср, 899 сл, 933 ср, 949 ср, 984
Спектры ЯМР 1H регистрировали на приборе
ср, 1032 ср, 1056 ср, 1116 с (С-О-С), 1189 сл, 1222
Bruker AVANCE III NanoBay с рабочими
ср, 1258 ср (С-Н), 1319 сл, 1359 сл, 1414 сл, 1457
частотами
300.28
в ДМСО-d6 при
25°С.
сл (Py), 1482 сл (Py), 1509 с (СН2), 1587 сл (Py),
Элементный анализ проводили на СНNS-
1624 сл (С=N), 2855 ш, 2925 сл (С-Н), 2932 сл
анализаторе Eurovector EuroEA 3000. ИК спектры
(С-Н), 3030 сл (С-НAr), 3055 сл (С-НAr). Спектр
регистрировали на ИК Фурье-спектрометре
ЯМР 1Н, δ, м. д.: 3.52 c (4H, СН2), 3.55-3.64 м (8Н,
VERTEX 70 в диапазоне волновых чисел от 600 до
СН2), 3.73-3.80 м (4Н, СН2), 4.07-4.18 м (4Н, СН2),
3800 см-1 с разрешением 4 см-1 для образцов на
6.95 д. д (1Н, СН, J = 8.5, 2.0 Гц), 7.01 д (1Н, СН,
приставке НПВО с кристаллом из ZnSe.
J = 8.5 Гц), 7.08 д (1Н, СН, J = 2.0 Гц), 7.82 д (2Н,
Синтез оснований Шиффа. К раствору
СН, J = 5.8 Гц), 8.68-8.77 м (3Н, СН + НС=N).
0.01 моля анилина 3 или краун-эфира 1 или 2 в
Найдено, %: С 63.31; Н 6.81; N 6.58. C22H28N2О6.
10 мл этанола прибавляли по каплям 0.012 моля
Вычислено, %: С 63.45; Н 6.77; N 6.73.
соответствующего альдегида 5 или 4. Полученную
N-(Пиридин-3-илметиленамино)бензо-18-краун-
смесь выдерживали при 40°С в течение 3 ч, затем
6 (2б). Выход 89%, порошок светло-зеленого цвета,
упаривали. Осадок отфильтровывали, сушили на
т. пл. 73.9-74.2°С. ИК спектр, ν, см-1: 629 сл, 713
воздухе при комнатной температуре.
ср, 802 ср, 829 ср, 849 ср, 899 сл, 933 ср, 949 ср, 984
N-(Пиридин-4-илметиленамино)бензо-15-краун-
ср, 1032 ср, 1056 ср, 1116 с (С-О-С), 1189 сл, 1222
5 (1a). Выход 86%, порошок светло-зеленого цвета,
ср, 1258 ср (С-Н), 1319 сл, 1359 сл, 1414 сл, 1457
т. пл. 75.1-76.0°С. ИК спектр, ν, см--1: 627 сл, 814
сл (Py), 1482 сл (Py), 1509 с (СН2), 1587 сл (Py),
сл, 851 сл, 934 сл, 989 сл, 1050 ср, 1091 ср, 1131 с
1624 сл (С=N), 2855 ш, 2925 сл (С-Н), 2932 сл
(C-O-C), 1230 с, 1266 с, 1316 ср, 1363 сл, 1414 сл,
(С-Н), 3030 сл (С-НAr), 3055 сл (С-НAr). Спектр
1453 ср, 1513 с, 1555 сл, 1588 ср, 1598 ср, 1626 сл
ЯМР 1Н, δ, м. д.: 3.53 уш. с (4Н, СН2), 3.55-3.61 м
(C=N), 2868-2922 уш. с (C-H), 3030-3060 уш. сл
(8Н, СН2), 3.74-3.80 м (4Н, СН2), 4.07-4.18 м (4Н,
(С-НAr). Спектр ЯМР 1Н, δ, м. д.: 3.62 уш. с (8Н,
СН2), 6.91 д. д (1Н, СН, J = 8.5, 2.3 Гц), 7.00 д (1Н,
СН2), 3.75-3.82 м (4Н, СН2), 4.05-4.16 м (4Н, СН2),
СН, J = 8.5 Гц), 7.04 д (1Н, СН, J = 2.4 Гц), 7.53 д. д
6.96 д. д (1Н, СН, J = 8.5, 2.2 Гц), 7.01 д (1H, CH,
(1Н, СН, J = 7.9, 4.7 Гц), 8.28 д. т (1Н, СН, J = 7.9,
J = 8.5 Гц), 7.08 д (1H, CH, J = 2.2 Гц), 7.79-7.85 м
1.9 Гц), 8.68 д. д (1Н, СН, J = 4.7, 1.4 Гц), 8.75 с
(2H, CH), 8.68-8.77 м (3Н, СН + HC=N). Найдено,
(1Н, НС=N), 9.03 д (1Н, СН, J = 1.0 Гц). Найдено,
%: С 64.69; Н 6.57; N 7.58. C20H24N2O5. Вычислено,
%: С 63.61; Н 6.62; N 6.32. C22H28О6N2. Вычислено,
%: С 64.50; Н 6.53; N 7.52.
%: С 63.45; Н 6.77; N 6.27.
N-(Пиридин-3-илметиленамино)бензо-15-краун-
N-(Пиридин-4-илметиленамино)анилин
(3a).
5 (1б). Выход 88%, порошок светло-зеленого цвета,
Выход 92%, белый порошок, т. пл. 67.8-69.2°С. ИК
т. пл. 87.3-88.0°С. ИК спектр, ν, см-1: 623 сл, 705
спектр, ν, см-1: 649 ср, 690 с, 734 ср, 764 с, 819 с,
ср, 811 сл, 844 сл, 918 сл, 939 сл, 991 сл, 1050 ср,
881 сл, 913 ср, 961 сл, 977 сл, 987 сл, 1022 сл, 1059
1091 ср, 1129 с (C-O-C), 1142 с, 1237 ср, 1262 с,
сл, 1074 сл, 1165 сл, 1186 сл, 1209 сл, 1226 сл, 1236
1331 сл, 1373 сл, 1421 сл, 1449 сл, 1510 с, 1568 сл,
сл, 1284 сл, 1325 ср, 1364 сл, 1411 с (Py), 1449 сл,
1586 сл, 1625 сл (C=N), 2873-2930 уш. с (C-H),
1482 ср (Py), 1554 сл, 1579 сл (Py), 1593 ср (Py),
3030-3060 уш. сл (С-НAr). Спектр ЯМР 1Н, δ, м. д.:
1620 ср (С=N), 1671 сл, 1711 сл, 1799 сл, 1881 сл,
3.63 уш. с (8Н, СН2), 3.75-3.82 м (4Н, СН2), 4.04-
1953 сл, 2001 сл, 2884 сл (С-Н), 2991 сл (С-Н),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
416
САДОВСКАЯ и др.
3025 сл (С-НAr), 3054 сл (С-НAr), 3072 сл (С-НAr).
спектр, ν, см-1: 627 сл, 793 ср, 819 ср, 839 сл, 862
Спектр ЯМР 1Н, δ, м. д.: 7.29-7.37 м (3Н, СН), 7.41-
сл, 879 сл, 945 ср, 987 ср, 1049 ср, 1107 с, 1127 с
7.50 м (2Н, СН), 7.83-7.88 м (2Н, СН), 8.69 с (1Н,
(С-О-С), 1225 с, 1245 ср, 1265 с, 1315 сл, 1326 сл,
НС=N), 8.76 д (1H, CH, J = 3.4 Гц). Найдено, %: С
1354 сл, 1412 сл, 1427 сл, 1449 сл (Py), 1463 сл (Py),
78.99; Н 5.57; N 15.58. C12H10N2. Вычислено, %: С
1511 с (СН2), 1552 о. сл, 1582 ср (Py), 1598 ср
79.10; Н 5.53; N 15.37.
(С=N), 2868 ср (С-Н), 2923 сл (С-Н), 3030 сл
(С-НAr), 3056 сл (С-НAr). Найдено, %: С 52.30; Н
N-(Пиридин-3-илметиленамино)анилин
(3б).
5.81; N 4.57. C26H34N2О10Cu. Вычислено, %: С
Выход 93%, желтое масло. ИК спектр, ν, см-1: 620
52.22; Н 5.73; N 4.69.
сл, 667 сл, 693 с, 760 с, 804 ср, 830 сл, 874 ср, 910
сл, 977 сл, 1023 сл, 1074 сл, 1092 о. сл, 1114 о. сл,
Комплекс
2б-Cu(CH3COO)2. Выход
88%,
1186 сл, 1204 ср, 1236 сл, 1324 ср, 1365 сл, 1386 о.
зеленый порошок, т. пл. 230.1-230.9°С (разл.). ИК
сл, 1418 ср (Py), 1450 сл, 1485 ср (Py), 1570 ср (Py),
спектр (KBr), ν, см-1: 628 сл, 642 сл, 680 с, 702 ср,
1587 ср (Py), 1626 ср (С=N), 1703 ср, 1943, 2857 сл
811 ср, 855 сл, 948 ср, 993 ср, 1031 ср, 1052 ср, 1120
(С-Н), 2886 сл (С-Н), 3001 сл (С-НAr), 3031 сл (С-
с, 1223 ср, 1257 ср, 1297 сл, 1333 сл, 1354 сл, 1371
НAr), 3054 сл (С-НAr), 3080 сл (С-НAr). Спектр ЯМР
сл, 1426 с, 1443 ср, 1510 ср, 1587 сл, 1616 с., 2866
1Н, δ, м. д.: 7.26-7.33 м (3Н, СН), 7.39-7.48 м (2Н,
ш, 2923 ш, 3032 сл, 3050 сл. Найдено, %: С 52.33; Н
СН), 7.54 д. д (1Н, СН, J = 7.9, 4.6 Гц), 8.31 д. т (1Н,
5.61; N 4.53. C26H34N2О10Cu. Вычислено, %: С
СН, J = 7.9, 1.9 Гц), 8.67-8.73 м (2Н, НС=N + СН),
52.22; Н 5.73; N 4.69.
9.06 д (1Н, СН, J = 1.9 Гц). Найдено, %: С 78.89; Н
Комплекс
3a-Cu(CH3COO)2. Выход
91%,
5.56; N 15.58. C12H10N2. Вычислено, %: С 79.10; Н
зеленый порошок, т. пл. 236.2-236.8°С (разл.). ИК
5.53; N 15.37.
спектр (KBr), ν, см-1: 631 ср, 660 ср, 683 с, 735 сл,
Получение медных комплексов с основа-
768 ср, 824 ср, 883 сл, 913 сл, 961 сл, 976 сл, 1013
ниями Шиффа 1а-3б. К раствору 0.001 моля
сл, 1033 сл, 1056 сл, 1185 сл, 1211 сл, 1244 сл, 1320
ацетата меди(II) в 15 мл метанола прибавляли
сл, 1350 сл, 1418 с, 1433 с, 1484 сл, 1559 сл, 1607 с,
раствор 0.001 моля соответствующего основания
1624 с, 2885 сл, 3000 сл, 3061 сл. Найдено, %: С
Шиффа в 10 мл метанола. Полученную смесь
52.61; Н 4.51; N 7.57. C16H16N2О4Cu. Вычислено, %:
выдерживали при 45°С в течение 4 ч. Осадок
С 52.82; Н 4.43; N 7.70.
отфильтровывали и сушили на воздухе при
Комплекс
3б-Cu(CH3COO)2. Выход
89%,
комнатной температуре.
зеленый порошок, т. пл. 239.1-240.0°С (разл.). ИК
Комплекс
1a-Cu(CH3COO)2. Выход
94%,
спектр, ν, см-1: 627 сл, 643 сл, 681 с, 699 ср, 761 сл,
зеленый порошок, т. пл. 203.2-203.8°С (разл.). ИК
800 сл, 892 сл, 988 сл, 1029 сл, 1049 сл, 1074 о. сл,
спектр (KBr), ν, см-1: 617 с, 628 с, 680 с, 792 сл, 831
1100 о. сл, 1124 о. сл, 1186 сл, 1197 сл, 1244 сл,
сл, 890 с, 942 ср, 974 сл, 1012 сл, 1026 ср, 1053 ср,
1327 сл, 1384 сл, 1374 сл, 1417 с, 1427 с, 1471 сл,
1084 сл, 1120 с (C-O-C), 1142 с, 1202 сл, 1276 ср
1488 сл, 1578 ср, 1617 с, 2930 сл, 3007 сл, 3071 сл.
(C-HAr), 1301 ср, 1350 сл, 1418 с, 1432 с, 1508 с,
Найдено, %: С 52.73; Н 4.51; N 7.62. C16H16N2О4Cu.
1608 с (COOCu), 1628 с (C=N), 2869-2930 уш. ср
Вычислено, %: С 52.82; Н 4.43; N 7.70.
(C-H). Найдено, %: С 52.12; Н 5.51; N 5.14.
Биологические испытания. Клеточные линии
C24H30N2О9Cu. Вычислено, %: С 52.02; Н 5.46; N 5.06.
культивировали в среде RPMI-1640, содержащей
Комплекс
1б-Cu(CH3COO)2. Выход
91%,
10% телячьей эмбриональной сыворотки, 10 мМ.
зеленый порошок, т. пл. 208.9-210.0°С (разл.). ИК
HEPES (Sigma, США), 2 мМ. L-глутамина (Sigma,
спектр, ν, см-1: 628 с, 641 с, 682 с, 713 ср, 803 ср,
США), 40 нг/мл гентамицина (ICN, США), амино-
822 ср, 841 ср, 887 сл, 929 сл, 980 ср, 1031 сл, 1052
кислоты, пируват натрия и раствор витаминов
ср, 1080 ср, 1137 с (C-O-C), 1191 сл, 1237 ср, 1262
(ПанЭко, Россия), при 37°С в атмосфере 5%-ного
ср, 1316 сл, 1428 с, 1513с, 1610 с (COOCu), 1629 с
СО2. Клетки поддерживали в логарифмической
(C=N), 2870-2950 уш. сл (C-H). Найдено, %: С
фазе роста постоянным пересевом культуры через
53.06; Н 5.51; N 5.12. C24H30N2О9Cu. Вычислено, %:
3-4 сут. Для открепления адгезионных культур с
С 53.03; Н 5.46; N 5.06.
пластика использовали раствор Версена.
Комплекс
2a-Cu(CH3COO)2. Выход
88%,
Для постановки MTT-теста клетки распре-
зеленый порошок, т. пл. 223.2-223.9°С (разл.). ИК
деляли в 96-луночные плоскодонные планшеты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ МЕДНЫХ КОМПЛЕКСОВ
417
(Costar, USA). Через сутки в каждую лунку
P. 437. doi 10.1007/s10847-005
добавляли исследуемые соединения в концен-
3. Alfonso I., Quesada R. // Chem. Sci. 2013. Vol. 4. N 8.
трации 100 мкМ. и инкубировали с клетками в
P. 3009. doi 10.1039/C3SC50882J
течение 72 ч в 5%-ном СО2 при 37°C. Каждое
4. Huang Sh.-T., Kuo H.-S., Hsiao Ch.-L., Lin Yu.-L. //
соединение исследовали в триплете. Соединения
Bioorg. Med. Chem. 2002. Vol. 10. N 6. P. 1947. doi
растворяли в диметилсульфоксиде (ДМСО) так,
10.1016/S0968-0896(02)00004-4
чтобы концентрация ДМСО в лунке не превышала
5. Supek F., Ramljak T.S., Marjanovic M., Buljubasic M.,
Kragol G., Llic N., Smuc T., Zahradka D., Mlinaric-
1%. В качестве контроля использовали лунки с
Majerski K., Kralj M. // Eur. J. Med. Chem.
2011.
клетками с 1%-ным ДМСО в полной ростовой
Vol. 46. I. 8. P. 3444. doi 10.1016/j.ejmech.2011.05.009
среде. Через 72 ч в каждую лунку вносили по
6. Karawajew L., Glibin E.N., Maleev V.Y., Czerwony G.,
20 мкл раствора МТТ (конечная концентрация -
Dörken B., Davies D.B., Veselkov A.N. // Anti-Cancer
1 мг/мл) и инкубировали 4 ч при 37°С в 5%-ном
Drug Des. 2000. Vol. 15. N 5. P. 331.
CO2. После образования формазана надосадочную
7. Jansen B.A.J.,Wielaard P., den Dulk H., Brouwer J.,
жидкость удаляли, осадок растворяли в 150 мкл
Reedijk J. // Eur. J. Inorg. Chem. 2002. N 9. P. 2375.
ДМСО. Далее планшеты помещали на 10 мин в
doi
10.1002/1099-0682(200209)2002:9<2375::AID-
термостат при
37°С и затем встряхивали для
EJIC2375>3.0.CO;2-B
равномерного растворения кристаллов формазана,
8. Yoo J., Sohn Y.S., Do Y. // J. Inorg. Biochem. 1999.
после чего интенсивность окрашивания среды
Vol. 73. N 3. P. 187. doi 10.1016/S0162-0134(99)00016-1
измеряли на фотометрическом анализаторе
9. Majouga A.G., Zvereva M.I., Rubtsova M.P., Skvor-
иммуноферментных реакций АИФР-01 Униплан
(ЗАО
«Пикон») при λ
=
540 нм. Величина
поглощения прямо пропорциональна числу живых
клеток.
Dontsova O.A.
// J. Med. Chem. 2014. Vol. 57. N 14.
Степень ингибирования роста клеток (I, %)
P. 6252. doi 10.1021/jm500154f
определяли по формуле:
10. Iakovidis I., Delimaris I., Piperakis S.M. // Mol. Bio.
Int. 2011. Vol. 2011. P. 1. doi 10.4061/2011/594529
Do
1
100%,
11. Marzano C., Pellei M., Tisato F., Santini C. // Anti-
I =
Dк
Cancer Agents Med.Chem. 2009. Vol. 9. N 2. P. 185.
doi 10.2174/187152009787313837
где Dк - оптическая плотность в контрольных
12. Plotek M., Dudek K., Kyziol A. // Chemik.
2013.
лунках, Dо - оптическая плотность в опытных
Vol. 67. N 12. P. 1181.
лунках. Соединение считали цитостатически
13. Усачева Т.Р. Дис
канд. хим. наук. Иваново, 2016.
активным, если оно вызывало подавление роста
292 с.
клеток более 50%.
14. Дорохов А.В. Дис
канд. хим. наук. Москва, 2007.
114 с.
КОНФЛИКТ ИНТЕРЕСОВ
15. Тимонин А.Н. Дис
канд. хим. наук. Москва, 2011.
145 с.
Авторы заявляют об отсутствии конфликта
16. Guler H., Hayvali Z., Dal H., Hokelek T. // Polyhedron.
интересов.
2012. Vol.
31. N
1.
P.
688. doi
10.1016/
j.poly.2011.10.034
СПИСОК ЛИТЕРАТУРЫ
17. Глушко В.Н., Садовская Н.Ю. Пат. РФ
2655166
(2018).
1. Глаголев Ю.В., Логунов М.В., Мамакин И.В., Поло-
син В.М., Ровный С.И., Старченко В.А., Шишелов Ю.П.,
18. Глушко В.Н., Садовская Н.Ю. Пат. РФ
2661871
Яковлев Н.Г. Пат. РФ 2318258 (2008).
(2018).
2. Deshmukh M.B., Alasundkar K.N., Salunkhe D.K.,
19. Mossman T. // J. Immunol. Meth. 1983. Vol. 65. N 1-2.
Sankpal S.A. // J. Chem. Pharm. Res. 2010. Vol. 2. N 4.
P. 55. doi 10.1016/0022-1759(83)90303-4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
418
САДОВСКАЯ и др.
Synthesis and Study of Copper Complexes of Some Azomethine
Monobenzo-Crown Ethers Derivatives
N. Yu. Sadovskaya, V. N. Glushko*, M. A. Baryshnikova, D. A. Afanasyev,
M. Yu. Zhila, and S. K. Belus
Institute for Chemical Reagents and High Purity Chemical Substances of the National Research Center
“Kurchatov Institute”, Bogorodskii Val 3, Moscow, 107076 Russia
*e-mail: tetrazoli@yandex.ru
Received October 11, 2018; revised October 23, 2018; accepted October 25, 2018
A number of new azomethine derivatives of benzo-18-crown-6, benzo-15-crown-5 and aniline, as well as their
complexes with copper(II) acetate, were synthesized. Using the MTT test, the antitumor activity of the
compounds obtained was determined. The effect of individual structural elements on the antitumor activity of the
compounds as a whole was assessed.
Keywords: crown ethers, copper complexes, Schiff bases, pyridinecarboxaldehyde, antitumor activity, MTT test
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019