ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 419-424
УДК 547.979.73
СИНТЕЗ И СПЕКТРАЛЬНЫЕ СВОЙСТВА КОМПЛЕКСОВ
НИКЕЛЯ С НИЗКОСИММЕТРИЧНЫМИ ФЕНОКСИ-
И ФЕНИЛСУЛЬФАНИЛЗАМЕЩЕННЫМИ
И 1,4-НАФТОХИНОН-АННЕЛИРОВАННЫМИ
ФТАЛОЦИАНИНАМИ
© 2019 г. А. В. Борисов*, Н. Е. Галанин, Г. П. Шапошников
Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
Поступило в Редакцию 12 июля 2018 г.
После доработки 12 июля 2018 г.
Принято к печати 16 июля 2018 г.
Кросс-сочетанием 4,5-дифеноксифталонитрила и 4,5-бис(фенилсульфанил)фталонитрила (компоненты
А) с имидом антрахинон-2,3-дикарбоновой кислоты (компонент В) в присутствии мочевины, ацетата
никеля, хлорида и молибдата аммония синтезированы металлокомплексы соответствующих
низкосимметричных фталоцианинов типа А3В, AABB и АВАВ. Исследованы их спектральные свойства и
установлено, что в растворах хлороформа все комплексы ассоциированы, причем тип ассоциации
зависит от дипольных моментов их молекул.
Ключевые слова: фталоцианины, низкосимметричные фталоцианины, 1,4-нафтохинон, комплексы никеля
DOI: 10.1134/S0044460X19030132
Низкосимметричные фталоцианины являются
комплексов никеля с низкосимметричными
интересными в плане практического использования
фенокси- и фенилсульфанилзамещенными фтало-
соединениями. Это связано с тем, что при наличии
цианинами с аннелированными остатками
1,4-
в молекуле одновременно электронодонорных и
нафтохинона и исследования их спектральных
электроноакцепторных заместителей эти соеди-
свойств. В работе в качестве компонентов А,
нения обладают поляризованной электронной
придающих фталоцианинам растворимость в
структурой [1] и перспективны для использования
органических средах, были использованы
4,5-
в нелинейной оптике [2, 3]. Кроме того, фтало-
дифеноксифталонитрил
1 и
4,5-бис(фенилсуль-
цианины несимметричного строения, содержащие
фанил)фталонитрил 2, полученные по методике
в своем составе длинные алкильные или
[9], а в качестве компонента В - имид антрахинон-
трифенилметильные группы, часто обладают
2,3-дикарбоновой кислоты
3. Последний был
жидкокристаллическими свойствами [4-6]. Особен-
синтезирован по методике [8].
ности молекулярной и электронной структуры
Взаимодействием соединений 1 или 2 с имидом
несимметрично замещенных фталоцианинов
3 в мольном соотношении
1:6 в присутствии
обусловливают возможность использования их в
мочевины, ацетата никеля и каталитических
нанотехнологиях [7].
количеств молибдата аммония при температуре
Ранее мы сообщали о синтезе и свойствах
160-180°С в течение 3 ч были синтезированы
низкосимметричных алкоксизамещенных фтало-
соответствующие комплексы никеля 4-9 (схема 1).
цианинов типа А3В, ААВВ и АВАВ, содержащих
аннелированные фрагменты 1,4-нафтохинона [8].
Хорошо растворимые фталоцианины типа А4,
Настоящая работа является продолжением иссле-
А3В 4, 5, ABAB 6, 7, AABB 8, 9 были выделены из
дований и посвящена синтезу схожих по строению
смесей экстракцией хлороформом и разделены с
419
420
БОРИСОВ и др.
Схема 1.
O
R
R
O
N
O
O
R
CN
N
N
Ni(OAc)2, CO(NH2)2
+
NH
N
Ni
N
R
CN
N
N
O
O
1, 2
3
N
R
R
R
R
4, 5
O
O
R
R
R
R
O
N
O
N
N
N
N
N
+
N
Ni
N
+
N
Ni
N
N
N
N
N
N
O
O
N
R
R
R
R
O
O
6, 7
8, 9
R = PhO (1, 4, 6, 8), PhS (2, 5, 7, 9).
помощью колоночной хроматографии. Вследствие
теоретическому
характерное изотопное расщеп-
значительного избытка компонента В фтало-
ление сигналов
анализируемых ионов подтвер-
цианины типа А4 образуются в следовых
ждает строение фталоцианинов.
количествах (<1%). Соединения типа АВ3 и В4,
Спектры ЯМР
1Н полученных соединений
выходы которых максимальны, обладают низкой
схожи по характеру и содержат по два широких,
растворимостью и не могут быть выделены
слабо разрешенных мультиплета в области
хроматографированием. Выходы соединений 4-9
резонанса ароматических протонов. Мультиплеты
составляют
7-15%. Их состав и строение
в области 8.65-8.00 м. д. соответствуют резонансу
установлены на основании данных элементного
протонов фрагментов 1,4-нафтохинона, а муль-
анализа, масс-спектрометрии (MALDI-TOF) и ЯМР
типлеты в области 7.60-6.50 м. д. характеризуют
1Н спектроскопии.
суммарный резонанс протонов заместителей и
В масс-спектрах синтезированных соединений
протонов фталоцианина, причем на их положение
присутствуют сигналы ионов [M + H]+, значения
природа мостиковых атомов (кислород или сера)
m/z которых в каждом случае близки к
существенного влияния не оказывает. Соотно-
рассчитанным (табл. 1). Близкое в каждом случае к
шение интегральных интенсивностей двух
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ И СПЕКТРАЛЬНЫЕ СВОЙСТВА КОМПЛЕКСОВ НИКЕЛЯ
421
Таблица 1. Данные масс-спектрометрии MALDI-TOF комплексов 4-9 для ионов
m/z [M + H]+
Соединение
Тип
Заместитель
найдено
вычислено
4
А3В
PhO
1253.11
1253.24
6
АВАВ
PhO
1199.02
1199.20
8
ААВВ
PhO
1199.51
1199.20
5
А3В
PhS
1349.41
1349.11
7
АВАВ
PhS
1263.72
1263.10
9
ААВВ
PhS
1263.55
1263.10
мультиплетов составляет от 1:6 для соединений 4,
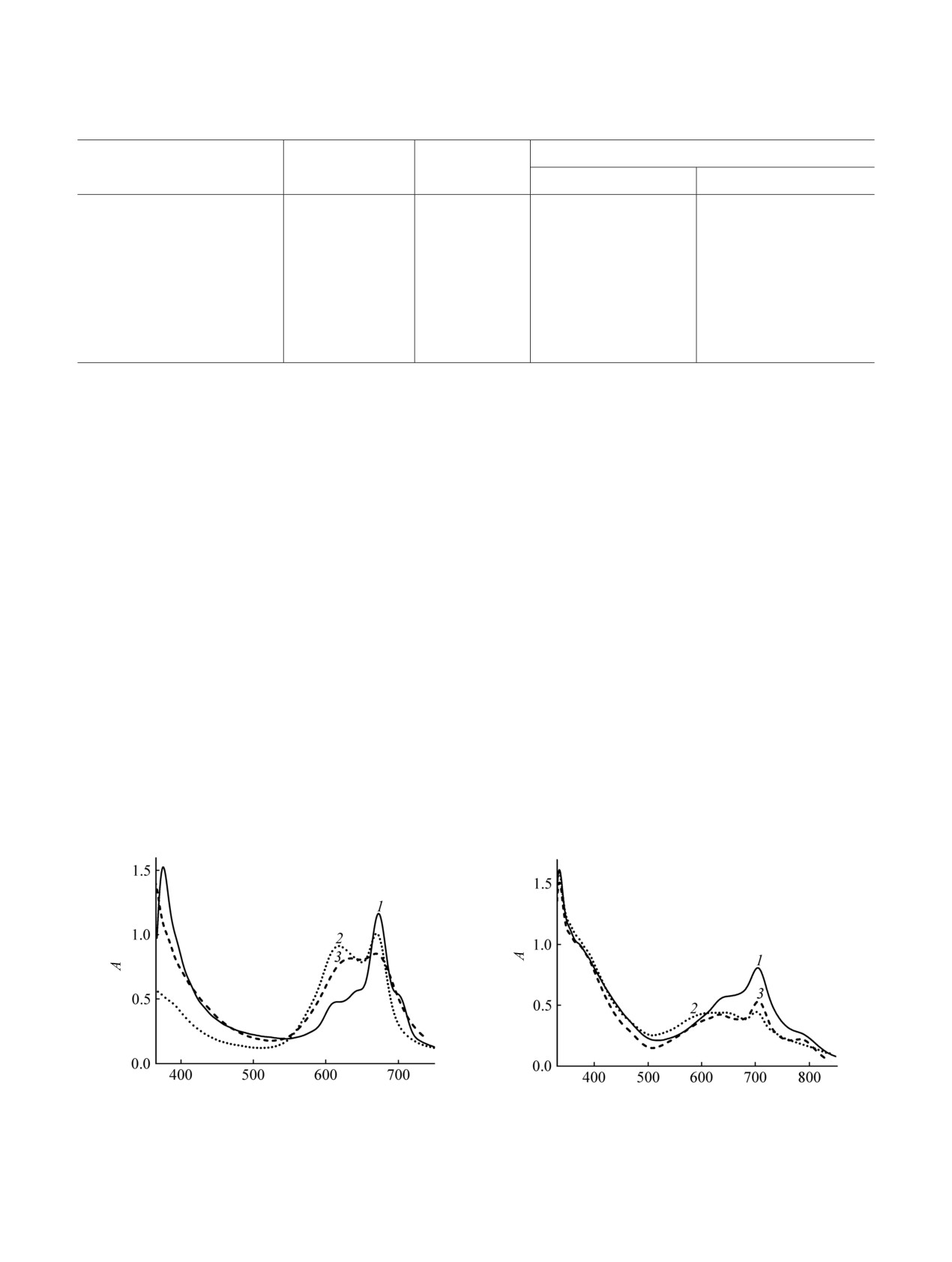
Спектры поглощения комплексов 6, 8 типов
5 типа А3В, до 1:2 для комплексов типов АВАВ 6,
АВАВ и ААВВ соответственно (рис.
1,
2,
3)
7 и ААВВ 8, 9. Характер спектров ЯМР позволяет
содержат в длинноволновой области широкие,
утверждать, что все синтезированные соединения в
расщепленные на две компоненты полосы Q,
растворах в хлороформе сильно ассоциированы.
причем, как и следовало ожидать, степень
Важно отметить, что уменьшение концентраций
расщепления полосы Q для комплекса типа АВАВ
растворов от 1×10-3 до 1×10-5 моль/л не привело к
(Δλ = 52 нм) существенно больше, нежели для
сколько-нибудь заметному улучшению качества
соединения типа ААВВ (Δλ = 35 нм). Характер
спектров ЯМР.
спектральных кривых позволяет предположить,
что комплексы 6 и 8, в отличие от фталоцианина 4,
Электронные спектры поглощения фенокси-
ассоциированы в растворе в хлороформе по H-типу
замещенных фталоцианинов 4, 6, 8 в хлороформе
[12, 13].
представлены на рис.
1. Спектр поглощения
комплекса 4 типа А3В (рис. 1, 1) содержит в
Электронные спектры поглощения фенилсуль-
длинноволновой области полосу Q с максимумом
фанилзамещенных фталоцианинов
5,
7,
9 в
при
672 нм, сопровождаемую колебательными
хлороформе представлены на рис.
2. Спектр
спутниками при 642 и 616 нм, а также флексией в
поглощения соединения 5 типа А3В (рис. 2, 1) в
области
703 нм. Наличие последней, а также
длинноволновой области содержит расщепленную
характер полосы Q (относительно узкая,
на две компоненты полосу Q с максимумами
разрешенная полоса) может свидетельствовать об
компонент при
704 и
639 нм. На ее длин-
ассоциации комплекса 4 в хлороформе по J-типу
новолновом спаде присутствует плечо в области
[10, 11].
798 нм, наличие которого, как и значительная
λ, нм
λ, нм
Рис. 1. Электронные спектры поглощения соединений
Рис. 2. Электронные спектры поглощения соединений
4 (1), 6 (2) и 8 (3) в CHCl3.
5 (1), 7 (2), 9 (3) в CHCl3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
422
БОРИСОВ и др.
Таблица 2. Дипольные моменты и типы ассоциации
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
фталоцианинов 4-9
Электронные спектры поглощения [c = (7.0-7.2)×
Соединение (тип)
D, Д
Тип ассоциации
10-6 моль/л] измерены на спектрофотометре Helios
4 (А3В)
9.87
J
Zeta в хлороформе в кварцевых кюветах с
6 (АВАВ)
5.91
H
толщиной поглощающего слоя 10 мм при 295 K.
Спектры ЯМР 1Н в CDCl3 сняты на приборе Bruker
8 (ААВВ)
1.85
H
Avance-500 (500.13 МГц, внутренний стандарт -
5 (А3В)
9.15
J, H
ТМС). Масс-спектры [MALDI-TOF, матрица - 2-(4-
7 (АВАВ)
7.35
J, H
гидроксибензоазо)бензойная кислота] зарегистри-
рованы на приборе Shimadzu AXIMA Confidence.
9 (ААВВ)
3.98
H
Элементный анализ выполнен на приборе FlashEA
1112 CHNS-O Analyzer.
ширина полосы Q, могут свидетельствовать о
Синтез комплексов
4-9 (общая методика).
присутствии в растворе соединения 5 как J-, так и
Смесь
1.0 ммоль нитрила
1 или
2,
1.70 г
H-ассоциатов.
(6.0 ммоль) имида 3, 0.60 г (10 ммоль) мочевины,
0.60 г (3.0 ммоль) дигидрата ацетата никеля(II) и
В спектрах поглощения комплексов 7 и 9 также
0.01 г молибдата аммония нагревали 3 ч при
наблюдается уширение и расщепление полос Q,
температуре 160-180°С. Расплав охлаждали, экстра-
причем, как и в спектрах феноксизамещенных
гировали хлороформом. Экстракт хроматогра-
фталоцианинов, степень расщепления полосы Q
фировали на колонке с силикагелем Kieselgel 60
для комплекса 7 типа АВАВ (Δλ = 90 нм) больше,
(Merck) с использованием в качестве элюента
чем для соединения 9 типа ААВВ (Δλ = 71 нм).
смеси хлороформа и ацетона (10:1, по объему).
Важно отметить присутствие в спектре погло-
Происходило разделение смеси на четыре зоны,
щения комплекса 9 (рис. 2, 3) полосы поглощения
содержащие фталоцианины типов А4, А3B АВАВ и
при 783 нм, которая, как и для соединения 5 типа
ААВВ соответственно.
А3В, может свидетельствовать о присутствии в
растворе ассоциатов J- и H-типа. В спектре
2,3-(1,4-Нафтохиноно)-9,10,16,17,23,24-гексафен-
поглощения комплекса 7 типа ААВВ (рис. 2, 2)
оксифталоцианинат никеля
(4, А3В). Выход
поглощение в ИК области отсутствует, следо-
0.04 г (10%), темно-зеленый порошок, хорошо
вательно, ассоциация этого фталоцианина в
растворимый в бензоле, хлороформе, плохо раство-
хлороформе осуществляется только по H-типу.
римый в ацетоне, ДМФА. Спектр ЯМР 1Н, δ, м. д.:
8.60-8.08 м (6Н), 7.55-6.65 м (36Н). ЭСП, λmax, нм
Можно предположить, что характер ассоциации
(А/Аmax): 703 (0.34), 672 (0.76), 642 пл, 616 (0.32),
фталоцианинов 4-9 в растворах зависит от их
375 (1.00). Найдено, %: С 72.73; Н 3.18; N 9.01.
дипольных моментов. Последние были вычислены
С76H42N8NiО8. Вычислено, %: С 72.80; Н 3.38; N 8.94.
полуэмпирическим методом PM-3, их значения и
типы ассоциации комплексов приведены в табл. 2.
2,3,16,17-Ди(1,4-нафтохиноно)-9,10,23,24-тетра-
феноксифталоцианинат никеля
(6, АВАВ).
Полученные данные свидетельствуют о том, что
Выход
0.09 г
(15%), темно-зеленый порошок,
фталоцианины 6, 8 и 9 с относительно низкими
хорошо растворимый в бензоле, хлороформе,
дипольными моментами молекул ассоциированы
плохо растворимый в ацетоне, ДМФА. Спектр
только по H-типу, а высокие дипольные моменты
ЯМР 1Н, δ, м. д.: 8.57-8.00 м (12Н), 7.60-6.61 м
молекул комплексов
4,
5 и
7 приводят к
(24Н). ЭСП, λmax, нм (А/Аmax): 670 (1.00), 618 (0.91).
образованию ассоциатов J-типа.
Найдено, %: С 71.98; Н 3.12; N 9.41. C72H36N8NiO8.
Вычислено, %: С 72.08; Н 3.02; N 9.34.
Таким образом, синтезированы комплексов
никеля с низкосимметричными фенокси- и фенил-
2,3,23,24-Ди(1,4-нафтохиноно)-9,10,16,17-тетра-
сульфанилзамещенными фталоцианинами, содержа-
феноксифталоцианинат никеля
(8, ААВВ).
щими аннелированные фрагменты
1,4-нафто-
Выход 0.06 г
(13
%), темно-зеленый порошок,
хинона и установлено, что тип их ассоциации в
хорошо растворимый в бензоле, хлороформе,
растворах хлороформа зависит от дипольных
плохо растворимый в ацетоне, ДМФА. Спектр
моментов их молекул.
ЯМР 1Н, δ, м. д.: 8.58-8.05 м (12Н), 7.55-6.67 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ И СПЕКТРАЛЬНЫЕ СВОЙСТВА КОМПЛЕКСОВ НИКЕЛЯ
423
(24Н). ЭСП, λmax, нм (А/Аmax): 669 (1.00), 634 (0.96).
СПИСОК ЛИТЕРАТУРЫ
Найдено, %: С 72.00; Н 3.10; N 9.16. С72H36N8NiО8.
Вычислено, %: С 72.08; Н 3.02; N 9.34.
1. de la Torre G., Torres T. // J. Porph. Phthal. 1997. Vol.
1. N 3. P. 221. doi 10.1002/(SICI)1099-1409(199707)
2,3-(1,4-Нафтохиноно)-9,10,16,17,23,24-гекса-
1:3<221::AID-JPP10>3.0.CO;2-A
фенилсульфанилфталоцианинат никеля
(5,
2. Lawrence D.S., Whitten D.G. // Photochem. Photobiol.
А3В). Выход 0.03 г (7%), темно-зеленый порошок,
1996. Vol.
64. N
6. P.
923. doi
10.1111/j.1751-
1097.1996.tb01857.x
хорошо растворимый в бензоле, хлороформе,
плохо растворимый в ацетоне, ДМФА. Спектр
3. Sastre A., Del Rey B., Torres T. // J. Org. Chem. 1996.
Vol. 61. N 24. P. 8591. doi 10.1021/jo961018o
ЯМР 1Н, δ, м. д.: 8.65-8.10 м (6Н), 7.58-6.55 м
(36Н). ЭСП, λmax, нм (А/Аmax): 798 пл, 704 (0.50),
4. Eichhorn H., Bruce D.W., Wohrle D. // Adv. Mater.
1998. Vol. 10. N 5. P. 419. doi 10.1002/(SICI)1521-
639 (0.35), 334 (1.00). Найдено, %: С 67.21; Н 3.19;
4095(199803)10:5<419::AID-ADMA419>3.0.CO;2-U
N 8.11. С76H42N8NiО2S6. Вычислено, %: С 67.60; Н
5. Eichhorn H. // J. Porph. Phthal. 2000. Vol. 4. N 1. P. 88.
3.14; N 8.30.
doi 10.1002/(SICI)1099-1409(200001/02)4:1<88::AID-
JPP208>3.0.CO;2-6
2,3,16,17-Ди(1,4-нафтохиноно)-9,10,23,24-тетра-
6. Usolt’seva N., Bykova V., Ananjeva G, Zharnikova N.,
фенилсульфанилфталоцианинат никеля (7, АВАВ).
Kudrik E. // Mol. Cryst. Liq. Cryst. 2004. Vol. 411.
Выход
0.07 г
(12%), темно-зеленый порошок,
N. 1. P. 329. doi 10.1080/15421400490435350
хорошо растворимый в бензоле, хлороформе,
7. de la Escosura A., Martinez-Diaz V.M., Thordarson P.,
плохо растворимый в ацетоне, ДМФА. Спектр
Rowan A.E., Nolte R.J.M., Torres T. // J. Am. Chem.
ЯМР 1Н, δ, м. д.: 8.55-8.01 м (12Н), 7.58-6.50 м
Soc. 2003. Vol. 125. N 40. P. 12300. doi 10.1021/
(24Н). ЭСП, λmax, нм (А/Аmax): 702 (0.28), 612 (0.28),
ja030038m
334 (1.00). Найдено, %: С 68.12; Н 3.21; N 8.54.
8. Борисов А.В., Ефимов Д.Е., Галанин Н.Е.,
С72H36N8NiО4S4. Вычислено, %: С 68.41; Н 2.87; N 8.86.
Шапошников Г.П. // ЖОХ. 2017. Т.
87.
№ 10.
С. 1685; Borisov A.V., Efimov D.E., Galanin N.E.,
2,3,23,24-Ди(1,4-нафтохиноно)-9,10,16,17-тетра-
Shaposhnikov G.P. // Russ. J. Gen. Chem. 2017. Vol. 87.
фенилсульфанилфталоцианинат никеля
(9,
N 10. P. 2343. doi 10.1134/S1070363217100152
ААВВ). Выход
0.09 г
(15%), темно-зеленый
9. Koptyaev A.I., Galanin N.E., Shaposhnikov G.P. //
порошок, хорошо растворимый в бензоле,
Macroheterocycles. 2015. Vol. 8. N 2. P. 156. doi
хлороформе, плохо растворимый в ацетоне,
10.6060/mhc140925g
ДМФА. Спектр ЯМР 1Н, δ, м. д.: 8.63-8.05 м (12Н),
10. Günsel A., Bilgicli A.T., Kandaz M.
// Dyes and
7.55-6.55 м (24Н). ЭСП, λmax, нм (А/Аmax):
783
Pigments.
2014. Vol.
102. P.
169. doi
10.1016/
(0.15), 705 (0.53), 634 (0.28), 334 (1.00). Найдено,
j.dyepig.2013.09.035
%: С
68.01; Н
2.94; N
8.54. С72H36N8NiО4S4.
11. Tolbin A.Yu., Sheinin V.B., Koifman O.I., Tomilova L.G. //
Вычислено, %: С 68.41; Н 2.87; N 8.86.
Macroheterocycles. 2015. V. 8. N. 2. P. 150. doi
10.6060/mhc150454t).
КОНФЛИКТ ИНТЕРЕСОВ
12. Arslan S., Yilmaz I. // Polyhedron. 2007. Vol. 26. N 12.
P. 2387. doi 10.1016/j.poly.2006.11.047
Авторы заявляют об отсутствии конфликта
13. Yang Y.-C., Ward J.R., Seiders R.P. // Inorg. Chem.
интересов.
1985. Vol. 24. N 12. P. 1765. doi 10.1021/ic00206a011
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
424
БОРИСОВ и др.
Synthesis and Spectral Properties of Nickel Complexes
with Low-Symmetry Phenoxyl- and Phenylsulfanyl-Substituted,
and 1,4-Naphthoquinone-Annelated Phthalocyanines
A. V. Borisov*, N. E. Galanin, and G. P. Shaposhnikov
Ivanovo State University of Chemistry and Technology, pr. Sheremetevskii 7, Ivanovo, 153000 Russia
*e-mail: borisov_av @ mail.ru
Received July 12, 2018; revised July 12, 2018; accepted July 16, 2018
Cross-combination of 4,5-diphenoxyphthalonitrile and 4,5-bis(phenylsulfanyl)phthalonitrile (components A)
with anthraquinone-2,3-dicarboxylic acid imide (component B) in the presence of urea, nickel acetate,
ammonium molybdate and ammonium chloride afforded metal complexes of the corresponding low-symmetry
phthalocyanines such as A3B, AABB and ABAB. Their spectral properties were studied and it was established
that all the complexes in chloroform solutions are associated. The association type depends on the dipole
moments of the molecules.
Keywords: phthalocyanines, low-symmetry phthalocyanines, 1,4-naphthoquinone, nickel complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019