ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 434-440
УДК 547.947.733
СИНТЕЗ, СПЕКТРАЛЬНЫЕ И КООРДИНАЦИОННЫЕ
СВОЙСТВА ГАЛОГЕНЗАМЕЩЕННЫХ
ТЕТРААРИЛПОРФИРИНОВ
© 2019 г. Ю. Б. Ивановаa, *, Н. В. Чижоваa, Ю. В. Хрушковаb,
А. И. Русановb, Н. Ж. Мамардашвилиa
a Институт химии растворов имени. Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
*e-mail: jjiv@yandex.ru
b Ивановский государственный химико-технологический университет, Иваново, Россия
Поступило в Редакцию 20 сентября 2018 г.
После доработки 20 сентября 2018 г.
Принято к печати 27 сентября 2018 г.
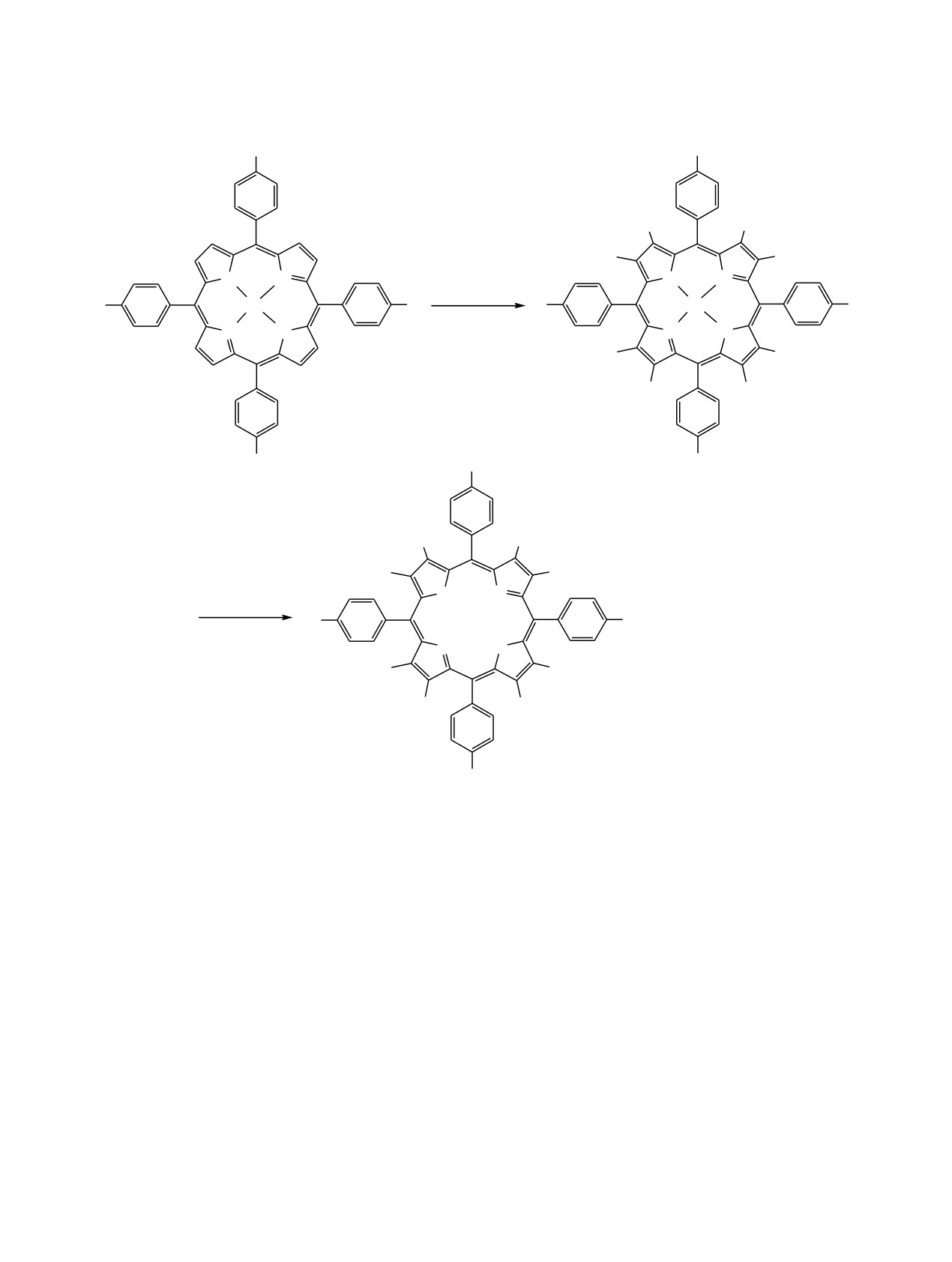
Осуществлен синтез 2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-(4-хлорфенил)порфирина и 2,3,7,8,12,13,17,18-
октахлор-5,10,15,20-тетра-(4-бромфенил)порфирина. Синтезированные соединения идентифицированы
методами электронной абсорбционной, ЯМР
1Н спектроскопии и масс-спектрометрии. Изучены
комплексообразующие свойства полученных порфиринов в системе ацетат цинка(II)-ацетонитрил при
278-298 K. Определены кинетические параметры образования соответствующих цинковых комплексов в
ацетонитриле.
Ключевые слова: 2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-(4-хлорфенил)порфирин, 2,3,7,8,12,13,17,18-
октахлор-5,10,15,20-тетра-(4-бромфенил)порфирин, галогензамещенные тетраарилпорфирины, комплексы
Co(II), комплексы Zn(II)
DOI: 10.1134/S0044460X19030156
Порфирины играют исключительную роль в
родов [8]. Большой интерес представляет способ-
природных биохимических и биофизических
ность
полигалогензамещенных
металлопор-
процессах
[1-6]. Применение порфиринов для
фиринов проявлять каталитическую активность в
решения конкретных практических задач требует
реакциях оксигенирования [9, 10]. Поэтому целью
определенной модификации структуры молекулы с
настоящей работы явилось получение замещенных
целью избирательного усиления или ослабления ее
по пиррольным и фенильным кольцам галоген-
свойства применимо к конкретным изучаемым
замещенных порфиринов и изучение влияния
процессам. Особый интерес представляют синтети-
атомов хлора и брома в тетрафенилпорфирине на
ческие порфирины, содержащие в β-положениях
комплексообразующие свойства молекул.
атомы брома и хлора, которые способствуют
В работе исследованы реакции бромирования
возникновению пространственного искажения
5,10,15,20-тетра-(4-хлорфенил)порфирината Со(II)
макроцикла, в результате которого молекула
1 с помощью N-бромсукцинимида (NBS) в смеси
способна реализовывать ряд недоступных ранее
хлороформ-ДМФА и хлорирования
5,10,15,20-
химических превращений. Свои биологические и
тетра-(4-бромфенил)порфирината Со(II) 2 избытком
каталитические функции порфирины осущест-
N-хлорсукцинимида (NCS) в смеси хлороформ-
вляют в составе комплексов с металлами
[7].
ДМФА и изучены координационные свойства
Особый интерес представляют комплексы пор-
галогензамещенных порфиринов с ацетатом цинка(II)
фиринов с металлами, проявляющими переменную
в ацетонитриле при 278-298 K (cхема 1).
валентность. В частности, порфиринаты кобальта с
высокой эффективностью применяют в катализе
Бромирование Со(II)-порфирина 1 с помощью
анодного окисления SO2 и различных углеводо-
NBS (мольное соотношение
1:25) в смеси
434
СИНТЕЗ, СПЕКТРАЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
435
Схема 1.
R
R
R1
R1
R1
R1
N
N
N
N
NBS, NCS
R
Co
R
R
Co
R
CHCl3, ДМФА
N
N
N
N
R1
R1
R1
R1
R
R
R
R1
R1
R1
R1
NH
N
R
R
HClO4, H2SO4
N HN
R1
R1
R1
R1
R
R1 = Cl, R2 = Br (3, 5); R1 = Br, R2 = Cl (4, 6).
хлороформ-ДМФА (4:1) при комнатной темпера-
образованию 2,3,7,8,12,13,17,18-октабром-5,10,15,20-
туре в течение 6 ч приводит к образованию смеси
тетра-(4-хлорфенил)порфирината Cо(II) 3. В ЭСП
Со(II) и Со(III)-порфиринов. В электронном
полученного соединения в хлороформе присут-
спектре поглощения (ЭСП) полученных соеди-
ствуют полосы с λmax = 564 и 449 нм. В спектре
нений в хлороформе присутствуют полосы с λmax =
ЯМР 1Н порфирината Co(II) 3 в CDCl3 сигналы
634,
584 и
455 нм, характерные как для
орто- и мета-протонов уширены и проявляются в
порфирината Со(II), так и для порфирината Со(III).
слабом поле при 15.10 и 10.08 м. д. Подобные
Полосы исходного комплекса с λmax = 529 и 410 нм
спектры для парамагнитных октаэтилпорфири-
исчезают. В спектре ЯМР 1Н в CDCl3, выделенных
натов Со(II) приведены в работе [11].
из реакционной смеси кобальтпорфиринов, присут-
ствуют сигналы орто- и мета-протонов в области
Хлорирование бромзамещенного кобальтпор-
8.90-7.80 м. д. (конфигурация 3d6) и сигналы в
фирина
2 130-кратным избытком N-хлорсукци-
области
15.10-10.08 м. д. (конфигурация
3d7).
нимида в кипящей смеси хлороформ ДМФА в
Хроматографическая очистка полученных соеди-
течение 10 мин также приводит к образованию
нений на основном оксиде алюминия приводит к
смеси β-октахлорзамещенных Со(II) и Со(III)-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
436
ИВАНОВА и др.
Таблица 1. Данные ЭСП для тетрафенилпорфиринатов
протонированной формы Н4ОСР2+ раствором
Cо(II) 1-4
аммиака получен
2,3,7,8,12,13,17,18-октахлор-
5,10,15,20-тетра-(4-бромфенил)порфирин
6.
В
λ, нм, (lgε)
Комплекс
Растворитель
спектре ЯМР 1Н октахлорзамещенного порфирина
полоса I
полоса Соре
6 в CDCl3 зафиксированы сигналы орто- и мета-
протонов при 8.04 и 7.92 м. д.
1
СHCl3
529 (4.23)
410 (5.32)
2
CHCl3
528 (4.50)
411 (5.57)
В табл. 1 приведены характеристики электрон-
ных спектров поглощения тетрафенилпорфи-
3
CHCl3
564 (4.17)
449 (5.04)
ринатов Со(II). Галогенирование β-положений
ДМФА
567 (4.29)
457 (5.12)
кобальтпорфиринов приводит к батохромному
4
CHCl3
554 (4.16)
438 (5.01)
смещению полос поглощения по сравнению с
ДМФА
557 (4.31)
446 (5.07)
незамещенными комплексами
1 и
2. В масс-
спектрах галогензамещенных Со(II)-порфиринов и
порфиринов. Хроматографическая очистка смеси
их свободных оснований зафиксированы сигналы,
октахлорзамещенных кобальтпорфиринов на
соответствующие молекулярным ионам соеди-
основном оксиде алюминия приводит к
нений 1-6.
образованию 2,3,7,8,12,13,17,18-октахлор-5,10,15,20-
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-тетра-(4-
тетра-(4-бромфенил)порфирината Со(II) 4 и лишь
хлорфенил)пор-фирин и
2,3,7,8,12,13,17,18-
последняя фракция содержит смесь кобальтпор-
октахлор-5,10,15,20-тетра-(4-бромфенил)порфирин
фиринов. В ЭСП соединения
4 в хлороформе
в присутствии кислот и оснований, растворенных в
присутствуют полосы с λmax =
554 и
438 нм
ацетонитриле, могут протонироваться и депрото-
(последняя фракция с λmax = 624, 558 и 445 нм). В
нироваться по внутрициклическим атомам азота
спектре ЯМР
1Н соединения
4 в CDCl3
[12]. Ранее методом спектрофотометрического
присутствуют уширенные сигналы орто- и мета-
титрования [13] были изучены кислотно-основные
протонов при 14.30 и 10.14 м. д.
свойства порфиринов 5 и 6 в системах ацетонитрил-
При обработке раствора комплекса 3 в хлоро-
HClO4 и ацетонитрил-1,8-диазабицикло[5.4.0]-
форме смесью хлорной и серной кислот (4:3) в
ундец-7-ен при 298 K [12]. Результаты этой работы
течение 2 ч образуется дважды протонированная
(в частности, анализ значений констант
форма (Н4ОВР2+) свободного основания. В
протонирования и депротонирования порфиринов)
электронном спектре поглощения Н4ОВР2+ в
показали, что введение атомов брома и хлора в β-
хлороформе присутствуют полосы с максимумами
положения тетрафенилпорфина приводит к
при 746, 499 и 434 нм После удаления минераль-
изменению π-электронной плотности в макроцикле
ных кислот и обработки протонированной формы
и способствует уменьшению основных и, соответ-
Н4ОВР2+ раствором аммиака получен
ственно, повышению кислотных свойств изучен-
2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-(4-хлор-
ных порфиринов по сравнению с незамещенным
фенил)порфирин
5. В спектре ЯМР
1Н бром-
тетрафенилпорфином. По возрастанию кислотности
замещенного порфирина 5 в CDCl3 присутствуют
соединения можно расположить в ряд: H2Br8TPP <
сигналы орто- и мета-протонов при 8.14 и 7.78 м. д.
H2Br8T(4-ClPh)P < H2Cl8T(4-BrPh)P (табл. 2).
В аналогичных условиях при обработке
Порфирины, обладающие выраженными кислот-
комплекса 4 смесью хлорной и серной кислот в
ными свойствами в ацетонитриле, способны
течение 5 ч полного деметаллирования порфири-
координировать катион цинка по двум механизмам
ната кобальта 4 не наблюдается. При повторном
[молекулярному (1) и ионному (2)] в зависимости
добавлении к смеси свободного основания и
от состояния молекулы в растворе [16, 17].
комплекса кобальта в хлороформе хлорной и
Н2P + [Zn(OAc)2(Solv)n-2]
серной кислот (4:3) в течение 3 ч образуется
ZnР + 2НOAc + (n-2)Solv,
(1)
дважды протонированная форма (Н4ОСР2+)
[DBU·2H]2+P2- + [Zn(OAc)2(Solv)n-2]
хлорзамещенного порфирина. В электронном
ZnР + 2HOAc + (n-2)Solv + DBU,
(2)
спектре поглощения Н4ОСР2+ в хлороформе
присутствуют полосы с максимумами при 734, 489
где Н2P
- порфирин, Zn
- катион металла
и 422 нм. После удаления кислот и обработки
координационного центра металлопорфирина, OAc -
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ, СПЕКТРАЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
437
Таблица 2. Параметры электронных спектров поглощения молекулярных и ионных форм порфиринов, их цинковых
комплексов в ацетонитриле и значения соответствующих констант основности и кислотности
λ, нм (lgε)
Форма, соединение
pKb1,2
pKa1,2
полоса Соре
Q-полосы
H2TPP
413 (5.02)
512 (3.56), 546 (3.12), 589 (2.92), 646 (2.96)
19.8 [14]
H3TPP+
413 (5.01)
512 (3.69), 547 (3.42), 660 (3.47)
18.61 [15]
H4TPP2+
441 (5.04)
661 (4.17)
H2Br8TPP
471 (5.14)
646 (4.16), 765 (3.92)
16.60
10.77 [15]
H4Br8TPP2+
490 (5.19)
741 (4.52)
Br8TPP2-29
497 (5.30)
734 (4.80)
H2Br8T(4-ClPh)P (5)
475 (5.09)
646 (4.17), 763 (3.94)
16.06
10.15 [12]
H4Br8T(4-ClPh)P2+
495 (5.21)
743 (4.54)
Br8T(4-ClPh)P2-
500 (4.96)
733 (4,18)
ZnBr8T(4-ClPh)P
472 (5.20)
611 (4.04), 675 (4.10)
H2Cl8T(4-BrPh)P (6)
458 (5.04)
554 (4.07), 623 (4.16), 732 (3.99)
14.76
9.66 [12]
H4Cl8T(4-BrPh)P2+
486 (5.23)
736 (4,56)
Cl8T(4-BrPh)P2-
491 (5.03)
755 (4.32)
ZnCl8T(4-BrPh)P
455 (5.18)
593 (4.18), 647 (4.18)
ацидолиганд (анион-соли), Solv - молекула раство-
Полученные параметры ЭСП для порфиринов,
рителя, n - координационное число катиона металла.
их дважды депротонированных форм и соответству-
ющих металлокомплексов представлены в табл. 2,
Реакции комплексообразования порфиринов 5 и
а кинетические параметры реакции образования
6 проходили при пониженных температурах и
цинковых комплексов порфиринов в системе
только по механизму (1). Комплексы цинка по
ацетонитрил-HClO4 представлены в табл. 3.
механизму
(2) (в присутствии органического
основания) образовывались мгновенно, что затруд-
Введение в β-положения порфириновой моле-
нило определение кинетических параметров реакции.
кулы электроотрицательных заместителей способ-
В электронных спектрах поглощения реагиру-
ствуют искажению плоскости макроцикла, и
ющих систем наблюдались четкие изобестические
степень искажения макроцикла увеличивается с
точки и реакция (1) подчинялась первому порядку
ростом электроотрицательности вводимого атома
по порфирину, о чем свидетельствовал прямо-
[15]. Деформация порфириновой структуры,
линейный характер зависимостей lg(с0H2P/сH2P) от
приводит к частичному обособлению p-электрон-
времени τ(с). Порядок реакции по соли определяли
ных систем пиррольных фрагментов и увеличению
из графических зависимостей как тангенс угла
электронной плотности на третичных атомах азота
наклона прямой lgKэф от lgс[Zn(ОAc)2].
[18, 19]. В свою очередь, электроноакцепторные
Таблица. 3. Кинетические параметры образования цинковых комплексов порфиринов в системе ацетат цинка(II)-
ацетонитрил
[Zn(OAc)2]×103,
kv298×103,
Ea,
ΔS≠,
Порфирин
моль/л
л∙моль-1·с-1
кДж/моль
Дж/(моль·K)
H2TPP[14]
1.84
302±1
70±2
-28± 2
H2Br8TPP [15]
4.50
69±1
56±1
-88±2
H2Br8T(4-ClPh)P
4.50
60±1
65±1
-58±3
H2Cl8T(4-BrPh)P
4.50
48±1
75±2
-26±2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
438
ИВАНОВА и др.
атомы брома и хлора оттягивают электронную
изменением типа заместителя в β- и пара-
плотность с внутрициклических атомов азота,
фенильных положениях тетрафенилпорфина
создавая избыточный положительный заряд на
можно изменять свойства порфириновой молекулы
внутрициклических атомах азота реакционного
в целом, подстраивая их под конкретные цели.
центра. Совокупность этих факторов влияет на
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
скорость образования цинковых комплексов:
наблюдается снижение скорости образования
В работе использовали тетра-(4-хлорфенил)-
цинковых комплексов с изменением электро-
порфирин и тетра-(4-бромфенил)порфирин произ-
отрицательности и числа вводимых заместителей.
водства «Porphychem». Для исследования коорди-
Константа скорости соединения 6 уменьшается по
национных свойств галогензамещенных порфи-
сравнению с константой скорости соединения 5,
ринов использовали ацетонитрил фирмы
«Lab-
при этом наблюдается увеличение энтальпии
Scan». Измерения проводили на спектрофотометре
реакционного процесса. Сравнительный анализ
Cary-100 (Varian) в термостатируемых кюветах на
констант скорости для соединений
5 и
6,
шлифах при 278-298 K не менее трех парал-
незамещенного тетрафенилпорфина (H2TPP) [14] и
лельных опытов при каждой температуре. Коле-
2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетрафенил-
бание температуры не превышало
±0.1 K.
порфирина (H2Br8TPP) [15] (табл. 3) показал, что
Методика эксперимента, препаративная химия и
введение в β-положения макроцикла и пара-
обработки экспериментальных данных подробно
положения фенильных колец атомов брома и хлора
представлены в работах [13, 16]. Растворители -
уменьшает значение скорости реакции комплексо-
диметилформамид, хлороформ, дихлорметан
-
образования kv в
~4-6 раз. Для β-замещенных
марки ХЧ, N-бромсукцинимид, N-хлорсукцинимид
порфиринов значение констант скорости
(Acros), оксид алюминия (Merck), использовали без
увеличивается в ряду H2Br8TPP ˃ H2Br8T(4-ClPh)P >
дополнительной обработки. Масс-спектры получали
H2Cl8T(4-BrPh)P. Известно, что реакционная
на масс-спектрометре MALDI TOF Shimadzu
способность порфиринов-лигандов в реакции
Biotech Axima Confidence (матрица
- дигид-
комплексообразования зависит от взаимодействия
роксибензойная кислота). Cпектры
ЯМР
1Н
третичных атомов азота макроцикла в переходном
(CDCl3) записывали на приборе Bruker AV III-500
состоянии с катионом металла, вступающим в
(внутренний стандарт
- ТМС). Электронные
координационный центр порфирина и чем сильнее
спектры поглощения записывали на спектрофото-
это взаимодействие, тем меньше энергия
метре Cary-100 при комнатной температуре.
активации реакции
(1)
[1]. В нашем случае
увеличение энергии активации реакции комплексо-
5,10,15,20-Тетра-(4-хлорфенил)порфиринат
образования (табл.
3), вероятно, связано с
Co(II) (1). Смесь 0.04 г (0.065 ммоль) тетра-(4-
ослаблением этого взаимодействия вследствие возник-
хлорфенил)порфирина и
0.096 г
(0.65 ммоль)
новения избыточного положительного заряда на
Со(ОAc)2 в 30 мл ДМФА кипятили 30 с, затем
внутрициклических атомах азота макроцикла под
охлаждали. Смесь выливали в воду и прибавляли
влиянием вводимых атомов галогенов.
NaCl. Осадок отфильтровывали, промывали водой,
сушили и хроматографировали на оксиде
Таким образом, синтезированы и идентифици-
алюминия дихлорметаном. Выход
0.033 г
рованы методами электронной абсорбционной,
(0.0407 ммоль, 77%). Спектр ЯМР 1Н, δ, м. д.: 15.82
ЯМР 1Н спектроскопии и масс-спектрометрии
уш. с (8Н, пиррол),13.00 уш. с (8Н, Но), 8.15 д (8Н,
2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-(4-хлор-
Нм, J = 7.6 Гц). Масс-спектр, m/z (Iотн, %): 809.02
фенил)порфирин и
2,3,7,8,12,13,17,18-октахлор-
(97) [M]+ (вычислено для C44H24N4Cl4Cо: 810).
5,10,15,20-тетра-(4-бромфенил)порфирин. Спектро-
фотометрическое определение комплексообразующих
5,10,15,20-Тетра-(4-бромфенил)порфиринат
свойств
2,3,7,8,12,13,17,18-октабром-5,10,15,20-
Co(II) (2) поучали аналогично из 0.04 г (0.043 ммоль)
тетра-(4-хлорфенил)порфирина и 2,3,7,8,12,13,17,18-
тетра-(4-бромфенил)порфирина, 0.075 г (0.43 ммоль)
октахлор-5,10,15,20-тетра-(4-бромфенил)порфирина
Cо(OAc)2 и
40 мл ДМФА. Выход
0.034 г
в системе ацетат цинка(II)-ацетонитрил при 278-
(0.0344 ммоль, 80%). Спектр ЯМР 1Н, δ, м. д.: 15.88
298 K и определение кинетических параметров
уш. с (8Н, пиррол), 12.94 уш. с (8Н, Но), 10.10 уш. с
образования соответствующих цинковых комплек-
(8Н, Нм). Масс-спектр, m/z (Iотн, %): 986.63 (98) [M]+
сов в ацетонитриле позволили сделать вывод, что
(вычислено для C44H24N4Br4Cо: 987.3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ, СПЕКТРАЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
439
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-тетра-
течение
5 ч. Oрганический слой отделяли,
(4-хлорфенил)порфиринат Со(II) (3). К раствору
добавляли 3 мл хлорной и 2.5 мл серной кислот.
0.02 г (0.0247 ммоль) комплекса 1 в смеси 12 мл
Полученную смесь перемешивали
3 ч, затем
хлороформа и 3 мл ДМФА прибавляли 0.11 г
обрабатывали, как описано выше. Целевой продукт
(0.618 ммоль) NBS. Смесь выдерживали при
выделяли хроматографией на оксиде алюминия,
комнатной температуре в течение
6 ч, затем
элюент - дихлорметан-гексан (1:1). Выход 0.01 г
упаривали до минимального объема, прибавляли
(0.0083 ммоль, 54%). ЭСП (MeCN), λmax, нм (lgε):
4 мл ДМФА, воду и NaCl. Осадок отфильтровывали,
732 (3.99), 623 (4.16), 554 (4.07), 458 (5.04). Спектр
промывали водой, сушили и хроматографировали
ЯМР 1Н, δ, м. д.: 8.04 д (8Н, Но, J = 7.7 Гц), 7.92 д
на оксиде алюминия (элюент
- дихлорметан,
(8Н, Нм, J = 7.6 Гц). Масс-спектр, m/z (Iотн, %):
хлороформ). Выход 0.027 г (0.0187 ммоль, 77%).
1207.3 (53) [M]+ (вычислено для C44H18N4Cl8Br4:
Спектр ЯМР 1Н, δ, м. д.: 15.10 уш. с (8Н, Но), 10.07
1205.9).
уш. с (8Н, Нм). Масс-спектр, m/z (Iотн, %): 1440.9 (48)
[M]+ (вычислено для C44H16N4Cl4Br8Cо: 1440.5).
ФОНДОВАЯ ПОДДЕРЖКА
2,3,7,8,12,13,17,18-Октахлор-5,10,15,20-тетра-
Работа выполнена при поддержке Российского
(4-бромфенил)порфиринат Со(II) (4). К раствору
фонда фундаментальных исследований (грант
0.02 г (0.0203 ммоль) комплекса 2 в смеси 10 мл
№ 18-43-370001 р_а, синтеза галогензамещенных
хлороформа и 2.5 мл ДМФА прибавляли 0.165 г
порфиринов и их комплексов с катионом кобальта;
(1.015 ммоль) NСS. Смесь кипятили в течение 4
грант
№18-03-00048_а, исследование координа-
мин, затем прибавляли 1.5 мл ДМФА, 0.165 г NСS
ционных свойств синтезированных порфиринов
и кипятили еще 2 мин. После охлаждения упаривали
лигандов) с использованием оборудования
смесь до минимального объема, прибавляли 3 мл
Верхневолжского регионального центра физико-
ДМФА, воду и NaCl. Осадок отфильтровывали,
химических исследований.
промывали водой, сушили и хроматографировали
на оксиде алюминия (элюент - гексан, дихлор-
КОНФЛИКТ ИНТЕРЕСОВ
метан, хлороформ). Выход 0.015 г (0.0119 ммоль,
60%). Спектр ЯМР 1Н, δ, м. д.: 14.30 уш. с (8Н, Но),
Авторы заявляют об отсутствии конфликта
10.14 уш. с (8Н, Нм). Масс-спектр, m/z (Iотн, %):
интересов.
1263.05 (42) [M]+ (вычислено для C44H16N4Cl8Br4Cо:
1262.7).
СПИСОК ЛИТЕРАТУРЫ
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-тетра-
(4-хлорфенил)порфирин (5). К 0.02 г (0.0139 ммоль)
1. Berezin B.D. Coordination compounds of porphyrins
соединения 3 в 10 мл хлороформа прибавляли 3 мл
and phthalocyanines. New York: John Wiley & Sons,
58%-ной хлорной и 2.5 мл 96%-ной серной кислот.
1981. P. 286.
Смесь перемешивали при комнатной температуре в
2. Senge M.O., MacGowan S.A., O’Brien J.M. // Chem.
течение 2 ч. После завершения реакции органи-
Commun. 2015. Vol. 51. N 96. P. 17031. doi 10.1039/
C5CC06254C
ческий слой отделяли, промывали водой,
3. Xie Y., Hill J.P., Charvet R., Ariga K. // J. Nanosci.
раствором аммиака, снова водой и сушили Na2SO4,
Nanotechnol. 2007. Vol. 7. N 9. P. 2969. doi 10.1166/
затем упаривали. Остаток хроматографировали на
jnn.2007.910
оксиде алюминия дихлорметаном и переосаждали
4. Röder B., Büchner M., Rückmann I., Senge M.O. //
из гексана. Выход 0.014 г (0.0101 ммоль, 72%).
Photochem. Photobiol. Sci.
2010. Vol.
9. N
8.
ЭСП (MeCN), λmax, нм (lgε): 763 (3.94), 646 (4.17),
P. 1152. doi 10.1039/C0PP00107D
474 (5.09), 372 (4.44). Спектр ЯМР 1Н, δ, м. д.: 8.14
5. Porphyrins and Metalloporphyrins / Ed. K.M. Smith.
д (8Н, Но, J = 7.7 Гц), 7.78 д (8Н, Нм, J = 7.6 Гц).
Amsterdam; Oxford; New York: Elsevier Sci., 1975. P. 317.
Масс-спектр, m/z (Iотн, %): 1385 (39) [M]+ (вычислено
6. The Porphyrins / Ed. D. Dolphin. New York; San
для C44H18N4Cl4Br8:1383.7).
Francisco; London: Academic Press, 1979. P. 463.
2,3,7,8,12,13,17,18-Октахлор-5,10,15,20-тетра-
7. Марри Р., Греннер Д., Мейес П., Родуэлл В.
(4-бромфенил)порфирин (6). К 0.02 г (0.0158 ммоль)
Биохимия человека. М.: Мир, 1993. Т. 1. C. 384.
соединения 4 в 10 мл хлороформа прибавляли 3 мл
8. Аскаров К.А., Березин Б.Д., Быстрицкая Е.В.
58%-ной хлорной и 2.5 мл 96%-ной серной кислот.
Порфирины:
спектроскопия,
электрохимия,
Смесь перемешивали при комнатной температуре в
применение. М.: Наука, 1987. C. 384.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
440
ИВАНОВА и др.
9. Da Silva V.S., Teixeira L.I., do Nascimento E., Idemori Y.M.,
2009. № 2. C. 130. doi 10.6060/mhc2009.2.130
De Freitas-Silva G. // Appl. Catal. (A). 2014. Vol. 469.
15. Пуховская С. Г., Иванова Ю. Б., Дао Тхе Нам,
P. 124. doi 10.1016/j.apcata.2013.09.033
Вашурин А.С. // ЖФХ. 2014. T. 88. № 10. С. 1487;
10. De Freitas Castro K.A., de Lima F.H.C., Simoes M.M.Q.,
Pukhovskaya S.G., Ivanova Yu.B., Nam D.T., Vashu-
Neves M.G.P.M.S., Almeida Paz F.A., Mendes R.F.,
rin A.S. // Russ. J. Phys. Chem. 2014. Vol. 88. N 10.
Nakagaki S., Cavaleiro J.A.S. // Inorg. Chim. Acta.
P. 1670. doi 10.1134/S0036024414100288
2017. Vol. 455. P. 575. doi 10.1016/j.ica.2016.05.038
16. Nam D.T., Ivanova Yu.B., Puhovskaya S.G., Kruk M.M.,
11. Ali B.B., Belkhiria M.S., Giorgi M., Nasri H. // Open J.
Syrbu A.S. // RSC Adv. 2015. Vol. 5. N 33. P. 26125.
Inorg. Chem.
2011. Vol.
1. P.
39. doi
10.4236/
doi 10.1039/C5RA01323B
ojic.2011.13006
17. Иванова Ю.Б., Чижова Н.В., Мамардашвили Н.Ж.,
12. Иванова Ю.Б., Пуховская С.Г., Сырбу С.А., Мамар-
Пуховская С.Г. // ЖОХ. 2014. Вып. 5. Т.
84.
дашвили Н.Ж. // Тезисы докл. XIII Междунар. конф.
С. 848; Ivanova Yu.B., Chizhova N.V., Mamarda-
«Проблемы сольватации и комплексообразования в
shvili N.Zh., Pukhovskaya S.G. // Russ. J. Gen. Chem.
растворах», Суздаль, 2018. С. 68.
2014. Vol. 84. P. 939. doi 10.1134/S1070363214050260
13. Иванова Ю.Б., Чурахина Ю.И., Мамардашвили Н.Ж. //
18. Senge M.O. // Chem. Commun. 2006. N 3. P. 243. doi
ЖОХ. 2008. Т. 78. Вып. 4. С. 691; Ivanova Yu.B.,
10.1039/b511389j
Chem. 2008. Vol. 78. N 4. Р. 673. doi 10.1134/
19. Pukhovskaya S.G., Ivanova Yu.B., Dao The Nam,
S1070363208040269
Vashurin A.S., Golubchikov O.A. // J. Porph. Phthal.
14. Андрианов В.Г., Малкова О.В. // Макрогетероциклы.
2015. Vol. 19. Р. 858. doi 10.1142/S1088424615500649
Synthesis, Spectral and Coordination Properties
of Halo-Substituted Tetraaryporphyrines
Yu. B. Ivanovaa*, N. V. Chizhovaa, Yu. V. Khrushkovab,
A. I. Rusanovb, and N. Zh. Mamardashvilia
a G. A. Krestov Institute of Solutions Chemistry of the Russian Academy of Sciences,
ul. Akademicheskaya 1, Ivanovo, 153045 Russia
*e-mail: jjiv@yandex.ru
b Ivanovo State University of Chemical Technology, Ivanovo, Russia
Received September 20, 2018; revised September 20, 2018; accepted September 27, 2018
2,3,7,8,12,13,17,18-Octabromo-5,10,15,20-tetra-(4-chlorophenyl)porphyrin and 2,3,7,8,12,13,17,18-octachloro-
5,10,15,20-tetra-(4-bromophenyl)porphyrin were synthesized. The obtained compounds were identified by
electron absorption, 1H NMR spectroscopy and mass spectrometry data. The complexing properties of the
obtained porphyrins in the zinc(II) acetate-acetonitrile system at 278-298 K was studied. The kinetic parameters
of the formation of the corresponding zinc complexes in acetonitrile were determined.
Keywords:
2,3,7,8,12,13,17,18-octabromo-5,10,15,20-tetra-(4-chlorophenyl)porphyrin,
2,3,7,8,12,13,17,18-
octachloro-5,10,15,20-tetra-(4-bromophenyl)porphyrin, halo-substituted tetraarylporphyrins, Co(II) complexes,
Zn(II) complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019