ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 468-471
ПИСЬМА В
РЕДАКЦИЮ
УДК 547.732
СИНТЕЗ НОВЫХ ПРЕДСТАВИТЕЛЕЙ РЯДА
СУЛЬФОЛАНОПИРАЗОЛИДИНОВ
© 2019 г. И. Е. Ефремоваа, *, А. В. Серебрянниковаа, А. В. Беляковb, Л. В. Лапшинаc
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
*e-mail: kohrgpu@yandex.ru
b Санкт-Петербургский государственный технологический институт (технический университет),
Санкт-Петербург, Россия
c Военно-медицинская академия имени С. М. Кирова, Санкт-Петербург, Россия
Поступило в Редакцию 15 ноября 2018 г.
После доработки 15 ноября 2018 г.
Принято к печати 21 ноября 2018 г.
На основе реакций 2-бензилиден-3-метил-4-нитро-3-тиолен-1,1-диоксида и его замещенных аналогов с
гидразином получены
3-арил-6а-метил-6-нитрогексагидротиено[2,3-d]пиразол-4,4-диоксиды
- новые
представители оригинальных бициклических структур, сочетающих в молекуле конденсированные
пиразолидиновое и сульфолановое кольца. Строение полученных бициклов установлено на основании
комплексного анализа данных ИК, ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC, 1Н-13С HMBC спектроскопии и
квантово-химических расчетов.
Ключевые слова: сульфоланы, пиразолидины, бициклы, гидразин, нуклеофильное присоединение, аза-
реакция Михаэля
DOI: 10.1134/S0044460X19030211
Гетероциклические системы ряда пиразола и его
диастереомера с конфигурацией 3R*,3aR*,6aR*,6R*
гидрированных производных являются ключевыми
(схема 1). Факторами, способствующими образо-
фрагментами алкалоидов
[1], витаминов
[2],
ванию данных бициклов, являются основность
макроциклических структур [3], β-лактамов [4] и
реагента и электронодефицитность субстрата. На
других практически значимых соединений. Среди
основании литературных данных [10-13] для этих
соединений данного ряда довольно редкую и
превращений предложен механизм домино-
труднодоступную группу составляют бициклические
процесса
[8,
9], инициируемого аза-реакцией
производные с кольцами пиразолина и сульфолана,
Михаэля (aza-MIRC).
получаемые на основе
1,3-диполярного цикло-
Учитывая легкость образования целевых
присоединения диазометана к
2-тиолен-1,1-ди-
сульфоланопиразолидинов в реакциях с указанными
оксидам в жестких условиях [5, 6].
N,N-бинуклеофилами, представлялось важным
Новый тип бициклов, в структурах которых
расширить круг реагентов и выявить границы
нитросульфолановое кольцо аннелировано с
пиразолидиновой системой, впервые был получен
Схема 1.
путем взаимодействия
2-бензилиден-3-метил-4-
X
NO2
Me
нитро-3-тиолен-1,1-диоксида и его аналогов [7] с
N
1
6
семикарбазидом
[8] и фенилгидразином
[9],
6a
HN
2
5
3a
4
протекающего в мягких условиях (18°С, этанол
3
SO2
или ДМСО,
24-72 ч). Было установлено, что
R H
сульфоланопиразолидины в этих реакциях
выделяются преимущественно в виде одного
X = C(O)NH2, Ph.
468
СИНТЕЗ НОВЫХ ПРЕДСТАВИТЕЛЕЙ РЯДА СУЛЬФОЛАНОПИРАЗОЛИДИНОВ
469
Схема 2.
что относительная конфигурация данных соединений
Me
NO2
NO2
3R*,3aR*,6R*,6aR*.
Me
H
NH2NH2
N
В целом, установлено, что реакции 2-бензилиден-
1
6a
6
HN
2
5
3-метил-4-нитро-3-тиолен-1,1-диоксидов с гидра-
3a
4
EtOH, 18С
3
SO2
SO2
зином, как и с его производными (фенилгидра-
R
H
R
зином, семикарбазидом), подчиняются общим
16
закономерностям и хорошо согласуются с приня-
712
тым механизмом. Мягкие условия и стереоселек-
тивность взаимодействия, а также высокие выходы
R = Ph (1, 7), 4-BrC6H4 (2, 8), 4-O2NC6H4 (3, 9),
продуктов позволяют рассматривать данные
4-MeC6H4 (4, 10), 4-HOC6H4 (5, 11), фур-2-ил (6, 12).
превращения в качестве препаративно удобного
метода синтеза оригинального типа пиразолидин-
применимости исследуемого взаимодействия.
содержащих бициклов - гексагидро-3Н-тиено[2,3-
С этой целью, а также для подтверждения
d]пиразол-4,4-диоксидов.
принятого механизма и его закономерностей нами
Общая методика синтеза сульфоланопиразол-
изучены реакции 2-бензилиден-3-метил-4-нитро-3-
идинов
7-12. К суспензии
1 ммоль бензил-
тиолен-1,1-диоксидов 1-6 с гидразингидратом.
иденнитротиолен-1,1-диоксида 1-6 в 7 мл этанола
Высокая основность выбранного бинуклеофила
прибавляли 1 ммоль (в случае соединений 4-6 -
способствовала увеличению эффективности
2 ммоль) гидразингидрата. Реакционную смесь пере-
процесса по сравнению с ранее изученными
мешивали при комнатной температуре в течение 5-
реакциями [8, 9], что позволило ввести в данное
24 ч. Образовавшийся осадок отфильтровывали,
взаимодействие соединения
5 и
6 с электро-
промывали этанолом и сушили на воздухе.
нодонорными ароматическими заместителями и
6а-Метил-6-нитро-3-фенилгексагидротиено-
сократить время образования бициклов
7-9 из
[2,3-d]пиразол-4,4-диоксид (7). Время реакции -
более электронодефицитных диенов 1-3 до 5 ч. В
5 ч. Выход 0.23 г (77%), белый порошок, т. пл. 138-
результате был получен довольно широкий ряд
140°C. ИК спектр, ν, см-1: 1134, 1309 (SO2), 1369,
гексагидро-3Н-тиено[2,3-d]пиразол-4,4-диоксидов
1555 (NO2), 1603 (С=С), 3279, 3296 (NH). Спектр
7-12, выделяемых в виде одного диастереомера с
ЯМР 1Н, δ, м. д. (J, Гц): 1.44 с (3H, Ме), 3.56 д. д
выходом до 90% (схема 2).
(1H, C5H2, 2J = 13.4, 3J = 6.1), 3.85 д. д (1H, C5H2,
Данные ИК, ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC,
1Н-13С HMBC спектроскопии подтвердили
принятые структуры бициклов 7-12 и обнаружили
полную аналогию с характеристиками ранее
полученных гексагидро-3Н-тиено[2,3-d]пиразол-
4,4-диоксидов [8, 9].
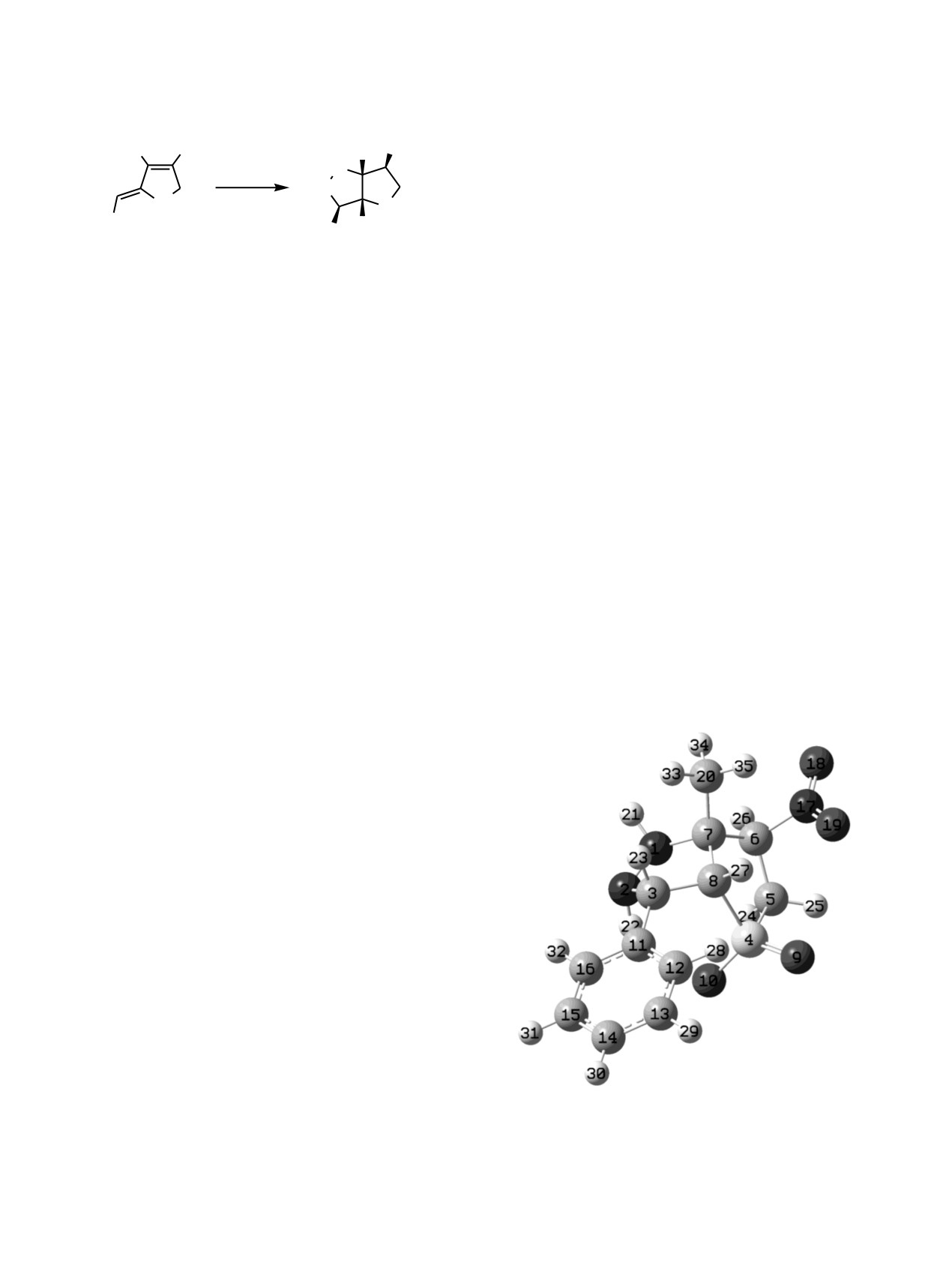
Структурные параметры бицикла
7 и его
модельного N-фенилсодержащего аналога,
исследованного ранее методом РСА [9], получены
на основании квантово-химических расчетов при
помощи программы Gaussian
09
[14] на
теоретическом уровне B3LYP/6-311++G**
[15].
Молекулярная модель, соответствующая оптимизи-
рованному набору геометрических параметров
молекулы 7, показана на рисунке. Расчет силовых
постоянных подтвердил, что минимуму на
поверхности потенциальной энергии соответствуют
структуры соединения 7 и его модельного аналога
с (R)-конфигурацией всех хиральных центров. На
основании полного подобия спектров ЯМР
1Н
Молекулярная модель соединения 7 по результатам
всего ряда бициклов 7-12 логично предположить,
квантово-химических расчетов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
470
ЕФРЕМОВА и др.
2
J = 13.4, 3J = 12.2), 4.30 д (1H, C3aH, 3J = 5.2), 4.65-
20.19 (Me), 53.25 (C5), 68.30 (C3), 74.67 (C3a), 76.66
4.72 м (2Н, С3Н, N2H), 4.09 д (1Н, N1H, 3J = 9.7),
(C6a), 88.49 (C6), 126.53, 128.83, 131.42, 137.11 (Ar).
5.19 д. д (1H, C6H, 3J = 6.1, 3J = 12.2), 7.22-7.44 м
Найдено, %: C 50.49; H 5.25; N 12.96. C13H17N3O4S.
(5H, Ph). Спектр ЯМР 13С, δС, м. д.: 19.49 (Me),
Вычислено, %: C 50.15; H 5.50; N 13.50.
53.26 (C5), 68.48 (C3), 75.00 (C3a), 76.83 (C6a), 88.31
3-(4-Гидроксифенил)-6а-метил-6-нитрогекса-
(C6), 127.36, 128.22, 128.41, 135.33 (Ar). Найдено,
гидротиено[2,3-d]пиразол-4,4-диоксид
(11).
%: C
48.04; H
5.32; N
14.04. C12H15N3O4S.
Время реакции - 24 ч. Выход 0.13 г (43%), белый
Вычислено, %: C 48.48; H 5.09; N 14.13.
:
порошок, т. пл. 143-145°C. ИК спектр, ν, см-1
1123, 1329 (SO2), 1341, 1558 (NO2), 1613 (С=С),
3-(4-Бромфенил)-6а-метил-6-нитрогекса-
3123 (ОН), 3174, 3297 (NH). Спектр ЯМР 1Н, δ, м.
гидротиено[2,3-d]пиразол-4,4-диоксид (8). Время
д. (J, Гц): 1.42 с (3H, Ме), 2.14 уш. с (1Н, ОН), 3.55
реакции - 5 ч. Выход 0.23 г (60%), белый порошок,
д. д (1H, C5H2, 2J = 13.2, 3J = 6.1), 3.83 д. д (1H,
т. пл. 140-143°C. ИК спектр, ν, см-1: 1123, 1318
C5H2, 2J = 13.2, 3J = 12.2), 4.23 д (1H, C3aH, 3J = 5.8),
(SO2), 1368, 1551 (NO2), 1592 (С=С), 3272, 3302
4.55-4.67 м (2Н, С3Н, N2H), 4.06 д (1Н, N1H, 3J =
(NH). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.42 с (3H,
9.2), 5.18 д. д (1H, C6H, 3J = 6.1, 3J = 12.2), 6.74 д и
Ме), 3.57 д. д (1H, C5H2, 2J = 13.4, 3J = 6.1), 3.86 д. д
7.20 д (4H, 4-HOС6Н4, 3J = 8.5). Найдено, %: C
(1H, C5H2, 2J = 13.4, 3J = 12.2), 4.29 д (1H, C3aH, 3J =
45.82; H 4.91; N 13.75. C12H15N3O5S. Вычислено, %:
5.8), 4.60-4.76 м (2Н, С3Н, N2H), 4.10 уш. с (1Н,
N1H), 5.18 д. д (1H, C6H, 3J = 6.1, 3J = 12.2), 7.29 д и
C 46.00; H 4.83; N 13.41.
7.49 д (4H, 4-BrС6Н4, 3J = 8.5). Спектр ЯМР 13С, δС,
6а-Метил-6-нитро-3-(фуран-2-ил)гексагидро-
м. д.: 19.05 (Me), 53.20 (C5), 67.87 (C3), 74.44 (C3a),
тиено[2,3-d]пиразол-4,4-диоксид
(12).
Время
76.51 (C6a), 88.26 (C6), 120.67, 128.65, 131.19, 134.01
реакции - 24 ч. Выход 0.10 г (38%), белый порошок,
(Ar). Найдено,
%: C
38.52; H
4.01; N
11.27.
т. пл. 123-126°C. ИК спектр, ν, см-1: 1134, 1315
C12H14BrN3O4S. Вычислено, %: C 38.31; H 3.75; N
(SO2), 1364, 1552 (NO2), 1614 (С=С), 3279, 3313
11.17.
(NH). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.48 с (3H,
Ме), 3.67 д. д (1H, C5H2, 2J = 13.4, 3J = 6.1), 3.95 д. д
6а-Метил-3-(4-нитрофенил)-6-нитрогекса-
(1H, C5H2, 2J = 13.4, 3J = 12.0), 4.16-4.18 м (1H,
гидротиено[2,3-d]пиразол-4,4-диоксид (9). Время
C3aH), 4.40-4.43 м (2Н, С3Н, N2H), 4.60-4.63 м (1Н,
реакции - 5 ч. Выход 0.30 г (90%), светло-желтый
N1H), 5.25 д. д (1H, C6H, 3J = 6.1, 3J = 12.0), 6.42-
порошок, т. пл. 134-138°C. ИК спектр, ν, см-1:
6.45 м и 7.48-7.50 м (3Н, фуран). Найдено, %: C
1129, 1314 (SO2), 1350, 1558 (NO2), 1601 (С=С),
42.16; H 4.04; N 14.11. C10H13N3O5S. Вычислено, %:
3276, 3315 (NH). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
C 41.81; H 4.56; N 14.63.
1.49 с (3H, Ме), 3.66 д. д (1H, C5H2, 2J = 13.4, 3J =
5.9), 3.95 д. д (1H, C5H2, 2J = 13.4, 3J = 12.2), 4.45 д
Физико-химические исследования выполнены с
(1H, C3aH, 3J = 5.2), 4.82-4.88 м (2Н, С3Н, N2H),
использованием оборудования Центра коллективного
4.20-4.23 м (1Н, N1H), 5.25 д. д (1H, C6H, 3J = 5.9,
пользования Российского государственного
3J = 12.2), 7.64 д и 8.24 д (4H, 4-O2NС6Н4, 3J = 8.5).
педагогического университета им. А.И. Герцена.
Найдено, %: C 42.03; H 4.50; N 15.83. C12H14N4O6S.
Вычислено, %: C 42.10; H 4.12; N 16.37.
Спектры ЯМР 1Н, 13С{1H}, 1Н-13С HMQC, 1Н-
13С HMBC получены на спектрометре Jeol
6а-Метил-3-(4-метилфенил)-6-нитрогекса-
ECX400A с рабочими частотами 399.78 (1H) и 100
гидротиено[2,3-d]пиразол-4,4-диоксид
(10).
(13С) MГц в CD3CN с использованием остаточного
Время реакции - 24 ч. Выход 0.15 г (47%), белый
сигнала недейтерированного растворителя как
порошок, т. пл. 148-151°C. ИК спектр, ν, см-1:
внутреннего стандарта. ИК спектры получены на
1133, 1309 (SO2), 1363, 1552 (NO2), 1614 (С=С),
Фурье-спектрометре Shimadzu IR Prestige-21 в
3274, 3294 (NH). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
таблетках KBr. Элементный анализ выполнен на
1.43 с (3H, Ме), 2.30 с (3Н, MeAr), 3.55 д. д (1H,
анализаторе Eurovector EA 3000 (CHN Dualmode).
C5H2, 2J = 13.4, 3J = 5.8), 3.84 д. д (1H, C5H2, 2J =
13.4, 3J = 12.2), 4.27 д (1H, C3aH, 3J = 5.5), 4.57-4.71
КОНФЛИКТ ИНТЕРЕСОВ
м (2Н, С3Н, N2H), 4.06 д (1Н, N1H, 3J = 9.2), 5.18 д.
д (1H, C6H, 3J = 5.8, 3J = 12.2), 7.14 д и 7.25 д (4H,
Авторы заявляют об отсутствии конфликта
4-МеС6Н4, 3J = 8.5). Спектр ЯМР 13С, δС, м. д.:
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
СИНТЕЗ НОВЫХ ПРЕДСТАВИТЕЛЕЙ РЯДА СУЛЬФОЛАНОПИРАЗОЛИДИНОВ
471
СПИСОК ЛИТЕРАТУРЫ
Rulev A.Yu. // Russ. Chem. Rev. 2011. Vol. 80. N 3.
P. 197. doi 10.1070/RC2011v080n03ABEH004162
1. Tufariello J.J. In: Nitrones in 1,3-Dipolar Cycloaddition
11. Горобец Е.В., Мифтахов М.С., Валеев Ф.А. // Усп.
Chemistry / Ed. A. Padwa. New York: Wiley, 1984.
хим. 2000. Т.
69.
№ 12. С. 1091; Gorobets E.V.,
Vol. 2. P. 83.
Miftakhov M.S., Valeev F.A. // Russ. Chem. Rev. 2000.
2. Confalone P.N., Huie E.M. // Org. React. 1988. Vol. 36.
Vol.
69.
N
12.
P.
1001.
doi
10.1070/
P. 1. doi 10.1002/0471264180.or036.01
RC2000v069n12ABEH000614
3. Asaoka M., Mukuta T., Takei H. // Tetrahedron Lett.
12. Baldwin J.E. // J. Chem. Soc. Chem. Commun.1976.
1981. Vol. 22. N 8. P. 735. doi 10.1016/0040-4039(81)
P. 734.
80137-2
13. Берестовицкая В.М., Ефремова И.Е., Трухин Е.В.,
4. Padwa A., Koehler K.F., Rodriguez A. // J. Org. Chem.
Беркова Г.А. // ЖОрХ. 1993. Т. 29. Вып. 2. С. 368.
1984. Vol. 49. N 2. P. 282. doi 10.1021/jo00176a013
14. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
5. Chuang T.-H., Sharpless K.B. // Helv. Chim. Acta.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
2000. Vol. 83. N 8. P. 1734. doi 1522-2675(20000809)
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
83:8<1734::AID-HLCA1734>3.0.CO;2-E
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
6. Pietrusiewicz K. M., Hozody W., Koprowski M., Cicchi S.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
Goti A., Brandi A. // Phosphorus, Sulfur, Silicon, Relat.
Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A.,
Elem.
1999. Vol.
144. P.
389. doi
10.1080/
Jr., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
10426509908546263
Brothers E., Kudin K.N., Staroverov V.N., Keith T.,
7. Берестовицкая В.М. // ЖОХ. 2000. Т. 70. С. 1512.
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
8. Ефремова И.Е., Серебрянникова А.В., Лапшина Л.В.,
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Гуржий В.В., Берестовицкая В.М. // ЖОХ. 2016.
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
Т. 86. Вып. 3. С. 481; Efremova I.E., Serebryanniko-
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
va A.V., Lapshina L.V., Gurzhiy V.V., Berestovits-
Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochter-
kaya V.M. // Rus. J. Gen. Chem. 2016. Vol. 86. N 3.
ski J.W., Martin R.L., Morokuma K., Zakrzewski V.G.,
P. 622. doi 10.1134/ S1070363216030191
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
9. Berestovitskaya V.M., Efremova I.E., Lapshina L.V., 12.
Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
Serebryannikova A.V., Gurzhiy V.V., Abzianidze V.V. //
Cioslowski J., Fox D.J. Gaussian 09, Revision D01,
Mendeleev Commun.
2015. Vol.
25. P.
191. doi
Gaussian Inc., Wallingford CT, 2013.
10.1016/j.mencom.2015.05.010
15. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. P. 5648.
10. Рулёв А.Ю. // Усп. хим. 2011. Т. 80. № 3. С 211;
doi 10.1063/1.464913
Synthesis of New Sulfolanopyrazolidines
I. E. Efremovaa*, A. V. Serebryannikovaa, A. V. Belyakovb, and L. V. Lapshinac
a Herzen State Pedagogical University of Russia, nab. r. Moiki 48, St. Petersburg, 191186 Russia
*e-mail: kohrgpu@yandex.ru
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, Russia
c S.M. Kirov Military Medical Academy, St. Petersburg, Russia
Received November 15, 2018; revised November 15, 2018; accepted November 21, 2018
3-Aryl-6a-methyl-6-nitrohexahydrothieno[2,3-d]pyrazole-4,4-dioxides, new representatives of original bicyclic
structures combining fused pyrazolidine and sulfolane rings in a molecule, were obtained through the reactions
of 2-benzylidene-3-methyl-4-nitro-3-thiolene-1,1-dioxide and its substituted analogues with hydrazine. Structure
of the bicycles obtained was established on the basis of a comprehensive analysis of IR, 1H, 13C{1H}, 1H-13C
HMQC, 1H-13C HMBC spectroscopy data, and quantum-chemical calculations.
Keywords: sulfolanes, pyrazolidines, bicycles, hydrazine, nucleophilic addition, aza-Michael reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019