ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 472-474
ПИСЬМА В
РЕДАКЦИЮ
УДК 547.333;546.98
ОДНОРЕАКТОРНЫЙ СИНТЕЗ N-2,4-ЕНИНОВЫХ
ЦИКЛИЧЕСКИХ АМИНОВ
© 2019 г. Р. Н. Шахмаев*, А. Ш. Сунагатуллина, А. Н. Васильева, В. В. Зорин
Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450062 Россия
*e-mail: shakhmaevrn@gmail.com
Поступило в Редакцию 25 октября 2018 г.
После доработки 25 октября 2018 г.
Принято к печати 31 октября 2018 г.
Осуществлен стреонаправленный синтез N-2,4-ениновых циклических аминов на основе однореакторного
аминирования индивидуальных изомеров
1,3-дихлорпропена и последующего Pd-Cu-катализируемого
сочетания образующихся винилхлоридов с терминальными алкинами.
Ключевые слова: кросс-сочетание, реакция Соногаширы, винилхлориды, енины
DOI: 10.1134/S0044460X19030223
Сопряженный ениновый фрагмент является
(2Z)- и (2E)-3-хлорпроп-2-ениламинов и алкинов
часто встречающимся мотивом многих биоло-
[18]. В настоящей работе исследована возможность
гически активных веществ, в том числе противо-
однореакторного синтеза подобных структур, вклю-
раковых средств
[1-5]. Ениновые соединения
чающего тандемную последовательность аминиро-
находят широкое применение в синтезе практи-
вание
1,3-дихлорпропена-Pd-Cu-катализируемое
чески важных феромонов
[6], полиенов
[7] и
сочетание.
функционализированных аренов [8].
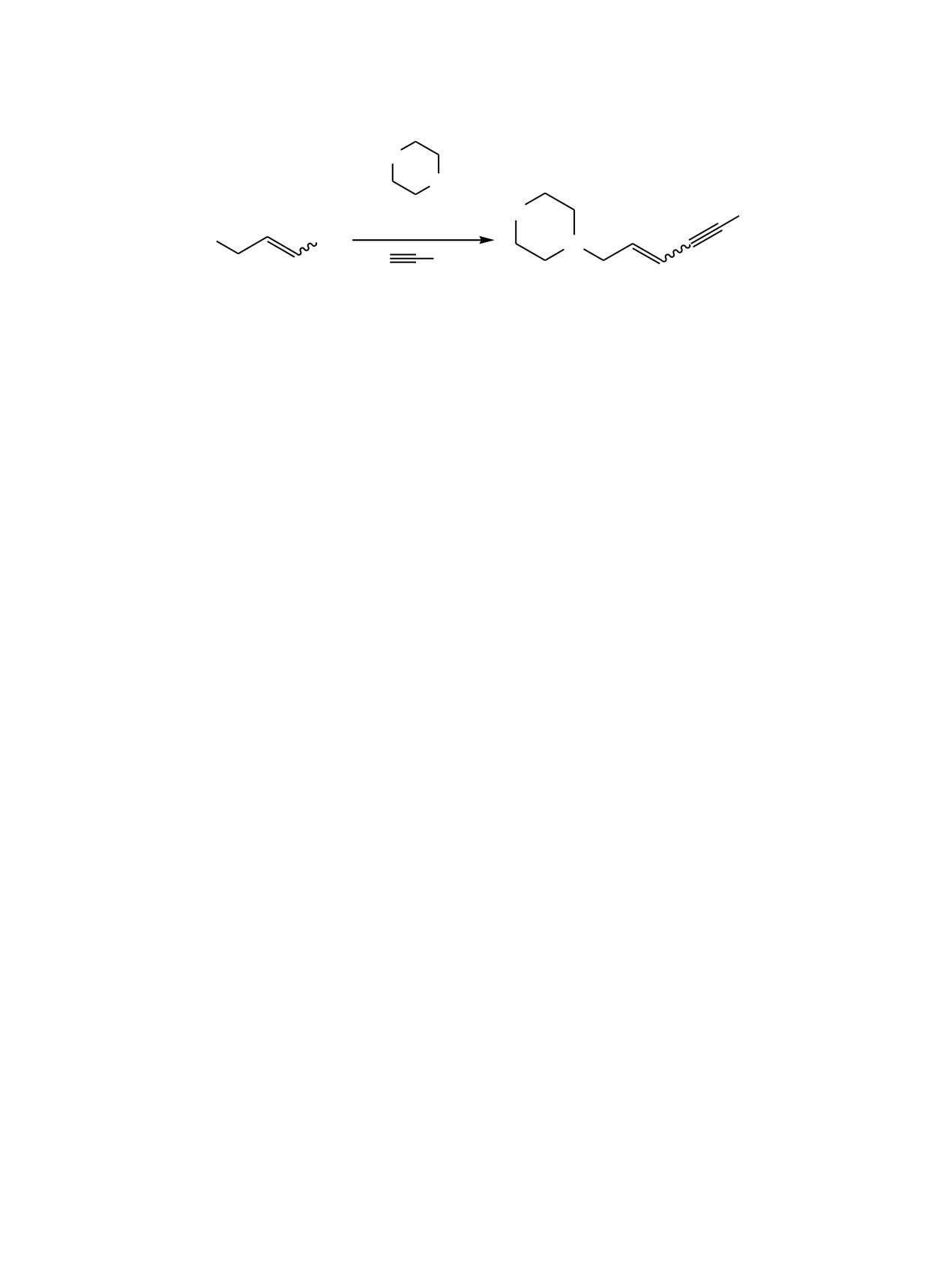
Показано, что взаимодействие (E)-1,3-дихлор-
Среди большого разнообразия известных методов
пропена 1 с морфолином 2 и гекс-1-ином 3 в при-
получения Pd-Cu-катализируемое сочетание винил-
сутствии нитрильного комплекса PdCl2(C3H7CN)2 и
галогенидов или тозилатов и терминальных
CuI приводит к
4-[(2Е)-нон-2-ен-4-ин-1-ил]мор-
алкинов (реакция Соногаширы) представляется
фолину 4 с выходом 78% и изомерной чистотой
наиболее удобным и эффективным методом
99%, соответствующей чистоте исходного
синтеза подобных ненасыщенных систем [9-13].
субстрата
1. При этом морфолин играет роль
Обычно в реакцию вводятся винилиодиды или
аминирующего реагента и основания для депро-
винилбромиды
[14,
15], использование более
тонирования алкина в реакции Соногаширы.
дешевых винилхлоридов ограничено их значи-
Аналогичные превращения с участием индиви-
тельно меньшей активностью в реакциях окисли-
дуальных (E)- и (Z)-изомеров 1,3-дихлорпропена 1,
тельного присоединения с комплексами Pd(0) [16].
аминов (пиперидина 5 и морфолина 2) и алкинов
Известные подходы, направленные на вовлечение
(гекс-1-ина 3, 3,3-диметилбут-1-ина 6 и 2-метилбут-
винилхлоридов в реакцию Соногаширы, основаны
3-ин-2-ола 7) также протекают с высоким выходом
на использовании слабосвязанных комплексов
соответствующих енинов
8-10 и сохранением
палладия, способствующих значительному ускоре-
конфигурации алкенового фрагмента (схема 1).
нию реакции на лимитирующей стадии окисли-
Структура и стереохимическая чистота синте-
тельного присоединения [17].
зированных соединений подтверждены данными
Ранее мы сообщали о стереонаправленном
спектроскопии ЯМР
1H и 13С и хромато-масс-
синтезе
(2Е,4)- и
(2Z,4)-ениновых циклических
спектрометрии, а также ГЖХ-анализом на высоко-
аминов путем Pd-Cu-катализируемого сочетания
эффективной капиллярной колонке. КССВ виниль-
472
ОДНОРЕАКТОРНЫЙ СИНТЕЗ N-2,4-ЕНИНОВЫХ ЦИКЛИЧЕСКИХ АМИНОВ
473
Схема 1.
X
NH
2, 5
X
R
PdCl2(C3H7CN)2,CuI
Cl
Cl
N
R
3, 6, 7
(E)- или (Z)-1
(E)-4, 10
(Z)-8, 9
X = O, R=C4H9 (2-4, 8); X = C, R = C(CH3)3 (5, 6, 9); X = C, R = C(CH3)2OH (5, 7, 10).
ных атомов водорода енинов 4, 10 (15.7-15.9 Гц) и
137.83 (С2). Масс-спектр, m/z (Iотн, %): 164 (99), 123
8, 9 (10.7-11.0 Гц) свидетельствует соответственно
(98), 120 (90), 112 (61), 91 (55), 79 (82), 77 (83), 56
о трансоидной и цисоидной конфигурации двойной
(100), 55 (56), 41(69).
связи.
4-[(2Z)-Нон-2-ен-4-ин-1-ил]морфолин (8) получали
Таким образом, однореакторный синтез,
аналогично. Выход 0.149 г (80%). Спектр ЯМР 1Н,
включающий региоселективное нуклеофильное
δ, м. д.: 0.91 т (3Н, CH3, J = 7.3 Гц), 1.36-1.53 м
замещение по аллильному положению
1,3-
(4Н, С7Н2, С8Н2), 2.32 т (2Н, С6Н2, J = 6.9 Гц), 2.48
дихлорпропена (без изомеризации хлоралкенового
уш. с (4Н, СН2N), 3.23 д (2Н, C1H2, J = 7.0 Гц), 3.71
фрагмента и аллильной перегруппировки) с
т (4Н, СН2О, J = 4.7 Гц ), 5.62 д (1Н, С3Н, Jцис =
последующей
стереоселективной
реакцией
10.7 Гц), 5.87 д. т (1Н, C2H, Jцис = 10.7, 7.0 Гц).
Соногаширы по его винильному положению может
Спектр ЯМР 13С, δС, м. д.: 13.50 (С9), 19.09 (С6),
служить эффек-тивным путем получения (2Е,4)- и
21.88 (С8), 30.69 (С7), 53.44 (2СН2N), 57.51 (С1),
(2Z,4)-ениновых циклических аминов.
66.82 (2СН2О), 76.58 (С4), 96.25 (С5), 113.13 (С3),
, %): 164 (75), 123
136.79 (С2). Масс-спектр, m/z (Iотн
4-[(2Е)-Нон-2-ен-4-ин-1-ил]морфолин
(4).
(84), 120 (79), 106 (58), 91 (61), 79 (90), 77 (97), 56
Смесь 0.1 г (0.9 ммоль) (E)-1,3-дихлорпропена 1 и
(77), 42 (67), 41(100).
1 мл морфолина перемешивали в течение 1 ч при
1-[(2Z)-6,6-Диметилгепт-2-ен-4-ин-1-ил]пипе-
комнатной температуре, затем добавляли 10.3 мг
ридин (9) получали аналогично. Выход 0.142 г
(0.054 ммоль) CuI, 8.5 мг (0.027 ммоль) PdCl2
(77%). Спектр ЯМР 1Н, δ, м. д.: 1.24 с (9Н, СН3),
(С3H7CN)2 и перемешивали 0.5 ч в атмосфере
1.39-1.46 м (2Н, СН2), 1.55-1.60 м (4Н, СН2), 2.41
аргона. После добавления 0.082 г (1 ммоль) гекс-1-
уш. с (4Н, СН2N), 3.19 д (2Н, С1Н2, J = 7.0 Гц), 5.58
ина 3 реакционную смесь перемешивали еще 3 ч
д (1Н, С3Н, Jцис = 10.7 Гц), 5.91 д. т (1Н, С2Н, Jцис =
при комнатной температуре, затем обрабатывали
10.7, 7.0 Гц). Спектр ЯМР 13С, δС, м. д.: 24.18 (СH2),
диэтиловым эфиром
(5 мл) и водой
(2 мл).
25.89
(2СH2),
28.08 (С6),
30.95
(3СH3),
54.42
Органический слой отделяли, водный слой экстра-
(2СН2N), 57.88 (С1), 75.37 (С4), 103.88 (С5), 112.10
гировали диэтиловым эфиром (3×5 мл). Объеди-
(С3), 138.07 (С2). Масс-спектр, m/z (Iотн, %): 190
ненные органические экстракты промывали водой,
(76), 148 (100), 121 (67), 110 (53), 91 (44), 79 (27),
сушили MgSO4 и концентрировали. Сырой продукт
77 (28), 55 (30), 42 (30), 41(53).
очищали методом колоночной хроматографии
(SiO2, гексан-этилацетат,
9:1). Выход
0.146 г
(5E)-2-Метил-7-пиперидин-1-илгепт-5-ен-3-
(78%). Спектр ЯМР 1Н, δ, м. д.: 0.89 т (3Н, CH3, J =
ин-2-ол (10) получали аналогично. Выход 0.138 г
7.3 Гц), 1.36-1.52 м (4Н, С7Н2, С8Н2), 2.28 т (2Н,
(74%). Спектр ЯМР 1Н, δ, м. д.: 1.39-1.44 м (2Н,
С6Н2, J = 6.9 Гц), 2.43 уш. с (4Н, СН2N), 3.00 д (2Н,
СН2), 1.51 с (6Н, СН3) 1.54-1.60 м (4Н, СН2), 2.35
C1H2, J = 6.7 Гц), 3.69 т (4Н, СН2О, J = 4.6 Гц), 5.63
уш. с (4Н, СН2N), 2.98 д (2Н, С1Н2, J = 6.7 Гц), 5.60
д (1Н, С3Н, Jтранс = 15.9 Гц), 5.99-6.05 м (1Н, C2H).
д (1Н, С3Н, Jтранс = 15.9 Гц), 6.21 д. т (1Н, С2Н,
Спектр ЯМР 13С, δС, м. д.: 13.54 (С9), 18.98 (С6),
Jтранс = 15.9, 6.7 Гц). Спектр ЯМР 13С, δС, м. д.:
21.89 (С8), 30.71 (С7), 53.47 (2СН2N), 60.88 (С1),
24.05 (СH2),
25.52
(2СH2),
31.46
(2СH3),
54.38
66.85 (2СН2О), 78.33 (С4), 90.66 (С5), 113.65 (С3),
(2СН2N), 61.36 (С7), 64.91 (С2), 79.95 (С4), 93.99
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
474
ШАХМАЕВ и др.
(С3), 111.94 (С5), 140.54 (С6). Масс-спектр, m/z (Iотн,
6. Шахмаев Р.Н., Сунагатуллина А.Ш., Зорин В.В. //
%): 192 (37), 148 (58), 134 (35), 121 (67), 110 (73),
ХПС. 2015. № 1. C. 111; Shakhmaev R.N., Sunaga-
tullina A.Sh., Emyshaeva N.V., Zorin V.V. // Chem. Nat.
84 (44), 55 (42), 43 (100), 42(37), 41(42).
Compd. 2015. Vol. 51. N 1. P. 127. doi 10.1007/s10600-
Спектры ЯМР 1Н и 13С записаны в CDCl3 на
015-1217-8
приборе AV-500 [500.13 (1H) и 125.76 МГц (13C)].
7. Crousse B., Mladenova M., Ducept P., Alami M.,
Хромато-масс-спектральный анализ проводили на
Linstrumelle G. // Tetrahedron. 1999. Vol. 55. P. 4353.
приборе GCMS-QP2010S Shimadzu (электронная
doi 10.1016/S0040-4020(99)00123-4
ионизация при 70 эВ, диапазон детектируемых
8. Saito S., Yamamoto Y. // Chem. Rev. 2000. Vol. 100.
масс 33-500 Да), капиллярная колонка HP-1MS
P. 2901. doi 10.1021/cr990281x
(30 м
×
0.25 мм
×
0.25 мкм), температура
9. Negishi E.I., Anastasia L. // Chem. Rev. 2003. Vol. 103.
испарителя - 300°C, температура ионизационной
P. 1979. doi 10.1021/cr020377i
камеры
-
200°C, режим программирования
10. Chinchilla R., Najera C. // Chem. Rev. 2007. Vol. 107.
температуры от 50 до 300°C со скоростью 10 град/
P. 874. doi 10.1021/cr050992x
мин, газ-носитель - гелий (1.1 мл/мин).
11. Doucet H., Hierso J.-C. // Angew. Chem. Int. Ed. 2007.
Vol. 46. N 6. P. 834. doi 10.1002/anie.20060276
ФОНДОВАЯ ПОДДЕРЖКА
12. Zhou Y., Zhang Y., Wang J. // Org. Biomol. Chem.
Работа выполнена при финансовой поддержке
2016. Vol. 14. P. 6638. doi 10.1039/c6ob00944a
Министерства образования и науки России в
13. Шахмаев Р.Н., Сунагатуллина А.Ш., Абдуллина Э.А.,
рамках базовой части государственного задания в
Зорин В.В. // ЖОрХ. 2017. Т. 53. Вып. 11. С. 1668;
Shakhmaev R.N., Sunagatullina A.Sh., Abdullina E.A.,
сфере научной деятельности (№ 4.6451.2017/8.9).
Zorin V.V. // Russ. J. Org. Chem. 2017. Vol. 53. N 11.
КОНФЛИКТ ИНТЕРЕСОВ
P. 1705. doi 10.1134/S1070428017110173
14. Metal-Catalyzed Cross-Coupling Reactions and More /
Авторы заявляют об отсутствии конфликта
Eds A. de Meijere, S. Bräse, M. Oestreich. New-York:
интересов.
Wiley-VCH, 2014. 1576 p.
СПИСОК ЛИТЕРАТУРЫ
15. Сунагатуллина А.Ш., Шахмаев Р.Н., Зорин В.В. //
ЖОХ. 2012. Т. 82. Вып. 7. С. 1216; Sunagatullina A.Sh.,
1. Dembitsky V.M., Levitsky D.O., Gloriozova T.A.,
Shakhmaev R.N., Zorin V.V. // Russ. J. Gen. Chem.
Poroikov V.V. // Nat. Prod. Commun. 2006. Vol. 1. P. 773.
2012. Vol.
82. N
7. P.
1313. doi
10.1134/
2. Mejia E.J., Magranet L.B., De Voogd N.J., TenDyke K.,
S1070363212070249
Qiu D., Shen Y.Y., Zhou Z., Crews P. // J. Nat. Prod.
16. Homogeneous catalysis for unreactive bond activation /
2013. Vol. 76. P. 425. doi 10.1021/np3008446
Ed. Z.-J. Shi. Hoboken: John Wiley & Sons, 2014. 648 p.
3. Nicolaou K.C., Dai W.M. // Angew. Chem. Int. Ed.
1991. Vol. 30. P. 1387. doi 10.1002/anie.199113873
17. Alami M., Crousse B., Ferri F. // J. Organomet. Chem.
4. Сунагатуллина А.Ш., Шахмаев Р.Н., Зорин В.В. //
2001. Vol. 624. P. 114. doi 10.1016/S0022-328X(00)
ЖОX. 2013. Т. 83. Вып. 1. С. 156; Sunagatullina A.S.,
00909-8
Shakhmaev R.N., Zorin V.V. // Russ. J. Gen. Chem.
18. Сунагатуллина А.Ш., Шахмаев Р.Н., Зорин В.В. //
2013.
Vol.
83.
N 1. P.
148. doi
10.1134/
ЖОрХ. 2013. T. 49. Вып. 5. C. 747; Sunagatullina A.S.,
S1070363213010313
Shakhmaev R.N., Zorin V.V. // Russ. J. Org. Chem.
5. Nussbaumer P., Leitner I., Mraz K., Stutz A. // J. Med.
2013. Vol.
49. N 5. P.
730.
doi
10.1134/
Chem. 1995. Vol. 38. P. 1831. doi 10.1021/jm00010a029
S1070428013050163
One-Pot Synthesis of N-2,4-Enyne Cyclic Amines
R. N. Shakhmaev*, A. Sh. Sunagatullina, A. N. Vasilyeva, and V. V. Zorin
Ufa State Petroleum Technological University, st. Kosmonavtov 1, Ufa, 450062 Russia
*e-mail: shakhmaevrn@gmail.com
Received October 25, 2018; revised October 25, 2018; accepted October 31, 2018
Stereoselective synthesis of N-2,4-enynic cyclic amines was performed by one-pot amination of individual
isomers of 1,3-dichloropropene and the subsequent Pd-Cu-catalyzed cross-coupling of the formed vinyl
chlorides with terminal alkynes
Keywords: cross-coupling reaction, Sonogashira reaction, vinyl chlorides, enynes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019