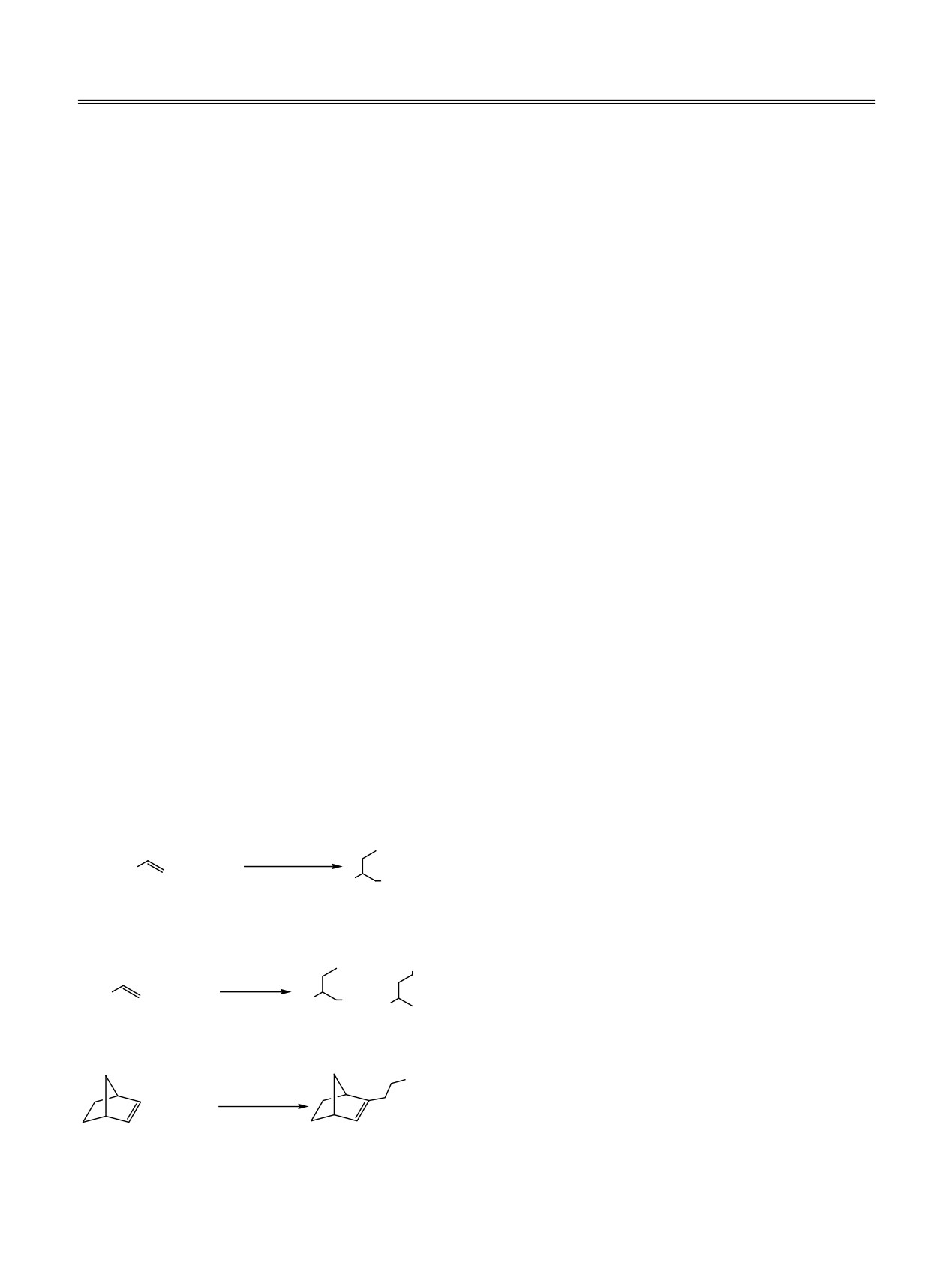ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 504-510
УДК 547.8
К ВОПРОСУ О МЕХАНИЗМЕ ДВУХМАРШРУТНОЙ
РЕАКЦИИ 1-АЛКЕНОВ С EtMgX, КАТАЛИЗИРУЕМОЙ TaCl5
© 2019 г. Р. М. Султановa, *, Ф. Ш. Хафизовa, И. В. Озденa, Н. В. Шутовa,
Д. Ш. Сабировb, У. М. Джемилевb
a Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450062 Россия
*e-mail: sultanov55@mail.ru
b Институт нефтехимии и катализа Российской академии наук, Уфа, Россия
Поступило в Редакцию 25 октября 2018 г.
После доработки 25 октября 2018 г.
Принято к печати 1 ноября 2018 г.
Изучена реакция 1-алкенов с C2D5MgBr в присутствии TaCl5. На основании распределения дейтериевой
метки в алкильной цепи региоизомерных магнийорганических соединений предложена вероятная схема
механизма их формирования в качестве ключевых интермедиатов 3-замещенных танталоциклопентанов.
Методом DFT выполнен расчет энергетического профиля реакций карбомагнирования и β-восстано-
вительного магнезаэтилирования 1-алкенов.
Ключевые слова: 1-алкены, карбомагнирование, β-восстановительное магнезаэтилирование, тантало-
циклопентаны, дейтеромеченые магнийорганические соединения, DFT расчеты
DOI: 10.1134/S0044460X19040024
Ранее нами было показано, что при замене
выходом ~98% (схема 2) [3]. Норборнены также
катализатора Cp2ZrCl2 в реакции карбомагниро-
реагируют с EtMgX в присутствии катализатора
вания 1-алкенов с помощью EtMgX, приводящей к
TaCl5 с высокой регио- и стереоселективностью,
получению исключительно
2-этил-1-магнийорга-
образуя только продукт β-восстановительного
нических соединений (схема 1) [1, 2], на TaCl5
магнезаэтилирования (схема 3) [4].
наблюдается образование региоизомерной смеси 2-
В развитие этих исследований и с целью
этил- и 3-метил-1-магнийорганических соединений
изучения механизма образования молекул
в соотношении
5:4 соответственно с общим
региоизомерных магнийорганических соединений
с участием комплексов тантала и выяснения
Схема 1.
направления гидридного переноса в промежу-
Cp2ZrCl2
точных металлокомплексах, ответственных за
+ EtMgX
R
образование
целевых
Mg-органических
эфир (ТГФ) R
MgX
20-25°С
соединений, мы на примере модельной реакции
исследовали взаимодействие 1-гексена с C2D5MgBr
Схема 2.
в присутствии катализатора ТаСl5.
MgX
Реакция 1-гексена и C2D5MgBr в присутствии
20°С, 3 ч
+
ТаСl5
(1-гексен:С2D5MgBr:TaCl5
=
100:150:5),
R
+ EtMgX
TaCl5
R MgX
проводимая в ТГФ в течение 4 ч при 20°С, дает
R
частично дейтерированные магнийорганические
соединения 1 и 2 в соотношении 55:45 с общим
Схема 3.
выходом ~ 95% (схема 4).
MgEt
При разложении продуктов реакции 1 и 2 8%-
20°С, 5 ч
+ Et2Mg
ным раствором HCl образуются частично
TaCl5 (5 мол%),
ТГФ
дейтерированные углеводороды 3 и 4. Окисление
504
К ВОПРОСУ О МЕХАНИЗМЕ ДВУХМАРШРУТНОЙ РЕАКЦИИ
505
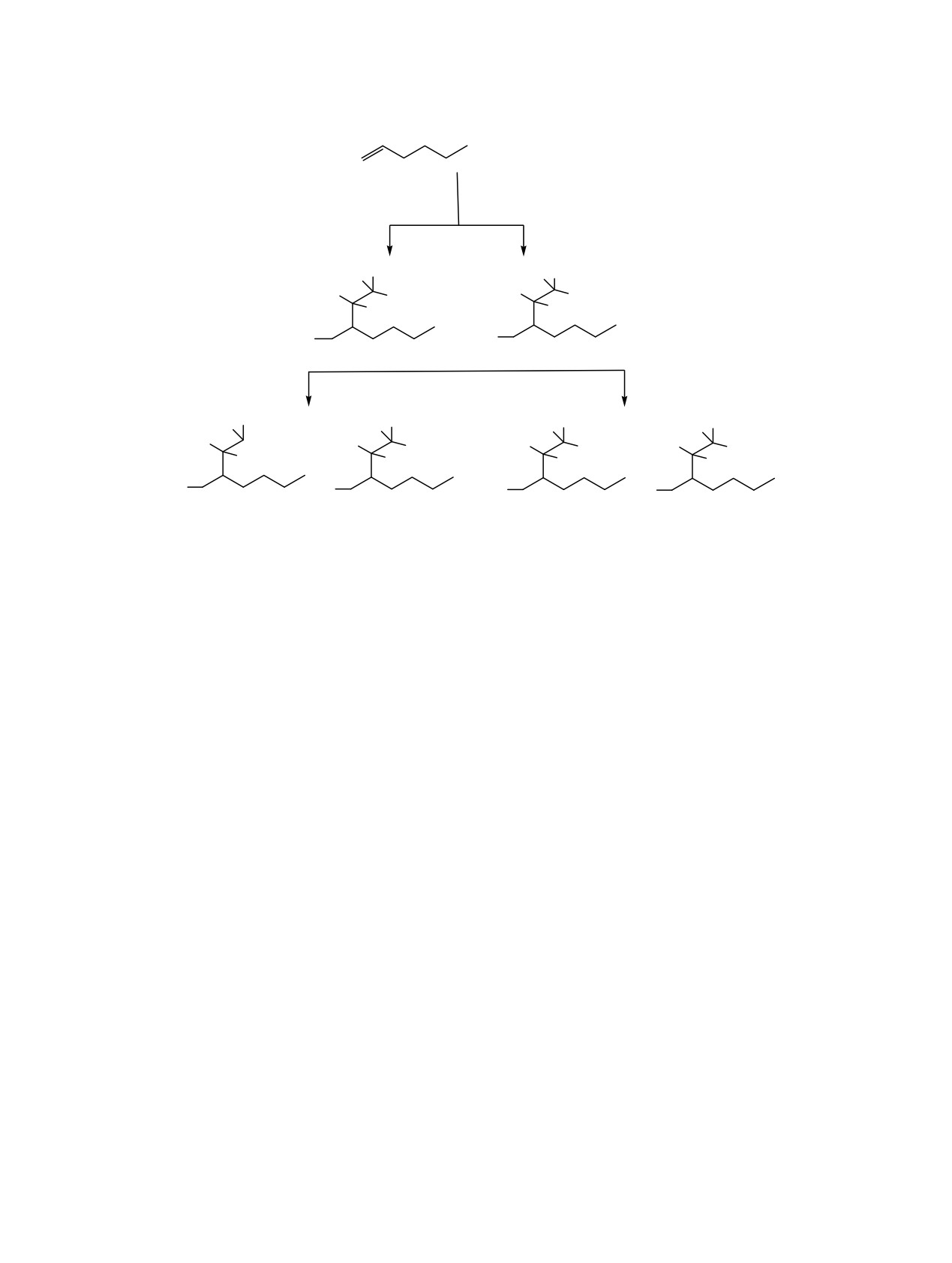
Схема 4.
+ C2D5MgBr
20οC, 4 ч
ТаСl5, ТГФ
D
MgBr
D
D
D
D
D
D
+
D
D
BrMg
D
1
2
H3O+
O2
D
H
D
OH
D
D
D
D
D
D
D
D
1 D
D
D
D
2
+
+
D
D
D
D
3
5
7
8
H
4
6
D
HO
D
5
6
3
4
реакционной массы молекулярным кислородом и
Мультиплетные сигналы при 9.58 и 22.58 м. д.,
последующий гидролиз приводят к образованию
которые наблюдались в спектре ЯМР
13С
региоизомерных частично дейтерированных спиртов
соединения 5, но не проявлялись в спектре 13С-
5 и 6, в которых гидроксильные группы находятся
DEPTQ, были отнесены к CD3 и CD2 атомам
у разных атомов углерода, связанных в исходных
углерода. Атом углерода при 9.58 м. д. испытывает
магнийорганических соединениях с MgBr-группой.
значительный изотопный эффект за счет трех
атомов дейтерия. Сигнал при
64.78 м. д.
Структура соединений
1 и
2 доказана с
соответствует СН2ОН-фрагменту, соединенному с
помощью спектров ЯМР продуктов их гидролиза и
метиновым углеродным атомом (41.60), на что
окисления, а также данных ИК спектроскопии и
указывают кросс-пики 64.78/1.46 и 41.60/3.44 в
масс-спектрометрии. Так, мультиплет при 59.74 м.
спектре НМВС. Сигналы при 23.03, 29/07 и 30/07
д. в спектре ЯМР 13С соединения 6 соответствует
характерны для метиленовых групп углеводо-
углеродному атому СD2OH-группы, а сигнал при
родного фрагмента, как и сигнал при 13.95 м. д.
21.99 м. д. принадлежит атому углерода СD2-
типичен для метильной группы.
фрагмента в исходном спирте 6. В спектре ЯМР 13С
в режиме DEPTQ (Distortionless Enhancement by
Анализ структуры частично дейтерированных
Polarization Transfer Including the Detection of
углеводородов 3, 4 и спиртов 5, 6, полученных из
Quaternary Nuclei) данные сигналы не обнаружены,
соответствующих магнийорганических соединений
что указывает на отсутствие протонов при
1,
2, а также имеющиеся данные по синтезу,
углеродных атомах упомянутых выше групп.
превращениям и применению комплексов тантала
Триплетный сигнал при
19.15 м. д. с
позволили предложить вероятную схему взаимо-
соотношением интенсивностей 1:1:1 соответствует
действия олефинов с C2D5MgBr, катализируемого
СН2D-группе
(1JCD
=
19.0 Гц) соединенной с
TaCl5 (схема 5) [5-12]. Согласно схеме 5, на первой
метиновым углеродным атомом (41.60 м. д.). На
стадии происходит алкилирование исходного TaCl5
это указывает также кросс-пик 41.60/0.84 в спектре
до (C2D5)2TaCl3
7, который за счет реакции
НМВС. Три сигнала при 23.03, 29.07 и 30.07 м. д. в
внутримолекулярного β-отщепления молекулы
спектре ЯМР
13С соединения
6 отнесены к
С2D4 и выделения газообразного C2D6 дает
метиленовым атомам углерода в углеводородном
комплекс 8. Последний координирует молекулу
фрагменте молекулы, тогда как сигнал при 13.95 м. д.
исходного 1-алкена, превращаясь в диолефиновый
принадлежит метильному атому углерода.
комплекс
9, который за счет окислительного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
506
CУЛТАНОВ и др.
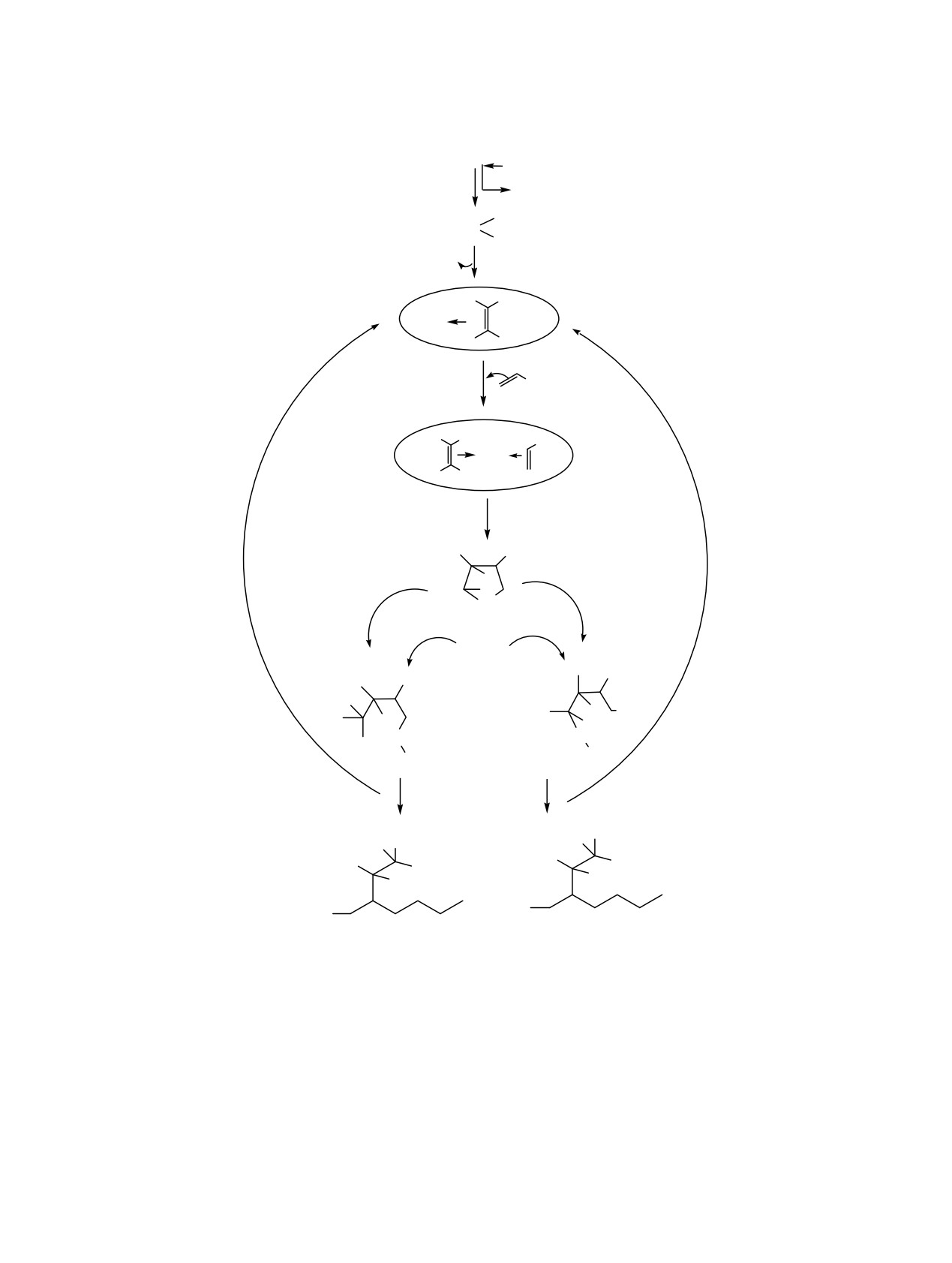
Схема 5.
TaCl5
2 C2D5MgBr
[Ta] = TaCl3
2 Mg Br
R = Bun
C2D5
[Ta]
7
C
2D5
C2D6
D D
8
[Ta]
D D
R
D D
R
9
[Ta]
D D
D
R
D
D D
a
б
[Ta]
10
C2D5MgBr
D
R
R
D
D
D
D
MgBr
BrMg
D
D
[Ta]
[Ta]
D
C2D5
11
C
2D5
12
D
MgBr
D
D
D
D
D
D
D
D
BrMg
D
2
1
присоединения двух молекул олефина к централь-
становительного магнезаэтилирования 1-алкена 1 и
ному атому катализатора образует частично
2 с высокими выходами. Согласно предложенному
дейтерированный
3-алкилзамещенный тантало-
механизму реакции, ключевыми интермедиатами
циклопентан трихлорид
10, содержащий атомы
реакции
1-алкенов с этильными производными
дейтерия при углеродных атомах С4 и С5
магния в присутствии ТаСl5 являются β-заме-
металлоцикла 10. Последующая атака связей Та-С2
щенные танталоциклопентаны А. Для выяснения
и Та-С5 в соединении 10 исходным С2D5MgBr
особенностей этой двухмаршрутной каталити-
приводит к формированию практически равной
ческой реакции с участием С2D5MgBr проведено
смеси продуктов карбомагнирования и β-вос-
квантово-химическое исследование строения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
К ВОПРОСУ О МЕХАНИЗМЕ ДВУХМАРШРУТНОЙ РЕАКЦИИ
507
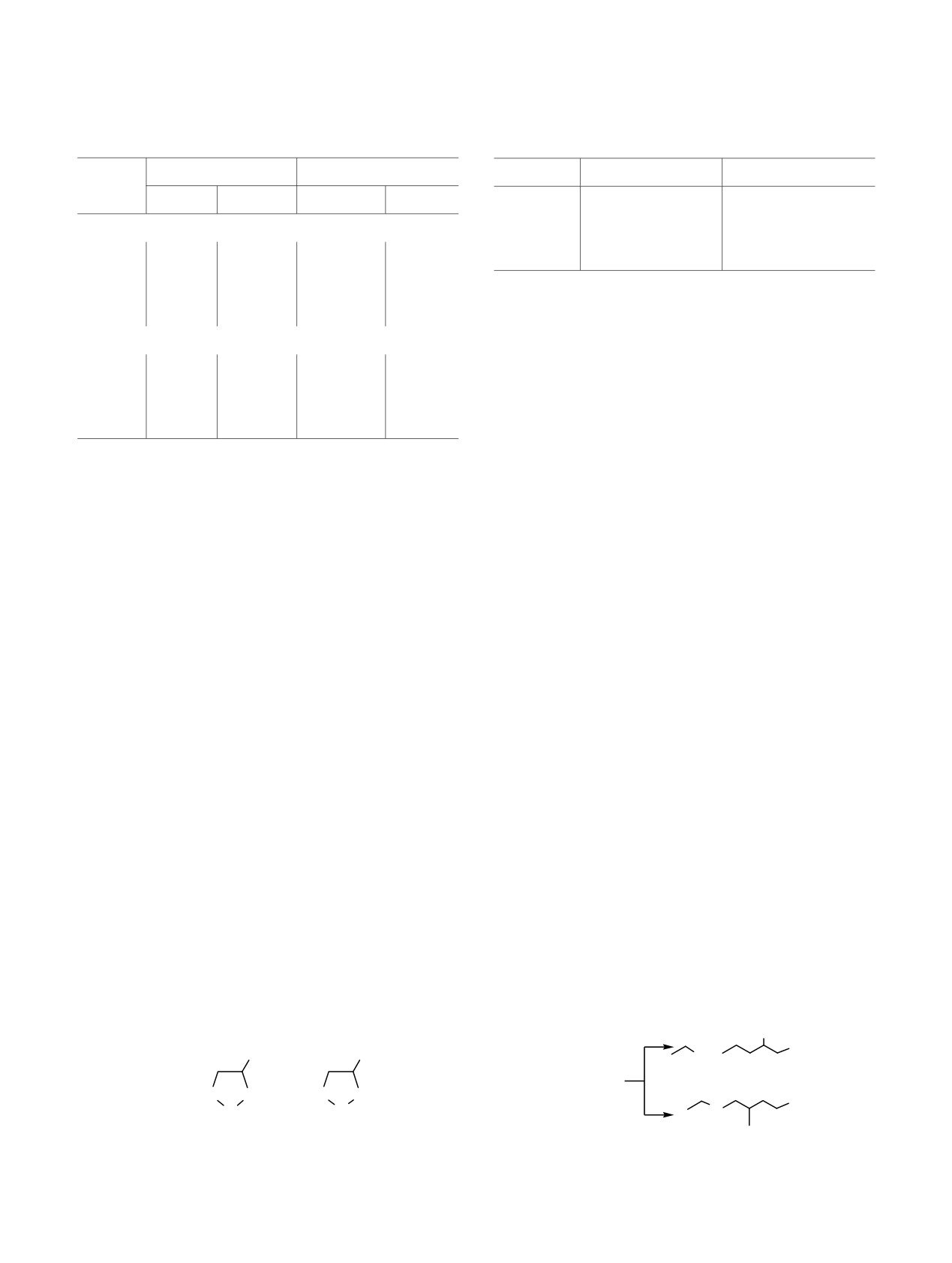
Таблица 1. Длины и порядок связей углерод-метал в
Таблица 2. Рассчитанные тепловые эффекты реакции
интермедиатах А и Б
между С и EtMgCl
Длина связи, Å
Порядок связи
R
∆H°r1, кДж/моль
r2
, кДж/моль
R
C2-M
C5-M
C2-M
C5-M
Me
3.1
5.2
А (M = Ta)
Bu
14.8
20.0
Me
2.177
2.192
0.92
0.95
Hex
29.9
32.0
Bu
2.175
2.190
0.89
0.95
связи С2-Zr при взаимодействии комплекса Б с
Hex
2.175
2.191
0.90
0.95
реактивами Гриньяра [1, 2].
Б (M = Zr)
Таким образом, связи углерод-металл в ком-
Me
2.313
2.308
0.55
0.68
плексах тантала А должны проявлять одинаковую,
а в комплексах циркония Б - разную активность в
Bu
2.313
2.309
0.55
0.69
аналогичных реакциях. Для доказательства
Hex
2.314
2.308
0.54
0.69
предположения об одинаковой реакционной спо-
собности связей C2-Та и С5-Та, мы рассчитали
тепловые эффекты для альтернативных маршрутов
танталциклопентанов А и цирконациклопентанов
реакции между интермедиатом А и EtMgCl (табл. 2).
Б (схема 6), взаимодействие которых с реактивами
Первый и второй маршруты указанной реакции
Гриньяра, как известно, осуществляется через
соответствуют расщеплению связей C2-Та и С5-Та
цирконациклопентаны [13-17].
соответственно (схема 7).
В табл. 1 приведены рассчитанные методом
Оба маршрута имеют низкие эндотермические
PBE/SBK ключевые геометрические параметры
тепловые эффекты, которые увеличиваются с
комплексов А и Б. Для танталоциклопентанов
размером алкильной цепи в соединении А.
разница длин связей C2-Ta и C5-Ta, которые
r2 в пределах
диссоциируют при взаимодействии с магний-
каждого заместителя R составляет малую вели-
органическими соединениями, независимо от
чину, что позволяет сделать вывод о практической
длины алкильного фрагмента R составляет ~0.015 Å;
равной термодинамической благоприятности
в случае комплексов циркония эта разница меньше
реакции диссоциации с участием обеих связей
0.015 Å.
С2-Та и С5-Та.
Гораздо более существенные отличия можно
Таким образом, исследование реакции 1-алкенов
наблюдать для рассчитанных порядков связей p,
с C2D5MgX под действием катализатора TaCl5 c
которые в первом приближении можно
учетом результатов распределения атомов
использовать для оценки прочности связей. Связи
дейтерия в продуктах данной реакции и DFT рас-
C2-Ta и C5-Ta характеризуются приблизительно
четов энергетического профиля этих превращений
одинаковыми значениями порядков (0.89-0.95 в
позволяет сделать вывод о практически равной
зависимости от R), в то время как в соединениях
термодинамической вероятности расщепления
циркония Б p(C2-Zr)
< p(C5-Zr). Последнее
cвязей С2-Та и С5-Та в интермедиатных тантал-
свидетельствует о меньшей прочности связи С2-Zr
циклопентанах при взаимодействии последних с
по сравнению с С5-Zr и хорошо согласуется с
С2D5MgX, что и приводит к образованию двух
экспериментальными данными о диссоциации
изомерных магнийорганических соединений.
Схема 6.
Схема 7.
R
MgCl
R
R
TaCl
3
5
2
5
2
А+ EtMgCl
H2C
CH2
H2C
CH2
MgCl
TaCl3
ZrCp2
TaCl3
А
Б
R
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
508
CУЛТАНОВ и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 1,1,1,2,2-пентадейтеро-3-метилгептана
3 и 1,1,2,2-тетрадейтеро-3-дейтеромeтилгептана
Все реакции проводили в атмосфере сухого
4. В атмосфере сухого аргона при 0°С смешивали
аргона. Использовали 1-гексен (99.8%), который
1.25 ммоль (0.45 г) TaCl5, 25 ммоль 1-гексена и
непосредственно перед опытами перегоняли над
40 ммоль (0.6 М. в ТГФ) С2D5MgBr. Температуру
i-Bu3Al в токе аргона. ТГФ выдерживали над KOH,
реакционной массы повышали до
20°С и
кипятили над Na (проволока) и перегоняли в токе
перемешивали еще 4 ч, затем обрабатывали 8%-
аргона над LiAlH4. Пентадейтероэтилмагнийбромид
ной HCl. Продукты реакции экстрагировали
С2D5MgBr синтезировали согласно методике [18].
диэтиловым эфиром (3 × 50 мл), экстракт сушили
Пентадейтероэтилбромид С2D5Br (99% D), а также
MgSO4. Смесь продуктов 3 и 4 выделяли фракцион-
TaCl5
(99.8%)
использовали коммерческие
ной перегонкой и с помощью препаративной ГЖХ
(Aldrich).
выделяли в индивидуальном виде.
1,1,1,2,2-Пентадейтеро-3-метилгептан (3). Т. кип.
Хроматографический анализ продуктов гид-
78°С (30 мм рт. ст.). ИК спектр, ν, см-1: 2175, 2250
ролиза и дейтеролиза были получены с помощью
(С-D). Спектр ЯМР 1Н, δ, м. д.: 1.14-1.41 м (7Н,
хроматографа SHIMADZU GC-2014 (капиллярная
СН), 0.85-0.88 м (6Н, СН3). Спектр ЯМР 13С, δС, м.
колонка 2 м × 3 мм, 5% SE-30 на хроматоне N-AW-
д.: 10.05 м (С1), 14.31 (С7), 19.33 (С8), 22.87 (С6),
HMDS (0.125-0.160 мм), газ-носитель
- гелий
27.72 м (С2), 29.23 (С5), 33.89 (С3), 35.62 (С4). Масс-
(30 мл/мин), программирование температуры от 50
спектр, m/z: 119 [M]+. Найдено, %: С 80.65; (Н+D)
до 300°С со скоростью 8 град/мин. Одномерные
19.29. C8H13D5. Вычислено, %: С 80.67; Н 10.92; D
(1Н, 13С), гомо- (COSY, NOESY) и гетероядерные
8.40.
(HSQC, HMBC) эксперименты ЯМР проводили на
спектрометре Bruker Avance
400 с рабочей
1,1,2,2-Тетрадейтеро-3-дейтеромeтилгептан (4).
частотой 100.62 МГц для 13С и 400.13 МГц для 1Н
Т. кип. 78°С (30 мм рт. ст.). ИК спектр, ν, см-1:
при
298 K, внутренний стандарт
- ТМС. ИК
2175, 2251 (С-D). Спектр ЯМР 1Н, δ, м. д.: 1.13-
спектры зарегистрированы на ИК Фурье-спектро-
1.42 м (7Н, СН2, СН), 0.75-0.94 м (5Н, СН3, СН2D).
метре Vertex 70 V Bruker в суспензии в вазели-
Спектр ЯМР 13С, δС, м. д.: 9.39 м (С1), 14.31 (С7),
новом масле. Масс-спектры получены на жид-
16.45 т (С8, 1JCD = 19.0 Гц) 22.86 (С6), 28.10 м (С2),
костном хромато-масс-спектрометре Shimadzu
29.23 (С5), 33.88 (С3), 35.62 (С4). Масс-спектр, m/z:
GCMS-QP-2010Plus, капиллярная колонка SUPERLCO
119
[M]+. Найдено, %: С
80.64; (Н+D)
19.30.
SLBTM-5 мс, 60000 мм × 0.25 мм × 0.25 мм, газ-
C8H13D5. Вычислено, %: С 80.67; Н 10.92; D 8.40.
носитель - гелий, программирование температуры
Синтез 2-пентадейтероэтилгексан-1-ола 5 и
260°С со скоростью
5 град/мин, температура
1,1,2,2-тетрадейтеро-3-дейтерометил-гептан-1-ола
ионного источника
-
260°С (ЭИ,
70 эВ).
6. Окисление магнийорганических соединений 1 и
Элементный анализ образцов проведен на
2, полученных реакцией С2D5MgBr с 1-гeксеном в
анализаторе Сarlo Erba 1106.
ТГФ в присутствии TaCl5, проводили в стеклянном
термостатируемом реакторе (V
=
100 мл),
Для расчета металлоорганических соединений
пропуская через реакционную смесь пузырьки
А и Б был использован метод функционала
сухого чистого кислорода. Температуру реакции
плотности PBE [19] с псевдопотенциалом Стивена-
поддерживали на уровне
5-8°С. По истечении
Баша-Краусса [20] (программа ПРИРОДА-06 [21]).
120 мин реакционную массу выливали в 5%-ный
Cтруктура соединений была оптимизирована без
раствор НCl. Образовавшиеся продукты (спирты
ограничений на симметрию. Рассчитанные частоты
экстрагировали диэтиловым эфиром, 3 × 30 мл),
гармонических колебаний характеризуют оптими-
сушили MgSO4 и после удаления эфира анализи-
зированные структуры как минимумы на
ровали с помощью ГЖХ. Выделение смеси спиртов
поверхности потенциальной энергии. Для связей в
5 и 6 осуществляли вакуумной ректификацией. В
молекулах А и Б были рассчитаны порядки по
индивидуальном виде соединения
5 и
6 были
Малликену (р) [22]. Тепловые эффекты модельных
выделены с помощью препаративной ГЖХ.
реакций (1) и (2) рассчитывали как разницу полных
энергий продуктов и исходных веществ с учетом
2-Пентадейтероэтилгексан-1-ол
(5). Т. кип.
энергии нулевых колебаний и термических
185°С (760 мм рт. ст.). ИК спектр, ν, см-1: 3450
поправок (298 K).
(О-Н), 2175, 2250 (С-D), 1465, 1375, 1045 (С-О).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
К ВОПРОСУ О МЕХАНИЗМЕ ДВУХМАРШРУТНОЙ РЕАКЦИИ
509
Спектр ЯМР 1Н, δ, м. д.: 3.44 м (2Н, СН2ОН), 1.24
Soc. 1979. Vol. 101. P. 4558. doi 10.1021/ja00510a022
м (6Н, СН2), 0.84 м (3Н, СН3). Спектр ЯМР 13С, δС,
7. Mclain S.J., Sancho J., Schrock R.R. // J. Am. Chem.
м. д.: 67.78 (С1), 14.60 (С2), 30.07 (С3), 29.07 (С4),
Soc. 1980. Vol. 101. P. 5610. doi 10.1021/ja00537a035
23.03 (С5), 22.58 м (С7), 13.95 (С6), 9.58 м (С8). Масс-
8. Smith S., Mclain S.J., Schrock R.R. // J. Organomet.
спектр, m/z: 135 [M]+. Найдено, %: С 71.09; (Н+D)
Chem. 1980.Vol. 202. P. 269. doi 10.1016/S0022-328X
17.00. C8H13D5O. Вычислено, %: С 71.11; Н 9.63; D
(00)92675-5
7.41.
9. Arteaga-Mueller R., Tsuguri H., Saito T., Yanagawa M.,
Oda S., Mashima K. // J. Am. Chem. Soc.
2009.
1,1,2,2-Тетрадейтеро-3-дейтерометил-гептан-
Vol. 1131. P. 5370. doi 10.1021/ja8100837
1-ол (6). Т. кип. 186°С (760 мм рт. ст.). ИК спектр,
10. Andes C., Harkins S.B., Murtuza S., Oyler K., Sen A. //
ν, см-1: 3455 (О-Н), 2175, 2250 (С-D), 1465, 1375,
J. Am. Chem. Soc. 2001.Vol. 123. P. 7423. doi10.1021/
1045 (С-О). Спектр ЯМР 1Н, δ, м. д.: 1.46 м (1Н,
ja010762+
СН), 1.24 м (6Н, СН2), 0.84 м (СH3, CH2D). Спектр
11. Zhi-Xiang Yu, Houk K.N. // Angew. Chem. Int. Ed.
ЯМР 13С, δС, м. д.: 59.74 м (С1), 41.60 (С3), 30.07
2003. N 42. P. 808. doi 10.1021/ja00016a052
(С4), 29.07 (С5), 23.03 (С6), 22.99 м (С2), 19.15 т (С8,
12. Lewis D.P., Müller P.M., Whitby R.J., Jones R.V.H. //
1JCD = 19.0 Гц), 13.95 (С7). Масс-спектр, m/z: 135
Tetrahedron Lett. 1991. N 32. P. 6797. doi 10.1016/
[M]+. Найдено, %: С 71.07; (Н+D) 17.01. C8H13D5O.
S0040-4039(00)93606-2
Вычислено, %: С 71.11; Н 9.63; D 7.41.
13. Visser M.S., Hoveyda A.H.
// Tetrahedron.
1995.
Vol. 51. P. 4383. doi 10.1016/0040-4020(94)01127-L
КОНФЛИКТ ИНТЕРЕСОВ
14. Knight K.S., Waymouth R.M. // J. Am. Chem. Soc.
Авторы заявляют об отсутствии конфликта
1991. Vol. 113. P. 6268. doi 10.1021/ja00068a019
интересов.
15. Houri A.F., Didink M.T., Xu Z., Noran N.R., Hoveyda A.H. //
J. Am. Chem. Soc. 1993. Vol. 115. N 6614. doi10.1021/
СПИСОК ЛИТЕРАТУРЫ
ja00016a052
1. Джемилев У.М. Вострикова О.С., Султанов Р.М. //
16. Morken J.P., Didink M.T., Hoveyda A.H. // J. Am.
Изв. АН СССР. Сер. хим. 1983. № 1. С. 213.
Chem. Soc. 1993. Vol. 115. P. 6997. doi 10.1021/
2. Dzhemilev U.M., Vostrikova O.S. // J. Organomet.
ja00068a77
Chem. 1985. Vol. 285. P. 43. doi 10.1016/0022-328X
17. Иоффе С.Т., Несмеянов А.М. Методы элементо-
(85)87355-1
органической химии. Подгруппа магния, бериллия,
3. Sultanov R.M., Dzhemilev U.M., Samoilova E.V.,
кальция, стронция, бария. М.: АН СССР, 1963. C. 561.
Ismagilov R.R., Khalilov L.M., Popod’ko N.R. // J.
18. Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett.
Organomet. Chem. 2012. Vol. 715. P. 5. doi 10.1016/
1996. Vol. 77. P. 3865. doi 10.1103/PhysRevLett.77.3865
j.jorganchem.2012.05.023
19. Giorgan M., Custodio R., Morgon N.H. // Chem. Phys.
4. Sultanov R.M., Ismagilov R.R., Popod’ko N.R.,
Lett. 1997. Vol. 279. P. 396. doi 10.1016/S0009-2614
Tulyabaev A.R., Sabirov D.Sh., Dzhemilev U.M. // J.
(97)01058-0
Organomet. Chem. 2013. Vol. 745. P. 120. doi 10.1016/
20. Лайков Д.Н., Устынюк Ю.А. // Изв. АН. Сер. хим.
j.jorganchem.2013.07.017
2005. № 3. С. 804; Laikov D.N., Ustynyuk Y.A. // Russ.
5. Fellmann J.D., Rupprecht G.A., Schrock R.R. // J. Am.
Chem. Bull. 2005. Vol. 54. P. 820. doi 10.1007/s11172-
Chem. Soc. 1979. Vol. 101. P. 5099. doi 10.1021/
005-0329-x
ja00511a067
21. Mayer I. Simple theorems, proofs, and derivations in
6. Mclain S.J., Wood C.D., Schrock R.R. // J. Am. Chem.
quantum chemistry. New York: Kluwer Academic, 2006.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
510
CУЛТАНОВ и др.
Two-Route Mechanism of TaCl5-Catalyzed Reaction
of 1-Alkenes with EtMgX
R. М. Sultanova, *, F. Sh. Khafizova, I. V. Ozdena, N. V. Shutova,
D. Sh. Sabirovb, and U. М. Dzhemilevb
a Ufa State Petroleum Technical University, ul. Kosmonavtov 1, Ufa, 450062 Russia
*e-mail: sultanov55@mail.ru
b Institute of Petrochemistry and Catalysis, Russian Academy of Sciences, Ufa, Russia
Received October 25, 2018; revised October 25, 2018; accepted November 1, 2018
The reaction of 1-alkenes with C2D5MgBr in the presence of TaCl5 was studied. Based on the distribution of the
deuterium label in the alkyl chain of the regioisomeric organomagnesium compounds, a tentative mechanism of
their formation as the key intermediates of 3-substituted tantalocyclopentanes was proposed. The energy profiles
of the reactions of carbomagnesation and β-reductive magnesium ethylation of 1-alkenes were calculated using
DFT method.
Keywords: 1-alkenes, carbomagnesation, β-reductive magnesium ethylation, tantalocyclopentanes, deuterated
organomagnesium compounds, DFT calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019