ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 511-521
УДК 547.739.3
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ
2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
© 2019 г. Р. Н. Хуснитдиновa, Р. М. Султановb, Р. Р. Гатауллинa, *
a Уфимский институт химии Уфимского федерального исследовательского центра
Российской академии наук, пр. Октября 71, Уфа, 450054 Россия
*e-mail: gataullin@anrb.ru
b Уфимский государственный нефтяной технический университет, Уфа, Россия
Поступило в Редакцию 29 ноября 2018 г.
После доработки 29 ноября 2018 г.
Принято к печати 6 декабря 2018 г.
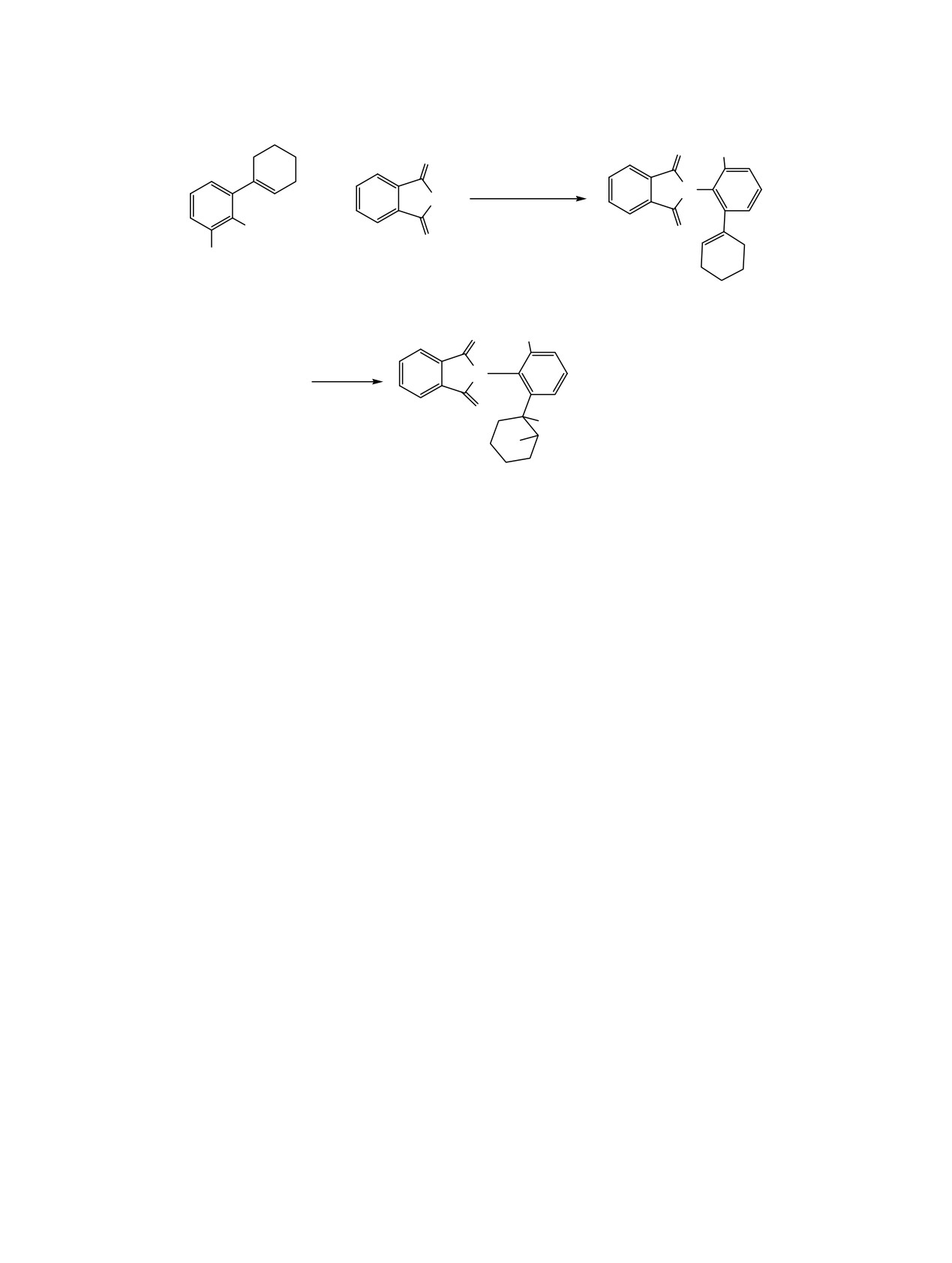
Реакцией 2-(1-циклогексен-1-ил)замещенных производных анилина и
6-метиланилина с фталевым
ангидридом синтезированы 2-(2-циклогекс-1-ен-1-илфенил)- и 2-(2-циклогекс-1-ен-1-илфенил)-6-метил-
фенил)-1H-изоиндол-1,3(2H)-дионы. Реакция полученных изоиндолдионов с бромом в дихлорметане в
присутствии гидрокарбоната натрия привела к образованию продукта псевдоаллильного галогениро-
вания. Выдерживанием
2-[2-(6-бромциклогекс-1-ен-1-илфенил)-6-метилфенил)]-1H-изоиндол-1,3(2H)-
диона в метанольном растворе в присутствии NaHCO3 синтезирован продукт замещения галогена на
метоксильную группу. При взаимодействии
2-(2-циклогекс-1-ен-1-ил-6-метилфенил)-1H-изоиндол-
1,3(2H)-диона с молекулярным бромом в присутствии метанола образуется продукт согалогенирования; в
присутствии октилового спирта получен продукт дибромирования.
Ключевые слова: изоиндолдионы, метоксилирование, бромирование, фталимиды, атропоизомер
DOI: 10.1134/S0044460X19040036
Разработаны несколько методов, позволяющих
реакциях указанных сульфониламидов с молекуляр-
препаративно вводить аллильный
[1,
2], гомо-
ным бромом в присутствии гидрокарбонатов или
аллильный [3] или винильный [4-6] заместители в
метанольным раствором дибромида меди, в
бензольное ядро. Соответственно, многие амино-
результате чего получены продукты псевдо-
арилзамещенные [7] ненасыщенные углеводороды
аллильного бромирования [22-24] или метоксили-
с орто- [8, 9], мета- [10] и пара-расположением
рования [25], которые удается использовать при
[11] аминного, алкенильного и циклоалкенильного
получении карбазолов различной региогидро-
фрагментов при ароматическом кольце, а также их
генизации. Недостатком в этих схемах является то,
производные с амино- или оксигруппами при
что тозильная и мезильная защитные группы
алкене [12, 13] и N-алкениланилины [14, 15] стали
удаляются в агрессивных средах, при применении
доступными. Многие из этих соединений находят
которых могут затрагиваться и функциональные
применение в органическом синтезе [16]. Так, на
группы. Использование протекторов, удаление
их основе синтезированы биологически активные
которых происходит легче, чем арил- или
ариламиды [17], ингибиторы кислотной коррозии
алкилсульфонильных, может приводить к другим
[18], противовирусные
[19,
20] и противо-
результатам. В частности, попытки функциона-
опухолевые вещества [21].
лизации аналогичным путем циклоалкенильного
Протекание химических превращений неко-
фрагмента N-ацетил- и N-алкоксикарбонил-
торых производных N-тозил(мезил)-2-(1-цикло-
замещенных аналогов в реакциях с бромом [26]
алкен-1-ил)анилина при взаимодействии с
или пероксидами [27] завершаются образованием
традиционными электрофильными реагентами
бензоксазинов. Эти обстоятельства стимулируют
может несколько отличаться от классических пред-
исследователей к поиску защитных групп, которые
ставлений. Такие трансформации отмечены в
приводили бы к удачным для функционализации
511
512
ХУСНИТДИНОВ и др.
Схема 1.
O
R
O
3
ДМФА, 180°C
N
+
O
1
NH2
O
O
R
1a, б
2a (92%), 2б (89%)
CH3
O
4
Br2
N
CH2Cl2
NaHCO3
O
1''
MeOH
OCH3
Br
2''
4 (36%)
R = H (a), CH3 (б).
циклоалкенильного фрагмента объектам, при этом
циклогексен-1-ил)]-6-метилфенил-1-индол-2,3-
оставаясь легко удаляемыми с атома азота.
диона 2б (схема 1) и ранее описанного действия
брома в этих же условиях на N-тозилат 3a [22, 25,
В данной работе нами синтезированы
34, 35] или N-мезилат 3б [22] (схема 2) показало
фталимидные производные 2-(1-циклогексен-1-ил)-
существенное влияние защитной группы при атоме
фенил-1,3-изоиндолдиона и исследованы их
азота на направление реакции. В отличие от
реакции с бромом в различных условиях.
реакции тозилата 3a или мезилата 3б с галогеном в
Фталильная группа [29] является одной из часто
присутствии метанола [25], при взаимодействии
используемых для защиты аминов при реализации
соединения 2 с молекулярным бромом в тех же
синтетических схем с участием аминокислот [28].
условиях образуется продукт когалогенирования 4
Фталильная защита применяется в случае
с метоксильной группой при узловом атоме
относительно термостабильных аминов, так как их
циклогексильного фрагмента (схема 1), на что
взаимодействие с фталевым ангидридом проходит
указывают сигналы углеродного атома С1'' в
при высоких температурах [30, 31], но снимается
спектре ЯМP 13C (синглет с химическим сдвигом δ
эта группа действием гидразина в мягких условиях
79.34 м. д.), бромзамещенного углеродного атома
[32]. Амины 1а, б, используемые нами в данном
С2 (дублет при δ 51.05 м. д.). Сигналу углеродного
исследовании отличаются высокой термостабиль-
атома заместителя OCH3 (квартет при δ 55.01 м. д.),
ностью. Получали их нагреванием
2-(2-цикло-
по данным экспериментов HSQC и HMBC,
гексен-1-ил)анилина и его
6-метилзамещенного
соответствует трехпротонный синглетный сигнал
гомолога с KOH при 300°С согласно работе [33],
протонов этой группы при δ 2.94 м. д. В масс-
физико-химические характеристики соответствовали
спектрах соединения 4 молекулярный ион [M + H]+
описанным в работах [22, 33, 34]. Изоиндолоны
проявляется с m/z 428 и 430 (интенсивность пика
2а, б синтезировали кипячением смеси соответ-
80%), который распадается, теряя атом галогена с
ствующих циклогексениланилинов 2а [33, 34], 2б
образованием осколка с m/z
348
(100%), под-
[22] и фталевого ангидрида в ДМФА (схема 1).
вергающегося дальнейшей деградации в осколок с
Продукты реакции выделяли хроматографиро-
m/z 316 (I = 68%) (схема 2).
ванием на силикагеле.
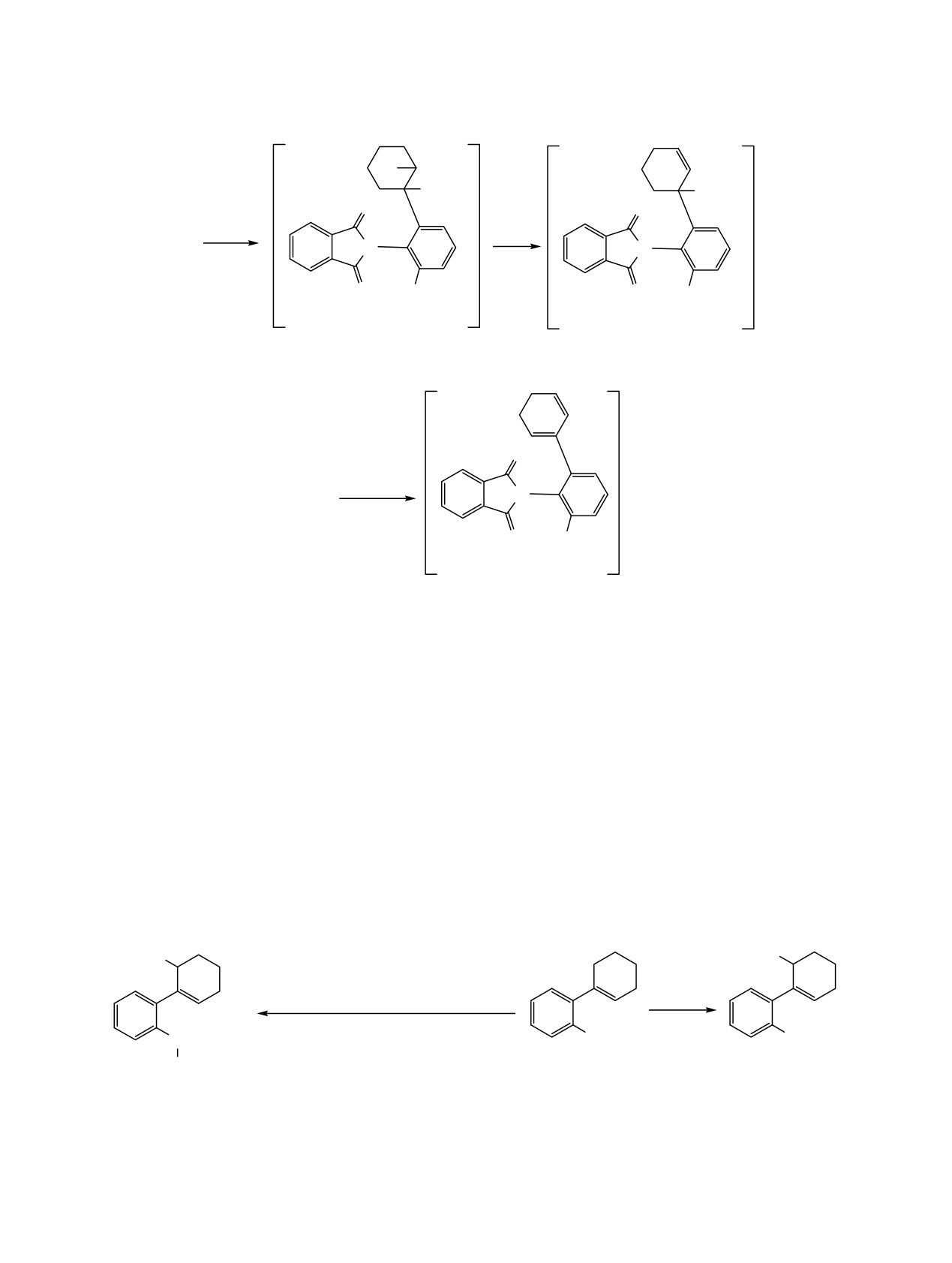
Сравнение результатов бромирования в
Ранее нами было показано, что N-тозил- и N-
присутствии MeOH синтезированного нами 2-[2-(1-
мезилзамещенные аналоги
3a, б при взаимо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ 2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
513
Схема 2.
+
+
Br
OCH3
OCH3
O
O
H+
4
N
N
-HBr
O H3C
O H3C
H+
H+
[M + H]+
[M + H - HBr]+
+
O
N
-CH3OH
O H3C
H+
OH]+
[M + H - HBr - CH3
действии с CuBr2 в метаноле трансформируются в
приводит к продукту дигалогенирования. При
эфиры 5в, г (схема 3) [22, 25]. В отличие от этого,
взаимодействии соединения 2б с молекулярным
выдерживание соединений
2a, б в растворе
бромом в хлористом метилене в присутствии
дибромида меди в MeOH не приводит к
октилового спирта образуется соединение
6 с
изменениям в структуре этих имидов. Оказалось,
двумя атомами брома при циклогексановом кольце
что N-ацетил-
(3д)
[33] и N-этоксикарбонил-
(схема
4), структура которого подтверждается
замещенные (3е) циклогексениланилины в этих
методом спектроскопии ЯМР 1Н и 13С. Область
условиях также не переходят в продукты
сигналов алифатических углеродных атомов этого
псевдоаллильного метоксилирования 5д, е (схема 3).
соединения достаточно проста и легко поддается
идентификации. В этой части спектра ЯМР 13С
Попытка получения соединения, аналогичного
присутствуют семь сигналов, соответствующих по
эфиру 4, имеющего октилоксигруппой при узловом
мультиплетности СH3-группе
(18.12
м. д.),
углеродном атоме циклогексанового кольца,
метиленовой цепи (CH2)4 циклогексанового кольца
Схема 3.
X
H3CO
CuBr2
i, 20oC
×
MeOH
i: Br2, CH2Cl2, NaHCO3, X = Br
NH
i: Br2, MeOH, CH2Cl2, NaHCO3, X = OCH3
NHR
NHR
i: CuBr2, MeOH, X = OCH3
SO2Ts(Ms)
5a-г
3a, б, д, е
5д, е
X= Br (5a, 5б), OCH3 (5в, 5г); R = Ts (3а), Ms (3б), Ac (3д, 5д), OCOEt (3е, 5е).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
514
ХУСНИТДИНОВ и др.
Схема 4.
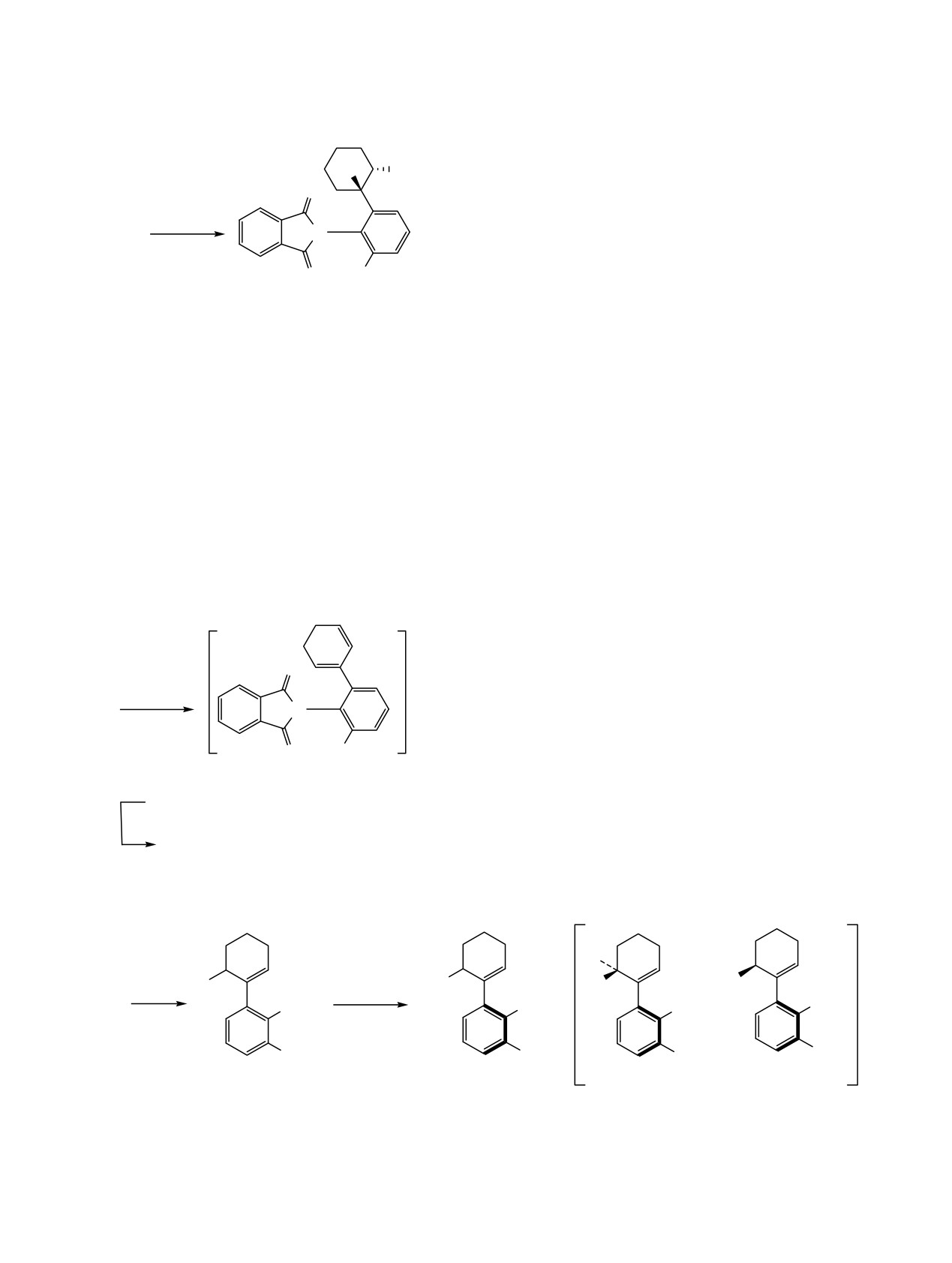
При взаимодействии соединений
2a, б с
4''
2''
молекулярным бромом в CH2Cl2 в присутствии
NaHCO3 образуются продукты монобромирования
Br
Br
9a, б с хорошим выходом (схема 6). Молекулярный
O
1''
ион
[М
+ Н]+ соединения
9б, из-за наличия
Br2
подвижного аллильного брома, в условиях масс-
2б
N
спектрометрических исследований в условиях
CH2Cl2
NaHCO3
ионизации APCI нестабилен, и пик этого иона
C8H17
OH
O
H3C
отсутствует. В масс-спектре представлен осколок
[M - Br]+ с m/z
316
(100%), который образует
6 (56%)
ассоциат с водой [M - Br + H2O]+ с m/z 334 (10%).
(триплеты в области 19.76, 20.81, 30.53 и 32.72 м. д.),
Из-за стерических особенностей, обусловлен-
углеродному атому C2ʹʹ (дублет при 57.17 м. д.) и
ных присутствием близкорасположенных
четвертичному углеродному атому C1ʹʹ (синглет
объемных заместителей при ароматическом цикле
при 74.90 м. д.). Отнесение сигналов к указанным
и циклогексеновом кольце, это соединение должно
группам осуществлено на основании ЯМР
было бы существовать в виде изомеров syn- и anti-
экспериментов HSQC и HMBC.
9 (схема 6). Первичный теоретический анализ с
В условиях химической ионизации при
использованием программы Hyperchem
[36]
атмосферном давлении (APCI) соединение
6
позволил установить практически перпендику-
неустойчиво и распадается с образованием осколка
лярное взаимное расположение фталимидного и
7 с m/z 316 [M - 2НBr + H]+ (60%) и ассоциата 8
ароматического циклов в случае гипотетического
этого осколка с водой [M - 2НBr + H2O + H]+
anti-изомера 9. В случае syn-изомера двугранный
(100%) с m/z 334 (схема 5).
угол был бы меньше и составлял ≈40°. При этом
олефиновая цепь циклогексенового фрагмента и
Схема 5.
ароматическое кольцо также не лежат в одной
+
плоскости, значение двугранного угла С2''С1''С2'С1' в
случае обоих изомеров составляет >40°. Однако
O
экспериментальных подтверждений существования
атропоизомеров нет. Вероятно, энергетический
APCI
6
N
барьер вращения вокруг углерод-углеродной связи
−2HBr
двух sp2-гибридизованных атомов С6ʹ-C1ʹʹ
O
H3C
монобромида 9 слишком мал, чтобы последствия
H+
торможения аксиального вращения отразились на
спектрах ЯМР.
7, m/z 316 (60%) [M - 2HBr + H]+
H2O
При нагревании соединения 9б в MeOH образуется
+
8, m/z 334 (100%)[M - 2HBr + H2O + H]
метиловый эфир 10 (схемы 4, 6). В спектре ЯМР
Схема 6.
Br
6''
6''
6''
2''
2''
2''
2''
Br
H3CO
H
Br
Br2
CH2Cl2
1''
1a, б
2'
NPht
NPht
NPht
NPht
+
CH2Cl2
NaHCO3
1'
NaHCO3
MeOH
CH3
R
CH3
CH3
9a (90%), 9б (97%)
10, 86%
anti-9a, б
syn-9a, б
R = H (a), CH3 (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ 2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
515
Схема 7.
(CH2)n
(CH2)n
(CH2)n
MeO
MeO
R2
Br
R2
CuBr2
+
Br
Br
MeOH
NH2
NH2
NH2
20oC
R1
1
R1
R
12a (79%)
13a (80%)
1a, в, 11б
12б (85%)
13б (11%)
13в (80%)
R1 = R2 = H, n = 2 (a), R1 = CH3, R2 = H, n = 1 (б), R1 = CH3, R2 = (Z)-CH3-CH-CH=CH-CH3, n = 2 (в).
13С соединений 9a, б и
10 обращает на себя
спектральных исследований APCI и имеющий m/z
внимание индивидуальность сигналов углеродных
348, мало стабилен. Низкая интенсивность этого
атомов симметричного фталимидного фрагмента.
иона (около 10%), вероятно, обусловлена быстрым
Моделирвание молекул соединений 9a, б и 10 с
распадом по схеме
[M
- CH3OH
+ H]+ с
использованием компьютерной программы
образованием осколка с m/z 316 (100%).
Hyperchem показало практически параллельное
расположение плоскостей изоиндолдиона и
Циклоалкениланилины 1a [33, 34], 1в [37] и 11б
циклогексенового кольца в пространстве. При этом
[38] в реакции с дибромидом меди(II) в метаноле
каждая симметричная группа фталимидного
образуют галогенэфиры 12, 13 (схема 7). Из 4-(1-
фрагмента пространственно сближена с разными
метилбут-2-ен-1-ил)циклогексениланилина
1в в
углеродными звеньями циклогексенового кольца,
этих условиях образуется единственное соеди-
что и определяет их неравнозначное магнитное
нение 13в с хорошим выходом. В случае аналогов
окружение. Более детальное отнесение сигналов
1a и
11б, кроме образования галогенэфира, в
ЯМР 1H и 13C проведением HSQC эксперимента на
зависимости от количества используемого CuBr2,
примере соединения 9б позволило установить, что
может происходить также замещение протона в
химические сдвиги попарно симметричных
пара-положении ароматического ядра на атом
фталимидных углеродных атомов С4,5,6,7 отли-
галогена. При взаимодействии соединения 11б с
чаются незначительно (на
≈0.09 м. д.). После
2 экв. CuBr2 в метаноле образуется дибромид 12б и
нагревания соединения
9б в метаноле сигнал
монобромид 13б. При взаимодействии циклогексе-
протона H6'', резонирующий при
4.75 м. д.,
нильного гомолога 1a с 1 экв. дибромида меди
исчезает, а в спектре ЯМР 1H образовавшегося
образуется галогенэфир 13a с хорошим выходом,
единственного продукта реакции
10 сигнал
при использовании 2 экв. CuBr2 образуется также
протона H6'' представлен в области 3.67 м. д. в виде
значительное количество пара-бромзамещенного
синглета. Наличие метоксильной группы в
эфира 12a.
соединении
10 подтверждает присутствие в
спектре ЯМР
1H трехпротонного синглета при
Структура полученных соединений установлена
3.20 м. д. В спектре ЯМP 13C этого соединения 10,
спектральными методами, состав подтвержден
снятого в режиме JMOD, сигналы углеродных
элементным анализом. Так, наличие первичной
атомов метоксильной группы и C6'' представлены в
аминогруппы в соединениях 12a, б и 13a, б, в
области
56.95 и
75.63 м. д. соответственно.
установлена на основании наличия в ИК спектрах
Сигналы углеродных атомов трех метиленовых
характеристичного сигнала в области 3360-3370 и
групп резонируют при δ 16.60, 25.46 и 26.56 м. д.
3445-3460 см-1. Протон H2' в спектре ЯМР 1Н
Все отнесения значений сигналов протонов к
соединений 12б и 13б представлен в области 5.05-
соответствующим углеродным группам подтвер-
5.08 м. д. в виде дублета дублетов дублетов с
ждены также ЯМР экспериментами HSQC, HMBC,
KCCB J1=1.2, J2=1.6, J3=6.3 Гц. Методом двойного
H-H корреляции. Молекулярный ион [M + H]+
резонанса установлено, что бόльшая константа
соединения 10, образующийся в условиях масс-
(J3 =
6.3 Гц) протона H2' обусловлена взаимо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
516
ХУСНИТДИНОВ и др.
действием с одним из протонов (группы C3'H2, а
вышеназванные фталимиды циклогексенильных
мультиплетный сигнал этой группы в спектрах
производных в метанольном растворе дибромида
ЯМР
1H обоих аминоэфиров
12б и
13б
меди изменению не подвергаются.
прослеживается в области
2.65-2.82 м. д.
Замещение галогеном пара-положения установ-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
лено на основании присутствия в спектре ЯМР 1H
дублетных сигналов протонов H3 и Н5
Исследования выполнены на оборудовании
ароматического кольца соединения 12a. Присут-
Центра коллективного пользования
«Химия»
ствие гетероатомов (брома, метоксигруппы и т. д.)
Уфимского института химии РАН. ИК спектры
между такими протонами ароматического цикла,
записаны на спектрометре с Фурье-трансформером
как известно из многочисленных примеров,
IRPresstige-21 (Shimadzu). Спектры ЯМР 1Н и 13С
приводит к усилению их взаимодействия (эффект
сняты на спектрометре Bruker AM 300 с рабочими
W-системы) между собой с КССВ до 3.0 Гц. В
частотами 300.13 и 75.73 МГц соответственно и
спектрах ЯМР 13С соединений 12б и 13б, снятых в
Bruker Avance III при
500.13 и
125.13 МГц
режиме JMOD, в области алифатических угле-
соответственно в CDCl3 (внутренний стандарт -
родных атомом представлены
7 сигналов, из
ТМС). ГЖХ-Контроль за чистотой продуктов
которых по мультиплетности и значению хими-
реакции осуществляли на хроматографе Chrom-5,
ческого сдвига углеродному атому С1'
газ-носитель - гелий (расход 50 мл/мин), детектор
соответствует сигнал в области 92.5 и 92.8 м. д.
пламенно-ионизационный, колонки
1200×3 мм,
Сигналы, находящиеся в области 54.0 и 54.5 м. д.
неподвижная фаза - силиконовая жидкость SE-30
нами отнесены метоксильной группе, сигналы
(5%) на носителе Chromaton N-AW DMCS, рабочая
бромзамещенного углеродного атома С2'
температура
50-300°С. Элементный анализ
соединений 12б и 13б представлены при 51.1 и
выполнен на приборе CHNS Elemental Analyzer
51.4 м. д. Химические сдвиги трех сигналов
EURO EA-3000. Содержание галогенов определяли
метиленовых групп триплетной мультиплетности
колбовым методом Шёнигера с последующим
циклопентанового звена соответствуют расчетным
потенциометрическим титрованием. Данные
значениям. В спектре ЯМР13С соединений 12a, 13a
элементного анализа соответствовали расчетным
и 13в углеродные атомы метоксильного фрагмента
значениям. Колоночное хроматографирование
резонируют в области около 54.0 м. д., а связанные
осуществляли на силикагеле MN Kisielgel 60 (40-
с этой группой углеродные атомы С1' этих эфиров
100 мкм). Для качественного анализа ТСХ
представлены в области 81.0 м. д.
использовали пластины Sorbfil (ЗАО Сорбполимер,
Краснодар) с обнаружением веществ парами иода.
Таким образом, взаимодействием
2-(2-
2-(2-Циклогекс-1-ен-1-илфенил)-1H-изоиндол-
циклогекс-1-ен-1-ил)анилина и 2-(2-циклогекс-1-ен-
1,3(2H)-дион (2a). Раствор соединения 1a (1.73 г,
1-ил)-6-метиланилина с фталевым ангидридом
10 ммоль) и фталевого ангидрида (1.48 г, 10 ммоль)
синтезированы 2-(2-циклогекс-1-ен-1-илфенил)- и
в
5 мл ДМФА нагревали при
180°С
12 ч.
2-(2-циклогекс-1-ен-1-ил-6-метилфенил)-1H-изо-
Растворитель упаривали в вакууме, к реакционной
индол-1,3(2H)-дионы с хорошими выходами.
смеси до-бавляли 5 мл воды, растирали вещество,
Реакция последнего с бромом в присутствии MeOH
после чего воду отфильтровали. Остаток хромато-
приводит к продукту когалогенирования, в присут-
графировали на колонке с силикагелем
(15 г,
ствии октанола получен вицинальный дибромид.
элюент
- C6H6). Полученное вязкое вещество
Предложен эффективный подход к получению
растирали с петролейным эфиром, образовавшийся
продукта псевдоаллильного галогенирования
осадок отфильтровывали и сушили. Выход 2.78 г
обоих имидов взаимодействием с бромом, которые
(92%). Спектр ЯМР 1Н, δ, м. д.: 1.41-1.48 м, 1.57-
могут быть использованы в синтезе полигетеро-
1.63 м, 1.79-1.87 м, 2.20-2.29 м (4×2H, 4CH2), 2.21
циклов. При выдерживании 2-(1-циклопентен-1-ил)-
c (3H, CH3), ), 5.50 уш. c (1H, H2ʹʹ), 7.25 д (1Н, НAr,
6-метил-,
2-(1-циклогексен-1-ил)-4-(1-метилбут-2-
J = 7.9 Гц), 7.34-7.46 м (2Н, НAr), 7.78 д. д (2Н, НAr,
ен-1-ил)-6-метил- и 2-(1-циклогексен-1-ил)анилина
J = 3.0, J = 5.0 Гц), 7.94 д. д (2Н, НAr, J = 3.0, J =
в растворе CuBr2 в MeOH образуются
5.0 Гц).
соответствующие
2-(1-метокси-2-бром-1-цикло-
алкил)анилины и
продукты их последующего
2-(2-Циклогекс-1-ен-1-ил-6-метилфенил)-1H-
бромирования в пара-положение. В то же время
изоиндол-1,3(2H)-дион (2б) получали аналогично
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ 2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
517
из соединения 1б (1.87 г, 10 ммоль) и 1.48 г
30 мл H2O, экстрагировали
70 мл CH2Cl2.
(10 ммоль) фталевого ангидрида. Выход 2.82 г
Органическую фазу сушили Na2SO4. Растворитель
(89%), бесцветные кристаллы, т. пл. 99-102°С, Rf
упаривали в вакууме, остаток хроматографировали
0.77 (CHCl3). ИК спектр, ν, см-1: 1741, 1715, 1462,
на колонке с 10 г силикагеля (элюент - бензол) и
1378, 721. УФ спектр (CH3CN), λmax, нм: 268 (ε =
кристаллизовали из EtOH. Общий выход 0.115 г
12000). Спектр ЯМР 1Н, δ, м. д.: 1.35-1.45 м, 1.50-
(36%), бесцветные кристаллы, т. пл. 110-112°C
1.60 м, 1.75-1.85 м, 2.12-2.20 м (4×2H, 4CH2), 2.21
(EtOH), Rf 0.64. ИК спектр, ν, см-1: 1747, 1463,
c (3H, CH3), 7.95 c (2H, H5,6), 7.89-7.98 c и 7.74-7.83
1372, 1089, 1040. Спектр ЯМР 1Н, δ, м. д.: 1.50-2.00
c (2H, H4, H7), 7.27-7.38 т (1H, H4ʹ, J = 15.2 Гц) 7.24
м (6H, CH2), 2.46 c (3H, CH3), 2.94 c (3H, OCH3),
д (2H, H3, H5, J = 7.3 Гц), 7.13 д (1Н, НAr, J =
3.82 c (1H, H2ʹʹ’’), 7.21 д (1H, HAr, J = 7.8 Гц), 7.24 д.
7.3 Гц), 5.48 c (1H, H2ʹʹ). Спектр ЯМР 13С, δС, м. д.:
т (1H, HAr, J = 1.6, J 7.8 Гц), 7.29 д. д (1H, HAr, J =
18.30 (CH3), 21.77, 23.01, 25.27, 29.52 (C3ʹʹ, C4ʹʹ, C5ʹʹ,
1.0, J = 7.8 Гц), 7.58 д. т (1H, HAr, J = 2.0, J =
C6ʹʹ), 123.52 (C4, C7), 126.10, 126.54, 129.01, 129.15
7.4 Гц), 7.65-7.80 м (2H, HAr), 7.91 д. т (1H, HAr, J =
(C3ʹ, C4ʹ, C5ʹ, C2ʹʹ), 128.23, 132.04, 135.97, 137.13 (C3а,
1.0, J = 7.6 Гц). Спектр ЯМР 13С, δС, м. д.: 18.82
C7а, C1ʹʹ, C2ʹ, C6ʹ), 134.08 (C5, C6), 144.38 (C1ʹ), 167.65
(CH3), 19.15, 20.41, 29.95, 30.32 (C3ʹʹ, C4ʹʹ, C5ʹʹ, C6ʹʹ),
(C1, C3). Масс-спектр, m/z (Iотн, %): 318 (100) [M +
51.05 (C2ʹʹ),
55.01 (OCH3),
79.34 (C1ʹʹ),
121.95,
H]+.
124.56, 124.96, 126.07, 130.35, 131.13, 133.09 (C4,
C5, C6, C7, C3ʹ, C4ʹ, C5ʹ), 106.88, 129.95, 130.29,
Этил-(2-циклогекс-1-ен-1-илфенил)карбамат
133.10, 139.19, 143.77 (C3a, C7a, C1ʹ, C2ʹ, C6ʹ), 163.99
(3е). К суспензии 3.8 г (22.1 ммоль) амина 1a и
(C1, C3). Масс-спектр, m/z (Iотн, %):: 428 (100) [M + H]+.
4.14 г K2CO3 в 20 мл CH2Cl2 при интенсивном
перемешивании прибавляли по каплям раствор
2-{2-[(1R*,2S*)-1,2-Дибромциклогексил]-6-
2.72 г (25.0 ммоль) этилхлорформиата в 10 мл
метилфенил}-1H-изоиндол-1,3(2H)-дион
(6). К
CH2Cl2, ход реакции контролировали по ТСХ. По
раствору соединения 2б (0.317 г, 1.0 ммоль) в 5 мл
завершении реакции через 3 ч добавляли 20 мл
CH2Cl2 добавляли 1 мл (5.0 ммоль) С8H17OH и
H2O и
30 мл CH2Cl2, перемешивали
10 мин,
0.42 г
(5 ммоль) NaHCO3. При интенсивном
органическую фазу отделяли, сушили Na2SO4.
перемешивании к этой смеси прибавляли по
Растворитель упаривали в вакууме, остаток
каплям 0.16 г (0.052 мл, 1 ммоль) Br2 в 2 мл CH2Cl2.
хроматографировали на колонке с силикагелем
Реакционную смесь перемешивали до обесцве-
(150 г, элюент петролейный эфир - C6H6, 1:1).
чивания раствора, при перемешивании разбавляли
Выход 4.75 г (86%), Rf 0.3 (петролейный эфир -
30 мл H2O, экстрагировали 70 мл CH2Cl2. Органи-
C6H6, 1:1). ИК спектр, ν, см-1: 3320 (NH). Спектр
ческую фазу сушили Na2SO4. Растворитель
ЯМР 1Н, δ, м. д.: 1.33 т (3H, CH3), 1.70-1.75 м, 1.77-
упаривали в вакууме, остаток хроматографировали
1.82 м, 2.18-2.25 м (3×2H, CH2), 4.19 к (2H, OCH2,
на колонке с силикагелем (10 г, элюент - С6H6).
J = 7.1 Гц), 5.70-5.73 м (1H, H2’), 6.82 уш. с (1H,
Полученную вязкую массу растирали с
HAr), 6.95 д. т (1H, HAr, J = 1.0, J = 7.5 Гц), 7.01 д. д
петролейным эфиром, образовавшийся белый
(1H, HAr, J = 1.6, J = 7.5 Гц), 7.16 д. т (1H, HAr, J =
порошок отфильтровывали и сушили. Выход 0.27 г
1.6, J = 7.5 Гц), 7.99 уш. с (1H, NH). Спектр ЯМР
(56%), т. пл. 135-140°С (петролейный эфир), Rf
13С, δС, м. д.: 14.68 (CH3), 21.99, 23.00, 25.34, 29.95
0.33 (CHCl3). ИК спектр, ν, см-1: 1699, 1460, 1380,
(4 CH2),
60.76 (OCH2),
122.57,
127.49,
128.00,
1148, 886. Спектр ЯМР 1Н, δ, м. д.: 1.45-1.51 м,
128.11 (C3, C4, C5, C6), 134.43, 135.91 (C1, C2),
1.65-1.69 м, 1.71-1.80 м, 1.83-1.87 м, 2.15-2.20 м,
153.00 (NCO2). Масс-спектр, m/z (Iотн, %): 246.0
2.75-2.83 м (4×2Н, 4CH2), 2.10 c (3H, CH3), 4.33 с
(100) [M + H]+, 244.2 (100) [M - H]-.
(1H, H2ʹʹ), 7.33 д (1H, HAr, J = 7.2 Гц), 7.38 т (1H,
2-{2-[(1R*,2S*)-2-Бром-1-метоксицикло-
HAr, J = 7.2 Гц), 7.42 д. д (1H, HAr, J = 0.8, J =
гексил]-6-метилфенил}-1H-изоиндол-1,3(2H)-
7.2 Гц), 7.80-7.83 м, 7.93-7.96 м, 7.99-8.10 м (4H,
дион
(4). К раствору соединения 2б (0.317 г,
HPht). Спектр ЯМР 13С, δ, м. д.: 18.12 (CH3), 19.76,
1.0 ммоль) в 5 мл CH2Cl2 добавляли 2 мл MeOH и
20.81, 30.53, 32.72 (C3ʹʹ, C4ʹʹ, C5ʹʹ, C6ʹʹ), 57.17 (C2ʹʹ),
0.42 г (5 ммоль) NaHCO3. При интенсивном пере-
74.90 (C1ʹʹ), 123.82, 124.03, 127.45, 128.91, 130.77,
мешивании к этой смеси прикапывали
0.16 г
134.75 (C4, C5, C6, C7, C3ʹ, C4ʹ, C5ʹ), 131.97, 132.06,
(0.052 мл)
(1 ммоль) Br2 в
2 мл CH2Cl2.
138.43, 144.51 (C3a, C7a, C1ʹ, C2ʹ, C6ʹ), 168.32, 169.41
Реакционную смесь перемешивали до обесцвечи-
(C1, C3). Масс-спектр, m/z (Iотн, %):: 316 (60) [M -
вания раствора, при перемешивании разбавляли
Br2 + H]+, 334 (100) [M - Br2 + H2O + H]+.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
518
ХУСНИТДИНОВ и др.
2-[2-(6-Бром-1-циклогексен-1-ил)фенил]-1H-
Растворитель упаривали в вакууме, остаток
изоиндол-1,3(2H)-дион (9a). К суспензии 0.606 г
хроматографировали на колонке с силикагелем
(2.0 ммоль) сое-динения 1a и 0.98 г (12 ммоль)
(2 г, элюент - CHCl3). Выход 0.06 г (86%), т. пл.
NaHCO3 в
10 мл CH2Cl2 при интенсивном
110-114°С, Rf 0.75 (CHCl3). ИК спектр, ν, см-1:
перемешивании прибавляли по каплям
0.32 г
1699, 1460, 1380, 1148, 886. Спектр ЯМР 1Н, δ, м.
(0.11 мл, 2.0 ммоль) Br2 в 5 мл CH2Cl2. Реакцион-
д.: 1.20-2.09 м (6Н, CH2), 2.20 с (3H, CH3), 3.20 с
ную смесь перемешивали до обесцвечивания
(3H, OCH3), 3.62 с (1H, H6ʹʹ), 5.65 д. д (1H, H2ʹʹ, J =
раствора, при перемешивании разбавили 30 мл
1.4, J = 2.9 Гц), 7.24 д (1H, HAr, J = 7.0 Гц), 7.28-
H2O, экстрагировали 70 мл CH2Cl2. Органическую
7.37 м (2H, HAr), 7.74-7.79 м (2H, HPht), 7.85-7.94 м
фазу сушили Na2SO4. Растворитель упаривали в
(2H, HPht). Спектр ЯМР 13С, δС, м. д.: 18.12 (CH3),
вакууме, остаток хроматографировали через слой
16.60, 25.46, 26.56 (C3ʹʹ, C4ʹʹ, C5ʹʹ), 56.99 (ОCH3),
силикагеля (5 г, элюент - CHCl3). Выход 0.69 г
75.66 (C6ʹʹ), 123.33, 123.55, 127.91, 129.02, 129.34,
(90%), белый аморфный порошок, Rf 0.33 (CHCl3).
130.84, 133.98, 134.05 (C4, C5, C6, C7, C3ʹ, C4ʹ, C5ʹ,
Спектр ЯМР 1Н, δ, м. д.: 1.51-2.19 м (3×2H, 3CH2),
C2ʹʹ), 128.69, 132.08, 135.79, 136.76, 142.77, 144.51
4.72 уш. c (1H, H6’’), 5.62 д. д (1H, H2ʹʹ), 7.12 д. д
(C3a, C7a, C1ʹ, C2ʹ, C6ʹ, C1ʹʹ), 167.20, 167.46 (C1, C3).
(1H, HAr, J = 1.3, J = 7.6 Гц), 7.32-7.38 м (1H, HAr),
Масс-спектр, m/z (Iотн, %): 348 [M + H]+ (10), 316
7.62 д. д (1H, HAr, J = 1.6, J = 7.6 Гц), 7.68 д. д (2H,
[M - CH3OH + H]+ (100).
HAr, J = 3.0, J = 5.0 Гц), 7.82 д. д (2H, HAr, J = 3.0,
4-Бром-2-(1-метокси-2-бром-1-циклогексил)-
J = 5.0 Гц). Спектр ЯМР 13С, δС, м. д.: 16.70, 25.18,
анилин (12a). К раствору 0.35 г (2 ммоль) анилина
33.01 (C3ʹʹ, C4ʹʹ, C5ʹʹ),
50.81 (C6ʹʹ), 123.43, 123.60,
1a в 10 мл MeOH добавляли 0.9 г (4 ммоль) CuBr2.
128.26,
129.02,
129.10,
130.73,
131.90,
134.04,
Реакционную смесь выдерживали
24 ч при
134.08 (C4, C5, C6, C7, C2ʹ, C3ʹ, C4ʹ, C5ʹ, C2ʹʹ), 129.63,
комнатной температуре, при перемешивании
131.96, 135.93, 141.03 (C3а, C7а, C1ʹ, C2ʹ, C1ʹʹ, C6ʹ),
разбавляли 50 мл H2O, продукт экстрагировали
166.93, 167.13 (C1, C3).
70 мл CH2Cl2. Органическую фазу сушили Na2SO4,
2-[2-(6-Бром-1-циклогексен-1-ил]-6-метил-
растворитель упаривали в вакууме, остаток
фенил]-1H-изоиндол-1,3(2H)-дион (9б) получали
хроматографировали на колонке с силикагелем
аналогично из 0.634 г (2.0 ммоль) соединения 2б и
(40 г, элюент - C6H6). Выход 0.57 г (79%), Rf 0.66
0.32 г
(2.0 ммоль) Br2 в присутствии
0.98 г
(C6H6). ИК спектр, ν, см-1: 3360, 3465 (NH2). Спектр
(12 ммоль) NaHCO3. Хроматографированием на
ЯМР 1Н, δ, м. д.: 1.50-2.55 м (8H, CH2), 3.12 с (3H,
колонке с силикагелем (10 г, элюент - бензол)
OCH3), 5.18 к (1Н, C2ʹH, J = 3.0 Гц), 5.22 уш. с (2Н,
получали 0.55 г (70%) чистого образца с т. пл. 145-
NH2), 7.10 д (1H, НAr, J = 2.2), 7.37 д. т (1H, НAr, J =
155°С (C6H6), Rf 0.34 (CHCl3). ИК спектр, ν, см-1:
2.2, J = 7.6 Гц), 7.52 д (1H, НAr, J = 7.6 Гц). Спектр
719, 1380, 1461, 1699. Спектр ЯМР 1Н, δ, м. д.: 1.54-
ЯМР 13С, δС, м. д.: 19.70, 20.4, 24.9, 29.9 (4СН2),
1.61 м (2H, CH2), 1.86-2.16 м (2×2H, 2CH2), 2.18 c
50.6 (ОСН3), 52.9 (C2ʹ), 81.2 (C1ʹ), 109.3, 127.0, 144.3
(3H, CH3), 4.75 уш. с (1H, H6ʹʹ), 5.71 д. д (1H, H2ʹʹ,
(C1, C2, C4), 118.1,
131.1,
132.5 (C3, C5, C6).
J = 2.4, J = 4.6 Гц), 7.29 д (1H, HAr, J = 7.6 Гц), 7.33-
Найдено, %: С 42.85; Н 4.59; Br 43.75; N 4.28.
7.39 м (1H, HAr), 7.45 д (1H, HAr, J = 7.6 Гц), 7.79-
C13H17Br2NO. Вычислено, %: С 43.00; Н 4.72; Br
7.82 м (2H, HAr), 7.91-7.94 м (2H, HAr). Спектр ЯМР
44.01; N 4.41.
13С, δС, м. д.: 16.72, 25.15, 32.97 (C3ʹʹ, C4ʹʹ, C5ʹʹ), 18.22
(CH3), 51.29 (C6ʹʹ), 123.63, 123.72, 134.31, 134.37 (C4,
2-(1-Метокси-2-бром-1-циклогексил)анилин
(13a) получали аналогично из 0.35 г (2 ммоль)
C5, C6, C7), 128.50, 130.03 (C3ʹ, C5ʹ), 129.18 (C4ʹ),
анилина 1a и 0.45 г (2 ммоль) CuBr2. Выделяли
131.81 (C2ʹʹ), 123.77, 128.89, 131.91, 136.31, 137.03,
141.59 (C3а, C7а, C1ʹ, C2ʹ, C1ʹʹ, C6ʹ), 167.07, 167.62 (C1,
хроматографированием на колонке с силикагелем.
Выход 0.45 г (80%), Rf 0.47 (C6H6). ИК спектр, ν, см-1:
C3). Масс-спектр, m/z (Iотн, %): 316 (60) [M - Br + H]+,
3360, 3465 (NH2). Спектр ЯМР 1Н, δ, м. д.: 1.50-
334 (100) [M - Br + H2O + H]+.
2.59 м (8H, CH2), 3.15 с (3H, OCH3), 5.25 к (1Н,
2-[2-(6-Метоксициклогекс-1-ен-1-ил)-6-
C2ʹH, J = 3.0 Гц), 5.30 уш. с (2Н, NH2), 7.00-7.60 м
метилфенил]-1H-изоиндол-1,3(2H)-дион
(10).
(4H, НAr). Спектр ЯМР 13С, δС, м. д.: 19.70, 20.6,
Раствор (0.08 г, 0.2 ммоль) соединения 9б в 3 мл
24.7, 30.3 (4СН2), 50.8 (ОСН3), 53.4 (C2ʹ), 81.3 (C1ʹ),
MeOH нагревали 1 ч при кипении растворителя и
109.6, 144.0 (C1, C2), 118.0, 126.7, 131.3, 132.7 (C3,
оставили на 24 ч при комнатной температуре.
C4, C5, C6). Найдено, %: С 54.82; Н 6.19; Br 27.91; N
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ 2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
519
4.78. C13H18BrNO. Вычислено, %: С 54.94; Н 6.38;
м. д.: 17.90, 17.95, 21.37 (3CH3), 19.9, 20.5, 25.2,
Br 28.12; N 4.93.
30.0 (4СН2), 41.41 (CH1ʹʹʹ), 50.4 (C2ʹ), 54.1 (ОСН3),
81.7 (C1ʹ), 122.2, 124.0, 133.7, 141.3 (C1, C2, C4, C6),
4-Бром-2-(1-метокси-2-бром-1-циклопентил)-
122.8,
126.7,
128.5,
136.9 (C3, C5, C2ʹʹʹ, C3ʹʹʹʹ).
6-метиланилин
(12б) получали аналогично из
Найдено, %: С 62.08; Н 7.57; Br 21.54; N 3.72.
0.35 г (2 ммоль) анилина 11б и 0.9 г (4 ммоль)
C19H28BrNO. Вычислено, %: С 62.29; Н 7.70; Br
CuBr2. Выделяли хроматографированием на
21.81; N 3.82.
колонке с силикагелем. Выход 0.61 г (85%), Rf 0.67
(C6H6). ИК спектр, ν, см-1: 3370, 3460 (NH2). Спектр
ФОНДОВАЯ ПОДДЕРЖКА
ЯМР 1Н, δ, м. д.: 1.70-2.05 м (2H, C4ʹH2), 2.16 с (3H,
CH3), 2.19-2.37 м (2H, C5ʹH, C3ʹH), 2.59 д. т (1Н,
Работа выполнена в рамках проекта госзадания
C5ʹH, J = 10.0, J = 13.8 Гц), 2.68-2.82 м (1Н, C3ʹH),
по теме № АААА-А19-119011790021-4.
3.09 с (3Н, OСН3), 4.51 уш. с (2Н, NH2), 5.08 д. д. д
КОНФЛИКТ ИНТЕРЕСОВ
(1Н, Н2ʹ, J = 1.2, J = 1.6, J = 6.3 Гц), 7.13 д (1H, НAr,
J = 2.2,), 7.17 д (1H, НAr, J = 2.2 Гц). Спектр ЯМР
Авторы заявляют об отсутствии конфликта
13С, δС, м. д.: 17.50 (CH3), 19.3, 27.6, 34.8, (3СН2),
интересов.
51.4 (C2ʹ), 54.5 (ОСН3), 92.8 (C1ʹ), 106.4, 124.2,
124.4, 143.4 (C1, C2, C4, C6), 130.1, 132.7 (C3, C5).
СПИСОК ЛИТЕРАТУРЫ
Найдено, %: С 42.79; Н 4.58; Br 43.82; N 3.68.
C13H17Br2NO. Вычислено, %: С 43.00; Н 4.72; Br
1. Hurd C.D., Jenkins W.W. // J. Org. Chem.
1957.
44.01; N 3.86.
Vol. 22. N 11. P. 1418. Doi 10.1021/jo01362a029
2. Denmark S.E., Chi H.M. // Synthesis. 2017. Vol. 49.
2-(1-Метокси-2-бром-1-циклопентил)-6-
P. 2873. doi 10.1055/s-0036-1589002.
метиланилин
(13б) получали при дальнейшем
3. Hamada Y., Kunimune I., Hara O. // Heterocycles.
элюировании хроматографической колонки
2002. Vol. 56. N 1-2. P. 97. doi 10.3987/COM-01-S(K)46
предыдущего эксперимента. Выход 0.06 г (11%), Rf
4. Sharma P., Kaur N., Jain S., Kishore D. // J. Curr.
0.45 (C6H6). ИК спектр, ν, см-1: 3370, 3460 (NH2).
Chem. Pharm. Sci. 2013. Vol. 3. N 1. P. 80.
Спектр ЯМР 1Н, δ, м. д.: 1.70-2.05 м (2H, C4H2),
5. Kessler A., Coleman C.M., Charoenying P., O’Shea D.F. //
2.14 с (3H, CH3), 2.15-2.35 м (2H, C5ʹH, C3ʹH), 2.55
J. Org. Chem. 2004. Vol. 69. N 23. P. 7836. doi
д. т (1Н, C5’H, J = 10.0, J = 13.8 Гц), 2.65-2.78 м
10.1021/jo048723e
(1Н, C3ʹH), 3.10 с (3Н, OСН3), 4.45 уш. с (2Н, NH2),
6. Bumagin N.A., Luzikova E.V. // J. Organomet. Chem.
5.05 д. д. д (1Н, Н2ʹ, J = 1.2, J = 1.6, J = 6.3 Гц), 7.15-
1997. Vol. 532. N 1-2. P. 271. doi 10.1016/S0022-
7.39 м (3H, НAr). Спектр ЯМР 13С, δС, м. д.: 17.50
328X(96)06794-0
(CH3),
19.1,
27.3,
34.7
(3СН2),
51.1 (C2ʹ),
54.0
7. Гатауллин Р.Р. // Вестн. СПбГУ. 2014. Сер.
4.
(ОСН3), 92.50 (C1ʹ), 106.2, 124.3, 143.6 (C1, C2, C6),
Вып. 1. C. 52.
124.3, 130.2, 132.7 (C3, C4, C5). Найдено, %: С 54.75;
8. Ogawa T., Nakamura T., Araki T., Yamamoto K., Shuto S.,
Н 6.34; Br 27.86; N 4.81; C13H18BrNO. Вычислено,
Arisawa M. // Eur. J. Org. Chem. 2012. P. 3084. doi
%: С 54.94; Н 6.38; Br 28.12; N 4.93.
10.1002/ejoc.201200260
9. Nicolaou K.C., Roecker A.J., Hughes R., van Summeren R.,
2-(1-Метокси-2-бром-1-циклогексил)-4-(1-
Pfefferkorna J.A., Winssinger N. // Bioorg. Med. Chem.
метилбут-2-ен-1-ил)-6-метиланилин
(13в).
2003. Vol. 11. N 3. P. 465. doi 10.1016/S0968-0896(02)
Получали реакцией 0.69 г (2.7 ммоль) амина 1в
00386-3
[37] и 1.22 г (5.5 ммоль) CuBr2 в 10 мл MeOH.
10. Xu G., Wei H., Ren Y., Yin J., Wang A., Zhang T. //
Продукт выделяли хроматографированием на
Green Chem. 2016. Vol. 18. P. 1332. doi 10.1039/
колонке с силикагелем (25 г, элюент - C6H6).
c5gc01914a
Выход 0.79 г (80%), Rf 0.66 (C6H6). ИК спектр, ν,
11. Chainikova E.M., Pankratyev E.Yu., Teregulova A.N.,
см-1: 3370, 3465 (NH2). Спектр ЯМР1Н, δ, м. д.: 1.29
Gataullin R.R., Safiullin R.L. // J. Phys. Chem. (A).
д. д (3H, CH3, J = 1.0, J = 7.0 Гц), 1.69 д. д (3H, CH3,
2013. Vol. 117. N 13. P. 2728. doi 10.1021/jp401038g
J = 1.0, J = 6.2 Гц), 1.50-2.59 м (8H, 4CH2), 2.16 с
12. Brucelle F., Renaud P. // J. Org. Chem. 2013. Vol. 78.
(3H, CH3), 3.10 с (3H, OCH3), 3.27 к (1H, H1ʹʹ, J =
N 12. P. 6245. doi 10.1021/jo4009904
7.0 Гц), 4.50 уш. с (2Н, NH2), 5.30 д. д (1Н, Н2ʹ, J =
13. Reding M.T., Kabaragi Y., Tokuyama H., Fukuyama T. //
1.2, J = 6.2 Гц), 5.35-5.65 м (2Н, HC=CH), 6.75 c
Heterocycles. 2002. Vol. 55. N
1-2. P. 313. doi
(1H, НAr), 6.85 c (1H, НAr). Спектр ЯМР 13С, δС,
10.3987/COM-01-S(K)42
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
520
ХУСНИТДИНОВ и др.
14. Xu H.-D., Jia Z.-H., Xu K., Zhou H., Shen M.-H. // Org.
Спирихин Л.В., Абдрахманов И.Б. // ЖОрХ. 2001.
Lett. 2015. Vol. 17. N 1. P. 66. doi 10.1021/ol503247t
T.
37. Вып.
6. С.
881; Gataullin R.R., Afon’kin
15. Xiao Y.-C., Moberg C. // Org. Lett. 2016. Vol. 18. N 2.
I.S., Fatykhov A.A., Spirikhin L.V., Abdrakhmanov I.B. //
P. 308. Doi 10.1021/acs.orglett.5b03479
Russ. J. Org. Chem. 2001. Vol. 37. N 6. P. 834. doi
10.1023/A:1012413715466
16. Kim J.N., Lee H.J., Lee K.Y., Kim H.S. // Tetrahedron
Lett. 2001. Vol. 42. N 22. P. 3737. doi 10.1016/S0040-
27. Гатауллин Р.Р., Насыров М.Ф., Иванова Е.В.,
4039(01)00552-4
Кабальнова Н.Н., Абдрахманов И.Б. // ЖОрХ, 2002.
Т.
38. Вып.
5. С.
799; Gataullin R.R., Nasy-
17. Гатауллин Р.Р., Кажанова Т.В. Давыдова В.А.
rov M.F., Ivanova E.V., Kabal’nova N.N.,
Карачурина Л.Т., Ильясова Л.Т., Сапожникова Т.А.,
Abdrakhmanov I.B.
// Russ. J. Org. Chem.
2002.
Зарудий Ф.А., Абдрахманов И.Б. // Хим.-фарм. ж.
Vol. 38. N 5. P. 763. doi 10.1023/A:1019696030069
2001. Т. 35. № 9. С. 28; Gataullin R.R., Kazhanova
T.V., Karachurina L.T., Il’yasova L.T., Davydova V.A.,
28. Сахаутдинов И.М., Леонтьева Н.А., Галин Ф.З.,
Sapozhnikova T.A., Zarudii F.S., Abdrakhmanov I.B. //
Вафина Г.Ф. // ЖОрХ. 2008. Т. 44. Вып. 7. С. 1020;
Pharm. Chem. J. 2001. Vol. 35. N 9. P. 493. doi
Sakhautdinov I.M., Leont’eva N.A., Galin F.Z., Vafina
10.1023/A:1014094709169
G.F. // Russ. J. Org. Chem. 2008. Vol. 44. N 7. P. 1009.
doi 10.1134/S1070428008070117
18. Гатауллин Р.Р., Хазиев Э.В., Хуснитдинов Р.Н.,
29. Гринштейн Дж., Винниц М. Химия аминокислот и
Борисов И.М., Абдрахманов И.Б. // ЖПХ.
2001.
пептидов. М.: Мир, 1965. 403 c.
Т. 74. Вып. 11. С. 1850; Gataullin R.R., Khaziev
E.V., Khusnutdinov R.N., Borisov I.M., Abdrakhmanov
30. Rasberry R.D., Shimizu K.D. // Org. Biomol. Chem.
I.B. // Russ. J. Appl. Chem. 2001. Vol. 74. N 11.
2009. Vol. 7. N 19. P. 3899. doi 10.1039/B909567E
P. 1910. doi 10.1023/A:1014809214971
31. Degenhardt III C.F., Lavin J.M., Smith M.D., Shi-
19. Gudmundsson K.S., Sebahar P.R., D’Aurora
mizu K.D. // Org. Lett. 2005. Vol. 7. N 19. P. 4079. doi
Richardson L., Catalano J.G., Boggs S.D., Spaltenstein A.,
10.1021/ol051325t
Sethna P.B., Brown K.W., Harvey R., Romines K.R. //
32. Smits R.A., Adami M., Istyastono E.P., Zuiderveld O.P., van
Bioorg. Med. Chem. Lett. 2009. Vol. 19. N 13. P. 3489.
Dam C.M.E., de Kanter F.J.J., Jongejan A., Coruzzi
doi 10.1016/j.bmcl.2009.05.003
G., Leurs R., de Esch I.J.P. // J. Med. Chem. 2010.
Vol. 53. N 6. P. 2390. doi 10.1021/jm901379s
20. Morimoto Y., Shirahama H. // Tetrahedron. 1996. Vol. 52.
N 32. P. 10631. doi 10.1016/0040-4020(96)00608-4
33. Гатауллин Р.Р., Афонькин И.С., Фатыхов А.А.,
Спирихин Л.В., Абдрахманов И.Б. // Изв. АН. Сер.
21. Ziegler F.E., Berlin M.Y. // Tetrahedron Lett. 1998. Vol. 39.
хим.
2000.
№ 1. 118; Gataullin R.R., Afon’kin
N 17. P. 2455. doi 10.1016/S0040-4039(98)00286-X
I.S., Fatykhov A.A., Spirikhin L.V., Abdrakhmanov
22. Гатауллин Р.Р., Сотников А.М., Спирихин Л.В.,
I.B. // Russ. Chem. Bull. 2000. Vol. 49. N 1. P. 122. doi
Абдрахманов И.Б. // ЖОрХ. 2005. Т. 41. Вып. 5.
10.1007/BF02499076
С. 730; Gataullin R.R., Sotnikov A.M., Spirikhin L.V.,
Abdrakhmanov I.B.
// Russ. J. Org. Chem.
2005.
34. Ortgies S., Breder A. // Org. Lett. 2015. Vol.
17.
Vol. 41. N 5. P. 715. doi 10.1007/s11178-005-0231-x
P. 2748. doi 10.1021/acs.orglett.5b01156
23. Гатауллин Р.Р., Фатыхов А.А. // ЖОХ. 2008. Т. 78.
35. Li Y.-L., Li J., Ma A.-L., Huang Y.-N., Deng J. // J. Org.
Вып. 3. С. 457; Gataullin R.R., Fatykhov A.A. // Russ.
Chem. 2015. Vol. 80. N 8. P. 3841. doi 10.1021/
J. Gen. Chem. 2008. Vol. 78. N 3. P. 442. doi 10.1134/
acs.joc.5b00090
S107036320803018
24. Gataullin R.R., Sotnikov A.M., Abdrakhmanov I.B.,
37. Гатауллин Р.Р., Ишбердина Р.Р., Сотников А.М.,
Tolstikov G.A. // Mendeleev Commun. 2003. Vol. 13.
Абдрахманов И.Б. // ЖПХ. 2005. Т. 78. Вып. 3.
N 5. P. 235. doi 10.1070/MC2003v013n05ABEH001699
С. 441; Gataullin R.R., Ishberdina R.R., Sotnikov A.M.,
25. Кириллова И.А., Залимова М.А., Мулюкова Р.В.,
Abdrakhmanov I.B. // Russ. J. Appl. Chem.
2005.
Вахитова Ю.В., Хуснитдинов Р.Н., Гатауллин Р.Р. //
Vol. 78. N 3. P. 438. doi 10.1007/s11167-005-0312-1
ЖОХ. 2018. Т. 88. Вып. 3. С. 390; Kirillova I.А., Zalimo-
38. Гатауллин Р.Р., Афонькин И.С., Павлова И.В.,
va М.M., Mulyukova R.V., Vakhitova Yu.V., Gataullin
Абдрахманов И.Б. // Изв. АН. Сер. хим. 1999. № 2.
R.R. // Russ. J. Gen. Chem. 2018. Vol. 88. N 3. P. 418.
C. 398; Gataullin R.R., Afon’kin I.S., Pavlova I.V.,
doi 10.1134/S1070363218030076
Abdrakhmanov I.B. // Russ. Chem. Bull. 1999. Vol. 48.
26. Гатауллин Р.Р., Афонькин И.С., Фатыхов А.А.,
N 2. P. 396. doi 10.1007/BF02494577
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ 2-(1-ЦИКЛОАЛКЕН-1-ИЛ)АНИЛИНА
521
Functionalization of 2-(1-Cycloalken-1-yl)aniline Derivatives
R. N. Khusnitdinova, R. M. Sultanovb, and R. R. Gataullina, *
a Ufa Institute of Chemistry, Ufa Federal Research Center, Russian Academy of Sciences,
pr. Oktyabrya 71, Ufa, 450054 Russia
*e-mail: gataullin@anrb.ru
b Ufa State Petroleum Technical University, Ufa, Russia
Received November 29, 2018; revised November 29, 2018; accepted December 6, 2018
The reaction of 2-(1-cyclohexen-1-yl)aniline and -6-methylaniline with phthalic anhydride afforded 2-(2-
cyclohex-1-en-1-ylphenyl)- and 2-(2-cyclohex-1-en-1-ylphenyl)-6-methylphenyl)-1H-isoindole-1,3(2H)-diones.
The reaction of the obtained isoindole-1,3-diones with bromine in dichloromethane in the presence of sodium
bicarbonate led to the formation of the product of pseudo-allylic halogenation. Replacing halogen atom by
methoxyl group was performed by maintaining 2-[2-(6-bromocyclohex-1-en-1-ylphenyl) -6-methylphenyl)]-1H-
isoindole-1,3(2H)-dione in a methanol solution in the presence of NaHCO3. The reaction of 2-(2-cyclohex-1-en-
1-yl-6-methylphenyl)-1H-isoindole-1,3(2H)-dione with molecular bromine in the presence of methanol provided
a co-halogenation product, whereas the dibromination product was obtained in the presence of octyl alcohol.
Keywords: isoindolediones, methoxylation, bromination, phthalimides, atropisomer
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019