ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 522-527
УДК 547.415.3;547.551.1;547.316;547.815
ОДНОРЕАКТОРНЫЙ МЕТОД СИНТЕЗА
2-ГИДРОКСИБЕНЗИЛИДЕН-
4-[(АЗА,ТИО)КСАНТЕНИЛ]АНИЛИНОВ
И ВОЗМОЖНОСТЬ ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ
РЕГУЛЯТОРОВ РОСТА РАСТЕНИЙ
© 2019 г. В. Ю. Гороховa, *, Я. В. Быковa, С. А. Батуевa, Е. А. Лысцоваb,
С. М. Гороховаa, Н. Н. Ягановаa
a Пермский государственный аграрно-технологический университет имени академика Д.Н. Прянишникова,
ул. Петропавловская 23, Пермь, 614000 Россия
*e-mail: Gorokhov_V.Yu@mail.ru
b Пермский государственный национальный исследовательский университет, Пермь, Россия
Поступило в Редакцию 1 ноября 2018 г.
После доработки 1 ноября 2018 г.
Принято к печати 8 ноября 2018 г.
Осуществлен синтез
2-гидроксибензилиден-4-[(аза,тио)ксантенил]анилинов взаимодействием
2-гид-
роксибензальдегида, анилина и (аза,тио)ксантгидрола в среде уксусной кислоты или этанола. Показаны
два конкурирующих направления образования 2-гидроксибензилиден-4-[(аза,тио)ксантенил]анилинов
методом хромато-масс-спектрометрии. Изучена росторегулирующая активность 2-гидроксибензилиден-4-
(5Н-бензопирано[2,3-b]пиридин-5-ил)анилина на яровой пшенице сорта Горноуральская.
Ключевые слова:
4-гетерилацетанилиды,
2-гидроксибензилиден-4-[(аза,тио)ксантенил]анилины,
ароматические имины, регуляторы роста растений
DOI: 10.1134/S0044460X19040048
Интерес к N-бензилиденанилинам связан с их
работах
[23,
24] показано образование произ-
разнообразной биологической активностью. Среди
водных N-бензилиденанилинов в реакциях дегидри-
них известны препараты, обладающие антиокси-
рования соответствующих вторичных аминов.
дантной
[1], противотуберкулезной [2] и анти-
Ранее нами был разработан метод синтеза,
бактериальной активностью [3]. Некоторые аро-
позволяющий получать пара-замещенные N-бензил-
матические имины применяются в сельском хозяй-
иденанилины, содержащие в анилиновом фраг-
стве в качестве регуляторов роста растений [4-9].
менте гетероциклический заместитель (9Н-ксантен,
Известен ряд методов синтеза ароматических
9Н-тиоксантен или 1-азаксантен) в среде уксусной
иминов, например прямое взаимодействие
кислоты [25] и изучена антимикробная активность
бензальдегида и анилина (или их производных) в
некоторых из них [26].
среде толуола [10-11], этанола [13-16], метанола
В настоящей работе поставлена задача изучить
[17], этанол-уксусная кислота [18, 19] или без
влияние сольватационного фактора на направление
участия растворителя
[20]. Также N-бензил-
однореакторного синтеза 2-гидроксибензилиден-4-
иденанилины (имины) могут быть получены
[(аза,тио)ксантенил]анилинов и исследовать их
конденсацией бензилового спирта с анилином в
прикладные свойства.
среде толуола в присутствии молекулярного
кислорода и катализаторов на основе Au, Pd, Ru
Однореакторный синтез 2-гидроксибензилиден-
[21] или конденсацией ароматических нитрозо-
4-[(аза,тио)ксантенил]анилинов
4a-в проводили
соединений с веществами, содержащими активи-
путем взаимодействия 2-гидроксибензальдегида 1,
рованную метиленовую группу [22]. В некоторых
анилина 2 и соответствующих гидролов (9Н-ксантен-
522
ОДНОРЕАКТОРНЫЙ МЕТОД СИНТЕЗА
523
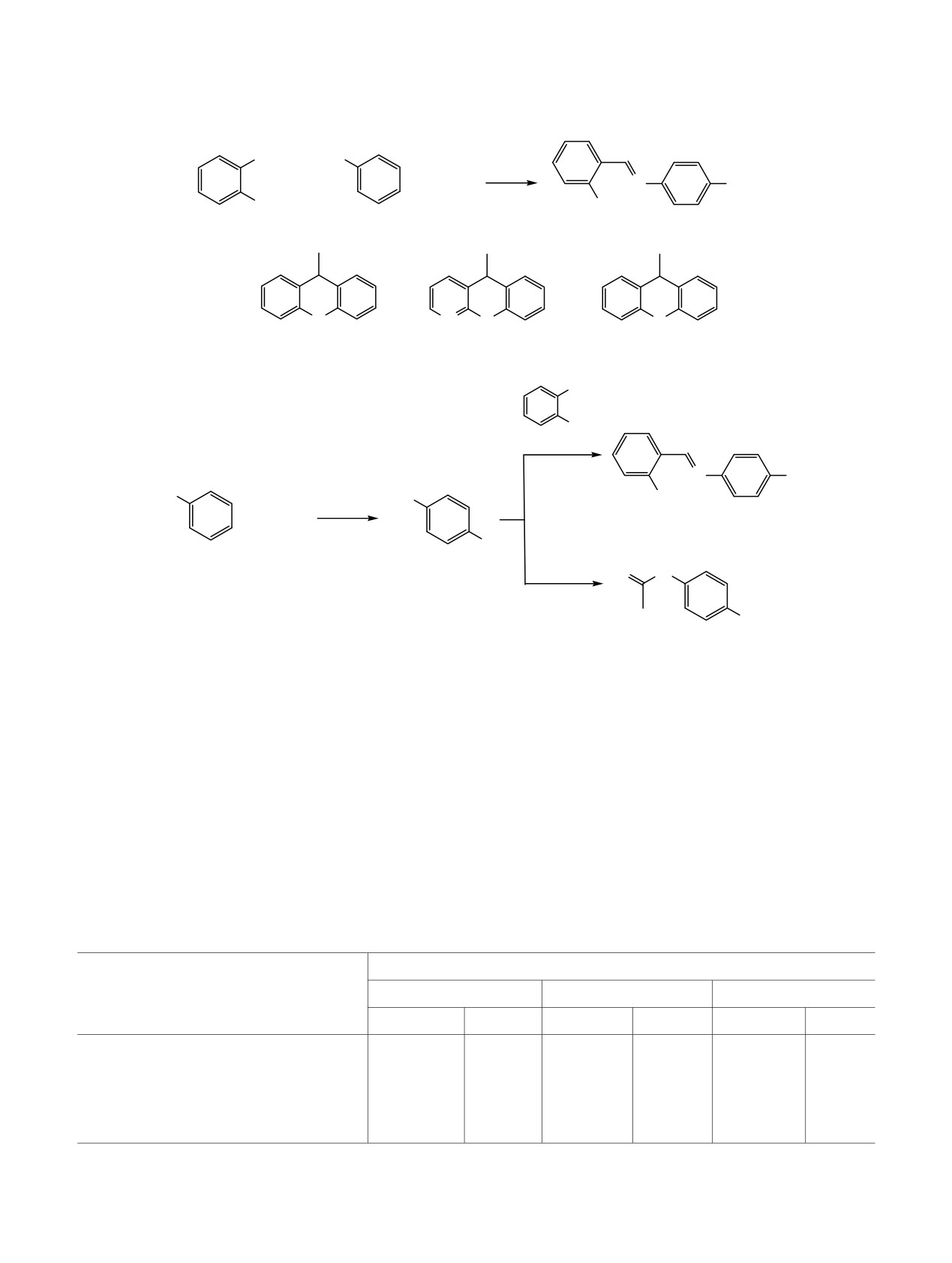
Схема 1.
CHO H2N
+
+
HtOH
N
Ht
OH
OH
1
2
3a-в
4a-в
Ht =
(a),
(б),
(в).
O
N O
S
Схема 2.
CHO
OH
1
-H2O
N
Ht
H2N
H2N
OH
AcOH
а
+
HtOH
-H2O
4a-в
Ht
H
2
3a-в
A
AcOH
O
N
-H2O
Ht
5a-в
9-ола 3a, 5H-бензопирано[2,3-b]пиридин-5-ола 3б или
растворителя на ход исследуемой реакции было
9Н-тиоксантен-9-ола 3в) в среде 43%-ной уксусной
проведено методом хромато-масс-спектрометрии,
кислоты или
96%-ного этанола с добавлением
результаты которого представлены в табл.
1.
соляной кислоты (схема 1). При использовании в
Полученные данные позволили обнаружить два
качестве растворителя уксусной кислоты выход
направления образования 2-гидроксибензилиден-4-
целевого продукта составляет 47-60%, при замене
[(аза,тио)ксантенил]анилинов 4a-в. Так, в среде
растворителя на этанол выход равен 45-84%.
уксусной кислоты кроме образования конечных
продуктов
4а-в идет конкурирующий процесс
В многокомпонентных системах часто наблю-
ацилирования интермедиата А с образованием 4-
дается несколько конкурирующих направлений
гетерилацетанилидов
5а-в, что указывает на
реакции. Детальное исследование влияния
протекание реакции по пути а (схема 2).
Таблица 1. Влияние растворителя на состав реакционной массы в синтезе 2-гидроксибензилиден-4-[(аза,тио)-
ксантенил]анилинов 4a-в
Содержание, %
Компонент реакционной массы
3а
3б
3в
AcOH
EtOH
AcOH
EtOH
AcOH
EtOH
Интермедиат А
-
5.06
10.16
0.32
0.25
-
Интермедиат Б
-
-
57.94
26.36
20.22
-
4a-в
99.06
94.94
27.23
73.32
63.07
100
5а-в
0.94
-
4.67
-
16.46
-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
524
ГОРОХОВ и др.
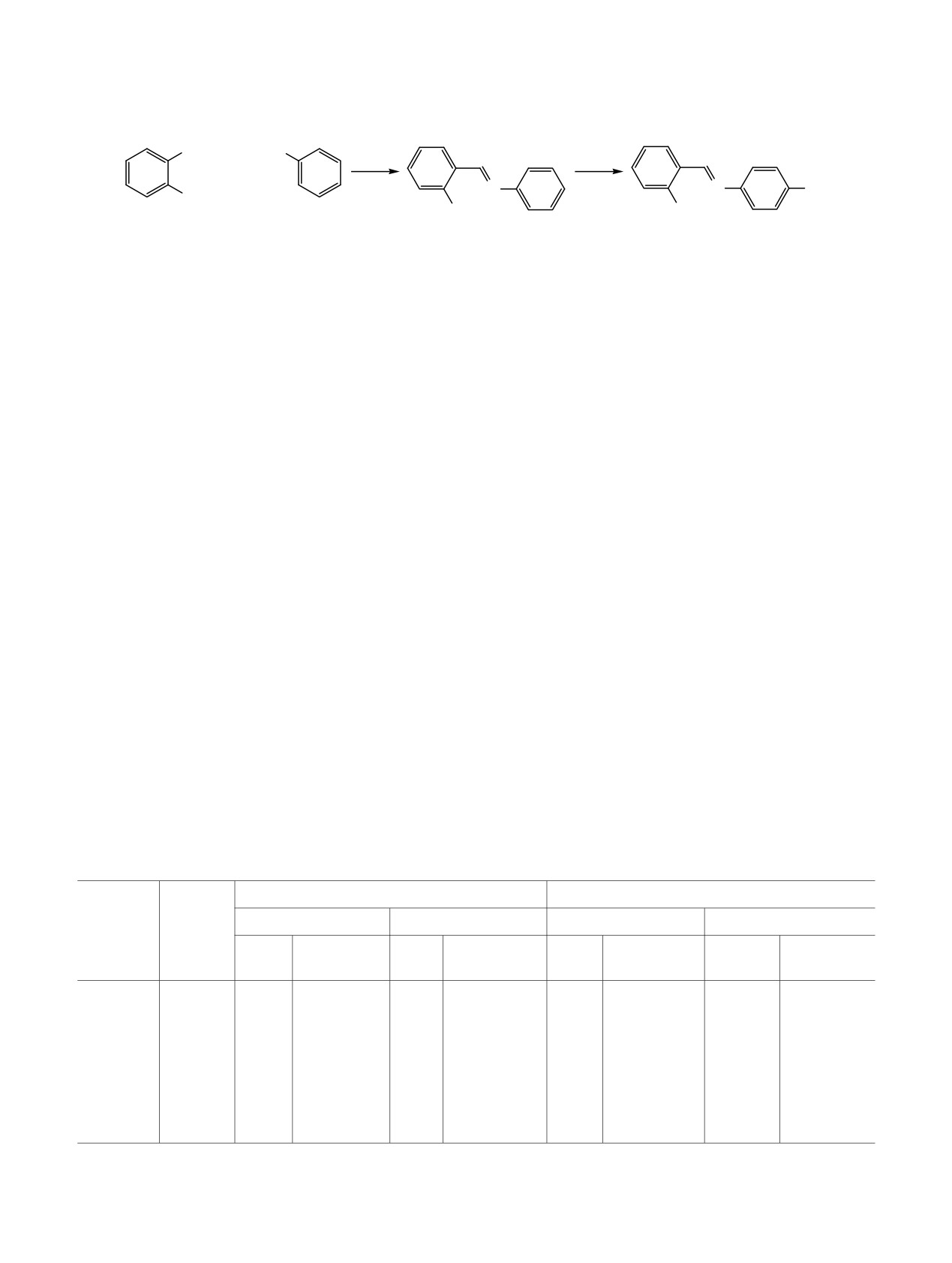
Схема 3.
CHO
H2N
EtOH
б
HCl
3a-в
+
−H2O
-H2O
N
N
Ht
OH
OH
OH
1
2
Б
4a-в
При использовании азаксантгидрола 3б в среде
физиологически активных фрагмента (азометино-
этанола реакция протекает преимущественно через
вый и азаксантеновый), способных проявлять
образование интермедиата Б, обнаруженного в
росторегулирующие свойства [4-9, 28].
реакционной массе. Невысокое содержание соеди-
Из данных табл. 2 видно, что соединение 4б в
нения
4б, по-видимому, связано с низкой
концентрации
0.001% повышает количество
скоростью гетерилирования (путь б, схема 3). В
продуктивных растений на 5%, а общее количество
случае с ксантгидролом 3а наблюдается высокое
стеблей во всех концентрациях увеличивается на
содержание целевого продукта 4а, однако предпо-
7-13%. В концентрациях
0.001 и
0.0005%
лагаемый интермедиат Б не обнаружен, что,
увеличивается средняя высота растений на 8 и 6%
вероятно, связано с высокой скоростью процесса
соответственно, масса соломы увеличивается на
гетерилирования.
22-23% в концентрациях 0.005 и 0.0001%, а масса
В реакции с тиоксантгидролом 3в наблюдается
колосьев увеличивается на 5-12% (табл. 3).
приблизительно одинаковое процентное содер-
Отличительной
особенностью
действия
жание
4-тиоксантенилацетанилида
5в и интер-
соединения 4б является значительное увеличение
медиата Б, что указывает на образование
(на 98%) массы корневой системы при использо-
соединения 4в по пути а или б. Замена раство-
вании раствора с концентрацией
0.001%, что
рителя на этанол исключает конкурирующий
позволяет увеличить интенсивность потребления
процесс ацилирования, и образование соединений
питательных веществ растением.
4а-в идет по пути б с незначительным повы-
шением выходов.
В концентрациях 0.005 и 0.001% увеличивается
число зерен в соцветиях на 2-3%, а биологическая
По известной методике [27] в полевых условиях
урожайность яровой пшеницы повышается на 0.13-
изучена росторегулирующая активность гетерили-
0.15 т/га по отношению как к контролю, так и к
рованных иминов на яровой пшенице сорта
эталонному препарату (табл. 4).
Горноуральская. В качестве модельного объекта
исследования выбрано новое соединение - 2-гид-
Таким образом, замена растворителя (уксусной
роксибензилиден-4-(5Н-бензопирано[2,3-b]пиридин-
кислоты) в синтезе
2-гидроксибензилиден-4-
5-ил)анилин
4б, содержащее два потенциально
[(аза,тио)ксантенил]анилинов на этанол приводит к
Таблица 2. Структура продуктивного стеблестоя яровой пшеницы сорта Горноуральская
Количество растений
Количество стеблей
общих
продуктивных
общих
продуктивных
Вариант
с, %
отклонение,
отклонение,
отклонение,
отклонение,
шт/м2
шт/м2
шт/м2
шт/м2
+/-
+/-
+/-
+/-
Контроль
290
-
290
-
348
-
338
-
Эталон
258
-16
258
-16
356
+3
326
-6
4б
0.0050
290
0
282
-4
372
+12
338
+2
0.0010
304
+7
304
+7
384
+17
326
+9
0.0005
284
-4
218
-36
392
+21
338
+14
0.0001
256
-17
256
-17
380
+15
326
+5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ОДНОРЕАКТОРНЫЙ МЕТОД СИНТЕЗА
525
Таблица 3. Влияние концентрации соединения 4б на генеративные и вегетативные части растений
Средняя высота
Масса соломы
Масса колосьев
Масса корней
Вариант
с, %
отклонение,
отклонение,
отклонение,
отклонение,
см
г
г
г
+/-
+/-
+/-
+/-
Контроль
94.50
-
305.56
-
250.84
-
121.10
-
Эталон
89.30
-5.17
354.98
+24.71
184.80
-33.02
195.04
+36.97
4б
0.0050
88.60
-5.90
371.58
+23.01
240.70
-5.07
239.34
+59.12
0.0010
101.75
-+7.25
356.42
+25.43
274.08
-+11.62
130.36
+4.63
0.0005
100.75
-+6.25
314.18
+4.31
262.54
- +5.85
164.36
+21.63
0.0001
101.00
-+6.50
374.92
+34.68
281.60
-+15.38
159.92
+19.41
небольшому увеличению выхода целевых
внутренний стандарт
- ГМДС. Масс-спектры
продуктов, но при этом позволяет избежать
сняты на хромато-масс-спектрометре Agilent
образования побочных ацетанилидов. В ходе
Technologies 6890N/5975B (США), колонка НР-5ms
агрохимических испытаний выявлено положи-
(30 × 0.25 мм, 0.25 мкм), газ-носитель - гелий,
тельное влияние
2-гидроксибензилиден-4-(5Н-
ионизация электронным ударом (70 эВ), темпера-
бензопирано[2,3-b]пиридин-5-ил)анилина на рост и
тура термостата колонки - 100°С. Контроль за
развитие яровой пшеницы сорта Горноуральская в
чистотой полученных соединений осуществляли с
концентрациях 0.005 и 0.001%.
помощью метода тонкослойной хроматографии на
пластинах Sorbfil ПТСХ-П-А-УФ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общая методика синтеза соединений 4а-в.
Спектры ЯМР 1Н сняты на приборе Mercury
Смесь эквимолекулярных количеств (по 1 ммоль)
300ВВ (Varian, США, 300 MГц) в растворах СDCl3,
2-гидроксибензальдегида 1, анилина 2 и соответ-
Таблица 4. Показатели урожайности яровой пшеницы сорта Горноуральская
Количество
Биологическая
Число зерен в
Продуктивность
продуктивных
Масса 1000 зерен
урожайность
соцветии
соцветия
стеблей
зерна
Вариант
с, %
шт./м2
шт.
г
г
т/га
Контроль
338
-
14.08
-
35.23
-
0.50
-
1.69
-
Эталон
326
-6
14.33
+0.25
34.44
-0.79
0.49
-0.01
1.60
-0.09
4б
0.0050
338
+2
14.43
+0.35
33.33
-1.90
0.48
-0.02
1.64
-0.05
0.0010
326
+9
14.53
+0.45
35.05
-0.18
0.51
+0.01
1.82
+0.13
0.0005
338
+15
14.28
+0.20
35.32
+0.09
0.50
0
1.84
+0.15
0.0001
326
+6
14.53
+0.45
34.66
-0.57
0.50
0
1.75
+0.06
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
526
ГОРОХОВ и др.
ствующего гидрола 3а-в в 7 мл 43%-ной уксусной
СПИСОК ЛИТЕРАТУРЫ
кислоты (или 7 мл 96%-ного этанола и 1 капли 36%-
1. Calil N.O., de Carvalho G.S.G., Zimmermann Franco D.C.,
ной соляной кислоты) нагревали в течение 10 мин
da Silva A.D., Barbosa Rapos N.R. // Lett. Drug Design
при
90°С. Реакционную массу охлаждали и
Discov. 2012. N 9. P. 8. doi 10.2174/157018012798192928
нейтрализовали
25%-ным раствором аммиака.
2. Тлегенов Р.Т. // Хим. раст. сырья. 2007. № 4. С. 69.
Кристаллический осадок промывали водой и
3. Karki S.S., Butle S.R., Shaikh R.M., Zubaidha P.K.,
перекристаллизовывали из этанола.
Pedgaonkar G.S., Shendarkar G.S., Rajput C.G. // Res.
J. Pharm. Biol. Chem. Sci. 2010. Vol. 1. N 4. P. 707.
2-Гидроксибензилиден-4-(9Н-ксантен-9-ил)-
4. Johnson W.O., Warner H.L., Yih R.Y. Pat.
3862833
анилин (4а). Выход 0.18 г (49%, AcOH), 0.32 г
(1975). USA.
(84%, EtOH
+ HCl), светло-желтые кристаллы,
5. Huneck S., Schreiber K., Schulze C., Sembdner G. Pat.
т. пл. 177-178°С (EtOH). Спектр ЯМР 1Н, δ, м. д.:
122915 (1976). DDR.
5.27 с (1Н, С9Н, Ht), 6.85-7.37 м (16Н, Ar + Ht),
6. Grimmecke H-D., Huneck S., Schreiber K., Schulze C.,
8.54 с (1Н, СН=N), 13.20 уш. с (1Н, ОН). Масс-
Sembdner G. Pat. 123053 (1976). DDR.
спектр, m/z (Iотн, %): 377 (69) [М]+, 360 (1), 271 (1),
7. Мазитова А.К., Хамаев В.Х., Аминова Г.К., Сухаре-
257 (10), 196 (1.1), 181 (100), 120 (0.6), 76 (1.7).
ва И.А., Спарс Н.П. Пат. 2146251 (1999). РФ // Б. И.
2-Гидроксибензилиден-4-(5Н-бензопирано[2,3-
1996. № 6.
b]пиридин-5-ил)анилин (4б). Выход 0.22 г (60%,
8. Мазитова А.К., Хамаев В.Х., Сухарева И.А., Улямае-
AcOH),
0.17 г
(45%, EtOH
+ HCl), желтые
ва Э.Ш. Пат. 2146252 (1999) РФ. // Б. И. 1996. № 6.
кристаллы, т. пл. 194°С (EtOH). Спектр ЯМР 1Н, δ,
9. Тимофеев В.П., Селимов Ф.А., Джемелев У.М. Пат.
м. д.: 5.34 с (1Н, С5Н, Ht), 6.89-7.44 м (15Н, Ar +
2101277С1 (1998) РФ. // Б. И. 2006. № 31.
Ht), 8.20-8.21 м (1Н, СН=N, Ht), 8.56 с (1Н, СH=N),
10. Hania M.M. // Eur. J. Med. Chem. 2009. Vol. 6. N 3.
13.14 уш. с (1Н, ОН). Масс-спектр, m/z (Iотн, %): 378
P. 629.
(78) [М]+, 361 (1), 260 (14), 258 (10.5), 196 (1.5), 182
11. Dutta S. // Pharm. Chem. J. 2014. Vol. 48. N 7. P. 448.
(100), 120 (1), 76 (2.5).
doi 10.1007/s11094-014-1129-0
12. De-Chun Z. // Acta Crystallogr. 2002. Vol. 58. P. 351.
2-Гидроксибензилиден-4-(9Н-тиоксантен-9-
doi 10.1107//S0108270102006479
ил)анилин (4в). Выход 0.35 г (47%, AcOH), 0.28 г
13. Senthilkannan K., Gunasekaran S. // Int. J. Chem. Tech.
(74%, EtOH + HCl), желтые кристаллы, т. пл. 150°С
Res. 2013. Vol. 5. N 6. P. 3051.
(EtOH). Спектр ЯМР 1Н, δ, м. д.: 5.35 с (1Н, С9Н,
14. Hankare A.S., Barhate V.D. // Int. J. Curr. Pharm. Res.
Ht), 6.84-7.64 м (16Н, Ar + Ht), 8.51 с (1Н, СН=N),
2014. Vol. 6. N 1. P. 30.
13.21 уш. с (1Н, ОН). Масс-спектр, m/z (Iотн, %): 393
15. Ibrahim M.N., Hamad K.J., Al-Joroshi S.H. // Asian J.
(64) [М]+, 376 (0.7), 288 (0.6), 273 (6.8), 197 (100),
Chem. 2006. Vol. 18. N 3. P. 2404. doi 10.1007/s10973-
182 (100), 196 (4.2), 120 (0.6), 76 (2).
015-4617-x
N-[4-(9H-Ксантен-9-ил)фенил]ацетамид
(5а)
16. Bae S.J., Ha Y.M., Park Y.J., Park J.Y., Song Y.M.,
выделить в индивидуальном состоянии не удалось.
Ha T.K., Chun P., Moon H.R., Chung H.Y. // Eur. J.
Масс-спектр, m/z (Iотн, %): 315 (41.0) [М]+, 257 (7.0),
Med. Chem. 2012. Vol. 57. P. 383. doi 10.1016/
j.ejmech.2012.09.026
181 (100), 152 (8.2).
17. Дикусар Е.А., Поткин В.И., Стёпин С.Г. // Вестн.
N-[4-(5H-Хромено[2,3-b]пиридин-5-ил)фенил]-
Витебск. гос. технол. унив. 2012. Вып. 22. С. 116.
ацетамид
(5б) выделить в индивидуальном
18. Upadhyaya K., Gude V., Mohiuddin G., Nandiraju R.V.S. //
состоянии не удалось. Масс-спектр, m/z (Iотн, %):
Beilstein J. Org. Chem. 2013. Vol. 9. P. 26. doi
316 (37.7) [М]+, 273 (16.4), 182 (100), 43 (12.5).
10.3762/bjoc.9.4.
N-[4-(9H-Тиоксантен-9-ил)фенил]ацетамид (5в)
19. Yong-S.Y., Jun-Hwan I., Bong-Hwan H., Myongsoo L.,
выделить в индивидуальном состоянии не удалось.
Moon-Gun C. // Bull. Korean Chem. Soc. 2001. Vol. 22.
Масс-спектр, m/z (Iотн, %): 331 (31.6) [М]+, 288 (7.9),
N 12. P. 1350.
197 (100), 165 (10.5).
20. Schmeyers J., Toda F., Bo J., Kaupp G. // J. Chem. Soc.
Perkin Trans. 2. 1998. P. 989. doi 10.1039/A704633B
КОНФЛИКТ ИНТЕРЕСОВ
21. Hao S., Fang-Zheng S., Ji N., Yong C., He-Yong H.,
Kang-Nian F. // Angew. Chem. Int. Ed. 2009. Vol. 48.
Авторы заявляют об отсутствии конфликта
P. 4390. doi 10.1002/anie.200900802
интересов.
22. Ehrlich P., Sachs F. // Ber. 1899. Vol. 32. P. 2341.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ОДНОРЕАКТОРНЫЙ МЕТОД СИНТЕЗА
527
23. Юнникова Л.П. // ХГС. 1995. № 7. С. 1003; Yunni-
Pharm. Chem. J. 2016. Vol. 50. N 8. P. 530. doi
kova L.P. // Chem. Heterocycl. Compd. 1995. Vol. 31.
10.1007/s11094-016-1483-1
N 7. P. 877. doi 10.1007/BF01170754
27. Доспехов Б.А. Методика полевого опыта (с основами
24. Юнникова Л.П. // ЖОрХ. 1995. Т. 31. Вып. 1. C. 76.
статистической обработки результатов исследо-
25. Горохов В.Ю., Щуренко С.М. // Бутлеровск. сообщ.
ваний). М.: Книга по требованию, 2012. 352 с.
2014. Т. 39. Вып. 8. С. 91.
28. Peter P., Costin R., Norbert M., Juergen K., Uwe K.,
26. Горохов В.Ю., Махова Т.В. // Xим.-фаpм. ж. 2016.
Matthias G., Helmut W., Andreas L., Karlotto W. Pat.
Т. 50. № 8. С. 33; Gorokhov V.Y., Makhova T.V. //
EP 1994/000073 (1994). EU.
One-Pot Synthesis Method of 2-Hydroxybenzylidene-
4-[(aza, thio)xanthenyl]anilines and Their Plant
Growth Regulator Activity
V. Yu. Gorokhova, *, Ya. V. Bykova, S. A. Batueva, E. A. Lystsovab,
S. M. Gorokhovaa, and N. N. Yaganovaa
a Academician D.N. Pryanishnikov Perm State Agro-Technological University, ul. Petropavlovskaya 23, Perm, 614000 Russia
*e-mail: Gorokhov_V.Yu@mail.ru
b Perm State National Research University, Perm, Russia
Received November 1, 2018; revised November 1, 2018; accepted November 8, 2018
The synthesis of 2-hydroxybenzylidene-4-[(aza, thio)xantenyl]anilines was carried out by reacting 2-hydroxy-
benzaldehyde, aniline and (aza, thio)xanthydrol in an acetic acid or ethanol medium. Two competing directions
for the formation of 2-hydroxybenzylidene-4-[(aza, thio)xantenyl]anilines were revealed by chromatography-
mass spectrometry method. The growth-regulating activity of 2-hydroxybenzylidene-4-(5H-benzopyrano[2,3-b]-
pyridin-5-yl)aniline was studied in spring wheat varieties Gornouralskaya.
Keywords: 4-heterylacetanilides, 2-hydroxybenzylidene-4-[(aza, thio)xantenyl]anilines, aromatic imines, plant
growth regulators
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019