ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 528-533
УДК 547.856.1
ПАЛЛАДИЙ-КАТАЛИЗИРУЕМЫЙ СИНТЕЗ
4-АМИНОХИНАЗОЛИНОВ ИЗ ЭФИРОВ
АМИДОКСИМОВ И 2-ИОДБЕНЗОНИТРИЛА
© 2019 г. М. Я. Демаковаa, *, Р. М. Исламоваa, В. В. Суслоновb
a Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: st008217@spbu.ru
b Ресурсный центр «Рентгенодиффракционные методы исследования»,
Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 19 января 2019 г.
После доработки 19 января 2019 г.
Принято к печати 24 января 2019 г.
4-Замещенные О-бензилбензамидоксимы реагируют с 2-иодбензонитрилом в присутствии 0.1 мол%
[Pd2(dba)3], 0.2 мол% XantPhos и 1.5-кратным избытком Cs2CO3 в диоксане в атмосфере аргона с
образованием 4-амино-2-арилхиназолинов. Данная реакция представляет собой новый тип каскадного
процесса, приводящего к производным
4-аминохиназолина без использования высокореакционо-
способных хлорирующих агентов.
Ключевые слова: оксимы, палладий, хиназолин, кросс-сочетание, металлокомплексный катализ
DOI: 10.1134/S0044460X1904005X
4-Аминохиназолины являются фармакологически
батывают весьма реакционоспособными хлори-
важным классом аминогетероциклов вследствие
рующими агентами, такими как PОCl3 или SOCl2
того, что на их основе создаются эффективные
(схема 1, а), с последующим ароматическим нуклео-
противораковые препараты, многие из которых
фильным замещением хлора аминогруппой (б).
уже внедрены в клиническую практику [1] или
проходят доклинические испытания
[2--5]. В
Избежать использования токсичных хлориру-
частности, в современной медицинской практике
ющих агентов возможно при получении 4-амино-
используются такие препараты, как Gefitinib,
хиназолинов взаимодействием 2-иодбензонитрилов
Erlotinib, Lapatinib и Vandetanib, которые
с первичными амидинами [6-8] (схема 2). Однако
эффективны против широкого спектра раковых
использование первичных амидинов, наиболее
заболеваний человека [1].
часто получаемых реакцией Пиннера, является
неудобным вследствие сложностей, связанных с их
Методы синтеза 4-аминохиназолинов системати-
получением (абсолютные растворители, сухой
зированы в обзоре
[1]. К основным методам
газообразный HCl) и хранением из-за склонности к
получения относятся реакции циклоконденсации
производных
2-аминобензойной кислоты и
гидролизу. Более того, использование сухого
окисление хиназолина [1]. Причем в большинстве
газообразного HCl является не менее опасным и
случаев и те и другие реакции протекают через
экологически неблагоприятным, чем исполь-
образование хиназолин-4(3Н)-онов, которые обра-
зование POCl3 и SOCl2.
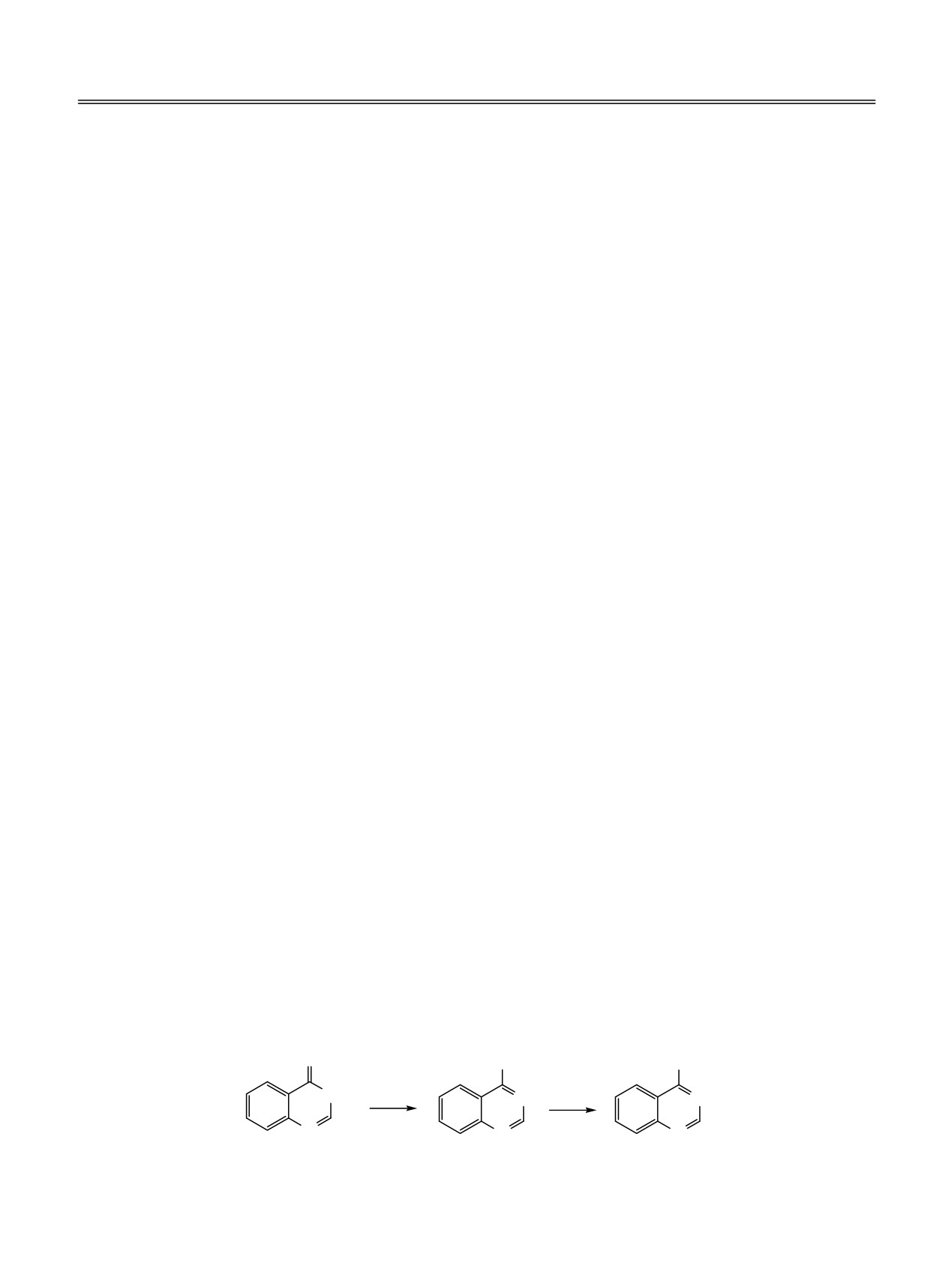
Схема 1.
O
Cl
NR2
NH
a
N
б
N
N
N
N
528
ПАЛЛАДИЙ-КАТАЛИЗИРУЕМЫЙ СИНТЕЗ 4-АМИНОХИНАЗОЛИНОВ
529
Схема 2.
NR2
N
NH
CuI
N
+
H2N R
I
N R
Вследствие этого разрабатываются иные
присутствии металлоцентров в низких степенях
подходы к получению 4-аминохиназолинов, которые
окисления способны восстанавливаться до
включают использование субстратов, более
амидинов in situ [14-17]. Более того получение
простых в получении и хранении, чем первичные
амидоксимов не требует использования осушенных
амидины, получение которых не предполагает
растворителей и токсичных летучих реагентов и
использования токсичных субстратов. В частности,
может проводиться в этаноле или воде [13]. Таким
была разработана методология получения
4-
образом, в рамках данной работы было решено
аминохиназолинов с использованием альдегидов и
разработать методологию получения
4-амино-
азида натрия в присутствии солей меди(I) [9, 10].
хиназолинов из амидоксимов, выступающих в роли
Реакция протекает с умеренными выходами,
удобных синтетических аналогов амидинов.
однако сопровождается образованием потенци-
Известно, что О-замещенные амидоксимы
ально взрывоопасных азидов тяжелых металлов.
арилируются по амидному атому азота иодарилами
Вследствие этого разработка синтетически удобных
в присутствии системы
[Pd2(dba)3]-XantPhos-
и безопасных методов получения 4-аминохина-
Cs2CO3
[18,
19]. В рамках нашей работы эта
золинов на сегодняшний день остается актуальной
методика была адаптирована для получения 4-амино-
задачей.
хиназолинов из эфиров амидоксимов с исполь-
Целью настоящего исследования являлась разра-
зованием 2-иодбензонитрила в качестве иодарила.
ботка метода получения производных 4-аминохина-
Установлено, что 4-замещенные О-бензилбензамид-
золина, который не предполагал бы использования
оксимы 1-5 реагируют с 2-иодбензонитрилом 6 в
токсичных летучих субстратов и не включал
присутствии
0.1 мол%
[Pd2(dba)3],
0.2 мол%
использования нестабильных при хранении в
XantPhos и
1.5-кратного избытка Cs2CO3 в
обычных условиях (неосушенная атмосфера воздуха,
диоксане в атмосфере аргона при 100°C в течение
комнатная температура) органических реагентов.
18 ч с образованием 4-амино-2-арилхиназолинов
7-11 (схема 3, а).
Ранее было показано, что оксимы являются
удобными субстратами для получения широкого
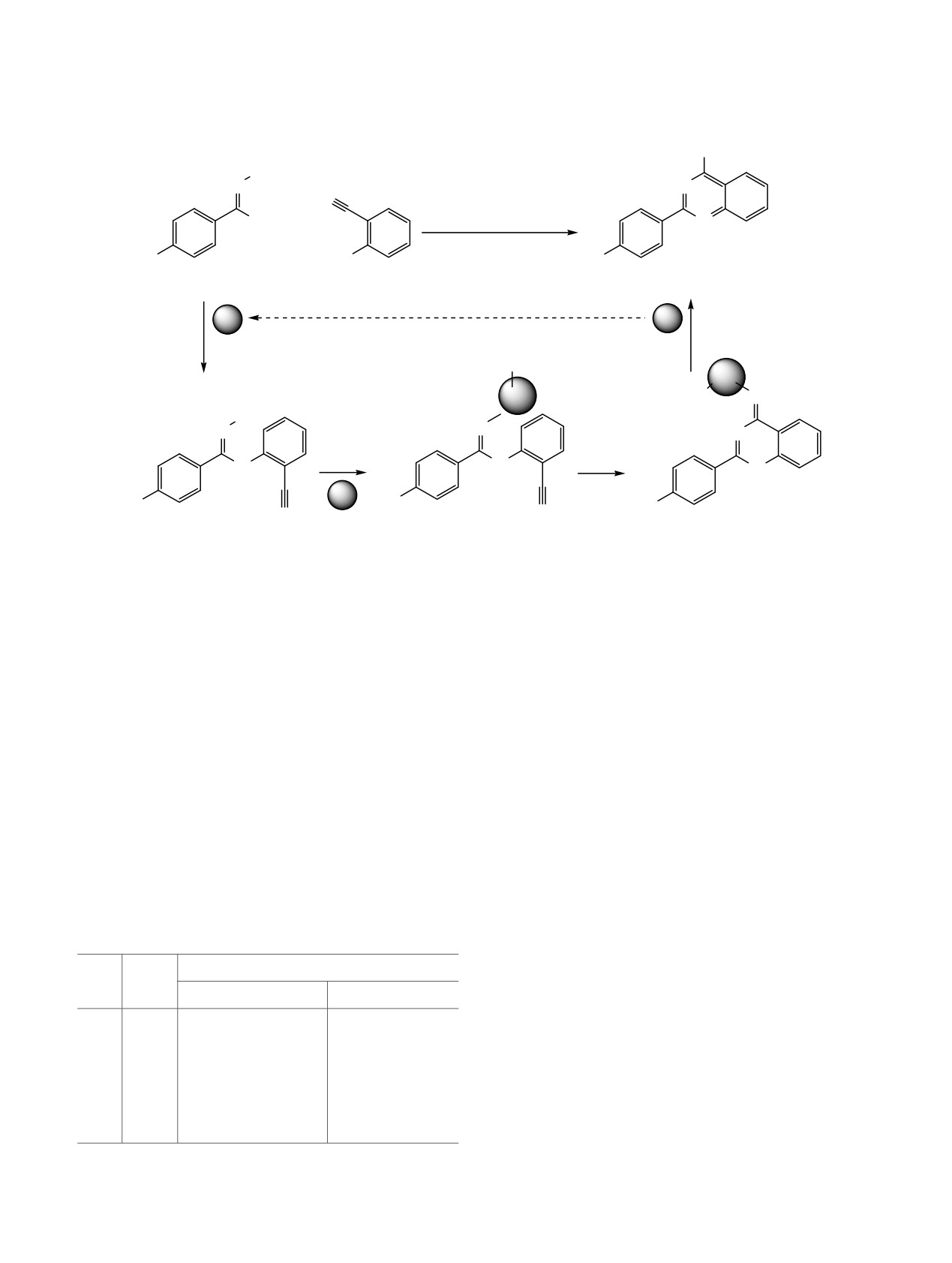
Наиболее вероятный механизм реакции включает
спектра азагетероциклов [11]. Большинство таких
в себя первичное аминирование эфира амидоксима
реакций являются металлопромотируемыми и
по Бухвальду-Хартвигу (б) [18, 19], окислительное
зачастую сопровождаются разрывом связи N-O.
внедрение палладия(0) по связи N-O (в)
[11],
Таким образом, за счет разрыва связи N-O оксимы
замыкание цикла за счет присоединения по связи
в ряде случаев выступают аналогами иминов, а
C≡N (г), протонирование и таутомеризацию с
амидоксимы - амидинов. Стоит отметить, что до
образованием 4-аминохиназолина и палладия(II)
наших исследований была известна работа, в
(д), который, вероятно, восстанавливается в
которой 4-аминохиназолины получали из производ-
условиях реакции до каталитически активного
ных
2-аминобензонитрилов и хлороксимов в
палладия(0). Стоит отметить, что была предпри-
присутствии олова(II) [12]. Реакция приводила к 4-
нята попытка получения 4-аминохиназолинов 7-11
аминохиназолинам с высокими выходами, однако
из О-бензиламидоксимов 1-5 и (2-цианофенил)
получение хлороксимов предполагает использо-
борной кислоты в условиях реакции Чана-Лама
вание реакционоспособных хлорирующих агентов,
[Cu(OAc)2, диоксан, на воздухе]. Образование
что противоречит цели данной работы и совре-
гетероциклов
7-11 было зафиксировано с
менной парадигме развития органической химии.
помощью масс-спектрометрии, однако выделить из
В отличие от амидинов, используемых при
реакционных смесей их не удалось. Таким образом,
получении
4-аминохиназолинов, амидоксимы
для Nамид-арилирования эфиров амидоксимов
могут неограниченно долго храниться в обычных
реакция Бухвальда-Хартвига оказалась более
условиях без заметных следов разложения [13] и в
эффективной, чем реакция Чана-Лама.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
530
ДЕМАКОВА и др.
Схема 3.
NH2
a
OBn
0.1 мол% [Pd2(dba)3],
N
0.2 мол% XantPhos,
N
N
1.5 экв. Cs2CO3,
диоксан, 100°C, 18 ч
NH2
N
+
R
I
R
1-5
6
7-11
Восстановление
д
б
Pd0
PdII
-"HI"
-BnO-
Η+
OBn
PdII
PdII
BnO
N
OBn
N
N
N
в
N
г
N
N
H
H
H
Pd0
R
R
R
N
N
Палладий-катализируемая реакция протекает с
Максимальные выходы были достигнуты в
выходами
25-47% (ЯМР
1Н). Полученные
условиях, указанных выше. Попытки выделения
соединения были выделены с препаративными
получаемых соединений
7-11 из реакционных
выходами
13-28% (см. таблицу). Очевидной
смесей путем их кристаллизации за счет
взаимосвязи между природой заместителя R в
медленного упаривания растворителя и путем
амидоксимах 1-5 и выходом ЯМР 1Н продуктов 7-
охлаждения реакционных смесей до 10°C (ниже
11 установить в рамках исследований не удалось.
происходила кристаллизация диоксана) приводили
Существенные потери соединений
7-11 при
к кристаллизации продуктов реакции, содержащих
выделении обусловлены их близкими временами
значительные примеси не идентифицированных
удерживания на силикагеле с неидентифицирован-
побочных продуктов.
ными побочными продуктами. В рамках
оптимизации реакции варьировали температуру (50-
Все полученные соединения являются извест-
115°C), относительное количество каталитической
ными, и их физико-химические характеристики
системы (вплоть до 5 мол% [Pd2(dba)3] и 10 мол%
(т. пл., данные ЯМР
1Н и
13С{1H}, масс-
XantPhos), растворитель (хлороформ, ацетонитрил,
спектрометрии) согласуются с установленными
диоксан, толуол), основание (Et3N, K2CO3, Cs2CO3,
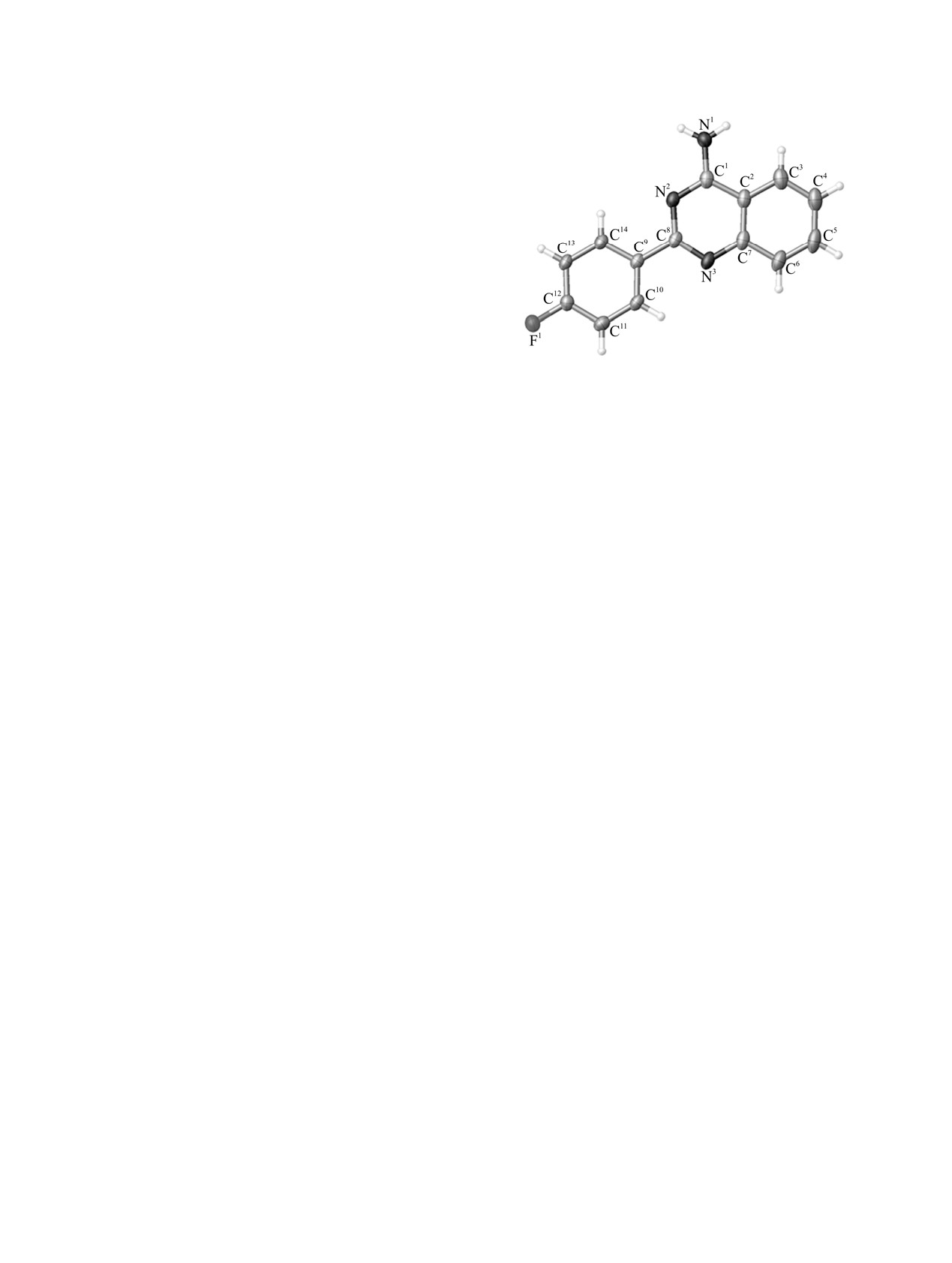
ранее [20]. Фторпроизводное 10 было впервые
NaH) и продолжительность проведения (1-24 ч).
охарактеризовано с помощью рентгенострук-
турного анализа (см. рисунок). Данные рентгено-
структурного анализа свидетельствуют о том, что в
Препаративные и ЯМР 1Н выходы 4-аминохиназолинов
кристаллической ячейке содержатся две кристал-
7-11
лографически независимые молекулы соединения
Выход, %
10. В молекулярной структуре связи C-C фениль-
№
R
ного кольца хиназолинового фрагмента находятся
ЯМР 1Н
препаративный
в диапазоне от 1.364(3) до 1.420(2) Å, и такие
7
MeO
32
17
значения свидетельствуют о полной делокализации
8
Me
47
24
π-системы [21]. В пиримидиновом кольце длины
связей N2-C1 и N3-C8 [1.314(2)-1.340(2) Å] близки
9
H
44
21
к двойным, в то время как длины связей N2-C8, N3-
10
F
38
28
C7 [1.364(2)-1.380(2) Å], а также C1-C2 [1.437 и
11
NO2
25
13
1.441 Å] имеют значения, близкие к одинарным
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ПАЛЛАДИЙ-КАТАЛИЗИРУЕМЫЙ СИНТЕЗ 4-АМИНОХИНАЗОЛИНОВ
531
связям
[21]. Длина связи N1-C1
[1.346(2) и
1.348(2) Å] имеет промежуточный характер между
одинарной и двойной
[21]. Торсионные углы
N2C8C9C14 равны 4.17 и 9.64°.
В результате проведенных исследований
разработана удобная методика синтеза 4-амино-
хиназолинов, не требующая использования высоко-
реакционоспособных хлорирующих реагентов и
включающая применение стабильных при хране-
нии в обычных условиях субстратов. Стоит также
отметить и то, что реакция протекает в
присутствии всего лишь
0.1% палладийфосфи-
Общий вид молекулы соединения
10 в кристалле
нового катализатора, и такая малая загрузка
(тепловые эллипсоиды представлены с вероятностью
катализатора также сказывается на снижении
50%).
токсичности проводимых синтезов. Недостатком
реакции является сложность выделения конечных
установлено как 1.5Ueq(O) и O-H 0.85 Å для воды.
продуктов, однако в перспективе разработанную
Полные кристаллографические данные соединения
методологию получения
4-аминохиназолинов
10 депонированы в Кембриджский банк рентгено-
можно использовать в
том случае, если
структурных данных (CCDC 1891327).
получаемые гетероциклы не являются конечными
продуктами реакции и планируется их дальнейшая
Синтез соединений 7-11. Смесь 4-замещенного
модификация без промежуточного выделения.
O-бензилбензамидоксима 1-5 (0.5 ммоль), 2-иод-
бензонитрила 6 (0.5 ммоль) и Cs2CO3 (0.75 ммоль)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
в 2 мл безводного диоксана продували аргоном,
затем добавляли предварительно приготовленную
Спектры ЯМР 1Н и 13С{1Н} записывали в СDCl3
и продутую аргоном каталитическую систему,
на приборе Bruker Avance
(400 MГц). Масс-
состоящая из [Pd2(dba)3] (0.5 мкмоль) и XantPhos
спектры регистрировали в МеОН на приборе
(1 мкмоль), в 2 мл диоксана. Реакционную смесь
Bruker microTOF. Температуры плавления измеряли
выдерживали при 100°C в течение 18 ч, затем
на приборе Stuart SMP30.
охлаждали до комнатной температуры. Раство-
ритель отгоняли, остаток растворяли в этилацетате
Рентгеноструктурные исследования. Кристаллы
(2 мл), фильтровали через цеолит и промывали
соединения
10, пригодные для рентгено-
водой (2 × 1 мл), затем раствором NaCl (2 × 1 мл).
структурного анализа, были получены путем
Конечный продукт выделяли с помощью
медленного упаривания раствора соединения 10 в
колоночной хроматографии (SiO2,
70-230 меш,
этилацетате при комнатной температуре на
Merck), элюент - гексан-этилацетат (15:1, по объему).
воздухе. Исследование образца проводили на
дифрактометре Rigaku Supernova, оснащенном
2-(4-Метоксифенил)хиназолин-4-амин
(7).
микрофокусным источником рентгеновского излу-
Выход 17% (21.4 мг), т. пл. 169°C. Спектр ЯМР 1Н,
чения и детектором отраженных рентгеновских
δ, м. д.: 3.89 с (3Н, СН3), 5.64 уш. с (2H, NH2), 7.12
лучей HyPix-3000. Измерения проводили при
д (2H, CH, J = 8.8 Гц), 7.35-7.40 м (1H, CH), 7.65-
100 K с использованием монохроматического CuKα
7.85 м (4H, CH), 8.28 д (1H, CH, J = 8.8 Гц). Спектр
-излучения. Структура решена методом Intrinsic
ЯМР 13С{1H}, δС, м. д.: 57.18, 113.42, 113.71,
Phasing и уточнена с использованием программы
123.66,
125.11,
127.48,
129.56,
131.04,
133.59,
SHELXL [22], встроенной в комплекс OLEX2 [23].
149.87, 159.69, 161.01, 161.95. Масс-спектр (ESI+),
Поправка на поглощение введена в программном
m/z: 252.1138 [M + H]+ (вычислено: 252.1132).
комплексе CrysAlisPro
[24]. Позиции атомов
водорода органических молекул рассчитаны по
2-(4-Метилфенил)хиназолин-4-амин (8). Выход
алгоритмам, заложенным в программном ком-
24% (28.2 мг), т. пл. 131°C. Спектр ЯМР 1Н, δ,
плексе OLEX2, где Uiso(H) установлено как 1.2Ueq(С)
м. д.: 2.41 с (3Н, СН3), 5.99 уш. с (2H, NH2), 7.32 д
и С-H 0.95 Å для групп CH, Uiso(H) установлено
(2H, CH, J = 8.2 Гц), 7.45-7.50 м (1H, CH), 7.75-
как 1.2Ueq(N) и N-H 0.88 Å для группы NH2, Uiso(H)
7.85 м (4H, CH), 8.30 д (1H, CH, J = 8.2 Гц). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
532
ДЕМАКОВА и др.
ЯМР 13С{1H}, δС, м. д.: 20.40, 113.37, 123.14, 124.85,
СПИСОК ЛИТЕРАТУРЫ
128.08, 128.47, 129.03, 133.13, 135.99, 138.94, 151.02,
160.41, 162.88. Масс-спектр (ESI+), m/z:
236.1176
1. Липунова Г.Н., Носова Э.В., Чарушин В.Н., Чупа-
хин О.Н. // Усп. хим. 2016. Т. 85. № 7. С. 759;
[M + H]+ (вычислено: 236.1182).
Lipunova G.N., Nosova E.V., Charushin V.N.,
2-Фенилхиназолин-4-амин
(9). Выход
21%
Chupakhin O.N. // Russ. Chem. Rev. 2016. Vol. 85.
(23.2 мг), т. пл. 135°C. Спектр ЯМР 1Н, δ, м. д.: 5.77
N 7. P. 759. doi 10.1070/rcr4591
уш. с (2H, NH2), 7.40-7.55 м (4H, CH), 7.70-7.80 м
2. Mphahlele M.J., Maluleka M.M., Aro A., McGaw L.J.,
(2H, CH), 7.95 д (1H, CH, J = 8.2 Гц), 8.48 c (1H,
Choong Y.S. // J. Enzyme Inhib. Med. Chem. 2018. Vol. 33.
CH). Спектр ЯМР 13С{1H}, δС, м. д.: 113.14, 121.85,
N 1. P. 1516. doi 10.1080/14756366.2018.1510919
125.79.
128.54,
128.60,
128.78,
130.32,
133.45,
3. Liu F., Huai Z., Xia G., Song L., Li S., Xu Y., Hong K.,
138.61, 150.93, 160.88, 161.67. Масс-спектр (ESI+),
Yao M., Liu G., Huang Y. // Bioorg. Med. Chem. Lett.
m/z: 236.1176 [M + H]+ (вычислено: 236.1182).
2018. Vol.
28. N
14. P.
2561. doi
10.1016/
j.bmcl.2018.05.033
2-(4-Фторфенил)хиназолин-4-амин (10). Выход
4. Fan Y.H., Ding H.W., Liu D.D., Song H.R., Xu Y.N.,
28% (33.5 мг), т. пл. 143°C. Спектр ЯМР 1Н, δ,
Wang J. // Bioorg. Med. Chem. 2018. Vol. 26. N 8.
м. д.: 5.72 уш. с (2H, NH2), 7.18 т (2H, CH, J =
P. 1675. doi 10.1016/j.bmc.2018.02.015
8.7 Гц), 7.48 т (1H, CH, J = 7.6 Гц), 7.76 д (1H, CH,
5. Hao C., Zhao F., Song H., Guo J., Li X., Jiang X., Huan R.,
J = 8.3 Гц), 7.81 д (1H, CH, J = 8.3 Гц), 7.96 д (1H,
Song S., Zhang Q., Wang R., Wang K., Pang Y., Liu T.,
CH, J = 8.3 Гц), 8.52 д (1H, CH, J = 5.7 Гц), 8.54 д
Lu T., Huang W., Wang J., Lin B., He Z., Li H., Li F.,
(1H, CH, J = 5.7 Гц). Спектр ЯМР 13С{1H}, δС, м. д.:
Zhao D., Cheng M. // J. Med. Chem. 2018. Vol. 61. N 1.
112.92, 115.22 д (J = 21.5 Гц), 121.57, 125.76,
P. 265. doi 10.1021/acs.jmedchem.7b01342
128.81, 130.41 д (J = 8.5 Гц), 133.32, 134.65, 151.00,
6. Feng J.B., Wu X.F. // Org. Biomol. Chem. 2015. Vol. 13.
N 43. P. 10656. doi 10.1039/c5ob01587a
159.89, 161.38, 164.43 д (J = 249.5 Гц). Масс-спектр
(ESI+), m/z:
240.0929
[M
+ H]+ (вычислено:
7. Yan S., Dong Y., Peng Q., Fan Y., Zhang J., Lin J.-B. //
RSC Adv.
2013. Vol.
3. P.
5563. doi
10.1039/
240.0932).
c3ra23059g
2-(4-Нитрофенил)хиназолин-4-амин (11). Выход
8. Qiao R., Fu H., Yang X., Liu H., Jiang Y., Zhao Y. //
13% (17.3 мг), т. пл. 208°C. Спектр ЯМР 1Н, δ,
Synlett. 2010. Vol. 2010. P. 101. doi 10.1055/s-0029-
м. д.: 6.01 уш. с (2H, NH2), 7.64 м (1H, CH), 7.90-
1218530
7.85 м (2H, CH), 8.39 д (1H, CH, J = 8.3 Гц), 8.46 д
9. Chen D., Yang L., Luo H., Sun Y., Shi Z., Ni K., Li F. //
(2H, CH, J = 8.2 Гц), 8.80 д (2H, CH, J = 8.2 Гц).
Synthesis. 2017. Vol. 49. N 11. P. 2535. doi 10.1055/s-
Спектр ЯМР 13С{1H} не регистрировали вслед-
0036-1588727
ствие низкой растворимости соединения в CDCl3.
10. Jia F.C., Zhou Z.W., Xu C., Cai Q., Li D.K., Wu A.X. //
Масс-спектр (ESI+), m/z:
267.0880
[M
+ H]+
Org. Lett. 2015. Vol. 17. N 17. P. 4236. doi 10.1021/
(вычислено: 267.0877).
acs.orglett.5b02020
11. Bolotin D.S., Bokach N.A., Demakova M.Ya., Kukush-
ФОНДОВАЯ ПОДДЕРЖКА
kin V.Yu. // Chem. Rev. 2017. Vol. 117. N.
21.
P. 13039. doi 10.1021/acs.chemrev.7b00264
Работа выполнена при финансовой поддержке
12. Patil S.S., Mhaske P.C., Patil S.V., Bobade V.D. //
Российского научного фонда (грант
№ 18-73-
J. Heterocycl. Chem. 2011. Vol. 48. N 3. P. 652. doi
00036, синтез и исследование соединений) и
10.1002/jhet.572
Российского фонда фундаментальных исследо-
13. Bolotin D.S., Bokach N.A., Kukushkin V.Yu. // Coord.
ваний (грант № 18-33-20062, рентгеноструктурный
Chem. Rev. 2016. Vol. 313. P. 62. doi 10.1016/
анализ) с использованием оборудования ресурсных
j.ccr.2015.10.005
центров Санкт-Петербургского государственного
14. Dondoni A. // J. Chem. Soc. Chem. Comm. 1975. N 18.
университета
«Магнитно-резонансные методы
P. 761. doi 10.1039/C39750000761
исследования»,
«Методы анализа состава
15. Akazome M., Kondo T., Watanabe Y. // J. Mol. Catal.
вещества» и
«Рентгенодифракционные методы
1993. Vol. 80. N 3. P. 383. doi 10.1016/0304-5102(93)
исследования».
85011-H
16. Mahajan U.S., Godinde R.R., Mandhare P.N. // Synth.
КОНФЛИКТ ИНТЕРЕСОВ
Commun.
2011.
Vol.
41.
P.
2195.
doi
10.1080/00397911.2010.488307.
Авторы заявляют об отсутствии конфликта
17. Duros V., Sartzi H., Teat S.J., Sanakis Y., Roubeau O.,
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ПАЛЛАДИЙ-КАТАЛИЗИРУЕМЫЙ СИНТЕЗ 4-АМИНОХИНАЗОЛИНОВ
533
Perlepes S.P. // Inorg. Chem. Commun. 2014. Vol. 50.
Orpen A.G., Taylor R. // J. Chem. Soc. Perkin Trans.
P. 117. doi 10.1016/j.inoche.2014.10.017
1987. Vol. 12. P. S1. doi 10.1039/P298700000S1
18. Anbazhagan M., Stephens C.E., Boykin D.W.
//
22. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Tetrahedron Lett. 2002. Vol. 43. N 23. P. 4221. doi
P. 112. doi 10.1107/S0108767307043930
10.1016/S0040-4039(02)00775-X
23. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
19. Abele E., Rubina K., Golomba L., Abele R.
//
ward J.A.K., Puschmann H. // J. Appl. Crystallogr.
Heterocycl. Lett. 2012. Vol. 2. N 1. P. 85.
2009. Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
20. Xu M.M., Cao W.B., Xu X.P., Ji S.J. // Chem. Commun.
24. CrysAlisPro. Data Collection and Processing Software
2018. Vol. 54. N. 89. P. 12602. doi 10.1039/c8cc07721e
for Agilent X-ray Diffractometers. 1.171.36.20, Agilent
21. Allen F.H., Kennard O., Watson D.G., Brammer L.,
Technologies. 2012.
Palladium-Catalyzed Synthesis of 4-Aminoquinazolines
from Amidoxime Ethers and 2-Iodobenzonitrile
M. Ya. Demakovaa, *, R. M. Islamovaa, and V. V. Suslonovb
a St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: st008217@spbu.ru
b Center for X-ray Diffraction Studies, St. Petersburg State University, St. Petersburg, Russia
Received January 19, 2019; revised January 19, 2019; accepted January 24, 2018
4-Substituted O-benzylbenzamidoximes react with 2-iodobenzonitrile in the presence of 0.1 mol% [Pd2(dba)3],
0.2 mol% XantPhos and a 1.5-fold excess of Cs2CO3 in dioxane under argon atmosphere to form 4-amino-2-
arylquinazolines. This reaction is a new type of cascade process leading to 4-aminoquinazoline derivatives
without the use of highly reactive chlorinating agents.
Keywords: oximes, palladium, quinazoline, cross-coupling reaction, metal complex catalysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019