ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 534-541
УДК 547.792;547.794.3
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 1,2,4-ТРИАЗОЛОВ,
1,3,4-ТИАДИАЗОЛОВ И ИХ ВОЗДЕЙСТВИЕ НА УРОВЕНЬ
МЕТИЛИРОВАНИЯ ДНК
© 2019 г. Т. Р. Овсепянa, *, М. Р. Акопянa, Р. Е. Мурадянa, Л. Э. Нерсесянa,
А. С. Агаронянa, И. С. Даниелянa, Н. С. Минасянb
a Институт тонкой органической химии имени А. Л. Мнджояна Научно-технологического центра органической и
фармацевтической химии Национальной академии наук Республики Армения,
пр. Азатутян 26, Ереван, 0014 Армения
*e-mail: tag.hovsepyan@mail.ru
b Центр исследования строения молекул Научно-технологического центра
органической и фармацевтической химии Национальной академии наук, Ереван Армения
Поступило в Редакцию 8 ноября 2018 г.
После доработки 8 ноября 2018 г.
Принято к печати 15 ноября 2018 г.
В продолжение поиска биологически активных соединений среди функционально-замещенных азолов на
основе некоторых производных 1,2,4-триазол-3-тиолов и 1,3,4-тиадиазолов синтезирован ряд новых
соединений с фармакологически активными карбоксамидным, гидрокси- или карбоксиалкильным, а
также с N-ациклонуклеозидным, N-циано- или карбоксиэтильным фрагментами в различных
положениях гетероциклов. Выявлена способность отдельных представителей этого класса соединений
ингибировать метилирование опухолевой ДНК в опытах in vitro. Соединение с наибольшей активностью
выбрано для дальнейшего исследования in vivo.
Ключевые слова: 1,2,4-триазол, 1,3,4-тиадиазол, цианоэтилирование, алкилирование, ациклонуклеозид,
метилирование ДНК
DOI: 10.1134/S0044460X19040061
Внимание исследователей последних лет к
практически лишено токсичности. Разнообразие
производным
1,2,4-триазола и
1,3,4-тиадиазола
биологических свойств производных
1,2,4-три-
связано с тем, что многие из них проявляют
азола и 1,3,4-тиадиазола свидетельствует о свое-
широкий спектр биологической активности [1, 2],
образном влиянии фармакологически активных
нашли применение как лекарственные средства
заместителей в определенных положениях гетеро-
или находятся на пути к внедрению в медицинскую
циклов на биологическую активность. В связи с
практику в качестве противоопухолевых
[3-5],
этим представляется перспективным расширение
антибактериальных [6, 7], противогрибковых [8, 9],
круга этого класса соединений путем разработки
антивирусных [10, 11], противосудорожных [12,
новых вариантов их функционализации и продол-
13] и других средств.
жения изучения фармакологической активности.
По результатам биологических испытаний
Нами получены новые производные
1,2,4-
среди некоторых ранее синтезированных нами
триазол-3-тиола, 1,3,4-тиадиазола с 3-бромфенокси-
соединений с 4-бромфенильнм [14], 4-бром(хлор)-
метиленовым и бензильным заместителями в
феноксиметиленовым
[15],
4-алкоксибензильным
положении 5 гетероциклов и изучены их прев-
[16, 17] заместителями выявлены вещества, обла-
ращения (схема
1).
Ценные биологические
дающие умеренным противоопухолевым, влияю-
свойства
1,2,4-триазол-3-тиолов
[1] послужили
щим на метилирование опухолевой ДНК, мутаген-
основой для введения новых функциональных
ным и антимутагенным действием
[18]. Боль-
групп в кольцо отработанными нами ранее
шинство этих соединений малотоксично или
методами [19]. В качестве алкилирующих агентов
534
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 1,2,4-ТРИАЗОЛОВ
535
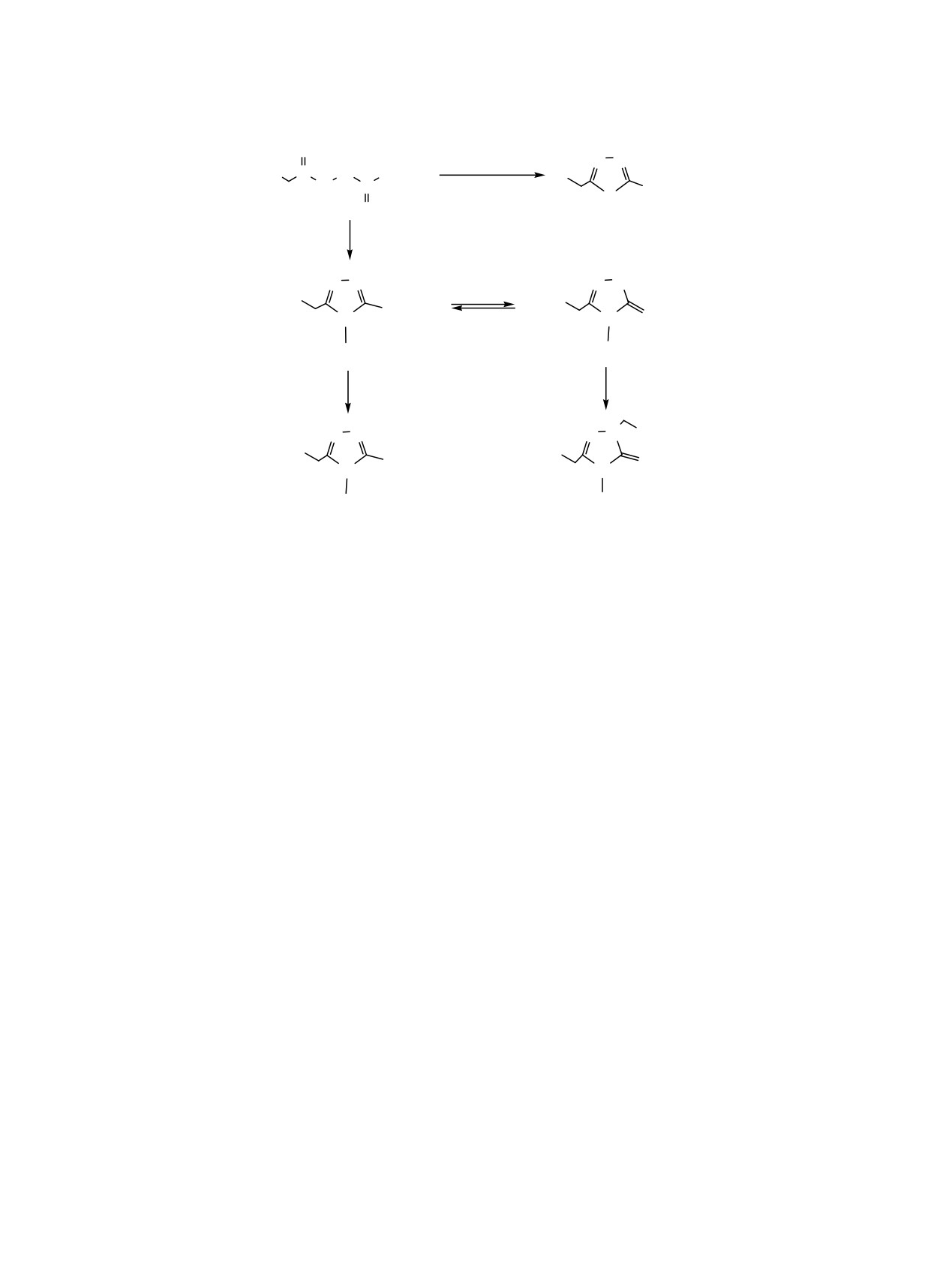
Схема 1.
O
H
(1) H2SO4
N
N
R1
C
N NHR2
R1
N
C
(2) CH2=CHCN
NR2R3
H
S
S
4a, б
KOH, H2O
N
N
N NH
R1
R1
SH
N
1a-д
N S
R2
R2
HlgR3, CH2O
HlgR3
N
N
N
N
R3
1
R
R1
SR3
S
N
N
R2
R2
2a-ж
3a-в
R1 = Ph, R2 = Ph (1a), C6H11 (1б); R1 = 3-BrC6H4O, R2 = Bn (1в), All (1г), C6H11 (1д); R1 = Ph, R2 = C6H11, R3 = CH2CH2OH
(2а); R1 = 3-BrC2H4O, R2 = Bn, R3 = CH2CH2OH (2б), CH2CONH2 (2в), CH2COOH (2г), CH(CH3)COOH (2д); R1 =
3-BrC2H4O, R2 = C6H11, R3 = CH2COOH (2е); R1 = 3-BrC2H4O, R2 = All, R3 = CH2CONH2 (2ж); R1 = Ph, R2 = C6H11, R3 =
морфолин-4-ил (3а); R1 = R2 = Ph, R3 = CH2CN (3б), CH2COOH (3в); R1 = Ph, R2 = H, R3 = COPh (4а); R1 = Ph, R2 =
CH2CH2CN, R3 = COPh (4б).
были выбраны галогениды алифатических кислот,
ный сигнал группы NCH2N в области 5.02 м. д., а в
2-хлорацетамид, а также этиленхлоргидрин.
спектрах соединенй 3б и 3в присутствуют триплет-
ные сигналы группы NCH2CH2 в соответствующих
4Н-1,2,4-Tриазол-3-тиолы 1а-д получены внутри-
областях, которые наряду с данными спектров
молекулярной циклизацией 1,4-дизамещенных тио-
ЯМР 13С подтверждают структуру соединений 3а-в.
семикарбазидов по методике
[14]. Строение
триазолов 1а-д подтверждено данными ИК и ЯМР
4-Бензоилзамещенный тиосемикарбазид также
1Н спектроскопии. Синглетные сигналы протонов
легко циклизуется в соответствующий
1,3,4-
группы SCH2 в области 3.80-4.10 м. д. в спектрах
тиадиазол
4а при дегидратации в присутствии
ЯМР 1Н соединений
2а-ж свидетельствуют о
концентрированной серой кислоты. Исходя из
протекании реакции алкилирования по нуклео-
бинуклеофильной реакционной способности 1,3,4-
фильному центру SН соединений 1a-д.
тиадиазол-2-аминов, полученный N-(5-бензил-1,3,4-
Взаимодействие триазола 1б с морфолином при
тиадиазол-2-ил)бензамид
4а был подвергнут
комнатной температуре по реакции Манниха
цианоэтилированию с целью уточнения, по какому
приводило к N2-аминометильному производному
реакционому центру - эндоциклическому атому N3
3а. А в результате реакций карбокси- или циано-
или аминному атому азота в боковой цепи
-
этилирования со свежеперегнанными акрило-
присоединяется цианоэтильная группа. При
нитрилом и акриловой кислотой в присутствии
аналогичной реакции с 5-замещенными 1,3,4-тиади-
основного катализатора триэтиламина синтези-
азол-2-тиолами цианоэтилированию подвергается
рованы N2-замещенные 1,2,4-триазолы 3б, в. В
не группа SH, а эндоциклический атом азота N3
спектре ЯМР 1Н соединения 3а в отличие от
[20]. В данном случае анализ спектров ЯМР 1Н и
спектров S-алкилированных производных
2a-ж
13С подтверждает образование N-(5-бензил-1,3,4-
наблюдается относительно слабопольный синглет-
тиадиазол-2-ил)-N-(2-цианоэтил)бензамида 4б.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
536
ОВСЕПЯН и др.
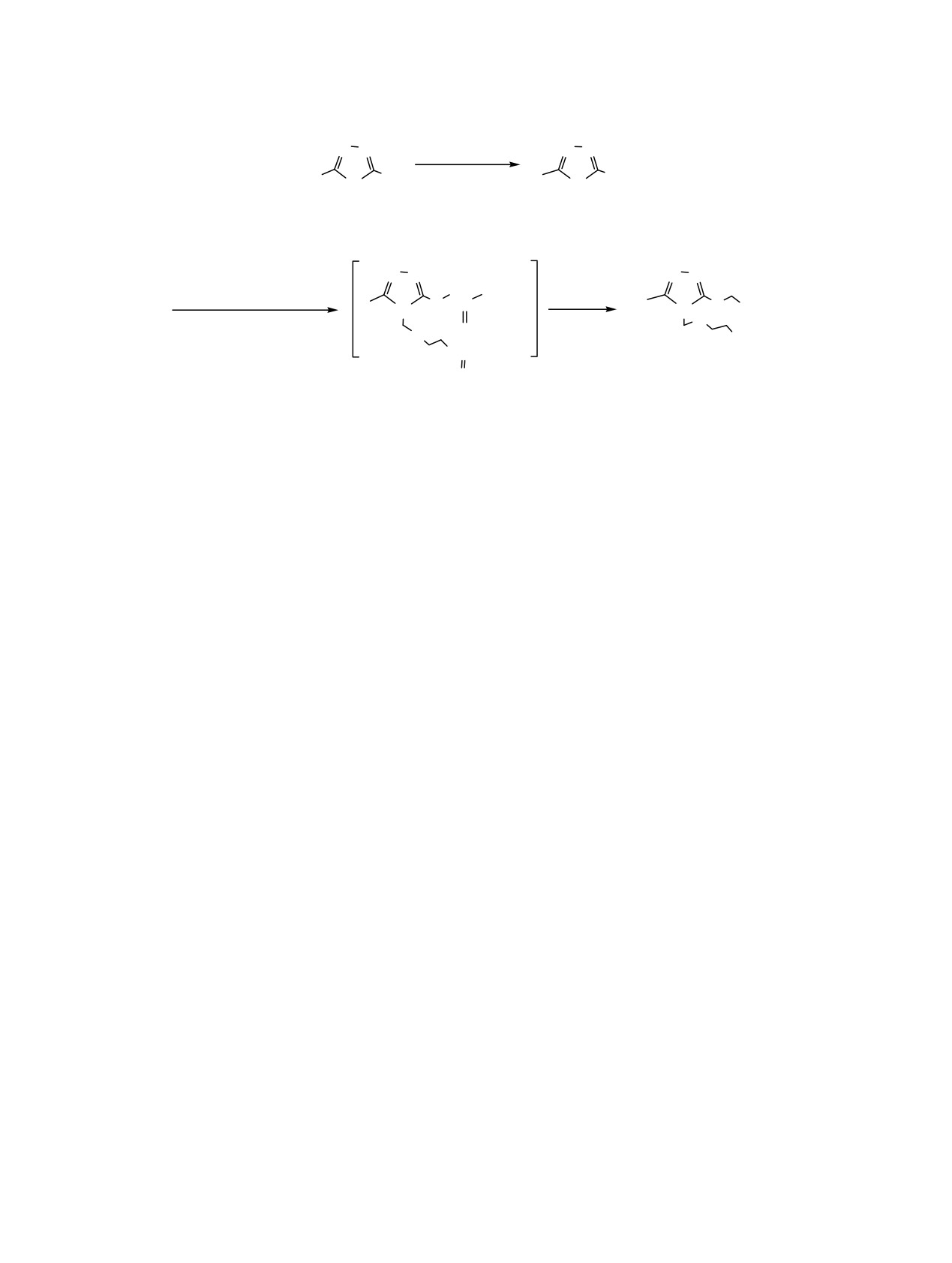
Схема 2.
N
N
N
N
ClCH2COOC2H5
R
SH
R
SCH2COOC2H5
N
N
H
H
5a, б
6a, б
N
N
N
N
ClCH2OCH2CH2OCOC6H5
OC2H5
CH3ONa
R
S C
R
N
N
S COOH
CH3OH
O
O
O
OH
OCC6H5
7a, б
O
R = Bn, 4-Br-C6H4.
С целью оптимальной функционализации 1,2,4-
Нами исследовано действие функционализи-
триазольного кольца была предпринята попытка
рованных производных 1,2,4-триазолов 2, 3, 7 и
введения в положение 4 1,2,4-триазолов 5a, б 2-
1,3,4-тиадиазолов 4а, б на уровень метилирования
(гидроксиэтокси)метильного фрагмента, который
опухолевой ДНК в условиях in vitro на модели
имеет структурное сходство с карбогидратной
саркомы 180 (С-180) по методу, описанному в
частью строения природных нуклеозидов и входит
работе [25].
в структуру антивирусного лекарственного
Проведенные нами эксперименты показали,
средства ацикловира [21, 22] (схема 2).
что четкое различие между образцами ДНК из
Исходные триазолы 6a, б получали алкили-
опухолевой ткани после воздействия исследуемых
рованием
1,2,4-триазол-3-тиолов
5a, б
[1,
18];
соединений обнаруживается только в отношении
2-(хлорметокси)этилбензоат синтезировали хлор-
содержания 5-метилцитозина (5-МЦ). Наибольшей
метилированием
2-гидроксиэтилбензоата
по
активностью обладают соединения
2е,
2a,
2ж,
методике [22, 23]. Из известных методов синтеза
которые подавляют уровень метилирования
ациклонуклеозидов
[21-23] нами был выбран
опухолевой ДНК на
63.5,
43.2 и
40.5%
наиболее простой и доступный
- сплавление
соответственно (см. таблицу).
Соединения
2в
исходных веществ при 110-120°С. Промежуточные
(32.4%), 2г (35.1%), 3a (35.1%) обладают слабой
бензоаты выделяли хроматографи-рованием на
деметилирующей активностью. Соединения 2б, 2д,
колонке с силикагелем и без дальнейшей
7a вызывают увеличение количества
5-
обработки дебензоилировали при взаимодействии
метилцитозина. Из полученных данных видно, что
с метилатом натрия в абсолютном метаноле [24].
у половины соединений, обладающих ингибиру-
После соответствующей очистки на колонке с
ющей метилирование опухолевой ДНК актив-
силикагелем соединения 7a, б выделяли в виде
ностью (2а, 2е, 3а), в положении 4 гетероцикла
светло-желтых мелкокристаллических соединений.
присутствует циклогексильная группа. Соединения
Строение соединений
7a, б подтверждено
2е выбрано для дальнейшего исследования in vivo.
аналитическими и спектральными данными,
Таким образом, синтезирован новый ряд
свидетельствующими о том, что в реакционной
функционально-замещенных 1,2,4-триазолов и 1,3,4-
среде омылению подвергаются и этоксикарбо-
тиадиазолов. У некоторых из полученных соедине-
нильные группы с образованием соответствующих
ний выявлена ингибирующая метилирование
сульфанилуксусных кислот. В спектрах ЯМР 1Н
опухолевой ДНК активность, свидетельствующая о
характерны уширенные синглеты протонов группы
перспективности поиска противоопухолевых
ОН в области 4.46-4.47 м. д.
препаратов среди изучаемого класса соединений.
Присутствующие в ИК спектрах соединений
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
7а, б полосы валентных, деформационных
колебаний групп CH2OCH2, CH2OH, C=O, COOH
ИК спектры сняты на спектрометре Nicolet
достаточно характерны для их структуры.
Avatar 330 FT-IR в вазелиновом масле. Спектры
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 1,2,4-ТРИАЗОЛОВ
537
Влияние полученных соединений на уровень метилирования опухолевой ДНК
Содержание оснований в ДНК, мол%
Изменение уровня
Соединение
метилирования, %
5-МЦ
Г+Ц+5-МЦ
Источник ДНК, (С-180)-контроль
0.74±0.02
42.66
2а
0.42±0.02
43.34
43.2а
2б
1.03±0.02
42.08
_
2в
0.05±0.01
43.72
32.4а
2г
0.48±0.02
42.06
35.1а
2д
1.53±0.01
42.00
_
2е
0.27±0.02
42.48
63.5а
2ж
0.44±0.02
42.02
40.5а
3a
0.48±0.02
44.72
35.1а
3б
0.68±0.01
42.02
_
3в
0.53±0.01
42.78
28.4
4a
0.61±0.02
44.76
17.6
4б
0.72±0.02
42.12
_
7a
1.05±0.01
43.00
_
7б
0.61±0.01
42.68
17.6
а p <
0.05.
ЯМР записаны на приборе Varian Mercury-300VX в
S 8.67. C16H14BrN3OS. Вычислено, % : N 11.17; S 8.52.
ДMCO-d6, внутренний стандарт
- ТМС.
4-Аллил-5-(3-бромфеноксиметил)-4Н-1,2,4-
Температуры плавления определены на столике
триазол-3-тиол (1г). Выход 89%, т. пл. 108-109°С.
Boеtius 72/2064. Ход реакций и индивидуальность
ИК спектр, ν, см-1: 3311, 3209, 3051, 2678, 1630,
соединений контролировали с помощью ТСХ на
1596, 1549, 1535, 1511, 1477, 1455, 1424, 1413,
пластинах Silica gel 60F254 (Германия) в системах
1358, 1334, 1300, 1280, 1239, 1205, 1160, 1072,
растворителей бензол-диоксан, 2:1 (1a-д, 2a-ж,
1029, 939, 879, 866. Спектр ЯМР 1Н, δ, м. д. (J. Гц):
3a-в), бензол-диоксан, 1:1 (4a, б), бензол-этил-
4.71 д. т (2H, NCH2, J = 5.7, 1.5), 5.11 c (2H, OCH2),
ацетат, 1:1 (6, 7a, б), проявление УФ облучением.
5.10-5.25 м (2H, =CH2), 5.85-5.98 м (1H, =CH), 6.98
4,5-Дизамещенные
4Н-1,2,4-триазол-3-тиолы
д. д. д (1HAr, J = 8.2, 2.5, 1.0), 7.06 м (2HAr), 13.75
1a-д синтезировали по методике [16], константы
уш. с (1H, SH). Найдено, %: N 12.61; S 9.59.
триазолов
1а, б соответствовали литературным
C12H12BrN3OS. Вычислено, %: N 12.88; S 9.83.
данным [2].
5-(3-Бромфеноксиметил)-4-циклогексил-4Н-
4-Бензил-5-(3-бромфеноксиметил)-4Н-1,2,4-
1,2,4-триазол-3-тиол (1д). Выход 91%, т. пл. 123-
триазол-3-тиол (1в). Выход 88%, т. пл. 159-160°С.
124°С. ИК спектр, ν, см-1: 3091, 3041, 2749, 1590,
ИК спектр, ν, см-1: 3062, 2766, 1589, 1577, 1494,
1577, 14959, 1471, 1456, 1424, 1370, 1352, 1342,
1470, 1284, 1226, 1044, 941, 860. Спектр ЯМР 1Н, δ,
1297, 1279, 1244, 1222, 1031, 854, 771. Спектр ЯМР
м. д., (J, Гц): 4.97 с (2Н, OCH2), 5.32 c (2H, NCH2),
1Н, δ, м. д. (J, Гц): 1.14-1.29 м (1Н), 1.35-1.52 м
6.76 д. д. д (1HAr, J = 8.0, 2.5, 1.2), 6.92 д. д (1HAr,
(2Н), 1.66-1.74 м (1Н), 1.83-1.94 м (4Н) и 2.09-2.28
J = 2.5, 1.7), 7.07 д. д. д (1HAr, J = 7.9, 1.7, 1.2), 7.14
м (2Н, С6Н11), 4.44-4.58 м (1Н, NСН), 5.15 с (2Н,
д. д (1HAr, J = 8.0, 7.9), 7.22-7.29 м (5HAr). Спектр
ОСН2), 6.99 д. д. д (1НAr, J = 8.2, 2.5, 1.1), 7.12 д. д.
ЯМР 13C, δС, м. д.: 46.0 (NCH2), 59.9 (OCH2), 113.1
д (1НAr, J = 7.7, 1.8, 1.1), 7.18-7.24 м (2HAr), 13.68 c
(CH), 117.5 (CH), 121.8 (C), 124.1 (CH), 126.9 (2CH),
(1H, SH). Найдено, %: N 11.26; S 8.52. C15H18BrN3OS.
127.1 (CH),
127.9
(2CH), 130.1 (CH), 135.1 (C),
Вычислено, %: N 11.41; S 8.71.
146.8 (C), 157.6 (C), 168.51 (C). Найдено, %: N 11.29;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
538
ОВСЕПЯН и др.
Алкилирование
4,5-дизамещенных
4Н-1,2,4-
(2д). Выход 91%, т. пл. 145-146°С. ИК спектр, ν, см-1:
триазол-3-тиолов
1а-д проводили по методике
1721, 1587, 1578, 1464, 1451, 1377, 1360, 1284,
[16].
1225, 1194. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.57 д
(3Н, СНСН3, J = 7.1), 3.90 уш. с (1Н, СООН), 4.20 к
2-[(5-Бензил-4-циклогексил-4Н-1,2,4-триазол-
(1Н, СН, J = 7.1), 5.17 с (2Н, ОСН2), 5.28 с (2Н,
3-ил)сульфанил]этанол (2а). Выход 88%, т. пл. 94-
NCH2), 6.85 д. д. д (1НAr, J = 8.2, 2.4, 1.1), 7.00 д. д
95°С. ИК спектр, ν, см-1: 3164, 1691, 1519, 1494,
(1НAr, J = 2.4, 1.7), 7.04-7.10 м (3НAr), 7.14 д. д
1456, 1440, 1412, 1377, 1367, 1332.6, 1282, 1199,
(1НAr, J = 8.2, 7.8), 7.25-7.33 м (3НAr). Найдено, %:
1073. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.05-1.45 м
N 9.12; S 7.01. C19H18BrN3O3S. Вычислено, %: N
(5Н), 1.54-1.78 м (3Н) и 1.86-2.02 м (2Н, С6Н11),
9.37; S 7.15.
3.28 т (2Н, SСН2, J 6.5), 3.71 к (2H, CH2OH, J 6.5),
3.82-3.93 м (1Н, NСН), 4.16 с (2Н, CСН2C), 4.77 т
2-{[5-(3-Бромфеноксиметил)-4-циклогексил-
(1Н, OH), 7.17-7.31 м (5НAr). Найдено, %: N 13.41;
4Н-1,2,4-триазол-3-ил]сульфанил}уксусная кислота
S 10.31. C17H23N3OS. Вычислено, %: N 13.23; S
(2е). Выход 81%, т. пл. 79-80°С. ИК спектр, ν, см-1:
10.10.
1723, 1589, 1577, 1465, 1376, 1280, 1221, 1183,
1027. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.18-1.48 м
2-{[4-Бензил-5-(3-бромфеноксиметил)-4Н-1,2,4-
(3Н), 1.67-1.77 м (1Н), 1.85-1.97 м (4Н) и 2.00-2.15
триазол-3-ил]сульфанил}этанол
(2б). Выход
м (2Н, С6Н11), 3.65 уш. с (1Н, СООН), 4.00 с (2Н,
83%, т. пл. 84-85°С. ИК спектр, ν, см-1: 3311, 1592,
SCH2), 4.08-4.21 м (1Н, NCH), 5.26 с (2Н, ОСН2),
1577, 1527, 1466, 1398, 1377, 1282, 1222, 1068,
7.01 д. д. д (1НAr, J = 8.2, 2.4, 1.0), 7.08-7.12 м
1014. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.28 т (2Н,
(1НAr), 7.19 д (1НAr, J = 8.2), 7.21-7.23 м (1НAr).
SCH2, J = 6.4), 3.70 к (2H, CH2OH, J 6.5), 4.75 т (1Н,
Найдено,
%: N
9.67; S
7.38. C17H20BrN3O3S.
ОН, J = 5.7), 4.95 c (2H, OCH2), 5.21 c (2H, NCH2),
Вычислено, %: N 9.86; S 7.52.
6.74 д. д. д (1НAr, J = 8.0, 2.5, 1.2), 6.89 д. д (1НAr,
J = 2.5, 1.2), 7.04 д. д. д (1HAr, J = 7.9, 1.7, 1.2), 7.12
2-{[4-Аллил-5-(3-бромфеноксиметил)-4Н-1,2,4-
д. д (1HAr, J = 8.0, 7.9), 7.19-7.27 м (5HAr). Найдено,
триазол-3-ил]сульфанил}ацетамид
(2ж). Выход
%: N 9.48; S 7.31. C18H18BrN3O2S. Вычислено, %: N
79%, т. пл. 147-148°С. ИК спектр, ν, см-1: 3394,
9.99; S 7.63.
3105, 1698, 1637, 1592, 1579, 1533, 1467, 1378,
1282, 1219, 1022, 762. Спектр ЯМР 1Н, δ, м. д.
2-{[4-Бензил-5-(3-бромфеноксиметил)-4Н-1,2,4-
(J, Гц): 3.86 с (2Н, СН2), 4.68 д. т (2Н, NCH2, J =
триазол-3-ил]сульфанил}ацетамид
(2в). Выход
5.4, 1.6), 5.08 д. к (1Н, =CH2, J = 17.0, 1.6), 5.23 c
98%, т. пл. 186-188°С. ИК спектр, ν, см-1: 3388,
(2H, OCH2), 5.24 д. к (1Н, =CH2, J = 10.5, 1.6), 5.94
3106, 1698, 1638, 1593, 1578, 1473, 1457, 1440,
д. д. т (1Н, =CH, J = 17.0, 10.5, 1.6), 6.92 уш. с (1Н),
1395, 1378, 1282, 1220, 1025. Спектр ЯМР 1Н, δ, м. д.
7.50 уш. с (1Н, NH2), 7.01 д. д. д (1Н, J = 8.2, 2.5,
(J, Гц): 3.87 с (2Н, SCH2), 5.18 c (2H, OCH2), 5.27 c
1.0), 7.09 д. д. д (1Н, С6Н4, J = 7.8, 1.8, 1.0) и 7.18 д.
(2H, NCH2), 6.85 д. д. д (1НAr, J = 8.2, 2.5, 1.0), 6.95
д (1НAr, J = 8.2, 7.8), 7.21 д. д (1НAr, J = 2.5, 1.8).
уш. с (1Н), 7.52 уш. с (1Н, NH2), 7.00-7.08 м (3НAr),
Найдено,
%: N
14.43; S
8.11. C14H15BrN4O2S.
7.10-7.15 м (2НAr), 7.26-7.34 м (3НAr). Найдено, %:
Вычислено, %: N 14.62; S 8.37.
N 12.81; S 7.28. C18H17BrN4O2S. Вычислено, %: N
5-Бензил-2-[(морфолин-4-ил)метил]-4-цикло-
12.93; S 7.40.
гексил-2Н-1,2,4-триазол-3-тион
(3а).
0.27 г
2-{[4-Бензил-5(3-бромфеноксиметил)-4Н-1,2,4-
(1 ммоль) триазола
1в растворяли в
8-10 мл
триазол-3-ил]сульфанил}уксусная кислота (2г).
метанола и прибавляли
0.12 г
(1.3 ммоль)
Выход 93%, т. пл. 155-156°С. ИК спектр, ν, см-1:
морфолина, затем по каплям при встряхивании
1948, 1706.1, 1592, 1579, 1472, 1443, 1400, 1341,
приливали
0.14 г
(1.6 ммоль) формалина и
1282, 1219, 1202, 1190, 1018. Спектр ЯМР 1Н, δ, м. д.
оставляли на 8-10 ч при комнатной температуре.
(J, Гц): 3.94 c (2H, SCH2), 3.01 уш. с (1Н, СООН),
Осадок отфильтровывали, промывали
5-10 мл
5.17 с (2Н, ОСН2), 5.28 с (2Н, NCH2), 6.86 д. д. д
воды и перекристаллизовывали из этанола. Выход
(1НAr, J 8.2, 2.5, 1.0), 6.99-7.02 м (2НAr), 7.03-7.07 м
67%, т. пл. 94-96°С. Спектр ЯМР 1Н, δ, м. д.: 1.09-
(1НAr), 7.11-7.15 м (2Н) и 7.25-7.31 м (3НAr).
1.34 м (3Н), 1.40-1.67 м (3Н), 1.71-1.83 м (2Н) и
Найдено,
%: N
9.46; S
7.21. C18H16BrN3O3S.
2.08-2.36 уш. с (2Н, С6Н11), 2.70-2.74 м [4Н, О
Вычислено, %: N 9.67; S 7.38.
(СН2)2], 3.56-3.63м [4Н, О(СН2)2], 4.14 с (2Н, СН2),
2-{[4-Бензил-5-(3-бромфеноксиметил)-4Н-1,2,4-
4.25-4.37 м (1Н, NСН), 5.00 м (2Н, NСН2N), 7.18-
триазол-3-ил]сульфанил}пропановая кислота
7.36 м (5НAr). Спектр ЯМР 13С, δС, м. д.: 24.2 (СН2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 1,2,4-ТРИАЗОЛОВ
539
25.3 (2СН2), 28.3 (2СН2), 31.5 (СН2), 50.2 (2СН2),
м. д.: 16.1 (СН2), 35.9 (СН2), 45.3 (СН2), 116.4 (СN),
56.9 (NСН2), 65.8 (2СН2), 68.0 (NСН), 126.8 (СН),
126.8 (СН), 127.4 (2СН), 128.3 (2СН), 128.4 (2СН),
127.8 (СН), 128.1 (СН), 134.7 (С), 148.6 (С), 167.6
128.9 (2СН), 131.3 (СН), 135.4 (C), 157.9 (C), 165.2
(СS). Найдено, %: N 14.87; S 8.41. C20H28N4OS.
(C),
172.5 (C). Найдено,
%: N
15.79; S
9.37.
Вычислено, %: N 15.04; S 8.60.
C19H16N4ОS. Вычислено, %: N 16.08; S 9.20.
3-(5-Бензил-3-тиоксо-4-фенил-2Н-1,2,4-триазол-
Триазолы 5 и 6 синтезировали по известным
2-ил)пропаннитрил (3б). Смесь 0.26 г (1ммоль)
методикам
[2,
18], константы соответствовали
триазола 1а, 1.62 г (30ммоль) свежеперегнанного
литературным.
акрилонитрила, 4 мл воды и 3.0 г (30 ммоль)
Соединения
7а, б. Смесь
1 ммоль мелко-
триэтиламина кипятили 8-10 ч. Раствор упаривали,
измельченного триазола 6а или 6б и 1 ммоль
кристаллический остаток перекристаллизовывали
свежеперегнанного
2-(хлорметокси)этилбензоата
из этанола. Выход 62%, т. пл. 74-75°С. Спектр
нагревали на масляной бане до полного рас-
ЯМР 1Н, δ, м. д. (J, Гц): 3.08 т (2Н, СН2СN, J = 6.6),
плавления соединений 6, затем нагревали 1-1.5 ч
3.90 с (2Н, СН2), 4.47 т (2Н, NСН2, J = 6.6), 6.88-
при той же температуре (110-120°С). Полученную
6.96 м (2НAr), 7.11-7.21 м (5НAr), 7.41-7.51 м (3НAr).
стекловидную массу растворяли в 3-4 мл бензола и
Спектр ЯМР 13С, δС, м. д.: 15.7 (СН2), 31.6 (СН2),
хроматографировали на колонке с силикагелем.
43.9 (NСН2), 116.4 (С≡N), 126.4 (СН), 127.8 (2СН),
Продукт реакции элюировали сначала бензолом,
127.9 (2СН), 128.10 (2СН), 128.7 (2СН), 129.0 (СН),
затем смесью бензол-этилацетат, 1:1. Выделенные
133.3 (С), 133.6 (С), 149.6 (С), 167.5 (С). Найдено,
после отгонки растворителей стекловидные
%: N 17.23; S 9.73. C18H16N4S. Вычислено, %: N
вещества без дальнейшей обработки подвергали
17.48; S 10.00.
дебензоилированию по отработанной ранее
методике [24].
3-(5-Бензил-3-тиоксо-4-фенил-2Н-1,2,4-триазол-
2-ил)пропановая кислота (3в) получена из 0.26 г
2-{5-Бензил-4-[(2-гидроксиэтокси)метил]-4Н-
(1 ммоль) триазола 1а и 0.22 г (3 ммоль) акриловой
1,2,4-триазол-3-ил-сульфанил}уксусная кислота
кислоты по методике получения соединения 3б.
(7а). Выход 53%, т. пл. >260°С. ИК спектр, ν, см-1:
Выход 82%, т. пл. 157-158°С. Спектр ЯМР 1Н, δ,
3445, 3155, 1705, 1640, 1564, 1462, 1378, 1275,
м. д. (J, Гц): 2.83 т (2Н, СН2СО, J = 7.5), 3.86 с (2Н,
1226, 1120, 1061, 931. Спектр ЯМР 1Н, δ, м. д.: 3.45-
СН2), 4.39 т (2Н, NСН2, J = 7.5), 6.86-6.92 м (2НAr),
3.58 м (4Н, OCH2CH2OH), 3.67 с (1Н) и 3.77 с (1Н,
7.11-7.19 м (5НAr), 7.39-7.48 м (3НAr). Спектр ЯМР
СН2Ph), 3.90 c (1H) и 4.14 c (1H, CH2S), 4.63 уш. с
13С, δС, м. д.: 31.2 (СН2), 31.8 (СН2), 44.2 (NСН2),
(1Н, ОН), 5.38 с (1Н) и 5.39 с (1Н, NCH2), 7.13-7.29
126.4 (СН), 127.9 (4СН), 128.1 (2СН), 128.7 (2СН),
м (5НAr). Найдено, %: С 51.67; Н 5.18; N 12.71; S
128.9 (СН), 133.6 (С), 133.8 (С), 149.1 (С), 167.1 (С),
9.69. C14H17N3О4S. Вычислено, %: С 51.99; Н 5.30;
171.1 (С). Найдено,
%: N
12.21; S
9.78.
N 12.99; S 9.91.
C18H17N3O2S. Вычислено, %: N 12.38; S 9.44.
2-{5-(4-Бромфенил)-4-[(2-гидроксиэтокси)-
N-(5-Бензил-1,3,4-тиадиазол-2-ил)бензамид (4а)
метил]-4Н-1,2,4-триазол-3-ил-сульфанил}уксусная
синтезировали по методике [20]. Выход 88%, т. пл.
кислота (7б). Выход 67%, т. пл. 131-132°С. ИК
226-227°С. ИК спектр, ν, см-1: 1662, 1600, 1578,
спектр, ν, см-1: 3406, 3161, 1727, 1599, 1466, 1398,
1530, 1486, 1463, 1377, 1321, 1302, 1255,
694.
1360, 1199, 1117, 1069, 1011. Спектр ЯМР 1Н, δ, м.
Спектр ЯМР 1Н, δ, м.д. (J, Гц): 4.32 с (2Н, СН2),
д.: 3.52-3.57 м (2Н, СН2), 3.58-3.64 м (2Н, СН2), 4.0
7.17-7.32 м (2НAr), 7.40-7.55 м (3Н) и 8.07-8.13 м
м (2НAr), 12.51 уш. с (1Н, СООН). Найдено, %: С
(2НAr), 12.59 м (1Н, NH). Найдено, %: N 14.57; S
40.03; Н
3.27; N
10.68; S
16.17. C13H14N3О4S.
10.61. C16H13N3ОS. Вычислено, %: N 14.23; S 10.86.
Вычислено, %: С 40.22; Н 3.64; N 10.82; S 8.26.
N-(5-Бензил-1,3,4-тиадиазол-2-ил)-N-(2-циано-
КОНФЛИКТ ИНТЕРЕСОВ
этил)бензамид
(4б) получали аналогично
Авторы заявляют об отсутствии конфликта
соединению 3б. Выход 93%, т. пл. 109-110°С. ИК
интересов.
спектр, ν, см-1: 1608, 1572, 1547, 1497, 1483, 1416,
СПИСОК ЛИТЕРАТУРЫ
1389, 1366, 1320, 1298. Спектр ЯМР 1Н, δ, м. д. (J,
Гц): 3.14 т (2Н, СН2СN, J = 6.5), 4.24 c (2H, CH2),
1. Kushwaha N., Kushwaha S.K.S., Rai A.K. // Jnt. J.
4.72 т (2H, NCH2, J = 6.5), 7.24-7.35 м (5НAr), 7.39-
Chem. Tech. Res. 2012. Vol. 4. P. 517.
7.52 м (3Н), 8.19-8.23 м (2НAr). Спектр ЯМР 13С, δС,
2. Shaker R.M. // Arkivoc. 2006. P. 59.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
540
ОВСЕПЯН и др.
3. Gomha S.M., Badry M.G., Abdolla M.M. // J. Heterocycl.
Даниелян И.С., Пароникян Р.В., Минасян Н.С. //
Chem. 2016. Vol. 53. P. 558. doi 10.1002/jhet.2417
ЖОХ. 2017. Т. 87. С. 782; Hakobyan M.R., Hovsepyan
4. He R., Chen U.E., Chen U.H., Ougolkov A.V., Zhang J.S.,
T.R., Nersesyan L.E., Agaronyan A.S., Danielyan I.S.,
Saroy D.N., Billadeai D.D., Kozikowski A.P. // J. Med.
Paronikyan R.V., Minasyan N.S. // Russ. J. Gen. Chem.
Chem. 2010. Vol. 53. P. 6337. doi 10.1021/jm1002414
2017. Vol. 87. P. 973. doi 10.1134/S1070363217050140
5. Hamamc W.S., Gouda M.A., Badr M.H., Zeorob H.H. //
17. Овсепян Т.Р., Диланян С.В., Арсенян Ф.Г., Мурадян Р.Е.,
J. Heterocycl. Chem. 2013. Vol. 50. P. 787. doi
Минасян Н.С., Мелик-Оганджанян Р.Г.
// Хим.-
10.1002/jhet.1569
фарм. ж.
2018. Т.
52. C.
107; Hovsepyan T.R.,
Dilanyan
S.V., Arsenyan F.H., Muradyan R.E.,
6. Kossentini M. // J. Heterocycl. Chem. 2015. Vol. 52.
Minasyan N.S., Melik-Ohanjanyan R.G.
// Pharm.
P. 1769. doi 10.1002/jhet.2264
Chem. J. 2018. Vol. 52. P. 404. doi 10.1007/S11094-
7. Deshmukh R., Karale B., Akolkaz H., KandhavaneP. //
018-1830-5
J. Heterocycl. Chem. 2017. Vol. 54. P. 1355. doi
10.1002/jhet.2714
18. Овсепян Т.Р., Аветисян А.Х., Терджанян С.М.,
Казарян Э.В., Тер-Захарян Ю.З., Пароникян Г.М.,
8. Tan Cheng-Xia, Shi Yan-xia, Weng, Jian-Quan, Liu
Акопян Л.Г. // Арм. хим. ж. 1990. Т. 43. C. 399.
Xing-Hai, Zhao Wei-Guang, Li Bao-Ju. // J. Heterocycl.
Chem. 2014. Vol. 51. P. 90. doi 10.1002/jhet.1656
19. Овсепян Т.Р., Грбоян С.В., Арсенян Ф.Г., Мелик-
Оганджанян Р.Г. // Хим.-фарм. ж. 2011. Т. 45. C. 3;
9. Wang Q.P., Zhang J.Q., Damu Guri L.V., Wan Kun,
Hovsepyan T.R., Grboyan S.V., Arsenyan F.H., Melik-
Zhang H.Z., Zhou Ch.H. // Sci. China Chem. 2012.
Ohanjanyan R.G. // Pharm. Chem. J. 2011. Vol. 45.
Vol. 55. P. 2134. doi 10.1007/s11426-012-4602-1
P. 705. doi 10.1007/S11094-012-0706-3
10. Witkowski J.T., Robins R.K., Sidwell R.W., Simon L.N. //
J. Med. Chem. 1972. Vol. 15. P. 1150. doi 10.1021/
20. Овсепян Т.Р., Акопян М.Р., Минасян Н.С., Мелик-
jm00281a014
Оганджанян Р.Г. // ЖОХ. 2016. Т. 86. С. 1306;
Hovsepyan T.R., Hakobyan M.R., Minasyan N.S., Melik-
11. Mi J.H., Zhou C.H., Baix X. // Chin. J. Antibiot. 2007.
Ohanjanyan R.G. // Russ. J. Gen. Chem. 2016. Vol. 86.
Vol. 32. P.587.
P. 1306. doi 10.1134/S1070363216080119
12. Siddiqui N., Ahsan W. // Eur. J. Med. Chem. 2010.
21. Schaeffer H.J., Beauchamp L., Miranda P., Elion G.B.,
Vol. 45. P. 1536. doi 10.1016/j.ejmech.2009.12.062
Bauer D.J., Collins P. // Nature. 1978. Vol. 272. P. 583.
13. Gupta A., Pandeya S.N., Mishra P., Kashaw S.K., Jatav Y.,
doi 10.1038/272583a0
Stables J.P. // Eur. J. Med. Chem. 2008. Vol. 43. P. 135.
doi 10.1016/j.ejmech.2007.02.004
22. Beauchamp L.M., Dolmach B.L., Schaeffer H.J., Collins P.,
Bauer D.J., Keller P.M., Lyfe J.A. // J. Med. Chem.
14. Овсепян Т.Р., Мелик-Оганджанян Р.Г., Паносян Г.А.,
1985. Vol. 28. P. 982. doi 10.1021/jm00146a002
Арсенян Ф.Г., Гарибджанян Б.Т. // Хим.-фарм. ж.
2009. Т. 43. С. 3; Hovsepyan T.R., Melik-Ohanjanyan R.G.,
23. Robinson B.J. // J. Chem. Soc. 1963. P. 2417. doi
Panosyan G.A., Arsenyan F.H., Garibjanyan B.T. //
10.1039/JR9630002417
Pharm. Chem. J. 2009. Vol. 43. P. 645. doi 10.1007/
24. Мелик-Оганджанян Р.Г., Овсепян Т.Р., Исраелян С.Г.,
s11094-010-0371-3
Гукасян М.С., Караханян Г.С., Паносян Г.А.,
15. Овсепян Т.Р., Арсенян Ф.Г., Нерсесян Л.Э., Агаронян А.С.,
Тамазян Р.А., Айвазян А.Г. // ЖОрХ. 2015. Т. 51.
Даниелян И.С., Пароникян Р.В., Мелик-Оганджа-
С.
377; Melik-Ohanjanyan R.G., Hovsepyan T.R.,
нян Р.Г.
// Хим.-фарм. ж.
2015. Т.
49. C.
23;
Israelyan S.G., Gukasyan M.S., Karakhanyan G.S.,
Hovsepyan T.R., Arsenyan F.H., Nersesyan L.E.,
Panosyan G.A., Tamazyan R.A., Ayvazyan A.G. // Russ.
Aharonyan A.S., Danielyan I.S., Paronikyan R.V., Melik-
J. Org. Chem. 2015. Vol. 51. P. 361. doi 10.1134/
Ohanjanyan R.G. // Pharm. Chem. J. 2015. Vol. 49.
S1070428015030124
P. 231. doi 10.1007/s11094-015-1261-5
25. Vanyushin B.F., Masin A.N., Vasiliev V.R. // Biochim.
16. Акопян М.Р., Овсепян Т.Р., Нерсесян Л.Э., Агаронян А.С.,
Et Biophys. Acta 1973. Vol. 299. P. 397.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 1,2,4-ТРИАЗОЛОВ
541
Synthesis of New Substituted 1,2,4-Triazoles
and 1,3,4-Thiadiazoles and Their Effects on DNA Methylation Level
T. R. Hovsepyana, *, M. R. Hakobyana, R. E. Muradyana, L. E. Nersesyana,
A. S. Agaronyana, I. S. Danielyana, and N. S. Minasyanb
a A.L. Mndzhoyan Institute of Fine Organic Chemistry of the Scientific and Technological Center of Organic
and Pharmaceutical Chemistry of the National Academy of Sciences of the Republic of Armenia,
pr. Azatutyan 26, Yerevan, 0014 Armenia
*e-mail: tag.hovsepyan@mail.ru
b Molecular Structure Research Center of the Scientific and Technological Center of Organic
and Pharmaceutical Chemistry of the National Academy of Sciences, Yerevan, Armenia
Received November 8, 2018; revised November 8, 2018; accepted November 15, 2018
Continuing to search for biologically active compounds among functionally substituted azoles, new 1,2,4-triazole-3-
thiols and 1,3,4-thiadiazoles derivatives bearing pharmacologically active carboxamide, hydroxyl or carboxy-
alkyl, as well as N-acyclonucleoside, N-cyano- or carboxyethyl fragments were synthesized. Ability of some
compounds obtained to inhibit the methylation of tumor DNA in vitro was revealed. The compound with the
highest activity was selected for further in vivo studies.
Keywords: 1,2,4-triazole, 1,3,4-thiadiazole, cyanoethylation, alkylation, acyclonucleoside, DNA methylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019