ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 542-551
УДК 547.551.525.211.1
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
5-АРИЛ-N-{4-[(1,3-ТИАЗОЛ-2-ИЛ)CУЛЬФАМОИЛ]ФЕНИЛ}-
1-ФЕНИЛПИРАЗОЛ-3-КАРБОКСАМИДОВ И ИХ СОЛЕЙ
© 2019 г. В. Л. Гейнa, *, О. В. Бобровскаяa, А. А. Русскихa, В. В. Новиковаa, О. Н. Гейнa,
Ю. Н. Карпенкоa, С. В. Чащинаb, М. В. Дмитриевb, А. Н. Янкинc
a Пермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
b Пермский государственный национальный исследовательский университет, Пермь, Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 15 ноября 2018 г.
После доработки 15 ноября 2018 г.
Принято к печати 22 ноября 2018 г.
Реакцией 4-арил-2-гидрокси-4-оксо-N-{4-[(1,3-тиазол-2-ил)сульфамоил]фенил}бут-2-енамидов с фенил-
гидразином в ледяной уксусной кислоте синтезированы 5-арил-N-{4-[(1,3-тиазол-2-ил)cульфамоил]-
фенил}-1-фенилпиразол-3-карбоксамиды, при обработке которых эквимолярным количеством нитрата
серебра в среде этанол-ДМФА (2:1) получены их серебряные соли. Натриевые соли 5-арил-N-{4-[(1,3-
тиазол-2-ил)cульфамоил]фенил}-1-фенилпиразол-3-карбоксамидов синтезированы в среде метанол-
ДМФА (1:1) с метоксидом натрия. Изучена анальгетическая, противовоспалительная и противо-
микробная активность полученных соединений.
Ключевые слова: пиразол-3-карбоксамиды, серебряные и натриевые соли пиразол-3-карбоксамидов,
анальгетическая активность, противовоспалительная активность, противомикробная активность
DOI: 10.1134/S0044460X19040073
Ранее нами были получены пиразол-3-карбо-
(1,3-тиазол-2-ил)сульфамоильного фрагмента в
ксамиды, содержащие в положении
3 гетеро-
структуру пиразол-3-карбоксамидов предоставляло
циклической системы
4-ацетиламиносульфонил-
возможность получения не только натриевых
фенильный заместитель [1]. Однако реакции соле-
солей, но и серебряных, а соответственно, и
образования по сульфамидной группе вышеуказан-
возможность
усиления
противомикробного
ных пиразол-3-карбоксамидов с ионами серебра,
действия, так как известны соли серебра
натрия и других металлов не были изучены.
сульфаниламидных лекарственных средств, такие
как Аргосульфан (серебряная соль сульфатиазола)
С целью синтеза биологически активных
и Дермазин (серебряная соль сульфадиазина),
производных пиразол-3-карбоксамидов с сульфа-
которые применяются в медицинской практике [2].
мидным фрагментом, а также в продолжение работ
по их химической модификации представляло
В связи с этим нами были синтезированы 5-арил-
интерес получить пиразол-3-карбоксамиды, содер-
N-{4-[(1,3-тиазол-2-ил)cульфамоил]фенил}-1-фенил-
жащие фрагмент
2-(4-аминобензолсульфамидо)-
пиразол-3-карбоксамиды 2а-д и изучено их взаимо-
тиазола, который входит в структуру известного
действие с метоксидом натрия и нитратом серебра.
лекарственного средства сульфатиазола натрия
(норсульфазола
натрия)
[2].
Характерной
Соединения 2а-д образуются при кипячении
особенностью сульфатиазола натрия является его
ранее полученных (2Z)-4-арил-2-гидрокси-4-оксо-N-
растворимость в воде, что может увеличить водо-
{4-[(1,3-тиазол-2-ил)сульфамоил]фенил}бут-2-
растворимость гетероциклов, имеющих фрагмент 2-
енамидов 1а-д [3] с фенилгидразином в течение 2 ч
(4-аминобензолсульфамидо)тиазола. Поэтому введение
в среде ледяной уксусной кислоты (схема 1).
542
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
543
Схема 1.
R
N
O
O
S
N
S
O
NHNH2
H
N
H
O
O
N
HO
O
N
HN
S
O
R
HN
N
2а-д
S
1а-д
N
O O
S
N-
S
O
CH3ONa
Na+
N
H
N
N
R
3а-д
N
O O
S
N-
S
O
Ag+
N
H
AgNO3
N
N
R
4а-в, д
R = Cl (а), Н (б), Me (в), OEt (г), ОМе (д).
Соединения
2а-д представляют собой окра-
сигналы ароматических протонов (6.78-8.02 м. д.),
шенные кристаллические вещества, растворимые в
протонов С5Н и С4Н тиазольного цикла (6.75-6.83
ДМСО, ДМФА, при нагревании
- в ледяной
и
7.09-7.25 м. д. соответственно, J5,4
=
4.50-
уксусной кислоте, диоксане, нерастворимые в
4.65 Гц), протона С4Н пиразольного цикла (7.02-
этаноле и воде.
7.18 м. д.), групп CONH (10.30-10.53 м. д.) и
SO2NH
(12.40-12.78 м. д.). Сигналы протонов
В ИК спектрах соединений 2а-д наблюдаются
других групп наблюдаются в ожидаемых областях.
полосы валентных колебаний аминогрупп (3493-
3242 см-1), амидной карбонильной группы (1693-
В масс-спектрах соединений 2а-г присутствует
1673 см-1), SO2-группы (1320-1310, 1152-1125 см-1).
пик молекулярного иона, подтверждающий пред-
В спектрах ЯМР 1Н соединений 2а-д присутствуют
полагаемую структуру.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
544
ГЕЙН и др.
5-Арил-N-{4-[(1,3-тиазол-2-ил)cульфамоил]фенил}-
1-фенилпиразол-3-карбоксамиды
2а-д, содер-
жащие
(1,3-тиазол-2-ил)сульфамоильный фраг-
мент, могут находиться в двух таутомерных
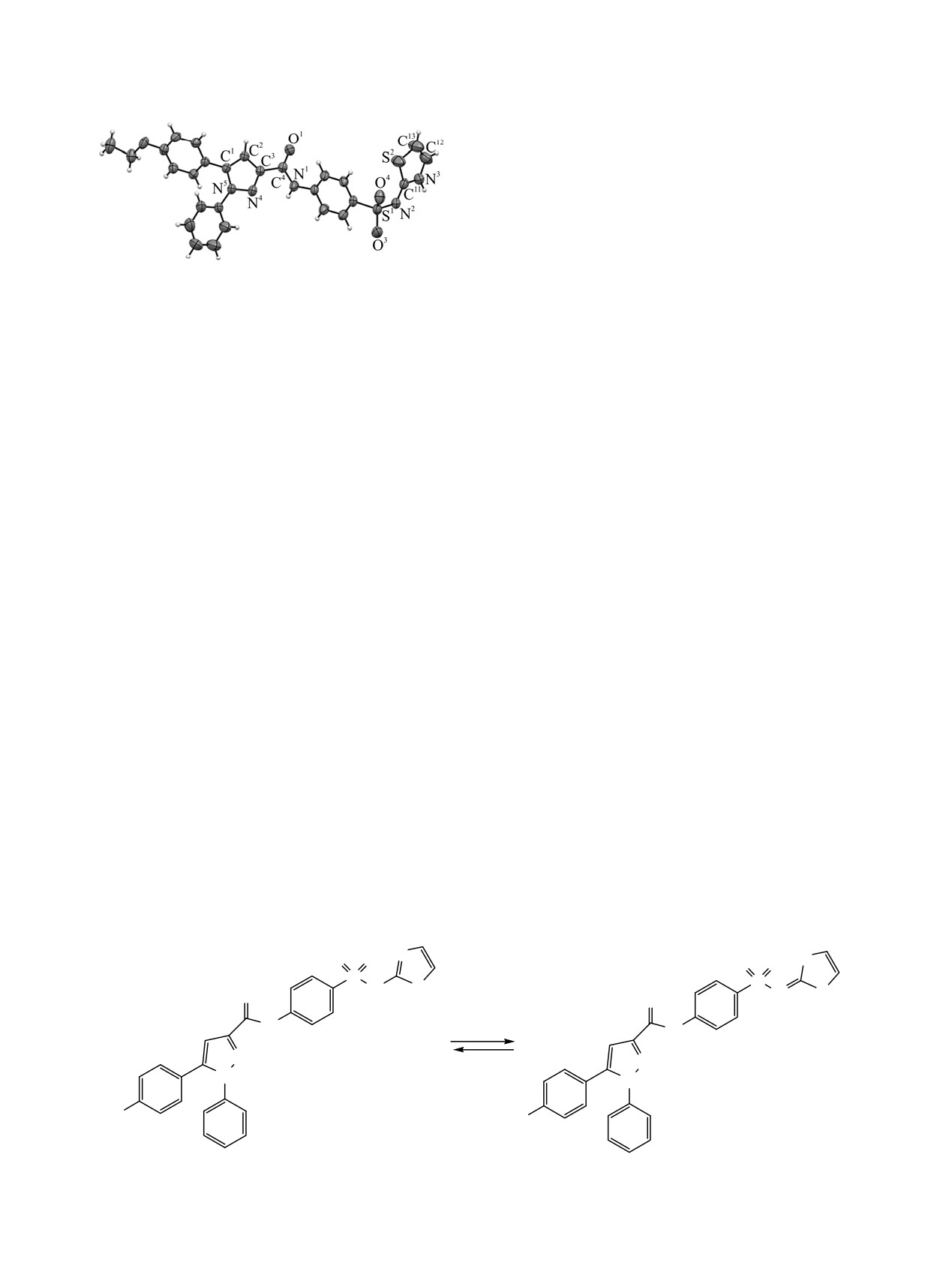
формах А и Б (схема 2).
По данным РСА, наиболее вероятно существо-
вание соединений в кристаллическом состоянии в
Общий вид молекулы соединения 2г по данным РСА в
форме Б. Согласно данным ЯМР 1Н, соединения 2а-д
тепловых эллипсоидах 50%-ной вероятности.
в растворе ДМСО-d6 существуют преиму-
щественно в форме А.
5-Арил-N-{4-[(1,3-тиазол-2-ил)cульфамоил]фенил}-
Известно, что химическая модификация
1-фенилпиразол-3-карбоксамиды 2а-д в отличие от
соединений путем образования солей с металлами
исходных соединений 1а-д не дают характерного
может привести к получению водорастворимых
красного окрашивания со спиртовым раствором
веществ [4], появлению новых видов активности и
хлорида железа(III), что наряду со спектральными
значительному усилению биологического дей-
данными подтверждает указанную структуру.
ствия, поэтому, несомненно, перспективными
являются ранее неисследованные реакции пиразол-
Для установления пространственного строения
3-карбоксамидов с метоксидом натрия и нитратом
соединений 2а-д медленной кристаллизацией из
серебра.
смеси диоксан-уксусная кислота (1:1) нами был
получен монокристалл соединения 2г и проведен
Установлено, что при добавлении к теплому
его рентгеноструктурный анализ (см. рисунок).
раствору
5-арил-N-{4-[(1,3-тиазол-2-ил)cульфа-
Соединение 2г кристаллизуется в центросиммет-
моил]фенил}-1-фенилпиразол-3-карбоксамидов 2а-д
ричной пространственной группе триклинной
в среде метанол-ДМФА
(1:1) эквимолярного
сингонии. Длины связей и валентные углы
количества 0.2 М. раствора метоксида натрия и
принимают обычные для соответствующих атомов
дальнейшем удалении растворителя образуются
значения. Пиразольный и тиазольный циклы
натриевые соли
5-арил-N-{4-[(1,3-тиазол-2-ил)
плоские в пределах 0.01 и 0.02 Å соответственно.
cульфамоил]фенил}-1-фенилпиразол-3-
Кратные связи в обоих гетероциклах ожидаемо
карбоксамидов 3а-д (схема 1).
делокализованы. В кристалле молекулы связаны в
Соединения
3а-д
представляют
собой
центросимметричные димеры посредством водо-
кристаллические вещества белого или слегка
родных связей N3-H3···N2 [-1-x, 2-y, 1-z]; N3-H3
желтоватого цвета, растворимые в ДМФА, ДМСО,
0.93(3), H3···N2 1.94(3), N3···N2 2.865(4) Å, угол
при нагревании - в ледяной уксусной кислоте,
N3H3N2
168(3)°. За счет водородной связи
этаноле и в воде.
N1-H1···O4 [1+x, y, z] димеры образуют бесконечные
двухрядные цепи, вытянутые вдоль направления a
В ИК спектрах соединений 3а-д наблюдаются
элементарной ячейки; N1-H1 0.81(3), H1···O4 2.47(3),
полосы валентных колебаний аминогруппы (3476-
N1···O4 3.065(4) Å, угол N1H1O4 131(2)°.
3242 см-1), амидной карбонильной группы (1693-
Схема 2.
N
O O
HN
O O
S
S
N
S
O
N S
H
O
N
N
H
H
N
N
N
N
R
R
A
Б
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
545
Таблица 1. Анальгетическая активность соединений 2а-в, 3а-д
Время оборонительного
Соединение
р по сравнению с контролем
р по сравнению с эталоном
рефлекса, с
2а
16.36±1.80
<0.05
<0.05
2б
16.02±2.44
<0.05
>0.05
2в
18.73±4.36
<0.05
<0.05
3а
14.42±3.11
>0.05
>0.05
3б
18.41±3.02
<0.05
<0.05
3в
23.58±10.49
<0.001
<0.05
3г
17.03±1.64
<0.05
<0.05
3д
16.84±1.58
<0.05
<0.05
Метамизол натрия (анальгин)
12.60±1.20
<0.05
-
Контроль
11.30±0.90
-
-
1666 см-1), SO2-группы (1329-1314, 1150-1128 см-1).
диметилсульфоксиде, ледяной уксусной кислоте и
В спектрах ЯМР 1Н соединений 3а-д присутствуют
нерастворимые в воде, этаноле, изопропаноле.
сигналы ароматических протонов (6.88-7.98 м. д.),
В ИК спектрах соединений 4а-в, д наблю-
протонов С5Н и С4Н тиазольного цикла (6.53-6.75
даются полосы валентных колебаний аминогруппы
и 6.96-7.18 м. д. соответственно, J5,4 4.0-4.4 Гц),
(3499-3300 см-1), амидной карбонильной группы
протона С4Н пиразольного цикла (6.84-7.19 м. д.),
(1688-1681 см-1), SO2-группы (1319-1317, 1141-
протона группы CONH
(10.17-10.74 м. д.).
1140 см-1). В спектрах ЯМР 1Н соединений 4а-в, д
Сигналы протонов других групп наблюдаются в
присутствуют сигналы ароматических протонов
ожидаемых областях. Характерной особенностью
(6.88-7.97 м. д.), протонов С5Н и С4Н тиазольного
спектров ЯМР 1Н полученных соединений 3а-д
цикла (6.86-6.87 и 7.18-7.19 м. д. соответственно,
является отсутствие сигнала протона группы
J5,4 3.9 Гц), протона С4Н пиразольного цикла (7.04-
SO2NH в области 12.40-12.78 м. д.
7.14 м. д.), протона группы CONH (10.25-10.29 м. д.).
В масс-спектрах соединений 3а-д присутствует
Сигналы протонов других групп наблюдаются в
пик молекулярного иона, подтверждающий
ожидаемых областях. Характерной особенностью
указанную структуру.
спектров ЯМР 1Н полученных соединений 4а-в, д,
также как и соединений 3а-д, является отсутствие
Продолжая исследовать реакции солеобразо-
сигнала протона группы SO2NH в области 12.40-
вания по сульфамидной группе 5-арил-N-{4-[(1,3-
12.78 м. д.
тиазол-2-ил)cульфамоил]фенил}-1-фенилпиразол-3-
карбоксамидов, нами были синтезированы их
Полученные соединения
2а-в,
3а-д были
серебряные соли. Было установлено, что при
исследованы на наличие анальгетической
добавлении к горячему раствору 5-арил-N-{4-[(1,3-
активности. Результаты испытаний представлены в
тиазол-2-ил)cульфамоил]фенил}-1-фенилпиразол-3-
табл.
1.
Исследования показали, что все
карбоксамидов 2а-в, д в среде этанол-ДМФА (2:1)
синтезированные соединения, за исключением
эквимолярного количества нитрата серебра (2%-
производного 3а, при внутрибрюшинном введении
ный раствор в этаноле) образуются серебряные
проявляют анальгетическую активность по тесту
соли
5-арил-N-{4-[(1,3-тиазол-2-ил)cульфамоил]
«горячая пластинка» в дозе 50 мг/кг, достоверно
фенил}-1-фенилпиразол-3-карбоксамидов 4а-в, д
увеличивая время пребывания подопытных
(схема 1).
животных на нагретой поверхности по сравнению
Соединения
4а-в, д представляют собой
с контролем. При этом изученные соединения
окрашенные кристаллические вещества, раство-
оказались более эффективными по сравнению с
римые при нагревании в диметилформамиде,
эталоном
сравнения
метамизолом натрия
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
546
ГЕЙН и др.
Таблица 2. Противовоспалительная активность соединений 2а-в, 3а-в
Соединение
Объем стопы до
Объем стопы через
Прирост объема
Торможение
введения флогогена, мл
3 ч, мл
стопы через 3 ч, %
отека через 3 ч, %
2а
1.34±0.03
1.43±0.02
6.8±1.8a,б,в
89.70
2б
1.58±0.08
1.87±0.12
19.6±8.2а,б
70.52
2в
1.45±0.09
1.81±0.13
25.8±9.2а,б
61.20
3а
1.52±0.08
1.77±0.04
17.8±7.1а,б
73.23
3б
1.45±0.05
2.02±0.08
39.3±2.2а,б
40.90
3в
1.36±0.04
1.69±0.11
24.5±7.6а,б
63.16
Нимесулид
1.54±0.06
1.53±0.07
12.1±2.3
81.70
Метамизол натрия (анальгин)
0.94±0.07
1.60±0.08
71.6±9.8
7.72
Контроль
0.77±0.05
1.26±0.08
66.5±10.2
-
а p < 0.05 по сравнению с контролем. б р <0.05 по сравнению с метамизолом натрия. в р <0.05 по сравнению с нимесулидом.
(анальгином). Наиболее выраженная анальгети-
результате проведенных экспериментов установ-
ческая активность обнаружена у соединения 3в.
лено, что все полученные соединения проявляют
выраженную противовоспалительную активность,
Соединения 2а-в, 3а-в были также изучены на
достоверно снижая прирост объема стопы после
наличие противовоспалительной активности.
введения флогогенного агента по сравнению с
Результаты испытаний представлены в табл. 2. В
контролем. Активность всех исследованных
Таблица 3. Противомикробная активность соединений 2а-д, 3а-в, 4а-в, д
МПК, мкг/мл
Соединение
S. aureus
E. coli
C. albicans
ATCC 6538-P
ATCC 25922
АТСС 885-653
2а
500.0
1000.0
1000.0
2б
>1000.0
1000.0
1000.0
2в
1000.0
1000.0
>1000.0
2г
1000.0
1000.0
1000.0
2д
1000.0
1000.0
>1000.0
3a
1000.0
1000.0
1000.0
3б
>1000.0
1000.0
1000.0
3в
500.0
1000.0
1000.0
4а
7.8
2.0
1.0
4б
15.6
3.9
1.0
4в
31.2
7.8
2.0
4д
15.6
2.0
1.0
Диоксидин (1%-ный раствор)
62.5
31.2
-
Флуконазол
-
-
2.0->64.0а
а Данные работы [5].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
547
Таблица 4. Антибактериальная активность соединения 4а
МПК, мкг/мл
Соединение
P. vulgaris
K. pneumoniae
P. aeruginosa
S. abony
S. epidermidis
E. faecalis
B. cereus
№HХ 19/222
№5055 NCTC
АТСС 9027
№103/39
АТСС 14990
ATCC 29212
АТСС 10702
4а
3.9
3.9
7.8
15.6
2.0
31.2
15.6
Диоксидин
7.8
15.6
500.0
7.8
500.0
500.0
31.2
(1%-ный
раствор)
соединений значительно превосходит действие
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
метамизола натрия и сопоставима с эффектом
нимесулида, за исключением соединения
3б.
Спектры ЯМР 1H записаны на приборе Bruker
Наиболее эффективно уменьшает развитие
AM-300 (300 МГц), Bruker Avance III HD (400
воспалительного отека соединение 2а, достоверно
МГц) в ДМСО-d6, внутренний стандарт - ТМС. ИК
(при р
<
0.05) превышая соответствующие
спектры сняты на ИК Фурье-спектрометре
показатели нимесулида.
IRAffinity-1 Shimadzu (Япония) в KBr. Масс-
спектры высокого разрешения записаны на масс-
Синтезированные соединения 2а-д, 3а-в, 4а-в,
спектрометре Bruker micrОTOF. Элементный
д были исследованы на наличие противогрибковой
анализ проведен на приборе PerkinElmer
2400.
и антибактериальной активности. Скрининг
Температуры плавления определены на приборе
противомикробной активности осуществляли в
Melting Point М-565.
отношении типовых штаммов Staphylococcus
Рентгеноструктурный анализ соединения 2г
aureus ATCC 6538-P, Escherichia coli ATCC 25922,
выполнен на дифрактометре Xcalibur Ruby с ССD-
Candida albicans АТСС
885-653. Результаты
детектором по стандартной методике
[MoKα-
испытаний представлены в табл. 3. Пиразол-3-
излучение, 295(2) K, ω-сканирование с шагом 1°].
карбоксамиды 2а-д и их натриевые соли 3а-в
Поглощение учтено эмпирически с использо-
обладают низкой противомикробной активностью.
ванием алгоритма SCALE3 ABSPACK
[6].
Введение в структуру пиразол-3-карбоксамидов
Сингония кристалла (C27H23N5O4S2, M = 545.62)
ионов серебра с образованием серебряных солей
триклинная, пространственная группа P-1, a =
4а-в, д приводит к резкому усилению
8.1680(11) Å, b = 10.4424(13) Å, c = 15.6117(19) Å,
биологического действия в отношении изучаемых
α = 84.769(10)°, β = 77.099(11)°, γ = 79.392(11)°, V =
культур. Соединение
4а, проявившее высокую
1274.0(3) Å3, Z = 2, dвыч = 1.422 г/см3, μ = 0.254 мм-1.
антибактериальную активность, было подвергнуто
Структура расшифрована с помощью программы
углубленному исследованию в отношении других
Superflip [7] и уточнена полноматричным МНК по
типовых штаммов бактерий Государственной
F2 в анизотропном приближении для всех
коллекции патогенных микроорганизмов Staphylo-
неводородных атомов с использованием прог-
coccus epidermidis АТСС
14990, Enterococcus
раммы SHELXL [8] с графическим интерфейсом
faecalis ATCC 29212, Кlebsiella pneumoniae №5055
OLEX2 [9]. Атомы водорода групп NH уточнены
NCTC, Proteus vulgaris №HХ 19/222, Pseudomonas
независимо в изотропном приближении. При
aeruginosa АТСС 9027, Salmonella abony №103/39,
уточнении остальных водородных атомов
Bacillus cereus АТСС 10702. Результаты испытаний
использована модель наездника. Окончательные
представлены в табл.
4.
Установлено, что
параметры уточнения: R1 = 0.0623, wR2 = 0.1377
соединение
4а обладает высокой антибакте-
[для 3834 отражений с I > 2σ(I)], R1 = 0.1008, wR2 =
риальной активностью, превышающей активность
0.1688 (для всех 5893 независимых отражений), S =
эталона сравнения (1%-ный раствор диоксидина), в
1.050. Результаты РСА зарегистрированы в
отношении Proteus vulgaris №HХ 19/222, Кlebsiella
Кембриджском центре кристаллографических
pneumoniae №5055 NCTC, Pseudomonas aeruginosa
данных (CCDC 1856231).
АТСС
9027, Staphylococcus epidermidis АТСС
14990; в отношении остальных изученных
N-{4-[(1,3-Тиазол-2-ил)cульфамоил]фенил}-1-
штаммов данное соединение проявляет среднюю
фенил-5-(4-хлорфенил)пиразол-3-карбоксамид
антибактериальную активность.
(2а). К суспензии 0.01 моля (2Z)-2-гидрокси-4-оксо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
548
ГЕЙН и др.
N-{4-[(1,3-тиазол-2-ил)сульфамоил]фенил}-4-(4-
J = 4.7 Гц), 6.89-8.02 м (13Н, CHAr), 10.51 с (1H,
хлорфенил)бут-2-енамида
1а в
30 мл ледяной
CONH), 12.67 уш. с (1H, SO2NH). Масс-спектр
уксусной кислоты добавляли
0.012
моля
(HRMS-ESI), m/z: 546.1251 [M + Н]+, 568.1074 [M +
фенилгидразина. Реакционную смесь кипятили в
Na]+. Найдено, %: С 59.27; Н 4.21; N 12.88; S 11.68.
течение 2 ч. Выпавший при охлаждении осадок
C27H23N5O4S2. Вычислено, %: С 59.43; Н 4.25; N
отфильтровывали и перекристаллизовывали из
12.84; S 11.75.
смеси этанол-уксусная кислота (2:1). Выход 3.65 г
5-(4-Метоксифенил)-N-{4-[(1,3-тиазол-2-ил)-
(68%), т. пл. 220-222°С (EtOH-AcOH, 2:1). ИК
cульфамоил]фенил}-1-фенилпиразол-3-карбо-
спектр, ν, см-1: 3400 (NH), 1682 (CON), 1313, 1148
ксамид (2д). Выход 4.14 г (78%), т. пл. 251-253°С
(SO2). Спектр ЯМР 1H, δ, м. д.: 6.79 д (1H, C5Hтиазол,
(EtOH-AcOH, 2:1). ИК спектр, ν, см-1: 3336 (NH),
J = 4.7 Гц), 7.18 с (1Н, С4Нпиразол), 7.19 д (1H,
1692 (CON), 1312, 1152 (SO2). Спектр ЯМР 1H, δ,
C4Hтиазол, J = 4.7 Гц), 7.29-7.99 м (13Н, CHAr), 10.31
м. д.: 3.70 с (3Н, CH3О), 6.75 д (1H, C5Hтиазол, J =
с (1H, CONH), 12.44 уш. c (1H, SO2NH). Масс-
4.6 Гц), 7.02 с (1Н, С4Нпиразол), 7.09 д (1H, C4Hтиазол,
спектр (HRMS-ESI), m/z: 536.0614 [M]+, 558.0430
J = 4.6 Гц), 6.78-7.95 м (13Н, CHAr), 10.35 с (1H,
[M + Na - Н]+, 574.0170 [M + K - Н]+. Найдено, %:
CONH), 12.40 уш. c (1H, SO2NH). Найдено, %: С
С 56.13; Н 3.34; N 13.15; S 12.05. C25H18ClN5O3S2.
58.87; Н 4.05; N 13.23; S 12.00. C26H21N5O4S2.
Вычислено, %: С 56.02; Н 3.38; N 13.07; S 11.96.
Вычислено, %: С 58.74; Н 3.98; N 13.17; S 12.06.
Соединения 2б-д получали аналогично.
Натриевая соль N-{4-[(1,3-тиазол-2-ил)cуль-
N-{4-[(1,3-Тиазол-2-ил)cульфамоил]фенил}-
фамоил]фенил}-1-фенил-5-(4-хлорфенил)пира-
1,5-дифенилпиразол-3-карбоксамид (2б). Выход
зол-3-карбоксамида
(3а). К теплому раствору
3.82 г (76%), т. пл. 215-217°С (EtOH-AcOH, 2:1).
0.005 моля N-{4-[(1,3-тиазол-2-ил)cульфамоил]-
ИК спектр, ν, см-1: 3493, 3274 (NH), 1673 (CON),
фенил}-1-фенил-5-(4-хлорфенил)пиразол-3-карбо-
1320, 1148 (SO2). Спектр ЯМР 1H, δ, м. д.: 6.78 д
ксамида 2а, полученному нагреванием в смеси
(1H, C5Hтиазол, J = 4.7 Гц), 7.14 с (1Н, С4Нпиразол),
метанол-ДМФА
(1:1), приливали эквимолярное
7.17 д (1H, C4Hтиазол, J = 4.7 Гц), 7.27-7.99 м (14Н,
количество
0.2 М. раствора метоксида натрия,
CHAr), 10.30 с (1H, CONH), 12.45 уш. c (1H,
раствор упаривали при комнатной температуре
SO2NH). Масс-спектр (HRMS-ESI), m/z: 502.0989
досуха, остаток перекристаллизовывали из этанола.
[M + Н]+, 524.0808 [M + Na]+. Найдено, %: С 59.72;
Выход 1.70 г (61%), т. пл. 320-322°С (EtOH). ИК
Н 3.86; N 13.91; S 12.86. C25H19N5O3S2. Вычислено,
спектр, ν, см-1: 3476 (NH), 1673 (CON), 1319, 1141
%: С 59.86; Н 3.82; N 13.96; S 12.79.
(SO2). Спектр ЯМР 1H, δ, м. д.: 6.55 д (1H, C5Hтиазол,
J = 4.0 Гц), 7.02 д (1H, C4Hтиазол, J = 4.0 Гц), 7.19 с
5-(4-Метилфенил)-N-{4-[(1,3-тиазол-2-ил)cуль-
(1Н, С4Нпиразол), 7.29-7.89 м (13Н, CHAr), 10.26 с
фамоил]фенил}-1-фенилпиразол-3-карбоксамид
(1H, CONH). Масс-спектр (HRMS-ESI), m/z:
(2в). Выход 4.02 г (78%), т. пл. 230-232°С (EtOH-
558.0428 [M]+, 580.0243 [M + Na - Н]+. Найдено, %:
AcOH, 2:1). ИК спектр, ν, см-1: 3347, 3242 (NH),
С
53.66; Н
3.01; N
12.65; S
11.40.
1688 (CON), 1310, 1125 (SO2). Спектр ЯМР 1H, δ, м.
C25H17ClN5NaO3S2. Вычислено, %: С 53.81; Н 3.07;
д.: 2.29 с (3Н, CH3), 6.83 д (1H, C5Hтиазол, J = 4.5 Гц),
N 12.55; S 11.49.
7.14 с (1Н, С4Нпиразол),
7.25 д (1H, C4Hтиазол, J =
4.5 Гц), 7.17-8.02 м (13Н, CHAr), 10.53 с (1H,
Соединения 3б-д получали аналогично.
CONH), 12.78 уш. c (1H, SO2NH). Масс-спектр
Натриевая соль N-{4-[(1,3-тиазол-2-ил)cуль-
(HRMS-ESI), m/z: 538.0955 [M + Na]+. Найдено, %:
фамоил]фенил}-1,5-дифенилпиразол-3-карбо-
С 60.45; Н 4.05; N 13.65; S 12.52. C26H21N5O3S2.
ксамида (3б). Выход 1.70 г (65%), т. пл. 300°С
Вычислено, %: С 60.57; Н 4.11; N 13.58; S 12.44.
(разл.) (EtOH). ИК спектр, ν, см-1: 3443 (NH), 1666
N-{4-[(1,3-Тиазол-2-ил)cульфамоил]фенил}-1-
(CON), 1317, 1144 (SO2). Спектр ЯМР 1H, δ, м. д.:
фенил-5-(4-этоксифенил)пиразол-3-карбоксамид
6.53 д (1H, C5Hтиазол, J = 4.0 Гц), 7.01 д (1H,
(2г). Выход 4.31 г (79%), т. пл. 240-242°С (EtOH-
C4Hтиазол, J = 4.0 Гц), 7.14 с (1Н, С4Нпиразол), 7.28-
AcOH, 2:1). ИК спектр, ν, см-1: 3337 (NH), 1693
7.92 м (14Н, CHAr), 10.74 с (1H, CONH). Масс-
(CON), 1314, 1149 (SO2). Спектр ЯМР 1H, δ, м. д.:
спектр (HRMS-ESI), m/z:
546.0632
[M
+ Na]+.
1.30 т (3Н, CH3CH2O, J = 6.9 Гц), 4.02 к (2Н,
Найдено, %: С 57.47; Н 3.39; N 13.30; S 12.19.
СН3СН2О, J = 6.9 Гц), 6.83 д (1H, C5Hтиазол, J =
C25H18N5NaO3S2. Вычислено, %: С 57.35; Н 3.47; N
4.7 Гц), 7.11 c (1Н, С4Нпиразол), 7.25 д (1H, C4Hтиазол,
13.38; S 12.25.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
549
Натриевая соль 5-(4-метилфенил)-N-{4-[(1,3-
1141 (SO2). Спектр ЯМР 1H, δ, м. д.: 6.86 д (1H,
тиазол-2-ил)cульфамоил]фенил}-1-фенилпиразол-
C5Hтиазол, J = 3.9 Гц), 7.14 с (1Н, С4Нпиразол), 7.19 д
3-карбоксамида (3в). Выход 1.53 г (57%), т. пл.
(1H, C4Hтиазол, J = 3.9 Гц), 7.25-7.96 м (13Н, CHAr),
298-300°С (EtOH). ИК спектр, ν, см-1: 3346, 3242
10.29 с (1H, CONH). Найдено, %: С 46.82; Н 2.64; N
(NH), 1687 (CON), 1329, 1128 (SO2). Спектр ЯМР
10.97; S 9.91. C25H17AgClN5O3S2. Вычислено, %: С
1H, δ, м. д.: 2.29 с (3Н, CH3), 6.75 д (1H, C5Hтиазол,
46.71; Н 2.67; N 10.89; S 9.98.
J = 4.4 Гц), 7.11 с (1Н, С4Нпиразол), 7.18 д (1H,
Соединения 4б, в, д получали аналогично.
C4Hтиазол, J = 4.4 Гц), 7.16-7.98 м (13Н, CHAr), 10.33
с
(1H, CONH). Масс-спектр (HRMS-ESI), m/z:
Серебряная соль N-{4-[(1,3-тиазол-2-ил)cуль-
538.0970 [M + Н]+, 560.0793 [M + Na]+. Найдено, %:
фамоил]фенил}-1,5-дифенилпиразол-3-карбо-
С 57.99; Н 3.80; N 13.12; S 11.99. C26H20N5NaO3S2.
ксамида (4б). Выход 2.16 г (71%), т. пл. 219-221°С
Вычислено, %: С 58.09; Н 3.75; N 13.03; S 11.93.
(EtOH). ИК спектр, ν, см-1: 3499, 3312 (NH), 1681
(CON), 1318, 1140 (SO2). Спектр ЯМР 1H, δ, м. д.:
Натриевая соль N-{4-[(1,3-тиазол-2-ил)cуль-
6.87 д (1H, C5Hтиазол, J = 3.9 Гц), 7.11 с (1Н,
фамоил]фенил}-1-фенил-5-(4-этоксифенил)-
С4Нпиразол), 7.19 д (1H, C4Hтиазол, J = 3.9 Гц), 7.24-
пиразол-3-карбоксамида (3г). Выход 1.62 г (57%),
7.97 м (14Н, CHAr), 10.29 с (1H, CONH). Найдено,
т. пл. 250-252°С (EtOH). ИК спектр, ν, см-1: 3336
%: С
49.42; Н
2.93; N
11.41; S
10.45.
(NH), 1693 (CON), 1314, 1149 (SO2). Спектр ЯМР
C25H18AgN5O3S2. Вычислено, %: С 49.35; Н 2.98; N
1H, δ, м. д.: 1.30 т (3Н, CH3CH2O, J = 7.0 Гц), 4.02 к
11.51; S 10.54.
(2Н, СН3СН2О, J = 7.0 Гц), 6.58 д (1H, C5Hтиазол, J =
4.4 Гц), 7.05 д (1H, C4Hтиазол, J = 4.4 Гц), 7.06 с (1Н,
Серебряная соль 5-(4-метилфенил)-N-{4-[(1,3-
С4Нпиразол),
6.88-7.90 м (13Н, CHAr), 10.23 с (1H,
тиазол-2-ил)cульфамоил]фенил}-1-фенилпиразол-
CONH). Масс-спектр (HRMS-ESI), m/z: 568.1081
3-карбоксамида (4в). Выход 2.11 г (68%), т. пл.
[M + Н]+, 590.0906 [M + Na]+. Найдено, %: С 57.21;
220-222°С (EtOH). ИК спектр, ν, см-1: 3300 (NH),
Н
3.87; N
12.40; S
11.37. C27H22N5NaO4S2.
1685 (CON), 1317, 1140 (SO2). Спектр ЯМР 1H, δ,
Вычислено, %: С 57.13; Н 3.91; N 12.34; S 11.30.
м. д.: 2.29 с (3Н, СН3) 6.86 д (1H, C5Hтиазол, J = 3.9
Гц), 7.07 с (1Н, С4Нпиразол), 7.19 д (1H, C4Hтиазол, J =
Натриевая соль
5-(4-метоксифенил)-N-{4-
3.9 Гц), 7.14-7.95 м (13Н, CHAr), 10.26 с (1H,
[(1,3-тиазол-2-ил)cульфамоил]фенил}-1-фенил-
CONH). Найдено, %: С 50.05; Н 3.30; N 11.28; S
пиразол-3-карбоксамида
(3д). Выход
1.63 г
10.23. C26H20AgN5O3S2. Вычислено, %: С 50.17; Н
(59%), т. пл. 250-252°С (EtOH). ИК спектр, ν, см-1:
3.24; N 11.25; S 10.30.
3339 (NH), 1691 (CON), 1315, 1150 (SO2). Спектр
ЯМР 1H, δ, м. д.: 3.72 с (3Н, CH3О), 6.63 д (1H,
Серебряная соль
5-(4-метоксифенил)-N-{4-
C5Hтиазол, J = 4.4 Гц), 6.84 с (1Н, С4Нпиразол), 6.96 д
[(1,3-тиазол-2-ил)cульфамоил]фенил}-1-фенил-
(1H, C4Hтиазол, J = 4.4 Гц), 7.04-7.90 м (13Н, CHAr),
пиразол-3-карбоксамида
(4д). Выход
2.04 г
10.17 с (1H, CONH). Масс-спектр (HRMS-ESI), m/z:
(64%), т. пл. 214-216°С (EtOH). ИК спектр, ν, см-1:
554.0906 [M + Н]+, 576.0727 [M + Na]+. Найдено, %:
3494, 3372 (NH), 1688 (CON), 1319, 1141 (SO2).
С 56.55; Н 3.60; N 12.56; S 11.67. C26H20N5NaO4S2.
Спектр ЯМР 1H, δ, м. д.: 3.75 с (3Н, CH3О), 6.86 д
Вычислено, %: С 56.41; Н 3.64; N 12.65; S 11.58.
(1H, C5Hтиазол, J = 3.9 Гц), 7.04 с (1Н, С4Нпиразол),
7.18 д (1H, C4Hтиазол, J = 3.9 Гц), 6.88-7.95 м (13Н,
Серебряная соль N-{4-[(1,3-тиазол-2-ил)cуль-
CHAr), 10.25 с (1H, CONH). Найдено, %: С 48.79; Н
фамоил]фенил}-1-фенил-5-(4-хлорфенил)пиразол-
3.21; N 10.88; S 9.93. C26H20AgN5O4S2. Вычислено,
3-карбоксамида
(4а). К горячему раствору
%: С 48.91; Н 3.16; N 10.97; S 10.04.
0.005 моля N-{4-[(1,3-тиазол-2-ил)cульфамоил]-
фенил}-1-фенил-5-(4-хлорфенил)пиразол-3-карбо-
Анальгетическую активность соединений 2а-в,
ксамида 2а в 30-35 мл cмеси этанол-ДМФА (2:1)
3а-д определяли методом термического раздра-
приливали горячий раствор 0.005 моля нитрата
жения
«горячая пластинка» на беспородных
серебра в этаноле (2%-ный раствор). Выпавший
мышах (самках) массой 25-30 г [10]. Для оценки
осадок отфильтровывали, промывали на фильтре
болевой чувствительности использовали прибор
от следов нитрата серебра этанолом и водой,
(анальгезиметр). Исследуемые соединения вводили
сушили, снова промывали этанолом и сушили.
внутрибрюшинно в дозе 50 мг/кг в виде взвеси в
Выход 2.15 г (67%), т. пл. 217-219°С (EtOH). ИК
1%-ном крахмальном растворе за
30 мин до
спектр, ν, см-1: 3494, 3376 (NH), 1688 (CON), 1319,
помещения животных на нагретую до
53.5°С
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
550
ГЕЙН и др.
металлическую пластинку. Показателем изменения
питательной среде составляла 1000.0 мкг/мл. Для
болевой чувствительности служила длительность
определения
антибактериальной
активности
пребывания животных на горячей пластинке с
использовали бульон Хоттингера, для определения
момента помещения на горячую поверхность до
противогрибковой активности - бульон Сабуро.
появления поведенческого ответа (облизывания и
Для приготовления взвеси дрожжевых культур
отдергивания задних лап, прыжков, либо попытки
применяли двухсуточные культуры, выращенные
выпрыгнуть), измеряемая в секундах. Результаты
на агаре Сабуро. Для определения анти-
оценивали по увеличению времени наступления
бактериальной активности использовали типовые
оборонительного рефлекса по сравнению с
суточные культуры, выращенные на питательном
исходными данными. Контрольной группе
агаре. Концентрация микробных клеток в опыте
животных вводили 1%-ный крахмальный раствор.
составила (2-5)×105 КОЕ/мл (для бактерий), (2-5)×
В качестве эталона сравнения использовали
104
КОЕ/мл (для грибов). В качестве
метамизол натрия (анальгин) в дозе
50 мг/кг,
положительного контроля использовали пита-
введенный аналогично исследуемым соединениям.
тельную среду с внесенной исследуемой
Результаты
статистически
обработаны
с
культурой. В качестве отрицательного контроля
вычислением
критерия
Фишера-Стьюдента.
использовали интактную питательную среду.
Эффект считали достоверным при p < 0.05 [11].
Посевы инкубировали в термостате при
температуре 25±2°С (для грибов), 37±2°С (для
Противовоспалительную активность соеди-
бактерий). Оценку роста бактерий проводили
нений 2а-в, 3а-в изучали на белых нелинейных
визуально через
20-24 ч инкубирования,
крысах обоего пола массой 220-270 г на модели
антимикотическую активность - на 40-48 ч и 70-
острого воспалительного отека, вызванного
72 ч инкубирования. В качестве значения МПК
субплантарным введением 0.1 мл 1%-ного водного
(минимальной
подавляющей концентрации)
раствора каррагенина в заднюю лапу животного
принимали концентрацию соединения в последней
[10].
Объем стопы у крыс измеряли
прозрачной пробирке серии разведения. В качестве
онкометрически до опыта и через
3 ч после
эталона сравнения антибактериальной активности
введения каррагенина. Исследуемые соединения
использовали
диоксидин.
Фунгистатический
вводили внутрижелудочно через атравматичный
эффект исследуемых соединений сравнивали с
металлический зонд в виде взвеси в
1%-ном
действием флуконазола.
крахмальном растворе в дозе 50 мг/кг за 1 ч до
введения флогогенного агента. Эталонами
Работа выполнена с соблюдением всех приме-
сравнения служили метамизол натрия (анальгин) и
нимых международных, национальных и
нимесулид в дозе 50 мг/кг, вводимые аналогично
институциональных руководящих принципов по
изучаемым соединениям. Статистическую обра-
уходу и использованию животных.
ботку проводили по методу Фишера-Стьюдента.
Эффект считали достоверным при p < 0.05 [11].
Исследования проведены с использованием
оборудования Ресурсных центров
«Методы
Противовоспалительный эффект оценивали по
анализа состава вещества» и
«Магнитно-
показателю торможения отека, который выражали
в процентах к показателям контрольной группы.
резонансные
методы
исследования»
и
Образовательного центра по направлению
Противогрибковую и антибактериальную
«Химия» Научного парка Санкт-Петербургского
активность полученных соединений 2а-д, 3а-в,
государственного университета.
4а-в, д определяли пробирочным методом
двукратных серийных разведений в жидкой
КОНФЛИКТ ИНТЕРЕСОВ
питательной среде [10]. Исследуемые соединения
массой 0.05 г растворяли в 5 мл ДМСО, получая
Авторы заявляют об отсутствии конфликта
основной раствор вещества в концентрации
интересов.
104 мкг/мл. Данный раствор служил основой для
рабочего раствора, имеющего концентрацию 2×
СПИСОК ЛИТЕРАТУРЫ
103 мкг/мл, который последовательно разводили
двукратно в жидкой питательной среде в ряду из
1. Гейн В.Л., Бобровская О.В., Селиверстов Г.В.,
10
пробирок.
Концентрация исследуемых
Слепухин П.А. // ЖОХ. 2016. Т. 86. Вып. 2. С. 272;
соединений в первой пробирке ряда разведений в
Gein V.L., Bobrovskaya O.V., Seliverstov G.V.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
551
Slepukhin P.A. // Russ. J. Gen. Chem. 2016. Vol. 86.
6. CrysAlisPro, Agilent Technologies, Version
N 2. Р. 300. doi 10.1134/S107036321602016X
1.171.37.33 (release 27-03-2014 CrysAlis171 .NET).
2. Машковский М.Д. Лекарственные средства. М.:
7. Palatinus L., Chapuis G. // J. Appl. Crystallogr. 2007.
Новая волна, 2012. С. 824.
Vol. 40. Р. 786. doi 10.1107/S0021889807029238.
3. Гейн В.Л., Бобровская О.В., Русских А.А., Петухо-
8. Sheldrick G.M. // Acta Crystallogr. (C) 2015. Vol. 71.
ва Н.Н. // ЖОХ. 2018. Т. 88. Вып. 2. С. 338;
P. 3. doi 10.1107/S2053229614024218
Gein V.L., Bobrovskaya O.V., Russkikh A.A., Petukho-
9. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
va N.N. // Russ. J. Gen. Chem. 2018. Vol. 88. N 2.
ward J.A.K., Puschmann H. // J. Appl. Crystallogr.
Р. 334. doi 10.1134/S1070363218020238
2009. Vol. 42. P. 339. doi 10.1107/S0021889808042726
4. Бобровская О.В., Гейн В.Л., Селиверстов Г.В.,
Чащина С.В., Дмитриев М.В. // ЖОХ. 2017. Т. 87.
10. Руководство по проведению доклинических
Вып. 12. С. 1957; Bobrovskaya O.V., Gein V.L.,
исследований лекарственных средств / Под ред.
Seliverstov G.V., Chashchina S.V., Dmitriev M.V. //
А.Н. Миронова, Н.Д. Бунятян, А.Н. Васильева,
Russ. J. Gen. Chem. 2017. Vol. 87. N 12. Р. 2776. doi
О.Л. Верстаковой, М.В. Журавлевой, В.К. Лепахина,
10.1134/S1070363217120040
Н.В. Коробова, В.А. Меркулова, С.Н. Орехова,
И.В. Сакаевой, Д.Б. Утешева, А.Н. Яворского. М.:
5. Cordeiro R.A., Teixeira C.E.C., Brilhante R.S.N.,
Гриф и К, 2012. Ч. 1. 944 с.
Castelo-Branco D.S.C.M., Paiva M.A.N., Leite J.J.G.,
Lima D.T., Monteiro A.J., Sidrim J.J.C., Ro-
11. Беленький М.Л. Элементы количественной оценки
cha M.F.G. // Med. Mycology. 2013. Vol. 51. N 1.
фармакологического эффекта. Ленинград: Медгиз,
P. 53. doi 10.3109/13693786.2012.692489
1963. С. 81.
Synthesis and Biological Activity of 5-Aryl-N-{4-[(1,3-thiazol-2-yl)-
sulfamoyl]phenyl}-1-phenylpyrazole-3-carboxamides
and Their Salts
V. L. Geina, *, O. V. Bobrovskayaa, A. A. Russkikha, V. V. Novikovaa, O. N. Geina,
Yu. N. Karpenkoa, S. V. Chaschinab, M. V. Dmitrievb, and A. N. Yankinc
a Perm State Pharmaceutical Academy, ul. Polevaya 2, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
b Perm State Natsional Research University, Perm, Russia
c St. Petersburg State University, St. Petersburg, Russia
Received November 15, 2018; revised November 15, 2018; accepted November 22, 2018
Reaction of 4-aryl-2-hydroxy-4-oxo-N-{4-[(1,3-thiazol-2-yl)sulfamoyl]phenyl}but-2-enamides with phenylhyd-
razine in glacial acetic acid afforded 5-aryl-N-{4-[(1,3-thiazol-2-yl)sulfamoyl]phenyl}-1-phenylpyrazole-3-
carboxamides, which were converted into silver salts when treated with an equimolar amount of silver nitrate in
ethanol-DMF (2:1). 5-Aryl-N-{4-[(1,3-thiazol-2-yl)sulfamoyl]phenyl}-1-phenylpyrazole-3-carboxamides sodium
salts were synthesized by reacting with sodium methoxide methanol-DMF (1:1). Analgesic, anti-inflammatory
and antimicrobial activity of the compounds obtained was studied.
Keywords: pyrazole-3-carboxamides, silver and sodium salts of pyrazole-3-carboxamides, analgesic activity,
anti-inflammatory activity, antimicrobial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019