ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 552-560
УДК 546.221:546.222:547.279.1:547.592.1:544.653.1
РЕДОКС-АКТИВАЦИЯ СЕРОВОДОРОДА, ТИОЛОВ
И СЕРЫ В ЭЛЕКТРОСИНТЕЗЕ ОРГАНИЧЕСКИХ ДИ-
И ПОЛИСУЛЬФИДОВ
© 2019 г. Е. В. Шинкарь*, И. В. Смолянинов, В. В. Кузьмин, Н. Т. Берберова
Астраханский государственный технический университет, ул. Татищева 16, Астрахань, 414056 Россия
*e-mail: nberberova@gmail.com
Поступило в Редакцию 15 ноября 2018 г.
После доработки 15 ноября 2018 г.
Принято к печати 22 ноября 2018 г.
Предложен новый эффективный метод синтеза биологически активных органических ди-, три- и
тетрасульфидов. Рассмотрены различные способы редокс-активации серы, сероводорода, тиолов в
реакциях с органическими соединениями. Электрохимическое инициирование реакций системы
медиатор-H2S-S8 с циклогексаном, метилциклогексаном и бензолом приводит к образованию
полисульфидов R2Sn (n
=
2-4). Применение в качестве медиатора окисления H2S бромида
тетрабутиламмония позволило снизить анодное перенапряжения электросинтеза. В условиях анодной
активации реакции циклоалкантиолов (С5, C6) или тиофенола с серой получены ди- и тетрасульфиды.
Электровосстановление S8 в присутствии тиолов благоприятствовало формированию ди- и трисульфидов.
Выход и соотношение R2Sn (n = 2-4) зависят от способа редокс-активации тиолирующего агента.
Ключевые слова: электросинтез, органические полисульфиды, сероводород, циклоалкантиолы,
элементная сера, редокс-активация
DOI: 10.1134/S0044460X19040085
Органические ди- и полисульфиды широко
разработка новых подходов к получению соеди-
применяют в различных областях промышлености,
нений-доноров сероводорода. Интересно, что
особенно в пищевой и фармацевтической
- в
между строением R2Sn и скоростью выделения H2S
качестве потенциальных противогрибковых, анти-
в результате распада органических полисульфидов
бактериальных и противоопухолевых веществ
существует корреляция, которую необходимо
[1-4]. Полисульфиды R2Sn (n = 2-4) играют роль
учитывать при дизайне лекарственных средств.
соединений-платформ и перспективны для
Таким образом, разработка эффективных подходов
создания лекарственных препаратов. Высокую
к синтезу ди-, три- и тетрасульфидов с различными
биологическую активность органических поли-
заместителями является актуальной проблемой.
сульфидов связывают с возможностью образования
H2S, поэтому их часто используют в качестве
При конструировании биологически активных
перспективных источников эндогенно образую-
органических соединений серы особое внимание
щегося сероводорода. В последнее время серо-
уделяют различным способам образования связей
водород признан важной биологической моле-
C-S, S-S [8, 9]. Реакции тиолирования реализуются
кулой, которая играет определенную роль в
благодаря активации связи Csp3-H в катали-
различных физиологических процессах
[5,
6].
тических условиях металлосодержащими соедине-
Недавние исследования выявили способность
ниями
[10,
11] или при радикальном иници-
сероводорода принимать активное участие в
ировании ди-трет-бутилпероксидом
[12-14].
передаче сигнала между клетками живого
Органические три- и тетрасульфиды получают
организма и регулировать некоторые процессы, что
также взаимодействием алкил(арил)тиолов с ди-
позволяет отнести его к газотрансмиттерам [7].
хлоридом серы в присутствии оснований в
Одним из приоритетных направлений в химии
неполярных растворителях [15]. Известно много
природных и синтетических веществ является
результативных примеров синтеза ди- и
552
РЕДОКС-АКТИВАЦИЯ СЕРОВОДОРОДА, ТИОЛОВ И СЕРЫ
553
полисульфидов в условиях термической активации
способов редокс-активации серосодержащих реа-
серы. Так, полисульфиды симметричного строения
гентов (сероводорода, циклопентантиола, цикло-
образуются в реакции диаллилдисульфида с
гексантиола, тиофенола и серы). В реакциях с
элементной серой при температуре расплава S8
участием H2S (Епа = 1.7 В) применяли электро-
(115-120°С) [16]. Термическая активация системы
медиаторное (Вu4NBr, Епа1 = 0.9 В, Епа2 = 1.2 В)
S8-H2S при
120-180°С эффективна в синтезе
окисление до катион-радикала сероводорода,
органических производных серы за счет
снижающее потенциал электролиза (ΔE = 0.8 В).
генерирования гидрополисульфидных и тиильных
Генерирование тиильного радикала осуществля-
радикалов в расплаве [17, 18]. Известен также
ется за счет циклических превращений редокс-
электрохимический способ получения смеси
пары Вr-/Br. при потенциале первого анодного
органических сульфидов R2Sn (n
=
2-4) при
пика. Взаимодействие HS-радикала с S8
комнатной температуре, основанный на взаимо-
способствует формированию гидрополисуль-
действии алкил(арил)меркаптанов с анодно-
фидных радикалов в растворе (схема 1).
генерируемым дикатионом серы (2.2 В) [19].
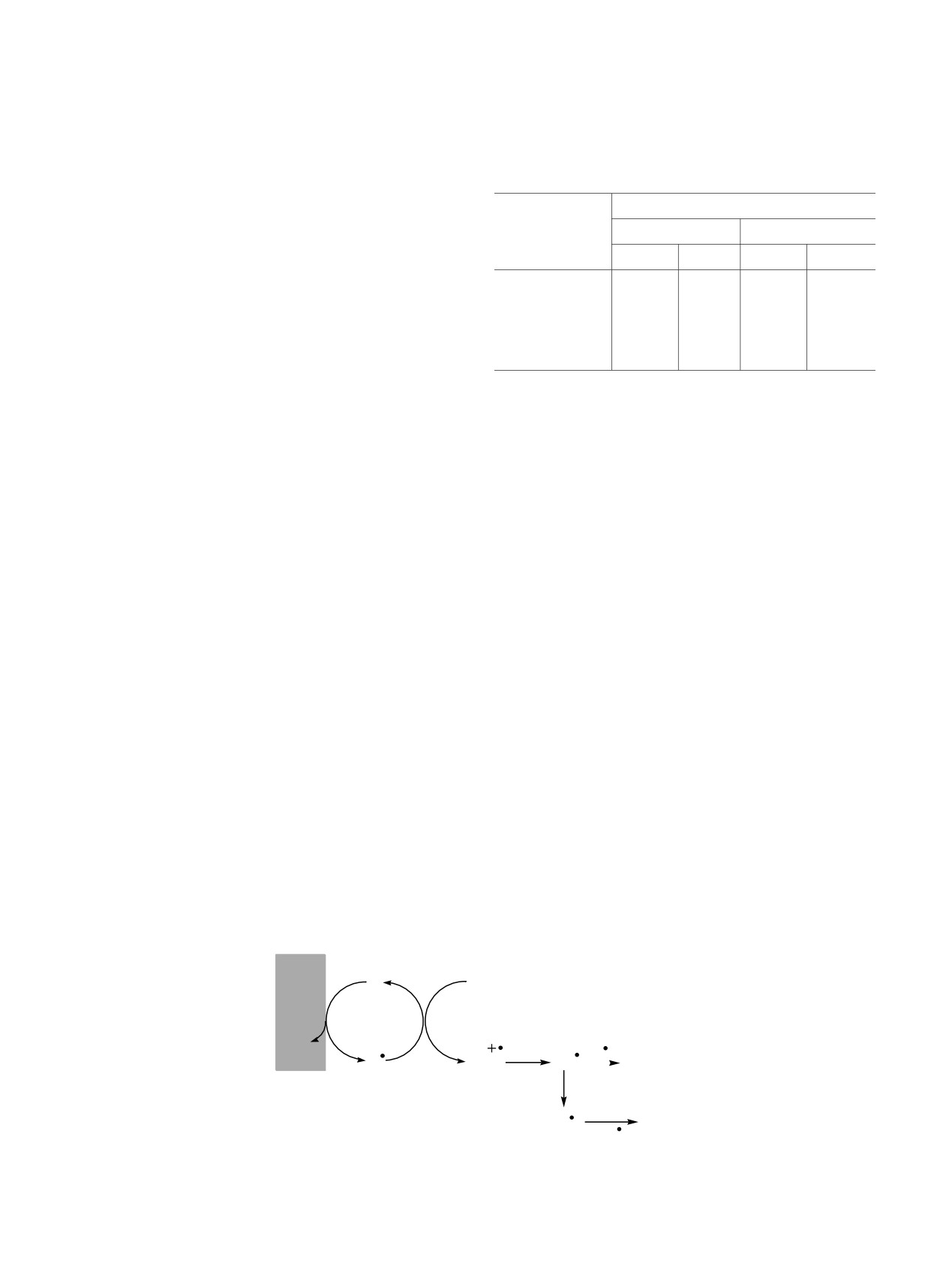
Схема 1.
Ранее нами был предложен электрохимический
+e
метод получения R2Sn (n = 2-4) на основе взаимо-
Br-
Br
Pt,
S8
действия циклоалканов С5-С8 с сероводородом в
-e
H2S
H2S
HS
HS9
+
E = 1.1 B; 25οC;
H
условиях прямой (анод/катод) активации H2S при
CH2Cl2
комнатной температуре и атмосферном давлении
[20, 21]. Для снижения анодного перенапряжения
электросинтеза применяли также косвенную
Димеризация тиильных радикалов как
активацию сероводорода в присутствии медиатора
продуктов фрагментации нестабильного катион-
окисления H2S - Вu4NBr [22, 23]. Эффективность
радикала H2S приводит к образованию неоргани-
бромида тетрабутиламмония обусловлена его
ческих полисульфанов (H2Sn) с различным содер-
инертностью по отношению к реагенту и
жанием атомов серы. Электролиз при потенциале
способностью к окислению при более низком
окисления медиатора благоприятствует одно-
значении потенциала, а также возможностью
электронному окислению H2Sn (0.4-1.5 В) до HSn-
регенерации на катоде [24]. При использовании
радикалов (схема 2).
различных способов активации H2S в реакции с
Схема 2.
циклоалканами С5-С8 первоначально образуются
+e
продукты тиолирования цикла - циклоалкантиолы
Br-
Br
и дисульфиды. Увеличение продолжительности
-e
2HS
H2S2
H2S2
HS2
электросинтеза способствует в результате окис-
H+
ления H2S формированию неорганических поли-
2
HS2
H2S4
сульфанов и серы, которые участвуют в синтезе
три- и тетрасульфидов симметричного строения
При длительном проведении реакции повы-
[25]. Таким образом, проведенные ранее исследо-
шается концентрация высших полисульфанов H2Sn
(n ≥ 4-8), которые превращаются в S8 [26, 27].
вания показали, что различные серосодержащие
соединения (сероводород, тиолы, сера) участвуют
Систему Med-H2S-S8 использовали для синтеза ди-
в электросинтезе органических ди-, три- и
и полисульфидов в реакциях с циклогексаном,
метилциклогексаном и бензолом в дихлорметане
тетрасульфидов. К основным достоинствам
данного метода можно отнести мягкие условия
при комнатной температуре. В случае цикло-
проведения реакций и высокую экологическую
алканов первично образуются соответствующие
циклоалкантиолы (схема 3).
безопасность процесса. В связи с этим целью
настоящей работы является поиск эффективных
Схема 3.
способов вовлечения серосодержащих соединений
HS
путем предварительной их редокс-активации в
+
HS
H2S
синтез биологически активных R2Sn (n = 2-4) в
SH
органическом растворителе.
Сравнительная оценка реакционной способности
Для эффективного электросинтеза полисуль-
тиильного и гидрополисульфидных радикалов НSn
фидов R2Sn (n
=
2-4) использовали несколько
(n = 2-6) в реакции с циклоалканами с помощью
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
554
ШИНКАРЬ и др.
квантово-химических расчетов показала, что отрыв
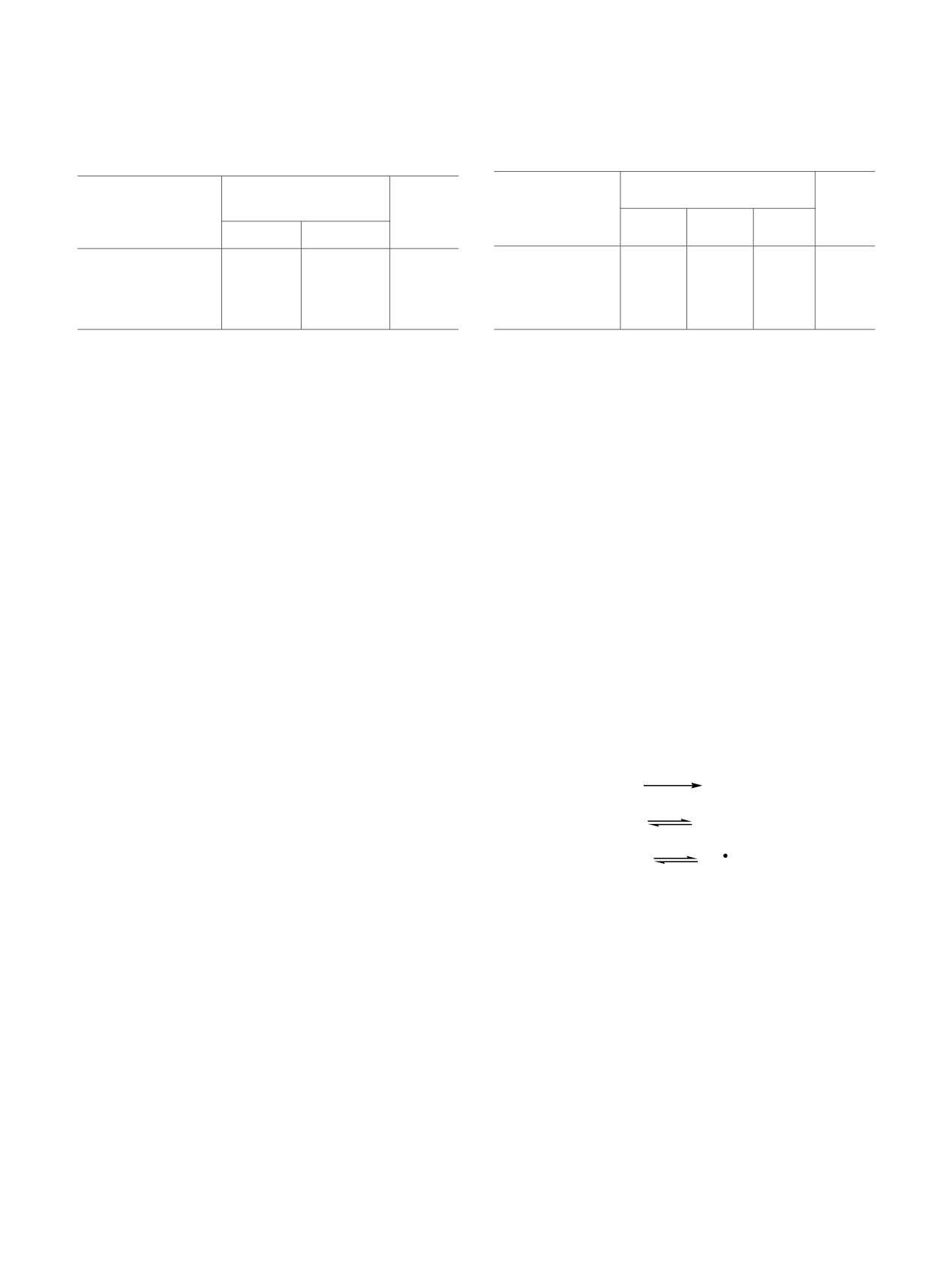
Таблица 1. Зависимость выхода продуктов взаимо-
атома водорода от субстрата при действии
действия циклогексана и метилциклогексана с системой
Med-H2S-S8 от времени электросинтеза [c(S8) = c(Med) =
тиильного радикала идет намного легче (на
5 ммоль, E = 1.10 В, CH2Cl2, Pt-анод]
~75 кДж/моль). Еще одной конкурирующей
атакующей частицей является радикал брома,
Выход, %
генерируемый на аноде. Однако концентрация
Величина
C6H12
(CH3)C6H11
медиатора в реакционной смеси значительно ниже,
1.5 ч
2.5 ч
1.5 ч
2.5 ч
чем сероводорода, что способствует высокой
степени регенерации Med в приэлектродной
R2S2
5.8
7.2
6.8
9.8
области. Следовательно, инициирование реакций с
R2S3
4.9
5.7
10.4
11.0
участием циклоалканов тиильными радикалами
R2S4
16.9
22.6
18.4
25.4
более вероятно (схема 3).
Σа
27.6
35.5
35.6
46.2
Образующиеся в ходе электролиза цикло-
а Суммарный выход продуктов реакции.
алкантиолы RSH также окисляются активной
формой медиатора до циклоалкилтиильных ради-
калов, способных к димеризации в приэлектродной
(n = 2-4) и Н2S, приводящим к RSH и RSn-1H,
области или к взаимодействию с серой в растворе
которое легко протекает в биологических системах
(схема 4).
[28]. Значения тепловых эффектов реакций Н2S и
R2Sn с циклогексильными группами варьируются
В результате электромедиаторного окисления
RSH образуются дисульфиды, а нестабильные
от -2.98 до 17.42 кДж/моль. Следует отметить, что
циклоалкилгидрополисульфиды RSnH превраща-
подобные превращения с участием низкомоле-
кулярных неорганических сульфанов H2Sn (n = 2, 3)
ются в три- и тетрасульфиды, что сопровождается
протекают заметно легче (ΔН изменяется от -7.75
выделением сероводорода и серы. При проведении
до 3.77 кДж/моль). Образующиеся нестабильные
электролиза циклоалканов C6, C7 с системой Med-
промежуточные соединения RSn-1H диспропор-
H2S-S8 при потенциале окисления первого
ционируют до ди- и трисульфидов с выделением
анодного пика медиатора были получены R2Sn (n =
серы. Кроме того, наличие бромид-аниона в
2-4) (табл.
1). Система Med-H2S-S8 позволяет
реакционной смеси может способствовать распаду
понизить энерго- и временные затраты на
RS2H до тиолов и серы [29]. Этот факт согласуется
получение R2Sn (n = 2-4) по сравнению с прямой
с расчетом величины конверсии серы, которая во
анодной активацией H2S в присутствии S8.
всех проведенных реакциях меняется незначи-
Для соединений C6H12, (CH3)C6H11 общий выход
тельно (25.8-32.3%). При увеличении продолжи-
продуктов реакции увеличивается при возрастании
тельности электросинтеза содержание S8 в
продолжительности электролиза до
2.5
ч.
реакционной смеси также возрастает за счет
Проведение электросинтеза в течение 3 ч приводит
превращения сероводорода в неорганические
к снижению выхода R2Sn (n = 2-4) до 24.6 и 37.7%
полисульфаны, способные к деструкции с
для циклогексана и его гомолога соответственно. В
образованием серы.
результате электросинтеза отмечено уменьшение
концентрации тетрасульфидов до 14.9 и 20.0%. Это
Полученные данные свидетельствуют о более
может быть обусловлено взаимодействием R2Sn
высоком суммарном выходе ди-, три- и
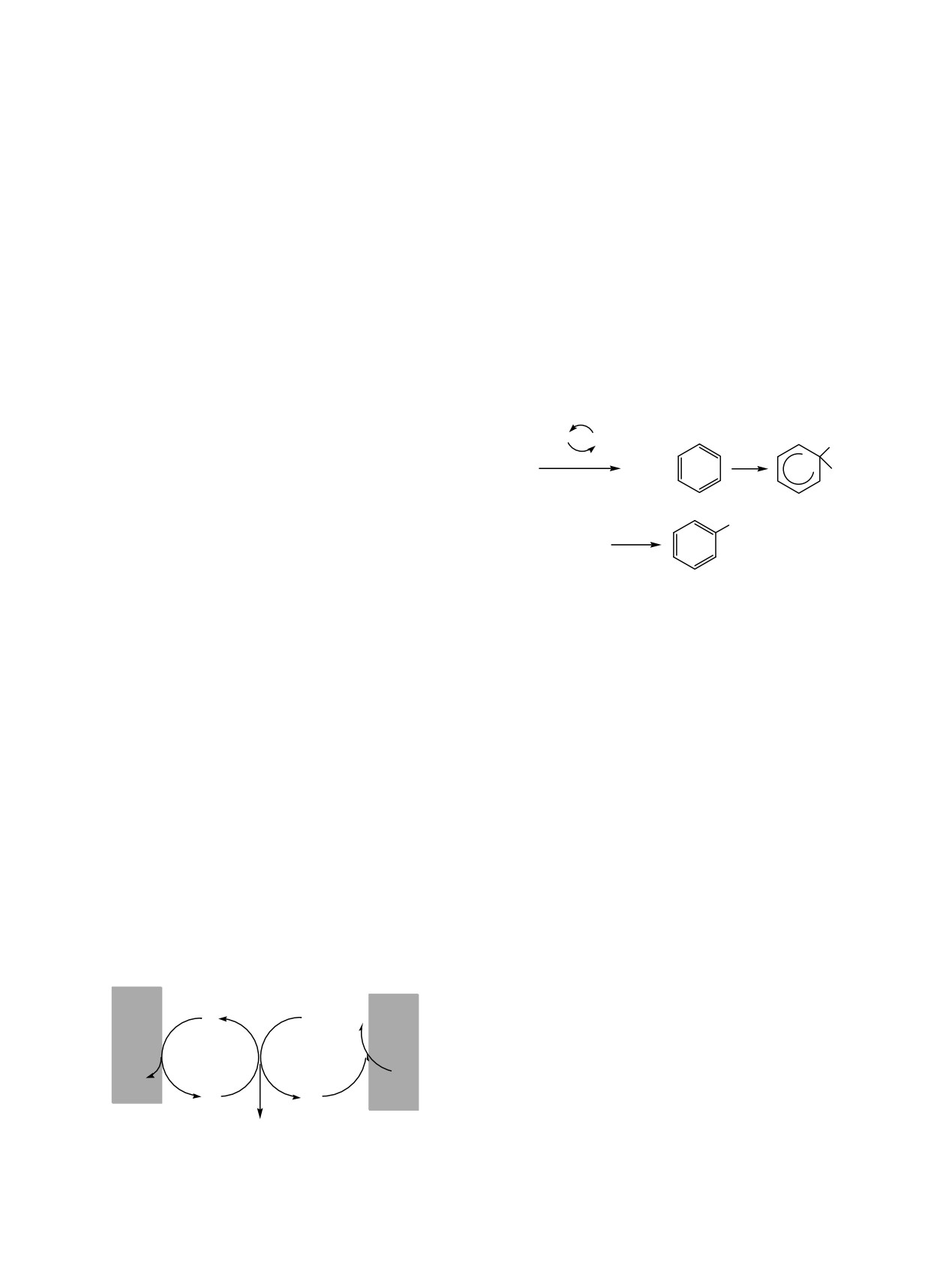
Схема 4.
Анод
Br-
RSH
e-
Br
RSH
RSRS R2S2
-H+
S8
H2S
RS9
RS9H
HS
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
РЕДОКС-АКТИВАЦИЯ СЕРОВОДОРОДА, ТИОЛОВ И СЕРЫ
555
тетрасульфидов в реакции с участием метил-
15-20% по сравнению с превращениями
циклогексана. Отличие в поведении данного
циклоалканов в аналогичных условиях (95-98%).
субстрата объясняется участием тиильных
Активация сероводорода, как в условиях
радикалов в реакции дегидрирования по третич-
радикального инициирования (схема 2), так и при
ному атому углерода в цикле. Повышение выхода
взаимодействии с электрофилом, приводит к
полисульфидов R2Sn (n = 2-4) происходит за счет
образованию дисульфана (схема 5).
значительного возрастания содержания тетра-
сульфидов (табл.
1). При проведении электро-
В условиях двухэлектронного окисления бромид-
медиаторного синтеза (1.5 ч) в отсутствие серы в
аниона при взаимодействии с H2S, предпо-
растворе соотношение продуктов реакции
ложительно, генеририруется сероцентрированный
отличается, R2S2:R2S3:R2S4
=
1.0:1.3:0.6. Состав
катион (HS2+), который реагирует с бензолом до
реакционной смеси изменяется в пользу
промежуточного продукта
- гидрофенилдисуль-
тетрасульфидов, следовательно, предварительное
фана (схема 6).
введение серы способствует увеличению их
Схема 6.
концентрации. В реакции циклогексана с системой
-2e
Med-H2S-S8 выход R2S3 по сравнению с
метилпроизводным незначителен. Более заметное
Br+
Br-
H
накопление дисульфидов по сравнению с
+2e
+
H2S2
HS2
+
+ SSH
трисульфидами объясняется достаточно высокой
-H+
скоростью димеризации циклоалкилтиильных ради-
калов. Экспериментальные данные согласуются с
SSH
ранее полученными результатами по прямой
-H+
анодной активации системы H2S-S8 в реакциях с
циклоалканами C5-C7 [25].
Представленный механизм электротиоли-
Наряду с циклогексаном и его метилпроиз-
рования бензола согласуется с изученными ранее
водным были изучены превращения бензола с
превращениями ароматических и гетероцикли-
участием системы Med-H2S-S8 при потенциале
ческих соединений с тиоцианат-анионом в электро-
электролиза, равном значению первого анодного
химических условиях [30, 31]. Электроокисление
пика Вu4NBr (0.9 В). В этих условиях электролиза
аниона способствует генерированию реакционно-
бензол не реагирует с активированным сероводо-
способного интермедиата - тиоцианогена (SCN)2,
родом, так как для реакции радикального
атакующего (гетеро)ароматическое ядро с
замещения не характерны. В связи с этим,
образованием продуктов тиоцианирования [32].
электролиз проводили при потенциале второго
пика окисления медиатора (1.2 В), что позволило
В ходе электролиза бензола с системой Med-
H2S-S8 в течение 1.5 ч получена смесь продуктов
снизить на 0.5 В анодное перенапряжение процесса
окисления сероводорода. В результате исполь-
реакции R2Sn (n = 2-4): R2S2 - 8.9%, R2S3 - 17.3 %,
зования данного подхода генерируется электрофил
R2S4 - 31.2%. Увеличение времени реакции до 2.5 ч
приводит к повышению суммарного содержания
(Br+), который выступает атакующей частицей по
отношению к сероводороду и бензолу. Это ведет к
продуктов тиолирования до 66.1% (11.3% R2S2,
уменьшению степени регенерации медиатора на
18.8% R2S3, 36.0% R2S4), при этом основной вклад
в прирост выхода происходит за счет накопления
тетрасульфидов. Этот факт объясняется тем, что
нестабильный гидрофенилдисульфан окисляется
Схема 5.
до R2S4 или взаимодействует с серой с образо-
Анод
ванием высокомолекулярных полисульфидов. Как
Катод
Br-
H2
2H2S
и в случае циклоалканов, увеличение продолжи-
тельности электролиза до
3 ч не приводит к
повышению общего выхода продуктов реакции
-
2e
−
(52.8%).
2e
+
Br
+
2H
Для электросинтеза, направленного на полу-
H2S2
чение полисульфидов R2Sn (n
=
2-4) без
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
556
ШИНКАРЬ и др.
Таблица 2. Выход продуктов реакций при анодной
Таблица 3. Состав и выход продуктов реакции при
активации RSH в присутствии S8 [RSH: S8 = 2:1, c(RSH) =
катодной активации S8 в присутствии RSH [RSH:S8 =
20 ммоль, E = 1.85 В, CH2Cl2, 1.5 ч, Pt-анод]
2:1, c(S8) = 1.5 ммоль, E = -1.30 В, CH2Cl2, 1.5 ч, Pt-анод]
Выход продуктов
Выход по току, %
реакции, %
Соединение
δ, % а
Соединение
δ, % а
R2S2
R2S3
R2S4
R2S2
R2S4
cyclo-C5H9SH
16.0
25.4
20.1
cyclo-C5H9SH
30.0
29.0
-
42.0
cyclo-C6H11SH
12.3
30.0
33.5
cyclo-C6H11SH
43.0
39.0
-
41.7
C6H5SH
27.8
10.1
7.0
C6H5SH
34.6
-
49.0
51.7
а δ - степень превращения серы.
а δ - степень превращения серы.
применения медиатора, были рассмотрены два
образование трисульфидов. Это объясняется
альтернативных подхода: анодная активация
отсутствием в реакционной смеси сероцентри-
тиолов в реакциях с серой и катодная активация
рованных интермедиатов (HS-радикал, HS2-
серы в присутствии тиолов. В первом случае в
катион), генерируемых из сероводорода. Таким
условиях электролиза
(1.85
В) окислению
образом, при использовании анодной активации
подвергаются тиолы (циклопентантиол - 1.68 В,
тиолов в присутствии серы не образуются
циклогексантиол - 1.72 В, тиофенол - 1.75 В),
полупродукты
- гидроциклоалкил(фенил)дисуль-
поскольку сера обладает более высоким анодным
фаны,
диспропорционирование
которых
потенциалом
(2.20
В). Во втором случае
способствует получению трисульфидов (схема 8)
электрохимическое восстановление серы протекает
[28].
в энергетически более выгодных условиях (-1.10, -
Схема 8.
1.40 В), чем катодная активация тиолов (> -1.80 B).
2RSSH → R2S3 + H2S
Анодная активация RSH, как и в присутствии
медиатора (схема
4), приводит к образованию
Для получения R2Sn (n = 2-4) предложена также
алкилтиильных радикалов, реагирующих с серой.
катодная активация S8 в реакции с тиолами.
Гидрополисульфиды с высокой молекулярной
Известно, что при электрохимическом восстанов-
массой (RS9H) могут диспропорционировать до
лении серы образуется ряд реакционноспособных
более устойчивых сульфидов R2S2 и R2S4 (схема 7).
интермедиатов (схема 9) [19, 34, 35].
Схема 7.
Схема 9.
+2e
4RS9H → R2S2 + R2S4 + 3H2S + 7/8S8
2-
S8
S
8
Результаты электросинтеза полисульфидов с
2-
4S82-
4S6
+ S8
применением анодной активации тиолов в
присутствии серы представлены в табл. 2.
-
S62-
2S3
Особенностью данной реакции является
преобладание выхода тетрасульфидов (25.0, 30.5%)
Катодная активация серы в присутствии тиолов
по сравнению с дисульфидами (16.5, 12.6%) для
позволяет получить смесь полисульфидов
циклопентан- и циклогексантиола, соответственно.
различного состава (табл.
3).
Для цикло-
В то же время для тиофенола доминирует
алкантиолов отмечается образование только ди- и
трисульфидов, тогда как в реакции с тиофенолом
направление реакции - димеризация фенилтиильных
радикалов. Подобная картина ранее наблюдалась
трисульфиды не фиксируются. Подобная
на примере реакции электрогенерируемого
закономерность наблюдается в случае прямой
анодной активации тиофенола в присутствии серы.
дикатиона серы с тиофенолом
[33]. Значение
конверсии серы согласуется с незначительным
Высокая концентрация образующихся дисуль-
выходом тетрасульфидов, что связано с низкой
фидов обусловлена взаимодействием тиолов с
реакционной способностью фенилтиильного
нуклеофильными частицами серы, что приводит к
радикала по отношению к сере. Стоит отметить,
окислению RS-анионов в ячейке с неразделенным
что в реакциях изученных тиолов не наблюдается
катодно-анодным пространством (схема 10).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
РЕДОКС-АКТИВАЦИЯ СЕРОВОДОРОДА, ТИОЛОВ И СЕРЫ
557
Схема 10.
анодного инициирования реакции тиолов с серой
S2- + RSH → RS– + RS-
преимущественно образуются ди- и тетрасульфиды
в отсутствии трисульфидов. Катодная активация
−e
серы в присутствии циклоалкантиолов благоприят-
RS-
R2S
2
2RS
ствует образованию ди- и трисульфидов, а в
реакции с тиофенолом получены ди- и
Для получения R2S3 необходимо формирование
тетрасульфиды. Таким образом, определяющими
в растворе HS3-радикалов, рекомбинация которых
факторами в электросинтезе полисульфидов
с RS-радикалами ведет к RS4H, диспропор-
заданного строения является способ активации
ционирующих на трисульфид, сероводород и серу
используемого реагента (сероводорода или тиола)
(схема 11).
в присутствии серы и продолжительность
Схема 11.
взаимодействия.
Основными достоинствами
электросинтеза R2Sn (n = 2-4) являются мягкие
S·- + RSH → HS· + RS-
условия
процесса
и его экологическая
HS· + RS· → RS4H
безопасность.
2RS4H → R2S3 + H2S + 1/2S8
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетрасульфиды с достаточно высоким выходом
фиксируются только в реакции с участием
В работе использовали коммерчески доступные
тиофенола, что согласуется с большей степенью
реактивы: циклогексан, метилциклогексан, бензол,
превращения серы. Следовательно, фенилти-
циклопентантиол, циклогексантиол, тиофенол
ильный радикал достаточно активен по отношению
(98%, Aldrich), бромид тетрабутиламмония (98%,
к различным полисульфидным частицам, образу-
Aldrich), гексан (95%, Alfa Aesar), серу
(99.5%
ющимся при активации серы. К преимуществу
Sigma-Aldrich) без дополнительной очистки.
указанного типа инициирования реакции следует
Сероводород получали по методике [36]. Очистку
отнести возможность направленного электро-
хлористого метилена (ХЧ) осуществляли по
синтеза ди- и трисульфидов и более высокую
известной методике [37].
степень превращения серы по сравнению с
анодной активацией циклоалкантиолов. Особен-
Метод циклической вольтамперометрии (ЦВА)
ностью данного подхода является отсутствие
использовали для анализа смеси продуктов
тетрасульфидов в продуктах реакции, поскольку в
электролиза и определения редокс-потенциалов
условиях катодной активации серы не затра-
соединений. Электрохимические эксперименты
гивается область электроокисления R2Sn (n = 2, 3).
проводили в трехэлектродной ячейке с помощью
потенциостата IPC-pro в среде аргона. Рабочий
Таким образом, в работе предложены новые
электрод - стационарный платиновый (Pt) электрод
эффективные подходы к электросинтезу ди-, три- и
диаметром
3 мм; вспомогательный электрод
-
тетрасульфидов с использованием различных спо-
платиновая пластина (S
=
36 мм2); электрод
собов активации серосодержащих реагентов в
сравнения - (Ag/AgCl/KCl) с водонепроницаемой
дихлорметане при комнатной температуре. Приме-
диафрагмой. Скорость развертки потенциала
нение редокс-системы Med-H2S-S8 в реакциях с
0.2 В·с-1. Фоновый электролит - 0.15 М. Bu4NClO4
циклоалканами С6, С7 и бензолом при варьиро-
(99%, Acros) дважды перекристаллизованный из
вании потенциала электролиза и времени взаимо-
водного EtOH и высушенный в вакууме (48 ч) при
действия позволило получить R2Sn (n = 2-4) с
50°С.
достаточно высоким выходом. В зависимости от
природы субстрата использование медиатора
Микроэлектролиз системы Med-H2S-S8 (1.5 ч)
Вu4NBr способствует снижению анодного пере-
проводили в потенциостатическом режиме на
напряжения на 0.8 или 0.5 В. Активация H2S в
платиновых электродах (S
=
30 мм2) в без-
присутствии S8 ведет к генерированию тиильных и
диафрагменной трехэлектродной ячейке (2 мл) в
гидрополисульфидных радикалов, участвующих в
дихлорметане при 25°C в среде аргона. Концен-
реакции тиолирования. Данный подход целесо-
трация медиатора Вu4NBr и S8 составляла 5 ммоль.
образно применять для получения тетрасульфидов
Мольное соотношение сероводород:углеводород =
с высоким выходом при наличии ди- и
3:1, с(H2S) =
30 ммоль. Сероводород вводили в
трисульфидов в смеси продуктов. В условиях
реакционную среду через
0.5
ч в виде
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
558
ШИНКАРЬ и др.
насыщенного раствора в дихлорметане (20 мкл).
сцентного анализа. На циклических вольтамперо-
Концентрацию H2S определяли гравиметрическим
граммах окисления продуктов электролиза
методом по реакции с Pb(CH3COO)2. Значение
фиксировали три анодных пика: R2S2 (1.50-1.60 В),
потенциала электролиза зависело от природы
R2S3 (1.73-1.85 В), R2S4 (1.90-2.05 В). В случае
субстрата: для циклоалканов поддерживали потен-
реакций тиолов с серой наблюдали также пики
циал 1.10 В (первый пик окисления медиатора), для
окисления исходных тиолов в диапазоне от 1.62 до
бензола - 1.40 В (второй анодный пик медиатора).
1.75 В. Выход ди-, трисульфидов оценивали по
данным хромато-масс-спектрометрии. В реакциях
Анодную активацию тиолов (5 ммоль) прово-
с использованием медиаторной системы расчет
дили в потенциостатическом режиме (1.5 ч) при
выхода продуктов электролиза проводили на
потенциале 1.85 В и соотношении RSH:S8 = 2:1.
прореагировавший сероводород, а в случае редокс-
Катодную активацию серы (1.5 ммоль) осущест-
активации системы RSH-S8 содержание R2S2 и R2S3 -
вляли при потенциале -1.30 В и соотношении
на прореагировавший тиол. Выход тетрасульфидов
RSH:S8 = 2:1 в течение 1.5 ч.
для всех исследуемых систем оценивали по
Препаративный электролиз
(10 мл) смеси
данным ЦВА путем определения соотношения
углеводорода и системы Med-H2S-S8 в дихлор-
токов анодных пиков ди- и тетрасульфидов с
метане проводили на платиновых электродах (S =
учетом молекулярных масс R2Sn (n
=
2,
4),
55 мм2) в течение 1.5 и 2.5 ч. Скорость подачи
окисляющихся в рассмотренных условиях в одну
сероводорода
составляла
2-3мл/мин,
что
двухэлектронную
стадию.
Неорганические
обеспечивало заданную концентрацию H2S в
полисульфаны (H2Sn) с различной молекулярной
электрохимической ячейке. Молярное соотно-
массой регистрировали электрохимическим методом
шение сероводород : углеводород составляло 3:1,
в диапазоне 0.4-1.5 В. Степень превращения серы
с(H2S) = 30 ммоль, с(S) = c(Med) = 5 ммоль. В про-
контролировали методом ЦВА по снижению
цессе электролиза плотность тока поддерживали в
величины тока катодного пика (-1.15 В).
диапазоне 5-10 мА/см2. Реакционную смесь после
электролиза дегазировали током аргона в течение
ИК спектры продуктов электролиза регистри-
30 мин, далее концентрировали в вакууме.
ровали на ИК Фурье-спектрометре ФСМ-1201 в
Фоновый электролит и медиатор осаждали
таблетках KBr в диапазоне от 400 до 4000 см-1. В
гексаном. Смесь органических полисульфидов
ИК спектрах фиксировали валентные колебания
выделяли трехступенчатой экстракцией гексаном,
связей: S-S (507-520 см-1), C-S (690-710 см-1) и S-H
далее экстракт концентрировали в вакууме.
(2550-2600 см-1). Анализ смеси продуктов реакции
проводили методом газовой хромато-масс-
Препаративный электролиз (15 мл) с участием
спектрометрии на приборе GCMS-QP2010 Ultra
серы и тиолов проводили в потенциостатическом
(Shimadzu) с масс-спектрометрическим детектором
режиме
(1.5 ч) при потенциале
1.85 В, в
(EI, 70 эВ). Капиллярная колонка SPB-1 SULFUR
дихлорметане на платиновых электродах (S
=
(30 м × 0.32 мм), tmax = 320°С, газ-носитель - гелий.
50 мм2). Навеску серы (10 ммоль) предварительно
Температурный режим колонки программировали
растворяли в дихлорметане. Раствор серы с тиолом
от 30 до 280°С. В масс-спектрах фиксировали
при соотношении 1:2 деаэрировали 5-7 мин. В
молекулярные ионы m/z (I, %): С5Н9SH, 102 (40)
случае катодной активации серы в присутствии
[M]+, 75 (15), 69 (100), 53 (20), 41 (60); С6Н11SH,
тиола препаративный электролиз проводили при
116 (25) [M]+, 83 (23), 67 (40), 55 (100), 45 (20);
потенциале
-1.30 В. Плотность тока в ходе
С6Н5SH, 110 (100) [M]+, 84 (14), 77 (12), 66 (31), 51 (10);
электролиза поддерживали в диапазоне 5-10 мА/см2.
(С5Н9)2S2, 202 (11) [M]+, 134 (21), 69 (100); (С5Н9)2S3,
Реакционную смесь после электролиза концентри-
234 (12) [M]+, 101 (25), 67 (55); (С6Н11)2S2, 230 (14)
ровали в вакууме. Фоновый электролит осаждали
[M]+, 147 (16), 83 (100), 55 (27); (С6Н11)2S3, 262 (16)
гексаном. Смесь органических полисульфидов и
[M]+, 230 (3), 179 (8), 115 (32), 83 (100), 55 (25);
тиолов выделяли трехступенчатой экстракцией
(С6Н5)2S2, 218 (100) [M]+, 185 (70), 154 (65), 109
гексаном, далее экстракт концентрировали в вакууме.
(80), 77 (55), 66 (70); (С6Н5)2S3, 250 (8) [M]+, 218
Для идентификации полученных органических
(100), 185 (25), 154 (35), 140 (10), 109 (80), 66 (35);
соединений серы использовали методы цикли-
(С7Н13)2S2, 260 (13)
[M]+, 163 (17), 130 (10),
97
ческой вольтамперометрии, ИК спектроскопии,
(100); (С7Н13)2S3, 291 (14) [M]+, 260 (4), 163 (28),
хромато-масс-спектрометрии и рентгенофлуоре-
130 (44), 97 (100).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
РЕДОКС-АКТИВАЦИЯ СЕРОВОДОРОДА, ТИОЛОВ И СЕРЫ
559
Органические тетрасульфиды в условиях
P. 3046. doi 10.1021/jm070165j
контроля методом хромато-масс-спектрометрии
9. Ley S.V., Thomas A.W. // Angew. Chem. Int. Ed. 2003.
подвергаются деструкции. В связи с этим, смесь
Vol. 42. N 44. P. 5400. doi 10.1002/anie.200300594
R2Sn (n = 2-4) анализировали рентгенофлуоре-
10. Beletskaya I.P., Ananikov V.P. // Chem. Rev. 2011.
сцентным методом на спектрометре АСЭ-1 для
Vol. 111. N 3. P. 1596. doi 10.1021/cr100347k
определения содержания общей серы. Полученные
11. Zou L.H., Reball J., Mottweiler J., Bolm C. // Chem.
данные позволили рассчитать процентное
Commun.
2012. Vol.
48. P.
11307. doi
10.1002/
содержание R2S4, учитывая результаты хромато-
adsc.201300566
масс-спектрометрии по выходу ди- и три-
12. Tang R.Y., Xie Y.X., Xie Y.L., Xiang J.N., Li J.H. //
Chem. Commun. 2011. Vol. 47. P. 12867. doi 10.1039/
сульфидов. Установленные значения выхода
C1CC15397H
тетрасульфидов согласуются с результатами
13. Zhao J., Fang H., Han J., Pan Y., Li G. // Adv. Synth.
электрохимических исследований.
Catal. 2014. Vol. 356. N 11-12. P. 2719. doi 10.1002/
Квантово-химические расчеты проводили с
adsc.201400032
использованием программы Hyper Chem
8.0
14. Zhang J.-R., Liao Y.-Y., Deng J.-C., Feng K.-Y., Zhang M.,
методом функционала плотности B3LYP/6-31++G
Ning Y.-Y., Lina Z.-W., Tang R.-Y. // Chem. Commun.
(d,p). Влияние растворителя (CH2Cl2) учитывали с
2017. Vol. 53. P. 7784. doi 10.1039/C7CC03940A
помощью модели поляризуемого континуума
15. Gundermann K.-D., Humke K. In: Methoden der
(PCM). Энергетические эффекты реакций (ΔH)
Organischen Chemie
/ Ed. D. Klamann. Stuttgart:
рассчитывали как разность полных энергий
Thieme, 1985. N 11. P. 148.
конечных и исходных структур.
16. Groom M., Block E. Pat. US 8101802 (2012).
17. Дерягина Э.Н., Паперная Л.К., Воронков М.Г.//
ФОНДОВАЯ ПОДДЕРЖКА
ЖОрХ. 1995. Т. 31. Вып. 4. С. 627; Deryagina E.N.,
Papernaya L.K., Voronkov M.G. // Russ. J. Org. Chem.
Работа выполнена при финансовой поддержке
1995. Vol. 31. P. 580.
Российского научного фонда (грант
№ 17-13-
18. Дерягина Э.Н., Паперная Л.К. // ЖОргХ. 1997. Т. 33.
Вып. 8. С. 1189; Deryagina E.N., Papernaya L.K. //
01168).
Russ. J. Org. Chem. 1997. Vol. 33. P. 1113.
КОНФЛИКТ ИНТЕРЕСОВ
19. Le Guillanton G. // Sulfur Rep. 1992. Vol. 12. P. 405.
doi 10.1080/01961779208048949
Авторы заявляют об отсутствии конфликта
20. Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В.,
Абдулаева В.Ф. // ЖОХ. 2015. Т. 85. Вып. 4. С. 697;
интересов.
Berberova N.T., Shinkar’ E.V., Smolyaninov I.V.,
Abdulaeva V.F. // Russ. J. Gen. Chem. 2015. Vol. 85.
СПИСОК ЛИТЕРАТУРЫ
P. 998. doi 10.1134/S1070363215040416.
21. Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В.,
1. Steudel R. // Chem. Rev. 2002. Vol. 102. N 11. P. 3905.
Швецова А.В., Седики А.Б., Кузьмин В.В. Пат. РФ №
doi 10.1021/cr010127m
2614151 (2017) // Б. И. 2017. № 9.
2. Lee B.C., Park B.H., Kim S.Y., Lee Y.J. // J. Cell.
22. Шинкарь Е.В., Швецова А.В., Седики А.Б., Бербе-
Biochem. 2011. Vol. 112. P. 118. doi 10.1002/jcb.22896
рова Н.Т. // Электрохимия. 2015. Т.
51.
№ 11.
3. Bisen P.S., Emerald M. // Curr. Nutr. Food. Sci. 2016.
С. 1182; Shinkar’ E.V., Shvetsova A.V., Sediki D.B.,
Vol. 12. P. 190. doi 10.2174/1573401312666160608121
Berberova N.T. // Russ. J. Electrochem. 2015. Vol. 51.
4. Münchberg U., Anwar A., Mecklenburg S., Jacob C. //
P. 1046. doi 10.1134/S1023193515110178
Org. Biol. Chem. 2007. P. 1505. doi 10.1039/B703832A
23. Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В.,
5. Pluth M.D., Bailey T.S., Hammers M.D., Hartle M.D.,
Пащенко К.П. // Докл. АН. 2015. Т.
465.
№ 6.
Henthorn H.A., Steiger A.K. // Synlett. 2015. Vol. 26.
С. 683; Berberova N.T., Shinkar’ E.V., Smolyaninov I.V.,
N 19. P. 2633. doi 10.1055/s-0035-1560638
Pashenko K.P. // Doklady Chem. 2015. Vol.
465.
6. Hartle M.D., Pluth M.D. // Chem. Soc. Rev.
2016.
P. 295. doi 10.1134/S0012500815120058
Vol. 45. P. 6108. doi 10.1039/c6cs00212a
24. Francke, R., Little R.D. // Chem. Soc. Rev. 2014. Vol. 43.
7. Li L., Rose P., Moore P.K. // Annu. Rev. Pharmacol.
P. 2492. doi 10.1039/C3CS60464K
Toxicol. 2011. Vol. 51. P. 169. doi 10.1146/annurev-
25. Берберова Н.Т., Смолянинов И.В., Шинкарь Е.В.,
pharmtox-010510-100505
Кузьмин В.В., Швецова А.В., Седики А.Б. // Изв. АН.
8. Gangjee A., Zeng Y., Talreja T., McGuire J.J., Kisliuk R.L.,
Сер. хим. 2018. Т. 67. № 1. С. 108; Berberova N.Т.,
Queener S.F. // J. Med. Chem. 2007. Vol. 50. N 13.
Smolyaninov I.V., Shinkar E.V., Кuzmin V.V., Sediki D.B.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
560
ШИНКАРЬ и др.
Shvetsova A.V. // Russ. Chem. Bull. 2018. Vol. 67.
P. 413. doi 10.1016/j.mencom.2016.09.016
P. 108. doi 10.1007/s11172-018-2044-4
32. Gitkis A., Becker J.Y. // Electrochim. Acta. 2010. Vol. 55.
26. Берберова Н.Т., Шинкарь Е.В. // Изв. АН. Сер. хим.
P. 5854. doi10.1016/j. electacta.2010.05.035
2000. Т.
49.
№ 7. С. 1182; Berberova N.Т., Shin-
33. Le Guillanton G., Do Q.T., Elothmani D. // J. Electro-
kar’ E.V. // Russ. Chem. Bull. 2000. Vol. 49. P. 1178.
chem. Soc. 1996. Vol. 143. P. L223. doi 10.1149/
doi 10.1007/BF02495758
1.1837151
27. Robert J., Anouti M., Abarbri M., Paris J. // J. Chem.
34. Kunugi A., Kuwamura K., Inoue M., Kawamura Y., Abe K. //
Soc. Perkin Trans. 1997. N 9. P. 1759. doi 10.1039/
Electrochim. Acta.
1996. Vol.
41. P.
1987. doi
A700939I
10.1016/0013-4686(96)00002-3
28. Bianco C.L., Chavez T.A., Sosa V., Saund S.S., Nhu N.Q.
35. Izumi I., Yasuzawa M., Kunugi A. // Electrochemistry.
Nguyen, Tantillo D.J., Ichimura A.S., Toscano J.P.,
2006. Vol. 74. P. 691. doi 10.5796/electrochemistry.74.691
Fukuto J.M. // Free Rad. Biol. Med. 2016. Vol. 101.
P. 20. doi 10.1016/j.freeradbiomed.2016.09.020
36. Летичевская Н.Н., Шинкарь Е.В., Береберова Н.Т.,
29. Bailey T.S., Zakharov L.N., Pluth M.D. // J. Am. Chem.
Охлобыстин О.Ю. // ЖОХ. 1996. Т. 66. Вып. 11.
Soc. 2014. Vol. 136. P. 10573. doi 10.1021/ja505371z
С. 1785; Letichevskaya N.N., Shinkar’ E.V., Berberova N.T.,
Okhlobystin O.Yu. // Russ. J. Gen. Chem. 1996. Vol. 66.
30. Gitkis A., Becker J.Y. // J. Electroanal. Chem. 2006.
P. 1739.
Vol. 593. P.29. doi 10.1016/j.jelechem.2005.12.011
31. Kokorekin V.A., Yaubasarova R.R., Neverov S.V.,
37. Gordon A.J., Ford R.A. The chemist’s companion. New
Petrosyan V.A. // Mendeleev Commun. 2016. Vol. 26.
York: Wiley Intersci. Publ., 1972. P. 541.
Redox Activation of Hydrogen Sulfide, Thiols and Sulfur
in Electrosynthesis of Organic Di- and Polysulfides
Е. V. Shinkar’*, I. V. Smolyaninov, V. V. Kuzmin, and N. Т. Berberova
Astrakhan State Technical University, ul. Tatishcheva 16, Astrakhan, 414056 Russia
*e-mail: nberberova@gmail.com
Received November 15, 2018; revised November 15, 2018; accepted November 22, 2018
A new and effective method for the synthesis of biologically active organic di-, tri- and tetrasulfides is proposed.
Different methods of redox activation of sulfur, hydrogen sulfide, thiols in the reactions with organic compounds
are considered. Electrochemical initiation of the reactions of the system mediator-H2S-S8 with cyclohexane,
methylcyclohexane and benzene results in the formation of polysulfides R2Sn (n = 2-4). The application of
tetrabutylammonium bromide as a mediator of oxidation of H2S allowed to decrease the anodic overpotential of
electrosynthesis. Under the conditions of anodic activation of the reaction of cycloalkanethiols (С5, C6) or
thiophenol with sulfur, di- and tetrasulfides were obtained. Electroreduction of S8 in the presence of the same
thiols favored the formation of di- and trisulfides. The yield and the ratio of R2Sn (n = 2-4) depend on the
method of redox activation of the thiolating reagent.
Keywords: electrosynthesis, organic polysulfides, hydrogen sulfide, cycloalkanethiols, elemental sulfur, redox
activation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019