ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 561-565
УДК 547.857.4;547.859.1;547.859.3
ВЗАИМОДЕЙСТВИЕ 1-АЛЛИЛ(МЕТАЛЛИЛ)ТЕОБРОМИНА
С ГАЛОГЕНАМИ
© 2019 г. К. Ю. Петроваa, *, Д. Г. Кимa, О. С. Ельцовb, Т. Д. Еременкоa
a Южно-Уральский государственный университет (НИУ), пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: osheko_kseniya@mail.ru
b Уральский федеральный университет имени первого Президента России Б. Н. Ельцина, Екатеринбург, Россия
Поступило в Редакцию 6 сентября 2018 г.
После доработки 16 сентября 2018 г.
Принято к печати 17 сентября 2018 г.
Изучены реакции брома и иода с 1-аллилтеобромином и 1-металлилтеобромином. Показано, что в
зависисмости от природы галогена и исходного теобромина реакция может приводить к продуктам
присоединения по двойной связи, оксазолопуринам или комплексным соединениям.
Ключевые слова: теобромин, 1-металлилтеобромин, оксазолопурин, алилтеобромин
DOI: 10.1134/S0044460X190400097
Известно, что производные теобромина обладают
Металлилтеобромин
1б получен впервые
антигипоксической активностью [1]. В то же время
алкилированием теобромина металлилхлоридом в
в литературе отсутствуют данные об оксазоло-
ДМФА в присутствии безводного карбоната калия
пуриниевых системах, которые могут обладать
(схема 2).
высокой биологической активностью.
Взаимодействие аллилтеоброминов
1a, б с
В настоящей работе с целью получения новых
бромом может протекать по различным
конденсированных оксазолопуриниевых систем
направлениям: галогенирование с последующей
нами изучено взаимодействие 1-аллилтеобромина
циклизацией в
[1,3]оксазоло[2,3-i]пуриниевые
1a и 1-металлилтеобромина 1б с бромом и иодом.
системы или присоединение брома к двойной
связи.
Установлено,
что
взаимодействие
Ранее синтез соединения 1a был осуществлен
теобромина 1a с бромом в хлороформе приводит к
алкилированием теобромина аллилбромидом в
образованию
1-(2,3-дибромпропил)теобромина
2
ДМФА или изопропиловом спирте в присутствии
(схема 3). В спектре ЯМР 1Н соединения 2 имеются
основания (i-BuONa, NaOH или K2CO3)
[2-6].
сигналы протонов CH2Br в виде двух дублетов
Нами теобромин
1а получен в ДМФА в
дублетов в области
3.95-4.05 м. д., сигналы
присутствии K2CO3. Данные спектра ЯМР
1Н
группы NCH2 регистрируются при 4.25 и 4.43 м. д.,
соединения 1a и температура плавления близко
протон группы CHBr проявляется при 4.68 м. д.,
совпадают с литературными данными [2].
что близко совпадает с сигналами аналогичных
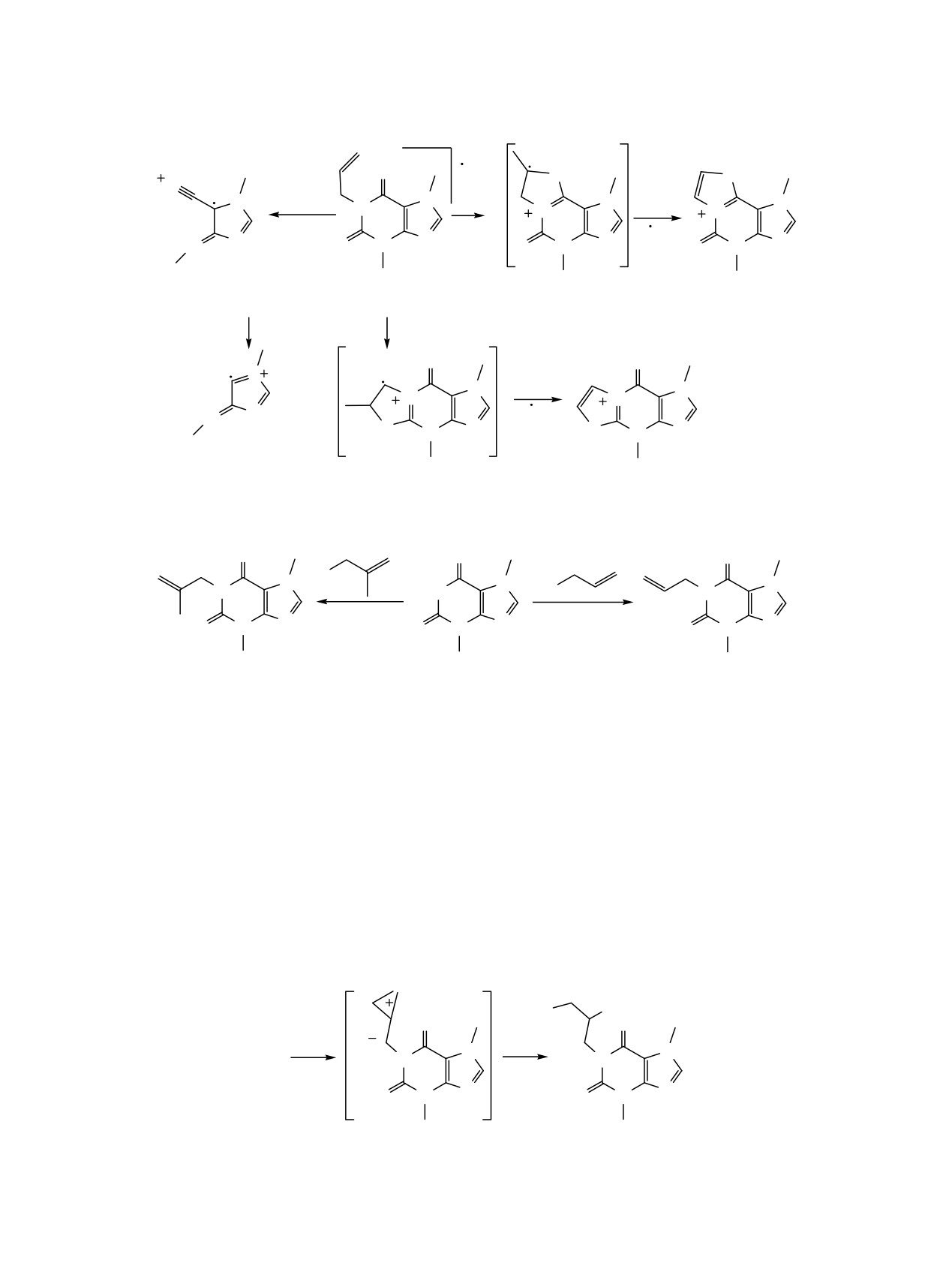
В масс-спектре аллилтеобромина
1a присут-
протонов в N-(2,3-дибромпропил)изатине [7].
ствует пик молекулярного иона [M]+• с интенсив-
ностью
82%, а максимальной интенсивностью
Сложнее протекает взаимодействие металлил-
обладает пик с m/z 205, обусловленный отрывом
теобромина 1б с бромом в уксусной кислоте и
метильного радикала (схема 1). На наш взгляд,
дихлорметане. Из реакционного раствора выпадает
высокая интенсивность сигнала свидетельствует об
смесь двух изомеров: бромидов 6-(бромметил)-
образовании устойчивых трициклических систем А
1,4,6-триметил-9-оксо-3a,4,6,7,9,9a-гексагидро-1H-
или Б. Для фрагментации аллилтеобромина 1a
оксазоло[3,2-a]пуриния
3 и
8-(бромметил)-1,4,8-
характерен отрыв аллилизоцианата и дальнейшее
триметил-5-оксо-3a,4,5,7,8,9b-гексагидро-1H-окса-
элиминирование СО (пики с m/z
137 и
109
золо[2,3-i]пуриния
4 в соотношении
1:0.63 в
соответственно).
уксусной кислоте и 1:0.95 в хлороформе (схема 4).
561
562
ПЕТРОВА и др.
Схема 1.
+
O
O
O
O
N
N
N
N
N
N
N
-AllNCO
-CH3
N
N
O
N N
O
N N
O
N N
1a
A
m/z 137
m/z 220
m/z 205
-CO
O
O
N
N
N
N
N
-CH3
N N
O
O
N N
N N
m/z 109
Б
m/z 205
Схема 2.
O
O
O
Cl
N
N Br
N
N
HN
N
O
N N
O
N N
O
N N
1б
1a
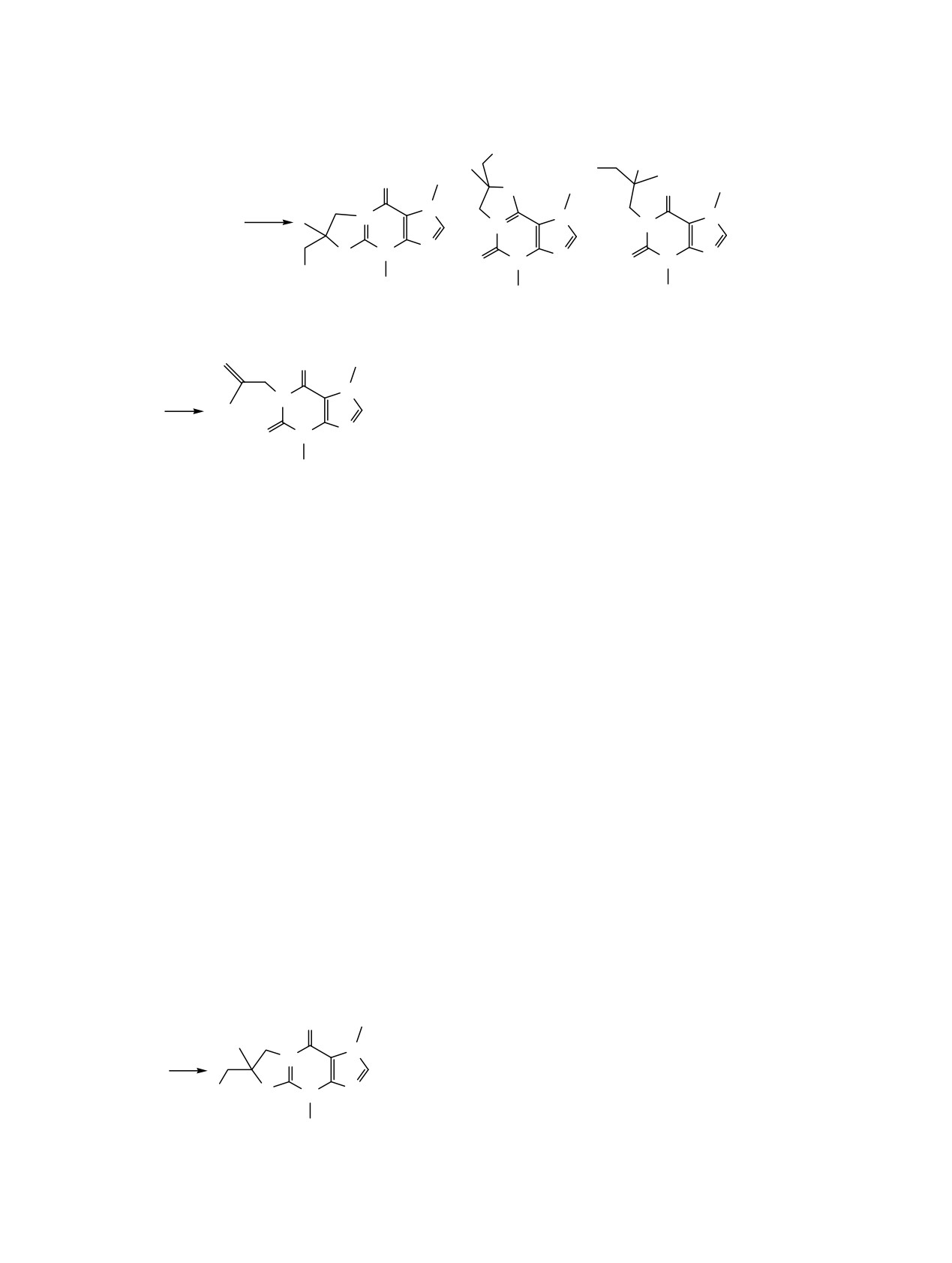
Спектры ЯМР 1Н бромидов 3 и 4 очень близки, а
и в случае аддукта 2, в спектре ЯМР 1Н соединения
сигнал протона Н8 смещен в слабое поле
5 протон Н8 проявляется в виде синглета в той же
относительно исходного соединения 1б (7.88→8.45-
области, что и в случае исходного соединения 1б.
8.80 м. д.), что обусловлено появлением поло-
При реакции теобромина 1a с иодом образуется
жительного заряда в системе. В случае линейной
комплекс иода с 1-аллилтеобромином 6 (схема 5),
структуры 3 сигнал протона имидазольного кольца
выделенный в виде темного порошкообразного
находится в более слабом поле, чем сигнал того же
вещества и не имеющий определенного состава. В
протона в случае системы 4.
Н комплекса 6 имеются сигналы
спектре ЯМР 1
В растворе уксусной кислоты после отделения
протонов аллильной группы.
бромидов
3 и
4 нами обнаружен продукт
присоединения брома по двойной связи - 1-(2,3-
Иначе протекает взаимодействие металлилтео-
дибром-2-метилпропил)теобромин 5 (схема 4). Как
бромина 1б с иодом: в результате реакции был
Схема 3.
Br
Br
Br
O
O
Br2
Br
N
N
1a
N
N
O
N N
O
N N
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ВЗАИМОДЕЙСТВИЕ 1-АЛЛИЛ(МЕТАЛЛИЛ)ТЕОБРОМИНА
563
Схема 4.
Br
Br-
Br
Br
-
O
Br
O
O
Br2
+
N
N
+
N
N
1б
N
N
+
+
O
N N
O
N N
O
N N
Br
3
4
5
Схема 5.
ТМС, растворитель - ДМСО-d6. Масс-спектр снят
на газовом хромато-масс-спектрометре GCMS-
O
QP2010 Ultra, Shimadzu (ЭУ, 70 эВ).
N
I2
N
1a
* I2
1-Аллилтеобромин
(1a) синтезирован по
методике [5]. Выход 80%, белый порошок, т. пл.
O
N N
147-148°С (т. пл. 142-143°С [2], 143°С [6]). Масс-
6
спектр, m/z (Iотн, %): 220 (82.5) [M]+, 219 (20.0) [M -
H]+, 205 (100) [M - СH3]+, 203 (20.0) [M - OH]+, 191
выделен порошкообразный трииодид 6-(иодметил)-
(7.5), 175 (5.0), 165 (5.0), 150 (7.4), 138 (15.0), 137
1,4,6-триметил-9-оксо-3a,4,6,7,9,9a-гексагидро-1H-
(6.4)
[M - СH2=CHCH2NCO]•+, 136 (12.5) [M -
оксазоло[3,2-a]пуриния, который при взаимо-
СH2=CHCH2NCO
- H]+,
109
(37.5)
[M
-
действии с иодидом натрия в ацетоне переходил в
СH2=CHCH2NCO - CO]+, 82 (24.5), 70 (13.5), 67
иодид
6-(иодметил)-1,4,6-триметил-9-оксо-
(37.0), 56 (9.9), 55 (24.4), 42 (22.5), 40 (25).
3a,4,6,7,9,9a-гексагидро-1H-оксазоло[3,2-a]пуриния
1-Металлилтеобромин (1б). К раствору 360 мг
7 (схема
7).
В спектре ЯМР
1Н протон
имидазольного кольца проявляется при 8.75 м. д.,
(2 ммоль) теобромина в 10 мл ДМФА добавляли
276 мг (2 ммоль) безводного карбоната калия,
что свидетельствует об образовании линейной
раствор нагревали на водяной бане в течение
оксазолопуриниевой системы.
30 мин. К полученной смеси добавляли раствор
Таким образом, бром реагирует с
1-аллил-
0.19 мл (2 ммоль) металлилхлорида в 1 мл ДМФА.
теобромином с образованием продукта присое-
Полученную смесь нагревали на водяной бане в
динения по двойной связи, а с
1-металлил-
течение 5 ч. Осадок отфильтровывали, фильтрат
теобромином - смеси оксазолопуринов и 1-(2,3-
упаривали, полученный остаток промывали водой
дибром-2-метилпропил)теобромина.
Взаимо-
и сушили. Выход 384 мг (82%), серый порошок, т.
действие 1-аллилтеобромина с иодом приводит к
пл. 68-72°С. Спектр ЯМР 1Н, δ, м. д.: 1.76 с (3Н,
образованию комплекса, а металлилтеобромина - к
CH3), 3.39 с (3H, N3CH3) , 3.94 с (3H, N7CH3), 4.39 с
образованию линейного оксазолопурина.
(2Н, NСН2), 4.59 c (1H, СH2), 4.75 с (1Н, СH2), 7.88
с (1Н, Н8). Найдено, %: С 56.42; H 5.99;N 23.90.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
C11H14N4O2. Вычислено, %: С 56.40; H 6.02; N
23.92. M 234.25.
Спектры ЯМР
1Н
(400 МГц) записаны на
приборе Bruker AVANCE II, внутренний стандарт -
1-(2,3-Дибромпропил)теобромин (2). К раствору
0.052 мл (1 ммоль) брома в 5 мл хлороформа
добавляли 0.110 г (0.5 ммоль) 1-аллилтеобромина.
Схема 6.
Через 48 ч упаривали растворитель. Выход 0.137 г
O
(72%), масло. Спектр ЯМР 1Н, δ, м. д.: 3.41 с (3Н,
+
N
N3CH3), 3.89 с (3H, N7CH3), 3.95 м и 4.02 м (2Н,
I2
N
1б
I-
CH2Br), 4.44 м и 4.27 м (2Н, NCH2), 4.69 м (1Н,
I
O
CHBr), 8.07 с (1Н, Н8). Найдено, %: С 31.57; H 3.17;
N N
N 14.77. C10H12Br2N4O2. Вычислено, %: С 31.60; H
7
3.18; N 14.74. M 380.04.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
564
ПЕТРОВА и др.
Взаимодействие 1-металлилтеобромина с бромом
пуриния (7). К раствору 254 мг (1 ммоль) иода в
в уксусной кислоте. а. К раствору 0.052 мл
5 мл хлороформа (уксусной кислоты) добавляли
(1 ммоль) брома в
5 мл уксусной кислоты
0.5 ммоль
1-металлилтеобромина. Через
48 ч
добавляли
0.118 г
(0.5 ммоль)
1-металлил-
отфильтровывали образовавшийся темно-коричневый
теобромина. Через 48 ч отфильтровали образо-
осадок трииодида 6-(иодметил)-1,4,6-триметил-9-
вавшийся осадок. Фильтрат упаривали, в остатке -
оксо-3a,4,6,7,9,9a-гексагидро-1H-оксазоло[3,2-a]-
маслообразный
1-(2,3-дибром-2-метилпропил)тео-
пуриния, сушили, затем растворяли в ацетоне,
бромин. Осадок обрабатывали ацетоном и отфиль-
добавили NaI и отфильтровывали образовавшийся
тровывали 0.069 г (выход 35%) смеси бромидов
светло-желтый осадок. Выход 0.146 г (60%), т. пл.
6-(бромметил)-1,4,6-триметил-9-оксо-3a,4,6,7,9,9a-
97-98°С. Спектр ЯМР 1Н, δ, м. д.: 1.96 с (3Н,
гексагидро-1H-оксазоло[3,2-a]пуриния и 8-(бром-
N6CH3), 3.65 с (3Н, N4CH3), 3.95 с (3H, N1CH3), 3.40
метил)-1,4,8-триметил-5-оксо-3a,4,5,7,8,9b-гекса-
м и 3.76 м (2Н, NCH2), 4.42 м (2Н, CH2Br), 8.75 с
гидро-1H-оксазоло[2,3-i]пуриния в соотношении
(1Н, Н2).
1.57:1.
ФОНДОВАЯ ПОДДЕРЖКА
б. К раствору 0.052 мл (1 ммоль) брома в 5 мл
дихлорметана добавляли
0.118 г
(0.5 ммоль)
Работа выполнена при финансовой поддержке
1-металлилтеобромина. Через 48 ч отфильтровывали
Правительства РФ (Постановление
№ 211 от
образовавшийся осадок, сушили, затем обраба-
16.03.2013 г., соглашение № 02.A03.21.0011) и
тывали ацетоном и отфильтровывали
0.138 г
Министерства образования и науки РФ в рамках
(выход 70%) смеси бромидов 6-(бромметил)-1,4,6-
государственного задания (№ 4.9665.2017/8.9).
триметил-9-оксо-3a,4,6,7,9,9a-гексагидро-1H-окса-
золо[3,2-a]пуриния и 8-(бромметил)-1,4,8-триметил-
КОНФЛИКТ ИНТЕРЕСОВ
5-оксо-3a,4,5,7,8,9b-гексагидро-1H-оксазоло[2,3-i]
пуриния в соотношении 1:0.95.
Авторы заявляют об отсутствии конфликта
Бромид 6-(бромметил)-1,4,6-триметил-9-оксо-
интересов.
3a,4,6,7,9,9a-гексагидро-1H-оксазоло[3,2-a]-
СПИСОК ЛИТЕРАТУРЫ
пуриния (3). Спектр ЯМР 1Н), δ, м. д.: 1.91 с (3Н,
N6CH3), 3.62 с (3Н, N4CH3), 3.94 с (3H, N1CH3), 4.15
1. Zlatkov A., Peikov P., Rodriguez-Alvarez J., Danchev N.,
м и 4.22 м (2Н, CH2Br), 4.19 м (2Н, NCH2), 8.79 с
Nikolova I., Mitkov J. // Eur. J. Med. Chem.
2000.
(1Н, Н2).
Vol. 35. N 10. P. 941. doi 10.1016/s0223-5234(00)
Бромид 8-(бромметил)-1,4,8-триметил-5-оксо-
01172-7
3a,4,5,7,8,9b-гексагидро-1H-оксазоло[2,3-i]-
2. Hung-Kun L., Fen-Tair L. // J. Chin. Chem. Soc. 2012.
пуриния (4). Спектр ЯМР 1Н, δ, м. д.: 1.92 с (3Н,
Vol. 59. N 3. P. 394. doi 10.1002/jccs.201100565
N8CH3), 3.85 с (3Н, N4CH3), 4.02 с (3H, N1CH3), 4.38
3. Pat. 94/00674 (1993). USA.
м и 4.45 м (2Н, CH2Br), 4.41 м (2Н, NCH2), 8.47 с
4. Madyastha K.M., Sridhar G.R. // J. Chem. Soc. Perkin
(1Н, Н2).
Trans. 1. 1999. N 6. P. 677. doi 10.1039/a900089e
1-(2,3-Дибром-2-метилпропил)теобромин
(5).
5. Lysakowska M., Balzarini J., Piotrowska D.G. // Arch.
Pharm. 2014. Vol. 347. N 5. P. 341. doi 10.1002/
Выход 0.077 г (39%, метод а). Спектр ЯМР 1Н, δ,
ardp.201300382
м. д.: 1.21 с (3H, CH3), 3.48 с (3Н, N3CH3), 3,94 с
(3H, N7CH3), 3.46 с (2Н, CH2Br), 4.13-4.15 м (2Н,
6. Daly J.W., Padgett W.L., Shamim M.T. // J. Med. Chem.
1986. Vol. 29. N 7. P. 1305. doi 10.1021/jm00157a035
NCH2), 7.94 с (1Н, Н8). Найдено, %: С 33.51; H 3.59;
7. Украинец И.В., Березнякова Н.Л., Горохова О.В.,
N 14.19. C11H14Br2N4O2. Вычислено, %: С 33.53; H
Шишкина С.В. // ХГС. 2009. Т. 45. № 10. С. 1546;
3.58; N 14.22. M 394.06.
Ukrainets I.V., Bereznyakova N.L., Gorokhova O.V.,
Иодид
6-(иодметил)-1,4,6-триметил-9-оксо-
Shishkina S.V. // Chem. Heterocycl. Compd.
2009.
3a,4,6,7,9,9a-гексагидро-1H-оксазоло[3,2-a]-
Vol. 45. N 10. P. 1241. doi 10.1007/s10593-010-0413-5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ВЗАИМОДЕЙСТВИЕ 1-АЛЛИЛ(МЕТАЛЛИЛ)ТЕОБРОМИНА
565
Reaction of 1-Allyl(methallyl)theobromine with Halogens
K. Yu. Petrovaa, *, D. G. Kima, O. S. Eltsovb, and T. D. Eremenkoa
a South-Ural State University (NPU), pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: osheko_kseniya@mail.ru
b Ural Federal University, Yekaterinburg, Russia
Received September 6, 2018; revised September 16, 2018; accepted September 17, 2018
The reactions of bromine and iodine with 1-allylteobromine and 1-methallyltheobromine were studied.
Depending on the nature of the halogen and the initial theobromine, the reaction can lead to the formation of the
adducts at the double bond, oxazolopurines or a complex compounds.
Keywords: theobromine, 1-methallyltheobromine, oxazolopurine, allyltheobromine
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019