ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 566-573
УДК 547.724.3
СИНТЕЗ 4-(5-НИТРОФЕНИЛФУР-2-ИЛ)-1,2,3-ТИА-
И -СЕЛЕНАДИАЗОЛОВ
© 2019 г. В. В. Дмитерко, Л. М. Певзнер*, М. Л. Петров,
А. И. Поняев, В. С. Завгородний
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 7 декабря 2018 г.
После доработки 7 декабря 2018 г.
Принято к печати 13 декабря 2018 г.
Aрилированием 2-ацетилфурана солями о-, м- и п-нитрофенилдиазония в условиях реакции Гомберга-
Бахмана синтезированы соответствующие 5-(нитрофенил)-2-ацетилфураны. Их карбэтоксигидразоны в
условиях реакции Хурда-Мори циклизуются в стабильные 4-(5-нитрофенилфур-2-ил)-1,2,3-тиадиазолы.
Семикарбазоны при окислении двуокисью селена в уксусной кислоте дают аналогичные
4-(5-
нитрофенилфур-2-ил)-1,2,3-селенадиазолы. Изучены электронные спектры поглощения полученных
гибридных гетероциклов и показано, что в о-нитропроизводных вследствие стерических затруднений
нарушается сопряжение между фенильным и фурановым кольцом, а в п-нитропроизводных наблюдается
эффект прямого полярного сопряжения, приводящий к сильному батохромному сдвигу полосы
поглощения. Положения максимумов и интенсивность спектров поглощения исследуемых соединений
определяются совокупностью электронных и стерических факторов. Свое влияние оказывает также и
разная длина цепи сопряжения за счет разного положения нитрогруппы в фенильном фрагменте. Замена
тиадиазольного фрагмента селенадиазольным приводит к небольшому батохромному сдвигу
электронных спектров поглощения.
Ключевые слова: 2-ацетилфуран, арилирование, гидразоны, реакция Хурда-Мори, 1,2,3-тиадиазолы,
1,2,3-селенадиазолы
DOI: 10.1134/S0044460X19040103
Ранее нами было показано, что фенильный
[2], и оценить, насколько будет отличаться распре-
заместитель, имеющий нитро- или сложноэфирную
деление электронной плотности в этих молекулах.
группу и находящийся в положении 5 фуранового
кольца 4-(3-фурил)-1,2,3-тиадиазола, придает этой
Первой стадией синтеза целевых продуктов
гибридной системе термическую стабильность [1].
являлось арилирование 2-ацетилфурана солями о-,
В настоящей работе мы решили проверить, можно
м- и п-нитрофенилдиазония в водно-ацетоновой
ли таким способом стабилизировать лабильные
среде в условиях реакции Гомберга-Бахмана по
системы
4-(2-фурил)-1,2,3-тиа- и
-селенадиазола
аналогии с методикой (схема 1) [3].
Схема 1.
N+ Cl-
CuCl2
+
O
O
O2N
O2N
O
O
1-3
2-NO2 (1), 3-NO2 (2), 4-NO2 (3).
566
СИНТЕЗ 4-(5-НИТРОФЕНИЛФУР-2-ИЛ)-1,2,3-ТИА- И -СЕЛЕНАДИАЗОЛОВ
567
Схема 2.
SOCl2
H2N-NHCOOEt
1-3
O
O
N
O2N
O2N
N
N
NHCOOEt
S
4-6
7-9
2-NO2 (4, 7), 3-NO2 (5, 8), 4-NO2 (6, 9).
Cоединения 1-3 были получены с выходами 62,
Выходы тиадиазолов 7-9 составляли 40, 35 и 76%
30 и
70% соответственно. Величины выходов
соответственно. Образование тиадиазольного
согласуются с электрофильностью арильных
кольца подтверждалось наличием сигнала протона
карбокатионов, образующихся в результате элими-
Н5 в спектрах ЯМР 1Н при 8.6-8.8 м. д. и сигналов
нирования азота из нитрофенилдиазониевых солей.
ядер углерода 1,2,3-тиадиазольного цикла около
Это дает основание полагать, что арилирование
129 (С5) и 149-152 м. д. (С4) в спектрах ЯМР 13С.
ацетилфурана протекает по электрофильному
Соединения 7-9 представляли собой кристалли-
механизму.
ческие вещества с т. пл.
107,
102 и
160°С
соответственно.
Нитрофенилкетоны
1-3 представляют собой
кристаллические вещества с четкими темпера-
Синтез 1,2,3-селенадиазолов из ацетилфуранов
турами плавления. Методика синтеза и спек-
1-3 проводили в две стадии аналогично работе [5].
тральные характеристики полученных веществ
Действием гидрохлорида семикарбазида в
приведены в экспериментальной части.
присутствии ацетата натрия в изопропиловом
спирте получали семикарбазоны 10-12 (схема 3).
Карбэтоксигидразоны соединений 1-3 получали
Реакцию проводили при мольном соотношении
действием карбэтоксигидразина в изопропиловом
кетон:гидрохлорид семикарбазида:ацетат натрия =
спирте в присутствии серной кислоты при мольном
1:1.2:2 при
80°С в течение
10 ч. После
соотношении кетон:гидразин = 1:1.05 (схема 2).
перекристаллизации из этанола выходы целевых
Время реакции составляло 10 ч при 80°С. Выходы
продуктов составлял 87, 89 и 90% соответственно.
о-
(4) и п- нитрофенильного
(6) производных
Окисление соединений 10-12 двуокисью селена в
практически не отличались и составляли 56 и 57%.
уксусной кислоте при
66°С приводило к
Выход м-изомера 5 был равен
65%. Согласно
образованию селенадиазолов
13-15 (схема
3).
данным спектроскопии ЯМР
1Н и
13С, эти
Реакцию проводили при мольном соотношении
соединения в растворе существуют в единственной
семикарбазон:двуокись селена = 1:1.1 в течение
форме, а не в виде смеси син- и анти- изомеров,
6 ч. Целевые продукты реакции были получены с
наблюдаемых в случае метильных производных
выходами 82, 65 и 77% соответственно. Образо-
гидразонов ацетилфуранов
[2]
и эфиров
вание
1,2,3-селенадиазольного цикла подтвер-
ацетилфуранкарбоновых кислот [4].
ждалось наличием сигнала протона при 9.3-9.6 м. д.
Превращение карбэтоксигидразонов 4-6 в 1,2,3-
в CDCl3 (сателлит с 2JHSe = 39.2 Гц) или при 10.2 м. д.
тиадиазолы 7-9 осуществляли в условиях реакции
в ДМСО-d6 (сателлит с 2JHSe = 37.2 Гц) в спектре
Хурда-Мори в кипящем хлороформе действием 3-
ЯМР 1Н. Сигналы ядер углерода С5 проявлялись
4-кратного избытка хлористого тионила (схема 3).
при 135-141 м. д., а углерода С4 - при 149-151 м. д.
Схема 3.
SeO2
H2N-NHCONH2
O
O
N
1-3
O2N
O2N
CH3COONa
CH3COOH
N
N
NHCONH2
Se
10-12
13-15
2-NO2 (10, 13), 3-NO2 (11, 14), 2-NO2 (12, 15).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
568
ДМИТЕРКО и др.
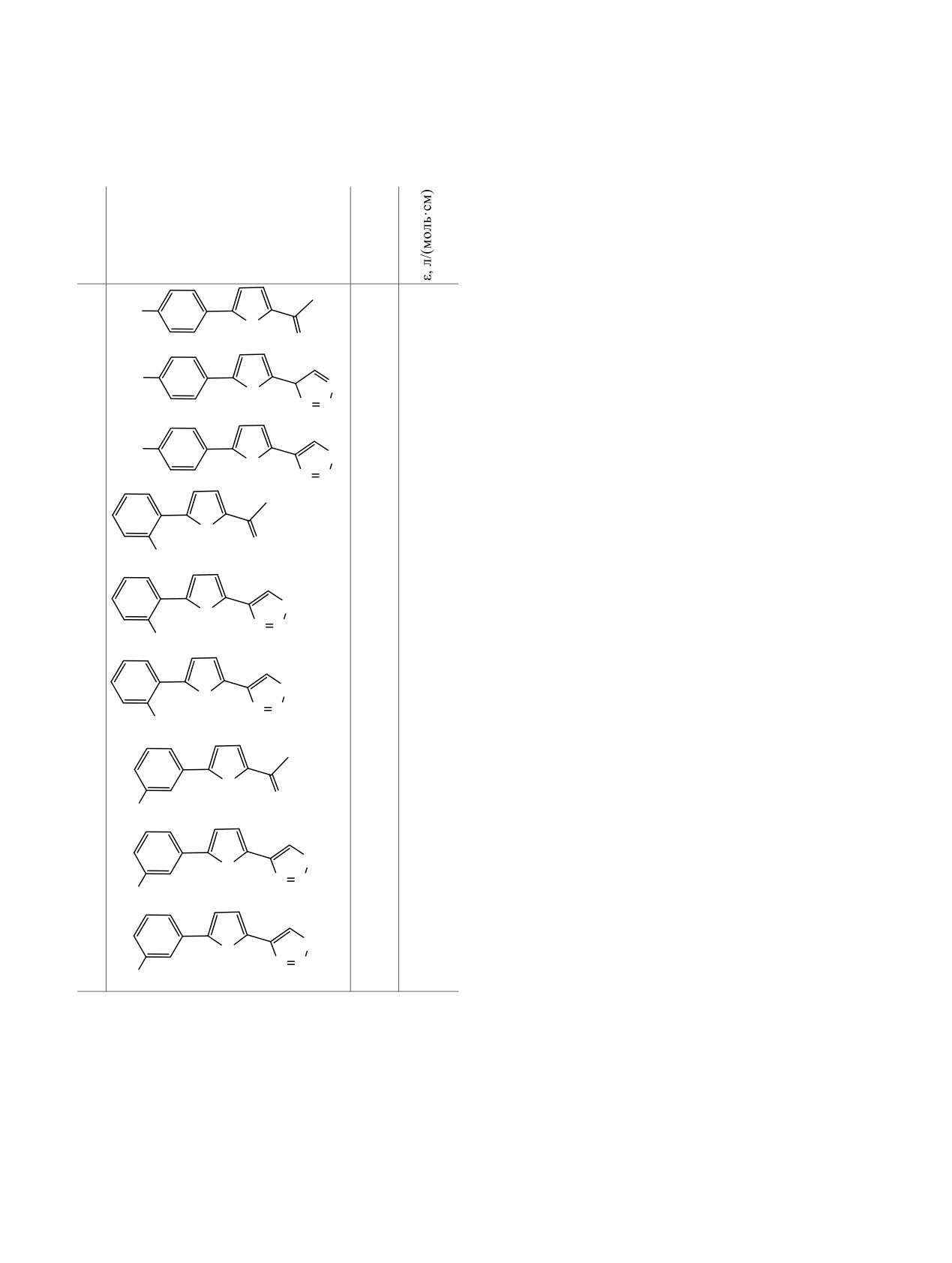
Данные электронной спектроскопии поглощения для 5-
тиадиазола, так и 4-(2-фурил)-1,2,3-селенадиазола
(нитрофенил)-2-ацетилфуранов 1-3, 4-[5-(нитрофенил)-
приводит к термической стабилизации системы.
фур-2-ил]-1,2,3-тиадиазолов 7-9 и 4-[5-(нитрофенил)-
При этом выходы целевых продуктов в реакции
фур-2-ил]-1,2,3-селенадиазолов 13-15 (хлороформ, 20°С)
Хурда-Мори в значительно большей степени
зависят от положения нитрогруппы в фенильном
№
λmax,
кольце, чем в реакции образования селенадиа-
Структурная формула
зольного кольца.
нм
С целью выявления влияния строения хромо-
форных групп и их взаимного влияния в
3
346
O2N
исследуемых соединениях нами были изучены
O
13452
электронные спектры поглощения кетонов
1-3,
O
тиадиазолов
7-9 и селенадиазолов
13-15 в
9
374
8934
хлороформе. Положения максимумов поглощения
O2N
S
O
и коэффициенты экстинкции указанных соеди-
N
N
нений при комнатной температуре приведены в
таблице. Как видно, введение заместителей в
15
385
16673
O2N
фурановый фрагмент в положения 2 и 5 во всех
Se
O
случаях приводит к существенному батохромному
N
N
сдвигу и увеличению коэффициента экстинкции по
1
295
17966
сравнению с незамещенным фураном (λmax
=
O
200 нм, εmax = 10000 л·моль-1·см-1 [6]).
O
NO2
Последовательный переход от орто-, мета- к
пара-нитрогруппе в фенильном фрагменте в рядах
7
300
14368
ацетилфуранов,
1,2,3-тиа- и
-селенадиазолов
S
O
увеличивает батохромный сдвиг спектра погло-
N
N
щения. Анализ моделей Стюарта-Бриглеба для
NO
2
нитрофенилфурильных производных показывает,
13
310
21911
что для орто-нитрофенилзамещенных фуранов 1,
Se
O
7, 13 копланарное расположение фенильного и
N
N
фуранового колец невозможно. Это снижает
NO
2
степень сопряжения между данными структур-
2
310
22378
ными единицами и приводит к более коротко-
волновым максимумам поглощения по сравнению
O
O
с пара-замещенными производными
3,
9,
15.
O2N
Наиболее длинноволновым поглощением обладают
пара-нитрофенильные производные 3, 9 и 15 за
8
315
14560
счет эффекта прямого полярного сопряжения с
S
O
электроноакцепторной пара-нитрогруппой. Макси-
N N
O2N
мальный батохромный сдвиг спектров поглощения
наблюдается в ряду фуранов с
1,2,3-селена-
14
320
25680
диазолом в положении 2 (∆λmax = 75 и 65 нм между
Se
O
п- и о-, м-нитропроизводными соот-ветственно).
N N
Наименьший сдвиг наблюдается в ряду
O2N
ацетилфуранов (∆λmax = 51 и 36 нм между п- и о-,
м-нитропроизводными соответственно). Переход же
от тиадиазола к селенадиазолу во всех трех (орто-,
Полученные соединения 13-15 представляли собой
мета-, пара-нитрогруппы) хромофорных системах
кристаллические вещества с т. пл. 120, 127 и 116°С
вызывает небольшое батохромное смещение
соответственно.
максимума поглощения, мало зависящее от их
Таким образом, введение нитрофенильного
строения. Из последнего факта следует, что 1,2,3-
фрагмента в структуру как
4-(2-фурил)-1,2,3-
тиа- и -селенадиазольный циклы сходным образом
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ 4-(5-НИТРОФЕНИЛФУР-2-ИЛ)-1,2,3-ТИА- И -СЕЛЕНАДИАЗОЛОВ
569
влияют на распределение электронной плотности в
ной соляной кислоты. Нагревали смесь до полного
исследуемых молекулах и эффект тяжелого атома
растворения гидрохлорида о-нитроанилина, охлаж-
проявляется слабо. Таким образом, положения
дали до 0°С и прибавляли по каплям 4.2 мл 30%-
полос в электронных спектрах погло-щения
ного раствора нитрита натрия при температуре не
исследуемых соединений определяются, главным
выше
3°С. Затем при этой же температуре
образом,
стерическими
факторами,
приливали раствор
1.91 г
(17.4 ммоль)
2-
обусловленными положением нитрогруппы в
ацетилфурана в 9 мл ацетона и раствор 0.44 г
фенильном фрагменте.
(2.6 ммоль) дигидрата хлорида меди в 2 мл воды.
Полученную смесь перемешивали 20 мин, затем
Изменение коэффициента экстинкции же ведет
нагревали до
40°С и перемешивали при этой
себя непредсказуемым образом и не подчиняется
температуре 5 ч. Образовавшуюся смесь экстра-
правилу Брауде, согласно которому уменьшение
гировали хлороформом, экстракт сушили хло-
коэффициента экстинкции должно быть тем
ристым кальцием, отфильтровывали осушитель,
больше, чем больше угол разворота фенильного
фильтрат упаривали. Остаток затирали с этанолом
кольца по отношению к фурану
[7]. Такое
и приливали воду до начала выделения осадка.
поведение связано, скорее всего, с влиянием
Через несколько часов отфильтровывали осадок и
электронных факторов в большей степени, чем
сушили его на воздухе. Выход 2.48 г (62%), т. пл.
стерических. Наличие сильных акцепторных
116°С. Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 2.48
заместителей по разные стороны от π-избыточного
с (3H, CH3C=O-фуран), 6.76 д (1H, H4-фуран, J =
фурана приводит к изменению полярности
3.6), 7.24 д (1H, H3-фуран, J = 3.6), 7.54 т (1H, H4-
молекулы. Суммарное электроноакцепторное
фенил, J = 7.6), 7.65 т (1H, H5-фенил, J = 7.6), 7.77
влияние нитрофенильного фрагмента в
5-поло-
уш. д (1H, J = 7.6, Н3,6-фенил), 7.78 уш. д (1H, J =
жении и заместителей во
2-положении с π-
7.6, Н3,6-фенил). Спектр ЯМР 13C (CDCl3), δС, м. д.:
дефицитной электронной плотностью (кетонов 1-3
26.07 (CH3C=O-фуран), 111.71 (С4-фуран), 118.20
и гетероциклов 7-9, 13-15) на фуран, обладающий
(С3-фуран), 123.02 (С1-фенил), 124.16 (С3-фенил),
донорным характером, сложным образом влияет на
129.70 (С4-фенил), 129.98 (С6-фенил), 132.27 (С5-
интенсивность поглощения. Молярный коэффи-
фенил),
147.95 (С5-фуран),
151.68 (С2-фуран),
циент экстинкции поглощения уменьшается при
153.08 (С2-фенил), 186.48 (C=O).
переходе от ацетильных производных к тиадиазолу
и увеличивается при переходе к селенадиазолам.
5-(м-Нитрофенил)-2-ацетилфуран (2). К сус-
Таким образом, положения максимумов и
пензии 2.50 г (20.3 ммоль) м-нитроанилина в 16 мл
интенсивность спектров поглощения исследуемых
воды при перемешивании приливали 12.2 мл 15%-
соединений определяются совокупностью электрон-
ной соляной кислоты, и нагревали смесь до
ных и стерических факторов. На это накладывается
полного растворения гидрохлорида м-нитро-
еще и разная длина цепи сопряжения за счет
анилина. Полученный раствор охлаждали до 0°С, и
разного положения нитрогруппы в фенильном
прибавляли по каплям 5.5 мл 30%-ного раствора
фрагменте.
нитрита натрия при температуре не выше 3°С.
Затем при этой же температуре прибавляли
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
раствор 2.30 г (20.3 ммоль) ацетилфурана в 10.2 мл
ацетона и раствор 0.51 г (3 ммоль) дигидрата
Спектры ЯМР 1H, 13C записаны на спектрометре
хлорида меди в 2 мл воды. Полученную смесь
Bruker DPX-400 [400.13 (1H), 100.61 MГц (13С)]. В
перемешивали 20 мин, после чего нагревали до 40°С
качестве растворителей использовали CDCl3 и
и перемешивали при этой температуре
5 ч.
ДМСО-d6. Электронные спектры поглощения
Выделившуюся органическую фазу кипятили с
сняты в хлороформе на приборе СФ-2000 в квар-
этанолом и небольшим количеством силикагеля,
цевых кюветах толщиной
1 см. Масс-спектры
затем фильтровали и оставляли фильтрат для
высокого разрешения получены на масс-
кристаллизации.
Осадок
отфильтровывали,
спектрометре Bruker MicrOTOF. Температуры
промывали этанолом и сушили на воздухе. Выход
плавления измерены на приборе Boёtius.
1.45 г (30%), т. пл. 117°С. Спектр ЯМР 1H (CDCl3),
5-(о-Нитрофенил)-2-ацетилфуран (1). К сус-
δ, м. д. (J, Гц): 2.59 с (3H, CH3C=O-фуран), 6.97 д
пензии 2.40 г (17.4 ммоль) о-нитроанилина в 14 мл
(1H, H4-фуран, J = 3.6), 7.32 д (1H, H3-фуран, J =
воды при перемешивании приливали 10.4 мл 15%-
3.6), 7.66 т (1H, H5-фенил, J = 8.0), 8.14 д (1H, H6-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
570
ДМИТЕРКО и др.
фенил, J = 8.0), 8.24 д (1H, H4-фенил, J = 8.0), 8.61 с
6.99 д (1H, H3-фуран, J = 3.6), 7.59 т (1H, H4-фенил,
(1H, H2-фенил). Спектр ЯМР 13C (CDCl3), δС, м. д.:
J = 7.6), 7.74 т (1H, H5-фенил, J = 7.6), 7.89 д (1H,
26.14 (CH3C=O-фуран), 109.37 (С4-фуран), 119.18
H6-фенил, J = 7.6), 7.91 д (1H, H3-фенил, J = 7.6),
(С3-фуран), 119.72 (С4-фенил), 121.70 (С1-фенил),
10.18 с (1H, NH). Спектр ЯМР 13C (ДМСО-d6), δС,
123.53 (С2-фенил), 130.12 (С5-фенил), 130.39 (С6-
м. д.: 13.43 (СН3C=N), 15.00 (CH3-этил),
61.14
фенил),
148.78 (С5-фуран),
152.66 (С3-фенил),
(OCH2-этил), 111.51 (С4-фуран), 112.36 (С3-фуран),
154.77 (С2-фуран), 186.59 (C=О).
122.79 (С1-фенил), 124.39 (С3-фенил), 129.17 (С4-
фенил),
129.82 (С6-фенил),
132.91 (С5-фенил),
5-(п-Нитрофенил)-2-ацетилфуран (3). К сус-
141.37 (С=N), 147.38 (С5-фуран), 148.65 (С2-фуран),
пензии 3.28 г (24 ммоль) п-нитроанилина в 21.6 мл
153.77 (С2-фенил), 154.37 уш. с (С=О).
воды при перемешивании приливали 16.2 мл 15%-
ной соляной кислоты, и нагревали смесь до
Карбэтоксигидразон 5-(м-нитрофенил)-2-ацетил-
полного растворения. Полученный раствор
фурана (5). Выход 65%, т. пл. 110°С. Спектр ЯМР
охлаждали до 0°С, и прибавляли по каплям 6.58 мл
1H (CDCl3), δ, м. д. (J, Гц): 1.39 уш. т (3H, СН3-
30%-ного раствора нитрита натрия при
этил, J = 7.0), 2.26 с (3H, CH3-гидразон), 4.36 уш. к
температуре не выше 5°С. Затем при этой же
(2Н, OCH2-этил, J = 7.0), 6.88 д (1H, H4-фуран, J =
температуре прибавляли раствор 2.93 г (27 ммоль)
3.6), 6.93 д (1H, H3-фуран, J = 3.6), 7.57 т (1H, H5-
ацетилфурана в 13.5 мл ацетона и раствор 0.69 г
фенил, J = 8.0), 8.11 д (1H, H6-фенил, J = 8.0), 8.35
(4 ммоль) дигидрата хлорида меди в 2 мл воды.
д (1H, H4-фенил, J = 8.0), 8.50 с (1H, H2-фенил, J =
Реакционную массу перемешивали 20 мин, затем
8.0). Спектр ЯМР 13C (CDCl3), δС, м. д.:
12.14
нагревали до
40°С и выдерживали при этой
(СН3C=N), 14.54 (CH3-этил), 62.37 (OCH2-этил),
температуре 5 ч. Органическую фазу кипятили в
109.42 (С4-фуран), 112.16 (С3-фуран), 118.73 (С4-
этаноле И фильтровали горячей. Выделившийся
фенил),
121.62 (С1-фенил),
122.18 (С2-фенил),
при охлаждении осадок отфильтровывали,
129.60 (С5-фенил), 129.81 (С6-фенил), 143.33 (С=
промывали этанолом и сушили на воздухе. Выход
N), 148.70 (С2-фуран), 148.70 (С5-фуран),
152.18
3.84 г (70%), т. пл. 196°С. Спектр ЯМР 1H (CDCl3),
(С2-фуран), 152.28 (C3-фенил), 152.46 (С=О).
δ, м. д. (J, Гц): 2.58 с (3H, CH3C=O-фуран), 7.00 д
Карбэтоксигидразон 5-(п-нитрофенил)-2-ацетил-
(1H, H4-фуран, J = 3.6), 7.31 д (1H, H3-фуран, J =
фурана (6). Выход 57%, т. пл. 166°С. Спектр ЯМР
3.6), 7.95 д (2H, H2-фенил, J = 9.0), 8.31 д (2H, H3-
1H (ДМСО-d6), δ, м. д. (J, Гц): 1.27 т (3H, СН3-этил,
фенил, J
= 9.0). Спектр ЯМР 13C (CDCl3), δС,
J = 7.0), 2.21 с (3H, CH3-гидразон), 4.19 к (2H,
м. д.: 26.16 (CH3C=O-фуран), 110.62 (С4-фуран),
OCH2-этил, J = 7.0), 7.02 д (1H, H4-фуран, J = 2.8),
119.18 (С3-фуран), 124.40 (С3,5-фенил), 125.40 (С2,6-
7.39 д (1H, H3-фуран, J = 3.6), 7.96 д (2H, H2,6-
фенил),
134.95 (С1-фенил),
147.65 (С2-фуран),
фенил, J = 8.4), 8.29 д (2H, H3,5-фенил, J = 8.4),
153.06 (С4-фенил), 154.71(С5-фуран), 186.50 (C=O-
10.23 с (1H, NH). Спектр ЯМР 13C (CDCl3), δС,
фуран).
м. д.: 13.75 (СН3C=N), 15.04 (CH3-этил),
61.18
Карбэтоксигидразоны 5-нитрофенил-2-ацетил-
(OCH2-этил), 112.38 (С4-фуран), 113.11 (С3-фуран),
фуранов (общая методика). Растворяли при
124.71 (С3,5-фенил), 125.95 (С2,6-фенил), 135.95 (С1-
нагревании и перемешивании 6 ммоль 5-нитро-
фенил), 141.27 уш. с (C=N), 146.51 (С5-фуран),
фенил-2-ацетилфурана
1-3 и
6.3 ммоль карб-
151.78 (С2-фуран), 154.03 (С4-фенил), 154.39 (C=O).
этоксигидразина в смеси 50 мл изопропилового
4-[5-(о-Нитрофенил)фур-2-ил]-1,2,3-тиадиазол
спирта и
0.25 мл концентрированной серной
(7). К суспензии 0.92 г (2.9 ммоль) карбэтокси-
кислоты. Полученный раствор кипятили 10 ч при
гидразона 5-(о-нитрофенил)-2-ацетилфурана в 20 мл
80°С. Выделившийся при охлаждении осадок
хлороформа прибавляли при перемешивании
отфильтровывали, промывали небольшим коли-
0.84 мл (11.6 ммоль) хлористого тионила. Смесь
чеством изопропилового спирта и перекристалли-
перемешивали 10 ч при 64-66°С и оставляли на
зовывали из этанола.
ночь. Отфильтровывали осадок, фильтрат упари-
Карбэтоксигидразон 5-(о-нитрофенил)-2-ацетил-
вали. Остаток растворяли в этилацетате и
фурана (4). Выход 56%, т. пл. 119°С. Спектр ЯМР
высаживали гексаном. Отделяли выделившийся
1H (ДМСО-d6), δ, м. д. (J, Гц): 1.26 т (3H, СН3-этил,
осадок, фильтрат кипятили с силикагелем,
J = 7.0), 2.14 с (3H, CH3-гидразон), 4.18 к (2H,
фильтровали и оставляли медленно испаряться.
OCH2-этил, J = 7.0), 6.94 д (1H, H4-фуран, J = 3.6),
Выделившийся осадок отделяли и перекристаллизо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ 4-(5-НИТРОФЕНИЛФУР-2-ИЛ)-1,2,3-ТИА- И -СЕЛЕНАДИАЗОЛОВ
571
вывали из этанола. Выход 0.43 г (40%), т. пл. 106°С.
нитрофенил)-2-ацетилфурана и 0.52 г (4.70 ммоль)
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 6.88 д (1H,
гидрохлорида семикарбазида при перемешивании
H4-фуран, J = 3.6), 7.27 д (1H, H3-фуран, J = 3.6),
и нагревании растворяли в 12 мл изопропилового
7.49 т (1H, H4-фенил, J = 7.6), 7.64 т (1H, H5-фенил,
спирта. После полного растворения реагентов
J = 7.6), 7.75 д (1H, H6-фенил, J = 7.6), 7.78 д (1H,
добавляли 0.79 г (9.60 ммоль) ацетата натрия.
H3-фенил, J = 7.6), 8.77 с (1H, H5-тиадиазол).
Полученную смесь перемешивали при кипении 10 ч
Спектр ЯМР 13C (CDCl3), δC, м. д.: 111.34 (С4-
и оставляли на ночь. Выпавший кристаллический
фуран),
111.71 (С3-фуран),
123.28 (С1-фенил),
осадок отфильтровывали, промывали небольшим
123.99 (С3-фенил), 128.83 (С4-фенил), 128.93 (С6-
количеством изопропилового спирта и перекристал-
фенил), 129.39 (С5-тиадиазол), 131.98 (С5-фенил),
лизовывали из этанола. Выход 1.00 г (87%), т. пл.
147.67 (С5-фуран), 149.27 (С2-фуран), 150.90 (С4-
121°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц):
тиадиазол), 153.99 (С2-фенил). Масс-спектр, m/z:
2.09 c (3H, CH3-семикарбазон), 6.53 уш. с (2H,
274.0290
[M + H]+ (вычислено для C12H7N3O3S:
NH2), 7.05 уш. с (1H, H4-фуран), 7.10 уш. с (1H, H3-
274.0281).
фуран), 7.55 уш. т (1H, H4-фенил, J = 7.2), 7.71 уш.
т (1H, H5-фенил, J = 7.2), 7.83 д (1H, H6-фенил, J =
4-[5-(м-Нитрофенил)фур-2-ил]-1,2,3-тиадиазол
7.2) 7.93 д (1H, H3-фенил, J = 7.2), 9.55 с (1H, NH).
(8) получали аналогично из 0.74 г (2.33 ммоль)
Спектр ЯМР
13C (ДМСО-d6), δС, м. д.:
12.84
карбэтоксигидразона
5-(м-нитрофенил)-2-ацетил-
(СН3C=N), 111.16 (С4-фуран), 112.19 (С3-фуран),
фурана и 0.7 мл (9.65 ммоль) хлористого тионила.
122.21 (С1-фенил), 124.05 (С3-фенил), 128.41 (С4-
Осадок отфильтровывали, фильтрат упаривали.
фенил),
129.50 (С6-фенил),
132.46 (С5-фенил),
Остаток затирали с гексаном, отфильтровывали
135.89 (C=N), 147.26 (С5-фуран), 148.18 (С2-фуран),
выделившиеся кристаллы, перекристаллизовывали
153.90 (С2-фенил), 157.45 (C=O).
из этанола. Выход 0.22 г (35%), т. пл. 101°С.
Спектр ЯМР 13C (CDCl3), δС, м. д.: 109.56 (С4-
Семикарбазон
5-(м-нитрофенил)-2-ацетил-
фуран),
111.92 (С3-фуран),
118.70 (С4-фенил),
фурана
(11) получали аналогично из
0.44 г
122.37 (С2-фенил), 123.07 (С1-фенил), 129.17 (С5-
(1.90 ммоль)
5-(м-нитрофенил)-2-ацетилфурана,
тиадиазол), 129.51 (С5-фенил), 129.98 (С6-фенил),
0.25 г (2.25 ммоль) гидрохлорида семикарбазида и
147.29 (С2-фуран), 148.26 (С5-фуран), 148.83 (С4-
0.37 г (4.60 ммоль) ацетата натрия. Выход 0.49 г
тиадиазол), 152.24 (С3-фенил). Масс-спектр, m/z:
(89%), т. пл. 124°С. Спектр ЯМР 1H (ДМСО-d6), δ,
274.0289
[M + H]+ (вычислено для C12H7N3O3S:
м. д. (J, Гц): 2.20 c (3H, CH3-семикарбазон), 6.54
274.0281).
уш. с (2H, NH2), 7.10 д (1H, H4-фуран, J = 3.4), 7.36
д (1H, H3-фуран, J = 3.4), 7.73 т (1H, H5-фенил, J =
4-[5-(п-Нитрофенил)фур-2-ил]-1,2,3-тиадиазол
7.2), 8.12 д (1H, H6-фенил, J = 7.2), 8.22 д (1H, H4-
(9) получали аналогично из 1.19 г (3.75 ммоль)
фенил, J = 7.2), 8.50 с (1H, H2-фенил), 9.52 с (1H,
карбэтоксигидразона
5-(п-нитрофенил)-2-ацетил-
NH). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 12.84
фурана и 1 мл (15 ммоль) хлористого тионила.
(СН3C=N), 110.96 (С4-фуран), 111.82 (С3-фуран),
Смолистый осадок отфильтровывали, фильтрат
118.20 (С4-фенил), 122.39 (С2-фенил), 124.32 (С1-
упаривали. Остаток затирали с гексаном, отфиль-
фенил),130.10 (С5-фенил),
131.16 (С6-фенил),
тровывали выделившиеся кристаллы и перекристал-
136.57 (C=N), 147.65 (С2-фуран), 148.96 (С5-фуран),
лизовывали из этанола. Выход 0.78 г (76%). Спектр
151.16 (С3-фенил), 157.42 (C=O).
ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 7.08 д (1H, H4-
Семикарбазон
5-(п-нитрофенил)-2-ацетил-
фуран, J = 3.6), 7.33 д (1H, H3-фуран, J = 3.6), 7.91
фурана (12) получали из 1.72 г (7.6 ммоль) 5-(п-
д (2H, H2,6-фенил, J = 8.8), 8.31 д (2H, H3,5-фенил,
нитрофенил)-2-ацетилфурана, 1.00 г (9.0 ммоль)
J = 8.8), 8.77 с (1H, H5-тиадиазол). Спектр ЯМР 13C
гидрохлорида семикарбазида и 1.50 г (18.3 ммоль)
(CDCl3), δС, м. д.: 111.13 (С4-фуран), 112.20 (С3-
ацетата натрия. Выход 1.93 г (90%), т. пл. 126°С.
фуран), 124.25 (С3,5-фенил), 124.47 (С2,6-фенил),
Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц): 2.20 c
129.37 (С5-тиадиазол), 135.16 (С1-фенил),
146.82
(3H, CH3-семикарбазон), 6.59 уш. с (2H, NH2), 7.14
(С5-фуран),
147.96 (С2-фуран),
152.42 (С4-тиа-
д (1H, H4-фуран, J = 3.4), 7.39 д (1H, H3-фуран, J =
диазол), 154.01 (С4-фенил). Масс-спектр, m/z: 274.0290
3.4), 8.02 д (2H, H2.6-фенил, J = 8.8), 8.26 д (2H, H3,5-
[M + H]+ (вычислено для C12H7N3O3S: 274.0281).
C
фенил, J = 8.8), 9.62 c (1H, NH). Спектр ЯМР 13
Семикарбазон
5-(о-нитрофенил)-2-ацетил-
(ДМСО-d6), δС, м. д.: 13.16 (СН3C=N), 112.13 (С4-
фурана
(10). Смесь
0.92 г
(3.98 ммоль)
5-(о-
фуран),
112.89 (С3-фуран),
124.66 (С3,5-фенил),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
572
ДМИТЕРКО и др.
124.86 (С2,6-фенил),
136.10 (С1-фенил),
136.41
селена. Выход 0.9 г (77%), т. пл. 116°С. Спектр
(C=N), 146.51 (С5-фуран), 151.34 (С2-фуран), 154.03
ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц): 7.35 уш. д (1H,
(С4-фенил), 157.40 (C=О).
H4-фуран, J = 2.4), 7.54 уш. д (1H, H3-фуран, J =
2.4), 8.13 д (2H, H2,6-фенил, J = 8.2), 8.32 д (2H,
4-[5-(о-Нитрофенил)фур-2-ил]-1,2,3-селена-
H3,5-фенил, J = 8.2), 10.17 с (1H, H5-селенадиазол,
диазол
(13). К суспензии 0.82 г (2.85 ммоль)
сателлит 2JHSe = 37.2). Спектр ЯМР 13C (ДМСО-d6),
семикарбазона 5-(о-нитрофенил)-2-ацетилфурана в
δС, м. д.: 112.20 (С4-фуран), 112.88 (С3-фуран),
12.3 мл ледяной уксусной кислоты прибавляли при
124.85 (С3,5-фенил), 124.94 (С2,6-фенил), 135.92 (С1-
перемешивании
0.35 г
(3.15 ммоль) диоксида
фенил),
140.60 (С5-селенадиазол),
146.62 (С5-
селена. Полученную смесь нагревали без доступа
фуран),
149.31 (С2-фуран),
151.80 (С4-селена-
света при 66°С в течение 6 ч. По окончании
диазол), 153.97(С4-фенил). Масс-спектр, m/z: 321.9710
реакции добавляли 10 мл теплой воды, осадок
[M + H]+ (вычислено для C12H7N3O3Se: 321.9725).
отфильтровали и промывали теплой водой. Выход
0.75 г (82%), т. пл. 119°С. Спектр ЯМР 1H (CDCl3),
ФОНДОВАЯ ПОДДЕРЖКА
δ, м. д. (J, Гц): 6.90 д (1H, H4-фуран, J = 3.6), 7.23 д
(1H, H3-фуран, J = 3.6), 7.49 т (1H, H4-фенил, J =
Работа выполнена при финансовой поддержке
8.0), 7.64 т (1H, H5-фенил, J = 8.0), 7.74 д (1H, H6-
Министерства образования и науки РФ (проект
фенил, J = 8.0) 7.81 д (1H, H3-фенил, J = 8.0), 9.38 с
4.4697.2017/6.7) и Российского фонда фунда-
(1H, H5-селенадиазол, сателлит
2JHSe
=
39.2).
ментальных исследований (проект 16-08-01299).
Спектр ЯМР 13C (CDCl3), δC, м. д.: 111.23 (С4-
фуран),
111.74 (С3-фуран),
123.38 (С1-фенил),
КОНФЛИКТ ИНТЕРЕСОВ
123.97 (С3-фенил), 128.74 (С4-фенил), 128.77 (С6-
фенил),
131.93 (С5-фенил),
136.12 (С5-селена-
Авторы заявляют об отсутствии конфликта
диазол),
147.58 (С5-фуран),
148.78 (С2-фуран),
интересов.
148.88 (С4-селенадиазол), 154.23 (С2-фенил). Масс-
спектр, m/z: 321.9710[M + H]+ (вычислено для
СПИСОК ЛИТЕРАТУРЫ
C12H7N3O3Se: 321.9725).
1. Ремизов Ю.О., Певзнер Л.М., Петров М.Л. // ЖОХ.
4-[5-(м-Нитрофенил)фур-2-ил]-1,2,3-селена-
2018. Т. 88. Вып. 7. С. 1110; Remizov Yu.O., Pevzner L.M.,
диазол
(14) получали аналогично из
0.46 г
Petrov M.L. // Russ. J. Gen. Chem. 2018. N 7. P. 1402.
(1.59 ммоль) семикарбазона 5-(м-нитрофенил)-2-
doi 10.1134/S1070363218070095
ацетилфурана и 0.2 г (1.80 ммоль) диоксида селена.
2. Певзнер Л.М., Ремизов Ю.О., Петров М.Л. // ЖОХ.
Выход 0.33 г (65%), т. пл. 127°С. Спектр ЯМР 1H
2015. Т. 85. Вып. 1. С. 67; Remizov Yu.O., Pevzner L.M.,
(CDCl3), δ, м. д. (J, Гц): 7.01 д (1H, H4-фуран, J =
Petrov M.L. // Russ. J. Gen. Chem. 2015. N 1. P. 61. doi
3.6), 7.28 д (1H, H3-фуран, J = 3.6), 7.63 т (1H, H5-
10.1134/S1070363215010119
фенил, J = 8.0), 8.06 д (1H, H6-фенил, J = 8.0), 8.17
3. Frimm R., Kovac J., Krutosikova A. // Chem. Zvesti.
д (1H, H4-фенил, J = 8.0), 8.60 с (1H, H2-фенил),
1973. Vol. 27. N 1. P. 101.
9.53 с (1H, H5-селенадиазол, сателлит 2JHSe = 39.2).
4. Маадади Р., Певзнер Л.М., Петров М.Л. // ЖОХ.
Спектр ЯМР 13C (CDCl3), δС, м. д.: 109.56 (С4-
2015. Т. 85. Вып. 11. С. 1830; Maadadi R., Pevzner L.M.,
фуран),
111.79 (С3-фуран),
118.64 (С4-фенил),
Petrov M.L. // Russ. J. Gen. Chem. 2015. N 11. P. 21.
122.23 (С2-фенил), 129.41 (С5-фенил), 129.92 (С6-
doi 10.1134/S1070363215110110
фенил),
131.69 (С1-фенил),
135.76 (С5-селена-
5. Петров М.Л., Ляпунова А.Г., Андросов Д.А. // ЖОрХ.
диазол),
148.39 (С2-фуран),
148.84 (С5-фуран),
2012. Т. 48. Вып. 1. С. 151; Petrov M.L., Lyapunova A.G.,
Androsov D.A. // Russ. J. Org. Chem. 2012. Vol. 48.
151.86 (С4-селенадиазол), 154.37 (С3-фенил). Масс-
N 1. P. 147. doi 10.1134/S1070428012010625
спектр, m/z:
321.9733
[M + H]+ (вычислено для
6. Казицина Л.А. Применение УФ-, ИК-, ЯМР-спектро-
C12H7N3O3Se: 321.9725).
скопии в органической химии. М: Рипол Классик,
4-[5-(п-Нитрофенил)фур-2-ил]-1,2,3-селена-
2013. 268 с.
диазол
(15) получали аналогично из
1.05 г
7. Штерн Э., Тиммонс К. Электронная адсорбционная
(3.64 ммоль) семикарбазона 5-(п-нитрофенил)-2-
спектроскопия в органической химии / Под ред.
ацетилфурана и
0.44 г
(3.96 ммоль) диоксида
Ю.А. Пентина. М.: Мир, 1974. 295 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ 4-(5-НИТРОФЕНИЛФУР-2-ИЛ)-1,2,3-ТИА- И -СЕЛЕНАДИАЗОЛОВ
573
Synthesis of 4-(5-Nitrophenylfur-2-yl)-1,2,3-thia-
and -Selenadiazoles
V. V. Dmiterko, L. M. Pevzner*, M. L. Petrov, A. I. Ponyaev, and V. S. Zavgorodnii
St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received December 7, 2018; revised December 7, 2018; accepted December 13, 2018
The corresponding 5-(nitrophenyl)-2-acetylfuranes were synthesized by arylation of 2-acetylfuran with o-, m-
and p-nitrophenyldiazonium salts under the Gomberg-Bachmann reaction conditions. Their carbethoxyhyd-
razones cyclized to form stable 4-(5-nitrophenylfur-2-yl)-1,2,3-thiadiazoles through the Hurd-Mori reaction.
When oxidized with selenium dioxide in acetic acid, semicarbazones gave similar 4-(5-nitrophenylfur-2-yl)-
1,2,3-selenadiazoles. The electronic absorption spectra of the obtained hybrid heterocycles were studied. It was
shown that the conjugation between the phenyl and furan rings is disrupted in o-nitro derivatives, and the effect
of direct polar conjugation is observed in p-nitroderivatives, leading to a strong bathochromic shift of the
absorption band. The positions of the maxima and the intensity of the absorption spectra of the compounds under
study were determined by a combination of electronic and steric factors. The difference in the length of the
conjugation chain due to the different positions of the nitro group in the phenyl fragment also has its effect.
Replacing the thiadiazole fragment with selenadiazole leads to a slight bathochromic shift of the electronic
absorption spectra.
Keywords: 2-acetylfuran, arylation, hydrazones, Hurd-Mori reaction, 1,2,3-thiadiazoles, 1,2,3-selenadiazoles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019