ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 574-579
УДК 547.34
ПОЛИФТОРАЛКИЛФОСФАТЫ С ПРОПАРГИЛЬНЫМИ
ЗАМЕСТИТЕЛЯМИ
© 2019 г. C. И. Верхотуроваa, А. М. Налибаеваb, С. Н. Арбузоваa, Т. И. Казанцеваa,
С. В. Зинченкоa, В. Л. Михайленкоc, Н. А. Чернышеваa, Г. К. Бишимбаеваb,
Н. К. Гусароваa, Б. А. Трофимовa, *
a Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
e-mail: boris_trofimov@irioch.irk.ru
b Институт топлива, катализа и электрохимии имени Д. В. Сокольского, Алматы, Казахстан
c Иркутский государственный университет, Иркутск, Россия
Поступило в Редакцию 29 декабря 2018 г.
После доработки 29 декабря 2018 г.
Принято к печати 11 января 2019 г.
Полифторалкилдихлорфосфаты легко реагируют с пропаргиловым спиртом в достаточно мягких
условиях
(22-62°С,
3 ч, пиридин-толуол), образуя неизвестные ранее бис(2-пропинил)-
полифторалкилфосфаты с выходом 36-41%, тройная связь в которых способна участвовать в реакции
азид-алкинового циклоприсоединения.
Ключевые слова: полифторалкилдихлорфосфаты, алкилдихлорфосфаты, пропаргиловый спирт, бис(2-
пропинил)полифторалкилфосфаты, бис(2-пропинил)алкилфосфаты, азид-алкиновое циклоприсоединение
DOI: 10.1134/S0044460X19040115
В последние годы фторалкилфосфаты привле-
фосфатов 1а, б с пропаргиловым спиртом 2 в
кают все большее внимание исследователей как
системе пиридин-толуол. Мониторинг осущест-
эффективные антипирены (например, негорючие
вляли методом спектроскопии ЯМР
31Р по
добавки к электролитам для Li-ионных батарей
исчезновению сигналов исходных дихлорфосфатов
[1-5]), компоненты для создания поверхностно-
1а, б в области 9-10 м. д. и появлению сигналов
активных материалов [6, 7], а также перспективные
целевых бис(2-пропинил)полифторалкилфосфатов
прекурсоры для дизайна лекарственных средств
3а, б в области -1-0 м. д. Реакция протекала при
[8-11]. Введение в молекулу фторалкилфосфатов
комнатной температуре в течение 2 ч с конверсией
дополнительных реакционноспособных групп
исходных фторалкилдихлорфосфатов 1а, б 80%.
открывает новые возможности для широкого
Для достижения полной конверсии реакционную
использования этих соединений в направленном
смесь дополнительно нагревали при 60-62°С в
органическом синтезе. В этом отношении
течение 1 ч (схема 1).
перспективны фторалкилфосфаты с пропаргиль-
В оптимизированных условиях (22-62°С, 3 ч,
ными заместителями, тройная связь в которых
система Py-толуол) выход фосфатов 3а, б близок к
может вступать далее в различные атом-экономные
количественному (ЯМР 31Р). Однако выделение
реакции присоединения и циклоприсоединения
фосфатов 3а, б из реакционной смеси и особенно
[12-14], в частности, в реакцию азид-алкинового
их очистка перегонкой в вакууме приводит к
циклоприсоединения [14, 15-18].
значительному снижению препаративного выхода
В настоящей работе мы впервые сообщаем о
(до
36-41%) целевых соединений за счет их
синтезе функциональных фосфатов, содержащих
значительного осмоления.
одновременно фторалкильные и пропаргильные
группы. Синтез реализован на основе реакции 2,2,2-
Подобранные условия оказались также
трифторэтил- и
2,2,3,3-тетрафторпропилдихлор-
подходящими для синтеза бис(2-пропинил)этил- и
574
ПОЛИФТОРАЛКИЛФОСФАТЫ С ПРОПАРГИЛЬНЫМИ ЗАМЕСТИТЕЛЯМИ
575
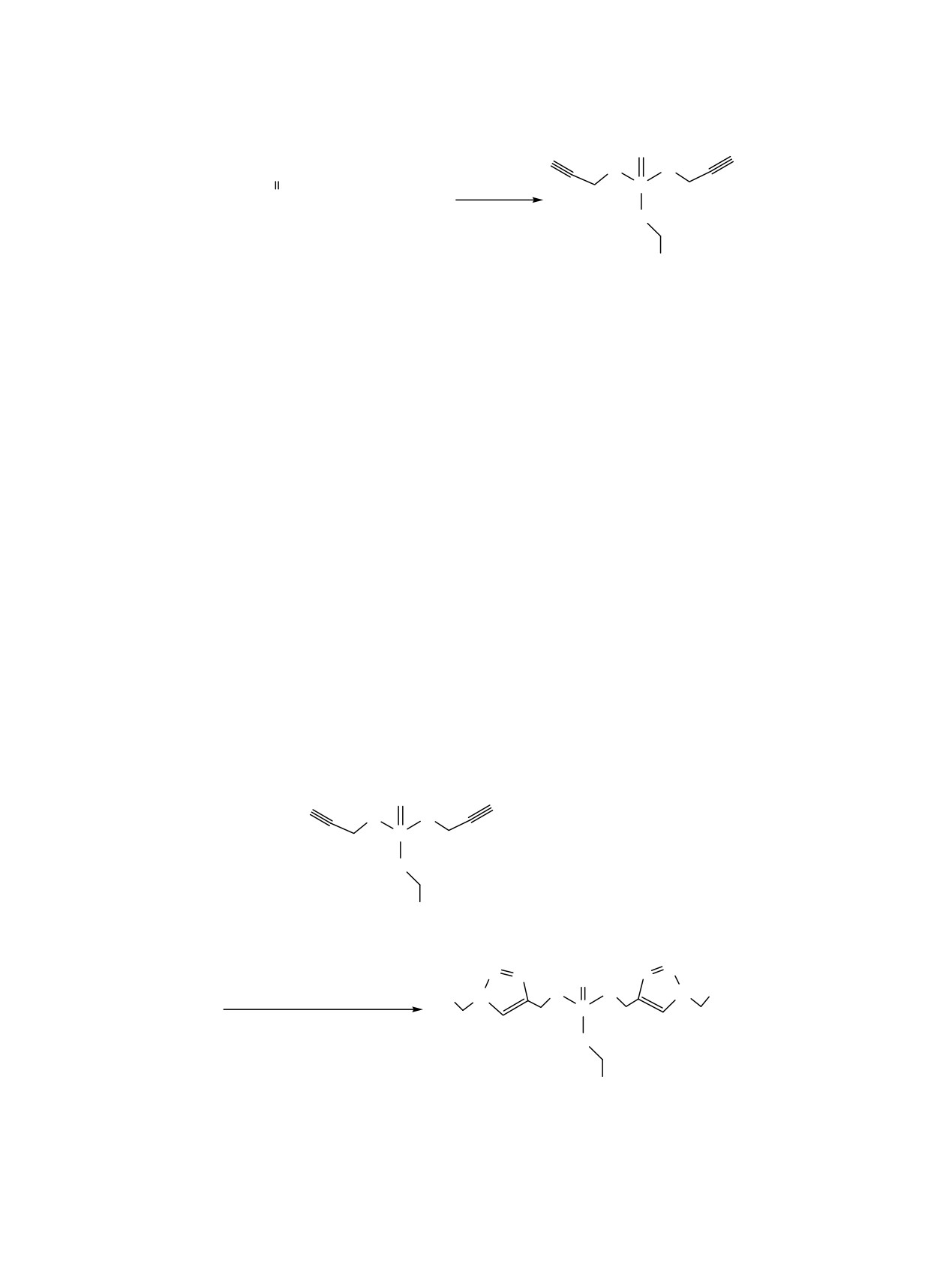
Схема 1.
O
O
O
O
Py/PhMe
22-62°C, 3 ч
P
RFCH2OPCl2
+
2 HC CCH2OH
-2Py.HCl
O
1a, б
2
RF
3a, б
RF = CF3 (a), HCF2CF2 (б).
бис(2-пропинил)пропилфосфатов
3в, г из этил
синтезированных триазолов 4 однозначно доказана
(пропил)дихлорфосфатов 1в, г и пропаргилового
методом спектроскопии ЯМР на ядрах 1Н, 13C, 15N,
спирта (препаративный выход соединений 3в, г
19F и 31Р, в том числе с использованием двумерной
достигал 38 и 42% соответственно).
спектроскопии ЯМР (COSY, HSQC, HMBC).
В ходе данного процесса образуются также
На примере дипропаргилфосфатов 3a, б и 3г
гидрохлорид триэтиламмония и хлорид триэтил-
получены предварительные результаты о воз-
бензиламмония. Попытки очистить целевые
можности
использования
синтезированных
соединения 4 от указанных солей (флеш-хромато-
соединений в реакции азид-алкинового циклопри-
графия на Al2O3 или на силикагеле, элюент -
соединения. Так, фосфаты 3a, б и 3г реагируют с
хлороформ, дихлорметан, ацетон) не привели к
бензилазидом (который генерируется in situ из
желаемому результату. Более того, триазолы 4 в
азида натрия и бензилхлорида) как терминальные
этих растворителях неустойчивы и претерпевают
диацетилены, образуя бис(1-бензил-1Н-1,2,3-три-
превращения, возможно, полимеризацию, поскольку
азол-4-ил)алкилфосфаты
4а, б и
4г. Реакция
в спектрах ЯМР 1Н и 31Р появляются уширенные
протекает при комнатной температуре за 4 (3а, б)
неразрешенные сигналы.
или 7 ч (3г) при использовании традиционной
каталитической системы CuSO4-аскорбат натрия-
Известно, что пропаргильные соединения
Et3N [15, 16] в среде водного ацетонитрила (схема 2).
(например, пропаргиловые эфиры, N-пропаргил-
В отсутствие триэтиламина при прочих равных
пирролы, N-пропаргилимидазол, N-пропаргил-1,2,4-
условиях реакция не реализуется. Структура
триазол) в присутствии сильных оснований (t-
Схема 2.
O
O
O
P
+ NaN3 + PhCH2Cl
O
R
3a, б, г
3
N
N
N2
N
O
CuSO4, аскорбат Na, Et3N, MeCN
O
O
N1
Ph
Ph
N
P
4
-Et3N.HCl, -[PhCH2NEt3]Cl
5
O
R
4a, б, г
R = CF3 (a), HCF2CF2 (б), Et (г).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
576
ВЕРХОТУРОВА и др.
BuOK, KОН-ДМСО) легко подвергаются прото-
оставляли на ночь. Органический слой деканти-
тропной изомеризации (при температуре 20-45°С)
ровали и фильтровали, толуол из фильтрата
[12]. В то же время оказалось, что cинтези-
отгоняли при пониженном давлении, остаток
рованные дипропаргилфосфаты
3 (показано на
растворяли в 30 мл дихлорметана. Осадок (гидро-
примере соединений 3б и 3г) при нагревании до 97-
хлорид пиридина), оставшийся после декантации
98°C в течение 3 ч в системе t-BuOK(30 моль%)-
органического слоя, растворяли в 30 мл воды,
ДМСО-d6 устойчивы и не претерпевают никаких
водный раствор экстрагировали дихлорметаном
изменений, согласно данным спектроскопии ЯМР
(5 × 20 мл). Растворы дихлорметана объединяли,
1Н и 31Р.
промывали последовательно насыщенным водным
раствором NaHCO3 (5 × 20 мл) и водой (5 × 20 мл),
Таким образом, на основе реакции полифтор-
сушили над Na2SO4. Дихлорметан отгоняли при
алкилдихлорфосфатов с пропаргиловым спиртом,
пониженном давлении, остаток перегоняли в
легко протекающей в системе пиридин-толуол в
вакууме.
мягких условиях
(22-62°С,
3 ч), разработан
удобный метод синтеза неизвестных ранее поли-
Бис(2-пропинил)(2,2,2-трифторэтил)фосфат
фторалкилфосфатов с пропаргильными замести-
(3а). Выход 4.2 г (41%), прозрачная жидкость, т.
телями. Синтезированные соединения являются
кип. 62-64°C (0.4 мм рт. ст.), d20 1.3470, n
20 1.4098.
перспективными прекурсорами лекарственных
ИК спектр, ν, см-1: 3303 с, 3246 с, 3008 ср, 2973 ср,
средств, востребованными компонентами для
2955 ср, 2889 ср, 2829 сл, 2744 сл, 2596 сл, 2440 сл,
дизайна инновационных материалов и реакционно-
2413 сл, 2256 сл, 2132 с, 1992 сл, 1915 сл, 1807 сл,
способными строительными блоками для элементо-
1624 сл, 1455 ср, 1423 ср, 1376 ср, 1276 с, 1178 с,
органического синтеза.
1109 ср, 1033 с, 994 ср, 886 ср, 777 ср, 689 ср, 658
), δ, м. д.: 2.65 т
ср, 505 ср. Спектр ЯМР 1H (CDCl3
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(2H, CH≡, 4JHH = 2.3 Гц), 4.41 к (2H, CF3CH2, 3JHF =
8.0, 3JHP = 8.0 Гц), 4.74 д. д (4H, ≡CCH2, 3JHP = 10.7,
Спектры ЯМР 1Н, 13C, 15N, 19F, 31Р получены на
4JHH = 2.3 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
спектрометрах Bruker DPX 400 и Bruker AV-400
56.0 д (≡CCH2, 2JCP = 4.9 Гц), 63.8 к. д (CF3CH2, 2JCF =
(400.13,
101.61,
40.55,
376.50 и
161.98 MГц
38.2, 2JCP = 4.4 Гц), 76.6 д (C≡, 3JCP = 7.1 Гц), 76.9
соответственно), внутренний стандарт - ГМДС (1Н,
(CH≡), 122.4 к. д (CF3, 1JCF = 277.6, 3JCP = 10.5 Гц).
13C), MeNO2 (15N), CFCl3 (19F), внешний стандарт -
Спектр ЯМР 19F (CDCl3), δF, м. д.: -75.0 т (CF3, 3JHF =
85%-ная H3PO4 (31P). Для отнесения сигналов в
8.0 Гц). Спектр ЯМР 31P (CDCl3): δP -0.9 м. д.
спектрах ЯМР 1Н и 13C использовали двумерные
Найдено, %: C 37.32; H 3.24; F 22.24; P 11.78.
гомо- и гетероядерные методы спектроскопии ЯМР
C8H8F3O4P. Вычислено, %: C 37.52; H 3.15; F 22.25;
(COSY, HSQC, HMBC). ИК спектры записаны на
P 12.09.
спектрометре Bruker IFS 25 в тонком слое. Масс-
спектры электронной ионизации (70 эВ) получены
Бис(2-пропинил)(2,2,3,3-тетрафторпропил)-
на приборе GCMS-QP5050A Shimadzu.
фосфат
(3б). Выход
4.1 г
(36%), прозрачная
жидкость, т. кип. 85-87°C (0.4 мм рт. ст.), d20
Исходные полифторалкилдихлорфосфаты 1a, б
1.3802, n
20 1.4128. ИК спектр, ν, см-1: 3305 с, 3246
были получены из POCl3 и полифторалканолов в
ср, 3005 сл, 2964 сл, 2889 сл, 2853 сл, 2440 сл, 2132
присутствии LiCl по известной методике [10, 19];
сл, 1984 сл, 1913 сл, 1806 сл, 1657 сл, 1455 сл, 1414
алкилдихлорфосфаты 1в, г получали по методике
сл, 1376 сл, 1286 с, 1237 ср, 1213 ср, 1189 ср, 1109
[20].
ср, 1034 с, 994 ср, 949 ср, 886 ср, 833 ср, 778 ср, 733
Общая методика синтеза бис(2-пропинил)-
ср, 677 ср, 647 ср, 549 ср, 510 ср. Спектр ЯМР 1H
алкилфосфатов 3а-г. К раствору дихлорфосфата 1
(CDCl3), δ, м. д.: 2.65 т (2H, CH≡, 4JHH = 2.4 Гц),
(0.04 моль) в 80 мл толуола добавляли по каплям
4.43 т. д. т (2H, CF2CH2O, 3JHF = 12.1, 3JHP = 7.0, 4JHF =
раствор пропаргилового спирта (0.08 моль, 4.49 г)
1.3 Гц), 4.74 д. д (4H, ≡CCH2O, 3JHP = 10.9, 4JHH =
и пиридина (0.09 моль, 7.12 г) в 15 мл толуола в
2.4 Гц), 5.96 т. т (1H, CHF2, 2JHF = 53.1, 3JHF = 4.3 Гц).
течение
1 ч при комнатной температуре и
Спектр ЯМР 13С (CDCl3), δС, м. д.: 56.0 д (≡CCH2O,
перемешивании. Наблюдалось образование белого
2JCP = 4.7 Гц), 63.4 т. д (CF2CH2O, 2JCF = 30.2, 2JCP =
осадка гидрохлорида пиридина. Реакционную
4.7 Гц), 76.4 д (C≡, 3JCP = 6.9 Гц), 77.0 (CH≡), 109.0
смесь перемешивали еще
1 ч при комнатной
т. т (CHF2, 1JCF = 250.4, 2JCF = 34.9 Гц), 113.7 т. т. д
температуре и затем еще 1 ч при 60-62°C и
(CF2, 1JCF = 251.3, 2JCF = 27.3 Гц, 3JCP = 9.5 Гц).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ПОЛИФТОРАЛКИЛФОСФАТЫ С ПРОПАРГИЛЬНЫМИ ЗАМЕСТИТЕЛЯМИ
577
Спектр ЯМР 19F (CDCl3), δF, м. д.: -138.4 д (CHF2,
триэтиламин (1.7 ммоль, 0.172 г). Аскорбат натрия
2JHF = 53.1 Гц), -125.2 м (CF2). Спектр ЯМР 31P
использовали в виде свежеприготовленного вод-
(CDCl3): δP -0.8 м. д. Найдено, %: C 37.35; H 3.19; F
ного раствора, который получали из аскорбиновой
26.30; P 10.60. C9H9F4O4P. Вычислено, %: C 37.52;
кислоты (0.18 ммоль, 0.32 г), NaOH (0.18 ммоль,
H 3.15; F 26.37; P 10.75.
0.07 г) и
0.2 мл Н2О. Реакционную смесь
перемешивали в атмосфере азота при комнатной
Бис(2-пропинил)этилфосфат (3в). Выход 3.1 г
температуре в течение 4 (3а, б) или 7 ч (3г), затем
(38%), прозрачная жидкость, т. кип.
85-87°C
20
20
фильтровали.
Растворитель
отгоняли
при
(0.4 мм рт. ст.), d20 1.1560, n
1.4500 (n
1.4488
пониженном давлении, остаток сушили в вакууме
[21]). ИК спектр, ν, см-1: 3295 с, 3229 с, 2987 с,
и анализировали. Согласно данным спектроскопии
2945 ср, 2913 ср, 2883 ср, 2826 сл, 2779 сл, 2747 сл,
ЯМР (1Н, 13C, 15N, 19F, 31Р), полученный продукт
2636 сл, 2529 сл, 2438 сл, 2127 с, 2080 сл, 2024 сл,
представлял собой смесь бис(1-бензил-1Н-1,2,3-
1899 сл, 1783 сл, 1637 сл, 1479 ср, 1451 ср, 1395 ср,
триазол-4-ил)алкилфосфата 4, гидрохлорида три-
1374 ср, 1277 с, 1166 ср, 1031 с, 995 с, 857 с, 851 с,
этиламмония и хлорида триэтилбензиламмония
754 ср, 688 ср, 649 ср, 560 ср. Спектр ЯМР 1H
(были идентифицированы методом спектроскопии
(CDCl3), δ, м. д.: 1.32 т (3H, Me, 3JHH = 7.1 Гц), 2.56
ЯМР 1Н и 15N с использованием заведомых образцов).
т (2H, CH≡, 4JHH = 2.4 Гц), 4.15 к (2H, MeCH2O,
3JHH = 7.1, 3JHP = 7.1 Гц), 4.64 д. д (4H, ≡CCH2O,
Бис(1-бензил-1Н-1,2,3-триазол-4-ил)(2,2,2-три-
3JHP = 10.2, 4JHH = 2.4 Гц). Спектр ЯМР 13С (CDCl3),
фторэтил)фосфат (4а). Спектр ЯМР 1H (CDCl3), δ,
δС, м. д.: 15.5 д (Me, 3JCP = 6.9 Гц), 54.7 д (≡CCH2O,
м. д.: 4.05 д. к (2H, CF3CH2, 3JHP = 6.3, 3JHF = 8.9 Гц),
2JCP = 4.3 Гц), 64.2 д (MeCH2O, 2JCP = 6.0 Гц), 75.7
4.91 д (4H, триазол-CH2O, 3JHP = 8.1 Гц), 5.38 с (4Н,
(CH≡), 76.9 д (C≡, 3JCP = 7.7 Гц). Спектр ЯМР 31P
PhCH2), 7.14-7.27 м (10Н, Ph), 7.55 c (2H, Hтриазол).
(CDCl3): δP -0.3 м. д. Найдено, %: С 47.82; H 5.47; P
Спектр ЯМР 13С (CDCl3), δС, м. д.: 53.9 (PhCH2),
15.13. C8H11O4P. Вычислено, %: C 47.53; H 5.48; P
59.1 д (триазол-CH2O, 2JCP = 5.4 Гц), 62.5 к. д
15.32.
(CF3CH2, 2JCF = 35.5, 2JCP = 4.3 Гц), 123.9 к. д (CF3,
1JCF = 278.0, 3JCP = 10.9 Гц), 123.0 (С5триазол), 128.0
Бис(2-пропинил)пропилфосфат
(3г). Выход
(Сo), 128.5 (Сп), 128.9 (См), 134.6 (Cипсо), 146.0 д
3.6 г (42%), прозрачная жидкость, т. кип. 87-89°C
20
20
(С4триазол, 3JCP = 7.9 Гц). Спектр ЯМР 15N (CDCl3),
(0.4 мм рт. ст.), d20 1.1206, n
1.4511 (n
1.4512
δN, м. д.: -132.0 (N1), -32.0 (N3), -20.0 (N2). Спектр
[21]). ИК спектр, ν, см-1: 3295 с, 3228 с, 2972 с,
ЯМР 19F (CDCl3), δF, м. д.: -74.9 т (CF3, 3JHF = 8.8 Гц).
2942 ср, 2901 ср, 2882 ср, 2743 сл, 2689 сл, 2438 сл,
Спектр ЯМР 31P (CDCl3): δP -1.0 м. д. Масс-спектр,
2128 с, 1922 сл, 1817 сл, 1623 сл, 1455 ср, 1394 ср,
m/z (Iотн, %): 522 (0.2) [M]+.
1375 ср, 1351 ср, 1277 с, 1153 ср, 1029 с, 994 с, 944
с, 910 ср, 873 ср, 782 ср, 688 ср, 648 ср, 558 ср, 383
Бис(1-бензил-1Н-1,2,3-триазол-4-ил)(2,2,3,3-
ср. Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.95 т (3H, Me,
тетрафторпропил)фосфат (4б). Спектр ЯМР 1H
3JHH = 7.5 Гц), 1.71 секстет (2H, MeCH2, 3JHH = 7.1
(CDCl3), δ, м. д.: 4.07 т. д (2H, CF2CH2O, 3JHF = 12.7,
Гц), 2.56 т (2H, CH≡, 4JHH = 2.3 Гц), 4.05 д. к (2H,
3JHP = 5.7 Гц), 4.94 д (триазол-CH2O, 3JHP = 7.0 Гц),
EtCH2O, 3JHH = 6.9, 3JHP = 6.9 Гц), 4.67 д. д (4H,
5.41 с (4Н, PhCH2), 5.94 т. т (1H, CHF2, 2JHF = 52.0,
≡CCH2O, 3JHP = 10.1, 4JHH = 2.3 Гц). Спектр ЯМР
3JHF = 5.8 Гц), 7.17-7.45 м (10Н, Ph), 7.57 с (2H,
13С (CDCl3), δС, м. д.: 10.0 (Me), 23.6 д (MeCH2, 3JCP =
Hтриазол). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 53.0
7.2 Гц), 55.2 д (≡CCH2O, 2JCP = 4.9 Гц), 70.1 д
(PhCH2), 59.1 д (триазол-CH2O, 2JCP = 5.0 Гц), 62.4
(EtCH2O, 2JCP = 6.1 Гц), 76.1 (CH≡), 77.5 д (C≡, 3JCP =
м (CF2CH2O), 110.3 т. т (CHF2, 1JCF = 247.5, 2JCF =
7.8 Гц). Спектр ЯМР 31P (CDCl3): δP -0.2 м. д.
32.3 Гц), 116.4 т. т. д (CF2, 1JCF = 248.9, 2JCF = 25.4,
Найдено, %: C 50.05; H 6.12; P 14.05. C9H13O4P.
3JCP = 9.3 Гц), 124.9 (С5триазол), 128.9 (Сo), 129.7 (См),
Вычислено, %: C 50.01; H 6.06; P 14.33.
131.1 (Сп), 137.1 (Cипсо), 146.2 д (С4триазол, 3JCP 8.5 Гц).
Спектр ЯМР 15N (ДМСО-d6), δN, м. д.: -130.1 (N1), -
Общая методика синтеза бис(1-бензил-1Н-
28.3 (N3), -18.5 (N2). Спектр ЯМР 19F (ДМСО-d6),
1,2,3-триазол-4-ил)алкилфосфатов (4а, б, г). К
δF, м. д.: -139.7 д. т (CHF2, 2JHF = 52.2, 3JFF = 6.6 Гц),
раствору
бис(2-пропинил)алкилфосфата
3
-126.0 м (CF2). Спектр ЯМР 31P (CDCl3): δP -0.9 м. д.
(0.85 ммоль) в 2 мл ацетонитрила последовательно
добавляли бензилхлорид (1.7 ммоль, 0.215 г), азид
Бис(1-бензил-1Н-1,2,3-триазол-4-ил)пропил-
натрия
(1.7
ммоль,
0.11
г),
CuSO4·5H2O
фосфат (4г). Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.81
(0.05 ммоль, 0.01 г), аскорбат натрия (0.18 ммоль) и
т (3H, Me, 3JHH = 7.4 Гц), 1.51 секстет (2H, MeCH2,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
578
ВЕРХОТУРОВА и др.
3
Vol. 33. N 6. P. 1304. doi 10.1002/med.21296
JHH = 7.4 Гц), 3.72 д. т (2H, EtCH2O, 3JHH = 7.4, 3JHP =
7.0 Гц), 4.97 д (триазол-CH2O, 3JHP = 6.9 Гц), 5.43 с
10. Гусарова Н.К., Верхотурова С.И., Арбузова С.Н.,
(4Н, PhCH2), 7.20-7.48 м (10Н, Ph), 7.62 с (2H,
Казанцева Т.И., Албанов А.И., Налибаева А.М.,
Hтриазол). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 11.3
Бишимбаева Г.К. // ЖОрХ. 2017. Т. 53. Вып. 11.
С. 1591; Gusarova N.K., Verkhoturova S.I., Arbuzova S.N.,
(Me), 24.5 д (MeCH2, 3JCP = 7.3 Гц), 53.7 (PhCH2),
Kazantseva T.I., Albanov А.I., Nalibaeva А.М.,
59.0 д (триазол-CH2O,
2JCP
=
4.8 Гц),
66.9 д
Bishimbaeva G.K. // Russ. J. Org. Chem. 2017. Vol. 53.
(EtCH2O, 2JCP = 5.8 Гц), 124.9 (С5триазол), 128.9 (Сo),
N 11. P. 1623. doi 10.1134/S107042801711001X
129.7 (См), 133.6 (Сп), 137.1 (Cипсо), 146.2 д (С4триазол,
11. Гусарова Н.К., Верхотурова C.И., Арбузова С.Н.,
3JCP = 8.4 Гц). Спектр ЯМР 15N (ДМСО-d6), δN, м. д.:
Казанцева Т.И., Албанов А.И., Налибаева А.М.,
-130.1 (N1), -27.8 (N3), -18.6 (N2). Спектр ЯМР 31P
Бишимбаева Г.К., Апарцин К.А., Киреева В.В.,
(CDCl3): δP 0.2 м. д.
Трофимов Б.А. // ЖОХ. 2018. Т. 88. Вып. 4. С. 623;
Gusarova N.K., Verkhoturova S.I., Arbuzova S.N.,
Работа выполнена с использованием обору-
Kazantseva T.I., Albanov A.I., Nalibaeva A.M.,
дования Байкальского аналитического центра
Bishimbaeva G.K., Apartsin K.A., Kireeva V.V.,
коллективного пользования Сибирского отделения
Trofimov B.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 4.
РАН.
P. 705. doi 10.1134/S107036321804014Х
КОНФЛИКТ ИНТЕРЕСОВ
12. Трофимов Б.А., Гусарова Н.К. // Усп. хим. 2007.
Т. 76. № 6. С. 550; Trofimov B.A., Gusarova N.K. //
Авторы заявляют об отсутствии конфликта
Russ. Chem. Rev. 2007. Vol. 76. N 6. P. 550. doi
интересов.
10.1070/RC2007v076n06ABEH003712
13. Gusarova N.K., Chernysheva N.A., Trofimov B.A. //
СПИСОК ЛИТЕРАТУРЫ
Synthesis. 2017. Vol. 49. N 21. P. 4783. doi 10.1055/s-
1. Zhang S.S. // J. Power Sources. 2006. Vol. 162. N 2.
0036-1588542
P. 1379. doi 10.1016/j.jpowsour.2006.07.074
14. Voronin V.V., Ledovskaya M.S., Bogachenkov A.S.,
2. Han S.-I., Shin W.-C., Yu J.-Y., Bae T.-H., Lee M.-H.,
Rodygin K.S., Ananikov V.P.
// Molecules.
2018.
Chernyshov D., Tereshchenko A., Shatunov P., Trofi-
Vol. 23. N 10. P. 2442. doi 10.3390/molecules23102442
mov B.A., Gusarova N.K. Pat. 20120244445 (2012).
15. Rostovtsev V.V., Green L.G., Fokin V.V., Sharpless K.B. //
USA // C. A. 2012. Vol. 157. P. 525496.
Angew. Chem. Int. Ed. 2002. Vol. 41. N 14. P. 2596.
3. Takase H., Yokotsuji H. Pat. 3038194 A1 20160629
doi 10.1002/1521-3773(20020715)41
(2016). Eur. // C. A. 2016. Vol. 165. P. 155467.
16. Grischenko L.A., Parshina L.N., Larina L.I., Novikova L.N.,
4. Aspern N., Röser S., Rad B.R., Murmann P., Streipert B.,
Trofimov B.A.
//
Carbohydrate Polymers.
2015.
Mönnighoff X., Tillmann S.D., Shevchuk M., Stubbmann-
Vol. 115. P. 294. doi 10.1016/j.carbpol.2014.08.050
Kazakova O., Röschenthaler G.-V., Nowak S., Winter M.,
17. Erzunov D.A., Latyshev G.V., Averin A.D., Beletskaya I.P.,
Cekic-Laskovic I. // J. Fluor. Chem. 2017. Vol. 198.
Lukashev N.V. // Eur. J. Org. Chem. 2015. Vol. 2015.
P. 24. doi 10.1016/j.jfluchem.2017.02.005
N 28. P. 6289. doi 10.1002/ejoc.201500835
5. Su C.-C., He M., Peebles C., Zeng L., Tornheim A., Liao C.,
18. Стародубцева Р.Р., Гибадуллина Э.М., Пазилова Н.Б.,
Zhang L., Wang J., Wang Y., Zhang Z. // ACS Appl.
Сякаев В.И., Пудовик М.А., Бурилов А.Р. // ЖОХ.
Mater. Interfaces. 2017. Vol. 9. N 36. P. 30686. doi
2017. Т. 87. Вып. 9. С. 1424; Starodubtseva R.R.,
10.1021/acsami.7b08953
Gibadullina E.M., Pazilova N.B., Syakaev V.V., Pudo-
6. Peng S., Yake A.M., Meng X. Pat. 20130210976 (2013).
vik M.A., Burilov A.R. // Russ. J. Gen. Chem. 2017.
USA // C. A. 2013. Vol. 159. P. 349704.
Vol. 87. N 9. P. 1908. doi 10.1134/S1070363217090031
7. Larichev R.B., Meng X., Yake A.M. Pat.
8859799
19. Гусарова Н.К., Верхотурова С.И., Арбузова С.Н.,
(2014). USA // C. A. 2014. Vol. 161. P. 588221.
Казанцева Т.И., Налибаева А.М., Бишимбаева Г.К. //
Бутлеровск. сообщ. 2016. Т. 47. № 8. С. 29.
8. Крутикова В.В., Крутиков В.И., Еркин А.В. // ЖОХ.
2010. Т. 80. Вып. 3. С. 410; Krutikova V.V., Krutikov V.I.,
20. Кормачев В.В., Федосеев М.С. Препаративная химия
Erkin A.V. // Russ. J. Gen. Chem. 2010. Vol. 80. N 3.
фосфора. Пермь: УрО РАН, 1992. C. 278.
P. 434. doi 10.1134/S1070363210030102
21. Arend G., Behrenz W., Block H.-D. Pat.
2727479
9. Baszczyňski O., Janeba Z. // Med. Res. Rev.
2013.
(1979). Germany // C. A. 1979. Vol. 90. P. 138331.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ПОЛИФТОРАЛКИЛФОСФАТЫ С ПРОПАРГИЛЬНЫМИ ЗАМЕСТИТЕЛЯМИ
579
Polyfluoroalkyl Phosphates Bearing Propargyl Substituents
S. I. Verkhoturovaa, A. M. Nalibaevab, S. N. Arbuzovaa, T. I. Kazantsevaa, S.V. Zinchenkoa,
V. L. Mikhailenkoc, N. A. Chernyshevaa, G. K. Bishimbaevab,
N. K. Gusarovaa, and B. A. Trofimova, *
a A.E. Favorskii Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: boris_trofimov@irioch.irk.ru
b D.V. Sokolsky Institute of Fuel, Catalysis and Electrochemistry, Almaty, Kazakhstan
c Irkutsk State University, Irkutsk, Russia
Received December 29, 2018; revised December 29, 2018; accepted January 11, 2019
Polyfluoroalkyl dichlorophosphates react easily with propargyl alcohol under mild conditions (22-62°С, 3 h,
pyridine-toluene) to form previously unknown bis(2-propynyl) polyfluoroalkyl phosphates with a yield of 36-
41%, a triple bond in which is capable of participating in the of azide-alkyne cycloaddition reaction.
Keywords: polyfluoroalkyl dichlorophosphates, alkyl dichlorophosphates, propargyl alcohol, bis(2-propynyl)-
polyfluoroalkyl phosphates, bis(2-propynyl) alkyl phosphates, azide-alkyne cycloaddition reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019