ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 580-584
УДК 547.245:541’128
КОНФОРМАЦИОННЫЙ АНАЛИЗ (1,1'-ФЕНИЛ-
1,1'-СИЛАЦИКЛОГЕКС-1-ИЛ)ДИСИЛОКСАНА.
ИССЛЕДОВАНИЕ МЕТОДОМ DFT
И НИЗКОТЕМПЕРАТУРНОЙ СПЕКТРОСКОПИИ ЯМР 13C
© 2019 г. Б. А. Шаинянa, *, Э. Кляйнпетерb, E. Н. Сусловаa
a Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*e-mail: bagrat@irioch.irk.ru
b Институт химии Университета Потсдама, Потсдам, Германия
Поступило в Редакцию 17 января 2019 г.
После доработки 17 января 2019 г.
Принято к печати 24 января 2019 г.
Теоретический конформационный анализ недавно синтезированного (1,1'-фенил-1,1'-силациклогекс-1-
ил)дисилоксана методами DFT и MP2 выявил энергетическую предпочтительность Phax,Phax конформера.
На основе расчета свободных энергий методом M062X/6-311G(d,p) оценено соотношение конформеров
Phax,Phax:Phax,Pheq:Pheq,Pheq, равное 46.6:33.1:20.3, свидетельствующее о возможном экспериментальном
обнаружении индивидуальных конформеров, например с помощью низкотемпературной спектроскопии
ЯМР 1H и 13C. Однако удается лишь показать наличие нескольких конформеров при 113 K в спектре ЯМР
1H; определить величины Δν (Гц) и ΔG# (ккал/моль) для процесса инверсии 6-членного цикла
невозможно из-за уширения сигналов при низкой температуре, температурного сдвига сигналов и крайне
низкого барьера инверсии цикла при Tc < 113 K.
Ключевые слова: силоксаны, силациклогексаны, конформационный анализ, расчеты DFT и MP2,
низкотемпературная спектроскопия ЯМР
DOI: 10.1134/S0044460X19040127
Фенильная группа в циклогексановом кольце
ционными эффектами [5], так что практически во
характеризуется конформационной энергией A,
всех изученных 1-метил-1-фенил-1-сила(гетеро)цикло-
равной 2.87 ккал/моль, и может рассматриваться
гексанах
[2,
6] преобладают Pheq конформеры.
как ананкомерная (якорная) группа
[1]. При
Единственным исключением является наша
переходе к силациклогексанам конформационные
недавняя работа [7], в которой с помощью расчетов
энергии заместителей у кремния резко понижаются
было показано преобладание Phax конформера у 1-
и могут даже становиться отрицательными, указывая
гидрокси-1-фенил-1-силациклогексана, близкого
на преобладание аксиальных конформеров [2]. В
аналога изученного в настоящей работе (1,1'-фенил-
геминально дизамещенных фенилциклогексанах
1,1'-силациклогекс-1-ил)дисилоксана
1. Разность
фенильная группа стерически взаимодействует со
свободных энергий
∆G°(103K) составляла
0.59
вторым геминальным заместителем, так что,
(DFT) или 0.62 ккал/моль (MP2) на одном и том же
например, несмотря на больший объем, фенильная
уровне теории. Общая тенденция такова, что в
группа в 1-метил-1-фенилциклогексане находится
газовой фазе преобладают Phax конформеры, а в
предпочтительно в аксиальном положении [3] из-за
растворе
- Pheq конформеры. Таким образом,
дестабилизирующих невалентных взаимодействий
несмотря на определенный прогресс в конфор-
протонов метильной группы и фенильного кольца
мационном анализе Si-Ph-замещенных сила-
в Pheq конформере
[4]. В силациклогексанах
(гетеро)циклогексанов, вопрос о возможности
стерические эффекты играют подчиненную роль по
существования этих соединений в Phax конфор-
сравнению с электростатическими и гиперконъюга-
мации остается открытым.
580
КОНФОРМАЦИОННЫЙ АНАЛИЗ (1,1'-ФЕНИЛ-1,1'-СИЛАЦИКЛОГЕКС-1-ИЛ)ДИСИЛОКСАНА
581
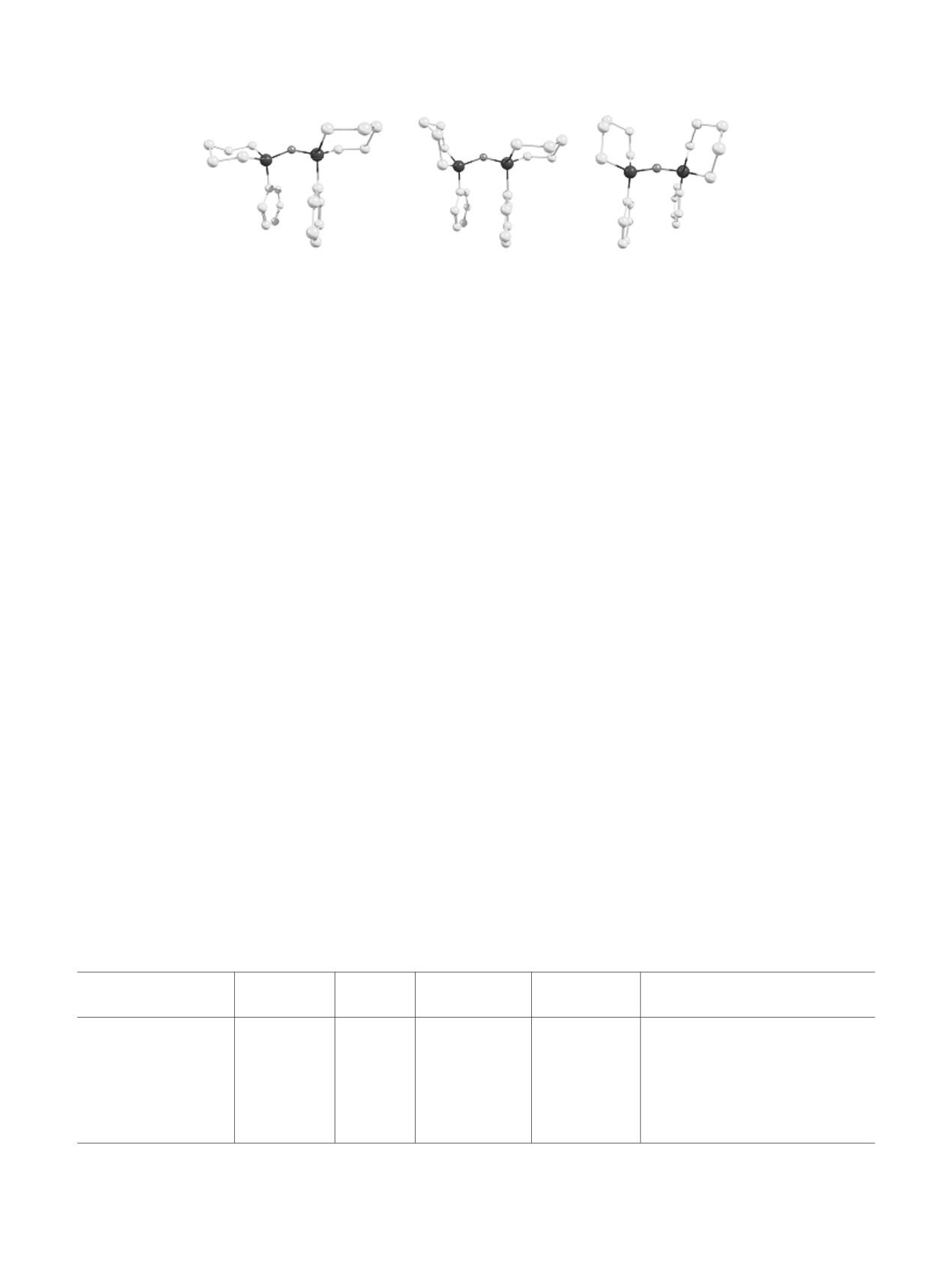
ax-ax
ax-eq
eq-eq
Рис. 1. Оптимизированная методом M062X/6-311G** геометрия конформеров силоксана 1. Обозначения «ax» и «eq»
относятся к положению фенильной группы.
Чтобы восполнить этот пробел, в настоящей
конформеров Pheq, тогда как аксиальные связи
работе мы приводим результаты теоретического
Si-O длиннее, чем экваториальные на 0.003-0.010 Å.
конформационного анализа
(1,1'-фенил-1,1'-сила-
Разумно предположить, что выигрыш энергии за
циклогекс-1-ил)дисилоксана 1 методами M062X/6-
счет укорочения связей Si-O в Phax конформерах
311G(d,p) и MP2/6-311G(d,p). С целью экспери-
соединения
1 перевешивает дестабилизацию за
ментального
обнаружения
индивидуальных
счет аксиального расположения более объемной
конформеров мы также синтезировали соединение
фенильной группы благодаря очень прочной связи
1 путем гидролиза
1-фенил-1-хлор-1-силацикло-
Si-O и незначительному влиянию стерических
гексана и зарегистрировали его спектры ЯМР 13C
эффектов в силациклогексанах [5]. Таким образом,
при низких температурах вплоть до -103 K.
как геометрические, так и энергетические эффекты
согласуются со слабым преобладанием Phax
На рис.
1 приведена оптимизированная
конформеров силоксана
1
(см.
таблицу).
геометрия конформеров силоксана 1. Силацикло-
Интересной структурной особенностью, отчетливо
гексановое кольцо принимает конформацию
видной на рис. 1 и отличающей силоксан 1 от его
кресло, плоскости фенильных колец у атомов
аналогов, содержащих лишь одну фенильную
кремния приблизительно параллельны друг другу,
группу, является эффект π-стекинга, энергия
причем расстояние между плоскостями составляет
которого, хоть и невелика, но благоприятствует
примерно ~3.5 Å как на уровне DFT так и на
Phax,Phax конформерам.
уровне MP2.
В таблице представлены результаты расчетов
Как и в предыдущих работах [2, 5-7], вначале
силоксана 1. Как видно, относительные энергии
мы изучили низкотемпературные спектры ЯМР 13C
конформеров отличаются незначительно. Отно-
силоксана 1; раствор в смеси фреонов CD2Cl2-
сительная стабильность конформеров сила-
CHFCl2-CHF2Cl состава
1:1:3 остается жидким
циклогексанов, содержащих одновременно атом
вплоть до ~100 K. Это наименьшая из когда-либо
кислорода и фенильную группу, обсуждалась
достигнутых температур, при которых можно
недавно [7]. Здесь следует отметить, что связи
получить и исследовать спектры ЯМР высокого
Si-Cипсо в молекуле 1 длиннее на 0.006 Å (MP2) или
разрешения
благодаря
узким,
хорошо
0.007-0.009 Å (DFT) у конформеров Phax, чем у
разрешенным сигналам растворителя CD2Cl2-
Относительные энергии ∆E, свободные энергии ∆G° и вычисленные соотношения конформеров (1,1'-фенил-1,1'-
силациклогекс-1-ил)дисилоксана 1 при 103 K
∆E,
∆G° (298 K),
∆G° (103 K),
Phax,Phax:Phax,Pheq:Pheq,Pheq,
Метод
Конформер
ккал/моль
ккал/моль
ккал/моль
%
M062X/6-311G**
Phax,Phax
0.00
0.00
0.00
46.6:33.1:20.3
Phax,Pheq
0.10
0.09
0.07
Pheq,Pheq
0.16
-0.23
0.10
MP2/6-311G**
Phax,Phax
0.00
-
-
-
Phax,Pheq
0.59
Pheq,Pheq
1.10
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
582
ШАИНЯН и др.
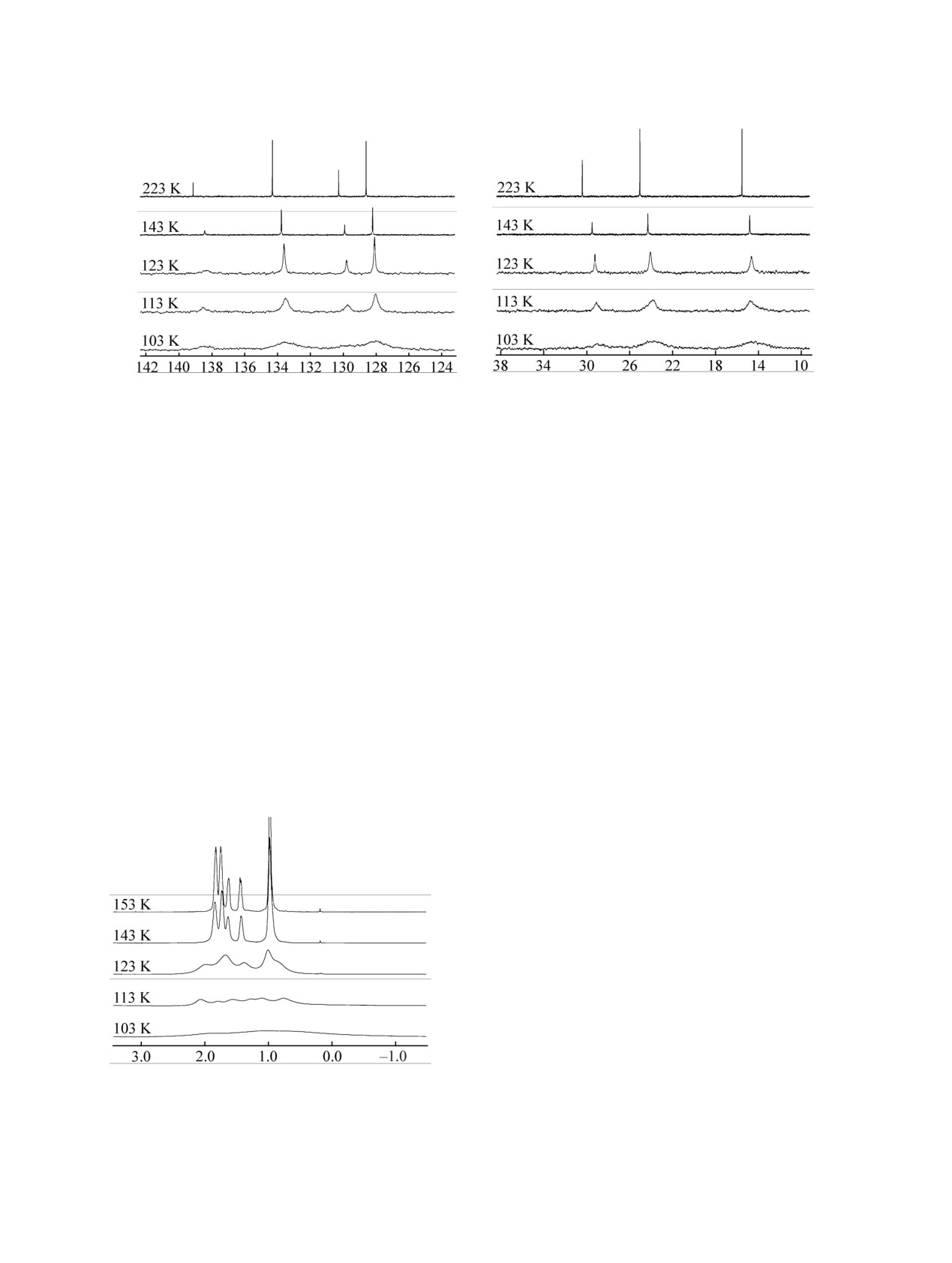
(a)
(б)
δ, м. д.
δ, м. д.
Рис. 2. Низкотемпературные спектры ЯМР 13C силоксана 1 в смеси фреонов CD2Cl2-CHFCl2-CHF2Cl состава 1:1:3 в области
ароматических (а) и алифатических углеродных атомов (б).
фреон. К сожалению, при
103 K углеродные
ароматическими протонами этого не происходит).
сигналы полностью расплываются, так что
К сожалению, наличие шести уширенных сигналов
декоалесценцию сигналов конформеров, участву-
после декоалесценции при T = 113 K можно лишь
ющих в исследуемом конформационном равно-
предполагать. Их наличие означало бы участие в
весии (рис. 1) установить невозможно (рис.
2).
конформационном равновесии силоксана 1 двух
Наименьшая достигнутая температура (Tc = 103 K)
конформеров из трех возможных (см. рис.
1),
представляет собой верхний предел температуры
однако такой вывод носит лишь пред-
коалесценции процесса инверсии
6-членного
положительный характер. Третий возможный
цикла. Однако более проблематично то, что
конформер (согласно расчетам, Pheq,Pheq) может
невозможно зафиксировать и отнести отдельные
быть минорным и его сигналы могут
сигналы конформеров после декоалесценции.
перекрываться соответствующими сигналами двух
преобладающих конформеров. В связи с этим,
Несколько отличную картину дает низко-
количественно измерить интенсивность сигналов
температурное исследование ЯМР
1H (рис. 3):
также невозможно. Фактически, единственным
сигналы протонов силациклогексанового кольца
достоверным результатом является то, что
уширяются при 123 K и далее декоалесцируют (с
температура коалесценции процесса конформа-
ционных взаимопревращений Tc близка к 115 K, и
что в конформационном равновесии участвуют от
двух до трех конформеров; более детальное
количественное описание конформационного
равновесия силоксана
1 не представляется
возможным.
Таким образом, теоретический конформацион-
ный анализ (1,1'-фенил-1,1'-силацикло-гекс-1-ил)-
дисилоксана показал незначительную энергети-
ческую предпочтительность Phax конформеров
(Phax,Phax
> Phax,Pheq
> Pheq,Pheq) несмотря на
бóльшую конформационную энергию более
объемной фенильной группы. Полученный
результат объясняется бóльшим выигрышем
δ, м. д.
энергии за счет укорочения связей Si-O в Phax
конформерах, который перевешивает стерическую
Рис. 3. Низкотемпературные спектры ЯМР 1Н силоксана
дестабилизацию за счет более объемной акси-
1 в смеси фреонов CD2Cl2-CHFCl2-CHF2Cl состава
1:1:3.
альной фенильной группы. Исследование с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
КОНФОРМАЦИОННЫЙ АНАЛИЗ (1,1'-ФЕНИЛ-1,1'-СИЛАЦИКЛОГЕКС-1-ИЛ)ДИСИЛОКСАНА
583
помощью низкотемпературной ЯМР спектро-
Stereoelectronic Effects. Ed. Е. Juaristi. New York:
скопии на ядрах 1H и 13C показало существование
Wiley-VCH, 1995. P. 25.
конформационного равновесия для силоксана 1,
2. Shainyan B.A., Kleinpeter E. // Tetrahedron.
2012.
однако даже при
100 K равновесие слишком
Vol. 68. N 1. P. 114. doi 10.1016/j.tet.2011.10.082
быстрое в шкале времени ЯМР и дальнейшая его
3. Eliel E.I., Manoharan M. // J. Org. Chem.
1981.
количественная оценка по имеющимся данным
Vol. 46. N 9. P. 1959. doi 10.1021/jo00322a056
невозможна.
4. Wiberg K.B., Castejon H., Bailey W.F., Ochterski J. // J.
Org. Chem. 2000. Vol. 65. N 20. P. 1181. doi 10.1021/
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
jo9917386
5. Shainyan B.A., Kleinpeter E. // Tetrahedron.
2013.
(1,1'-Фенил-1,1'-силациклогекс-1-ил)дисилоксан
Vol. 69. N 29. P. 5927. doi 10. 1016/j.tet.2013.04.126
1 был получен по реакции щелочного гидролиза
раствора
1-фенил-1-хлор-1-силациклогексана в
6. Shainyan B.A., Kirpichenko S.V., Chipanina N.N.,
хлористом метилене водным раствором KOH в
Oznobikhina L.P., Kleinpeter E., Shlykov S.A., Osad-
chiy D.Yu. // J. Org. Chem. 2015. Vol. 80. N 12.
двухфазной системе при комнатной температуре в
P. 12492. doi 10.1021/acs.joc.5b02355
присутствии триэтиламина. Сырой продукт
очищали колоночной хроматографией на
7. Shainyan B.A., Kirpichenko S.V., Kleinpeter E. // J. Org.
силикагеле. Спектры ЯМР 1H, 13C, 29Si совпадают с
Chem. 2017. Vol. 82. N 24. P. 13414. doi: 10.1021/
приведенными ранее [8].
acs.joc.7b02505
8. Суслова Е.Н., Шаинян Б.А. // ЖОХ. 2016. Т. 86.
Низкотемпературные спектры ЯМР записывали
Вып. 8. C. 1316. Suslova E.N., Shainyan B.A. // Russ. J.
на спектрометре Bruker AVANCE 600 в смеси
Gen. Chem. 2016. Vol. 86. N 8. P. 1854. doi 10 1134/
фреонов CD2Cl2-CHFCl2-CHF2Cl состава
1:1:3.
S1070363216080132
Температура датчика калибровалась с помощью
9. Frisch M.J., Trucks G.W., Schlegel H.B, Scuseria G. E.,
термопары PT 100, вставленной в пустую ампулу.
Robb M. A., Cheeseman J. R., Scalmani G., Barone V.,
Точность измерений при низкой температуре
Mennucci B., P.etersson G.A., Nakatsuji H., Caricato M.,
составляла ±1 K.
Li X., Hratchian H.P., Izmaylov A.F. ,Bloino J., Zheng G.,
Все расчеты геометрических и колебательных
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
параметров выполнены без ограничений по
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
симметрии с помощью корреляционного функци-
mery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.,
онала M06-2X или на уровне теории MP2 с
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
базисным набором 6-311G(d,p) с использованием
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
пакета программ Gaussian 09 [9].
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
КОНФЛИКТ ИНТЕРЕСОВ
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
Авторы заявляют об отсутствии конфликта
Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochter-
интересов.
ski J.W., Martin R.L., Morokuma K., Zakrzewski V.G.,
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
СПИСОК ЛИТЕРАТУРЫ
Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
1. Bushweller C.H. In: Conformational Behavior of Six-
Cioslowski J., Fox D.J. Gaussian 09, Revision C.01,
Membered Rings. Analysis, Dynamics, and
Gaussian, Inc.: Wallingford. CT. 2009.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
584
ШАИНЯН и др.
Conformational Analysis of (1,1'-Phenyl-1,1'-silacyclohex-
1-yl)disiloxane. DFT and Low-Temperature NMR Spectroscopy
Study
B. A. Shainyana, *, E. Kleinpeterb, and E. N. Suslovaa
a I.A. Favorskii Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: bagrat@irioch.irk.ru
b Institute of Chemistry, University of Potsdam, Potsdam, Germany
Received January 17, 2019; revised January 17, 2019; accepted January 24, 2019
The DFT and MP2 theoretical conformational analysis of the recently synthesized (1,1'-phenyl-1,1'-silacyclohex-
1-yl)disiloxane showed the energetic preference of the Phax,Phax conformer. From M062X/6-311G(d,p) free
energy calculations, the ratio of the Phax,Phax:Phax,Pheq:Pheq,Pheq conformers was estimated to be
46.6:33.1:20.3%, suggesting the possibility of detecting individual conformers experimentally, e.g., by low-
temperature 1H and 13C NMR spectroscopy. However, only the presence of several conformers at 113 K in 1H
NMR spectroscopy could be verified; determination of Δν (Hz) and ΔG# (kcal/mol) for the 6-membered ring
interconversion process was impossible due to line broadening at low temperature, signal temperature shifts and
extremely low barrier to ring inversion at Tc < 113 K.
Keywords: siloxanes, silacyclohexanes, conformational analysis, DFT and MP2 calculations, low-temperature
NMR spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019