ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 620-626
УДК 546.72/.74
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОЦЕНДИХЛОРИДОВ
ТИТАНА, ЦИРКОНИЯ И ГАФНИЯ СО СТИРОЛОМ И
МЕТИЛМЕТАКРИЛАТОМ В СРЕДАХ РАЗНОЙ
ПОЛЯРНОСТИ
© 2019 г. Ю. И. Пузинa, *, Е. М. Захароваb, П. Ю. Пузинa,
Б. Н. Мастобаевa, А. В. Пименовc
a Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфa, 450062 Россия
*e-mail: ppuziny@mail.ru
b Уфимский институт химии Российской Академии наук, Уфа, Россия
c ООО «УГМК-Холдинг», Уральская горно-металлургическая компания, Верхняя Пышма, Россия
Поступило в Редакцию 6 сентября 2018 г.
После доработки 16 сентября 2018 г.
Принято к печати 17 сентября 2018 г.
Методом изомолярных серий проведено УФ спектральное исследование взаимодействия
металлоцендихлороидов титана, циркония и гафния со стиролом или метилметакрилатом в средах разной
полярности (тетрахлорметане, этаноле). Установлено, что имеет место формирование слабых
промежуточных комплексов, причем полярность растворителя существенно влияет на процесс их
образования. Впервые обнаружено, что только в полярной среде этанола образуются комплексы с
переносом заряда между металлоцендихлоридами и стиролом. Предложены вероятные структуры
промежуточных комплексов.
Ключевые слова: стирол, метилметакрилат, титаноцендихлорид, цирконоцендихлорид, гафноценди-
хлорид, комплекс донорно-акцепторного типа
DOI: 10.1134/S0044460X19040188
Металлоценовые соединения активно изучаются
присутствии металлоценов и показано, что ферро-
в процессах радикальной (со)полимеризации,
цен образует комплекс с переносом заряда с
прежде всего, в качестве компонентов инициирую-
пероксидным инициатором (пероксид бензоила),
щих систем для комплексно-радикальной полиме-
который взаимодействует с мономером, в
ризации
[1,
2]. Использование инициирующих
результате чего происходит образование активных
систем позволяет регулировать как процесс полу-
центров полимеризации [1, 2]. Также на основе
чения полимеров, так и свойства получаемого поли-
квантово-механических расчетов установлено, что
мера, в частности термическую стабильность [2].
ферроцен вступает в комплексообразование с
радикалами роста цепей, причем в случае стирола
Основной причиной высокой активности
оно происходит за счет координации его связи С=С
металлоценовых инициирующих систем является
по атому железа, а в случае метилметакрилата -
взаимодействие их компонентов как друг с другом,
его карбонильной группы [4].
так и с радикалами роста [3]. При этом отмечены
особенности комплексообразования металлоценовых
В отличие от ферроцена ценовые соединения
соединений разного строения с ненасыщенными
титана и циркония иначе влияют на процесс
соединениями разной полярности.
полимеризации: рост скорости, а также снижение
Наиболее изученными мономерами, исполь-
средней степени полимеризации заметно ниже, чем
зуемыми для получения промышленных (со)поли-
в случае ферроцена, но энергия активации
меров, являются стирол и метилметакрилат.
полимеризации в их присутствии значительно
Исследован процесс их гомо-полимеризации в
меньше [5]. Эти данные свидетельствуют о том,
620
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОЦЕНДИХЛОРИДОВ ТИТАНА
621
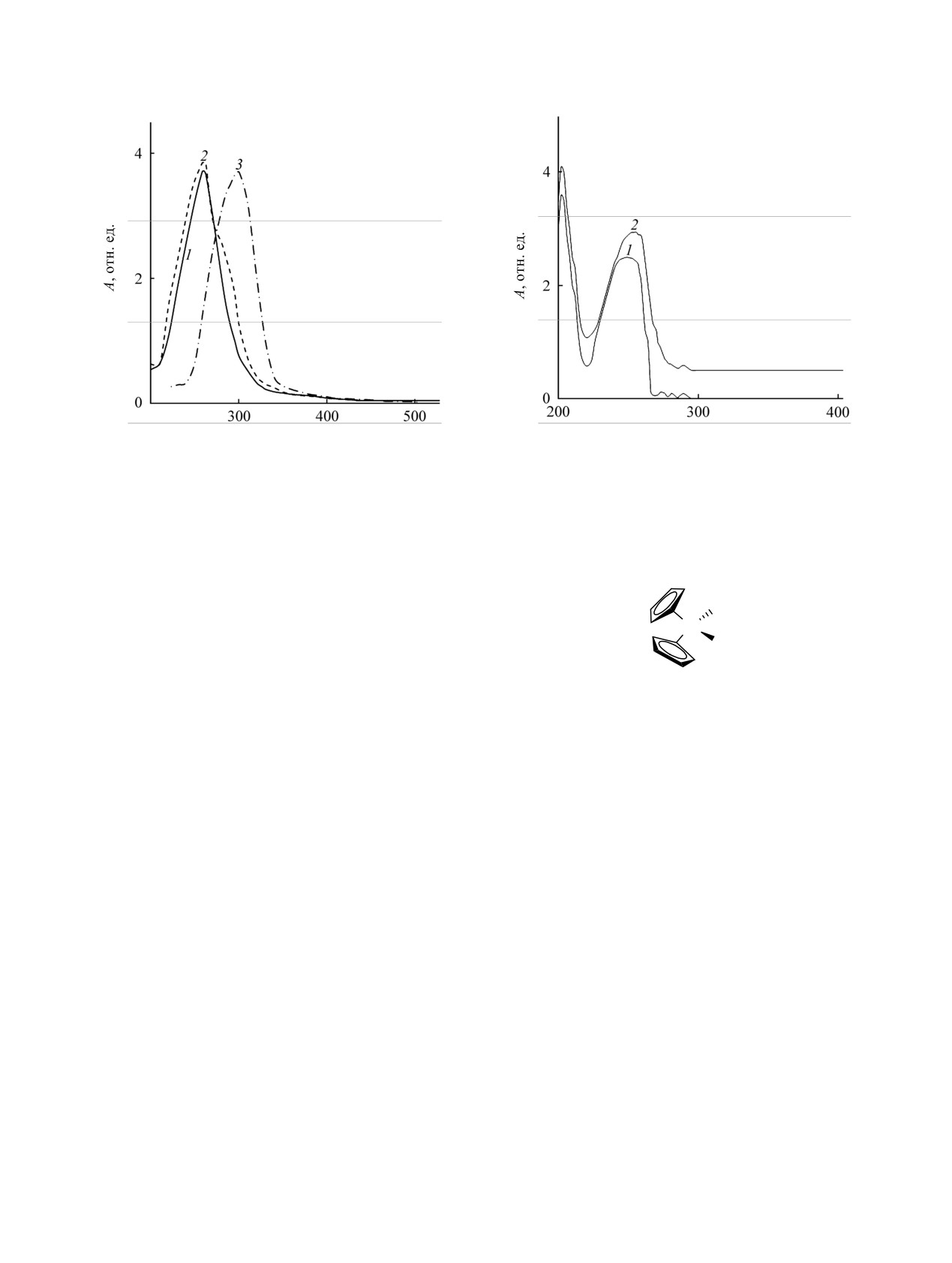
λ, нм
λ, нм
Рис.
1. УФ спектры цирконо-
(1), титано-
(2) и
гафноцендихлорида (3) в СCl4
и этаноле в обоих
Рис. 2. УФ спектры стирола в гексане или СCl4 (1) и в
растворителях одновременно. с = 1.5×10-4 моль/л.
этаноле (2). с = 1.54×10-4 моль/л.
что соединения титана и циркония в большей
металлоцендихлоридами титана, циркония и
степени способствуют переходу процесса в режим
гафния в растворителях разной полярности.
комплексно-радикальной полимеризации.
Cl
Проведенные квантово-механические расчеты
M
показали, что комплексообразование стирола с
Cl
Cp2TiCl2 и Cp2ZrCl2 возможно, но рассчитанные
значения энергетических барьеров высоки,
M = Ti, Zr, Hf.
поэтому концентрация таких комплексов не может
быть большой [4]. Изменений в спектрах смесей
Одним из методов, позволяющих зафиксировать
металлоцендихлоридов со стиролом не удалось
слабое взаимодействие, является метод изомоляр-
обнаружить методами ИК, УФ, и ЯМР
1Н
ных серий [8]. Поэтому для исследования влияния
спектроскопии [4, 5]. Это свидетельствует о том,
растворителей, различающихся полярностью (н-
что формирование комплексов с переносом заряда
гексан, тетрахлорид углерода, этанол), на взаимо-
не происходит или оно протекает в очень малой
действие стирола и метилметакрилата с металло-
степени. Видимо, взаимодействие, если оно имеет
цендихлоридами был выбран именно этот метод.
место, относится к слабым, например эксиплексно-
На рис.
1,
2 представлены УФ спектры
эксимерного типа (так называемые ван-дер-
титаноцен-, цирконоцен-, гафноцендихлоридов и
ваальсовы комплексы)
[6,
7]. Такие взаимо-
стирола в CCl4 и этаноле в области 200-600 нм. В
действия могут повлечь усиление донорно-акцеп-
гексане исследуемые металлоцендихлориды не
торного взаимодействия между вступающими в
растворяются. Важно, что положение максимумов
них молекулами [7, 8]. К тому же полярность
поглощения для металлоценов при регистрации
среды существенно сказывается на таком взаимо-
спектров в тетрахлорметане и этаноле не меняется,
действии.
а в спектре стирола полоса с λmax
=
245 нм
Известно, что ферроцен сильно ускоряет
претерпевает закономерный батохромный сдвиг до
процесс полимеризации метилметакрилата, но
5 нм в этаноле. К тому же оказалось, что в
гораздо слабее влияет на получение полистирола
спектрах смеси металлоценов и стирола
[2]. Учитывая различие в полярности мономеров,
отсутствуют новые полосы поглощения, которые
мы предприняли сравнительное исследование
могли бы говорить о формировании комплекса с
взаимодействия стирола и метилметакрилата с
переносом заряда.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
622
ПУЗИН и др.
Значения молярных коэффициентов экстинкции металлоцендихлоридов, стирола и метилметакрилата в разных
растворителях и для разных полос поглощения
ε, л/(моль·см)
Соединение
298 нм
262 нм
203 нм
CCl4
этанол
CCl4
этанол
CCl4
этанол
Титаноцендихлорид
8110
6850
37420
35210
35
30
Цирконоцендихлорид
12720
9380
41210
36850
38
30
Гафноцендихлорид
34610
29770
4360
4250
12
7
Стирол
-
-
3370
3180
27050
23250
Метилметакрилат
-
-
65
52
21280
20390
Титаноцендихлорид Cp2TiCl2 не поглощает в
не только роль среды, но и вклад каждого
области λ > 380 нм, а пик поглощения приходится
соединения в их взаимодействие.
на λmax
=
262 нм. В спектре Cp2ZrCl2 нет
На рис. 3 представлены результаты измерений
поглощения в области λ > 350 нм, а максимум
ΔD в зависимости от состава смеси для системы
поглощения наблюдается при λmax
=
260 нм.
титаноцендихлорид-стирол в среде тетрахлорида
Максимум поглощения для гафноцендихлорида
углерода и этанола. Видно, что при проведении
Cp2HfCl2 соответствует
298 нм, что заметно
эксперимента в неполярном CCl4 измеренные
больше, чем для титаноцендихлорида или
отклонения разностей оптических плотностей при
цирконоцендихлорида, но вид полосы поглощения
разных составах смесей соизмеримы с величиной
сходен для всех исследованных металлоценов.
ошибки измерений и близки к нулю (рис. 3а, б, 4).
Спектр стирола характеризуется полосами
Только для полосы поглощения 203 нм (рис. 3б, 4)
поглощения с λmax = 205 нм (переход σ-π*) и λmax =
величина ΔD несколько превышает ошибку
245 нм (переход π-π*).
определения.
Путем последовательного кратного разбавления
В среде этанола для полосы поглощения 298 нм,
приготовленных растворов и измерений их
в интенсивность которой определяющий вклад
оптических плотностей были получены калибро-
вносит Cp2TiCl2, наблюдается существенное
вочные зависимости оптической плотности от
отклонение значения ΔD от аддитивности при
концентрации для металлоценов и мономеров для
эквимольном составе смеси в область положитель-
выбранных длин волн. В качестве последних были
ных значений. В полосе перехода σ-π* стирола
взяты значения длин волн максимумов поглощения
наблюдаются сильные измеренные отклонения
металлоценов: 298 и 262 нм в среде CCl4; 298, 262
разностей оптических плотностей при разных
и
203 нм в среде этилового спирта. Следует
составах смесей с максимальным значением при
отметить, что зависимости оптической плотности
эквимольном составе смеси в области отрицатель-
растворов металлоценов и мономеров от кон-
ных значений ΔD. Следовательно, в полярном
центрации подчиняются закону Бугера-Ламберта-
растворителе (этаноле) наблюдается синхронное
Бера для всех полос поглощения, за исключением
достоверное значительное отклонение от правила
λ = 203 нм для растворов металлоценов в этаноле;
аддитивности как в полосе поглощения Cp2TiCl2
экстраполирование значения оптической плот-
при 298 нм, так и в полосе σ-π*-перехода стирола
ности раствора металлоценов в этаноле к нулевой
(203 нм) с максимумом при эвимолярном соотно-
концентрации заметно отличается от
0.
Из
шении титаноцендихлорида и стирола в смеси. Это
полученных калибровочных зависимостей были
свидетельствует о наличии донорно-акцепторного
рассчитаны значения молярных коэффициентов
взаимодействия между молекулой титаноценди-
экстинкции, которые представлены в таблице.
хлоридом и стиролом в разбавленной полярной
среде и существовании комплекса состава 1:1.
Как можно видеть, основной вклад в
поглощение при 298 нм вносят металлоцены, а при
Похожий характер имеют зависимости ΔD от
203 нм - мономеры, что дает возможность оценить
состава смеси для цирконо- (рис. 3а, б, 2, 5) и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОЦЕНДИХЛОРИДОВ ТИТАНА
623
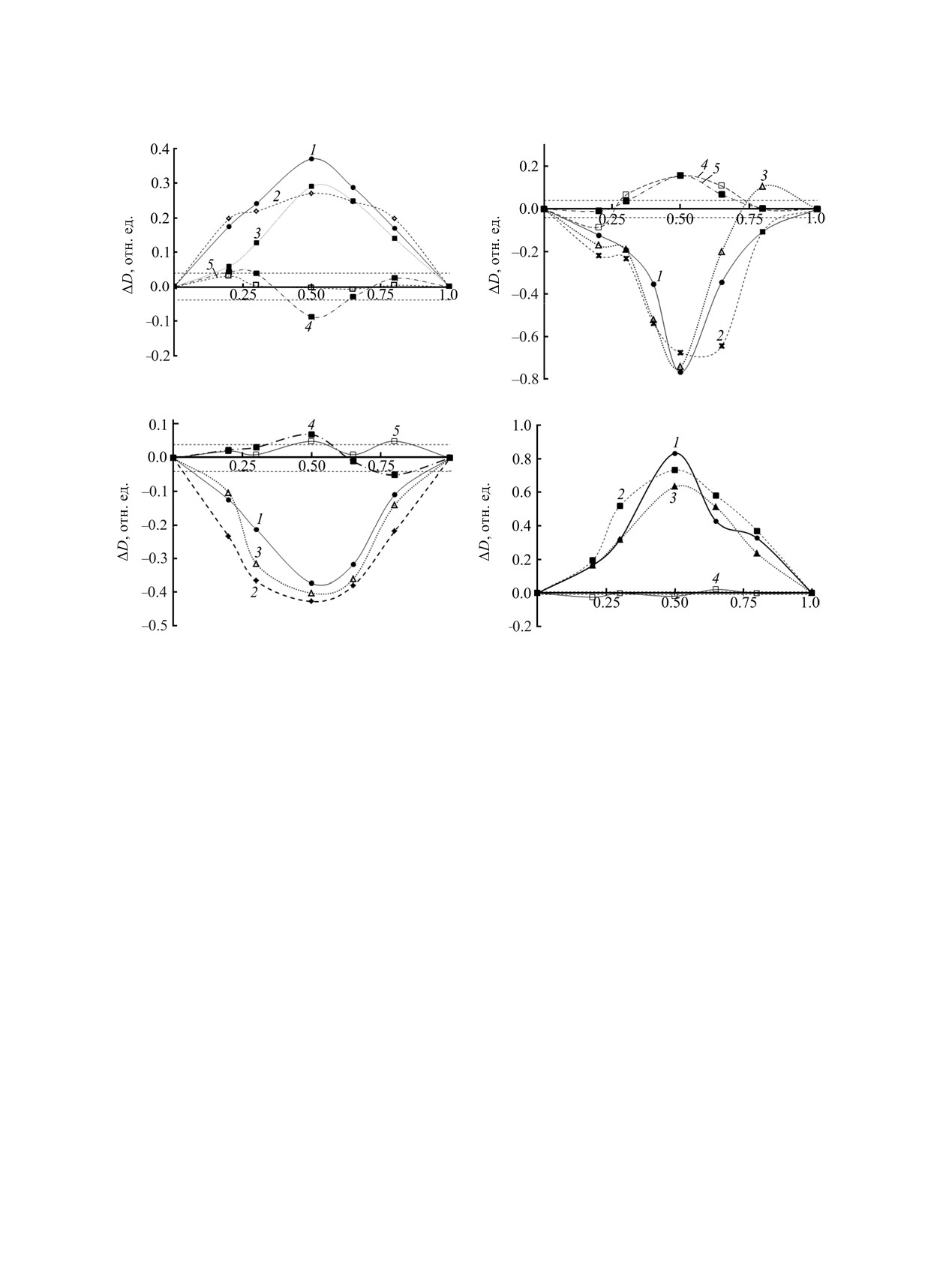
(а)
(б)
Мол. доля, отн. ед.
Мол. доля, отн. ед.
(в)
(г)
Мол. доля, отн. ед.
Мол. доля, отн. ед.
Рис. 3. Зависимость разности экспериментальной и рассчитанной оптических плотностей от мольной доли гафно- (1),
цирконо- (2) и титаноцендихлорида (3) в растворе для смеси со стиролом (а, б) или метилметакрилатом (в, г) λ = 298 (а, в),
203 (б, г). [металлоцен]0+[мономер]0 = 1×10-3 (а, в), 1×10-4 моль/л (б, г); растворитель - СCl4 (4, 5), этанол (1-3). Пунктиром
выделена область погрешности определения ΔD.
гафноцендихлоридов (рис. 3, 1), хотя им присущи
Известно, что полярные среды способствуют
и некоторые особенности. Так, в случае Cp2ZrCl2
образованию донорно-акцепторных комплексов[8].
экстремумы менее выражены и не так сильно
Для стирола это было показано на примере его
зависят от состава смеси, чем для соединения
взаимодействия с SnCl4 [9]. Авторы отмечали, что
титана; у соединения гафния зависимости носят
в этом взаимодействии участвует двойная связь
промежуточный (между Cp2TiCl2 и Cp2ZrCl2)
стирола. Но нужно заметить, что в случае
характер. Важно отметить, что для всех трех
полистирола, в котором двойных связей ничтожно
соединений знак отклонения величины ΔD
мало, взаимодействие также имеет место, но
одинаков для всех исследованных длин волн, что
затрагивает π-электроны бензольного кольца.
свидетельствует о сходной природе донорно-
Важно отметить, что комплекс металлоцен-
акцепторного взаимодействия. Таким образом,
стирол имеет состав
1:1 и поэтому может
только в полярной среде (этанол) проявляется
существовать как несимметричный ассоциат и,
донорно-акцепторное взаимодействие между
следовательно, он по природе полярен (рис. 3а, б).
молекулами металлоцендихлоридов и стирола.
Это, в свою очередь, означает, что в полярной
среде будет усиливаться формирование донорно-
Интересно, что небольшое достоверное отклоне-
акцепторного комплекса эквимольного состава.
ние величины ΔD наблюдается для взаимодействия
металлоцендихлоридов со стиролом и в среде CCl4
В случае взаимодействия метилметакрилата с
(рис. 3б, 4, 5), но оно противоположно по знаку
металлоцендихлоридами можно видеть, что
отклонению, наблюдаемому в этаноле.
характер изменения ΔD в зависимости от состава
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
624
ПУЗИН и др.
Схема 1.
H2
C
CH
Cl
Cl
Cl
HC
M
O=C
M
M
CH2
O
Cl
Cl
Cl
A
Б
В
Cl
M
Cl
Cl
M
H O=C
H
Cl
C⎯O
O
H
O
Г
Д
смеси иной (рис. 3в, г). Так, для сигнала, основной
внутрисферный комплекс типа А или Б (схема 1).
вклад в который вносят металлоцены (298 нм),
Во-вторых, могут затрагиваться циклопентади-
наблюдается сильное отрицательное отклонение в
енильные кольца металлоцена с образованием
полярном этаноле (рис. 3в), хотя в тетрахлориде
внешнесферных комплексов типа В-Д. В квантово-
углерода отклонения величины ΔD находятся в
механическом исследовании
[4] отмечено, что
пределах ошибки определения.
предпочтительным направлением взаимодействия
металлоценов со стиролом и метилметакрилатом
Со стороны метилметакрилата во взаимо-
является формирование «слабых внешнесферных
действии, как видно из рис. 3г, участвует сопря-
комплексов»,
отличающихся
«небольшими
женная электронная система С=С-С=О (203 нм),
положительными значениями ΔН298» (структуры
причем это также наблюдается лишь в среде
В-Д, схема
1), что делает их образование
этанола; при этом наиболее значительное откло-
возможным при изменении внешних факторов. С
нение величины ΔD наблюдается при соотношении
другой стороны, образование внутрисферного
металлоцен:метилметакрилат = 1:1.
комплекса типа А или Б также возможно в
Из представленных результатов следует, что
определенных условиях. При этом, как показали
взаимодействие металлоценов с метилметакри-
расчеты, различия в значениях ΔН298 образования
латом и стиролом коренным образом различается.
таких структур не превышают 30-40 кДж. Каких-
Прежде всего, знаки этих обменных процессов
либо экспериментальных доказательств, подтвер-
противоположны; это говорит о том, что роль
ждающих образование комплексов, автор не
металлоцендихлоридов в донорно-акцепторном
представил. К тому же, расчеты проводились для
взаимодействии со стиролом и метилметакрилатом
газовой фазы и не учитывали влияния среды на
разная: в первом случае они, скорее всего,
взаимодействие.
акцепторы, а во втором - доноры электронов. В
Ранее спектрально было обнаружено [3], что
случае стирола отклонения величины ΔD гораздо
при взаимодействии ферроцена с малеиновым
меньше, чем для метилметакрилата, что связано,
ангидридом преимущественно затрагивается одно
видимо, с различной полярностью участвующих в
из циклопентадиенильных колец. Сходные резуль-
комплексообразовании функциональных групп
таты были получены и для системы металлоцены -
мономеров.
акрилонитрил
[10].
Учитывая это, можно
В металлоцендихлоридах взаимодействие
предположить, что наиболее вероятное строение
может затрагивать несколько центров. Во-первых,
переходного комплекса отражается структурами В
это атом металла, при этом формируется
(для стирола) и Г (для метилметакрилата).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОЦЕНДИХЛОРИДОВ ТИТАНА
625
Таким образом, установлено, что в полярных
составляли: для области 298 нм ±0.01, для области
средах имеет место донорно-акцепторное взаимо-
203 и 262 нм ±0.04.
действие между молекулами металлоцендихло-
ФОНДОВАЯ ПОДДЕРЖКА
ридов, стирола и метилметакрилата и образование
комплексов эквимольного состава. Показано, что
Работа выполнена при финансовой поддержке
роль металлоцендихлорида в донорно-акцепторном
Российского фонда фундаментальных исследований
взаимодействии с винильными соединениями
(проект 16-33-50102-мол_нр).
разная и определяется строением последних.
КОНФЛИКТ ИНТЕРЕСОВ
Обсуждены и предложены вероятные структуры
промежуточных комплексов.
Авторы заявляют об отсутствии конфликта
интересов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
СПИСОК ЛИТЕРАТУРЫ
Стирол и метилметакрилат очищали много-
1. Щепалов А.А., Гришин Д.Ф. // Высокомол. соед. (А).
кратным промыванием 10%-ным раствором NaOH,
2008. Т. 50. № 4. С. 599; Shchepalov A.A., Grishin D.F. //
затем промывали дистиллированной водой до
Polymer Sci. (A). 2008. Vol. 50. N 4. P. 382. doi
нейтральной реакции по фенолфталеину. Промы-
10.1134/S0965545X08040044
тые мономеры сушили безводным сульфатом
2. Сигаева Н.Н., Юмагулова Р.Х., Насретдинова Р.Н.,
магния и дважды перегоняли в вакууме при
Фризен А.К., Колесов С.В. // Кинетика и катализ.
остаточном давлении
70 мм рт. ст. Отбирали
2009. Т. 50. № 2. С. 182; Sigaeva N.N., Yumagulova R.Kh.,
фракции, кипящие при 69 (метилметакрилат) и 48°С
Nasretdinova R.N., Frizen A.K., Kolesov S.V. // Kinetics
(стирол); плотность метилметакрилата 0.945 г/см3,
and Catalysis. 2009. Vol. 50. N 2. Р. 168. doi 10.1134/
стирола - 0.906 г/см3 при 20°С.
S0023158409020049
3. Пузин Ю.И., Гафуров М.А. // ЖОХ. 2015. Т. 85.
Металлоцендихлориды титана, циркония и
№ 10. С. 1704; Puzin Yu.I., Gafurov M.A. // Russ. J.
гафния использовали коммерческие марки ХЧ
Gen. Chem. 2015. Vol. 85. N 10. Р. 2334. doi 10.1134/
(Aldrich). Растворители после очистки обще-
S1070363215100187
принятыми методами [11] по своим характерис-
4. Колесов С.В., Насибуллин И.И., Фризен А.К.,
тикам соответствовали литературным данным.
Сигаева Н.Н., Галкин Е.Г. // Высокомол. соед. (Б).
2015. Т. 57. № 2. С. 83; Kolesov S.V., Nasibullin I.I.,
УФ спектры регистрировали на спектрофото-
Frizen A.K., Sigaeva N.N., Galkin E.G. // Polymer Sci.
метре Shimadzu UV-3100. Использовали кварцевые
(B).
2015. Vol.
57. N
2. P.
71. doi
10.1134/
кюветы толщиной 1 см объемом 3 мл. Готовили
S1560090415020062
растворы металлоцендихлорида и мономера в
5. Пузин Ю.И., Прокудина Е.М., Юмагулова Р.Х.,
соответствующих растворителях с концентрацией
Муслухов Р.Р., Колесов С.В.
// Докл. АН.
2002.
1×10-3 моль/л. Путем кратных разбавлений
Т.
386.
№ 1. С. 69; Puzin Yu.I., Prokudina E.M.,
Yumagulova R.Kh., Muslukhov R.R., Kolesov S.V. //
полученных растворов получали растворы для
Doklady Phys. Chem. 2002. Vol. 386. N 1-3. Р. 211.
калибровочных измерений, а путем кратных
doi 10.1023/A:1020343820445
смешений - растворы для изомолярных серий. По
6. Шлефер Г.Л. Комплексообразование в растворах.
калибровочным
зависимостям
оптической
М.; Л.: Химия, 1964. 378 с.
плотности D от концентрации раствора (в случае
7. Рабек Я. Экспериментальные методы в химии
подчинения системы закону Бугера-Ламберта-
полимеров. М.: Мир, 1983. Ч. 1. 384 с.
Бера) рассчитывали молярный коэффициент
8. Лейдлер К. Кинетика органических реакций. М:
экстинкции соединения при заданной длине волны.
Мир,1966. 346 с.
В методе изомолярных серий, оставляя суммарную
9. Богомолова Т.Б., Гантмахер А.Р., Людвиг Е.Б. //
молярную концентрацию растворов постоянной,
Высокомол. соед. (А). 1972. Т. 14. № 10. С. 2210.
10. Пузин Ю.И., Гафуров М.А., Голованов А.А., Куна-
определяли отклонение оптической плотности ΔD
фин Р.Г., Смольникова Т.В. // Баш. хим. ж. 2016.
растворов смеси от величины суммы оптических
Т. 23. № 2. С. 54.
плотностей индивидуальных компонентов донора
11. Беккер Х., Беккерт Р., Бергер В., Гевальд К., Генц Ф.,
и акцептора, рассчитываемой по правилу
Глух Р., Домшке Г., Зайлер Э., Майер Р., Мец П.,
аддитивности. По графику зависимости ΔD от
Мюллер К., Пафель Д., Фангхэнель Э., Фауст Ю.,
мольного соотношения компонентов смеси для
Фишер М., Хабихер В., Шветлик К., Шмидт Г.,
серии изомолярных растворов оценивали состав
Шольберг К., Цеппенфельд Г. Органикум. М.: Мир,
комплекса. Значения погрешности измерений
2008. Т. 2. 488 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
626
ПУЗИН и др.
Interaction of Titanium, Zirconium and Hafnium Metallocene
Dichlorides with Styrene and Methyl Methacrylate
in Media of Different Polarity
Yu. I. Puzina, *, E. M. Zakharovab, P. Yu. Puzina, B. N. Mastobaeva, and A. V. Pimenovc
a Ufa State Petroleum Technological University, ul. Kosmonavtov 1, Ufa, 450062 Russia
*e-mail: ppuziny@mail.ru
b Ufa Institute of Chemistry, Russian Academy of Sciences, Ufa, Russia
c UGMK-Holding Ltd, Ural Mining and Metallurgical Company, Verkhnyaya Pyshma, Russia
Received September 6, 2018; revised September 16, 2018; accepted September 17, 2018
Using the isomolar series method, a UV spectral study of the interaction of titanium, zirconium and hafnium
metallocene dichlorides with styrene or methyl methacrylate in media of different polarity (carbon tetrachloride,
ethanol) was carried out. Formation of weak intermediate complexes takes place, and the polarity of the solvent
significantly affects the process of their formation. It was found for the first time that charge transfer complexes
between metallocene dichlorides and styrene are formed only in polar ethanol. Possible structures of
intermediate complexes were proposed.
Keywords: styrene, methyl methacrylate, titanocene dichloride, zirconocene dichloride, hafnocene dichloride,
donor-acceptor type complex
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019