ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 4, с. 643-648
ПИСЬМА В
РЕДАКЦИЮ
УДК 547.816:547.859:547.834
СИНТЕЗ НОВЫХ КОНДЕНСИРОВАННЫХ
ПРЕДСТАВИТЕЛЕЙ ТИЕНО[3,2-d]ПИРИМИДИНА НА
ОСНОВЕ ПРОИЗВОДНОГО ТИЕНО[3,2-d][1,3]ОКСАЗИНА
© 2019 г. В. В. Дабаева*, М. Р. Багдасарян, Е. Г. Пароникян, Ш. Ш. Дашян
Институт тонкой органической химии имени А. Л. Мнджояна Научно-технологического центра органической
и фармацевтической химии Национальной академии наук Республики Армении,
пр. Азатутян 26, Ереван 0014, Армения
*e-mail: valya.dabayeva@mail.ru
Поступило в Редакцию 20 сентября 2018 г.
После доработки 20 сентября 2018 г.
Принято к печати 27 сентября 2018 г.
Разработан метод синтеза новых конденсированных аминов - производных тиено[3,2-d]пиримидина - из
соответствующего хлорида и разнообразных аминов. Получены изомерные триазоло[4,3-с]- и -[1,5-с]-
пиримидины. Установлено отсутствие азидотетразольного превращения конденсированного тетразоло-
[1,5-с]пиримидина.
Ключевые слова: конденсированные тиено[3,2-d]пиримидины, перегруппировка Димрота, триазоло-
пиримидины, тетразолопиримидины
DOI: 10.1134/S0044460X1904022X
Производные тиено[3,2-d]пиримидина обладают
производное триазоло[4,3-с]пиримидина 5, а во
широким спектром биологической активности, о
втором - [1,5-с]пиримидина 6 (схема 2), в то время
чем свидетельствуют литературные данные [1-3].
как из аналогичного соединения с метилсуль-
Исследование биологических свойств ранее
фанильной группой в пиримидиновом кольце в
синтезированных нами новых конденсированных
обоих случаях было получено производное
производных тиено[3,2-d]пиримидина показало
триазоло[4,3-с]пиримидина [6].
высокую биологическую активность последних [4].
Данные спектров ЯМР
1H однозначно
В продолжение работ по изучению свойств этого
указывают на различие в строении соединений 5 и
класса соединений на основе 2,8,8-триметил-7,10-
6. Сигнал триазольного протона соединения
5
дигидро-4H,8H-пирано[3",4":5,6]пиридо[3',2':4,5]-
проявляется при 9.52 м. д., в то время как синглет
тиено[3,2-d][1,3]оксазин-4-она 1 [5] было получено
протона триазоло[1,5-с]пиримидина 6 смещен в
производное пиримидин-4-она 2, взаимодействие
более сильное поле, что обусловлено экрани-
которого с хлорокисью фосфора приводит к 4-
рующим эффектом пиримидинового цикла
[7].
хлорпроизводному
3. Присутствие диэтиламина
Изомеры различаются по точкам плавления, проба
значительно повышает выход продукта реакции.
смешения их сопровождается значительной депрес-
Дальнейшее замещение атома хлора различными
сией температуры плавления. Кипячение изомера 5
аминами протекало гладко и позволило получить
в муравьиной кислоте приводит к изомеру
6.
амины 4а-м с высоким выходом (схема 1).
Вероятно, в обоих случаях первоначально
С целью дальнейшего изучения этого ряда
образуется соединение 5, в котором далее под
соединений были проведены реакции гидразинил-
действием кислоты происходит разрыв связи C-N
производного
4к с триэтиловым эфиром орто-
пиримидинового кольца и обращение триазольного
муравьиной кислоты и муравьиной кислотой. Как и
цикла в соответствии с перегруппировкой
предполагалось, в первом случае образовалось
Димрота. Обработкой гидразинилпроизводного 4к
643
644
ДАБАЕВА и др.
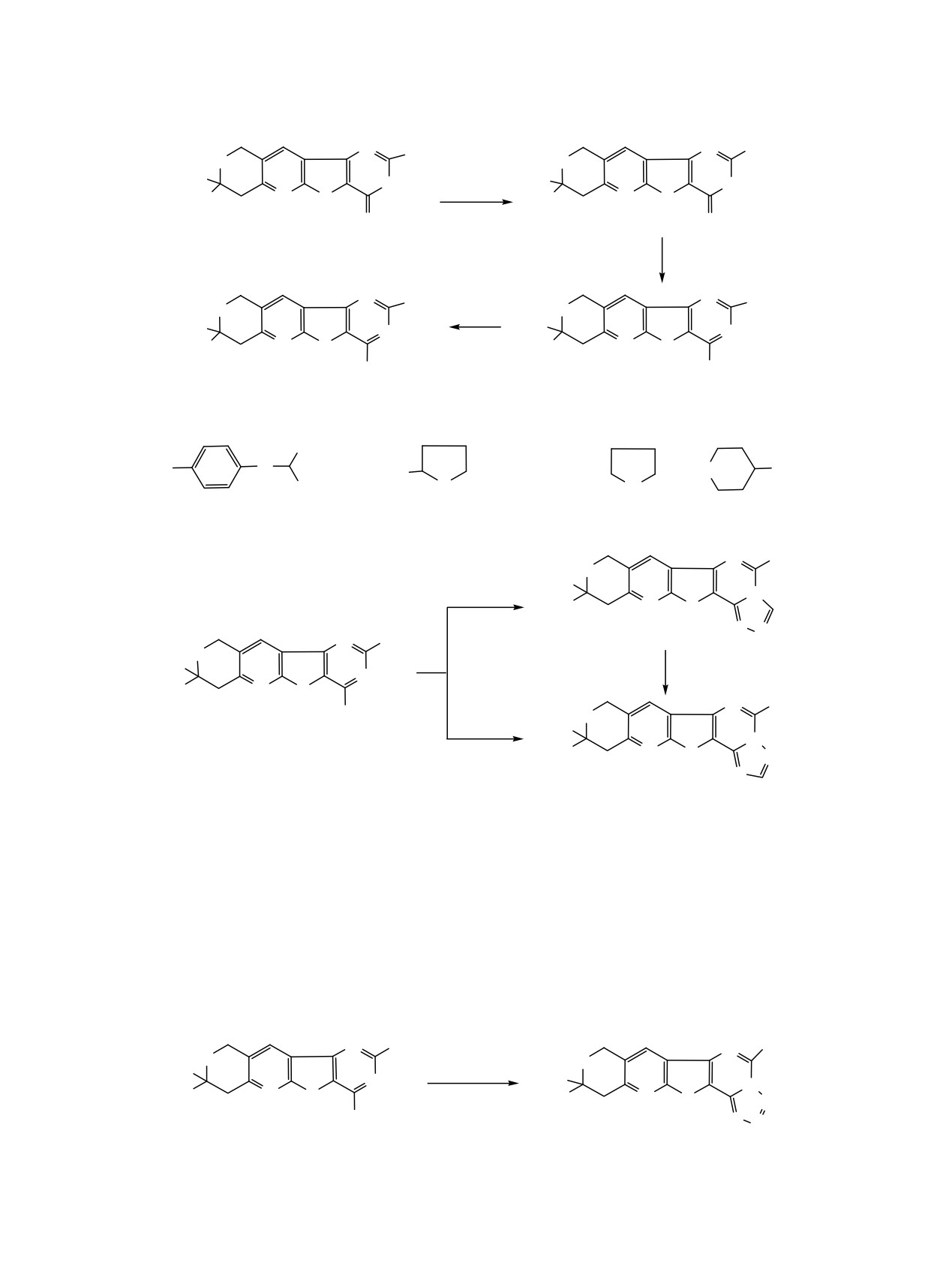
Схема 1.
N
N CH3
CH3
O
O
CH
3
CH3
O
NH4OH
NH
N S
N S
CH3
CH
3
O
2
O
1
POCl3
N
N
CH3
CH3
O
O
амины
CH3
CH3
N
N
N S
N S
CH3
CH3
R
Cl
4a-м
3
R = NHC4H9 (а), NHC5H11 (б), NHiC5H11 (в), NHCH2C6H5 (г), NH(CH2)2C6H5 (д),
NH(CH2)2OH (е), NHCH(CH3)C6H5 (ж),
CH3
(з),
(и),
NHNH2 (к),
NHCH2
O
NHCH2
(л), N
CH3
(м).
CH3
O
N
Схема 2.
N CH3
O
H3C
HC(OC2H5)3
N
H3C
N S
N N
N
CH3
5
O
H3C
HCOOH
N
H3C
N S
N CH
3
4к
NHNH2
O
HCOOH
H3C
N
H3
C
N S
N
6
N
водным раствором
нитрита натрия получен
Отсутствие в спектре ЯМР 1H (ДМСО-d6) двойного
тетразоло[1,5-с]пиримидин 7 (схема 3).
набора сигналов также свидетельствует о том, что
и в растворе вещество находится в тетразольной
В то время как тетразолы, аннелированные с
форме, что, по всей вероятности, обусловлено
гетероциклами, обладают склонностью к азидо-
присутствием метильной группы в пиримидиновом
тетразольным превращениям [8], в ИК спектре
кольце.
соединения 7 отсутствует полоса поглощения в
области 2140-2160 см-1 и обнаруживается харак-
2,8,8-Триметил-7,10-дигидро-8H-пирано-
терный сигнал тетразольного кольца при 1100 см-1.
[3",4":5',6']пиридо[3'2':4,5]тиено[3,2-d]пирими-
Схема 3.
N
CH3
N CH3
O
CH3COOH,
O
H3C
NaNO2
N
H3C
N
H3C
N S
H3C
N S
N
NHNH2
7
N N
4к
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ НОВЫХ КОНДЕНСИРОВАННЫХ ПРЕДСТАВИТЕЛЕЙ
645
дин-4(3H)-он (2). Смесь 3.0 г (0.01 моль) 2,8,8-
64.15; H
6.82; N
15.84; S
9.10. C19H24N4OS.
триметил-7,10-дигидро-4H,8H-пирано[3'',4'':5',6']-
Вычислено, %: С 64.01; H 6.79; N 15.72; S 8.99.
пиридо[3'2':4,5]тиено[3,2-d][1,3]оксазин-4-она
1,
N-Пентил-2,8,8-триметил-7,10-дигидро-8H-
30 мл диоксана и 16 мл 25%-ного водного аммиака
пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-d]-
кипятили
2 ч. После охлаждения кристаллы
пиримидин-4-амин (4б). Выход 2.1 г (58%), т. пл.
отфильтровывали, промывали водой, сушили и
141-142°C, Rf = 0.60 (петролейный эфир-этил-
перекристаллизовывали из этанола. Выход 2.1 г
ацетат, 1:4). Спектр ЯМР 1H, δ, м. д.: 0.92-0.98 м
(69%), т. пл.
318-319°C, Rf
=
0.51 (пиридин-
(3H, CH3), 1.33 с (6H, 2CH3), 1.34-1.44 м (4H,
бутанол, 1:1). ИК спектр, ν, см-1: 3110 (NH), 1680
CH2CH2CH3), 1.62-1.72 м (2H, CH2C3H7), 2.52 с
(С=O), 1620, 1594, 1552 (Ar, C=C, С=Nсопр). Спектр
(3H, =CCH3), 2.94 с (2H, CH2), 3.52 т. д (2H, NCH2,
ЯМР 1H, δ, м. д.: 1.33 с (6H, CH3), 2.54 с (3H, CH3),
J = 7.2, 5.5 Гц), 4.90 с (2H, OCH2), 7.30 уш. т (1H,
2.95 с (2H, CH2), 4.90 с (2H, OCH2), 8.26 с (1H,
NH, J = 5.5 Гц ), 8.25 с (1H, =CH). Найдено, %׃ C
=CH), 12.90 уш. с (1H, NH). Найдено, %׃ C 59.66; H
64.79; H
7.15; N
15.19; S
8.73. C20H26N4OS.
5.18; N 14.03; S 10.69 C15H15N3O2S. Вычислено, %:
Вычислено, %: С 64.85; H 7.07; N 15.12; S 8.65.
С 59.78; H 5.02; N 13.94; S 10.64.
2,8,8-Триметил-N-(3-метилбутил)-7,10-
2,8,8-Триметил-4-хлор-7,10-дигидро-8H-
дигидро-8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]-
пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-d]-
тиено[3,2-d]пиримидин-4-амин (4в). Выход 2.0 г
пиримидин (3). Смесь 3.0 г (0.01 моль) соединения
(56%), т. пл. 125-126°C, Rf = 0.61 (петролейный
2, 2 мл диэтиламина и 30 мл хлорокиси фосфора
эфир-этилацетат, 1:4). Спектр ЯМР 1H, δ, м. д.:
нагревали
4 ч при
105°С. Избыток хлорокиси
0.98 д [6H, CH(CH3)2, J = 6.5 Гц], 1.33 с (6H, CH3),
фосфора отгоняли в вакууме, к остатку при
1.51-1.60 м (2H, CHCH2), 1.65-1.79 м (1H, CHCH2),
охлаждении прибавляли
20 мл ледяной воды.
2.54 с (3H, CH3), 2.94 с (2H, CH2), 3.56 т. д (2H,
Смесь нейтрализовали 25%-ным водным раство-
NCH2, J = 7.2, 5.7 Гц), 4.90 с (2H, OCH2), 7.36 уш. с
ром аммиака, осадок отфильтровывали, промывали
(1H, NH), 8.30 с (1H, =CH). Найдено, %׃ C 64.70; H
водой, сушили и перекристаллизовывали из
7.10; N 15.33; S 8.54. C20H26N4OS. Вычислено, %: С
этанола. Выход 2.8 г (89%), т. пл. 201-202°C, Rf =
64.83; H 7.07; N 15.12; S 8.65.
0.65 (этилацетат-гексан, 1:1). ИК спектр, ν, см-1:
N-Бензил-2,8,8-триметил-7,10-дигидро-8H-
1600, 1560, 1520 (Ar, C=C, С=Nсопр). Спектр ЯМР
1H, δ, м. д.: 1.32 с (6H, CH3), 2.80 с (3H, CH3), 2.98 с
пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-d]-
пиримидин-4-амин (4г). Выход 2.3 г (59%), т. пл.
(2H, CH2), 4.94 с (2H, OCH2), 8.41 с (1H, =CH).
210-211°C, Rf
=
0.59 (петролейный эфир-
Найдено, %׃ C 56.42; H 4.48; Cl 11.32; N 13.25; S
10.12. C15H14ClN3OS. Вычислено, %: С 56.33; H
этилацетат, 1:4). Спектр ЯМР 1H, δ, м. д.: 1.33 с
(6H, CH3), 2.54 с (3H, CH3), 2.95 с (2H, CH2), 4.78 д
4.41; Cl 11.09; N 13.14; S 10.03.
(2H, NCH2, J = 5.8 Гц), 4.91 с (2H, OCH2), 7.15-7.22
Общая методика получения аминов (4а-м).
м (1H, Hп, Ph), 7.24-7.30 м (2H, Hм, Ph), 7.36-7.41 м
Смесь
0.01 моля соединения
3 и
0.02 моля
(2H, Hо, Ph), 7.96 уш. т (1H, NH, J = 5.8 Гц ), 8.27 с
соответствующего амина в 50 мл абсолютного
(1H, =CH). Найдено, %׃ C 67.80; H 5.64; N 14.41; S
этанола кипятили
6 ч. После удаления
8.19. C22H22N4OS. Вычислено, %: С 67.67; H 5.68;
растворителя к остатку добавляли 20 мл воды.
N 14.35; S 8.21.
Кристаллы отфильтровывали, промывали водой,
2,8,8-Триметил-N-(2-фенилэтил(-7,10-дигидро-
сушили и перекристаллизовывали из этанола.
8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-
N-Бутил-2,8,8-триметил-7,10-дигидро-8H-
d]пиримидин-4-амин
(4д). Выход 2.4 г (62%),
пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-d]
т. пл. 182-183°C, Rf = 0.55 (петролейный эфир-
пиримидин-4-амин (4а). Выход 2.1 г (59%), т. пл.
этилацетат, 1:4). Спектр ЯМР 1H, δ, м. д.: 1.33 с
165-166°C, Rf
=
0.58 (петролейный эфир-
(6H, CH3), 2.56 с (3H, CH3), 2.94 с (2H, CH2), 2.98 т
этилацетат, 1:4). Спектр ЯМР 1H, δ, м. д.: 0.99 т
(2H, CH2Ph, J = 7.3 Гц ), 3.76 т. д (2H, NCH2, J =
(3H, CH3, J = 7.3 Гц), 1.33 с (6H, CH3), 1.37-1.50 м
7.3, 5.5 Гц), 4.91 с (2H, OCH2), 7.11-7.19 м (1H, Ph),
(2H, CH2CH3), 1.60-1.70 м (2H, CH2C2H5), 2.52 с
7.21-7.28 м (4H, Ph), 7.46 уш. т (1H, NH, J = 5.5 Гц),
(3H, =CCH3), 2.95 с (2H, CH2), 3.54 т. д (2H, NCH2,
8.26 с (1H, =CH). Найдено, %׃ C 68.35; H 5.83; N
J = 7.3, 5.5 Гц), 4.90 с (2H, OCH2), 7.30 уш. т (1H,
13.80; S 7.93. C23H24N4OS. Вычислено, %: С 68.33;
NH, J = 5.5 Гц), 8.25 с (1H, =CH). Найдено, %׃ C
H 5.90; N 13.84; S 7.99.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
646
ДАБАЕВА и др.
2-[(2,8,8-Триметил-7,10-дигидро-8H-пирано-
4-Гидразинил-2,8,8-триметил-7,10-дигидро-
[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-d]пири-
8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-
мидин-4-ил(амино]этанол (4е). Выход 1.8 г (52%),
d]пиримидин (4к). Выход 2.4 г (75%), т. пл. 282-
т. пл. 215-216°C, Rf = 0.61 (петролейный эфир-
283°C, Rf
=
0.51 (пиридин-бутанол,
1:1). ИК
этилацетат, 1:1). Спектр ЯМР 1H, δ, м. д.: 1.33 с
спектр, ν, см-1: 1600, 1580, 1560 (C=CAr, C=C,
(6H, CH3), 1.62 д (3H, CHCH, J = 7.0 Гц), 2.51 с
C=Nсопр). Спектр ЯМР 1H, δ, м. д.: 1.33 с (6H, CH3),
(3H, CH3), 2.95 с (2H, CH2), 4.90 с (2H, OCH2), 5.65
2.49 с (3H, CH3), 2.95 с (2H, CH2), 4.55 м (2H, NH2),
к (1H, CH, J = 7.1 Гц), 7.13-7.19 м (1H, Hп, Ph), 7.23-
4.90 с (2H, OCH2), 8.21 с (1H, =CH), 8.63 м (1H,
7.30 м (2H, Hм, Ph), 7.42 м (2H, Hо, Ph), 7.78 уш. д
NH), 4.90 с (2H, OCH2). Найдено, %׃ C 57.35; H
(1H, NH, J = 7.0 Гц), 8.26 с (1H, =CH). Найдено, %׃
5.50; N 22.28; S 10.29. C15H17N5OS. Вычислено, %:
C 59.38; H 5.78; N 16.40; S 9.27. C17H20N4O2S.
С 57.12; H 5.43; N 22.21; S 10.17.
Вычислено, %: С 59.28; H 5.85; N 16.27; S 9.31.
2,8,8-Триметил-4-(пирролидин-1-ил)-7,10-
дигидро-8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]-
2,8,8-Триметил-N-(1-фенилэтил)-7,10-дигидро-
тиено[3,2-d]пиримидин (4л). Выход 2.1 г (59%),
8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]тиено[3,2-
т. пл. 171-172°C, Rf = 0.62 (петролейный эфир-
d]пиримидин-4-амин (4ж). Выход 2.1 г (51%),
этилацетат, 1:1). Спектр ЯМР 1H, δ, м. д.: 1.33 с
т. пл. 201-202°C, Rf = 0.59 (петролейный эфир-
(6H, CH3), 2.03-2.11 м (4H, CH2), 2.50 с (3H, CH3),
этилацетат, 1:1). Спектр ЯМР 1H, δ, м. д.: 1.33 с
2.95 с (2H, CH2), 3.84-3.93 м (4H, CH2NCH2), 4.90 с
(6H, CH3), 1.62 д (3H, CHCH, J = 7.0 Гц), 2.51 с
(2H, OCH2), 8.27 с (1H, =CH). Найдено, %׃ C 64.29;
(3H, CH3), 2.95 с (2H, CH2), 4.90 с (2H, OCH2), 5.65
H 6.34; N 15.92; S 9.20. C19H22N4OS. Вычислено, %:
к (1H, CH, J = 7.1 Гц), 7.13-7.19 м (1H, Hп, Ph),
С 64.38; H 6.26; N 15. 81; S 9.05.
7.23-7.30 м (2H, Hм, Ph), 7.42 м (2H, Hо, Ph), 7.78
уш. д (1H, NH, J = 7.0 Гц), 8.26 с (1H, =CH). Найде-
2,8,8-Триметил-4-(4-метилпиперидин-1-ил)-
но,
%׃ C
68.35; H
5.69; N
13.97; S
7.98.
7,10-дигидро-8H-пирано[3'',4'':5',6']пиридо-
C23H24N4OS. Вычислено, %: С 68.29; H 5.98; N
[3'2':4,5]тиено[3,2-d]пиримидин (4м). Выход 2.2 г
13.85; S 7.93.
(57%), т. пл. 158-159°C, Rf = 0.62 (петролейный
эфир-этилацетат, 1:1). Спектр ЯМР 1H, δ, м. д.:
N-(4-Изопропилоксибензил﴿триметил-7,10-
1.01 д (3H, CH3, J = 6.5 Гц), 1.21-1.36 м (2H, CH2),
дигидро-8H-пирано[3'',4'':5',6']пиридо[3'2':4,5]-
1.33 с (6H, CH3), 1.73-1.87 м (3H, CHCH2), 2.54 с
тиено[3,2-d]пиримидин-4-амин (4з). Выход 2.2 г
(3H, =CCH3), 2.96 с (2H, CH2), 3.06-3.16 м (2H,
(50%), т. пл. 125-126°C, Rf = 0.58 (петролейный
NCH2), 4.71-4.80 м (2H, NCH2), 4.91 с (2H, OCH2),
эфир-этилацетат, 1:3). Спектр ЯМР 1H, δ, м. д.:
8.29 c (1H, =CH). ). Найдено, %׃ C 65.90; H 6.82; N
1.30 д [6H, CH(CH3)2, J = 6.0 Гц], 1.33 с (6H, CH3),
14.50; S 8.44. C21H26N4O6S. Вычислено, %: С 65.94;
2.56 с (3H, CH3), 2.95 с (2H, CH2), 4.51 септет (1H,
H 6.85; N 14.65; S 8.38.
OCH, J = 6.0 Гц), 4.69 д (2H, NCH2, J = 5.8 Гц), 4.91
5,10,10-Триметил-10,11-дигидро-8H-пирано-
с (2H, OCH2), 6.73-6.78 м (2H, Ph), 7.26-7.31 м (2H,
[3'',4'':5',6']пиридо[3'2':4,5]тиено[2,3-e][1,2,4]-
Ph), 7.89 уш. с (1H, NH), 8.30 с (1H, =CH). Найде-
триазоло[4,3-с]пиримидин
(5).
Смесь
3.1 г
но,
%׃ C
66.85; H
6.35; N
12.52; S
7.25.
(0.01 моль) соединения 4к и 20 мл триэтилового
C25H28N4O2S. Вычислено, %: С 66.94; H 6.29; N
эфира ортомуравьиной кислоты кипятили
6 ч.
12.49; S 7.15.
После охлаждения осадок отфильтровывали, про-
2,8,8-Триметил-N-(тетрагидрофуран-2-ил-
мывали водой, затем диэтиловым эфиром и
метил)-7,10-дигидро-8H-пирано[3'',4'':5',6']пи-
перекристаллизовывали из этанола. Выход 2.4 г
ридо[3'2':4,5]тиено[3,2-d]пиримидин-4-амин
(75%), т. пл. 222-223°C, Rf = 0.62 (пиридин-бутан-
(4и). Выход 2.0 г (51%), т. пл. 165-166°C, Rf = 0.61
1-ол, 1:2). ИК спектр, ν, см-1: 1620, 1600,
1570
(петролейный эфир-этилацетат, 1:3). Спектр ЯМР
(C=CAr, C=C, С=Nсопр). Спектр ЯМР 1H, δ, м. д.:
1H, δ, м. д.: 1.32 с (6H, CH3), 1.63-1.74 м (1H, CH2),
1.32 с (6H, CH3), 2.96 с (2H, CH2), 3.02 с (3H, CH3),
1.80-2.05 м (3H, CH2), 2.53 с (3H, CH3), 2.95 с (2H,
4.92 с (2H, OCH2), 8.29 с (1H, =CH), 9.52 с (1H,
CH2), 3.51-3.73 м (3H), 3.82-3.90 м и 4.09-4.18 м
триазол). Спектр ЯМР 13С, δС, м. д.: 20.3, 26.1 (2С),
(2H, NCH2CHOCH2), 4.90 с (2H, OCH2), 7.35 уш. т
42.8, 61.3, 70.8, 114.7, 125.4, 125.6, 126.5, 135.7,
(1H, NH, J = 5.6 Гц), 8.25 с (1H, =CH). Найдено, %׃
140.1, 144.6, 145.4, 154.5, 158.2. Найдено, %׃ C
C 62.52; H 6.35; N 14.43; S 8.21. C20H24N4O2S.
59.21; H 4.72; N 21.44; S 9.95. C16H15N5OS. Вычис-
Вычислено, %: С 62.47; H 6.29; N 14. 57; S 8.34.
лено, %: С 59.06; H 4.65; N 21.52; S 9.85.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
СИНТЕЗ НОВЫХ КОНДЕНСИРОВАННЫХ ПРЕДСТАВИТЕЛЕЙ
647
5,10,10-Триметил-10,11-дигидро-8H-пирано-
ИК спектры регистрировали на спектрометре
[3'',4'':5',6']пиридо[3'2':4,5]тиено[2,3-e][1,2,4]-
Nicolet Avatar 330 FT-IR в вазелиновом масле.
триазоло[1,5-с]пиримидин
(6). a. Смесь
3.1 г
Спектры ЯМР
1H и 13С снимали на приборе
(0.01 моль) соединения 4к и 15 мл муравьиной
Mercury Vх в растворе ДМСО-d6 с рабочими
кислоты кипятили 5 ч. После отгонки избытка
частотами
300 и
75.462 МГц соответственно,
муравьиной кислоты остаток обрабатывали
внутренний стандарт - ТМС. Элементный анализ
этанолом. Выпавшие кристаллы отфильтровывали,
проводили на приборе Elemental Analyzer Euro EA
промывали водой и перекристаллизовывали из
3000. Температуры плавления определяли на
этанола. Выход 2.5 г (78%), т. пл. 220-221°C, Rf =
микронагревательном столике Boёtius. Для ТСХ
0.59 (пиридин-бутан-1-ол, 1:2). ИК спектр, ν, см-1:
использовали пластины Silufol UV-254, проявитель -
1620, 1570, 1560 (C=CAr, C=C, С=N). Спектр ЯМР
пары иода.
1H, δ, м. д.: 1.29 с (6H, CH3), 2.95 с (2H, CH2), 3.01 с
(3H, CH3), 4.92 с (2H, OCH2), 8.39 с (1H, =CH), 8.75
КОНФЛИКТ ИНТЕРЕСОВ
с (1H, триазол). Найдено, %׃ C 59.21; H 4.72; N
21.55; S 9.73. C16H15N5OS. Вычислено, %: С 59.06;
Авторы заявляют об отсутствии конфликта
H 4.65; N 21.52; S 9.85.
интересов.
б. Смесь 3.2 г (0.01 моль) соединения 5 и 12 мл
СПИСОК ЛИТЕРАТУРЫ
муравьиной кислоты кипятили 3 ч. После удаления
избытка муравьиной кислоты остаток обраба-
1. Munchhof
M.J., Sobolev-Jaynes S.B. Pat. WO
тывали этанолом. Кристаллы отфильтровывали,
99.1999.24.440; C. A. 1999. Vol. 131. 5266z.
промывали водой и перекристаллизовывали из
2. Buchanan J.G., Graven D.A., Wighmtan R.H., Harnden M. //
этанола. Выход 2.6 г (81%), т. пл. 220-221°C.
J. Chem. Soc. Perkin Trans.1991. P. 195. doi 10.1039/
P19910000195
5,10,10-Триметил-10,11-дигидро-8H-пирано-
3. Webber L.G. Pat. 7202648 (1979); C. A. 1980. Vol. 92.
[3'',4'':5',6']пиридо[3'2':4,5]тиено[2,3-e]тетразоло-
35997q.
[1,5-с]пиримидин (7). К смеси 3.1 г (0.01 моль)
4. Дабаева В.В., Багдасарян М.Р., Норавян А.С.,
соединения 4к в 30 мл 50%-ной уксусной кислоты
Джагацпанян И.А., Назарян И.М., Акопян А.Г. //
при перемешивании по каплям прибавляли 1.4 г
Хим.-фарм. ж.
2015.
№ 9. С. 17; Dabaeva V.V.,
(0.02 моль) NaNO2, растворенного в 10 мл воды.
Bagdasaryan M.R., Noravyan A.S., Dzhagatspanyan I.A.,
Полученную смесь перемешивали при комнатной
Nazaryan I.M., Akopyan A.G. // Pharm. Chem. J. 2015.
температуре 12 ч, после чего осадок отфильт-
Vol. 49. N 9. P. 587. doi 10.1007/s11094-015-1334-5
ровывали, промывали водой и перекристаллизовы-
5. Дабаева И.И., Енокян Б.Д., Норавян А.С. // ХГС.
вали из этанола. Выход 2.7 г (81%), т. пл. 205-206°C,
1995.
№ 2. С. 250; Dabaeva V.V., Noravyan A.S.,
Rf = 0.59 (пиридин-бутан-1-ол, 1:1). ИК спектр, ν,
Enokyan B.D. // Chem. Heterocycl. Compd.
1995.
см-1: 1620, 1600, 1550 (C=CAr, C=C, С=N), 1165,
Vol. 31. P. 219. doi 10.1007/BF01169683
1150, 1100 (тетразол). Спектр ЯМР 1H, δ, м. д.: 1.36
6. Пароникян Е.Г., Дашян Ш.Ш. // ЖОХ. 2018. Т. 88.
c (6H, CH3), 3.01 c (2H, CH2), 3.23 c (3H, CH3), 4.97
С. 1302; Paronikyan E.G., Dashyan Sh.Sh. // Russ. J.
c (2H, OCH2), 8.43 c (1H, =CH). Спектр ЯМР 13С,
Gen. Chem. 2018. Vol. 88. P. 1623. doi 10.1134/
δC, м. д.: 19.4, 26.1 (2С), 42.9, 61.2, 70.8, 114.3,
S1070363218080121
124.6, 126.5, 127.3, 143.9, 146.1, 146.2, 156.1, 159.1.
7. Ионин Б.И., Ершов Б.А. // ЯМР-спектроскопия в
Найдено, %׃ C 55.30; H 4.25; N 25.71; S 9.86.
органической химии. Л.: Химия, 1967. С. 69.
C15H14N6OS. Вычислено, %: С 55.20; H 4.32; N
8. Lioux T., Gosselin G., Mathe Ch. // Eur. J. Org. Chem.
25.75; S 9.82.
2003. P. 3997. doi 10.1002/ejoc.200300274
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019
648
ДАБАЕВА и др.
Synthesis of New Fused Thieno[3,2-d]pyrimidines
Based on Thieno[3,2-d][1,3]oxazine Derivative
V. V. Dabaeva*, M. R. Bagdasaryan, E. G. Paronikyan, and Sh. Sh. Dashyan
A. L. Mndzhoyan Institute of Fine Organic Chemistry of the Scientific and Technological Center of Organic
and Pharmaceutical Chemistry of the National Academy of Sciences of the Republic of Armenia,
pr. Azatutyan 26, Yerevan 0014, Armenia
*e-mail: valya.dabayeva@mail.ru
Received September 20, 2018; revised September 20, 2018; accepted September 27, 2018
A method was developed for the synthesis of new fused amines, thieno[3,2-d]pyrimidine derivatives, starting
from the corresponding chloride and various amines. Isomeric triazolo[4,3-c]- and -[1,5-c]pyrimidines were
obtained. The absence of azidotetrazole transformation of fused tetrazolo[1,5-c]pyrimidine was revealed.
Keywords: fused thieno[3,2-d]pyrimidine, Dimroth rearrangement, triazolopyrimidines, tetrazolopyrimidines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 4 2019