ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 671-683
УДК 547.332;547.339.2;547.384;547.391.1;547.751
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО
АКТИВИРОВАННЫХ НИТРОЭТЕНОВ ИНДОЛЬНОГО
РЯДА
© 2019 г. Р. И. Байчуринa, А. А. Федорущенкоa, Н. И. Абоскаловаa, Л. В. Байчуринаb,
А. В. Фельгендлерb, С. В. Макаренкоa, *
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
*e-mail: kohrgpu@yandex.ru
b Военно-медицинская академия имени С. М. Кирова, Санкт-Петербург, Россия
Поступило в Редакцию 13 декабря 2018 г.
После доработки 13 декабря 2018 г.
Принято к печати 20 декабря 2018 г.
Синтезирована серия нитроэтенов индольного ряда, содержащих в гем-положении к нитрогруппе
сложноэфирную, ацетильную, бензоильную или нитрильную функцию, и изучено их строение с
использованием комплекса методов ЯМР 1Н, 13С{1H}, ИК и УФ спектроскопии.
Ключевые слова: индол, гем-этоксикарбонилнитроэтен, гем-ацетилнитроэтен, гем-бензоилнитроэтен,
гем-цианонитроэтен
DOI: 10.1134/S0044460X19050032
β-Нитростиролы, а также их фурановые и
ограничены отдельными методиками получения, а
тиофеновые аналоги, содержащие в гем-положении
также разрозненными спектральными характерис-
к нитрофункции сложноэфирную, ацильную или
тиками. Между тем, особенности строения нитро-
нитрильную группы, являются реакционно-
этенов индольного ряда, содержащих в гем-
способными веществами и удобными синтонами
положении к нитрофункции сложноэфирную,
для получения разнообразных линейных и цикли-
нитрильную или ацильную (ацетильную, бензоиль-
ческих структур [1-4], многие из которых (α-амино-
ную) группы, представляют несомненный интерес.
кислоты, α-аминокетоны, 1,2,3-триазолы, дигидро-
Известно, что синтез большинства (гет)-
фураны, дигидро-1,5-бензотиазепины и др.)
арилсодержащих геминально активированных
обладают практически полезными свойствами.
нитроэтенов путем конденсации альдегидов с
Вместе с тем, среди биологически активных
нитросодержащими СН-кислотами в присутствии
соединений важное место занимают структуры,
основных агентов не приводит к желаемому
содержащие фармакофорный индольный цикл
результату, а завершается образованием произ-
[5-9]. Так, в медицинской практике широко
водных
2,4-динитроглутаровой кислоты или
применяются лекарственные препараты индоль-
замещенных N-окиси изоксазолинов (изоксазолов)
ного ряда
- кавинтон, индометацин, индопан,
[18-22], а также
5-гидрокси-1,2-оксазин-6-он-3-
бопиндол,
арбидол и др.
[10,
11]. Широко
карбоксилатов, выделяемых в виде солей
[23].
используются в органическом синтезе препара-
Кроме того, взаимодействие альдегидов с
тивно доступные соединения индола [12]. Интерес
нитроацетоном под действием оснований
к химии и синтезу
3-(2-нитровинил)индолов
протекает лишь по метильной группе СН-кислоты
возрастает в последние несколько лет
[13-17].
[24], а нитроацетофенон в присутствии сильных
Однако литературные сведения об индолсодер-
оснований легко претерпевает расщепление [25].
жащих гем-функционализированных нитроэтенах
представлены в основном α-нитроакрилатами.
Использование оснований Шиффа или диаце-
Данные об их ацильных и нитрильных аналогах
талей альдегидов позволяет синтезировать некоторые
671
672
БАЙЧУРИН и др.
Схема 1.
H
H NO2
O NO2
+
X
X
R2
N R2
N
R1
R1
1-5
6-22
R1 = R2 = H (1); R1 = Me, R2 = H (2); R1 = Bn, R2 = H (3); R1 = R2 = Me (4); R1 = C(O)Me, R2 = H (5); X = C(O)OEt: R1 =
Bn, R2 = H (6); R1 = R2 = Me (7); R1 = C(O)Me, R2 = H (8); X = C(O)Me: R1 = R2 = H (9); R1 = Me, R2 = H (10); R1 = Bn,
R2 = H (11); R1 = R2 = Me (12); X = C(O)Ph : R1 = R2 = H (13); R1 = Me, R2 = H (14); R1 = Bn, R2 = H (15); R1 = R2 =
Me (16); R1 = C(O)Me, R2 = H (17); X = CN: R1 = R2 = H (18); R1 = Me, R2 = H (19); R1 = Bn, R2 = H (20); R1 = R2 =
Me (21); R1 = C(O)Me, R2 = H (22).
гем-активированные нитроэтены. Так, на основе
Осуществленная нами конденсация 3-формил-
эфиров нитроуксусной кислоты получены этил-β-
индолов 1-5 с этиловым эфиром нитроуксусной
(1-ацетилиндол-3-ил)-α-нитроакрилат
[19,
20] и
кислоты, нитроацетоном, нитроацетофеноном и
метил-β-(индол-3-ил)-α-нитроакрилат
[26,
27].
нитроацетонитрилом привела к получению
Успешным оказывается и прямое алкенилирование
нитроэтенов индольного ряда 6-22, содержащих в
этилового эфира нитроуксусной кислоты (гет)-
гем-положении к нитрофункции сложноэфирную,
ароматическими альдегидами в растворе смеси
ацетильную, бензоильную и цианогруппы (схема 1).
безводного ССl4-ТГФ в присутствии TiCl4 и N-
Процесс протекает в безводном этаноле в
метилморфолина (пиридина) [28-30]. Перспектив-
присутствии тионилхлорида или хлорокиси
ной представляется и конденсации
3-формил-
фосфора (7, 9-15, методика а) или без добавления
индола и его аналогов с нитроуксусным эфиром,
катализатора1 (18-22, методика б). Соединения 6,
нитроацетоном и нитроацетофеноном в этаноле в
8,
15-17 синтезированы путем кипячения
присутствии апротонных и протонных кислот
реагентов в бензоле в присутствии β-аланина и
[19, 31, 32], позволившая получить широкий ряд
уксусной кислоты с одновременной отгонкой воды
(гет)арилсодержащих нитроэтенов [33-35]. Разно-
(методика в). Выходы целевых соединений
образные гем-алкоксикарбонил- и гем-бензоил-
достигают 93%.
нитроэтены (среди них индолсодержащие аналоги)
синтезированы путем кипячения альдегидов и
Соединения 7, 12, 16, 17, 21, 22 получены
соответствующих СН-кислот в бензоле в присут-
впервые. Характеристики соединений
6,
8,
15,
ствии уксусной кислоты и β-аланина или ε-амино-
синтезированных нами по методике в,
капроновой кислоты
[34-38].
Конденсация
соответствуют таковым для образцов, полученных
альдегидов с нитроацетонитрилом в качестве
ранее другими способами [20, 29, 31].
метода синтеза гем-цианонитроэтенов успешно
Строение нитроэтенов
6-222 изучено с
осуществляется в присутствии конденсирующего
использованием комплекса методов ИК, УФ, ЯМР
агента (AlkNH2·HCl
+ Na2CO3, β-аланин или
1Н,
13С{1H} спектроскопии с привлечением
N-пропиламин) на силикагеле при микроволновом
экспериментов
1Н-13С HMQC,
1H-13C HMBC,
облучении [4, 39, 40] либо без катализатора [41].
1H-1H NOESY.
Причем, серия гем-цианонитроэтенов получена
таким методом с использованием неочищенного
Спектры ЯМР
1Н гем-бензоил(циано)-
нитроацетонитрила [19, 31]. Следует отметить, что
нитроэтенов 13-18, 20-223 свидетельствуют об их
взаимодействие (гет)ароматических альдегидов с
нитроацетонитрилом (1:2) в присутствии эквимоль-
1 Использован сырой (неочищенный) нитроацетонитрил [44].
ного количества основания (диэтиламин или ацетат
2 При сопоставлении и сравнительном анализе структурно-
натрия) приводит к бис-солям динитрилов 2,4-
однотипные соединения рассматриваются нами как
динитроглутаровых кислот, под действием кислот
индолсодержащие геминально замещенные 1-нитроэтены.
превращающихся в соответствующие гем-
3 Данные ЯМР 1Н, 13С{1H}, ИК, электронной спектроскопии
цианонитроэтены [42, 43].
цианосодержащего аналога 19 приведены нами в работе [45].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
673
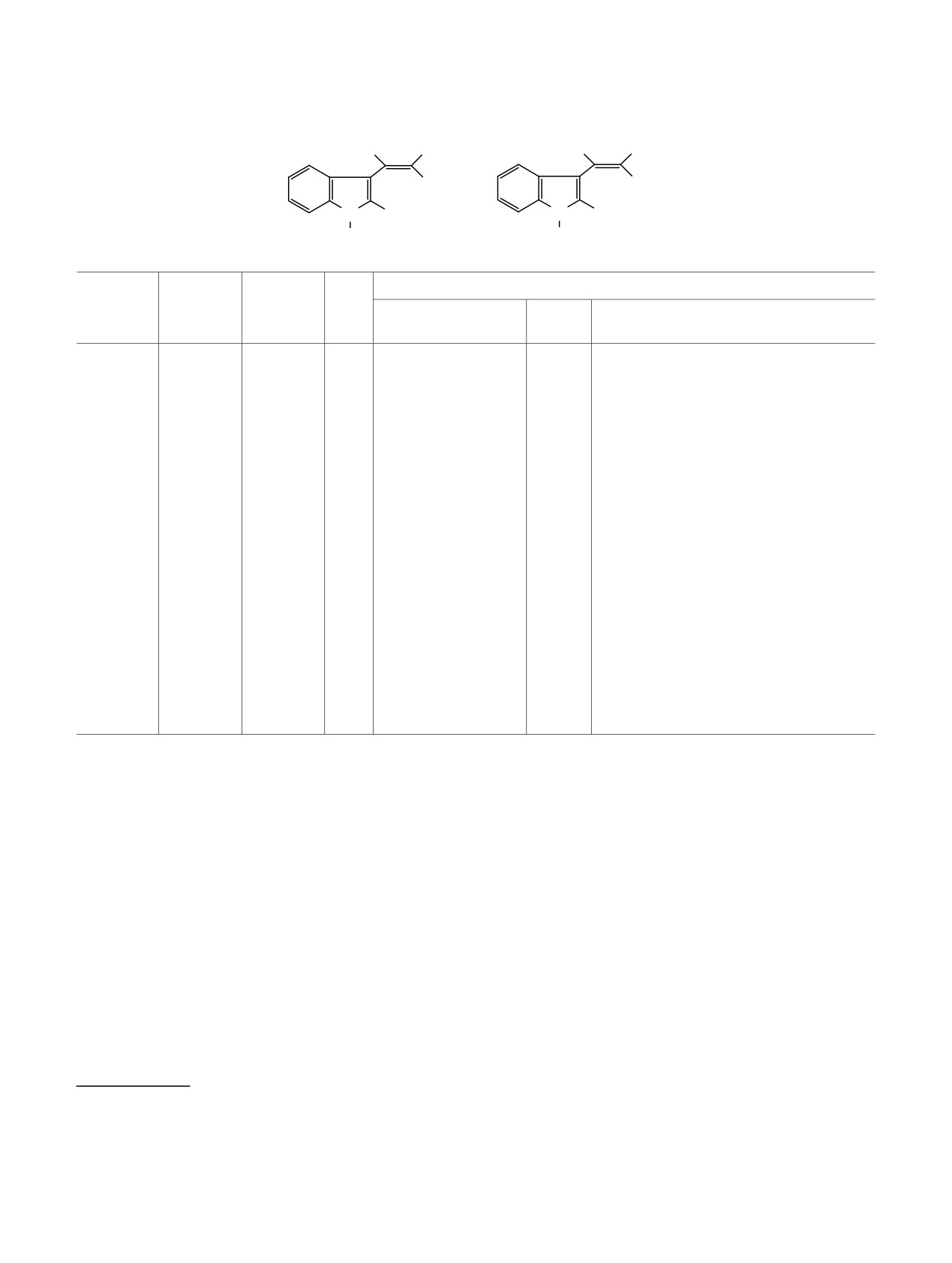
Таблица 1. Данные спектроскопии ЯМР 1Н для Е-гем-бензоил(циано)нитроэтенова
H
NO2
H
NO2
β
α
β
α
X
H
N R2
N R2
R1
R1
13-18, 20-22
23, 24
δ, м. д. (J, Гц)
№
X
R1
R2
Hα (Hβ)
R1
Ph, Ind
13
C(O)Ph
H
H
8.80 с
12.33 с
7.10-8.0 м
14
C(O)Ph
CH3
H
8.77 с
3.76 с
7.30-7.94 м
15
C(O)Ph
CH2Ph
H
8.69 с
5.24 с
6.90-7.90 м
16б
C(O)Ph
CH3
CH3
8.70 с
3.69 с
6.95-8.00 м
17
C(O)Ph
C(O)CH3
H
8.59 с
2.52 с
7.40-8.44 м
18
CN
H
H
8.93 с
13.06 с
7.27 м, 7.53, 8.00 м, 8.54 м
20
CN
CH2Ph
H
9.08 с
5.68 с
7.31-7.33 м, 7.66 м, 8.13 м, 8.80 м
21в
CN
CH3
CH3
8.78 с
3.81 с
7.32-7.40 м, 7.67 м, 8.14 м
22
CN
C(O)CH3
H
9.09 с
2.70 с
7.42-7.47 м, 8.14 м, 8.33 м, 8.80 м
23
-
CH2Ph
Н
8.13 д
5.18 с
7.19-7.43 м
(7.61 д)
Jαβ = 14.0
24
-
C(O)CH3
Н
8.17 д
2.71 с
7.40-7.87 м, 8.48-8.52 м
(7.81 д)
Jαβ = 13.7
а Спектры ЯМР 1Н соединений 13, 18, 20-22 сняты в (CD3)2SO, соединений 14-17, 23 и 24 - в CDCl3. б Синглет метильной группы
в положении 2 индольного цикла проявляется при 2.57 м. д. в Синглет метильной группы в положении 2 индольного цикла
проявляется при 2.60 м. д.
стереооднородности (табл. 1). Сигнал олефинового
атомов углерода, связанного с нитро- и циано-
протона Нβ (δН 8.59-9.09 м. д.) по сравнению с
группами, проявляется в более сильном поле (δС
модельными Е-нитроэтенами4 проявляется в более
111.00-115.92 м. д.), что может являться
слабом поле, что свидетельствует о Е-
следствием анизотропного влияния цианогруппы
конфигурации соединений 13-18, 20-22 (табл. 1).
[49]. Наблюдаемая величина константы спин-
спинового взаимодействия (3JHβCN = 10.1-10.6 Гц)
В спектрах ЯМР 13С{1H} гем-бензоил(циано)-
между протоном Нβ и атомом углерода циано-
нитроэтенов 13-18, 20-22 присутствуют сигналы
группы в спектрах ЯМР 13С также подтверждает их
всех атомов углерода (табл.
2). При этом в
транс-расположение, что согласуется с литератур-
спектрах соединений 13-17 сигнал атома углерода,
ными данными [39, 50].
связанного с нитро- и бензоильной функциями,
проявляется в слабом поле (δС 138.40-144.02 м. д.),
Выводу о Е-конфигурации гем-бензоил(циано)-
а в спектрах нитрильных аналогов 18, 20-22 сигнал
нитроэтенов, сделанному на основании анализа
спектров ЯМР 1Н, не противоречат их электронные
спектры (табл. 3). Действительно, введение в
4 Спектральные характеристики модельного нитроэтена
26
представлены в работе [46], а модельных соединений 23-25,
молекулу индолилнитроэтена группы C(O)Ph или
синтезированных по методикам [47, 48], получены нами.
CN приводит к батохромному смещению
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
674
БАЙЧУРИН и др.
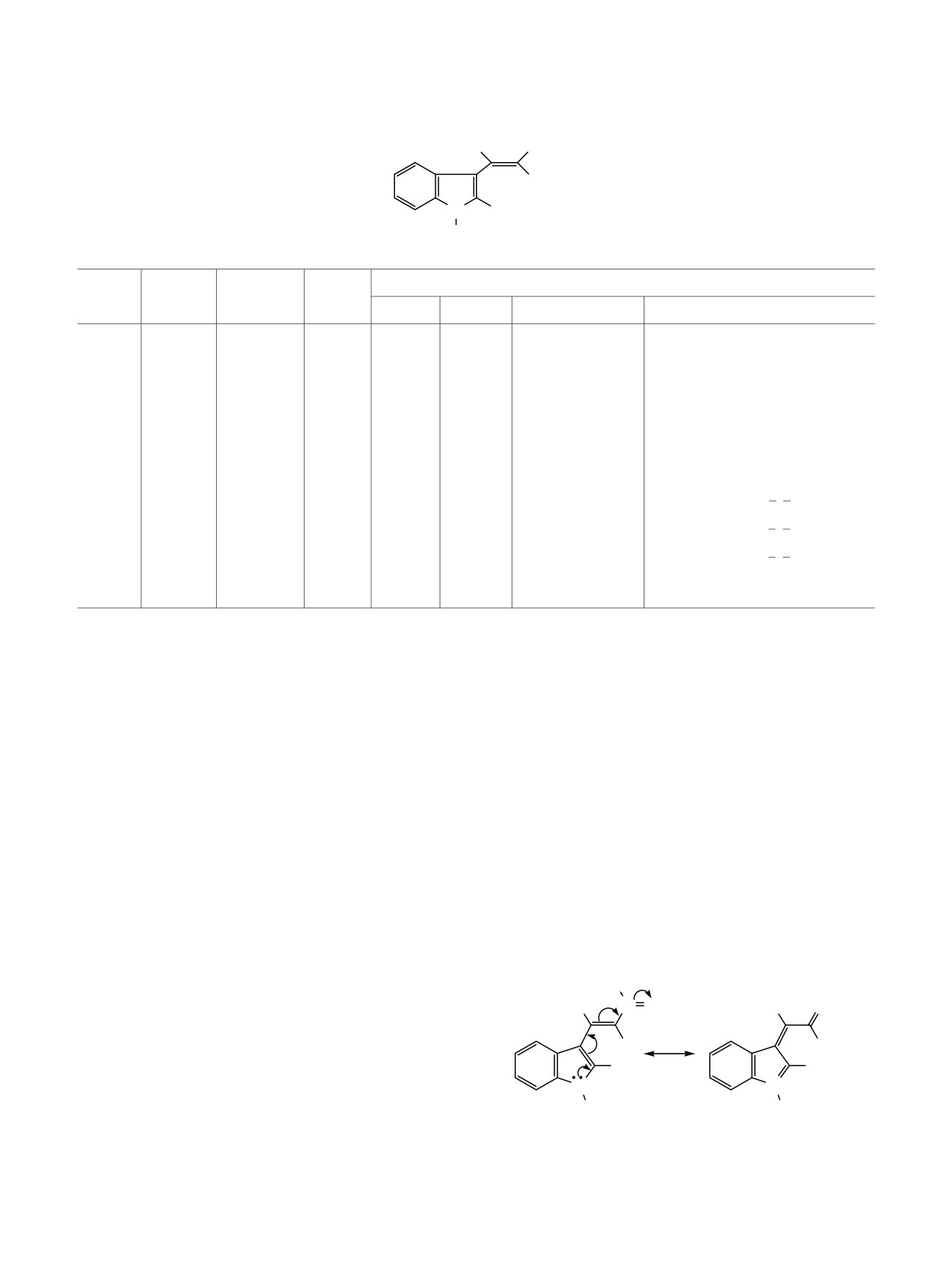
Таблица 2. Данные спектроскопии ЯМР 13С{1H} для Е-гем-бензоил(циано)нитроэтенова
H
NO2
β
α
X
N R2
R1
13-18, 20-22
δС, м. д. (J, Гц)
№
X
R1
R2
Cα
Cβ
R1
X
13
C(O)Ph
H
H
138.40
132.77
-
190.41 (C=O)
14
C(O)Ph
CH3
H
139.14
131.04
34.01
190.29 (C=O)
15
C(O)Ph
CH2Ph
H
140.01
130.13
51.28 (СН2)
189.43 (C=O)
16
C(O)Ph
CH3
CH3
138.98
134.02
30.66
189.70 (C=O)
17
C(O)Ph
C(O)CH3
H
144.02
129.04
23.82 (СН3),
188.80 (C=O)
168.53 (С=О)
18
CN
H
H
115.31
142.58
-
114.70 (CN, 3JCNHβ = 10.4)
20
CN
CH2Ph
H
115.92
141.90
51.12 (СН2)
114.44 (CN, 3JCNHβ = 10.6)
21
CN
CH3
CH3
113.95
142.43
31.93
114.96 (CN, 3JCNHβ = 10.1)
22
CN
C(O)CH3
H
111.00
141.70
24.38 (СН3),
113.38 (CN)
170.40 (С=О)
а Спектры ЯМР 13С{1H} соединений 13, 18, 20-22 сняты в (CD3)2SO, соединений 14-17 - в CDCl3. Атомам углерода бензольных и
индольных циклов соответствуют сигналы в области 107.28-157.43 м. д.; сигнал атома углерода метильной группы в положении
2 индольного цикла проявляется при 11.94 м. д. (16) и 12.22 м. д. (21).
длинноволновых полос поглощения, что подтвер-
заместитель - ацетильную группу, присутствуют
ждает существование соединений 13-18, 20-22 в Е-
полосы поглощения ковалентно построенной
форме.
нитрогруппы (1524, 1324 см-1).
ИК спектры гем-бензоил(циано)нитроэтенов 13-
Среди гем-этоксикарбонил- и гем-ацетилнитро-
18, 20, 21, имеющих Е-конфигурацию (табл. 3),
этенов, по данным спектроскопии ЯМР 1Н, лишь
близки спектрам модельных Е-нитроэтенов. В них
ацетильный аналог 9 стереооднороден (табл. 4). В
также отсутствуют полосы поглощения ковалентно
его спектре олефиновый протон Нβ резонирует при
построенной нитрогруппы, но наблюдаются
7.75 м. д., т. е. в более сильном поле по сравнению
интенсивные полосы в областях 1546-1632 (С=С,
с модельным Е-нитровинилиндолом 25 [δН 8.38 м. д.
С=N+) и 1167-1321 см-1 (NOO-). Такая спек-
в (CD3)2SO], что позволяет сделать вывод о Z-
тральная картина свидетельствует о высокой
конфигурации соединения 9. В спектрах ЯМР 1Н
полярности их молекул вследствие эффективного
остальных соединений
6-8,
10-12 наблюдается
p,π-сопряжения с участием электронов азота
индольного цикла, кратной С=С связи и
Схема 2.
нитрогруппы (схема 2). Подобная спектральная
O
картина наблюдалась ранее для гем-циано-
H
N
O
H
NOO-
нитроэтенов, содержащих пиррольный, N-
метилпиррольный, тиофеновый или фурановый
X
X
циклы [39, 41].
R2
R2
+
В отличие от соединений 13-18, 20, 21, в ИК
N
N
спектре цианонитроэтена 22, содержащего у атома
R1
R1
азота индольного цикла электроноакцепторный
X = C(O)Ph, CN.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
675
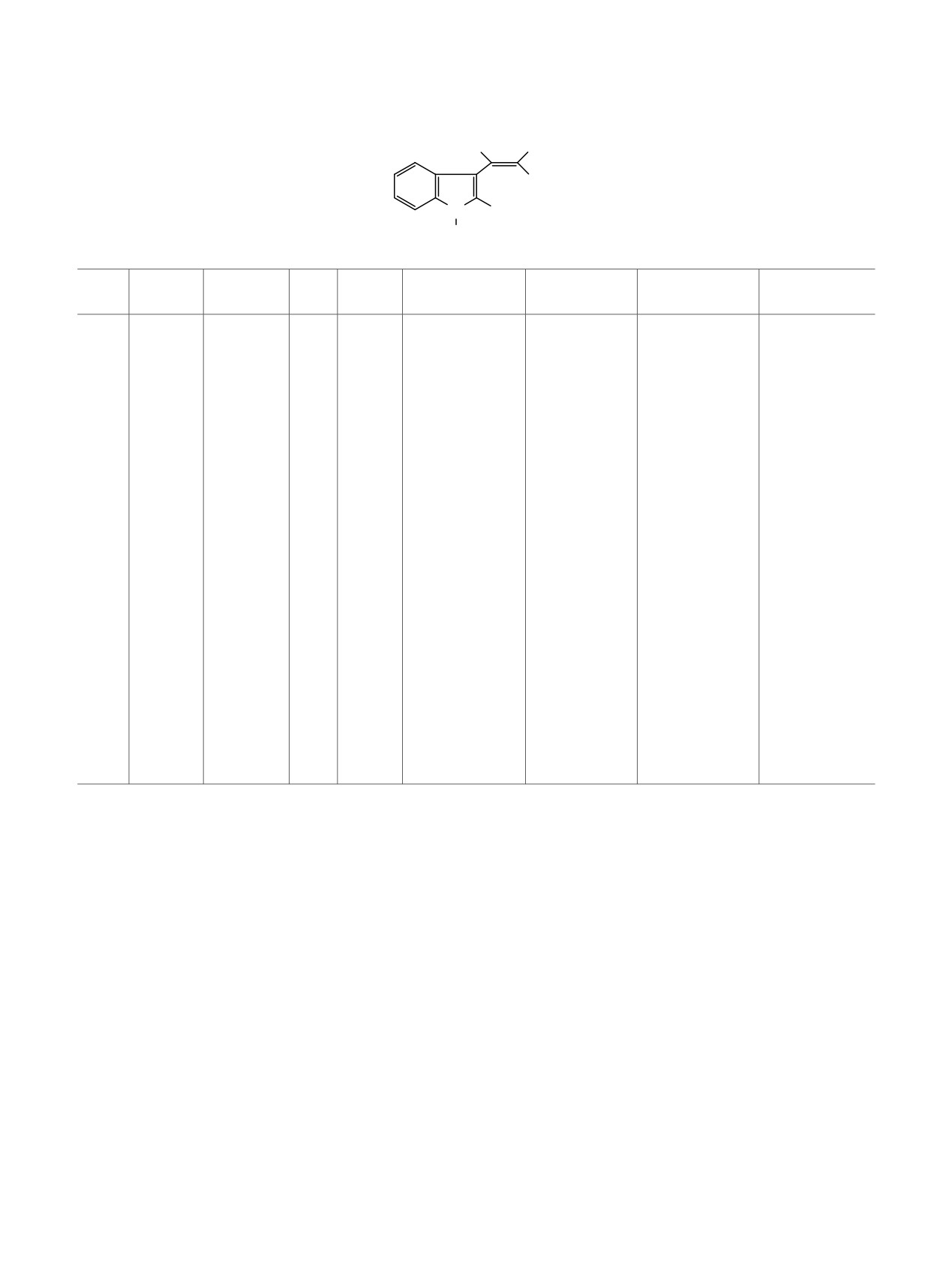
Таблица 3. Данные электронныха и ИКб спектров для гем-Е-бензоил(циано)нитроэтенов
H
NO2
β
α
X
N R2
R1
13-18, 20-22
C=O
№
X
R1
R2
λmax, нм
ε, л/(моль·см)
NOO-(NO2)
C=C, C=N+
(CN) [NH]
13
C(O)Ph
H
H
422
17300
1277, 1228,
1670
1606, 1580
1220
[3337 ш]
14
C(O)Ph
CH3
H
430
17000
1288, 1244,
1672
1620, 1608
1229
15
C(O)Ph
CH2Ph
H
426
16400
1321, 1292,
1672
1620, 1608
1176
16
C(O)Ph
CH3
CH3
440
18500
1286, 1260,
1668
1601, 1579
1229
17
C(O)Ph
C(O)CH3
H
386
12800
1321, 1231,
1724,
1632, 1546
1202
1676
18
CN
H
H
440
30000
1278, 1262,
(2219)
1593, 1575
1238
[3352 ш]
20
CN
CH2Ph
H
440
36200
1297, 1274,
(2219)
1591, 1576
1167
21
CN
CH3
CH3
439
39330
1300, 1285,
(2211)
1593, 1580
1237
22
CN
C(O)CH3
H
407
18840
(1524, 1324)
(2227)
1611, 1601
1728
23
-
CH2Ph
Н
397
17900
1310, 1265
-
1625, 1500
24
-
C(O)CH3
Н
354
19000
1513, 1337
1723
1623
а УФ спектры соединений 21-23
сняты в МеСN,
соединений 18,
20,
24
- в этаноле;
приведены полосы поглощения в
длинноволновой области выше 300 нм. б ИК спектры соединений 14-17, 23, 24 сняты в CHCl3, соединений 13, 18, 20-22 - в
удвоение сигналов. Сигналы протона Нβ обнару-
индол-3-ил)акриловой кислоты удается выделить
живаются при 7.74-8.01 м. д. (Z-форма) и 8.22-8.62
индивидуально [52].
м. д. (Е-форма), причем в смесях в большинстве
В спектрах ЯМР 13С{1Н} гем-этоксикарбонил-
случаев преобладают Z-изомеры (табл.
4).
(ацетил)нитроэтенов
6-8,
10-12 присутствуют
Отсутствие стереооднородности у соединений 6-8,
удвоенные сигналы всех структурных фрагментов
10-12 подтверждается и электронными спектрами,
молекул (табл. 5). Атомам углерода карбонильных
в которых присутствуют две полосы поглощения в
групп соответствуют сигналы в области 159.32-
длинноволновой области (табл. 4).
195.31 м. д. Сигналы атомов Сα, связанных с нитро-
Следует отметить, что ранее синтезированные
и сложноэфирной или ацетильной группами, также
эфиры α-нитро-β-(индол-3-ил)акриловой кислоты и
как в бензоильных аналогах
13-17 (табл.
2),
их N-метильные аналоги также выделяются в виде
проявляются в более слабом поле
(134.49-
равновесной смеси Z- и E-изомеров [51]. Лишь Z-
144.43 м. д.), чем сигналы атомов углерода Сβ
изомер метилового эфира α-нитро-β-(1-ацетил-
(126.59-134.10 м. д.).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
676
БАЙЧУРИН и др.
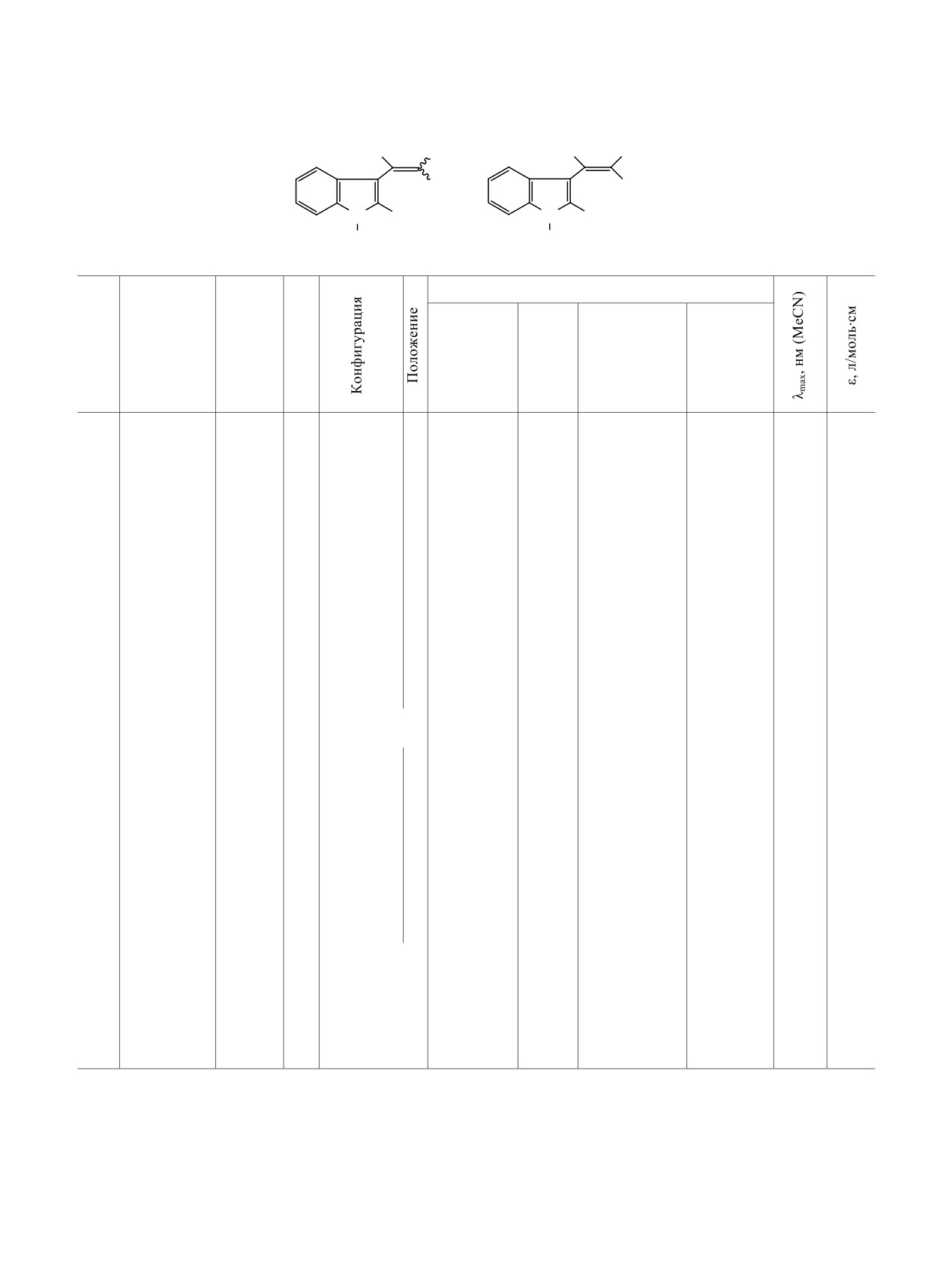
Таблица 4. Данные ЯМР 1Н и электронных спектров для гем-этоксикарбонил(ацетил)нитроэтенова
H
NO2
H
NO2
β
α
β
α
X
H
2
N R
N R2
1
R
R1
6-12
25, 26
δН, м. д. (J, Гц)
№
X
R1
R2
Нα
R1
OCH2CH3
Ph, Ind
(Hβ)
(NH)
(CH3)
6
СООСН2СН3
Вn
Н
Z:E ≈ 1.1:1
Z
7.96 с
5.27 с
4.37 к, 1.37 т
7.13-7.82 м
(3J = 7.2)
E
8.49 с
5.31 с
4.34 к, 1.30 т
7.06-7.94 м
(3J = 7.2)
7б
СООСН2СН3
СН3
СН3
Z:E ≈ 1:1.2
Z
7.90 с
3.70 с
4.369 к, 1.37 т
344
7340
(3J = 7.2)
7.15-7.45 м
E
8.43 с
3.73 с
4.368 к, 1.23 т
429
16280
(3J = 7.2)
8
СООСН2СН3
С(О)СН3
Н
Z:E ≈ 3.3:1
Z
7.74 с
2.60 с
4.36 к, 1.34 т
7.30-8.40 м
332
11470
(3J = 7.2)
E
8.22 д
2.64 с
4.39 к, 1.33 т
8.18-8.40 м
385 пл
5900
[4J(HβH2Ind) =
(3J = 7.2)
0.7]
9
С(О)СН3
Н
Н
Z
7.75 с
(12.37 с)
(2.52 с)
7.30-8.05 м
390
6300
10
С(О)СН3
СН3
Н
Z:E ≈ 5:1
Z
8.01 с
3.85 с
(2.50 с)
7.22-7.90 м
367
15500
8.29 с
E
8.44 с
3.88 с
(2.49 с)
7.22-7.80 м
430
8200
11
С(О)СН3
Вn
Н
Z:E ≈ 1.6:1
Z
7.94 с
5.34 с
(2.48 с)
7.10-7.85 м
366
20000
E
8.62 с
5.40 с
(2.55 с)
7.93 с, 8.66 с
429
8300
12в
С(О)СН3
СН3
СН3
Z:E ≈ 2.9:1
Z
7.94 с
3.73 с
(2.46 с)
360
11500
7.08-7.37 м
E
8.42 с
3.73 с
(2.63 с)
440
8300
25
-
Н
Н
E
8.38 д
(12.23)
-
7.22-8.22 м
400г
22300
(7.98 д)
3Jαβ = 13.4
26д
-
СН3
СН3
E
8.32 д
3.77 с
-
7.27-8.02 м
415
20200
(7.75 д)
3Jαβ
= 13.1
а Спектры ЯМР 1H соединений 6-8, 11, 12, 26 сняты в CDCl3, соединений 9, 10, 25 - в (CD3)2SO. б Синглет метильной группы в
положении 2 индольного цикла проявляется при 2.53 (Z) и 2.55 (Е) м. д. в Синглет метильной группы в положении 2 индольного
цикла проявляется при 2.56 (Z) и 2.54 (Е) м. д. г УФ спектр снят в этаноле. д Синглет метильной группы в положении 2 индольного
цикла проявляется при 2.57 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
677
Таблица 5. Данные спектроскопии ЯМР 13С для гем-этоксикарбонил(ацетил)нитроэтенова
HA
NO2
β
α
X
N R2
R1
6-8, 10-12
№
X
R1
R2
Конфигурация
Сα
Сβ
R1
X
6
СООСН2СН3
СН2Ph
H
Z
134.49
126.59
51.22 (СН2)
14.31 (СН3), 62.44
(СН2), 60.46 (С=О)
E
135.42
130.77
51.22 (СН2)
13.99 (СН3), 62.58
(СН2), 162.81 (С=О)
7б
СООСН2СН3
CH3
CH3
Z
134.42
130.54
30.49 (СН3)
14.36 (СН3), 62.30
(СН2), 161.36 (С=О)
E
136.20
133.27
30.60 (СН3)
13.87 (СН3), 62.50
(СН2), 163.16 (С=О)
8
СООСН2СН3
COCH3
H
Z
139.26
127.71
23.86 (СН3)
14.13 (СН3), 63.19
168.8 (С=О)
(СН2), 159.32 (С=О)
E
140.65
128.73
23.90 (СН3)
13.92 (СН3), 63.22
168.8 (С=О)
(СН2), 161.57 (С=О)
10
С(О)СН3
CH3
H
Z
144.43
127.27
34.00
25.62 (СН3), 188.25
(С=О)
E
141.49
131.99
34.27
30.35 (СН3), 194.99
(С=О)
11
С(О)СН3
СН2Ph
H
Z
143.42
127.07
51.50 (СН2)
26.11 (СН3), 188.55
(С=О)
E
142.30
133.02
56.65 (СН2)
30.41 (СН3), 194.41
(С=О)
12в
С(О)СН3
CH3
CH3
Z
142.66
130.99
29.94
26.45 (СН3), 189.19
(С=О)
E
141.70
134.10
29.94
30.68 (СН3), 195.31
(С=О)
a Спектры ЯМР 13С{1H} соединений 6-8, 11, 12 сняты в CDCl3, соединения 10 - в (CD3)2SO. Атомам углерода бензольного и
индольного циклов соответствуют сигналы в области 105.38-148.51 м. д. б Сигнал метильной группы в положении 2 индольного
цикла проявляется при 11.60 (Z) и 11.67 (Е) м. д. в Сигнал метильной группы в положении 2 индольного цикла проявляется при
11.77 (Z) и 12.13 (Е) м. д.
ИК спектры гем-ацетил(этоксикарбонил)-
кратных С=С связей (схема 3). При этом пара-
нитроэтенов 6-8, 10-17, представляющих собой
метры полос поглощения нитрогруппы практи-
смеси Z- и E-форм, носят сложный характер,
чески не изменяются.
однако в них можно выделелить полосы
поглощения ковалентно построенной NO2-группы
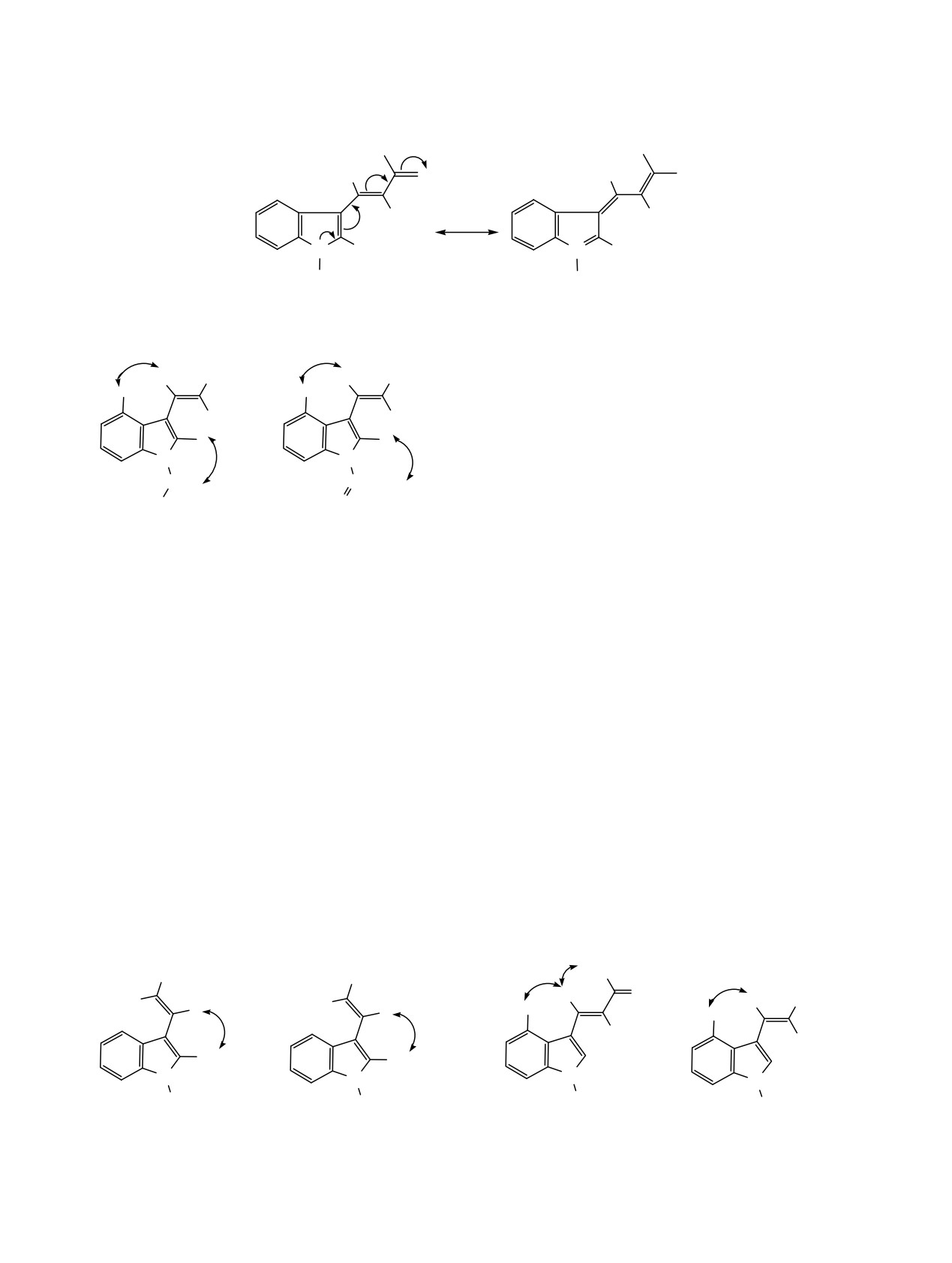
Анализ данных NOESY экспериментов
Z-изомеров. Эффективное сопряжение неподелен-
позволяет определить конформацию относительно
ной пары электронов атома азота индольного
связи C3-Cβ для некоторых представителей
цикла, кратной С=С связи и карбонильного
полученных индолилнитроэтенов. Так, наличие в
фрагмента ацетильной (сложноэфирной) группы в
спектре 1Н-1Н NOESY (ДМСО-d6) соединения 21
Z-форме, вероятно, вызывает снижение интенсив-
кросс-пиков сигналов протона Нβ и протонов
ности полосы поглощения группы С=О по
метильной группы при атоме С2 индольного цикла
сравнению с интенсивностью полос поглощения
свидетельствует
о
реализации
s-транс-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
678
БАЙЧУРИН и др.
Схема 3.
Me
Me
H
O
H
O-
NO2
NO2
+
N
R2
N R2
R1
R1
Схема 4.
для Z- и E-изомера s-транс-конформации винил-
NOE
NOE
индольного фрагмента (схема 5).
H
NO2
H
NO2
В свою очередь, в спектре
1H-1H NOESY
β
α
β
α
H
H
(ДМСО-d6) смеси Z- и E-изомеров гем-ацетил-
4
CN
4
CN
нитроэтена 10 присутствуют кросс-пики сигналов
5
3
5
3
6
2
H
6
2
H
протонов Нβ обоих изомеров и протонов С4Н
7
7
NOE
N
N
индольного цикла, что свидетельствует о s-цис-
NOE
конформации винилиндольного фрагмента для
CH2
C⎯CH3
обоих изомеров. Кроме того, наличие кросс-пиков
Ph
O
сигнала олефинового протона и протонов метиль-
20
22
ной группы ацетильного заместителя говорит о
реализации для Z-изомера соединения 10 s-транс-
конформации (схема 4). В то же время присутствие
конформации енонового фрагмента (схема 6).
в спектрах 1H-1H NOESY (ДМСО-d6) соединений
Аналогичным образом Z-изомеру соединения 12
20 и 22 кросс-пиков сигналов протона Нβ и протона
в растворе CDCl3 можно приписать s-транс-
С4Н индольного цикла указывает на s-цис-
конформацию и винилиндольного, и енонового
конформацию молекулы.
фрагментов.
Такая же картина наблюдается в растворе CDCl3
Таким образом, нами осуществлен синтез ряда
для гем-бензоилнитроэтена 14, в то время как его
индолсодержащих
нитроэтенов,
геминально
аналог 16 демонстрирует существование в растворе
функционализированных ацетильной, бензоиль-
CDCl3 в виде s-транс-конформера.
ной,
этоксикарбонильной или нитрильной
В спектре
1H-1H NOESY (CDCl3) α-нитро-
группами, на основе взаимодействия 3-формил-
акрилата 7 оба геометрических изомера образуют
индолов с соответствующими СН-кислотами;
кросс-пики сигналов протона Нβ и протонов
способ отличается высокой эффективностью и
метильной группы при атоме углерода С2
препаративно удобен. Комплексный анализ
индольного кольца [7.90/2.53 м. д. (Z) и 8.43/2.55 м. д.
спектральных характеристик позволяет сделать
(Е)], что свидетельствует, вероятно, о реализации
заключение об особенностях их строения.
Схема 5.
Схема 6.
NO2
COOEt
NOE H3C
NOE
NOE
α
α
H
O
EtOOC
β
β α
H
NO2
O2
N β
H
β α
H
H
H
Z
NOE
NOE
E
4
4
NO2
C(O)CH3
3
4
3
4
5
5
3
5
3
2
CH3
6
2
5
6
6
2
CH3
2
7
7
6
7
7
N
N
N
N
CH3
CH3
CH
3
CH3
s-транс-Е-7
s-транс-Z-7
s-цис-Z-10
s-цис-E-10
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
679
Установлено, что гем-бензоил(циано)нитроэтены
этанола прибавляли
0.25 мл
(2 ммоль) этил-
имеют Е-конфигурацию, а гем-ацетил(этокси-
нитроацетата и 2 капли хлористого тионила. Смесь
карбонил)замещенные аналоги, в большинстве
нагревали до полного растворения исходных
случаев, существуют в виде смесей изомеров с
веществ и оставляли при комнатной температуре.
преимущественным содержанием Z-форм. Для
Через сутки осадок отфильтровывали и сушили.
отдельных представителей полученных нитро-
Выход 0.42 г (73%), желтые кристаллы, т. пл. 107-
этенов установлена конформация простой связи
108°С (EtOH). Найдено, %: N 9.85. С15Н16N2O4.
гетероцикл-этиленовый остов путем анализа
Вычислено, %: N 9.72.
данных 1H-1H NOESY экспериментов.
Этил-3-(1-ацетилиндол-3-ил)-2-нитропропеноат
(8)
получали аналогично методике синтеза
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
соединения
6 из 1-ацетил-3-формилиндола 5 и
этилнитроацетата; время реакции
-
2 ч.
Физико-химические исследования выполнены с
Выделившийся после удаления бензола до
1/3
использованием оборудования Центра коллектив-
исходного объема твердый желтый осадок отфиль-
ного пользования факультета химии Российского
тровывали и сушили. Выход 55%, т. пл. 137-138°С
государственного педагогического университета
(EtOH) {т. пл. 140-141°С (EtOH) [20]}.
им. А. И. Герцена.
4-(Индол-3-ил)-3-нитро-3-бутен-2-он (9). Смесь
Спектры ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC и
0.206 г (2 ммоль) нитроацетона, 0.29 г (2 ммоль)
1Н-13С HMBC регистрировали на спектрометре
3-формилиндола 1 и 2 капель хлорокиси фосфора в
Jeol JNM-ECX400A с рабочими частотами 399.78
3 мл безводного этанола нагревали до растворения
(1Н) и 100.53 МГц (13С), растворитель - хлороформ-
исходных веществ и затем оставляли при
d или ДМСО-d6. В качестве внутреннего стандарта
комнатной температуре. Через сутки раствор
использовали сигналы остаточных протонов
выливали на крошку льда. Образовавшийся осадок
недейтерированного растворителя. ИК спектры
отфильтровывали и промывали на фильтре
получены на Фурье-спектрометре Shimadzu IR-
этанолом. Выход 0.3 г (65%), желтые кристаллы, т.
Prestige-21 в хлороформе (с
=
40 мг/мл) или
пл. 157-158°С (EtOH) {т. пл. 159-160°С (EtOH)
таблетках KBr. Электронные спектры поглощения
[31]}.
в растворах этанола или ацетонитрила записаны на
спектрометре Shimadzu UV 2401PC в кварцевых
4-(1-Метилиндол-3-ил)-3-нитро-3-бутен-2-он
неразборных кюветах (l = 1.01 мм). Элементный
(10) получали аналогично методике синтеза
анализ выполнен на анализаторе EuroVector (EA
соединения
7 из
1-метил-3-формилиндола
2 и
3000, CHN Dual).
нитроацетона (через сутки реакционный раствор
выливали на крошку льда). Выход 93%, желтые
Этил-3-(1-бензилиндол-3-ил)-2-нитропропеноат
кристаллы, т. пл. 154-155°С (MeCN). Найдено, %:
(6). Смесь 0.67 г (5 ммоль) этилнитроацетата, 1.17 г
С 63.75; Н 4.84; N 11.53. C13H12N2O3. Вычислено,
(5 ммоль) 1-бензил-3-формилиндола 3, каталити-
%: С 63.93; Н 4.92; N 11.48.
ческого количества (0.19 г) β-аланина и 0.8 мл
ледяной уксусной кислоты в 20 мл безводного
4-(1-Бензилиндол-3-ил)-3-нитро-3-бутен-2-он
бензола кипятили 5 ч с насадкой Дина-Старка.
(11) получали аналогично методике синтеза
После охлаждения реакционную смесь промывали
соединения 10 из 1-бензил-3-формилиндола 3 и
насыщенным раствором NaCl и органический слой
нитроацетона. Выход 80%, оранжевые кристаллы,
сушили над прокаленным MgSO4. Остаток,
т. пл. .137-138°С (i-PrOH). Найдено, %: С 71.36; Н
полученный после удаления бензола, хромато-
5.23; N 8.63. C19H16N2O3. Вычислено, %: С 71.25; Н
графировали на силикагеле. Из фракции,
5.00; N 8.75.
вымываемой бензолом, получили
1.42 г
(81%)
4-(1,2-Диметилиндол-3-ил)-3-нитро-3-бутен-2-
соединения 6 в виде красно-оранжевого масла, Rf
он
(12) получали аналогично методике синтеза
0.53 (гексан:ацетон = 3:1). Найдено, %: N 7.89.
соединения 10 из 1,2-диметил-3-формилиндола 4 и
C20H18N2O4. Вычислено, %: N 8.00.
нитроацетона. Выход
64%, желтые кристаллы,
Этил-3-(1,2-диметилиндол-3-ил)-2-нитропро-
т. пл. 170-171°С (EtOH). Найдено, %: С 64.96; Н
пеноат (7). К суспензии 0.35 г (2 ммоль) 1,2-ди-
5.57; N 10.70. C14H14N2O3. Вычислено, %: С 65.10;
метил-3-формилиндола
4 в
2 мл безводного
Н 5.42; N 10.85.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
680
БАЙЧУРИН и др.
3-(Индол-3-ил)-2-нитро-1-фенилпропен-1-он
3-(1-Ацетилиндол-3-ил)-2-нитро-1-фенилпропен-
(13). К 0.72 г (5 ммоль) 3-формилиндола 1 в 3 мл
1-он (17) получали аналогично методике синтеза
безводного этанола прибавляли 0.82 г (5 ммоль)
соединения 15 из 1-ацетил-3-формилиндола 5 и
нитроацетофенона, 2 капли хлорокиси фосфора и
нитроацетофенона (время кипячения - 2 ч). Выход
нагревали до полного растворения исходных
73%, желтые кристаллы, т. пл. 142-143°С (i-PrOH).
веществ. Через сутки реакционную массу
Найдено, %: N 8.51. С19Н14N2O3. Вычислено, %: N
выливали в воду со льдом и экстрагировали
8.38.
диэтиловым эфиром. Эфирный раствор сушили
прокаленным Na2SO4, растворитель удаляли.
3-(Индол-3-ил)-2-нитропропеннитрил
(18).
Выход 1.35 г (93%), т. пл. 131-132°С (EtOH) {т. пл.
Суспензию 1.45 г (10 ммоль) 3-формилиндола 1 в
131-132°С (EtOH) [31]}.
15 мл безводного этанола прибавляли к 0.86 г
(10 ммоль) неочищенного (сырого) нитроацето-
3-(1-Метилиндол-3-ил)-2-нитро-1-фенилпропен-
нитрила. Суспензия темнела и при легком
1-он (14). Смесь 0.41 г (2.5 ммоль) нитроацето-
нагревании выделялся кристаллический осадок
фенона, 0.4 г (2.5 ммоль) 1-метил-3-формилиндола
оранжевого цвета. Реакционную смесь оставляли
2 и 2 капель хлористого тионила в 2 мл безводного
при комнатной температуре. Через сутки кристал-
этанола нагревали до полного растворения
лический продукт отфильтровывали и сушили.
исходных веществ и оставляли при комнатной
Выход 1.86 г (87%), т. пл. 219-220°С (MeNO2)
температуре. Через сутки осадок отфильтровывали
{т. пл. 215°С (MeNO2) [31]}.
и сушили. Выход
0.62 г
(81%), оранжевые
кристаллы, т. пл. 191-192°С (MeCN). Найдено, %:
3-(1-Метилиндол-3-ил)-2-нитропропеннитрил
С 70.50; Н 4.72; N 9.28. С18Н14N2O3. Вычислено, %:
(19) получали аналогично методике синтеза
С 70.59; Н 4.58; N 9.15.
соединения 18 из 1-метил-3-формальдегида 3 и
3-(1-Бензилиндол-3-ил)-2-нитро-1-фенилпропен-
нитроацетонитрила. Выход 66%, т. пл. 190-191°С
1-он
(15). а. Получали аналогично методике
(MeNO2). Найдено, %: С 63.58; Н 4.05; N 18.48.
синтеза соединения
14 из
1-бензил-3-формил-
С12Н9N3O2. Вычислено, %: С 63.44; Н 3.96; N 18.50.
индола
3 и нитроацетофенона. Выход
76%,
оранжевые кристаллы, т. пл. 116-118°С (i-PrOH).
3-(1-Бензилиндол-3-ил)-2-нитропропеннитрил
Найдено, %: С 75.35; Н 4.85; N 7.25. С24Н18N2O3.
(20) получали аналогично методике синтеза
Вычислено, %: С 75.39; Н 4.71; N 7.32.
соединения 18 из 1-бензил-3-формилальдегида 3 и
нитроацетонитрила, время реакции - 3 ч. Выход
б. Смесь 0.82 г (5 ммоль) нитроацетофенона,
51%, т. пл. 213-214°С (MeNO2) {т. пл. 211°С
1.17 г
(5 ммоль)
1-бензил-3-формилиндола
3,
(MeNO2) [31]}.
каталитического количества (0.19 г) β-аланина и
4 мл ледяной уксусной кислоты в 40 мл безводного
3-(1,2-Диметилиндол-3-ил)-2-нитропропеннитрил
бензола кипятили в течение 4 ч с насадкой Дина-
(21) получали аналогично методике синтеза
Старка. После охлаждения реакционную смесь
соединения 18 из 1-бензил-3-формилальдегида 3 и
промывали водой и органический слой сушили над
нитроацетонитрила, время реакции - 3 ч. Выход
прокаленным MgSO4. Растворитель удаляли,
78%, т. пл. 191-192°С (MeNO2). Найдено, %: N
осадок отфильтровывали и сушили. Выход 1.62 г
17.51. С13Н11N3O2. Вычислено, %: N 17.43.
(85%), оранжевые кристаллы, т. пл. 124-126°С
(i-PrOH). Проба смешения с образцом, полученным
3-(1-Ацетилиндол-3-ил)-2-нитропропеннитрил
по методике a, депрессии температуры плавления
(22) получали аналогично методике синтеза
не давала.
соединения
18 из
1-ацетил-3-формилиндола и
3-(1,2-Диметилиндол-3-ил)-2-нитро-1-фенил-
нитроацетонитрила. Выход 78%, т. пл. 201-202°С
пропен-1-он (16) получали аналогично методике
(MeNO2). Найдено,
%: N
16.38. С13Н9N3O3.
синтеза соединения 15 из 1,2-диметил-3-формил-
Вычислено, %: N 16.47.
индола 4 и нитроацетофенона (время кипячения -
КОНФЛИКТ ИНТЕРЕСОВ
4.5 ч). Выход 58%, оранжевые кристаллы, т. пл.
183-184°С (С6Н6). Найдено, %: С 71.35; Н 5.20; N
Авторы заявляют об отсутствии конфликта
8.60. С19Н16N2O3. Вычислено, %: С 71.25; Н 5.0; N
интересов.
8.75.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
681
СПИСОК ЛИТЕРАТУРЫ
16. Wang Y.-C., Wang J.-L., Burgess K.S., Zhang J.-W.,
Zheng Q.-M., Pu Y.-D., Yan L.-J., Chen X.-B. // RSC
1.
Перекалин В.В., Сопова А.С., Липина Э.С.
Adv. 2018. Vol. 8. N 11. P. 5702. doi 10.1039/
Непредельные нитросоединения. Л.: Химия, 1982.
c7ra13207g
452 с.
17. Zhmurov P.A., Ushakov P.Yu., Novikov R.A.,
2.
Perekalin V.V., Lipina E.S., Berestovitskaya V.M.,
Sukhorukov A.Yu., Ioffe S.L. // Synlett. 2018. Vol. 29.
N 14. P. 1871. doi 10.1055/s-0037-1610213
Efremov D.A. Nitroalkenes. Conjugated Nitrocom-
pounds. Chichester: John Wiley and Sons, 1994. 256 p.
18. Dornow A., Menzel H. // Lieb. Ann. 1954. Bd 588. Hf 1.
S. 40. doi 10.1002/jlac.19545880105
3.
Караханов Р.А., Келарев В.И., Поливин Ю.Н. // Усп.
хим. 1993. Т. 62. № 2. С. 184; Karakhanov R.A.,
19. Абоскалова Н.И. Дис. … канд. хим. наук. Л., 1971.
137 с.
Kelarev V.I., Polivin Yu.N. // Russ. Chem. Rev. 1993.
Vol.
62.
N
2.
P.
169.
doi
10.1070/
20. Абоскалова Н.И., Полянская А.С., Перекалин В.В. //
RC1993v062n02ABEH000011
Докл. АН СССР.
1967. Т.
176.
№ 4. С. 829;
Aboskalova N.I., Polyanskaya A.S., Perekalin V.V. //
4.
Берестовицкая В.М., Байчурин Р.И., Абоскалова Н.И.
Doklady Chem. 1967. Vol. 176. N 4. P. 861.
Сопряженные нитроэтены, геминально активи-
рованные сложноэфирной, циано- и ацильной
21. Виноград Л.Х., Суворов Н.Н. // ХГС. 1970. № 11.
С. 1505; Vinograd L.Kh., Suvorov N.N. // Chem.
группами. СПб: Астерион, 2014. 231 с.
Heterocycl. Compd. 1970. Vol. 6. N 11. P. 1403. doi
5.
Избранные методы синтеза и модификации
10.1007/BF00476782
гетероциклов. Химия синтетических индольных
22. Umezawa S., Zen S. // Bull. Chem. Soc. Japan. 1963.
систем / Под ред. В.Г. Карцева. М.: IBS Press, 2004.
Vol. 36. N 9. P. 1150. doi 10.1246/bcsj.36.1150
Т. 3, 635 C.
23. Вaranov M.S., Yampolsky I.V. // Tetrahedron Lett. 2013.
6.
Шульц Э.Э., Карцев В.Г., Толстиков Г.А. Химия и
Vol. 54. N 7. P. 628. doi 10.1016/j.tetlet.2012.11.132
биологическая активность индольных алкалоидов.
24. Dornow A., Sassenberg W. // Lieb. Ann. 1957. Bd 602.
М.: ICSPF, 2018. 880 с.
Hf 1. S. 14. doi 10.1002/jlac.19576020102.
7.
Sharma V., Kumar P., Pathak D. // J. Heterocycl. Chem.
25. Залукаев Л.П. Синтез и реакции альфа-
2010. Vol. 47. N 3. P. 491. doi 10.1002/jhet.349
нитрокетонов. Рига: АН ЛатвССР, 1958. 184 с.
8.
Kaushik N.K., Kaushik N., Attri P., Kumar N.,
26. Бабиевский К.К. Автореф. дис. … докт. хим. наук.
Kim C.H., Verma A.K., Choi E.H. // Molecules. 2013.
М., 1980. 54 с.
Vol. 18. N 6. P. 6620. doi 10.3390/molecules18066620
27. Кочетков К.А., Бабиевский К.К., Беликов В.М.,
9.
Singh T.P., Singh O.M. // Mini Rev. Med. Chem. 2018.
Гарбалинская Н.С., Бахмутов В.И. // Изв. АН СССР.
Vol.
18.
N
1.
P.
9.
doi
10.2174/
Сер. хим.
1980.
№ 3. С. 639; Kochetkov K.A.,
1389557517666170807123201
Babievskii K.K., Belikov V.M., Garbalinskaya N.S.,
10. Мальцев О.В., Белецкая И.П., Злотин С.Г. // Усп.
Bakhmutov V.I. // Bull. Acad. Sci. USSR, Div. Chem.
хим. 2011. Т.
80
№ 11. С. 1119; Maltsev O.V.,
Sci.
1980. Vol.
29. N
3. P.
458. doi
10.1007/
Beletskaya I.P., Zlotin S.G. // Russ. Chem. Rev. 2011.
BF00949634
Vol.
80.
N.
11.
P.
1067.
doi
28. Lehnert W. // Tetrahedron. 1972. Vol. 28. N 3. P. 663.
RC2011v080n11ABEH004249
doi 10.1016/0040-4020(72)84029-8
11. Машковский М.Д. Лекарственные средства. М.: РИА
29. Rodríguez R., Viñets I., Diez A., Rubiralta M., Giralt E. //
«Новая волна», 2012. 1216 с.
Synth. Commun. 1996. Vol. 26. N 16. P. 3029. doi
12. Жунгиету Г.И., Будылин В.А., Кост А.Н.
10.1080/00397919608004608
Препаративная химия индола. Кишинев: Штиинца,
1975. 264 с.
30. Rodríguez R., Diez A., Rubiralta M., Giralt E. //
Heterocycles. 1996. Vol. 43. N 3. P. 513. doi 10.3987/
13. Baron M., Metay E., Lemaire M., Popowycz F. // J. Org.
COM-95-7327
Chem. 2012. Vol. 77. N 7. P. 3598. doi 10.1021/
jo2026096
31. Абоскалова Н.И., Полянская А.С., Перекалин В.В.,
14. Аксенов А.В., Аксенов Н.А., Скоморохов А.А.,
Демирева З.И., Соколова Л.Н. // ЖОрХ. 1972. Т. 8.
Вып. 6. С. 1332; Aboskalova N.I., Polyanskaya A.S.,
Аксенова И.В., Грязнов Г.Д., Воскресенский Л.Г.,
Рубин М.А. // ХГС. 2016. Т. 52. № 11. С. 923; Akse-
Perekalin V.V., Demireva Z.I. // J. Org. Chem. USSR.
1972. Vol. 8. N 6. P. 1349.
nov A.V., Aksenov N.A., Skomorokhov A.A., Akseno-
va I.V., Gryaznov G.D., Voskressensky L.G., Ru-
32. Полянская А.С., Перекалин В.В., Абоскалова Н.И.,
bin M.A. // Chem. Heterocycl. Compd. 2016. Vol. 52.
Соколова Л.Н. // А. с. СССР 335246 // Б. И. 1972. № 13.
N 11. P 923. doi 10.1007/s10593-017-1988-x
33. Фельгендлер А.В., Абоскалова Н.И., Берестовиц-
15. Abdelwaly A., Salama I., Gomaa M.S., Helal M.A. //
кая В.М. // ЖОХ. 2000. Т. 70. Вып. 7. С. 1158;
Med. Chem. Res. 2017. Vol. 26. N 12. P. 3173. doi
Fel’gendler A.V., Aboskalova N.I., Berestovitskaya V.M. //
10.1007/s00044-017-2011-x
Russ. J. Gen. Chem. 2000. Vol. 70. N 7. P. 1087.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
682
БАЙЧУРИН и др.
34. Бахарева С.В. Дис. … канд. хим. наук. СПб, 2001.
jlac.197519751003
158 с.
44. Ried W., Köhler E. // Lieb. Ann. 1956. Bd 598. Hf 2.
35. Берестовицкая В.М., Абоскалова Н.И., Ишмаева Э.А.,
S. 145. doi 10.1002/jlac.19565980207
Бахарева С.В., Беркова Г.А., Верещагина Я.А.,
45. Берестовицкая В.М., Байчурин Р.И., Абоскалова Н.И.,
Фельгендлер А.В., Фаттахова Г.Р. // ЖОХ. 2001.
Байчурина Л.В., Трухин Е.В., Фельгендлер А.В.,
Т.
71. Вып.
12. С.
2049; Berestovitskaya V.M.,
Генсировская М.А. // ЖОХ. 2016. Т. 86. Вып. 6.
Aboskalova N.I., Ishmaeva E.A., Bakhareva S.V.,
С.
936; Berestovitskaya V.M., Baichurin R.I.,
Berkova G.A., Vereshchagina Ya.A., Fel'gendler A.V.,
Aboskalova N.I., Baichurina L.V., Trukhin E.V.,
Fattakhova G.R. // Russ. J. Gen. Chem. 2001. Vol. 71.
Fel’gendler A.V., Gensirovskaya M.A. // Russ. J. Gen.
N 12. P. 1942. doi 10.1023/A:1014200612456
Chem. 2016. Vol. 86. N 6. P. 1266. doi 10.1134/
36. Байчурина Л.В., Байчурин Р.И., Абоскалова Н.И.,
S1070363216060086
Берестовицкая В.М. // ЖОХ. 2010. Т. 80. Вып. 10.
46. Берестовицкая В.М., Ишмаева Э.А., Литвинов И.А.,
С. 1712; Baichurina L.V., Baichurin R.I., Aboskalova N.I.,
Васильева О.С., Верещагина Я.А., Остроглядов Е.С.,
Berestovitskaya V.M. // Russ. J. Gen. Chem.
2010.
Фаттахова Г.Р., Бескровный Д.В., Александрова С.М. //
Vol.
80.
N
10.
P.
2022.
doi
10.1134/
ЖОХ. 2004. Т. 74. Вып. 7. С. 1198; Berestovitskaya V.M.,
S1070363210100221
Ishmaeva E.A., Litvinov I.A., Vasil'eva O.S.,
37. Вележева В.С., Ерофеев Ю.В., Суворов Н.Н.
//
Vereshchagina Ya.A., Ostroglyadov E.S., Fattakhova G.R.,
ЖОрХ. 1980. Т. 16. Вып. 10. С. 2157; Velezheva V.S.,
Beskrovnyi D.V., Aleksandrova S.M. // Russ. J. Gen.
Erofeev Yu.V., Suvorov N.N. // J. Org. Chem. USSR.
Chem. 2004. Vol. 74. N 7. P. 1108. doi 10.1023/
1980. Vol. 16. N 10. P. 1839.
B:RUGC.0000045874.46434.ea
38. Байчурин Р.И., Байчурина Л.В., Абоскалова Н.И.,
47. Булатова Н.Н., Суворов Н.Н. // ХГС. 1969. № 5.
Берестовицкая В.М. // ЖОХ. 2013. Т. 83. Вып. 9.
С.
813; Bulatova N.N., Suvorov N.N.
// Chem.
С. 1547; Baichurin R.I., Baichurina L.V., Aboskalova N.I.,
Heterocycl. Compd. 1969. Vol. 5. N 5. P. 602. doi
Berestovitskaya V.M. // Russ. J. Gen. Chem.
2013.
10.1007/BF00957368
Vol. 83. N 9. P. 1764. doi 10.1134/S1070363213090223
48. Young E.H.P. // J. Chem. Soc. 1958. N 10. P. 3493. doi
39. Байчурин Р.И., Абоскалова Н.И., Трухин Е.В.
10.1039/JR9580003493
Берестовицкая В.М. // ЖОХ. 2015. Т. 85. Вып. 8.
49. Ионин Б.И., Ершов Б.А., Кольцов А.И. ЯМР-
С. 1288; Baichurin R.I., Aboskalova N.I., Trukhin E.V.,
спектроскопия в органической химии. Л.: Химия,
Berestovitskaya V.M. // Russ. J. Gen. Chem.
2015.
1983. 272 с.
Vol. 85. N 8. P. 1845. doi 10.1134/S1070363215080101
50. Troschütz R., Grün L. // Archiv Pharm. 1993. Bd 326.
40. Woliński P., Jasiński R. // Czasopismo Techniczne.
Hf 11. S. 857. doi 10.1002/ardp.19933261104
Tech. Trans. Chem.
2018. N
2. P.
109. doi
51. Бабиевский К.К., Бахмутов В.И., Кочетков К.А.,
10.4467/2353737XCT.18.024.7997
Бурмистров В.А., Беликов В.М. // Изв. АН СССР.
41. Полянская А.С., Перекалин В.В., Абоскалова Н.И.,
Сер. хим.
1977.
№ 2. С. 425; Babievskii K.K.,
Демирева З.И., Соколова Л.Н., Абдулкина З.А. //
Bakhmutov V.I., Kochetkov K.A., Burmistrov V.A.,
ЖОрХ. 1979. Т.15. Вып. 10. С. 2057; Polyanskaya A.S.,
Belikov V.M. // Bull. Acad. Sci. USSR, Div. Chem. Sci.
Perekalin V.V., Aboskalova N.I., Demireva Z.I.,
1977. Vol. 26. N 2. P. 384. doi 10.1007/BF00921860
Sokolova L.N., Abdulkina Z.A. // J. Org. Chem. USSR.
52. Абоскалова Н.И., Бабиевский К.К., Беликов В.М.,
1979. Vol. 15. N 10. P. 859.
Перекалин В.В., Полянская А.С. // ЖОрХ. 1973. Т. 9.
42. Шадрин В.Ю. Дис. … канд. хим. наук. Л., 1987. 163 с.
Вып. 5. С. 1058; Aboskalova N.I., Babievskii K.K.,
43. Garming A., Redwan D., Gelbke P., Kern D., Dierkes U. //
Belikov V.M. Perekalin V.V., Polyanskaya A.S. // J. Org.
Lieb. Ann.
1975. N
10. S.
1744. doi
10.1002/
Chem. USSR. 1973. Vol. 9. N 5. P. 1082.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ И СТРОЕНИЕ ГЕМИНАЛЬНО АКТИВИРОВАННЫХ НИТРОЭТЕНОВ
683
Synthesis and Structure of Geminally Activated Nitroethenes
of The Indole Series
R. I. Baichurina, A. A. Fedoruschenkoa, N. I. Aboskalovaa, L. V. Baichurinab,
A. V. Felgendlerb, and S. V. Makarenkoa, *
a Herzen State Pedagogical University of Russia, nab. r. Moiki 48, St. Petersburg, 191186 Russia
e-mail: kohrgpu@yandex.ru
b S.M. Kirov Military Medical Academy, St. Petersburg, Russia
Received December 13, 2018; revised December 13, 2018; accepted December 20, 2018
A series of indole nitroethenes containing an ester, acetyl, benzoyl or nitrile function in the gem-position to the
nitro group was synthesized. Their structure was studied using the 1H, 13C{1H} NMR, IR and UV spectroscopy
methods.
Keywords: indole, gem-ethoxycarbonyl nitroethene, gem-acetylnitroethene, gem-benzoylnitroethene, gem-
cyanonitroethene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019