ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 690-700
УДК 547.385.1:547.825:547.834.22
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ
2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
РЕАКЦИЕЙ АЦЕТИЛЕНОВЫХ КЕТОНОВ С
ЦИАНОТИОАЦЕТАМИДОМ
© 2019 г. Д. С. Бурыйa, В. В. Доценкоa, b, *, А. С. Левашовa, Д. Ю. Лукинаa,
В. Д. Стрелковa, Н. А. Аксеновb, И. В. Аксеноваb, Е. Е. Нетребаc
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040, Россия
*e-mail: victor_dotsenko_@mail.ru
b Северо-Кавказский федеральный университет, Ставрополь, Россия
c Таврическая академия Крымского федерального университета имени В. И. Вернадского, Симферополь, Россия
Поступило в Редакцию 28 декабря 2018 г.
После доработки 28 декабря 2018 г.
Принято к печати 14 января 2019 г.
Реакцией ацетиленовых кетонов с цианотиоацетамидом в присутствии морфолина получены 4,6-
дизамещенные
2-тиоксо-1,2-дигидропиридин-3-карбонитрилы. Строение соединений доказано с
привлечением методов 2D ЯМР спектроскопии, а также превращениями в производные 3-аминотиено-
[2,3-b]пиридин-2-карбоксамида.
Ключевые слова: ацетиленовые кетоны, цианотиоацетамид, реакция Больмана-Ратца, реакция Торпа-
Циглера, тиено[2,3-b]пиридины
DOI: 10.1134/S0044460X19050056
2-Тиоксо-1,2-дигидропиридин-3-карбонитрилы
Подход в представляется наиболее рацио-
привлекают постоянное внимание химиков
нальным и гибким в силу большого выбора
благодаря доступности, интересному профилю био-
исходных 1,3-С3-диэлектрофилов (1,3-дикарбониль-
логической активности и возможностям широкого
ных соединений, непредельных кетонов, альде-
использования в синтезе различных гетероцикли-
гидов, нитрилов, енаминокетонов и енамино-
ческих систем [1-5]. В частности, 2-тиоксо-1,2-
эфиров, винамидиниевых солей и т. п.) и
дигидропиридин-3-карбонитрилы являются наиболее
появляющихся вследствие этого возможностей
важными прекурсорами в синтезе 3-аминотиено-
модифицирования структуры 1 в весьма широких
[2,3-b]пиридинов
- популярного класса гетеро-
пределах. Среди различных способов построения
циклических соединений с широчайшим спектром
пиридинового цикла
[12] следует отметить
практического применения [6-11]. Традиционные
реакцию Больмана-Ратца, основанную на
подходы к получению
2-тиоксо-1,2-дигидро-
взаимодействии α,β-ацетиленовых кетонов с
пиридин-3-карбонитрилов 1 основаны на тиолизе
енаминоэфирами и аналогичными N-C-C
2-хлорникотинонитрилов (путь а) или
3-оксо-
реагентами. В то же время в литературе нам
пропилмалононитрилов (путь б), взаимодействии
удалось обнаружить единственный пример
цианотиоацетамида
2 с
1,3-С3-диэлектрофилами
взаимодействия α,β-ацетиленового кетона
(4-
(путь в), присоединении активных карбонильных
фенилбут-3-ин-2-она) в качестве 1,3-С3-диэлектро-
соединений или их енаминов к активированным 2-
фильного реагента с цианотиоацетамидом 2 [13].
цианотиоакриламидам с последующей цикли-
Авторами работы отмечается (без описания
зацией (путь г), или же на трех- и много-
подробностей эксперимента и глубокого анализа
компонентных подходах (путь д, схема 1) [1-5].
строения продуктов), что направлением реакции
690
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ 2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
691
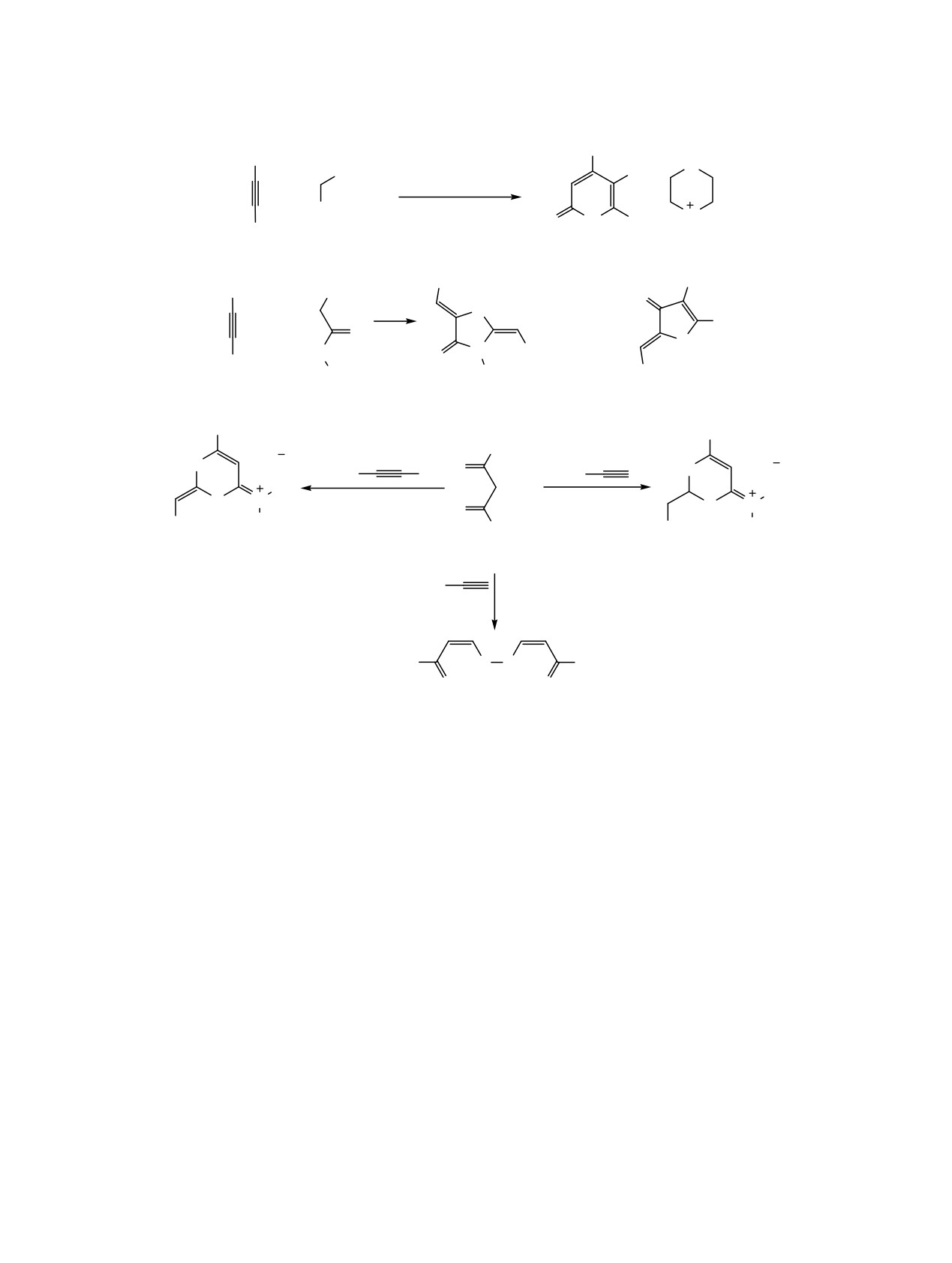
Схема 1.
R2
R2
S
R1
CN
R1
CN
H2N
NH2
CN
R
N
Cl
R
O
R2
б
а
R1
CN
R2
R2
R
N
S
CN
в
H
г
R1
1
CN
R1
+
-
+
+
S
д
+
+
R
H2N
S
R
H2N
2
R2CHO
R1
-
CN
+
+
CSNH2
R
можно управлять, и это позволяет получать
22,
23]. Реакцией малондитиоамидов
6 с
региоизомерные пиридин-2(1Н)-тионы (схема 2).
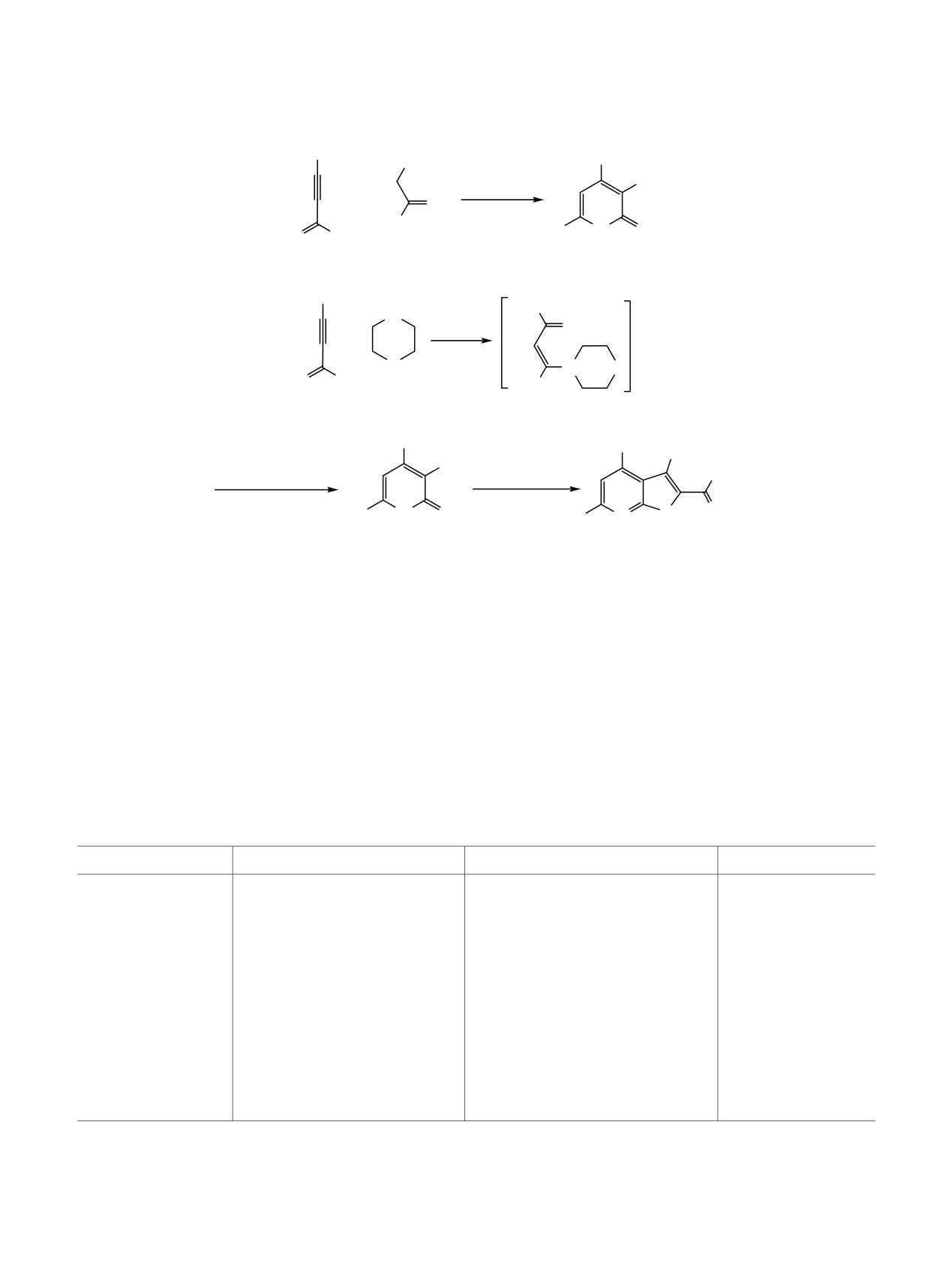
метилпропиолатом [24], 1-ацил-2-бромацетиленами
Так, одновременное взаимодействие фенил-
[25, 26] или бензоилацетиленом [27] были полу-
бутинона с тиоамидом 2 и морфолином ведет к
чены 1,3-дитиины 7, 8 и дисульфид 9 (схема 3).
образованию 6-метил-4-фенилзамещенного продукта
А, тогда как предварительная обработка ацети-
Ранее нами были разработаны удобные
ленового кетона морфолином и дальнейшая
препаративные методы синтеза α,β-ацетиленовых
конденсация образовавшегося β-енаминокетона с
кетонов, исходя из тетраалкинилстаннанов [28-30].
цианотиоацетамидом
2 приводит к
4-метил-6-
Продолжая работы в химии 2-тиоксо-1,2-дигид-
фенилзамещенному изомеру Б.
ропиридин-3-карбонитрилов и родственных тиено-
[2,3-b]пиридинов
[31-36], мы решили изучить
Известно, что метиленактивные тиоамиды легко
возможность практического получения 2-тиоксо-
вступают в реакцию с активированными ацетиле-
1,2-дигидропиридин-3-карбонитрилов по реакции
нами - эфирами пропиоловой и ацетилендикарбо-
Больмана-Ратца
[37], исходя из цианотиоаце-
новой кислот. При этом в зависимости от условий
тамида 2 и ряда α,β-ацетиленовых кетонов 10a-е
и строения реагентов образуются производные
(схема 4), а также изучить региоселективность
3-цианопиридин-2-тиолата 3 [14-16], тиазолидина
реакции и строение образующихся продуктов.
4 [17-21] или 3-оксо-2,3-дигидротиофена 5 [17, 18,
Схема 2.
Ph
NCCH2CSNH2
CN
2
морфолин,
25°C, EtOH
H3C
N
S
H
O
CH3
A, 75%
O
CH3
Ph
N
морфолин,
NCCH2CSNH2
Ph
CN
3-4 ч
2
O
25°C, EtOH
Ph
N
S
CH3
H
Б, 49%
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
692
БУРЫЙ и др.
Схема 3.
R
R
O
CN
CN
абс. EtOH, 45-60°C
+
CSNH2
морфолин
N
O
N
S-
CO2Me
H2
H
2
3
CO2Me
EWG
CO2Me
EWG
O
S
и/или
NR2
+
S
S
RN
N
EWG
O
CO2Me
R
R
CO2Me
4
5
NHR2
NHR2
NHR2
S
ClO4
S
S
ClO4
Ar(O)C
Br
MeO2C
H
H
S
N
HClO4, AcOH
HClO4, AcOH
S
N
S
C(O)Ar
R2
NHR2
CO2Me
R2
8
6
7
Ph(O)C
R2 = H
Et3N, EtOAc
Ph
S
S
Ph
O
O
9
EWG = CN, COOR, C(O)NHAr.
Установлено, что прямое взаимодействие
обрабатывали небольшим избытком морфолина
тиоамида 2 с кетонами 10 в присутствии оснований
при нагревании в ДМФА, затем цианотио-
(KОН, Et3N) в различных растворителях (EtOH,
ацетамидом 2 и раствором KОН в спирте (схема 4).
PhMe, n-PrOH, n-BuOH, ДМФА) приводит к
После подкисления из реакционной смеси
осмолению реакционной массы и образованию
осаждаются соединения 11a-е. Мы полагаем, что
многокомпонентных смесей, согласно данным
первоначально
имеет
место
селективное
ТСХ и ГХ-МС. Наблюдаемая неселективность
присоединение морфолина по тройной связи
реакции, предположительно, связана с тем, что
кетонов 10 с образованием енаминокетонов 12,
цианотиоацетамид
2
имеет три активных
которые региоселективно реагируют с тиоамидом 2
нуклеофильных центра и может реагировать с
по механизму SNVin с последующей 6-экзо-триг-
активными кетонами 10 по различным маршрутам -
циклизацией и отщеплением молекулы воды.
как мононуклеофильный реагент, или же как C,N-,
Соединения 11 вступают в тандемную реакцию S-
С,S- или S,N-бинуклеофил.
алкилирования/циклизации по Торпу-Циглеру с
хлорацетамидом с образованием ожидаемых тиено-
Дальнейшие исследования показали, что
2-
[2,3-b]пиридинов 13.
тиоксо-1,2-дигидропиридин-3-карбонитрилы могут
быть синтезированы при условии добавления
Строение соединений 11a-е и 13a, б также
реагентов в строго заданной последовательности.
подтверждается данными ИК спектроскопии, масс-
Так, ацетиленовые кетоны
10 последовательно
спектрометрии высокого разрешения, а также
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ 2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
693
Схема 4.
R1
R1
CN
CN
основание
+
×
S
H2N
R
N
S
O R
H
2
11
R1
H
R
N
O
ДМФА
+
150°C
O
N O
O R
R1
10a-е
12
R1
R1
NH2
NCCH2C(S)NH2
CN
ClCH2CONH2
NH
2
2
KOH, ДМФА-EtOH
KOH, ДМФА
R
N
S
S
O
R
N
H
11a-е
13a, б
R = R1 = Ph (11а); R = CH3(CH2)2, R1 = Ph (11б); R = 3-MeOC6H4, R1 = Ph (11в); R = Ph, R1 = 4-MeC6H4 (11г); R =
4-(CH3)3CC6H4, R1 = Ph (11д); R = CH3, R1 = Ph (11е); R = R1 = Ph (13a); R = 4-(CH3)3CC6H4, R1 = Ph (13б).
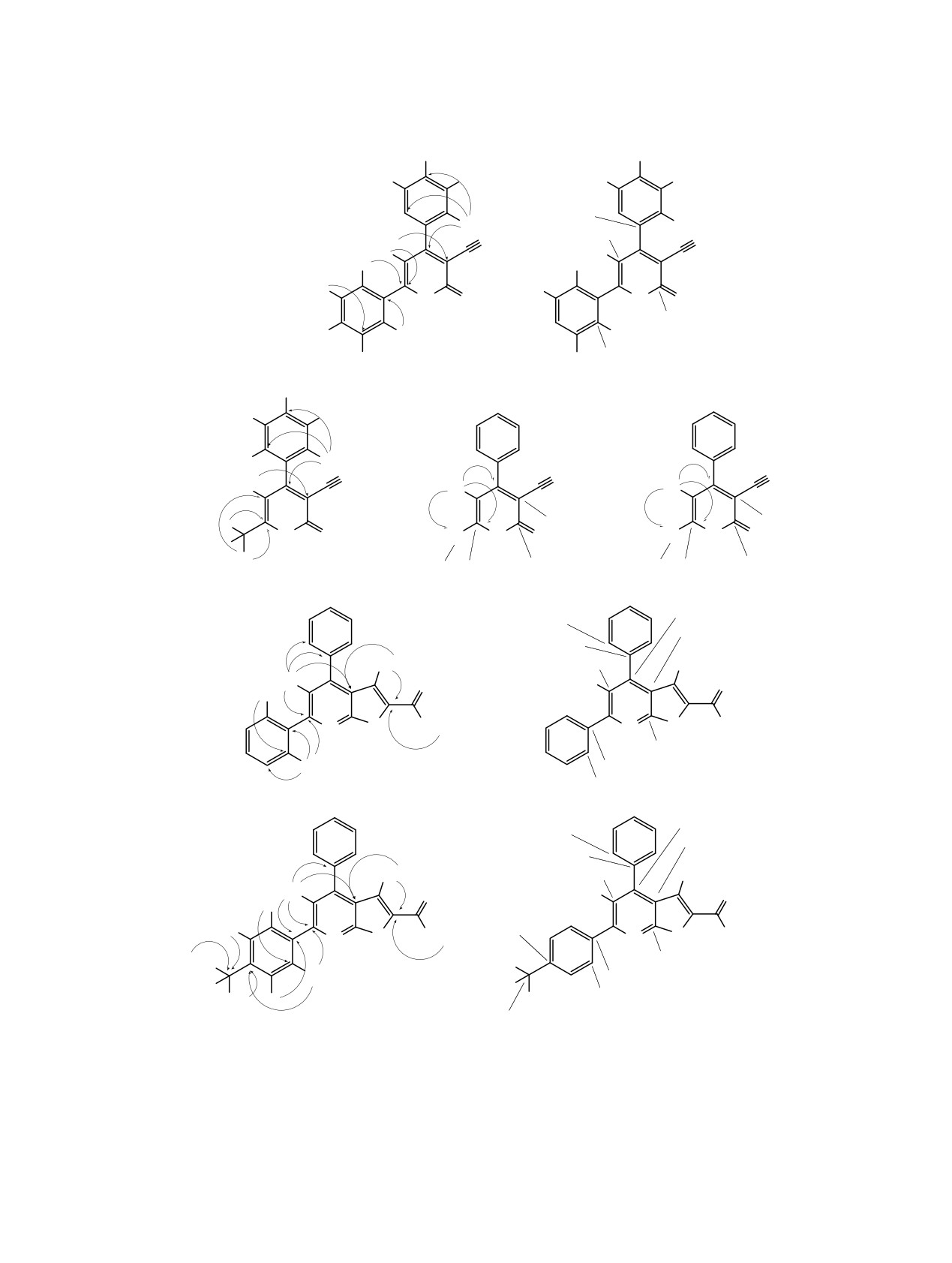
спектроскопии ЯМР на ядрах 1Н, 13С (DEPTQ). В
1Н-13С HSQC, 1Н-13С HMBC, 1Н-15N HSQC, 1Н-15N
ИК спектрах соединений
11a-е имеются
HMBC (схема 5). Вопреки данным работы [13], в
характерные полосы поглощения, соответству-
спектрах не обнаружено сигналов региоизомеров,
ющие валентным колебаниями сопряженной
соответствующих структуре Б (схема 2).
нитрильной группы (2218-2224 см-1). Интенсивная
В спектре HMBC 1H-13C 4-(4-метилфенил)-2-
полоса поглощения тиокарбонильной группы
тиоксо-6-фенил-1,2-дигидропиридин-3-карбонитрила
обнаруживается в области 1204-1213 см-1.
11г обнаруживаются корреляции, указывающие на
Строение полученных соединений однозначно
связь
4-толильного заместителя с атомом С4
подтверждено методами 2D ЯМР спектроскопии
(156.4 м. д.), а фенильного заместителя - с атомом
Таблица 1. Основные корреляции в HSQC и HMBC 2D ЯМР спектрах соединения 11гa
δH, м. д.
1H-13C HSQC, δ, м. д.
1H-13C HMBC, δ, м. д.
1H-15N HMBC, δ, м. д.
2.39 с (3Н, ArСН3)
21.0* (ArСН3)
129.3* (CH, Ar), 140.8 (CMe)
-
7.09 с (1Н, Н5)
113.1* (C5H)
112.5 (C3), 132.7 (C1, Ar), 152.2 (C6)
195.1 (N1)
7.37 д (2H, H3, H5 Ar)
129.3* (CH, Ar)
21.0* (ArСН3), 129.3* (CH, Ar),
-
132.7 (C1, Ar)
7.51-7.61 м (4H, Ar)
128.8* (CH, Ar), 131.5* (CH, Ar)
128.8* (CH, Ar), 131.3 (C1, Ar)
-
7.65 д (2H, H2, H6 Ar)
128.5* (CH, Ar)
128.5* (CH, Ar), 140.8 (CMe), 156.4
-
(C4)
7.84 д (2H, H2, H6 Ph)
128.6* (CH, Ar)
128.6* (CH, Ar), 131.3 (C1, Ar), 152.2
-
(C6)
14.21 уш. с (1Н, NH)
-
-
-
a Здесь и далее звездочкой обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР 13C DEPTQ (СН, СН3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
694
БУРЫЙ и др.
Схема 5.
2.39
CH3
21.0
CH
3
7.37
7.37
140.8
H
H
H
H
129.3
129.3
128.5
7.65
132.7
H
H
7.09
113.1
N
N
156.4
H
H
7.84
117.0
H
H
112.5
152.2
H
H
N
S
N S
128.8
131.3
7.51-7.61
H
H
131.5
179.5
14.21
H
H
H
128.8
7.84
7.51-7.61
128.6
H
H
11г
H7.54-7.56
130.5
130.4
H
H
128.8
128.8
7.59-7.62
7.59-7.62
135.7
136.1
128.2
128.2
128.0
128.0
H
H
N
N
N
156.6
6.34
160.2
6.83
H
H
H
116.9
116.7
114.1
106.6
111.3
97.6
H
N
S
H3C
N
S
2.31
H3C
N
O
H
H
H
H
H
19.1
19.2
2.42
14.12
152.2
12.63
161.5
153.6
178.5
11е
11е-O
129.2
147.5
128.8
128.7
121.1
7.57-7.58
136.1
NH2
5.89
118.2
NH2
7.76
H
H
145.5
O
O
8.21
H
127.1
166.9
155.5
7.47-7.52
98.5
S
128.9
S
NH2
N
NH2 7.28
N
129.8
159.7
H
8.21
137.5
128.9
127.1
13a
129.2
147.4
128.8
128.7
7.57-7.58
120.9
136.7
NH2
5.87
117.9
NH2
7.71
H
H
145.5
O
O
8.13
H
126.9
166.9
155.6
7.52
152.5
98.3
H
S
NH2 7.25
S
NH2
N
N
H3C
H3
31.0C
159.7
1.31
H
8.13
134.8
H3C
H3C
125.7
126.9
CH3
H
CH
3
34.5
31.0
7.52
13б
С6 (152.2 м. д., табл. 1). В спектре HMBC 1H-13C
С6 (153.6 м. д.) и С5 (114.1 м. д., табл. 2). Это
6-метил-2-тиоксо-4-фенил-1,2-дигидропиридин-3-
однозначно подтверждает строение продукта как
карбонитрила
11е атомы водорода метильной
6-метил-4-фенильного региоизомера (структура А,
группы дают всего два кросс-пика - с углеродами
схема
2), поскольку для протонов метильной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ 2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
695
Таблица 2. Основные корреляции в HSQC и HMBC 1H-13C 2D ЯМР спектрах соединения 11е
δH, м. д.
1H-13C HSQC, δ, м. д.
1H-13C HMBC, δ, м. д.
2.42 с (3Н, СН3)
19.1 (СН3)
114.1 (C5H), 153.6* (C6)
6.83 с (1Н, Н5)
114.1 (C5H)
19.1 (СН3), 111.3*(C3), 116.9* (CN), 135.7*
(C1, Ph), 153.6* (C6), 156.6* (C4)
7.54-7.56 м (3H, Н3-5, Ph)
128.8 (CH, Ph), 130.5 (CH, Ph)
128.2 (CH, Ph), 128.8 (CH, Ph), 130.5 (CH, Ph)
7.59-7.62 м (2H, Н2-6, Ph)
128.2 (CH, Ph)
128.2 (CH, Ph), 128.8 (CH, Ph), 130.5 (CH,
Ph), 135.7* (C1, Ph), 156.6* (C4)
14.12 уш. с (1Н, NH)
-
-
группы 4-метил-6-фенильного изомера (структура
Основные корреляции в HSQC и HMBC 1H-13C
Б, схема 2) следовало бы ожидать набор из трех
2D ЯМР спектрах тиено[2,3-b]пиридин-2-карбок-
кросс-пиков с сигналами атомов С3, С4 и С5.
самидов 13а и 13б представлен в табл. 3, 4.
Помимо этого, в спектрах ЯМР неочищенного
образца соединения 11е обнаруживается примесь
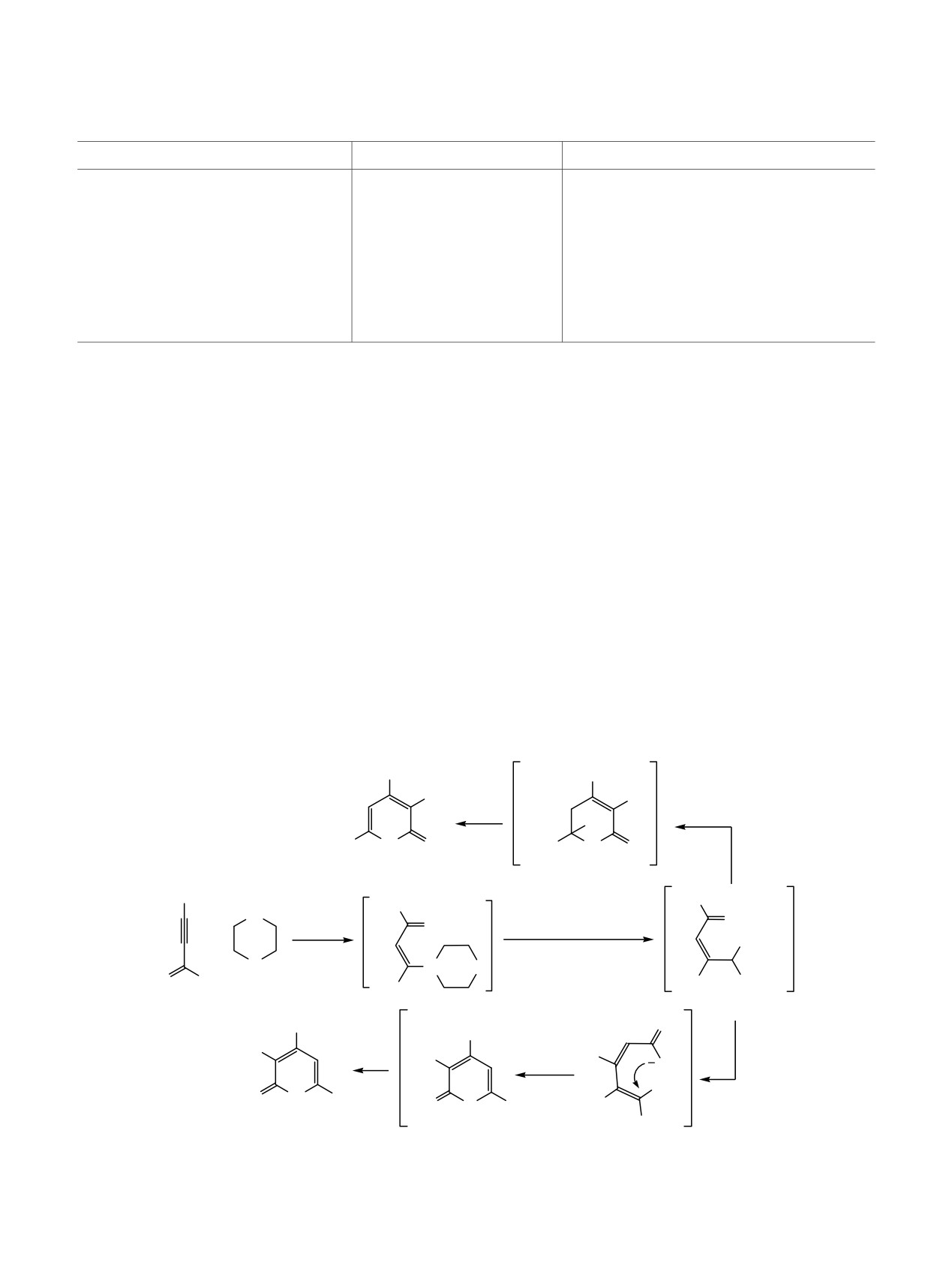
Таким образом, показана возможность полу-
(~8-9 мол%) кислородного аналога
11е-O.
чения
важных
полупродуктов
тонкого
Последний однозначно идентифицирован по
органического синтеза, 2-тиоксо-1,2-дигидропири-
данным спектроскопии ЯМР 1Н-13С HSQC, 1Н-13С
дин-3-карбонитрилов, из ацетиленовых кетонов и
HMBC (схема 5), а также хорошим совпадением со
цианотиоацетамида в условиях модифицированной
спектрами заведомого образца [38]. Возможный
реакции Больмана-Ратца. Установлено, что прямая
механизм образования продукта
11е-O
конденсация реагентов в присутствии морфолина
предполагает возможность элиминирования
ведет к осмолению и образованию смесей, тогда
сероводорода из линейного интермедиата 14 путем
как последовательная обработка инонов морфо-
нуклеофильной атаки тиоамидной группы
лином и цианотиоацетамидом региоселективно
енольным атомом кислорода (схема
6)
с
дает целевые продукты. В числе недостатков
последующей рециклизацией 2-имино-2Н-пирана в
подхода следует указать относительно невысокие
основной среде по известной схеме [39].
выходы
2-тиоксо-1,2-дигидропиридин-3-карбо-
Схема 6.
Ph
Ph
CN
CN
OH
−H2O
H3C
N
S
H3C
N
S
H
H
11е
Ph
H3C
H
H3C
NCCH2C(S)NH2
N
O
ДМФА
O
2
+
CSNH2
150°C
KOH, ДМФА-EtOH
O
N O
O CH3
Ph
CN
Ph
10е
14
Ph
CH2
Ph
NC
NC
Ph
O
−H2S
SH
O
N
CH3
HN
O CH3
NC
H
NH2
11е-O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
696
БУРЫЙ и др.
Таблица 3. Основные корреляции в HSQC и HMBC 1H-13C 2D ЯМР спектрах 3-амино-4,6-дифенилтиено[2,3-b]пири-
дин-2-карбоксамида 13а
δH, м. д.
1H-13C HSQC, δ, м. д.
1H-13C HMBC, δ, м. д.
5.89 с (2Н, NН2)
-
98.5 (C2), 121.1 (C3а), 145.5 (С3)
7.28 с (2Н, CONH2)
-
98.5 (C2)
7.47-7.52 м (3H, Н3-5, Ph)
128.9* (CH, Ph), 129.8* (CH, Ph)
127.1* (C2, С6 Ph), 128.9* (CH, Ph), 137.5 (C1, Ph)
7.57-7.58 м (5H, Ph)
128.7* (CH, Ph) 128.8* (CH, Ph)
128.7* (CH, Ph), 128.8* (CH, Ph), 129.2* (CH, Ph),
129.2* (CH, Ph)
136.1 (C1, Ph), 147.5 (С4)
7.76 с (1H, Н5)
118.2* (С5)
121.1 (C3а), 128.7* (CH, Ph), 136.1 (C1, Ph), 137.5 (C1,
Ph), 155.5 (C6)
8.21 д (2H, Н2, Н6, Ph)
127.1* (C2, С6 Ph)
127.1* (C2, С6 Ph), 128.9* (CH, Ph), 129.8* (CH, Ph),
137.5 (C1, Ph), 155.5 (C6)
Таблица 4. Основные корреляции в HSQC и HMBC 1H-13C 2D ЯМР спектрах 3-амино-6-(4-трет-бутилфенил)-4-
фенилтиено[2,3-b]пиридин-2-карбоксамида 13б
δH, м. д.
1H-13C HSQC, δ, м. д.
1H-13C HMBC, δ, м. д.
1.31 с [9Н, С(СН3)3]
31.0* [С(СН3)3]
31.0* [С(СН3)3], 34.5 [С(СН3)3], 152.5 (C-Bu-t)
5.87 с (2Н, NН2)
-
98.3 (C2), 120.9 (C3a), 145.5 (C3)
7.25 с (2Н, CONH2)
-
98.3 (C2)
7.52 д (2H, Н3, Н5,
125.7* (CH, Ar)
34.5 [С(СН3)3], 125.7* (CH, Ar), 134.8 (C1, Ar)
4-t-BuC6H4)
7.57-7.58 м (5H, Ph)
128.7* (CH, Ar), 128.8* (CH, Ar),
128.7* (CH, Ar), 128.8* (CH, Ar), 129.2* (CH, Ar),
129.2* (CH, Ar)
136.7 (C1, Ar), 147.4 (C4)
7.71 с (1H, Н5)
117.9* (C5)
120.9 (C3a), 134.8 (C1, Ar), 136.7 (C1, Ar), 145.5 (C3),
155.6 (C6)
8.13 д (2H, Н2, Н6,
126.9* (CH, Ar)
126.9* (CH, Ar), 152.5 (C-Bu-t), 155.6 (C6)
4-t-BuC6H4)
нитрилов (50-60%). Ограничением также является
ных соединений детально изучено с привлечением
невозможность ввести заместитель в положение 5
методов 2D ЯМР спектроскопии.
на стадии построения пиридинового цикла. К
числу достоинств метода следует отнести высокую
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
вариабельность и селективность введения
заместителей в при атомах С4 и С6. Предложенный
Спектры ЯМР регистрировали на приборе
подход пригоден для селективного введения в
Bruker Avance III HD
400MHz на ядрах
1Н
положения 4 и 6 алкильных заместителей. Это
(400.17 MГц), 13С (100.63 МГц), 15N (40.55 МГц) в
представляется существенным преимуществом,
растворе ДМСО-d6, в качестве стандарта
поскольку классический пиридиновый синтез по
использовали остаточные сигналы растворителя.
Гуарески-Торпу в случае несимметричных
1,3-
Для спектров ЯМР
15N в качестве внешнего
дикетонов (схема
1, подход в) протекает
стандарта использовали нитрометан (δN 381.7 м. д.).
неселективно [35], а синтезы на основе других
ИК спектры регистрировали на Фурье-спектро-
субстратов (халконов, непредельных нитрилов и
метре Bruker Vertex 70 с приставкой НПВО на
др.)
ограничены возможностью введения
кристалле алмаза, спектральное разрешение ±4 см-1.
преимущественно ароматических и гетеро-
Масс-спектры высокого разрешения (HRMS)
ароматических заместителей. Строение получен-
получены на времяпролетном масс-спектрометре
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ 2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
697
Bruker maXis хионизация распылением в электри-
(СН3), 22.0 (СН2СН2СН3), 34.1 (СН2СН2СН3), 111.6
ческом поле (ESI-TOF), растворитель - MeCN,
(C3), 113.4* (C5H), 116.8 (C≡N), 128.3* (C4H, Ph),
калибровка по HCO2Na-HCO2H]. Контроль за
128.8* (C3H, C5H, Ph), 130.5* (C2H, C6H, Ph), 135.7
чистотой полученных соединений осуществляли
(C1, Ph), 156.7 (C6), 157.1 (C4), 178.6 (С2). Масс-
методом ТСХ на пластинах Сорбфил-А, элюент -
спектр (HRMS ESI-TOF), m/z: 277.0767 [M + Na]+
ацетон-петролейный эфир (1:1), проявление УФ
(вычислено для C15H14N2NaS: 277.0770).
светом.
6-(3-Метоксифенил)-2-тиоксо-4-фенил-1,2-ди-
Цианотиоацетамид
2 получен пропусканием
гидропиридин-3-карбонитрил (11в). Выход 53%,
тока сероводорода через спиртовой раствор мало-
оранжевый порошок, т. пл. 185°С. ИК спектр, ν, см-1:
нонитрила в пристутствии триэтиламина [35].
3061 (N-H), 2224 (C≡N), 1643, 1585, 1555 (С=С),
1211 (C=S). Спектр ЯМР 1Н, δ, м. д.: 3.85 с (3Н,
2-Тиоксо-1,2-дигидропиридин-3-карбонитрилы
OСН3), 7.12-7.16 м (2H, Н5, Ar), 7.43-7.44 м (3H,
11a-е (общая методика). Смесь
1 ммоль α,β-
Ar), 7.56-7.58 м (3H, Ar), 7.72-7.74 м (2H, Ar),
ацетиленового кетона 10a-е, 0.25 мл ДМФА и
14.23 уш. с (1Н, NH). Спектр ЯМР 13С DEPTQ, δC,
96 мг
(1.1 ммоль) морфолина нагревали при
м. д.: 55.5* (OСН3), 112.9 (C3), 113.2* (C5H), 116.8
перемешивании до 150°C в течение 5 мин. После
(C≡N), 118.0* (CH, Ar), 120.9* (CH, Ar), 128.5*
охлаждения до комнатной температуры добавляли
(CH, Ar), 128.8* (CH, Ph), 129.9* (CH, Ph), 130.6*
раствор цианотиоацетамида 2 (100 мг, 1 ммоль) и
(CH, Ph), 132.5 (C1, Ar), 135.6 (C1, Ph), 152.1 (C6),
KOH (56 мг, 1 ммоль) в 0.3 мл EtOH. Полученную
156.4 (C4), 159.3 (COMe), 179.5 (С2). Масс-спектр
смесь нагревали при 150°C в течение 15 мин. За
(HRMS ESI-TOF), m/z:
341.0722
[M
+ Na]+
это время реакционная смесь приобретала темно-
(вычислено для C19H14N2NaOS: 341.0719).
красный цвет и частично или полностью
закристаллизовывалась. После охлаждения смеси
4-(4-Метилфенил)-2-тиоксо-6-фенил-1,2-ди-
примерно до 50°C ее обрабатывали ледяной AcOH
гидропиридин-3-карбонитрил (11г). Выход 61%,
(0.3 мл, 5 ммоль) и добавляли 2 мл смеси воды с
т. пл. 217°С. ИК спектр, ν, см-1: 3155 (N-H), 2218
этанолом
(1:1 по объему). Осадок отфильтро-
(C≡N), 1637, 1601, 1574, 1547 (С=С), 1205 (C=S).
вывали,
промывали
50%-ным EtOH, затем
Спектр ЯМР 1Н, δ, м. д.: 2.39 с (3Н, ArСН3), 7.09 с
изопропанолом и гексаном.
(1Н, Н5), 7.37 д (2H, H3, H5, Ar, 3J = 8.1 Гц), 7.51-
7.61 м (4H, Ar), 7.65 д (2H, H2, H6, Ar, 3J = 8.1 Гц),
2-Тиоксо-4,6-дифенил-1,2-дигидропиридин-3-
7.84 д (2H, H2, H6 Ph, 3J = 7.3 Гц), 14.21 уш. с (1Н,
карбонитрил (11a). Выход 54%, желтый порошок,
NH). Спектр ЯМР 13С DEPTQ, δC, м. д.: 21.0*
т. пл. 223°С (т. пл. 228-230°С [40], 226-228°C [41]).
(ArСН3), 112.5 (C3), 113.1* (C5H), 117.0 (C≡N),
ИК спектр, ν, см-1: 3155 (N-H), 2220 (C≡N), 1637,
128.5* (CH, Ar), 128.6* (CH, Ar), 128.8* (CH, Ar),
1602, 1552 (С=С), 1211 (С=S). Спектр ЯМР 1Н, δ, м. д.:
129.3* (CH, Ar), 131.3 (C1, Ar), 131.5* (CH, Ar),
7.12 с (1Н, Н5), 7.51-7.61 м (6H, Ar), 7.73-7.75 м
132.7 (C1, Ar), 140.8 (CMe), 152.2 (C6), 156.4 (C4),
(2H, Ar), 7.86 д (2H, Ar, 3J = 7.8 Гц), 14.27 уш. с
179.5 (С2). Масс-спектр (HRMS ESI-TOF), m/z:
(1Н, NH). Спектр ЯМР 13С DEPTQ, δC, м. д.: 112.8
найдено
325.0764
[M
+ Na]+ (вычислено для
(C3), 113.2* (C5H), 116.9 (C≡N), 128.5* (CH, Ar),
C19H14N2SNa: 325.0770).
128.7* (CH, Ar), 128.8* (CH, Ar), 130.6* (CH, Ph),
131.2 (C1, Ar), 131.6* (CH, Ph), 135.6 (C1, Ph), 152.4
6-(4-трет-Бутилфенил)-2-тиоксо-4-фенил-1,2-
(C6), 156.4 (C4), 179.5 (С2). *Сигналы в противо-
дигидропиридин-3-карбонитрил
(11д). Выход
фазе. Масс-спектр (HRMS ESI-TOF), m/z: 311.0607
41%, желтый порошок, т. пл. 230°С. ИК спектр, ν,
[M + Na]+ (вычислено для C18H12N2NaS: 311.0613).
см-1: 3157 (N-H), 2218 (C≡N), 1639, 1612, 1605,
1549 (С=С), 1213 (C=S). Спектр ЯМР 1Н, δ, м. д.:
6-Пропил-2-тиоксо-4-фенил-1,2-дигидропи-
1.30 с [9Н, С(СН3)3], 7.11 с (1H, Н5), 7.54-7.57 м
ридин-3-карбонитрил (11б). Выход 58%, желтый
(5H, Ar), 7.71-7.73 м (2H, Ar), 7.81 д (2H, H2, H6,
порошок, т. пл. 212°С. ИК спектр, ν, см-1: 3167
Ar, 3J = 8.6 Гц), 14.16 уш. с (1Н, NH). Масс-спектр
(N-H), 2220 (C≡N), 1605, 1558 (С=С), 1213 (С=S).
(HRMS ESI-TOF), m/z:
367.1238
[M
+ Na]+
Спектр ЯМР 1Н, δ, м. д.: 0.89 т (3Н, СН3, 3J =
(вычислено для C22H20N2NaS: 367.1239).
7.3 Гц), 1.60-1.69 м (2Н, СН2СН2СН3), 2.67 д (2Н,
СН2СН2СН3, 3J = 7.6 Гц), 6.83 с (1Н, Н5), 7.53-7.56
6-Метил-2-тиоксо-4-фенил-1,2-дигидропиридин-
м (3H, Ph), 7.61-7.63 м (2H, Ph), 14.09 уш. с (1Н,
3-карбонитрил (11е). Выход 53%, желтый порошок,
NH). Спектр ЯМР 13С DEPTQ, δC, м. д.: 13.4*
т. пл. 231°С (т. пл. 274-276°С [13]). ИК спектр, ν,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
698
БУРЫЙ и др.
см-1: 3171 (N-H), 2222 (C≡N), 1639, 1614, 1605,
ФОНДОВАЯ ПОДДЕРЖКА
1556 (С=С), 1211 (C=S). Спектр ЯМР 1Н, δ, м. д.:
2.42 с (3Н, СН3), 6.83 с (1Н, Н5), 7.54-7.56 м (3H,
Работа выполнена при частичной финансовой
Ph), 7.59-7.62 м (2H, Ph), 14.12 уш. с (1Н, NH).
поддержке Министерства образования и науки
Спектр ЯМР 13С DEPTQ, δC, м. д.: 19.1 (СН3),
Российской
Федерации
(проект
МОН
111.3* (C3), 114.1 (C5H), 116.9* (C≡N), 128.2 (C2H,
№ 4.5547.2017/8.9, В.В. Доценко, И.В. Аксенова;
C6H, Ph), 128.8 (C3H, C5H, Ph), 130.5 (C4H, Ph),
проект МОН № 4.1196.2017/4.6, Н.А. Аксенов).
135.7* (C1, Ph), 153.6* (C6), 156.6* (C4), 178.5* (С2).
КОНФЛИКТ ИНТЕРЕСОВ
6-Метил-2-оксо-4-фенил-1,2-дигидропиридин-
3-карбонитрил (11е-О). Спектр ЯМР 1Н, δ, м. д.:
Авторы заявляют об отсутствии конфликта
2.31 с (3Н, СН3), 6.34 с (1Н, Н5), 12.63 уш. с (1Н,
интересов.
NH). Спектр ЯМР 13С DEPTQ, δC, м. д.: 19.2 (СН3),
97.6* (C3), 106.6 (C5H), 116.7* (C≡N), 128.0 (C2H,
СПИСОК ЛИТЕРАТУРЫ
C6H, Ph), 130.4 (C4H, Ph), 136.1* (C1, Ph), 152.2*
(C6), 160.2* (C4), 161.5* (С2).
1. Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A.,
Shestopalov A.M., Senning A. // J. Sulfur Chem. 1992.
3-Амино-4,6-дифенилтиено[2,3-b]пиридин-2-
Vol. 13. N 1. P. 1. doi 10.1080/01961779208048951
карбоксамид (13а). Выход 81%, желтый порошок,
2. Litvinov V.P. // Phosphorus, Sulfur, Silicon, Relat.
т. пл. 229°С (т. пл. 251-252°С [42]). ИК спектр, ν,
Elem. 1993. Vol. 74. N 1. P. 139. doi 10.1080/
см-1: 3487, 3450, 3329, 3296, 3157 (N-H), 1639, 1587
10426509308038105
(C=N, С=С). Спектр ЯМР 1Н, δ, м. д.: 5.89 уш. с
3. Литвинов В.П. // Изв. АН. Сер. хим. 1998. № 11.
(2Н, NH2), 7.28 уш. с [2Н, C(O)NH2], 7.47-7.52 м
С. 2123; Litvinov V.P. // Russ. Chem. Bull.
1998.
(3H, Ar), 7.57-7.58 м (5H, Ph), 7.76 с (1Н, Н5), 8.21 д
Vol. 47. N 11. P. 2053. doi 10.1007/BF02494257
(2H, H2, H6, Ar, 3J = 6.9 Гц). Спектр ЯМР 13С
4. Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. //
ХГС. 1999. № 5. С. 579; Litvinov V.P., Krivoko-
DEPTQ, δC, м. д.: 98.5 (C2), 118.2* (C5), 121.1 (C3a),
lysko S.G., Dyachenko V.D.
// Chem. Heterocycl.
127.1* (CH, Ar), 128.7* (CH, Ar), 128.8* (CH, Ar),
Compd. 1999. Vol. 35. N 5. P. 509. doi 10.1007/
128.9* (CH, Ar), 129.2* (CH, Ar), 129.8* (CH, Ar),
BF02324634
136.6 (C1, Ph), 137.5 (C1, Ph), 145.5 (C3), 147.5 (C4),
5. Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7. С. 645;
155.5 (C6), 159.7 (C7а), 166.9 (CONH2). Спектр ЯМР
Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75. N 7.
15N, δN, м. д.: 69.2 (NH2), 105.3 (CONH2), 286.8
P. 577. doi 10.1070/RC2006v075n07ABEH003619
(NPy). Масс-спектр (HRMS ESI-TOF), m/z: 368.0833
6. Bakhite E.A.-G. // Phosphorus, Sulfur, Silicon, Relat.
[M
+ Na]+ (вычислено для C20H15N3NaOS:
Elem.
2003. Vol.
178. P.
929. doi
10.1080/
368.0828).
10426500390208820
7. Литвинов В.П., Доценко В.В., Кривоколыско С.Г. //
3-Амино-6-(4-трет-бутилфенил)-4-фенилти-
Изв. АН. Сер. хим. 2005. № 4. С. 847; Litvinov V.P.,
ено[2,3-b]пиридин-2-карбоксамид
(13б). Выход
Dotsenko V.V., Krivokolysko S.G. // Russ. Chem. Bull.
83%, желтый порошок, т. пл. 262°С. ИК спектр, ν,
2005. Vol. 54. N 4. P. 864. doi 10.1007/s11172-005-
см-1: 3488, 3464, 3340, 3109 (N-H), 1647,
1591
0333-1
(C=N, С=С). Спектр ЯМР 1Н, δ, м. д.: 1.31 с [9Н, С
8. Litvinov V.P., Dotsenko V.V., Krivokolysko S.G. // Adv.
(СН3)3], 5.87 уш. с (2Н, NH2), 7.25 уш. с [2Н, C(O)
Heterocycl. Chem. 2007. Vol. 93. P. 117. doi 10.1016/
NH2], 7.52 д (2H, H3, H5, Ar, 3J = 8.3 Гц), 7.57-7.58
S0065-2725(06)93003-7
м (5H, Ph), 7.71 с (1Н, Н5), 8.13 д (2H, H2, H6, Ar,
9. Литвинов В.П., Доценко В.В., Кривоколыско С.Г.
Химия тиенопиридинов и родственных систем. М.:
3J
= 8.3 Гц). Спектр ЯМР 13С, δC, м. д.: 31.0*
Наука, 2006. С. 6.
[С(СН3)3],
34.5
[С(СН3)3], 98.3 (C2), 117.9* (C5),
10. El-Sayed H. A. // J. Iran. Chem. Soc. 2014. Vol. 11. N 1.
120.9 (C3a), 125.7* (CH, Ar), 126.9* (CH, Ar), 128.7*
P. 131. doi 10.1007/s13738-013-0283-8
(CH, Ar), 128.8* (CH, Ar), 129.2* (CH, Ar), 134.8
11. Eurtivong C., Semenov V., Semenova M., Konyushkin L.,
(C1, Ar), 136.7 (C1, Ar), 145.5 (C3), 147.4 (C4), 152.5
Atamanenko O., Reynisson J., Kiselyov A. // Bioorg.
(C-Bu-t), 155.6 (C6), 159.7 (C7a), 166.9 (CONH2).
Med. Chem. 2017. Vol. 25. N 2. P. 658. doi 10.1016/
Спектр ЯМР 15N, δN, м. д.: 69.9 (NH2),
105.9
j.bmc.2016.11.041
(CONH2), 287.1 (NPy). Масс-спектр (HRMS ESI-
12. Allais C., Grassot J.M., Rodriguez J., Constantieux T. //
TOF), m/z:
424.1449
[M + Na]+ (вычислено для
Chem. Rev. 2014. Vol. 114. N 21. P. 10829. doi
C24H23N3NaOS: 424.1454).
10.1021/cr500099b
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ 4,6-ДИЗАМЕЩЕННЫХ 2-ТИОКСО-1,2-ДИГИДРОПИРИДИН-3-КАРБОНИТРИЛОВ
699
13. Шаранин Ю.А., Родиновская Л.А., Шестопалов А.М.,
Yaroshenko T.I., Larina L.I., Shulunova A.M., Amoso-
Промоненков В.К., Литвинов В.П. // ЖОрХ. 1986.
va S.V. // Russ. J. Org. Chem. 2007. Vol. 43. N 5.
Т. 22. № 1. С. 223; Sharanin Yu.A., Rodinovskaya L.A.,
P. 768. doi 10.1134/S1070428007050211
Shestopalov A.M., Promonenkov V.K., Litvinov V.P. // J.
25. Низовцева Т.В., Комарова Т.Н., Нахманович А.С.,
Org. Chem. USSR. 1986. Vol. 22. N 1. P. 223.
Лопырев В.А. // ХГС. 2002. № 9. С. 1293; Nizovtse-
14. Chen Z., Cirillo P.F., Disalvo D., Liu W., Marshall D.R.,
va T.V., Komarova T.N., Nakhmanovich A.S., Lopy-
Wu L., Young E.R.R. Pat. WO2005056562 (2005).
rev V.A. // Chem. Heterocycl. Compds. 2002. Vol. 38.
15. Cywin C.L., Chen Z., Emeigh J., Fleck R.W., Hao M.,
N 9. P. 1134. doi 10.1023/A:1021273702933
Hickey E., Liu W., Marshall D.R., Morwick T., Nemoto P.,
26. Nizovtseva T.V., Komarova T.N., Nakhmanovich A.S.,
Sorcek R.J., Sun S., Wu J. Pat. WO2003103661 (2003).
Larina L.I., Lopyrev V.A. // Arkivoc. 2003. Vol. 2003.
16. Liu W., Hickey E.R., Cywin C.L., Fleck R.W., Spero D.M.,
N 13. P. 191.
Morwick T.M., Proudfoot J.R. Pat. WO2005035537
27. Низовцева Т.В., Комарова Т.Н., Нахманович А.С. //
(2005).
ЖОрХ. 2007. Т. 43. № 1. С. 142; Nizovtseva T.V.,
17. Obydennov K.L., Klimareva E.L., Kosterina M.F.,
Komarova T.N., Nakhmanovich A.S. // Russ. J. Org.
Slepukhin P.A., Morzherin Yu.Yu. // Tetrahedron Lett.
Chem. 2007. Vol. 43. N 1. P. 148. doi 10.1134/
2013. Vol.
54. N
36. P.
4876. doi
10.1016/
S1070428007010198
j.tetlet.2013.06.127
28. Левашов А.С., Бурый Д.С., Коншин В.В, Доценко В.В.,
18. Костерина М.Ф., Моржерин Ю.Ю., Крамаренко О.А.,
Аксенов Н.А., Аксенова И.В. // ЖОХ. 2017. Т. 87.
Берсенева В.С., Матерн А.И., Ткачев А.В., Бакулев В.А. //
№ 7. С. 1200; Levashov A.S., Buryi D.S., Konshin V.V.,
ЖОрХ. 2004. Т. 40. № 6. С. 904; Kosterina M.F.,
Dotsenko V.V., Aksenov N.A., Aksenova I.V. // Russ. J.
Morzherin Yu.Yu., Kramarenko O.A., Berseneva V.S.,
Gen. Chem. 2017. Vol. 87. N 7. P. 1627. doi 10.1134/
Matern A.I., Tkachev A.V., Bakulev V.A. // Russ. J. Org.
S1070363217070295
Chem. 2004. Vol. 40. N 6. P. 866. doi 10.1023/
29. Levashov A.S., Aksenov N.A., Aksenova I.V., Konshin V.V. //
B:RUJO.0000044550.62124.94
New J. Chem. 2017. Vol. 41. P. 8297. doi 10.1039/
19. Обыденнов К.Л., Костерина М.Ф., Климарева Е.Л.,
c7nj01376k
Бакулев В.А., Моржерин Ю.Ю. // Изв. АН. Сер. хим.
30. Levashov A.S., Buryi D.S. // Tetrahedron Lett. 2017.
2011. № 5. С. 991; Obydennov K.L., Kosterina M.F.,
Vol. 58. N 47. P. 4476. doi 10.1016/j.tetlet.2017.10.035
Klimareva E.L., Bakulev V.A., Morzherin Yu.Yu. // Russ.
31. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. //
Chem. Bull. 2011. Vol. 60. N 5. P. 1016. doi 10.1007/
Monatsh. Chem. 2008. Vol. 139. P. 271. doi 10.1007/
s11172-011-0159-y
s00706-007-0784-1
20. Berseneva V.S., Tkachev A.V., Morzherin Yu.Yu.,
32. Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
Dehaen W., Luyten I., Toppet S., Bakulev V.A. // J.
Литвинов В.П. // Изв. АН Сер. хим. 2002. № 8.
Chem. Soc. Perkin Trans. 1. 1998. P. 2133. doi 10.1039/
С. 1432; Dotsenko V.V., Krivokolysko S.G., Chernega A.N.,
A803543A
Litvinov V.P. // Russ. Chem. Bull. 2002. Vol.
51.
21. Моржерин Ю.Ю., Костерина М.Ф., Берсенева В.С.,
P. 1556. doi 10.1023/A:1020939712830
Дехаен В., Бакулев В.А. // Изв. АН. Сер. хим. 2002.
33. Фролов К.А., Доценко В.В., Кривоколыско С.Г. //
№ 7. С. 1194; Morzherin Yu.Yu., Kosterina M.F.,
ХГС. 2013. № 9. С. 1397; Frolov K.A., Dotsenko V.V.,
Berseneva V.S., Dehaen W., Bakulev V.A. // Russ.
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2013.
Chem. Bull. 2002. Vol. 51. N 7. P. 1292. doi 10.1023/
Vol. 49. P. 1301. doi 10.1007/s10593-013-1379-x
A:1020912932335
34. Доценко В.В., Чигорина Е.А., Папаянина Е.С.,
22. Костерина М.Ф., Моржерин Ю.Ю., Ткачев А.В.,
Фролов К.А., Кривоколыско С.Г. // Макрогетеро-
Рыбалова Т.В., Гатилов Ю.В., Бакулев В.А. // Изв.
циклы. 2015. Т. 8. С. 310; Dotsenko V.V., Chigorina E.A.,
АН. Сер. хим. 2002. № 4. С. 604; Kosterina M.F.,
Papaianina E.S., Frolov K.A., Krivokolysko S.G. //
Morzherin Yu.Yu., Tkachev A.V., Rybalova T.V., Gati-
Macroheterocycles. 2015. Vol. 8. P. 310. doi 10.6060/
lov Yu.V., Bakulev V.A. // Russ. Chem. Bull.
2002.
mhc150870d
Vol. 51. N 4. P. 653. doi 10.1023/A:1015868201847
35. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
23. Костерина М.Ф., Рыбалова Т.В., Гатилов Ю.В.,
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsenko V.V.,
Моржерин Ю.Ю. // ХГС.
2009.
№ 4. С. 541;
Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
Kosterina M.F., Rybalova
T.V.,
Gatilov Yu.V.,
Chem. Heterocycl. Compd. 2012. Vol. 48. P. 309. doi
Morzherin Yu.Yu. // Chem. Heterocycl. Compd. 2009.
10.1007/s10593-012-0991-5
Vol. 45. N 4. P. 422. doi 10.1007/s10593-009-0291-x
36. Доценко В.В., Кривоколыско С.Г., Кривоколыско Б.С.,
24. Волкова К.А., Нахманович А.С., Елохина В.Н.,
Фролов К.А. // ЖОХ. 2018. Т. 88. № 4. С. 599;
Ярошенко Т.И., Ларина Л.И., Шулунова А.М.,
Dotsenko V.V., Krivokolysko S.G., Krivokolysko B.S.,
Амосова С.В. // ЖОрХ. 2007. Т. 43. № 5. С. 770;
Frolov K.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 4.
Volkova K.A., Nakhmanovich A.S., Elokhina V.N.,
P. 682. doi 10.1134/S1070363218040114
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
700
БУРЫЙ и др.
37. Bagley M.C., Glover C., Merritt E.A. // Synlett. 2007.
Шаранин Ю.А., Промоненков В.К. // ХГС. 1981. № 3.
No. 16. P. 2459. doi 10.1055/s-2007-986674
С. 377; Krauze A.A., Bomika Z.A., Shestopalov A.M.,
38. Шацаускас А.Л., Абрамов А.А., Сайбулина Э.Р.,
Rodinovskaya L.A., Pelcher Yu.E., Dubur G.Ya.,
Паламарчук И.В., Кулаков И.В., Фисюк А.С. // ХГС.
Sharanin Yu.A., Promonenkov V.K.
//
Chem.
2017. Т. 53. № 2. С. 186; Shatsauskas A.L., Abramov A.A.,
Heterocycl. Compd. 1981. Vol. 17. N 3. P. 279. doi
Saibulina E.R., Palamarchuk I.V., Kulakov I.V.,
10.1007/BF00505994
Fisyuk A.S. // Chem. Heterocycl. Compd. 2017. Vol. 53.
41. Краузе А.А., Бомика З.А., Пелчер Ю.Э., Мажейка И.Б.,
N 2. P. 186. doi 10.1007/s10593-017-2038-4
Дубур Г.Я. // ХГС. 1982. № 4. С. 508; Krauze A.A.,
39. Alberola A., Calvo L.A., Ortega A.G., Sañudo Ruíz M.C.,
Bomika Z.A., Pelcher Yu.É., Mazheika I.B., Dubur G.Ya. //
Yustos P., Granda S.G., García-Rodriguez E. // J. Org.
Chem. Heterocycl. Compd. 1982. Vol. 18. N 4. P. 385.
Chem. 1999. Vol. 64. N 26. P. 9493. doi 10.1021/
doi 10.1007/BF00503559
jo991121o
42. Шестопалов А.М., Шаранин Ю.А. // ЖОрХ. 1984.
40. Краузе А.А., Бомика З.А., Шестопалов А.М.,
Т. 20. № 9. С. 1991; Shestopalov A.M., Sharanin Yu.A. //
Родиновская Л.А., Пелчер Ю.Э., Дубур Г.Я.,
J. Org. Chem. USSR. 1984. Vol. 20. N 9.
Synthesis of 4,6-Disubstituted 2-Thioxo-1,2-dihydropyridine-3-
carbonitrile by the Reaction of Acetylenic Ketones
with Cyanoacetamide
D. S. Buryia, V. V. Dotsenkoa, c, *, A. S. Levashova, D. Yu. Lukinaa, V. D. Strelkova,
N. A. Aksenova, I. V. Aksenovab, and E. E. Netrebac
a Kuban State University, ul. Stavropol’skaya 149, Krasnodar, 350040, Russia
*e-mail: victor_dotsenko_@mail.ru
b North-Caucasus Federal University, Stavropol, Russia
c V.I. Vernadsky Taurida Academy, Crimean Federal University, Simferopol, Russia
Received December 28, 2018; revised December 28, 2018; accepted January 14, 2019
The reaction of acetylenic ketones with cyanothioacetamide in the presence of morpholine yields 4,6-
disubstituted 2-thioxo-1,2-dihydropyridine-3-carbonitriles. Structure of the obtained compounds was proved
using 2D NMR spectroscopy, as well as transformations into 3-aminothieno[2,3-b]pyridine-2-carboxamide
derivatives.
Keywords: acetylenic ketones, cyanothioacetamide, Bollman-Ratz reaction, Thorp-Ziegler reaction, thieno[2,3-
b]pyridines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019