ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 707-711
УДК 547.854.83;547.859.3
ВЗАИМОДЕЙСТВИЕ 3-АЛЛИЛ-6-МЕТИЛ-2-ТИОУРАЦИЛА
С БРОМОМ И ИОДОМ
© 2019 г. Д. Г. Ким*, Т. В. Фролова, К. Ю. Петрова, В. В. Шарутин
Южно-Уральский государственный университет (НИУ), пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: kim_dg48@mail.ru
Поступило в Редакцию 29 декабря 2018 г.
После доработки 29 декабря 2018 г.
Принято к печати 24 января 2019 г.
3-Аллил-6-метил-2-тиоурацил реагирует с иодом с образованием иодида 2-иодметил-7-метил-5-оксо-3,5-
дигидро-2H-тиазоло[3,2-a]пиримидиния. Реакция с бромом приводит к образованию смеси бромидов
2-бромметил-7-метил-5-оксо-3,5-дигидро-2H-тиазоло[3,2-a]пиримидиния и
6-бром-2-броммметил-7-
метил-5-оксо-3,5-дигидро-2H-тиазоло[3,2-a]пиримидиния.
Ключевые слова: 2-тиоурацил, тиазоло[3,2-a]пиримидин, галогениды 2-галогенметил-7-метил-5-оксо-
3,5-дигидро-2H-тиазоло[3,2-a]пиримидиния
DOI: 10.1134/S0044460X1905007X
Тиазолопиримидиноны имеют низкую токсич-
6-метил-2-тиоурацила 1 [6]. Следует отметить, что
ность, среди них найдены эффективные противо-
в указанных работах структура соединений
опухолевые, иммуномодулирующие, противо-
исследована лишь методами ИК и ЯМР
воспалительные, психотропные и успокаивающие
спектроскопии, что недостаточно для доказатель-
средства [1-4].
ства положения аллильной группы. Нами 3-аллил-6-
метил-2-тиоурацил
1
получен по методу,
С целью синтеза новых тиазолопиримидинов
описанному в работе [6], и его структура доказана
мы изучили циклизацию 3-аллил-2-тиоурацила под
методами РСА, ЯМР 1Н и хромато-масс-спектро-
действием галогенов. Теоретически, в результате
метрии. Последним методом удалось обнаружить в
конденсации 1,3-дикарбонильных соединений с N-
реакционной смеси следы 1-аллил-6-метил-2-тио-
аллилтиомочевиной возможно образование N1- или
урацила 2 (схема 1).
N3-изомеров или их смеси. В литературе имеются
Кристаллы соединения 1, пригодные для РСА,
противоречивые данные о реакции N-аллил-
получены перекристаллизацией из этанола. Общий
тиомочевины с
1,3-дикарбонильными соедине-
вид молекулы 3-аллил-6-метил-2-тиоурацила 1 в
ниями и их производными. Так, взаимодействие N-
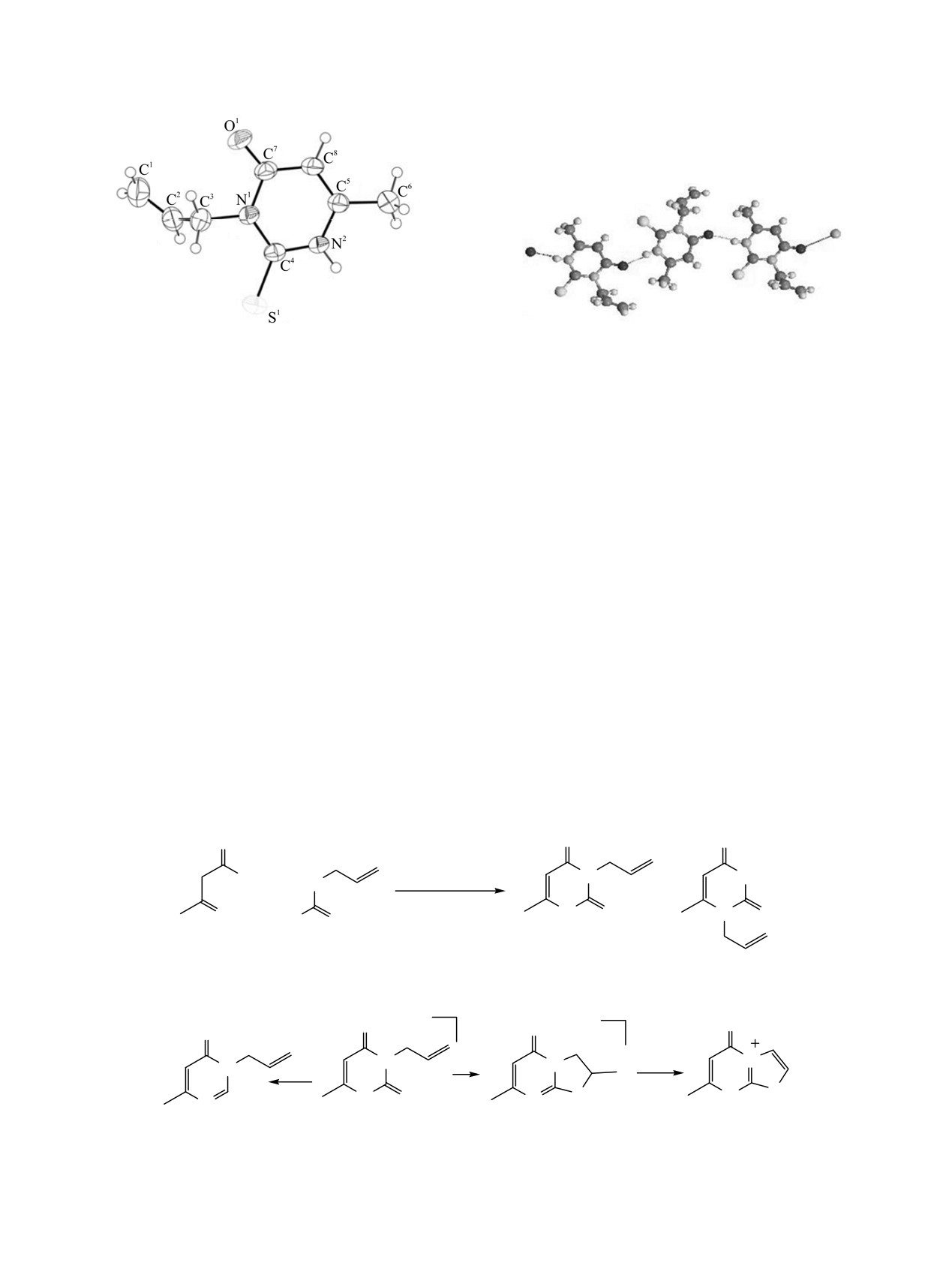
кристалле представлен на рис. 1. В кристаллах
аллилтиомочевины с этиловым эфиром
3,3-ди-
соединения 1 между кислородом одной молекулы
этоксипропионовой кислоты в этаноле в
и аминогруппой другой молекулы образуется
присутствии этилата натрия приводит к образо-
водородная связь (1.94 Å). Наличие протона у
ванию
1-аллил-2-тиоурацила
[5].
С другой
атома N1 в соединении 1 приводит к объединению
стороны,
при
взаимодействии
N-аллил-
молекул водородными связями не в димеры, как в
тиомочевины с этиловым эфиром 3-адамантил-3-
случае
2-аллилсульфанил-4(3H)-пиримидинонов
оксопропионовой кислоты или этил-5-метил-2-
[7], а в полимерные цепочки (рис. 2).
оксоциклогексанкарбоксилатом в присутствии
этилата натрия образуется N3-аллильное производ-
В масс-спектре соединения
1 имеется пик
ное, а взаимодействие с этилдодеканкарбоксилатом
молекулярного иона с m/z
149, отвечающий
в аналогичных условиях приводит к смеси
элиминированию радикала SH•. Максимальной
изомеров [5]. Реакция N-аллилтиомочевины с ацето-
интенсивностью обладает пик иона [М - СН3]+. По-
уксусным эфиром в метаноле в присутствии
видимому, это обусловлено тем, что при
метилата натрия протекает с образованием 3-аллил-
элиминировании метильного радикала образуется
707
708
КИМ и др.
Рис. 1. Общий вид молекулы соединения 1 в кристалле
в представлении атомов эллипсоидами тепловых
колебаний с 50%-ной вероятностью.
Рис. 2. Водородные связи в кристалле соединения 1.
устойчивая ароматическая система A (схема
2).
метил-2,3-дигидро-5-оксотиазоло[3,2-a]пиримиди-
Масс-спектр соединения 2 близко совпадает с масс-
нийтрииодид 4. В случае эквимольного соотно-
спектром соединения 1, но отличается интенсив-
шения реагентов выход не достигает 50%. Это
ностью пиков. В частности, пик молекулярного
свидетельствует о том, что галогенциклизация
иона в случае соединения 2 имеет интенсивность
протекает через иодониевый ион 3, противоионом
21% (для соединения
1 интенсивность пика
которого является трииодид-анион (схема
3).
составила 40%). Максимальной интенсивностью в
Образование тригалогенидов на первой стадии
масс-спектре тиоурацила 1 обладает пик с m/z 154,
реакции алкенилсульфидов с галогенами при
который обусловлен элиминированием молекулы
соотношениях 1:1 или 1:2 было доказано ранее в
CO.
работах [14, 15].
При взаимодействии трииодида 4 с иодидом
Тиазолопиримидиниевые системы могут быть
натрия в ацетоне нами выделен иодид 2-иодметил-
синтезированы циклизацией N- и S-аллил-2-
7-метил-2,3-дигидро-5-оксотиазоло[3,2-a]пирими-
тиоурацилов под действием галогенов [6, 8-13].
диния 5. В свою очередь, при взаимодействии
Мы изучили галогенирование тиоурацила
1 с
иодида 5 с иодом в спирте образуется трииодид 4.
целью установления структуры промежуточных
продуктов. Оказалось, что при взаимодействии
Авторы работы
[9] считают, что при
тиоурацила 1 с иодом независимо от соотношения
взаимодействии тиоурацила 1 с бромом образуется
реагентов (1:1 или 1:2) образуется 2-иодметил-7-
продукт присоединения брома по двойной связи
Схема 1.
O
O
O
OEt
MeONa, MeOH
N
NH
HN
+
+
3.5 ч
O
N
S
N S
H2N S
H
1
2
Схема 2.
+
+
O
O
O
O
N
N
N
N
−CH3
+
S
-SH
N
S
S
N
N
N
H
H
A
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ВЗАИМОДЕЙСТВИЕ 3-АЛЛИЛ-6-МЕТИЛ-2-ТИОУРАЦИЛА
709
Схема 3.
O
O
O
CH2
I3
I
I3
N
N
I2
N
CH
NaI, (CH3)2CO
1
I
N
S
N
S
I2, ROH
N
S
H2C
H
H
H
I
I
3
4
5
Схема 4.
O
O
CH2
N
K2CO3, ДМФА
Br2
CHBr
N
1
-HBr
CH2Br
Br
N
S
N
S
H
6
7
аллильной группы, 3-(2,3-дибромпропил)-6-метил-
оксотиазоло[3,2-a]пиримидиния
9, которые при
2-тиоурацил
6,
который циклизуется под
взаимодействии с ацетоном образуют бромид 2-
действием K2CO3 в ДMФА с образованием
бромметил-7-метил-2,3-дигидро-5-оксотиазоло[3,2-
тиазолопиримидинона 7 (схема 4). При двукратном
a]пиримидиния
10 и продукт дальнейшего
избытке брома реакция не останавливается на
электрофильного замещения - 6-бром-2-бромметил-
стадии образования продукта циклизации, а
7-метил-2,3-дигидро-5-оксотиазоло[3,2-a]пирими-
происходит замещение протона пиримидинового
динийбромид 11 в соотношении 3:1 (по данным
кольца на бром [9].
ЯМР 1Н) (схема 5).
Нами найдено, что при взаимодействии соеди-
На наш взгляд, образование тиазолопурина 7
нения 1 с бромом в уксусной кислоте уже при
происходит через образование трибромида 8. При
эквимольном соотношении реагентов происходит
действии же K2CO3 в ДМФА соединение
8
образование смеси трибромидов 2-бромметил-7-
превращается в тиазолопиримидинон 7. Следует
метил-2,3-дигидро-5-оксотиазоло[3,2-a]пиримиди-
отметить, что в литературе существуют примеры,
ния 8 и 6-бром-2-бромметил-7-метил-2,3-дигидро-5-
где продукты присоединения брома по двойной
Схема 5.
O
O
Br3
Br3
Br
Br2
N
N
1
+
Br
Br
H3C
N
S
H3C
N
S
H
H
8
9
(CH3)2CO
O
O
Br
Br
Br
N
N
+
Br
Br
H3C
N
S
H3C
N
S
H
H
10
11
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
710
КИМ и др.
связи аллильной группы не вступают в дальней-
растворителя остаток растворяли в 7 мл ацетона и
шую реакцию внутримолекулярной циклизации
добавляли
130 мг
(0.88 ммоль) NaI. Осадок
[16].
отфильтровывали и сушили. Выход 140 мг (74%),
т. разл. 174-176°С. Спектр ЯМР 1Н, δ, м. д.: 2.14
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
уш. д (3H, CH3, 4J = 0.9 Гц), 3.64-3.71 м (2H, СН2I),
4.25-4.36 м (3H, NCH2, SCH), 6.03 уш. к (1H, H6,
Спектры ЯМР
1Н
(500 МГц) записаны на
4J = 0.9 Гц), 8.5 уш. с (N+H). Спектр ЯМР 13С, δС,
приборе Bruker Avance-500 в растворе ДМСО-d6,
м. д.: 11.10 (СН2I), 22.71 (CH3), 43.31 (SCH), 53.40
внутренний стандарт - ТМС. Масс-спектр снят на
(NCH2), 107.32 (C6), 159.87 (C5), 163.26 (C8a), 163.40
хромато-масс-спектрометре GCMS-QP2010 Ultra
(C7). Найдено,
%: С
22.11; Н
2.23; N
6.38.
Shimadzu (ЭУ,
70 эВ). Элементный анализ
C8H10I2N2OS. Вычислено, %: С 22.01; Н 2.29; N
выполнен на анализаторе Carlo Erba EA
1108.
6.42.
Температуры плавления определены на приборе
Бромирование 3-аллил-6-метил-2-тиоурацила.
ПТП (М). Рентгеноструктурное исследование
К раствору 90 мг (0.49 ммоль) соединения 1 в 5 мл
соединения
1 выполнено на автоматическом
уксусной кислоты добавляли раствор
0.03 мл
четырехкружном дифрактометре D8 QUEST Bruker
(0.49 ммоль) брома в 5 мл уксусной кислоты и
(MoKα-излучение, λ
=
0.71073 Å, графитовый
оставили на сутки. После удаления растворителя
монохроматор). Полный набор рентгеноструктурных
остаток обрабатывали ацетоном. Осадок смеси
данных депонирован в Кембриджском банке
монобромидов 2-бромметил-7-метил-2,3-дигидро-5-
структурных данных (CCDC 1006223).
оксотиазоло[3,2-a]пиримидиния
10 и
6-бром-2-
3-Аллил-6-метил-2-тиоурацил (1). К раствору
бромметил-7-метил-2,3-дигидро-5-оксотиазоло[3,2-
350 мг (15 ммоль) металлического натрия в 5 мл
a]пиримидиния 11 фильтровали и сушили.
метанола добавляли 580 мг (5 ммоль) N-аллил-
Бромид
2-бромметил-7-метил-2,3-дигидро-5-
тиомочевины и 0.64 мл (5 ммоль) ацетоуксусного
оксотиазоло[3,2-a]пиримидиния
(10).
Спектр
эфира. Смесь нагревали в течение 3.5 ч, после
ЯМР 1Н, δ, м. д.: 2.13 с (3H, CH3), 3.89 м (2H,
охлаждения добавляли
15 мл воды и нейтра-
СН2Br), 4.33-4.37 м (3H, NCH2, SCH), 6.01 с (1Н, Н6).
лизовали уксусной кислотой. Белый осадок отфиль-
тровывали и перекристаллизовывали из этанола.
Бромид
6-бром-2-бромметил-7-метил-2,3-ди-
Выход 590 мг (64%), т. пл. 189°С (т. пл. 191°С [6]).
гидро-5-оксотиазоло[3,2-a]пиримидиния
(11).
Спектр ЯМР 1Н, δ, м. д.: 2.32 с (3H, CH3), 3.92-3.96
Спектр ЯМР 1Н, δ, м. д.: 2.10 д (3H, CH3, 4J =
1.0 Гц), 4.87 д. т (2H, NCH2, 3J = 5.3, 4J = 1.6 Гц),
м (2H, СН2Br), 4.39-4.42 м (3H, NCH2, SCH).
5.09 д. к (1H, =CHH, 3J = 17.3, 4J = 1.6 Гц), 5.12 д. к
ФОНДОВАЯ ПОДДЕРЖКА
(1H, =CHH, 3J = 10.5, 4J =1.6 Гц), 5.82 к (1H, H5,
4J = 1.0 Гц), 5.84 д. д. т (1H, =CH, 3J = 17.3, 3J =
Работа выполнена при финансовой поддержке
10.5, 3J = 5.3 Гц), 12.51 уш. с (1H, NH). Спектр
Правительства РФ (Постановление
№ 211 от
ЯМР 13С, δС, м. д.: 17.85 (CH3), 46.89 (C1'), 102.66
16.03.2013 г., соглашение № 02.A03.21.0011) и
(C5), 117.03 (C3'), 131.36 (C2'), 151.85 (C6), 159.71
Министерства образования и науки в рамках
(C4), 176.32 (C2). Масс-спектр, m/z (Iотн, %): 182 (40)
государственного задания (№ 5.9665.2017/8.9).
[M]+·, 167 (100) [M - CH3]+, 149 (3) [M - SH]+, 139
(3), 127 (6) [M - C3H6 - CH3]+, 99 (9), 84 (21), 72
КОНФЛИКТ ИНТЕРЕСОВ
(15), 67 (8), 42 (24).
1-Аллил-6-метил-2-тиоурацил (2). Масс-спектр,
Авторы заявляют об отсутствии конфликта
m/z (Iотн, %): 182 (21) [M]+·, 167 (61) [M - CH3]+, 154
интересов.
(100) [M - CO]+·, 139 (3), 125 (17), 98 (8), 86 (21), 70
(67), 55 (8), 41 (26).
СПИСОК ЛИТЕРАТУРЫ
Иодид 2-иодметил-7-метил-2,3-дигидро-5-оксо-
1. Wippich P., Gutschow M., Leistner S. // Synthesis.
тиазоло[3,2-a]пиримидиния (5). К раствору 80 мг
2000. N 5. P. 714. doi 10.1055/s-2000-6390
(0.44 ммоль) соединения 1 в 5 мл хлороформа
2. Youssef S.K., Ahmed R.A., Abbady M.S., Abdel-Mohsen S.A.,
добавляли раствор 220 мг (0.88 ммоль) иода в 5 мл
Omar A.A. // Chemical Monthly. 2008. P. 553. doi
хлороформа и оставили на сутки. После удаления
10.1007/s00706-007-0817-9
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ВЗАИМОДЕЙСТВИЕ 3-АЛЛИЛ-6-МЕТИЛ-2-ТИОУРАЦИЛА
711
3. Abdel-Razik H.H. // Chem. Pap. 2006. Vol. 60. N 4.
10. Studzinska R., Wroblewski M., Draminski M.
//
P. 268. doi 10.2478/s11696-006-0046-4
Heterocycles. 2008. Vol. 75. N 8. P. 1953. doi 10.3987/
4. Glennon R.A., Rogers M.E., Bass R.G., Ryan S.B. //
com-08-11365
J. Pharm. Sci. 1978. Vol. 67. N 12. P. 1762. doi
11. Сливка Н.Ю., Геваза Ю.И., Станинец В.И. // ХГС.
10.1002/jps.2600671236
2004. Т. 40. № 5. С. 776; Slivka N.Yu., Gevaza Yu.I.,
Staninets V.I. // Chem. Heterocycl. Compd. 2004. N 5.
5. Draminski M., Turski K., Tateoka Y., Kimura T.,
P. 660. doi 10.1023/b:cohc.0000037323.22839.9f
Watanabe K., Kondo S., Ho I.K., Yamamoto I. // Chem.
12. Фролова Т.В., Ким Д.Г. // Изв. вузов. Сер. хим. и
Pharm. Bull. 1998. Vol. 46. N 9. P. 1370. doi 10.1248/
хим. технол. 2011. Вып. 9. С. 109.
cpb.46.1370
13. Frolova Т.V., Kim D.G., Sharutin V.V., Osheko K.Yu. //
6. Turski K., Draminski M. // Pol. J. Chem. 1992. N 66.
Вестн. ЮУрГУ. Сер. Химия. 2015. Т. 7. № 3. С. 11.
P. 1591.
14. Ким Д.Г., Шмыгарев В.И. // Изв. вузов. Сер. хим. и
7. Ким Д.Г., Шмыгарев В.И. // ХГС. 1995. Т. 31. № 2.
хим. технол. 1997. Вып. 2. С. 18.
С. 211; Kim D.G., Shmygarev V.I. // Chem. Heterocycl.
15. Ким Д.Г., Судолова Н.М., Слепухин П.А. // ХГС.
Compd. 1995. N 2. P. 183. doi 10.1007/bf01169677
2011. Т. 47. № 5. С. 631; Kim D.G., Sudolova N.M.,
8. Studzinska R., Wroblewski M., Karczmarska-Wodzka A.,
Slepuhin P.A. // Chem. Heterocycl. Compd. 2011. N 5.
Kolodziejska R.
// Tetrahedron Lett.
2014. N
55.
P. 760. doi 10.1007/s10593-011-0808-y
P. 1384. doi 10.1016/j.tetlet.2014.01.033
16. Вершинина Е.А., Ким Д.Г., Слепухин П.А. // ХГС.
9. Mizutani M., Sanemitsu Y., Tamaru Y., Yoshida Z. //
2010. Т. 46. № 11. С. 1739; Vershinina E.A., Kim D.G.,
J. Org. Chem. 1985. N 50. P. 764. doi 10.1021/
Slepukhin P.A. // Chem. Heterocycl. Compd.
2010.
jo00206a007
N 11. P. 1415. doi 10.1007/s10593-011-0684-5
Reaction of 3-Allyl-6-methyl-2-thiouracil
with Bromine and Iodine
D. G. Kim*, T. V. Frolova, K. Yu. Petrova, and V. V. Sharutin
South Ural State University, pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: kim_dg48@mail.ru
Received December 27, 2018; revised December 27, 2018; accepted January 24, 2019
3-Allyl-6-methyl-2-thiouracil reacts with iodine to form 2-iodomethyl-7-methyl-5-oxo-3,5-dihydro-2H-thiazolo-
[3,2-a]pyrimidinium iodide. The reaction with bromine leads to the formation of a mixture of 2-bromomethyl-7-
methyl-5-oxo-3,5-dihydro-2H-thiazolo[3,2-a]pyrimidinium and
6-bromo-2-bromomethyl-7-methyl-5-oxo-3,5-
dihydro-2H-thiazolo[3,2-a]pyrimidinium bromides.
Keywords: 2-thiouracil, thiazolo[3,2-a]pyrimidine, 2-halomethyl-7-methyl-5-oxo-3,5-dihydro-2H-thiazolo[3,2-
a]pyrimidinium halides
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019