ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 712-720
УДК 547.1;547.814.5;547.333
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА НОВОГО ЕНАМИНА,
СОДЕРЖАЩЕГО КУМАРИНОВЫЙ И ФОСФОНИЕВЫЙ
ФРАГМЕНТЫ
© 2019 г. Л. Д. Поповa, *, И. Н. Щербаковa, С. А. Бородкинa, Ю. В. Ревинскийb,
Е. А. Казоянc, Г. А. Шагинянc, А. Р. Саркисянc, Ш. А. Маркарянc
a Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
*e-mail: ldpopov@mail.ru
b Южный федеральный исследовательский научный центр Российской академии наук, Ростов-на-Дону, Россия
c Ереванский государственный университет, Ереван, Армения
Поступило в Редакцию 21 ноября 2018 г.
После доработки 21 ноября 2018 г.
Принято к печати 28 ноября 2018 г.
Конденсация 4-гидрокси-3-формилкумарина с бромидом 4-аминобензил(трифенил)фосфония приводит к
образованию фосфониевой соли, существующей в растворе ДМСО в виде двух енаминных форм - Z и E,
согласно данным спектроскопии ЯМР и квантово-химических расчетов. На основе полученной соли
синтезированы металлохелаты цинка(II), меди(II) и никеля(II) состава ML2. Изучена люминесценция
лиганда и его комплекса с цинком.
Ключевые слова: енамины, 4-гидрокси-3-формилкумарин, металлохелаты цинка(II), фосфониевые соли,
магнетохимия
DOI: 10.1134/S0044460X19050081
Интерес к фосфониевым солям обусловлен
взаимодействии альдегидов или кетонов с
широким спектром практически важных
аминами. Спектр применения енаминов очень
свойств, особенно их потенциальной
широк: в частности, они применяются в медицине
биологической активностью. Известно, что
в качестве кардиотонических средств
[20],
фосфониевые соли могут проявлять
антагонистов ГАМК-рецепторов
[21] и т. д.
антибактериальные свойства и в качестве
Особый интерес представляют гетероциклические
одиночных молекул в растворах и входить в
енамины, поскольку многие гетероциклы являются
состав полимерных материалов [1-8]. Соеди-
фармакофорными субстратами, а также содержат в
нения, содержащие в своем составе трифенил-
своем составе гетероатомы, способные образовывать
фосфониевый фрагмент в качестве
устойчивые связи с ионами металлов.
липофильного катиона, могут быть
Известно также, что соединения, содержащие
использованы в качестве антиоксидантов,
кумариновый фрагмент, обладают разнообразной и
противораковых препаратов и функциональных
ярко выраженной биологической активностью,
зондов в митохондриях [9-15]. Фосфониевые
входят в состав многих природных соединений и
соли также нашли применение в качестве
синтетических лекарственных препаратов. Кроме
ионных жидкостей
[16], катализаторов
того, такие соединения проявляют интересные
межфазного переноса [17, 18], синтонов для
фотохимические свойства [22, 23]. Несмотря на
получения биологически активных полифунк-
это, данные о продуктах взаимодействия
ционально замещенных гетероциклических
формилкумаринов с аминами немногочисленны
систем [19] и др.
[23-30].
Енамины или алкениламины
- соединения
Ранее нами были синтезированы и изучены
общей формулы R2NCR=CR2, образуются при
продукты конденсации аминофосфониевых солей с
712
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА НОВОГО ЕНАМИНА
713
Схема 1.
OH
Br-
HC(OEt)3
p
2'
H2
i
+
+
C
m
H2N
CH2PPh3
O
3'
P
1'
O O
Br-
o
5
4
3
Ph Ph
6
N
4'
2
H
7
OH
O 1 O
8
CHO
2
EtOH, Δ
O O
+
H2N
CH2PPh3
1
Br-
некоторыми альдегидами. Было показано, что
колебаний Р-Рh при
1436 см-1, и полосы,
часть из них существуют в растворах в иминной
отвечающие валентным колебаниям С-Н связей
форме, а часть - в енаминной [31-33].
ароматических фрагментов в области 3055 см-1.
Целью настоящего исследования являлось
В спектре ЯМР 1Н полученного соединения,
получение нового соединения, содержащего
снятого в ДМСО-d6, наблюдаются два набора
кумариновый и фосфониевый фрагменты, изучение
сигналов различной интенсивности, отвечающих
его строения и некоторых свойств. В качестве
двум изомерным формам, которыми являются
альдегидной компоненты был взят 4-гидрокси-3-
геометрические E- и Z-изомеры енаминных
формилкумарин, поскольку азометины на его
таутомеров в мольном соотношении 2:1 (схема 2),
основе обладают интенсивной люминесценцией,
судя по дублетной форме сигналов NH- и
проявляющейся как в твердом состоянии, так и в
азометинового СН-протонов.
растворах [34, 35].
В спектре ЯМР 1Н, снятом в ДМСО-d6 сигналы
Искомый продукт 2 был получен нами двумя
протона NH-группы преобладающего изомера
способами (схема 1). Первый способ заключался в
наблюдается в виде дублета в области 13.33 м. д.
конденсации коммерчески доступного
4-
(2/3Н, J
=
13.6 Гц), в то время как сигнал
гидроксикумарина с бромидом
4-аминобензил
минорного изомера значительно смещен в сильное
(трифенил)фосфония в присутствии конденсиру-
поле (11.75 м. д., 1/3H, J = 13.3 Гц). Для азо-
ющего агента - триэтилортоформиата по реакции
метинового протона наблюдается обратная
Кнотта без выделения соответствующего
тенденция
- сигнал минорного изомера
альдегида. Второй метод синтеза соединения
2
интенсивностью
1/3H (уширенный дублет, J
=
заключался в конденсации 4-гидрокси-3-формил-
13.3 Гц,
8.83 м. д.) смещен в слабое поле
кумарина 1 с бромидом 4-аминобензил(трифенил)-
относительно сигнала главного изомера (дублет
фосфония в этаноле при кипячении в течение 1 ч.
интенсивностью 2/3Н с J = 13.6 Гц, 8.79 м. д.).
При этом продукты, полученные в результате двух
Очевидно, что более электроотрицательным
реакций, оказались идентичными друг другу и по
является кислород карбонильной группы C3=O по
точке плавления, и по спектральным данным.
сравнению с C1=O кумаринового фрагмента, а
также наличие внутримолекулярной водородной
Строение соединения
2 было подтверждено
связи NH···O=C3 будет приводить к более
данными ИК, 1Н, 13С ЯМР спектроскопии, а также
существенному дезэкранированию NH протона,
электронной спектроскопии поглощения. Так, в ИК
чем при реализации внутримолекулярной
спектре соединения 2 наблюдаются следующие
водородной связи NH···O=C1. Поэтому следует
основные полосы поглощения:
3359 см-1,
идентифицировать основной компонент раствора
отвечающая валентным колебаниям NН-группы;
как E-изомер, а минорный как Z-изомер енаминной
1718 см-1, соответствующая валентным колебаниям
таутомерной формы. Сигналы орто-, мета- и пара-
карбонильной группы пиранового фрагмента;
протонов трифенилфосфониевого фрагмента
1630 см-1, соответствующая валентным колебаниям
регистрируются в виде трех групп сигналов -
ациклической группировки C=С; полоса валентных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
714
ПОПОВ и др.
Схема 2.
H
R
O H
O
N
R
N
H
H
O O
O O
E-гидроксиимин
Z-гидроксиимин
R
H
O H
O
N
R
N
H
H
O O
O O
E-енамин
Z-енамин
+
R =
CH2PPh3
Br-
дублета дублетов иненсивностью 6H (7.69 м. д.,
Так, сигнал ядра С3 основного изомера сдвинут в
JРH = 12.7 Гц, 3JHH = 7.8 Гц), дублета триплетов
слабое поле по сравнению с сигналом минорного
(6H, 7.75 м. д., JРH = 3.5 Гц, 3JHH = 7.8 Гц) и дублета
изомера почти на 3 м. д., в то время, как сигнал C1
триплетов (3H, 7.91 м. д., 3JHH = 7.8 Гц, 4JHH =
сдвинут в более сильное поле на 1.8 м.д., что также
1.6 Гц) соответственно. Сигнал протонов СН2-
свидетельствует об образовании водородной связи
группы наблюдается в виде дублета с химическим
NH···O=C3 в преобладающем компоненте раствора
сдвигом 5.23 м. д. и характерной констанстой спин-
и NH···O=C1 - в минорном. Сигналы ядер углерода
спинового взаимодействия с фосфорным ядром
бензилтрифосфониевого фрагмента легко
JРH = 15.6 Гц. Сигналы протонов ароматической
идентифицируюся по характерному взаимодействию
системы кумаринового фрагмента резонируют в
ядер 31P и 13С, определющему дублетную форму
ожидаемой области химических сдвигов 7.2-8.0 м. д.
сигналов. Ядра трифенилфосфониевой группы
проявляются в виде четырех групп сигналов Си
В спектре ЯМР на ядрах 13С соединения 2 также
(117.6 м. д., JPС = 85.5 Гц), Со (134.0 м. д., JPС =
наблюдаются два набора сигналов. Наибольшие
9.9 Гц), См (130.1 м. д., JPС = 12.4 Гц) и Сп (135.1 м.
различия в расположении сигналов у обоих
д., JPС = 3.1 Гц). Сигнал метиленового углерода,
изомеров регистрируется для ядер углерода
резонирующий с химическим сдвигом 27.75 м. д.
карбонильных групп кумаринового фрагмента.
также расщеплен (JPC = 46.5 Гц). Значения JPC для
ядер углерода
1'-4' бензильного фрагмента
соствляет 9.0, 5.8, 3.3 и 4.2 Гц соответственно.
Остальные отнесения сигналов в ЯМР 13C спектре
Относительная устойчивость изомеров (ккал/моль),
вычисленная из полной энергии в газовой фазе (E) и в
приведены в экспериментальной части.
растворе ДМСО (PCM)
Хорошо известно, что производные 4-гидрокси-
3-формилкумарина склонны к проявлению
Таутомер
Изомер
E
PCM
таутомерии и сольватохромии
[36]. Для опре-
Гидроксиимин
Z
12.1
16.2
деления относительной устойчивости таутомерных
E
5.90
9.61
форм был проведен квантово-химический расчет
методом функционала плотности (DFT). Как видно
Енамин
Z
0.47
0.61
из приведенных данных (см. таблицу),
E
0.00
0.00
гидроксииминные таутомеры значительно деста-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА НОВОГО ЕНАМИНА
715
билизированы относительно енаминных как в
мерам, в которых лиганд, скорее всего, при
газовой фазе, так и в растворе ДМСО. Геометри-
образовании хелатной структуры, координируется
ческие Z- и E-изомеры енаминного таутомера
к иону цинка(2+) через либо карбонильный атом
близки по устойчивости с небольшой разницей
кислорода группы C3=O, либо C1=O.
(0.47 ккал/моль в газовой и
0.61 ккал/моль в
Как известно, внутрикомплексные соединения
растворе ДМСО) в пользу E-изомера, что
цинка(II) часто обладают ярко выраженной
прекрасно совпадает с выводами, полученными
люминесценцией. В связи с этим нами были сняты
при анализе экспериментальных спектров ЯМР 1H
электронные спектры поглощения и спектры
и 13C (в соответствии с распределением Больцмана,
люминесценции енамина 2 и комплекса цинка(II)
относительная устойчивость
0.47
ккал/моль
на его основе 3.
определяет соотношение компонентов 68:32 мол.%
при
300К). Различие в устойчивости изомеров
В электронном спектре поглощения (ЭСП)
енаминного таутомера незначительно, поскольку
соединения
2 в этаноле наблюдаются полосы
она обусловлена, в основном, различной
поглощения, наиболее интенсивные из которых
внутримолекулярной водородной связи NH···О=С
представляют собой две широкие полосы с λmax =
с одной из карбонильных групп.
230 нм (lgε = 4.90) и плечом при 280 нм (lgε = 4.50)
и 368 нм (lgε = 4.90), последняя из которых,
В отличие от изомеров енаминного таутомера,
вероятно, обусловлена π-π*-переходами в
геометрические изомеры гидроксииминного
ароматических фрагментах.
таутомера сильно различаются по относительной
устойчивости (более 6 ккал/моль в газовой фазе и в
При переходе к кислой среде не наблюдается
растворе), так как в этом случае, кроме различной
сильных изменений в ЭСП соединения 2, что,
силы внутримолекулярной водородной связи
вероятно, связано с отсутствием протонирования
OH···N=C, вклад в величину относительных
молекул, обусловленное наличием положительного
энергий изомеров вносит различие в энергии
заряда на атоме фосфора. При переходе к
протонирования карбонильных групп кумарино-
щелочной среде интенсивность плеча при 280 нм
вого фрагмента, которая, что очевидно, будет
(lgε = 4.60) сильно увеличивается и становится
весьма значительной.
сравнимой с интенсивностью первой полосы,
которая немного смещается в коротковолновую
Наличие в структуре енамина 2 подвижного
область и наблюдается при 220 нм (lgε = 5.03).
протона NH-группы, способного замещаться на
Наиболее заметное изменение в ЭСП соединения 2
ион металла, определяет возможность получения
наблюдается в длинноволновой области, где
соответствующих металлокомплексов. Так, при
происходит гипсохромное смещение полосы на 40
взаимодействии соединения
2 с ацетатами
нм, что обусловлено депротонированием
металлов
- двухвалентными цинком, медью,
исходного соединения, приводящее к образованию
никелем
были синтезированы соединения,
тесных ионных пар.
которые,
на основании данных элементного
анализа, соответствуют составу ML2.
При переходе от этанола к ДМСО происходит
значительное изменение в длинноволновой
В ИК спектрах комплексов наблюдается
области ЭСП в нейтральной среде: полоса с λ =
исчезновение валентных колебаний NH-группы в
368 нм (в этаноле) наблюдается при 328 нм (lgε =
области 3359 см-1, а группа C=O проявляется в
5.65), что можно объяснить влиянием более
виде двух полос в области 1655-1685 см-1. Также
полярного, по сравнению с этанолом, растворителя.
происходит сдвиг в длинноволновую область и
полосы поглощения группы С=С, которая
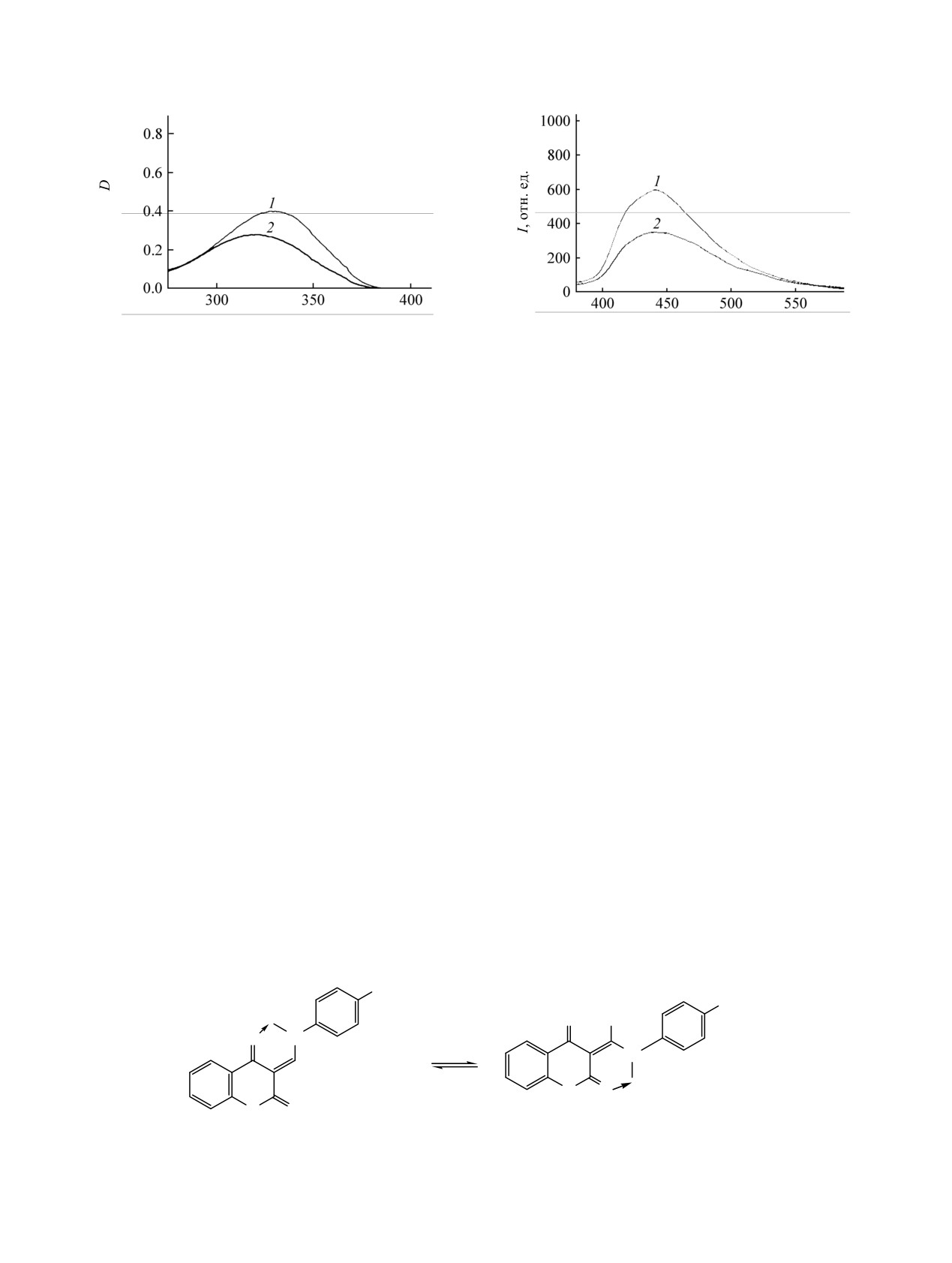
В ЭСП комплекса цинка(II)
3 в ДMCO
наблюдается в виде двух сигналов в области 1600-
наблюдается небольшое изменение в длинновол-
1610 см-1. Полоса валентных колебаний связи Р-Рh
новой части спектра: происходит гипсохромный
наблюдается при 1438±2 см-1.
сдвиг полосы поглощения на 10 нм по сравнению
со спектром лиганда 2 (рис. 1).
В ЯМР 1H спектре комплекса цинка(II), по
сравнению со спектром лиганда, происходит
В спектрах люминесценции лиганда и
исчезновение сигнала NH протона и, как и в
комплекса цинка(II), полученных при длине волны
спектре лиганда, наблюдаются два набора сигналов
возбуждения, соответствующей максимумам
в соотношении 3:1, соответствующие двум изо-
поглощения
(330 и
320 нм соответственно),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
716
ПОПОВ и др.
λ, нм
λ, нм
Рис. 2. Спектры флуоресценции в ДМСО лиганда
Рис. 1. Электронные спектры поглощения в ДМСО
лиганда 2 (1, с = 9.0×10-6 М.) и цинкового комплекса 3
2 (1, с = 9.0×10-6 М.) и цинкового комплекса 3 (2,
(2, с = 7.7×10-6 М.).
с = 7.7×10-6 М.).
наблюдается единственная среднеинтенсивная
изменяется при понижении температуры до
полоса с максимумом при λ = 440 нм для обоих
температуры кипения жидкого азота, что
соединений (рис.
2). При этом интенсивность
свидетельствует о моноядерном строении
люминесценции для комплекса цинка уменьшается
металлокомплекса. Для комплекса никеля(II)
5
почти вдвое по сравнению со спектром лиганда.
величина эффективного магнитного момента
Таким образом можно сделать вывод, что под
составляет 3.8 М. Б., что характерно для псевдо-
действием иона цинка происходит тушение
тетраэдрического строения координационного узла
люминесценции в растворе.
комплекса (схема 3).
Следует отметить, что, в отличие от раствора в
Таким образом, нами двумя способами
ДMCO, комплекс цинка(II) сильно люминесцирует
синтезирован новый енамин, содержащий
в порошке белым цветом, однако нам не удалось
кумариновый фрагмент и катионную фосфониевую
зарегистрировать спектр люминесценции в твердой
группировку, причем первый способ является
фазе и определить квантовый выход. По-видимому,
предпочтительным, так как проходит в одну
при переходе в раствор происходит тушение
стадию, а выход не сильно отличается от
люминесценции молекулами растворителя.
двухстадийного синтеза. Изучено строение и
таутомерия полученного соединения; обнаружено,
Также известно, что неполярный растворитель
что в растворе полярного ДМСО оно существует в
(толуол, октан, гексан) часто способствует
виде смеси двух енаминных форм в соотношении
появлению люминесценции, однако полученный
2:1, что полностью согласуется с данными
нами комплекс цинка(II) 3 оказался практически
квантово-химических расчетов, так как энергии
нерастворимым в этих растворителях.
для двух этих форм очень близки. Препаративно
Эффективный магнитный момент комплекса
выделены металлокомплексы Zn(II), Cu(II), Ni(II) с
меди(II) 4 с лигандом 2 составляет 1.83 М. Б. и не
полученным енамином, которые изучены
Схема 3.
Br-
+
-
Br
CH2PPh3
+
CH2PPh3
M/2
O H
O N
N
M/2
O O
O O
M = Zn2+ (3), Cu2+ (4), Ni2+ (5).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА НОВОГО ЕНАМИНА
717
спектральными и магнитным методами. Пред-
бромида 4-аминобензил(трифенил)фосфония [41]
положено октаэдрическое строение металлхелатов.
(0.39 г, 0.001 моль) в 4 мл изопропанола. Получен-
Лиганд и комплекс Zn(II) на его основе обладают
ную смесь кипятили
1.5 ч, выпавший осадок
слабой люминесценцией.
отфильтровывали, промывали горячим этанолом и
перекристализовывали из смеси этанол-ДМФА
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(2:1). Выход 0.33 г (62%), т. пл. 309-310°С (разл.).
ИК спектр (вазелин), ν, см-1: 502, 517, 694, 720,
Спектры ЯМР 1Н и 13С получены на спектро-
749, 760, 839, 867, 996, 1067, 1110 (Р-С), 1184,
метре Avance (Bruker, 600 и 126.1 МГц соответ-
1195, 1252, 1294, 1353, 1436 (Р-Рh), 1464, 1481,
ственно) при 20°С. Элементный анализ выполнен
1571, 1583, 1603, 1630 (C=С), 1718 (С=О), 3055 (C-
на приборе PerkinElmer
240C в лаборатории
HAr), 3359 (NН). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
микроанализа Южного федерального университета.
5.23 д (2H, CH2, JРH = 15.6 Гц), 7.06 д (2H2', 3JHH =
ИК спектры регистрировали на приборе Varian
8.0 Гц), 7.31 д (1H5, 3JHH = 7.6 Гц), 7.34 т (1H6, 3JHH =
Scimitar 1000 FT-IR в вазелиновом масле в области
7.6 Гц), 7.54 д (2H3', 3JHH = 8.0 Гц), 7.66-7.72 м (7Н,
400-4000 см-1. Электронные спектры регистрировали
6Hо + Н7), 7.75 д. т (6Hм, 3JHH = 7.8 Гц, JРH = 3.5 Гц),
на приборе Varian Cary 5000 в области 200-800 нм.
7.91 д. т (3Hп, 3JHH = 7.6 Гц, 4JHH = 1.6 Гц), 7.95 д
Спектры флуоресценции сняты на спектро-
(1Н, H8, 3JHH = 7.8 Гц), 8.79 д (2/3H, CH-NH, JHH =
флуориметре Cary Exlipse (Varian). Значения
13.6 Гц), 8.83 уш. д (1/3H, CH-NH, JHH = 13.3 Гц),
квантовых выходов флуоресценции были опре-
11.75 уш. д (1/3H, NH, JHH = 13.3 Гц), 13.33 д (2/3Н,
делены методом Паркера-Риса
[37], причем в
NH, JHH = 13.6 Гц). Спектр ЯМР 13C (ДМСО-d6), δС,
качестве стандарта был использован бисульфат
м. д.: 27.75 д (CH2, JPC = 46.5 Гц), 98.2, 117.1, 117.6
хинина в
0.1 н. серной кислоте. Магнитную
д (Cи, JPC = 85.5 Гц), 119.6 д (C3, JPC = 3.3 Гц),
восприимчивость поликрис-таллических образцов
119.8, 124.2, 125.4, 126.4 (C1', JPC = 9.0 Гц), 130.1 д
определяли относительным методом Фарадея в
(Cм, JPC = 12.4 Гц), 132.1 д (C2', J = 5.8 Гц), 134.0 д
температурном интервале 77.4-300 K. Измерение
(Co, JPC = 9.9 Гц), 135.1 д (Cп, JPC = 3.1 Гц), 137.9 д
проводили при напряженности магнитного поля
(C4', J = 4.2 Гц), 154.3, 155.4, 162.1 (C1), 180.3 (C3).
7.16×105 А/м. В качестве этанола для калибровки
Найдено, %: C 67.3; H 4.4; Br 13.0; N 2.5; P 5.2.
использовали Hg[Co(CNS)4].
C35H27BrNO3P. Вычислено, %: C 67.78; H 4.35; Br
12.88; N 2.26; P 4.99.
Квантово-химический расчет проводили в
рамках теории функционала плотности с
б. К раствору 4-гидрокси-3-формилкумарина 1
использованием гибридного обменно-корреляцион-
[35] (0.175 г, 0.001 моль) в 10 мл этанола добавляли
ного функционала B3LYP
[38] в валентно-
бромид
4-аминобензил(трифенил)фосфония
расщепленном базисе гауссовых функций, расши-
(0.403 г,
0.001 моль) при перемешивании и
ренного поляризационными d-функциями на
комнатной температуре. Полученный раствор
тяжелых атомах 6-311G(d). Использовали прог-
кипятили 4 ч, выпавший осадок отфильтровывали,
рамму Gaussian’09 [39]. Оптимизацию геометрии
промывали этанолом и перекристализовывали из
проводили без ограничения по симметрии,
смеси этанол-ДМФА (2:1). Выход 0.43 г (75%).
минимумы на поверхности потенциальной энергии
Комплекс цинка
3. К кипящей суспензии
характеризовали отсутствием мнимых частот
соединения 2 (0.1 г, 0.2 ммоль) в 5 мл этанола
рассчитанных нормальных колебаний. Влияние
добавляли раствор Zn(CH3COO)2·2Н2О (0.019 г,
среды учитывали в рамках модели непрерывной
0.1 ммоль) в 2 мл этанола. Полученный раствор
поляризуемой среды (PCM) [40] с использованием
кипятили 3 ч, выпавший осадок отфильтровывали,
параметров для растворителя (ДМСО), принятых в
промывали кипящим этанолом и высушивали в
программе Gaussian’09 по умолчанию.
вакууме. Выход
0.048 г
(47%), светло-желтый
Бромид (4-{[(2,4-диоксо-2Н-хромен-3(4Н)-или-
мелкокристаллический порошок, т. пл. >350°С. ИК
ден)метил]амино}бензил)(трифенил)фосфония
спектр (вазелин), ν, см-1: 567, 609, 692, 748, 760,
(2). а. К раствору 4-гидроксикумарина (0.15 г,
812, 831, 846, 872, 904, 934, 989, 1019, 1031, 1068,
0.001 моль) при
40°С в
3 мл изопропанола
1111 (Р-С), 1149, 1187, 1201, 1217, 1273, 1298,
добавляли по каплям при перемешивании
1324, 1404, 1421, 1438 (Р-Рh), 1484, 1576, 1604
ортомуравьиный эфир (0.4 мл, 0.002 моль) и через
(С=С), 1610 (С=С), 1663 (C=O), 1682 (C=O), 3072
5 мин к полученному раствору добавляли раствор
(CHAr). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 5.15 д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
718
ПОПОВ и др.
(2H, CH2, JРН = 15.6 Гц), 6.95-6.99 м (1/2H), 7.00-
10.1080/10426507.2012.740694
7.03 м (3/2H), 7.22-7.28 м (1H), 7.30-7.35 м (3H),
5. Kanazava A., Ikeda T., Endo T. // Antimicrob. Agent.
7.61-7.68 м (7H), 7.72-7.76 м (6H), 7.85-7.91 м
Chemother. 1994. Vol. 38. N 5. P. 945. doi 10.1128/
(13/4H), 8.01 д (3/4Н, 3JНН = 6.5 Гц), 8.38 уш. c.
AAC.38.5.945
(1/4H, CH-N), 8.58 c (3/4H, CH-N). Найдено, %: C
6. Popa А., Davidescu С.M., Trif R., Ilia Gh., Iliescu S.,
63.3; H
4.1; Br
12.6; N
2.2; P
4.9; Zn
5.2.
Dehelean Gh. // React. Funct. Polym. 2003. Vol. 55.
N 2. P. 151. doi 10.1016/S1381-5148(02)00224-9
C68H52Br2N2O6P2Zn. Вычислено, %: C 63.82; H 4.06;
7. Masayo I., Tomoo I., Biyuuki K. Pat.
2002308713
Br 12.49; N 2.19; P 4.84; Zn 5.11.
(2002). Japan.
Комплекс меди(II)
4 получали аналогично.
8. Xue Y., Xiao H., Zhang Yi. // Int. J. Mol. Sci. 2015.
Выход 51%, т. пл. >350°С. ИК спектр (вазелин), ν,
Vol. 16. N 2. P. 3626. doi 10.3390/ijms16023626
см-1: 554, 601, 688, 747, 810, 839, 863, 900, 931, 986,
9. Modica-Napolitano J.S., Aprille J.R. // Adv. Drug
1109 (Р-С), 1144, 1178, 1213, 1319, 1418, 1437 (Р-
Delivery Rev. 2001. Vol. 49. N 1-2. P. 63. doi 10.1016/
Рh), 1479, 1572, 1601 (С=С), 1606 (С=С),
1660
S0169-409X(01)00125-9
(C=O), 1675 (C=O), 3069 (C-HAr). Найдено, %: C
10. Murphy M.P. // Biochim. Biophys. Acta. 2008. Vol. 1777.
63.1; H
4.1; Br
12.7; Cu
5.1; N
2.3; P
5.0.
N 7-8. P. 1028. doi 10.1016/j.bbabio.2008.03.029
C68H52Br2CuN2O6P2. Вычислено, %: C 64.02; H 4.06;
11. Porteous C.M., Logan A., Evans C., Ledgerwood E.C.,
Menon D.K., Aigbirhio F., Smith R.A.J., Murphy M.P. //
Br 12.50; Cu 4.97; N 2.23; P 4.81.
Biochim. Biophys. Acta. 2010. Vol. 1800. N 9. P. 1009.
Комплекс никеля(II) 5 получали аналогично.
doi 10.1016/j.bbagen.2010.06.001
Выход 49%, т. пл. >350°С. ИК спектр (вазелин), ν,
12. Le Trionnaire S., Perry A., Szczesny B., Szabo C.,
см-1: 565, 686, 744, 802, 822, 871, 920, 1011, 1055,
Winyard P.G., Whatmore J.L., Wood M.E., Whiteman M. //
Med. Chem. Commun. 2014. Vol. 5. N 6. P. 728. doi
1110 (Р-С), 1140, 1177, 1267, 1315, 1419,
1436
10.1039/C3MD00323J
(Р-Рh), 1477, 1568, 1600 (С=С), 1605 (С=С), 1661
13. Millard M., Gallagher J.D., Olenyuk B.Z., Neamat N. //
(C=O), 1682 (C=O), 3068 (C-HAr). Найдено, %: C
J. Med. Chem. 2013. Vol. 56. N 22. P. 9170. doi
64.3; H
4.1; Br
12.8; Ni
4.7; N
2.2; P
4.8.
10.1021/jm4012438
C68H52Br2NiN2O6P2. Вычислено, %: C 64.15; H 4.14;
14. Chalmers S., Caldwell S.T., Quin C., Prime T.A.,
Br 12.60; Ni 4.61; N 2.22; P 4.91.
James A.M., Cairns A.G., Murphy M.P., McCarron J.G.,
Hartley R.C. // J. Am. Chem. Soc. 2012. Vol. 134. N 2.
КОНФЛИКТ ИНТЕРЕСОВ
P. 758. doi 10.1021/ja2077922
15. Stoyanovsky D.A., Jiang J., Murphy M.P., Epperly M.,
Авторы заявляют об отсутствии конфликта
Zhang X., Li S., Greenberger J., Kagan V., Bayır H. //
интересов.
ACS Med. Chem. Lett. 2014. Vol. 5. N 12. P. 1304. doi
10.1021/ml5003635
СПИСОК ЛИТЕРАТУРЫ
16. Zhang Ch., Xin B., Xi Zh., Zhang B., Li Zh., Zhang H.,
Li Zh., Hao J. // ACS Sust. Chem. Eng. 2018. Vol. 6.
1. Pugachev M.V., Shtyrlin N.V., Sysoeva L.P., Nikitina E.V.,
N 1. P. 1468. doi 10.1021/acssuschemeng.7b03954
Abdullin T.I., Iksanova A.G., Ilaeva A.A., Musin R.Z.,
17. Pozzi G., Quici S., Fish R.H. // J. Fluorine Chem. 2008.
Berdnikov E.A., Shtyrlin Y.G. // Bioorg. Med. Chem.
Vol.
129.
N
10.
P.
920.
doi
10.1016/
2013. Vol.
21. N
14. P.
4388. doi
10.1016/
j.jfluchem.2008.06.001
j.bmc.2013.04.051
18. Werner T. // Adv. Synth. Catal. 2009. Vol. 351. N 10.
2. Pugachev M.V., Shtyrlin N.V., Sapozhnikov S.V.,
P. 1469. doi 10.1002/adsc.200900211
Sysoeva L.P., Iksanova A.G., Nikitina E.V., Musin R.Z.,
19. Mohamed N.R., Halim M.M.A., Gad W.A., Zaid M.F. //
Lodochnikova O.A., Berdnikov E.A., Shtyrlin Y.G. //
Phosphorus, Sulfur, Silicon, Relat. Elem. 2007. Vol. 182.
Bioorg. Med. Chem. 2013. Vol. 21. N 23. P. 7330. doi
N 3. P. 551. doi 10.1080/10426500600977379
10.1016/j.bmc.2013.09.056
20. Greenhill J.V. // Chem. Soc. Rev. 1977. Vol. 6. P. 277.
3. Galkina I.V., Aksunova A.F., Bakhtiyarov D.I., Shulae-
doi 10.1039/CS9770600277
va M.P., Pozdeev O.K., Egorova S.N., Bakhtiyarova Y.V.,
Galkin V.I. // Phosphorus, Sulfur, Silicon, Relat. Elem.
21. Lue P., Greenhill J.V. // Adv. Heterocycl. Chem. 1996.
2016. Vol.
191.
N
11-12. P.
1676. doi
N 67 . P. 207. doi 10.1016/S0065-2725(08)60072-0
10.1080/10426507.2016.1227821
22. Seo K.D., Song H.M., Lee M.J., Pastore M., Anselmi C.,
4. Galkina I., Bakhtiyarova Y., Andriyashin V., Galkin V.,
De Angelis F., Nazeeruddin M.K., Graetzel M.,
Cherkasov R. // Phosphorus, Sulfur, Silicon, Relat.
Kim H.K. // Dyes Pigments. 2011. Vol. 90. N 3. P. 304.
Elem.
2013. Vol.
188. N
1-3. P.
15. doi
doi 10.1016/j.dyepig.2011.01.009
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА НОВОГО ЕНАМИНА
719
23. Травень В.Ф., Иванов И.В., Панов А.В., Сафроно-
Silicon, Relat. Elem. 2018. Vol. 193. N 6. P. 375. doi
ва О.Б., Чибисова Т.А. // Изв. АН. Сер. хим. 2008.
10.1080/10426507.2018.1424159
Т. 57. № 9. С. 1954; Traven’ V.F., Ivanov I.V., Panov A.V.,
34. Murray R.D.H., Mendes J., Brown S.A. The Natural
Safronova O.B., Chibisova T.A. // Rus. Chem. Bull.
Coumarins: Occurrence, Chemistry and Biochemistry.
2008. Vol. 57. N 9. P. 1989. doi 10.1007/s11172-008-
New York: Wiley, 1982. Р. 702.
0267-5
35. Шкумат А.П. // Вестн. Харьковск. нац. унив. 1999.
24. Bagihalli G.B., Avaji P.G., Badami P.S., Patil S.A. // J.
Вып. 4 (27). № 454. С. 150.
Coord. Chem. 2008. Vol. 61. N 17. P. 2793. doi
10.1080/00958970801975109
36. Милевский Б.Г., Чибисова Т.А., Соловьева Н.П.,
Анисимова О.С., Лебедев В.С., Иванов И.В., Тра-
25. Yan M.-h., Li T.-r., Yang Z.-y. // Inorg. Chem. Commun.
вень В.Ф. // ХГС. 2012. № 12. С. 1903; Milevskii B.G.,
2011. Vol.
14. N
3. P.
463. doi
10.10316/
Chibisova T.A., Solov’eva N.P., Anisimova O.S.,
j.inoche.2010.12.027
Lebedev V.S., Ivanov I.V., Traven V.F.
// Chem.
26. An J.-m., Yang Z.-y., Yan M.-h., Li T.-r. // J. Lumine-
Heterocycl. Compd. 2013. Vol. 48. N 12. P. 1781. doi
scence.
2013. Vol.
139. P.
79. doi
10.10316/
10.1007/s10593-013-1209-1
j.jlumin.2013.02.019
37. Паркер C.A. Фотолюминесценция растворов. М.:
27. Xie L., Chen Y., Wu W., Guo H., Zhao J., Yu X. // Dyes
Мир, 1972. С. 247.
Pigments. 2012. Vol. 92. N 3. P. 1361. doi 10.1016/j.
dyepig.2011.09.023
38. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7.
28. Kulkarni A.D., Bagihalli G.B., Patil S.A., Badami P.S. //
P. 5648. doi 10.1063/1.464913
J. Coord. Chem. 2009. Vol. 21. N 18. P. 3060. doi
39. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
10.1080/00958970902914569
Robb M.A., Cheeseman J.R., G. Scalmani V.B.,
29. Chen F., Liu G., Shi Y., Xi P., Cheng J., Hong J., Shen R.,
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Yao X., Bai D., Zeng Z. // Talanta. 2014. Vol. 124.
Li X., Hratchian H.P., A.F. Izmaylov, Bloino J., Zheng G.,
P. 139. doi 10.1016/j.talanta.2014.02.034
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
30. Шкумат А.П., Бережной А.Ю. // Вестн. Харьковск.
Honda Y., Nakai H., Vreven T., Montgomery J.A.,
нац. унив. 2008. Вып. 16 (39). № 820. С. 246.
Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
31. Попов Л.Д., Бородкин С.А., Щербаков И.Н., Тка-
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
ченко Ю.Н., Александров Г.Г., Белобородов С.С.,
Normand J., Raghavachari K., Rendell A., Burant J.C.,
Зубенко А.А., Коган В.А., Маевский О.В. // ЖОХ.
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
2013. Т. 83. Вып. 7. С. 1125; Popov L.D., Borod-
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
kin S.A., Scherbakov I.N., Tkachenko Yu.N.,
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
Aleksandrov G.G., Beloborodov S.S., Zubenko A.A.,
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
Kogan V.A., Maevskii O.V. // Russ. J. Gen. Chem. 2013.
Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A.,
Vol.
83.
N
7.
P.
1376.
doi
10.1134/
Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D.,
S107036321307013X
Farkas O., Foresman J.B., Ortiz J.V., Cioslowski J.,
32. Попов Л.Д., Бородкин С.А., Щербаков И.Н., Тка-
Fox D.J. Gaussian 09, Revision A.02. 2009.
ченко Ю.Н., Коган В.А. // ЖОХ. 2008. Т. 78. Вып. 4.
40. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
С. 586; Popov L.D., Borodkin S.A., Scherbakov I.N.,
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009
Tkachenko Yu.N. // Russ. J. Gen. Chem. 2008. Vol. 78.
N 4. P. 567. doi 10.1134/S1070363208040099
41. Le Corre M., Hercouet A., Le Stanc Y., Le Baron H. //
33. Borodkin S.A., Popov L.D., Tsaturyan A., Milenković M.R.,
Tetrahedron. 1985. Vol. 41. N 22. P. 5313. doi 10.1016/
Shcherbakov I.N., Lukov V.V. // Phosphorus, Sulfur,
S0040-4020(01)96783-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
720
ПОПОВ и др.
Synthesis, Structure and Properties of New Enamine Containing
Coumarin and Phosphonium Fragments
L. D. Popova, *, I. N. Scherbakova, S. A. Borodkina, Yu. V. Revinskiib, E. A. Kazoyanc,
G. A. Shaginyanc, A. R. Sarkisyanc, and Sh. A. Markaryanc
a Southern Federal University, ul. Zorge 7, Rostov-on-Don, 344090 Russia
*e-mail: ldpopov@mail.ru
b Southern Scientific Center, Russian Academy of Sciences, Rostov-on-Don, Russia
c Yerevan State University, Yerevan, Armenia
Received November 21, 2018; revised November 21, 2018; accepted November 28, 2018
Condensation of 4-hydroxy-3-formylcoumarin with 4-aminobenzyl(triphenyl) phosphonium bromide leads to the
formation of a phosphonium salt existing in a solution of DMSO in the form of two enamine forms, Z and E,
according to NMR spectroscopy and quantum-chemical calculations data. Based on the obtained salt, metal
chelates of zinc(II), copper(II) and nickel(II) of ML2 formula were synthesized. Luminescence properties of the
ligand and its complex with zinc were studied.
Keywords: enamines, 4-hydroxy-3-formylcoumarin, zinc(II) metal chelates, phosphonium salts, magnetochemistry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019