ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 721-725
УДК 615.355;54.057
СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ЛЮТЕИНА,
АСТАКСАНТИНА И ПРОГНОЗ ИХ АКТИВНОСТИ
© 2019 г. С. В. Печинский*, А. Г. Курегян, Э. Т. Оганесян, Э. Ф. Степанова
Пятигорский медико-фармацевтический институт, филиал Волгоградского государственного медицинского
университета Министерства здравоохранения России,
пр. Калинина 11, Пятигорск, 357532 Россия
*e-mail: hplc@yandex.ru
Поступило в Редакцию 24 декабря 2018 г.
После доработки 30 января 2019 г.
Принято к печати 31 января 2019 г.
Синтезированы сложные эфиры индивидуальных природных каротиноидов - лютеина и астаксантина - с
бензойной, 4-метилбензойной, никотиновой и фенилгликолевой кислотами. Этерификацию каротино-
идов проводили в безводной среде при 37°С, что обусловлено применением биокатализатора Новозима
435. Прогноз активности полученных сложных эфиров in silico методом молекулярного докинга позволил
определить два перспективных соединения в отношении белка сетчатки глаза Stard3 PDP код 5I9J.
Ключевые слова: лютеин, астаксантин, этерификация, Новозим 435, молекулярный докинг
DOI: 10.1134/S0044460X19050093
Целенаправленный транспорт лекарственных
сравнению с другими тканями концентрация
средств
- одна из первоочередных проблем
лютеина и зеаксантина в центре макулы сетчатки
современных медицины и фармации, решение
человеческого глаза
[7,
9]. Избирательность
которой ведется, как правило, в двух взаимо-
накопления каротиноидов в органах и тканях
связанных областях: направленный (прогнозируемый)
целесообразно использовать для направленного
синтез лекарственных средств и использование
транспорта лекарственных средств к органу-
новых лекарственных форм и средств доставки
мишени. Модификация молекулы каротиноида,
(липосомальные, микрокапсулированнные, магнитные
например, синтез сложных эфиров, окажет влияние
лекарственные формы, транспортные терапевтические
на его фармакокинетические характеристики, а
системы и др.). Целевая доставка лекарственных
остающийся каротиноидный фрагмент позволит
средств к органу-мишени позволит повысить
сохранить изначальные свойства базовой струк-
терапевтический эффект и, что немаловажно,
туры. Для поиска оптимального класса модифици-
снизить их дозу и побочное действие.
рованных производных каротиноидов важно то,
что в биологических средах эти соединения в
Одна из важных тенденций в области
связанной форме находятся преимущественно в
направленного синтеза - преобразование природ-
виде эфиров органических кислот [7, 9].
ных соединений. В настоящее время достаточно
Для обоснования проведения направленной
активно ведутся исследования по получению
модификации структуры каротиноидов (лютеина и
полусинтетических продуктов на основе природ-
астаксантина) и экспериментального подтверждения
ных биологически активных веществ, например,
нашей гипотезы необходимо было синтезировать
тритерпеноидов лупанового ряда [1], алкалоидов
структурно близкие производные и осуществить
[2], терпенофенолов [3, 4], флавоноидов [5, 6] и др.
прогноз активности полученных кандидатов in silico.
Модификация структуры природных каротино-
идов, обладающих широким спектром фармаколо-
Получение сложных эфиров лютеина и
гических свойств [7, 8], открывает перспективу
астаксантина осуществляли по аналогии с
направленного синтеза их оригинальных полусинте-
синтезом цикланделата, где в качестве спирта был
тических производных. Для каротиноидов харак-
использован 3,3,5-триметилциклогексан-1-ол, близкий
терна избирательность накопления в органах и
по строению к структуре концевых фрагментов
тканях, например, максимально высокая по
молекул ксантофиллов
[10,
11]. Результаты
721
722
ПЕЧИНСКИЙ и др.
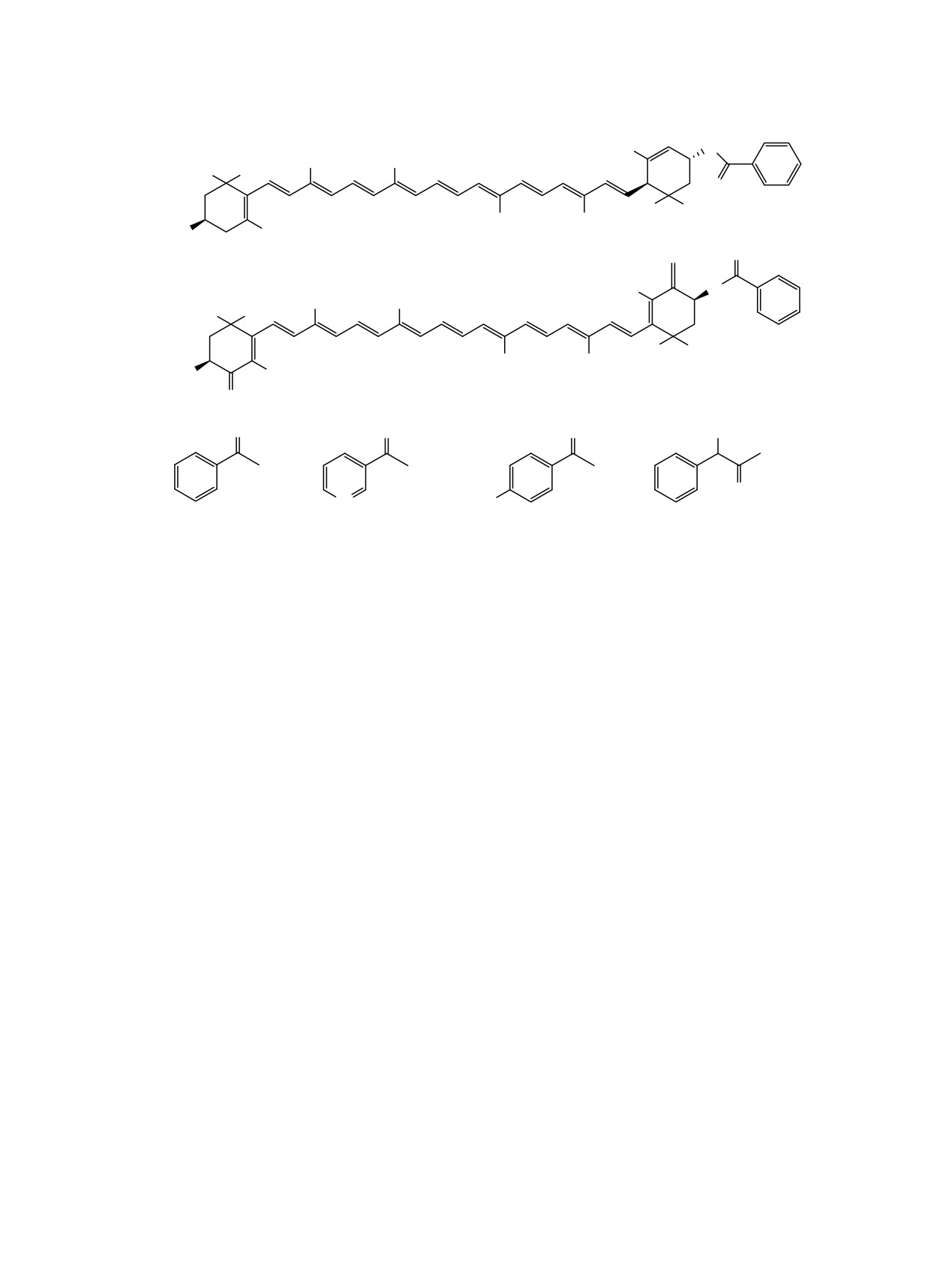
Схема 1.
H3C
O
CH3
CH3
H3C CH3
O
H3C CH3
CH
3
CH3
RO
CH3
1-4
O
H3C
O
CH3
CH3
H3C CH3
H3C CH3
CH
3
CH3
RO
CH3
O
5-8
O
O
O
OH
R =
(1, 5);
(2, 6);
(3, 7);
(4, 8).
O
N
H
3C
эксперимента хорошо согласуются с данными,
фикации ксантофиллов нами был использован
представленными в патенте [12], авторы которого
щадящий режим получения их эфиров, а именно,
получили сложные эфиры ретинола с
применение биокатализаторов, в частности липаз.
органическими кислотами. Для интерпретации
Ферментативный катализ с использованием
полученных результатов мы сочли целесообразным
липаз позволяет получать эфиры при низких
получить ряд соединений с максимально близкими
температурах и без использования агрессивных
структурами. В связи с этим в качестве кислот
реактивов. Активный участок фермента имеет
были выбраны бензойная,
4-метилбензойная,
гидрофобный характер, и поэтому реакции
никотиновая, фенилгликолевая кислоты [10, 11].
этерификации с их участием протекают в среде
органических растворителей. Считается, что
Как известно, этерификация наиболее полно и
гидрофобные спирты
- наиболее подходящие
быстро протекает в присутствии металлов,
растворители для этерификации, катализируемой
например, цинка, никеля, магния, и сильных
липазой.
кислот - серной или хлористоводородной, другое
Этерификацию лютеина и астаксантина
необходимое условие - нагревание реакционной
проводили в присутствии биокатализатора Новозим
смеси до
100°С
[10-12]. Очевидно, что для
435 (Novozyme 435), который представляет собой
этерификации ксантофиллов необходима адаптация
фермент липазу Candida antarctica, иммобилизи-
традиционных условий ее протекания. Это связано
рованную на акриловой смоле [13]. Ранее этот
с особенностями растворимости ксантофиллов: они
катализатор был использован при синтезе
практически нерастворимы в воде и растворимы в
производных ретинола, структуры близкой
неполярных органических растворителях. Немало-
каротиноидам
[12]; он соответствует всем
важным фактором является температурный режим:
требованиям, присущим биокатализаторам. Данный
реакция с ксантофиллами при температурах свыше
катализатор приемлем также для работы с
50°С приведет к разрушению основного фарма-
индивидуальными каротиноидами. Установлено,
кофора каротиноидов - полиеновой цепи. При
что через
6 ч катализатор не изменялся. В
использовании металлов и кислот в качестве
результате эксперимента были получены сложные
катализаторов помимо основной реакции проис-
эфиры лютеина 1-4 и астаксантина 5-8 с выходами
ходит выделение водорода, что приведёт к
58-61% (схема 1).
частичному или полному гидрированию поли-
еновой цепи и к изменению каротиноидной
Структура полученных соединений подтвер-
структуры. С учетом описанной специфики этери-
ждена методами ЯМР 1H и масс-спектрометрии. В
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ЛЮТЕИНА
723
(a)
(б)
Пространственное расположение лютеина (a) и соединений 1 и 2 (б) в белке Stard3, код 5I9J.
спектрах ЯМР
1H синтезированных сложных
полусинтетических производных каротиноидов,
эфиров
1-8 четко прослеживаются сигналы
найдены условия синтеза сложных эфиров
лютеина и астаксантина, а также сложноэфирных
ксантофиллов, при которых сохраняется каро-
фрагментов. Отсутствие полос при 4.00 (1Н, Н3) и
тиноидоная часть структуры соединений. Наиболее
4.25
(1Н, Н3') свидетельствует об образовании
перспективными соединениями для исследований в
сложноэфирной связи.
области активного транспорта при макуло-
дистрофии являются сложные эфиры лютеина с
Клинические исследования показали, что
бензойной и никотиновой кислотами. Дальнейшие
лютеин понижает риск развития возрастной
фармакологические исследования позволят под-
макулодистрофии за счет защиты от фотоокисли-
твердить взаимосвязь между структурой синте-
тельного стресса [14, 15]. Локализация ксанто-
зированных соединений и их биологической
филлов в макуле обусловлена их связью со
активностью.
специфическим белком сетчатки глаза - Stard3,
также известного как MLN64, что, вероятней всего,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
определяет их специфичную фотозащитную
Лютеин и астаксантин были получены по
биохимическую функцию [16, 17]. Нами проведено
известным методикам [18-20].
прогнозирование активности восьми синтезиро-
Регистрацию спектров ЯМР 1Н проводили на
ванных сложных эфиров методом молекулярного
спектрометре Bruker AMXIII-400 при 400 МГц в
докинга, т. е. изучена возможность связывания
ДМСО-d6, внутренний стандарт - ТМС. Масс-
синтезированных соединений с белком Stard3 PDP,
спектры регистрировали на масс-спектрометр
код 5I9J (см. рисунок).
Agilent
6420, сопряженным с ВЭЖХ системой
Установлено, что синтезированные производные
Agilent HPLC 1100 методом химической ионизации
лютеина 1 и 2 имеют наиболее близкое с лютеином
при атмосферном давлении (APCI), температура
пространственное расположение в активном
ионного источника 120°C, газ-носитель - гелий,
центре белка Stard3, код 5I9J, причем соединение 2
энергия CID 40 эВ. Параметры ВЭЖХ: колонка
имеет дополнительную водородную связь с
Dionex Acclaim C30
(250x4.6 мм
×
5 мкм);
лизином 372, что свидетельствует о более прочной
температура колонки
25°С; подвижная фаза
-
связи в сравнении с лютеином. Производные
метанол (фаза А), трет-бутилметиловый эфир
лютеина 3 и 4 и астаксантина 5-8 имеют низкие
(фаза Б), вода (фаза В); линейный градиент: фазы А
значения энергии докинга, их пространственное
85, Б 12, В 3% → А 5, Б 92 В 3% за 45 мин; объем
расположение в активном центре существенно
пробы 20 мкл, скорость подвижной фазы 0.5 мл/мин;
отличается от расположения лютеина, что
объем пробы, автоматически вводимой в масс-
свидетельствует
о
слабой
вероятности
детектор,
20 мкл. Температуры плавления
взаимодействия с белком Stard3, код 5I9J.
определены на приборе ПТП (М).
Таким образом, экспериментально подтвер-
Молекулярный докинг кандидатов с белком
ждена принципиальная возможность получения
Stard3, код 5I9J, проводили, используя программу
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
724
ПЕЧИНСКИЙ и др.
ArgusLab, GA Dock [21]. Оптимизацию простран-
J = 15.0), 6.67-6.71 м (4Н, Н11,11',15,15'), 7.43 д. д (4Н,
ственной структуры лиганда выполняли полу-
Н24,24',26,26', J = 8.0, 2.0), 7.74 д. д (4Н, Н23,23',27,27', J =
эмпирическим методом PM3 с помощью прог-
9.0, 1.0). Масс-спектр, m/z:
805.5178
[M + Н]+.
раммного комплекса GAMESS [22].
С56Н68О4Н+. Мвыч. 805.5190.
Общая методика синтеза сложных эфиров
β,ε-Каротин-3,3'-диилди(2-гидрокси-2-фенил-
лютеина и астаксантина 1-8. К смеси 2 ммоль
этаноат) (4). Выход 0.97 г (58%), т. пл. 157-159°С.
лютеина или астаксантина и 4 ммоль кислоты
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.14 c (6Н,
(бензойной, 4-метилбензойной, никотиновой или
Ме16',17'),1.15 c (6Н, Ме16,17), 1.83 д. д (1Н, Н6, J =
фенилгликолевой) прибавляли 50 мл толуола и
14.0, 5.0), 1.62 т (1Н, Н2, J = 17.0), 1.91 c (3Н, Ме5'),
5 мл метанола. В полученную реакционную смесь
1.92 c (3Н, Ме5), 1.99 c (3Н, Ме9'), 2.00 c (9Н,
вносили 0.1 г катализатора Новозим 435. Смесь
Ме9,13,13'), 2.36 т (1Н, Н2, J = 17.0), 2.42 c (6Н,
перемешивали 6 ч при 37°С, защищая от действия
Ме25,25'), 5.14 с (2Н, Н22,22'), 6.15 c (2Н, Н7,8), 6.18 м
света. Полученную смесь пропускали через
(3Н, Н8',10,10'), 6.27 м (2Н, Н14,14'), 6.31 д (2Н, Н12,12',
колонку, заполненную 2.5 г оксида алюминия,
J = 15.0), 6.66-6.70 м (4Н, Н11,11',15,15'), 7.32 т (6Н,
собирали вторую окрашенную фракцию. Получен-
Н25,25',26,26',27,27', J = 7.0), 7.41 д. д (4Н, Н23,23',28,28', J =
ную фракцию промывали
95%-нным этиловым
8.0, 1.0). Масс-спектр, m/z:
837.5059
[M + Н]+.
спиртом и водой, затем сушили 2 ч в вакууме (20-
С56Н68О6Н+. Мвыч. 837.5089.
25 мм рт. ст.) при 40°С.
4,4'-Диоксо-β,β-каротин-3,3'-диилдибензоат
(5). Выход 0.94 г (59%), т. пл. 201-203°С. Спектр
β,ε-Каротин-3,3'-диилдибензоат
(1).
Выход
ЯМР 1Н, δ, м. д. (J, Гц): 1.13 с (6Н, Ме17,17'), 1.25 с
0.95 г (61%), т. пл. 165-167°С. Спектр ЯМР 1Н, δ,
(6Н, Ме16,16'), 1.77 т (2Н, Н2, J = 13.0), 2.00 с (6Н,
м. д. (J, Гц): 1.14 c (6Н, Ме16',17'), 1.15 c (6Н, Ме16,17),
Ме13,13'), 2.01 с (6Н, Ме9,9'), 6.21 д (2Н, Н7,7', J =
1.83 д. д (1Н, Н6, J = 14.0, 5.0), 1.62 т (1Н, Н2, J =
16.0), 6.28-6.31 м (4Н, Н10,10',14,14'), 6.41 д (2Н, Н8,8',
17.0), 1.91 c (3Н, Ме5'), 1.92 c (3Н, Ме5), 1.99 c (3Н,
J = 15.0), 6.67-6.76 м (4Н, Н11,11',15,15'), 7.46 д (4Н,
Ме9'), 2.00 c (9Н, Ме9,13,13'), 2.36 т (1Н, Н2, J = 17.0),
Н25,25',27,27', J = 9.0), 7.57 т (2Н, Н26,26', J = 7.0), 8.03 д
6.14 c (2Н, Н7,8), 6.18 м (3Н, Н8',10,10'), 6.27 м (2Н,
(4Н, Н24,28,24',28', J = 8.0). Масс-спектр, m/z: 805.4436
Н14,14'), 6.31 д (2Н, Н12,12', J = 15.0), 6.67-6.71 м (4Н,
[M + Н]+. С54Н60О6Н+. Мвыч. 805.4463.
Н11,11',15,15'), 7.46 д (4Н, Н25,25',27,27', J = 9.0), 7.58 т
(2Н, Н26,26', J = 7.0), 8.03 д (4Н, Н24, 24',28,28', J = 2.0).
4,4'-Диоксо-β,β-каротин-3,3'-диилди(пиридин-
Масс-спектр, m/z: 777.4851 [M + Н]+. С54Н64О4Н+.
3-карбоксилат) (6). Выход 0.93 г (57%), т. пл. 203-
Мвыч. 777.4877.
205°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.13 с (6Н,
Ме17,17'), 1.25 с (6Н, Ме16,16'), 1.77 т (2Н, Н2, J =
β,ε-Каротин-3,3'-диилди(пиридин-3-карбокси-
13.0), 2.00 с (6Н, Ме13,13'), 2.01 с (6Н, Ме9,9'), 6.21 д
лат) (2). Выход 0.92 г (59%), т. пл. 171-173°С.
(2Н, Н7,7', J = 16.0), 6.28-6.31 м (4Н, Н10,10',14,14'),
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.14 c (6Н, Ме16',17'),
6.41 д (2Н, Н8,8', J = 15.0), 6.67- 6.76 м (4Н,
1.15 c (6Н, Ме16,17), 1.83 д. д (1Н, Н6, J = 14.0, 5.0),
Н11,11',15,15'), 7.49 д. д (2Н, Н24,24', J = 8.0, 5.0), 8.57 д.
1.91 c (3Н, Ме5'), 1.92 c (3Н, Ме5), 1.99 c (3Н, Ме9'),
д (2Н, Н23,23', J = 4.0, 2.0), 8.78 т (2Н, Н25,25', J = 2.0),
2.00 c (9Н, Ме9,13,13'), 2.36 т (1Н, Н2, J = 17.0), 6.14 c
9.56 т (2Н, Н26,26', J = 4.0). Масс-спектр, m/z:
(2Н, Н7,8), 6.18 м (3Н, Н8',10,10'), 6.27 м (2Н, Н14,14'),
807.4324 [M + Н]+. С52Н58N2О6Н+. Мвыч. 807.4368.
6.31 д (2Н, Н12,12', J = 15.0), 6.67-6.71 м (4Н,
Н11,11',15,15'), 7.48 д. д (2Н, Н24,24', J = 8.0, 5.0), 8.57 д.
4,4'-Диоксо-β,β-каротин-3,3'-диилди(4-метил-
д (2Н, Н23,23', J = 4.0,
2.0), 8.78 т (2Н, Н25,25',
бензоат) (7). Выход 0.96 г (58%), т. пл. 197-199°С.
J = 2.0), 9.56 т (2Н, Н26,26', J = 4.0). Масс-спектр,
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.13 с (6Н, Ме17,17'),
m/z: 779.4763 [M + Н]+. С52Н62N2О4Н+. Мвыч. 779.4782.
1.25 с (6Н, Ме16,16'), 1.77 т (2Н, Н2, J = 13.0), 2.00 с
(6Н, Ме13,13'), 2.01 с (6Н, Ме9,9'), 2.42 c (6Н, Ме25,25'),
β,ε-Каротин-3,3'-диилди(4-метилбензоат)
(3).
6.21 д
(2Н, Н7,7', J =
16.0),
6.28-6.31 м
(4Н,
Выход 0.97 г (60%), т. пл. 162-164°С. Спектр ЯМР
Н10,10',14,14'), 6.42 д (2Н, Н8,8', J = 15.0), 6.67-6.76 м
1Н, δ, м. д. (J, Гц): 1.14 c (6Н, Ме16',17'), 1.15 c (6Н,
(4Н, Н11,11',15,15'), 7.42 д. д (4Н, Н24,24',26,26', J = 8.0, 2.0),
Ме16,17), 1.83 д. д (1Н, Н6, J = 14.0, 5.0), 1.62 т (1Н,
7.74 д. д (4Н, Н23,23',27,27', J = 9.0, 2.0). Масс-спектр,
Н2, J = 17.0), 1.91 c (3Н, Ме5'), 1.92 c (3Н, Ме5), 1.99
m/z: 833.4758 [M + Н]+. С56Н64О6Н+. Мвыч. 833.4776.
c (3Н, Ме9'), 2.00 c (9Н, Ме9,13,13'), 2.36 т (1Н, Н2, J =
17.0), 2.42 c (6Н, Ме25,25'), 6.14 c (2Н, Н7,8), 6.18 м
4,4'-Диоксо-β,β-каротин-3,3'-диилди(2-гид-
(3Н, Н8',10,10'), 6.27 м (2Н, Н14,14'), 6.31 д (2Н, Н12,12',
рокси-2-фенилэтаноат) (8). Выход 0.95 г (55%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ЛЮТЕИНА
725
т. пл. 188-190°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
2018. Vol. 13. N 9. doi 10.1371/journal.pone.0203159
1.13 с (6Н, Ме17,17'), 1.25 с (6Н, Ме16,16'), 1.77 т (2Н,
7. Krinsky N. Carotenoids in health and disease. New
Н2, J = 13.0), 2.00 с (6Н, Ме13,13'), 2.01 с (6Н, Ме9,9'),
York: Dekker, 2004. P. 503.
2.42 c (6Н, Ме25,25'), 5.14 с (2Н, Н22,22'), 6.21 д (2Н,
8. Tanaka T., Shnimizu M., Moriwaki H. // Molecules.
Н7,7', J = 16.0), 6.28-6.31 м (4Н, Н10,10',14,14'), 6.41 д
2012. Vol. 17. Р. 3202. doi 10.3390/molecules17033202
(2Н, Н8,8', J = 15.0), 6.67-6.76 м (4Н, Н11,11',15,15'), 7.33
9. Britton G. Carotenoids. Nutrition and Health. Basel;
т (6Н, Н25,25',26,26',27,27', J = 7.0, 1.0), 7.40 д. д (4Н,
Boston; Berlin: Birkhäuser Verlag, 2009. Vol. 5. P. 464.
Н23,23',28,28', J = 8.0). Масс-спектр, m/z: 865.4661 [M +
10. Pat. 2707193 US (1955).
Н]+. С56Н64О8Н+ Мвыч. 865.4674.
11. Pat. 3673239 US (1972).
12. Pat. 7566795 US (2009).
КОНФЛИКТ ИНТЕРЕСОВ
13. Гарабаджиу А.В., Галынкин В.А., Карасев М.М.,
Авторы заявляют об отсутствии конфликта
Козлов Г.В., Лисицкая Т.Б. // Изв. СПбГТИ(ТУ).
интересов.
2010. Т. 7. Вып. 33. С. 63.
14. Bernstein P.S., Li B., Vachali P.P., Gorusupudi A.,
СПИСОК ЛИТЕРАТУРЫ
Shyam R., Henriksen B.S., Nolan J.M. // Prog. Retin Eye
1. Абышев А.З., Абышев Р.А., Нгуен В.Х., Морозова В.А. //
Res. 2016. Vol. 50. P. 34. doi 10.1016/j.preteyeres.2015.10.003
Мед. акад. ж. 2013. Т. 13. Вып. 2. С. 15.
15. Wu J., Cho E., Willett W.C., Sastry S.M., Schaum-
2. Дикусар Е.А., Петкевич С.К., Клецков А.В.,
berg D.A. // JAMA Ophthalmol. 2015. Vol. 133. N 12.
Кадуцкий А.П., Козлов Н.Г., Поткин В.И. // Сб.
P. 1415. doi 10.1001/jamaophthalmol.2015.3590
статей Х Междунар. симпозиума
«Фенольные
16. Li B., Vachali P., Frederick J.M., Bernstein P.S. //
соединения: свойства, активность, инновации». М.,
Biochemistry. 2011. Vol. 50. N 13. P. 2541. doi
2018, C. 47.
10.1021/bi101906y
3. Попова С.А., Чукичева И.Ю.
// Сб. статей Х
17. Horvath M.P., George E.W., Tran Q.T., Baumgardner K.,
Междунар. симпозиума
«Фенольные соединения:
Zharov G., Lee S., Sharifzadeh H., Shihab S., Mattinson T.,
свойства, активность, инновации». М., 2018, C. 133.
Li B., Bernstein P.S. // Struct. Biol. Commun. 2016.
4. Чукичева И.Ю., Буравлёв Е.В., Дворникова И.А.,
Vol. 72. N 8. P. 609. doi 10.1107/S2053230X16010694
Федорова И.В., Щукина О.В., Кучин А.В. // Сб.
18. Курегян А.Г., Печинский С.В., Степанова Э.Ф. Пат.
статей Х Междунар. симпозиума
«Фенольные
РФ 2648452 (2018) // Б. И. 2018. № 9.
соединения: свойства, активность, инновации». М.,
19. Курегян А.Г., Печинский С.В., Степанова Э.Ф. Пат.
2018, C. 190.
РФ 2659165 (2018) // Б. И. 2018. № 19.
5. Тюкавкина Н.А., Селиванова И.А., Терехов Р.П. // Сб.
20. Курегян А.Г., Печинский С.В. // Вопр. биол., мед. и
статей Х Междунар. симпозиума
«Фенольные
фарм. хим. 2016. Вып. 1. С. 22.
соединения: свойства, активность, инновации». М.,
2018, C. 526.
6. Mecenas A.S., Adão Malafaia C.R., Sangenito L.S.,
arguslab.com/ArgusLab.html.
Simas D.L.R., Machado T.B., Amaral A.C.F., Dos
Santos A.L.S., Freire D.M.G., Leal I.C.R. // PLoS One.
download.html.
Synthesis of Lutein and Astaxanthin Esters
and Their In Silico Activity
S. V. Pechinskii*, A. G. Kuregyan, E. T. Oganesyan, and E. F. Stepanova
Medical Pharmaceutical Institute of Pyatigorsk Branch of Volgograd Medical State University, Pyatigorsk, Russia
*e-mail: hplc@yandex.ru
Received December 24, 2018; revised January 30, 2019; accepted January 31, 2019
The synthesis of esters of individual natural carotenoids lutein and astaxanthin with benzoic, 4-methylbenzoic,
nicotinic and mandelic acids was performed. The esterification reaction of carotenoids was carried out in a non-
aqueous medium at a temperature of 37°C with use of Novozyme 435 biocatalyst. The forecast of candidate in
silico activity by molecular docking identified two promising compounds in relation to the retinal protein Stard3
PDP code 5I9J.
Keywords: lutein, astaxanthin, esterification, Novozyme 435, molecular docking
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019