ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 739-749
УДК 547.1’:541.67
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ
ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ:
ЭКСПЕРИМЕНТАЛЬНЫЙ И ТЕОРЕТИЧЕСКИЙ
КОНФОРМАЦИОННЫЙ АНАЛИЗ В РАСТВОРЕ
© 2019 г. Я. А. Верещагинаa, *, Р. Р. Исмагиловаa, Д. В. Чачковa,b,
С. Ф. Малышеваc, Н. А. Белогорловаc
a Казанский (Приволжский) федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия
*e-mail: yavereshchagina@gmail.com
b Казанское отделение Межведомственного суперкомпьютерного центра Российской академии наук,
Федеральный научный центр «Научно-исследовательский институт системных исследований
Российской академии наук», Казань, Россия,
c Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук, Иркутск, Россия
Поступило в Редакцию 13 декабря 2018 г.
После доработки 13 декабря 2018 г.
Принято к печати 23 декабря 2018 г.
Выполнен конформационный анализ Se-эфиров диселенофосфиновых кислот и определена их
полярность методами дипольных моментов и квантовой химии ([B3PW91/6-311++G(df,p)]+CPCM). В
растворе изученные соединения существуют в виде равновесия нескольких конформеров с
заторможенной гош- и транс- или заслоненной цис-ориентацией заместителей относительно связи P=Se.
Наличие заслоненных цис-конформаций объясняется образованием внутримолекулярных связей H···Se с
участием атома водорода Se-алкильных(бензильных) или фенильных заместителей у атома фосфора и
атомом селена P=Se группы.
Ключевые слова: дипольные моменты, конформационный анализ, диселенофосфинаты, DFT расчеты
DOI: 10.1134/S0044460X19050123
В последнее время производные диселено-
Сведения о конформационном анализе фосфор-
фосфиновых кислот находят широкое применение
органических соединений, содержащих P=Se и P-
в качестве лигандов в дизайне координационных
Se-Alk(Ar) фрагменты, с использованием квантово-
структур [1-3], высокоэффективных «одноисточ-
химических методов в литературе довольно
никовых» прекурсоров магнитооптических и
скудны, поэтому теоретическое обоснование
фотохимических материалов [4-12], экстрагентов
экспериментальных данных о конформациях
тяжелых, редкоземельных и трансурановых элементов
фосфинхалькогенидов, в частности фосфинселе-
[13,
14],
потенциальных фармацевтических
нидов, остается актуальной задачей для изучения
препаратов [15], строительных блоков в органи-
их координирующих свойств и объяснения
ческом и элементоорганическом синтезе [16-22].
механизмов реакций с их участием.
Метод синтеза Se-эфиров диселенофосфиновых
Недавно нами был проведен экспери-
кислот на основе трехкомпонентной атом-
ментальный и теоретический конформационный
экономной реакции с участием вторичных
анализ некоторых бис(2-фенилалкил)фосфин-
фосфинселенидов, элементного селена и алкенов
селенидов
[25-29],
трис(2-пиридил)фосфин-
(или алкилгалогенидов), был разработан в
селенида [30] и производных бис(2-фенилэтил)-
Иркутском институте химии им. А.Е. Фаворского.
селенофосфиновых кислот
[31]. Конформации
Реакция протекает в отсутствие катализаторов с
исследованных структур вписываются в общую
хорошим выходом целевых продуктов [21, 23, 24].
конформационную картину, характерную для
739
740
ВЕРЕЩАГИНА и др.
Таблица
1. Коэффициенты расчетных уравнений,
Схема 1.
ориентационные поляризации и экспериментальные
R1
Se
дипольные моменты соединений 1-6
P
R1
Se
R2
µэксп,
№
Растворитель
α
γ
Pор, см3
R1 = Ph, R2 = Me (1); R1 = Ph, R2 = Pr (2); R1 = Ph, R2 = Bn
Д
(3); R1 = Ph(CH2)2, R2 = Me (4); R1 = Ph(CH2)2, R2 = Et (5);
1
Бензол [32]
8.165
0.393
523.864
4.94
R1 = Ph(CH2)2, R2 = Bn (6).
Диоксан
6.717
0.586
358.533
4.41
2
Бензол [32]
6.644
0.199
468.55
4.76
растворов полярных веществ в неполярных
растворителях [33], и приведены в табл. 1. Их
Диоксан
7.363
0.610
426.042
4.30
высокие значения хорошо согласуются с
3
Бензол [32]
7.955
0.382
645.007
5.59
известными данными по полярности соединений
Диоксан
8.558
0.455
579.668
5.30
четырехкоординированного фосфора, содержащих
связи P=Se и P-Se, алкильные или арильные
4
Бензол [32]
4.827
0.333
350.245
4.17
радикалы [34].
Диоксан
6.301
0.593
385.750
4.52
Конформационный анализ диселенофосфинатов
5
Бензол [32]
5.473
0.289
417.886
4.50
1-7 выполнен с использованием метода дипольных
Диоксан
4.274
0.446
266.713
3.59
моментов, ИК спектроскопии и квантово-
химических расчетов. Согласно предыдущим
6
Бензол [32]
6.324
0.296
556.307
5.19
исследованиям [29], метод B3PW91/6-311++G(df,p)
позволяет достичь хорошего согласия величин
ациклических соединений с четырехкоордини-
теоретических и экспериментальных дипольных
рованным фосфором. Они существуют в виде
моментов при оптимальном времени расчета.
равновесия нескольких форм; в предпочтительных
Диселенофофинат 7 был использован в качестве
конформерах реализуется незаслоненные гош- и
аналога соединения
2. Мы рассчитали относи-
транс-ориентации заместителей у атома фосфора
тельные энергии и теоретические дипольные
относительно группы P=Se, в то время как
моменты возможных конформеров молекул 1-7 и
заслоненная цис-форма обусловлена образованием
провели сравнение теоретических и экспери-
внутримолекулярного водородного контакта. В
ментальных данных. Кроме того, для соединений
данной работе исследованы особенности конфор-
1-6 были вычислены дипольные моменты по
мационного поведения замещенных диселенофос-
векторно-аддитивной схеме. Согласно теорети-
финатов в растворе и проведено сравнение
ческим расчетам, соединения
1-7 могут
результатов с известными данными о соединениях,
существовать в виде нескольких конформеров в
содержащих связи P=Se и P-Se.
результате внутреннего вращения относительно
Нами впервые определена полярность произ-
связей Р-Csp2, Р-Csp3, P-Se, Se-Csp3 и Csp3-Csp3.
водных диселенофосфинатов
1-6 (схема
1) в
Предпочтительные конформеры соединений 1-7
растворах бензола [32] и 1,4-диоксана.
показаны на рис. 1-7. Значения относительных
энергий и энергий Гиббса, вычисленные и
Экспериментальные
значения
дипольных
теоретические дипольные моменты в газовой фазе
моментов соединений 1-6 определены с помощью
и в растворе (с применением моделей сольватации
второго метода Дебая, основанного на измерении
IPCM и CPCM) приведены в табл. 2.
диэлектрической проницаемости разбавленных
(а)
(б)
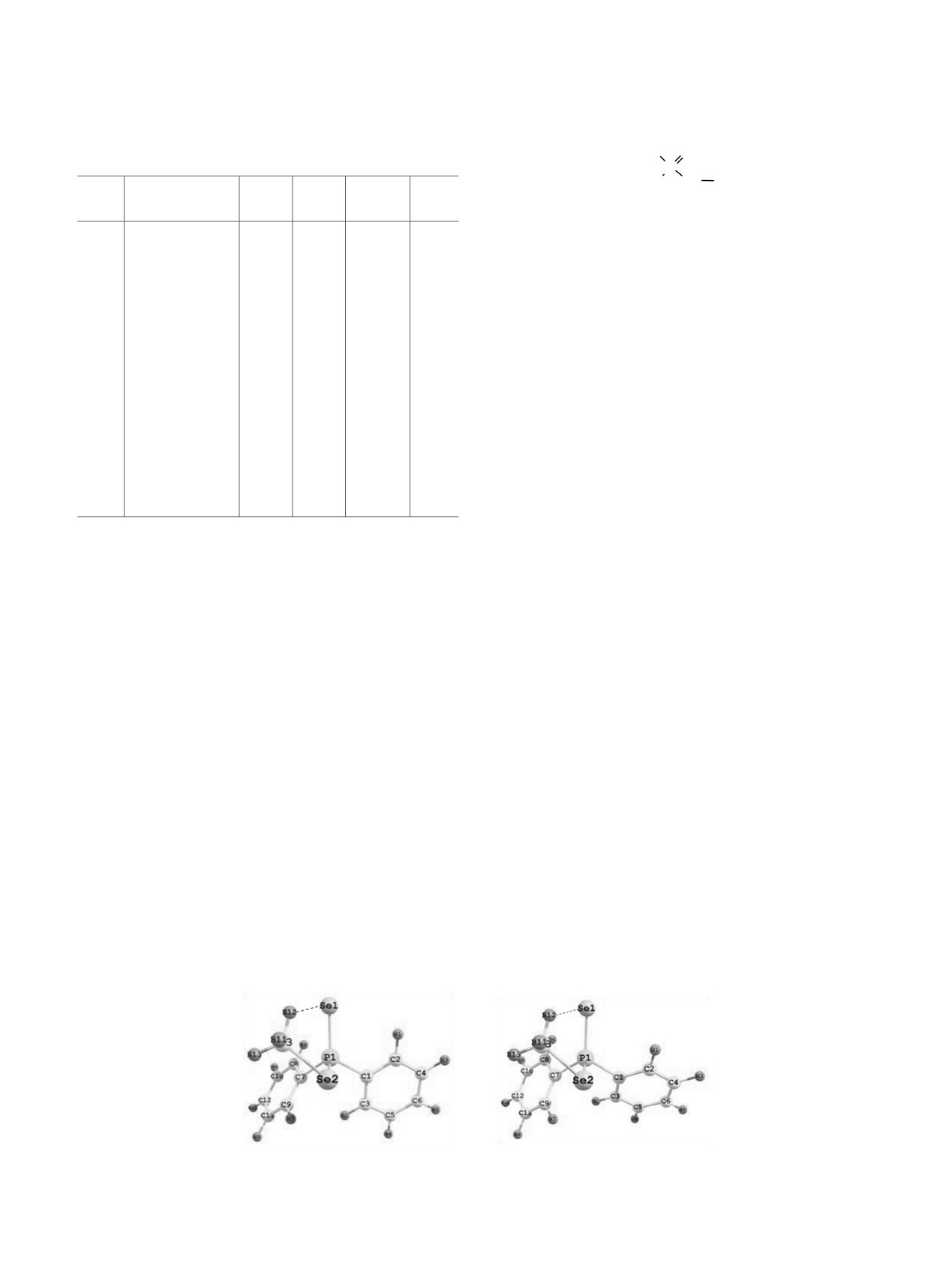
Рис. 1. Структуры конформеров диселенофосфината (a) 1a и (б) 1б [B3PW91/6-311++G(df,p)].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ
741
Таблица 2. Относительные энергии (ΔE, кДж/моль), энергии Гиббса (ΔG, кДж/моль), экспериментальные (в бензоле),
вычисленные по векторной схеме и теоретические дипольные моменты (Д) конформеров 1-7
Газовая фаза
Раствор
IPCM
CPCM
Конформер
µэксп, Д
µтеор, Д
ΔE,
ΔG,
μтеор, Д
кДж/моль
кДж/моль
ΔE,
ΔG,
μтеор, Д
μтеор, Д
кДж/моль
кДж/моль
1a
4.94
4.79
0.0
0.0
3.78
5.52
0.0
0.0
4.95
1б
4.86
0.1
1.7
3.82
5.45
0.0
0.0
4.95
2a
4.76
4.68
0.0
0.0
3.51
5.27
0.0
0.0
4.72
2б
4.69
0.4
0.3
3.63
5.44
0.0
0.0
4.71
2в
4.86
3.6
2.7
3.48
5.19
3.2
1.4
4.59
2г
5.20
4.2
7.6
3.39
4.98
4.0
7.5
4.37
3a
5.59
4.47
0.0
0.4
3.72
7.22
0.0
0.0
4.73
3б
4.78
1.4
0.0
3.65
6.24
0.5
2.2
4.75
4a
4.17
4.06
0.0
2.8
2.63
4.21
0.0
0.0
3.64
4б
4.12
5.0
0.0
2.84
4.79
1.8
1.1
3.88
4в
4.13
7.3
2.7
3.11
5.15
3.4
1.8
4.17
5a
4.50
4.07
0.0
0.0
2.53
3.78
0.0
0.0
3.35
5б
4.16
2.3
1.8
2.66
4.76
1.6
1.4
3.54
5в
4.07
5.5
5.3
2.77
4.88
4.7
3.2
3.58
6a
5.19
4.11
0.0
0.0
2.67
4.03
0.0
0.0
3.45
6б
4.09
2.4
2.3
3.05
4.70
1.9
4.6
3.91
6в
4.06
3.6
5.2
3.19
5.00
3.1
6.8
4.09
7a
-
4.07
0.0
0.0
2.47
3.93
0.0
0.0
3.31
7б
4.05
0.8
0.4
2.50
3.76
0.8
2.8
3.34
7в
4.09
2.2
1.0
2.65
4.54
1.6
2.3
3.57
В конформерах
1а и
1б, обладающих
Сопоставление экспериментальных и теорети-
практически равной относительной энергией
ческих результатов для конформеров соединения 1
(рис.
1,
табл.
2),
атом фосфора имеет
указывает на его существование в виде равновесия
пирамидальное строение, а заместители при нем
форм
1а и
1б, являющихся поворотными
располагаются в виде пропеллера относительно
изомерами относительно связи P-Csp2(фенил).
группы P=Se. В симметричном конформере 1а
Близкое расположение метильной и селенофос-
заместители (Se-Csp3 и Csp2-Csp2 связи) имеют гош-
форильной групп в обоих конформерах
ориентацию
относительно
группы
P=Se
благоприятно для образования внутримолеку-
(двугранные углы Se2P1Se2C3 44°, Se2P1C1C2 32°,
лярного контакта между атомом селена группы
Se2P1C7C8
33°). В конформере
1б заместители
P=Se и атомом водорода метильного заместителя
имеют гош,гош,цис-ориентацию, а значения
(табл. 3).
двугранных углов немного отличаются от таковых
для конформера 1а (Se2=P1Se2C3 45°, Se2P1C1C2 54°,
Замена метильной группы на пропильную
Se2P1C7C8 22°).
приводит к увеличению числа возможных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
742
ВЕРЕЩАГИНА и др.
(а)
(б)
(в)
(г)
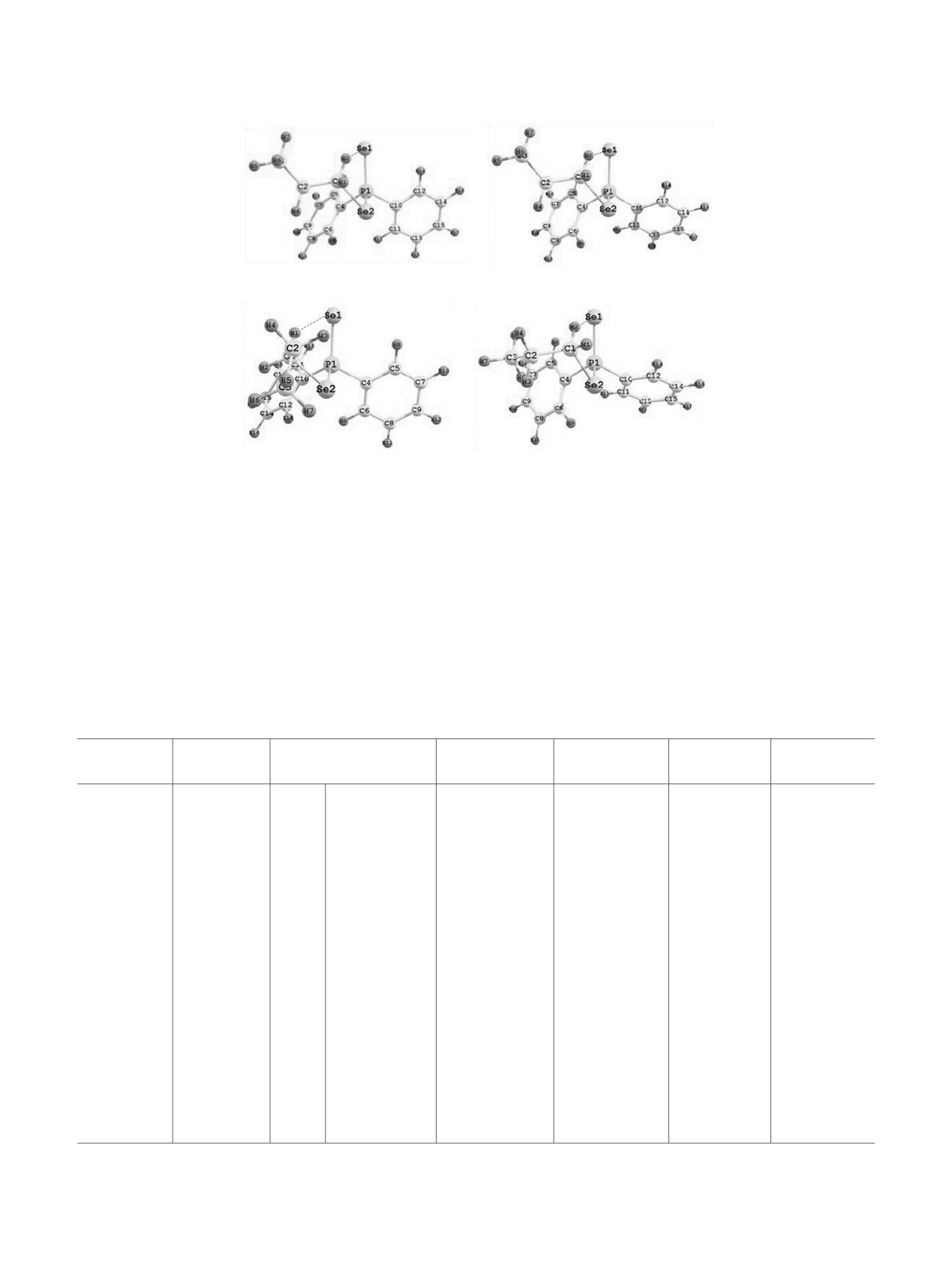
Рис. 2. Структуры конформеров диселенофосфината (а) 2а, (б) 2б, (в) 2в, (г) 2г [B3PW91/6-311++G(df,p)].
конформеров до четырех в соединении 2 (рис. 2,
28°, Se1P1C10C12 37° (2в)]. В конформере 2г замести-
табл. 2). Конформеры 2а и 2б имеют практически
тели при атоме фосфора имеют цис,цис,гош-ориен-
равную энергию, тогда как конформеры 2в и 2г
тацию относительно связи P=Se (двугранные углы
лежат выше по энергии на 3.6 и 4.2 кДж/моль
Se1P1Se2C1
28°, Se1P1C4C5 13°, Se1P1C10C12 67°).
соответственно. В конформерах 2а-в связь Se-Csp3
Образование водородной связи между атомом H1
имеет гош-ориентацию, а фенильные кольца - гош-
пропильной группы и атомом селена группы P=Se
или цис-ориентацию относительно связи P=Se
возможно во всех четырех конформерах
2а-г
[двугранные углы Se1P1Se2C1 35°, Se1P1C4C5 36°,
(табл. 3). Согласно полученным экспериментальным
Se1P1C10C12
29° (2а); Se1P1Se2C1 38°, Se1=P1C4C5
и теоретическим данным (табл. 2), соединение 2
22°, Se1P1C10C12 55° (2б); Se1P1Se2C1 42°, Se1P1C4C5
существует в виде равновесия форм 2а-г.
Таблица 3. ИК спектральные (ν, см-1) и геометрические характеристики (Å) соединений 1-6
Se···H
Se···H
Соединение
νэксп P=Se
Конформер
νгаз. фаза P=Se
νCPCM P=Se
(газовая фаза)
(CPCM)
1
557, 476 [21]
1a
гош,гош,гош
562 о. с, 483 с
550 о. с, 477 с
2.949
3.009
1б
гош,гош,цис
562 о. с, 480 с
550 о. с, 477 с
2.948
3.009
2
553, 475 [32]
2a
гош,гош,цис
560 о. с, 483 с
552 о. с, 472 с
2.857
2.895
2б
гош,цис,гош
561 о. с, 479 с
551 о. с, 475 с
2.862
2.895
2в
гош,цис,гош
558 о. с, 483 с
549 о. с, 481 с
2.834
2.881
2г
цис,цис,гош
563 о. с, 474 с
552 о. с, 472 с
2.755
2.782
3
555, 474 [19]
3a
гош,цис,гош
557 о. с, 482 с
548 о. с, 481 с
2.855
2.884
3б
гош,цис,гош
553 о. с, 483 с
547 о. с, 481 с
2.890
2.940
4
576, 472 [21]
4a
цис,гош,гош
574 сл, 475 о. с
574 сл, 468 о. с
2.661
2.765
4б
цис,гош,гош
575 сл, 475 о. с
573 сл, 469 о. с
2.752
2.852
4в
цис,транс,гош
579 сл, 490 о. с
574 сл, 468 о. с
2.751
2.857
5
577, 472 [21]
5a
цис,гош,гош
574 сл, 474 о. с
573 сл, 467 о. с
2.750
2.759
5б
цис,гош,гош
575 сл, 475 о. с
574 сл, 468 о. с
2.782
2.793
5в
цис,транс,гош
579 сл, 490 о. с
577 сл, 484 о. с
2.752
2.755
6
577, 471 [21]
6a
цис,гош,гош
574 сл, 473 о. с
573 сл, 466 о. с
2.686
2.684
6б
цис,гош,гош
574 сл, 473 о. с
573 сл, 467 о. с
2.830
2.846
6в
цис,транс,гош
578 сл, 487 о. с
577 сл, 481 о. с
2.821
2.827
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ
743
(а)
(б)
Рис. 3. Структуры конформеров диселенофосфината (а) 3а и (б) 3б [B3PW91/6-311++G(df,p)].
(а)
(б)
(в)
Рис. 4. Структуры конформеров диселенофосфината (а) 4а, (б) 4б, (в) 4в [B3PW91/6-311++G(df,p)].
Расчеты
указывают
на
существование
Для соединения 4 найдено три энергетически
соединения
3 в виде двух энергетически
предпочтительных конформера (рис. 4, табл. 2).
предпочтительных конформеров (рис. 3, табл. 2),
Группы P=Se и Se-Csp3 находятся в полностью
отличающихся
взаимным
расположением
заслоненной цис-ориентации (Se1P1Se1C17
0°) в
бензильной группы и связи P-Se: двугранный угол
энергетически наиболее выгодном конформере 4а,
P1Se2C13C14 равен 88° в конформере
3а (гош-
фенилэтильные заместители расположены сим-
ориентация, близкая к транс-конфигурации) и -
метрично относительно связи P=Se (Se1P1C1C4
157° в конформере 3б (транс-ориентация). Одна из
–54°, Se1P1C2C3 54°), при этом фенильные кольца и
фенильных групп цис-ориентирована по отно-
связи P-Csp3 транс-ориентированы по отношению
шению к группе P=Se в обоих конформерах (угол
к
связям
Csp3-Csp3
(двугранные
углы
Se1P1C1C2 равен 25° и 28° в конформере 3а и 3б
P1C1C4C11 178°, P1C2C3C5 -178°). Конформеры 4б и
соответственно), а вторая
- гош-ориентирована
4в обладают более высокой энергией (табл. 2) и
[угол Se1P1C7C8 43° (3а), 35° (3б)]. Связи P=Se и
менее симметричны. Связи P=Se и Se-Csp3 имеют
Se-Csp3 имеют взаимную гош-ориентацию (угол
взаимную цис-ориентацию [Se1P1Se2C17 23° (4б),
Se1P1Se2C13 равен 37° и 44° в конформерах 3а и 3б
24°
(4в)], что благоприятствует P=Se···H-Csp3
соответственно). Расстояние P=Se···H12-C13 равно
взаимодействию (табл. 3). Фенилэтильные группы
2.855 и
2.889 Å в конформерах
3а и
3б
гош,гош-ориентированы по отношению к связи
соответственно (табл. 3), что свидетельствует о
P=Se в конформере 4б (Se1P1C1C4 56°, Se1P1C2C3
возможном внутримолекулярном взаимодействии
51°) и транс,гош-ориентированы в конформере 4в
между атомом селена P=Se группы и атомом
(Se1P1C1C4 178°, Se1P1C2C3 49°). Во фрагментах
водорода CH2-группы.
P-CH2-CH2-Ph связи P-Csp3 и Csp3-Csp2 транс-
(а)
(б)
(в)
Рис. 5. Структуры конформеров диселенофосфината (а) 5а, (б) 5б, (в) 5в [B3PW91/6-311++G(df,p)].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
744
ВЕРЕЩАГИНА и др.
(а)
(б)
(в)
Рис. 6. Структуры конформеров диселенофосфината (а) 6а, (б) 6б, (в) 6в [B3PW91/6-311++G(df,p)].
(а)
(б)
(в)
Рис. 7. Структуры конформеров диселенофосфината (а) 7а, (б) 7б, (в) 7в
[B3PW91/6-311++G(df,p)].
ориентированы по отношению к связям Csp3-Csp3
ориентированы в конформерах 6а и 6б и транс,гош-
[P1C1C4C11 -178° (4б),
-175° (4в); P1C2C3C5 176°
ориентированы в форме 6в [Se1P1C1C4 и Se1P1C2C3
(4б), -178° (4в)].
-54°,
54°
(6а);
55°,
51°
(6б);
178°,
49°
(6в)].
Фенильные кольца находятся в транс- положении
Три предпочтительных конформера 5а-в были
к связи P-Csp3. Во всех конформерах
6а-в
найдены для диселенофосфината 5 (рис. 5, табл. 2).
возможно образование внутримолекулярного
Во всех трех конформерах связи P=Se и Se-CH2 цис-
связывания между атомом селена группы P=Se и
ориентированы [Se1P1Se2C17 5° (5а), 15° (5б), -0.5°
атомом водорода группы CH2 (табл. 3).
(5в)], а связь P-Se и этильные фрагменты
Se-Пропилдифенилдиселенофосфинат
7 был
практически перпендикулярны друг другу
рассчитан в качестве модели (для сравнения с
[двугранные углы P1Se2C17C18 96° (5а), 90° (5б),
соединением
2), для него было найдено три
-97° (5в)]. Фенилэтильные фрагменты и группа
энергетически предпочтительных конформера 7а-
P=Se гош,гош-ориентированы в конформерах 5а и
в (табл. 2, рис. 7). Конформеры 7а и 7б близки по
5б и транс,гош-ориентированы в конформере 5в
энергии, оба имеют симметричные фенилэтильные
[Se1P1C1C4 и Se1P1C2C3 -55°, 54° (5а); 56°, 52° (5б);
фрагменты. Группы P=Se и Se-Csp3 цис-
-180°, 53° (5в)], фенильные кольца имеют транс-
ориентированы по отношению друг к другу
ориентацию относительно связей P-Csp3. В
[двугранные углы Se1P1Se2C17 5° (7а), -5° (7б), 16°
соединении
5 также возможен внутримоле-
(7в)], а связь P1-Se2 либо практически перпен-
кулярный контакт между атомом селена группы
дикулярна плоскости пропильного заместителя
P=Se и атомом водорода при первичном углероде
(двугранные углы P1Se2C17C18 равны 95° и 89° в
этильного заместителя (табл. 3).
конформерах 7а и 7в соответственно), либо транс-
Согласно расчетам, для соединения 6 также
ориентирована по отношению к этой плоскости в
найдено три конформера (рис.
6). Введение
конформере 7б (P1Se2C17C18 -102°). Фенилэтильные
фенилэтильного заместителя к атому селена не
фрагменты и группа P=Se имеют взаимную
меняет положение заместителей при атоме
гош,гош-ориентацию во всех трех конформерах
фосфора: связи P=Se и Se-Csp3 цис-ориентированы
[двугранные углы Se1P1C1C4 и Se1P1C2C3 -55°, 54°
относительно друг друга [Se1P1Se2C17 3° (6а), 29°
(7а); -54°, 55° (7б); 57°, 52° (7в)]. Фенильные
(6б), 29.5° (6в)], связь P-Se и этильные фрагменты
кольца транс-ориентированы по отношению к
практически перпендикулярны друг другу
связям P-Csp3. Во всех конформерах
7а-в
[двугранные углы P1Se2C17C18 110° (6а), 89° (6б),
наблюдается внутримолекулярное взаимодействие
89° (6в)], как и в диселенофосфинатах 4 и
5.
между атомом селена группы P=Se и одним из
Фенилэтильные фрагменты и группа P=Se гош,гош-
водородов CH2-группы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ
745
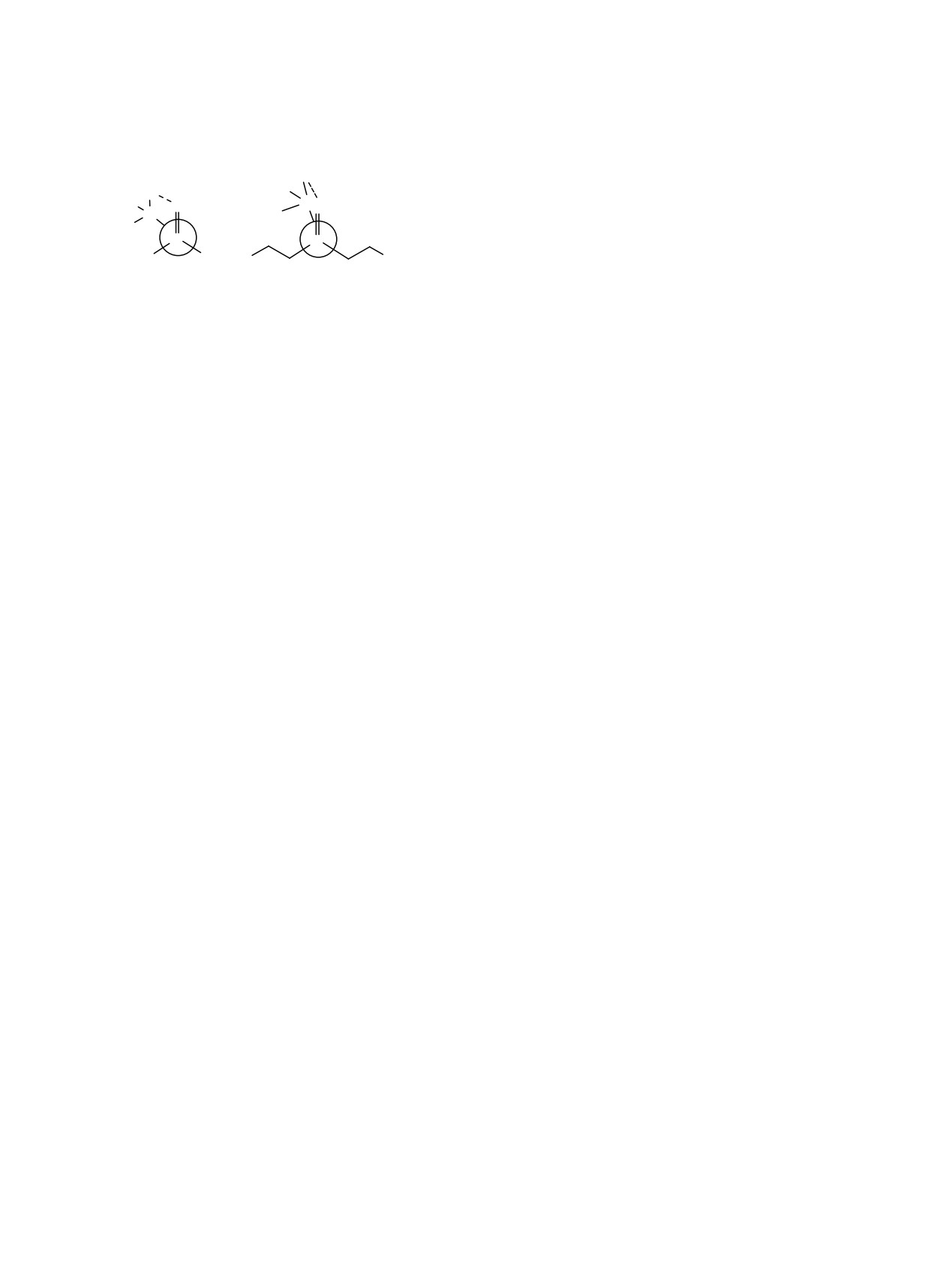
Схема 2.
S-Csp3 тиоэтильного фрагмента благоприятна для
(а)
(б)
образования внутримолекулярного водородного
взаимодействия P=Se···H-Csp3 во всех трех
H
H
возможных конформерах этого соединения.
H
H
C
Se
Se
C
R
Сведения об ИК спектрах соединений со связью
R
P=Se весьма ограничены. По сравнению со связями
P
P
P=O и P=S группа P=Se считается менее
Ph
Ph Ph
Ph
характеристичной [35], валентное колебание связи
Основываясь на сопоставлении теоретических
P=Se дает две полосы: 577-517 (полоса I) и 535-
результатов, вычисленных по аддитивной схеме и
473 см-1 (полоса II)
[35-38]. ИК спектры
экспериментальных дипольных моментов соеди-
диорганодиселенофосфинатов
с
щелочными
нений
1-7, мы полагаем, что в растворе эти
металлами содержат интенсивные полосы при 540-
диселенофосфинаты
существуют
в
виде
570 и
470-490 см-1, которые приписывают
равновесия нескольких конформеров. Анализ
асимметричным (νas) и симметричным (νs)
полученных данных позволяет сделать вывод о
колебаниям групп PSe2 [39].
предпочтительной гош- или цис-ориентации
заместителей R2-Se относительно связи P=Se в
Частоты колебаний связи P=Se в соединениях
соединениях
1-7. На схеме
2
показано
1-6, вычисленные в вакууме и в бензоле с
внутримолекулярное водородное взаимодействие
использованием CPCM модели, находятся в
P=Se···H-Csp3 в предпочтительных конформерах 1-
области 579-554 (полоса I) и 490-473 см-1 (полоса
7 (проекция Ньюмана): (а) - гош-ориентация Se-
II), что хорошо согласуется с экспериментальными
алкильного(бензильного) заместителя относи-
данными (табл.
3).
Следует отметить, что
тельно связи P=Se в соединниях 1-3; (б) - цис-
интенсивность полосы I в несколько раз выше
ориентация Se-алкильного(бензильного) замести-
интенсивности полосы II в соединениях 1-3 с
теля относительно связи P=Se в соединениях 4-7.
фенильными заместителями у атома фосфора в
Согласно
квантово-химическим
расчетам,
отличие от соединений 4-6 с фенилэтильными
заслоненная
цис-ориентация
обусловлена
заместителями, в спектрах которых более
образованием внутримолекулярной водородной
интенсивна низкочастотная полоса II (табл. 3). В
связи между атомом селена группы P=Se и одним
ИК спектре диселенофосфината 1 в хлороформе
из атомов водорода при Csp3-атоме селенал-
частоты валентных колебаний связи P=Se почти
кильного (1, 2, 4, 5, 7) или селенбензильного
эквивалентны в растворе (554 и 476 см-1) и в
фрагмента (3, 6). В конформерах с наименьшим
твердом состоянии (557 и 476 см-1) [21], и хорошо
двугранным углом Se1PSe2C цис-ориентированного
согласуются с вычисленными значениями (табл. 3).
заместителя
(4-6) наблюдаются наименьшие
Согласно данным метода B3PW91/6-311++G
расстояния H···Se (табл.
3), что указывает на
(df,p)+CPCM для возможных конформеров
бóльшую прочность Н-контакта.
диселенофосфинатов 1-6 (табл. 3), теоретические
Сокращенные контакты между одним из атомов
частоты валентных колебаний связи P=Se в них
водорода
цис-ориентированного
фенильного
практически идентичны, что делает эти формы
заместителя у атома фосфора и атомом селена
неразличимыми в симулированных ИК спектрах.
группы P=Se наблюдаются и в других
Вероятно, по этой причине признаки конформа-
конформерах [расстояние H···Se, Å:
2.882
(1б),
ционного равновесия не наблюдаются в
2.987 (2а), 2.885 (2б), 2.981 (2в), 2.856 (2г), 2.960
экспериментальных спектрах соединений 1-6.
(3а), 2.975 (3б)].
Сравнение экспериментальных и теоретических
В соединениях
4-7 с более сложными и
дипольных моментов соединений 1-6 (табл.
2)
разветвленными
заместителями
гош-формы
показало, что теоретические значения ниже на 1-
исключены из конформационного равновесия, и
2 Д, а вычисленные по аддитивной схеме диполь-
предпочтительной является цис-ориентация замес-
ные моменты находятся в относительно хорошем
тителя R-Se относительно связи P=Se (табл. 3).
согласии с экспериментальными значениями. Для
Ранее подобный факт был установлен для S-
объяснения этого факта и общего сопоставления
этильного эфира дифенетилфосфиноселенотиоата
величин полярностей был проведен теоретический
[31]: заслоненная цис-ориентация связей P=Se и
конформационный анализ соединений
1-7 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
746
ВЕРЕЩАГИНА и др.
использованием моделей IPCM [40] и CPCM [41] и
тительны заторможенные гош- или транс-кон-
бензола в качестве растворителя. Значения,
формации, независимо от природы гетероатома,
рассчитанные с использованием CPCM модели,
связанного с фосфором, количества осей
более точны, так как в этой модели
внутреннего вращения в молекуле и природы
оптимизируется геометрия молекулы с учетом
заместителей у атома фосфора, что также
эффекта растворителя, тогда как в рамках IPCM
справедливо для классических органических
модели рассчитываются только энергии. В то же
соединений [42]. В растворе и в газовой фазе
время, как следует из табл. 2, даже применение
равновесие между энергетически предпочтитель-
IPCM модели обеспечивает лучшее согласие
ными и наименее стерически затрудненными
между значениями экспериментальных и теорети-
заторможенными ротамерами часто наблюдается
ческих дипольных моментов с минимальным
для
соединений
четырехкоординированного
увеличением времени вычислений по сравнению с
фосфора с двумя и более осями внутреннего
расчетами в газовой фазе. Наилучшее согласие
вращения (особенно, если эти оси принадлежат
между экспериментальными, вычисленными по
разным атомам) [29, 31, 42]. Исключение из этого
векторно-аддитивной схеме и теоретическими
правила, а именно возникновение заслоненных цис-
значениями для диселенофосфинатов 1-6 (табл. 2)
конформаций, обусловлено дополнительными
достигается при использовании модели CPCM. Для
внутримолекулярными взаимодействиями, например,
соединений 1 и 2 наблюдается идеальное согласие
наличием водородной связи [31, 42].
между дипольными моментами. Эксперимен-
тальные значения несколько выше теоретических
Результаты данного исследования могут быть
для соединений
3-6, причем наибольшее
полезны для развития конформационного анализа
отклонение наблюдается для бензилзамещенных
и синтеза фосфорорганических соединений,
производных 3 и 6. Теоретические (модель CPCM)
содержащих связи фосфор-халькоген, например,
и вычисленные дипольные моменты хорошо
полифункциональных производных диселенофос-
согласуются для соединения 7. Таким образом,
финовых кислот, обладающих потенциальными
модель CPCM является наилучшим выбором для
координационными и биологическими свойствами,
расчета теоретической полярности в случае
а также для объяснения и прогнозирования
диорганодиселенофосфинатов 1-7.
реакционной способности таких соединений.
Относительные энергии конформеров
1-7,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
рассчитанные в газовой фазе и в растворе бензола
(B3PW91/6-311++G(df,p)+CPCM приближение),
Se-Метилдифенилдиселенофосфинат 1, Se-метил-
отличаются не более чем на 3.9 кДж/моль, поэтому
бис(2-фенилэтил)диселенофосфинат 4, Se-этилбис-
можно сделать вывод, что вклад эффектов
(2-фенилэтил)диселенофосфинат 5, Se-бензилбис(2-
сольватации менее важен для оценки термо-
фенилэтил)диселенофосфинат
6 были синтези-
динамических характеристик стабильных конфор-
рованы по методике
[21], Se-пропилдифенил-
маций диселенофосфинатов
1-7, особенно в
диселенофосфинат 2 и Se-бензилдифенилдиселено-
растворителях с низкой полярностью.
фосфинат
3 получены согласно работе
[32].
Таким образом, можно заключить, что в
Растворители очищали по стандартным методикам.
растворе исследованные диселенофосфинаты су-
ИК спектры регистрировали на приборе Bruker
ществуют в виде равновесной смеси конформеров
Vertex 70.
с заторможенной гош- и транс- или заслоненной
цис-ориентацией фенилакильных, Se-алкильных и
Экспериментальные
значения
дипольных
Se-бензильных радикалов относительно связи
моментов были определены по второму методу
P=Se. В этих конформерах возможно образование
Дебая
[33]. Физические свойства диселенофос-
внутримолекулярных водородных связей между
финатов измеряли для серий из 4-6 растворов в
атомом водорода Se-алкильных(бензильных) или
бензоле и 1,4-диоксане при 25°С. Диэлектрическую
фенильных заместителей у атома фосфора и
проницаемость определяли на приборе BI-870
атомом селена группы P=Se. Такой вывод
(Brookhaven Instruments Corporation), точность
согласуется
с
результатами
предыдущих
определения
±0.01. Показатели преломления
исследований соединений четырехкоординирован-
растворов определяли на рефрактометре RA-500
ного фосфора: в большинстве случаев предпоч-
(Kyoto Electronics), точность измерений ±0.0001.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ
747
Экспериментальный дипольный момент рассчи-
ФОНДОВАЯ ПОДДЕРЖКА
тывали по формуле (1) [33].
Работа выполнена при финансовой поддержке
(1)
Российского фона фундаментальных исследований
μ = 0.01283√P
orT.
(проект № 16-03-00100 а) и частично за счет
Ориентационные поляризации определяли по
средств субсидии, выделенной в рамках
формуле Гуггенгейма-Смита (2) [43, 44].
государственной
поддержки
Казанского
федерального университета в целях повышения его
M
3α
3γ
Por =
-
,
(2)
конкурентоспособности среди ведущих мировых
d
(ε0 + 2)2
(n2+ 2)2
научно-образовательных центров.
КОНФЛИКТ ИНТЕРЕСОВ
где М
- молекулярная масса вещества, d
-
плотность растворителя, a и g - тангенсы углов
Авторы заявляют об отсутствии конфликта
и
наклона прямых на графиках εi-wi и ni2-wi; εi, ni
интересов.
wi - диэлектрическая проницаемость, показатель
преломления и весовая доля растворенного
СПИСОК ЛИТЕРАТУРЫ
вещества i-раствора соответственно. Коэффи-
1. Lobana T.S., Wang J.C., Liu C.W. // Coord. Chem. Rev.
циенты α и γ вычисляли по формулам: α = (εi - ε0)/
2007. Vol.
251. N
1-2. P.
91. doi
10.1016/
ωi и γ = (ni2 - n02)/ωi, где ε0 и n0 диэлектрическая
j.ccr.2006.05.010
проницаемость и показатель преломления
2. Nguyen C.Q., Adeogun A., Afzaal M., Malik M.A.,
растворителя соответственно.
O’Brien P. // Chem. Commun. 2006. N 20. P. 2182.
При вычислении моментов по векторно-адди-
doi 10.1039/b603198f
тивной схеме были использованы геометрические
3. Артемьев А.В., Малышева С.Ф., Гусарова Н.К.,
Трофимов Б.А. // ЖОХ. 2011. Т. 81. № 7. С. 1100;
параметры из данных теоретических расчетов, а
Artem’ev A.V., Malysheva S.F., Gusarova N.K.,
также следующие моменты связей и групп:
Trofimov B.A. // Russ. J. Gen. Chem. 2011. Vol. 81.
m(P=Se) = 4.00 Д, вычислен из µэксп Et3P=Se [34]; m
N 7. P. 1449. doi 10.1134/S1070363211070085
(Csp3→Р) = 0.94 Д, вычислен из µэксп Et2POEt [34];
4. Nguyen C.Q., Afzaal M., Malik M.A., Helliwell M.,
m(CPh→Р) = 1.09 Д, вычислен из µэксп Ph3P [45]; m
Raftery J., O’Brien P. // J. Organomet. Chem. 2007.
(Csp3→Csp2) = 0.75 Д, вычислен из µэксп C6H5CН3
Vol.
692.
N
13.
P.
2669.
doi
10.1016/
[33]; m(Se→P) = 1.24 Д, вычислен из µэксп 2-оксида
j.jorganchem.2006.11.043
4-метил-2-(метилселанил)-1,3,2-диоксафосфинана
5. Kawai T., Hasegawa Y., Adachi T. Pat. WO
[34]; m(Csp3→Se) = 0.95 Д, вычислен из µэксп Et2Se
2007/102271 (2007). US // C. A. 2007. Vol.
147.
3) = 0.28 Д [46].
[33]; m(H→Csp
P. 368034.
6. Panneerselvam A., Nguyen C.Q., Waters J., Malik M.A.,
Квантово-химические расчеты проводили
O’Brien P., Raftery J., Helliwell M. // Dalton Trans.
методом функционала плотности (DFT) с исполь-
2008. N 33. P. 4499. doi 10.1039/B802012D
зованием гибридного функционала B3PW91
7. Hasegawa Y., Adachi T., Tanaka A., Afzaal M., O’Brien P.,
[47, 48] и расширенного базиса 6-311++G(df, p)
Doi T., Hinatsu Y., Fujita K., Tanaka K., Kawai T. // J.
[49] с помощью программы GAUSSIAN 09 [50] с
Am. Chem. Soc. 2008. Vol. 130. N 17. P. 5710. doi
полной оптимизацией геометрии. Соответствие
10.1021/ja710165m
найденных стационарных точек минимумам
8. Maneeprakorn W., Nguyen C.Q., Malik M.A., O’Brien P.,
энергии
подтверждено
расчетом
вторых
Raftery J. // Dalton Trans. 2009. N 12. P. 2103. doi
производных энергии по координатам атомов; при
10.1039/b816903a
этом все равновесные структуры, соответство-
9. Panneerselvam A., Nguyen C.Q., Malik M.A., O’Brien P.,
вавшие точкам минимума на поверхностях потен-
Raftery J. // J. Mater. Chem. 2009. Vol. 19. N 3. P. 419.
циальной энергии, имели лишь положительные
doi 10.1039/B812074A
значения частот. Влияние растворителя (бензола)
10. Tanaka C.Q., Adachi T., Hasegawa Y., Kawai T. // J.
учитывали в рамках модели IPCM [40] и CPCM
Alloys Compd. 2009. Vol. 488. N 2. P. 538. doi
[41]. Все расчеты выполнены в Казанском
10.1016/j.jallcom.2008.11.126
отделении Межведомственного суперкомпью-
11. Maneeprakorn W., Malik M.A., O’Brien P. // J. Mater.
терного центра РАН и Казанском федеральном
Chem. 2010. Vol. 20. N 12. P. 2329. doi 10.1039/
университете.
B922804G
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
748
ВЕРЕЩАГИНА и др.
12. Cossairt B.M., Owen J.S. // Chem. Mater. 2011. Vol. 23.
Phosphorus, Sulfur, Silicon, Relat. Elem. 2013. Vol. 188.
N 12. P. 3114. doi 10.1021/cm2008686
N 1-3. P. 95. doi 10.1080/10426507.2012.743132
13. Rickelton W.A., Boyl R. // J. Sep. Sci. Tech. 1988. Vol. 23.
29. Малышева С.Ф., Белогорлова Н.А., Верещагина Я.А.,
N 12-13. P. 1227. doi 10.1080/01496398808075627
Алимова А.З., Ишмаева Э.А., Чачков Д.В. // ЖОХ.
2016. Т. 86. N 3. С. 448; Malysheva S.F., Belogorlova N.A.,
14. Flett D.S. // J. Organomet. Chem. 2005. Vol. 690. N 10.
Vereshchagina Y.A., Alimova A.Z., Ishmaeva E.A.,
P. 2426. doi 10.1016/j.jorganchem.2004.11.037
Chachkov D.V. // Russ. J. Gen. Chem. 2016. Vol. 86.
15. Машковский М.. Лекарственные средства. М.:
N 3. P. 590. doi 10.1134/S1070363216030154
Медицина, 1998. Т. 2. 1206 с.
30. Vereshchagina Ya.А., Chachkov D.V., Alimova A.Z.,
16. Kimura T., Murai T. // J. Org. Chem. 2005. Vol. 70.
Malysheva S.F., Gusarova N.K., Ishmaeva E.A.,
N 3. P. 952. doi 10.1021/jo0484979
Trofimov B.A. // J. Mol. Struct. 2014. Vol. 1076. P. 285.
17. Kimura T., Murai T., Mizuhata N. // Heteroatom. Chem.
doi 10.1016/j.molstruc.2014.07.081
2005. Vol. 16. N 3. P. 185. doi 10.1002/hc.20091
31. Vereshchagina Y.A., Khanafieva R.R., Chachkov D.V.,
18. Moon J., Nam H., Kim S., Ryu J., Han C., Lee C.,
Ishmaeva E.A., Malysheva S.F., Gusarova N.K.,
Lee S. // Tetrahedron Lett. 2008. Vol. 49. N 35. P. 5137.
Trofimov B.A. // Pure Appl. Chem. 2017. Vol. 89. N 3.
doi 10.1016/j.tetlet.2008.06.098
P. 393. doi 10.1515/pac-2016-0802
19. Song E., Jo Y., Bae G., Oh I.-K., Jung H.M., Lee S. //
32. Верещагина Я.А., Ханафиева Р.Р., Малышева С.Ф.,
Bull. Korean Chem. Soc. 2009. Vol. 30. N 9. P. 2129.
Ишмаева Э.А. // ЖОХ. 2017. Т. 87. № 9. С. 1567;
doi 10.5012/bkcs.2009.30.9.2129
Vereshchagina Ya.A., Khanafieva R.R., Malysheva S.F.,
20. Artem’ev A.V., Malysheva S.F., Gusarova N.K.,
Ishmaeva E.A. // Russ. J. Gen. Chem. 2017. Vol. 87.
Belogorlova N.A., Trofimov B.A. // Synthesis.
2010.
N 9. P. 2122. doi 10.1134/S1070363217090365
N 11. P. 1777. doi 10.1055/s-0029-1218729
33. Осипов О.А., Минкин В.И., Гарновский А. Справоч-
21. Artem’ev A.V., Chernysheva N.A., Gusarova N.K.,
ник по дипольным моментам. М.: ВШ, 1971. 414 с.
Malysheva S.F., Yas’ko S.V., Albanov A.I., Trofimov B.A. //
34. Ишмаева Э.А., Тимошева А.П., Тимошева Н.В.,
Synthesis. 2011. N 8. P. 1309. doi 10.1055/s-0030-
Верещагина Я.А. Справочник по дипольным
1258471
моментам фосфорорганических соединений. Казань:
Изд. Казанск. унив., 1998. 120 с.
22. Gusarova N.K., Volkov P.A., Ivanova N.I., Gatilov Yu.V.,
Trofimov B.A. // Tetrahedron Lett. 2013. Vol. 54. N 27.
35. Шагидуллин Р.Р., Липатова И.П. // Изв. АН СССР.
P. 3543. doi 10.1016/j.tetlet.2013.04.117
Сер. хим. 1971. N 5. С. 1024; Shagidullin R.R.,
Lipatova I.P. // Russ. Chem. Bull. 1971. Vol. 20. N 5.
23. Gusarova N.K., Artem’ev A.V., Malysheva S.F.,
P. 940. doi 10.1007/BF00862199
Tarasova O.A., Trofimov B.A. // Tetrahedron Lett. 2011.
Vol. 52. N 51. P. 6985. doi 10.1016/j.tetlet.2011.10.094
36. Bellamy L.J. The infrared spectra of complex molecules.
London: Chapman and Hall, 1980. Vol. 2. 299 p.
24. Gusarova N.K., Chernysheva N.A., Trofimov B.A. //
37. Chittenden R.A., Thomas L.C. // Spectrochim. Acta.
Synthesis. 2017. Vol. 49. N 21. P. 4783. doi 10.1055/s-
1964. Vol. 20. N 11. P. 1679. doi 10.1016/0371-1951
0036-1588542
(64)80173-9
25. Верещагина Я.А., Климовицкий А.Е., Ишмаева Э.А.,
38. Hua G., Woollins J.D. // Polyhedron. 2012. Vol. 42.
Алимова А.З., Малышева С.Ф. // ЖОрХ. 2012. Т. 48.
N 1. P. 190. doi 10.1016/j.poly.2012.05.010
№ 7. С. 1005; Vereshchagina Ya.A., Klimovitskii A.E.,
Ishmaeva E.A., Alimova A.Z., Malysheva S.F. // Russ. J.
39. Trofimov B.A., Artem’ev A.V., Malysheva S.F.,
Org. Chem. 2012. Vol. 48. N 7. P. 1003. doi 10.1134/
Gusarova N.K. // J. Organomet. Chem. 2009. Vol. 694.
S1070428012070184
N 25. P. 4116. doi 10.1016/j.jorganchem.2009.03.010
26. Верещагина Я.А., Чачков Д.В., Алимова А.З.,
40. Foresman J.B., Keith T.A., Wiberg K.B., Snoonian J.,
Ишмаева Э.А., Малышева С.Ф. // ЖОрХ. 2012. Т. 48.
Frisch M.J. // J. Phys. Chem. 1996. Vol. 100. N 40.
№ 10. С. 1324; Vereshchagina Ya.A., Chachkov D.V.,
P. 16098. doi 10.1021/jp960488j
Alimova, A.Z., Ishmaeva E.A., Malysheva S.F. // Russ. J.
41. Cossi M., Rega N., Scalmani G., Barone V. // J. Comp.
Org. Chem. 2012. Vol. 48. N 10. P. 1320. doi 10.1134/
Chem. 2003. Vol. 24. P. 669. doi 10.1002/jcc.10189
S1070428012100090
42. Верещагина Я.А., Ишмаева Э.А., Зверев В.В. // Усп.
27. Верещагина Я.А., Алимова А.З., Чачков Д.В.,
хим. 2005. Т. 74. № 4. С. 323; Vereshchagina Y.A.,
Малышева С.Ф., Ишмаева Э.А. // ЖOрX. 2013. Т. 49.
Ishmaeva E.A., Zverev V.V. // Russ. Chem. Rev. 2005.
№ 11. С. 1725; Vereshchagina Ya.A., Alimova A.Z.,
Vol.
74.
N
4.
P.
297.
doi
10.1070/
Chachkov D.V., Malysheva S.F., Ishmaeva E.A. // Russ.
RC2005v074n04ABEH000890
J. Org. Chem. 2013. Vol. 49. N 11. P. 1709. doi
43. Guggenheim E.A. // Trans. Faraday Soc. 1949. Vol. 45.
10.1134/S1070428013110262
P. 714. doi 10.1039/TF9494500714
28. Vereshchagina Ya.A., Ishmaeva E.A., Chachkov D.V.,
44. Smith J.W. // Trans. Faraday Soc. 1950. Vol. 46. P. 394.
Gusarova N.K., Malysheva S.F., Alimova A.Z.
//
doi 10.1039/TF9504600394
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ПОЛЯРНОСТЬ И СТРУКТУРА Se-ЭФИРОВ ДИСЕЛЕНОФОСФИНОВЫХ КИСЛОТ
749
45. Ишмаева Э.А., Зимин М.Г., Галеева Р.М., Пудовик А.Н. //
Iyengar S.S., Tomasi J., Barone V., Mennucci B., Cossi M.,
Изв. АН СССР. Сер. хим. 1971. N 3. С. 538; Ishmaeva E.A.,
Scalmani G., Rega N., Petersson G.A., Nakatsuji H.,
Zimin M.G., Galeeva R.M., Pudovik A.N. // Russ. Chem.
Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J.,
Bull. 1971. Vol. 20. N 3. P. 473. doi org/10.1007/
Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H.,
BF00852033
Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B.,
46. Грибов Л.А., Попов Е.М. // Докл. АН СССР. 1962.
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
Т. 145. № 4. С. 761.
Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochter-
47. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7.
ski J.W., Ayala P.Y., Morokuma K., Voth G.A., Salvador P.,
P. 5648. doi 10.1063/1.464913
Dannenberg J.J., Zakrzewski V.G., Dapprich S., Da-
48. Perdew J.P., Burke K., Wang Y. // Phys. Rev. (B). 1996.
niels A.D., Strain M.C., Farkas O., Malick D.K., Ra-
Vol.
54.
N
23.
P.
16533.
doi
10.1103/
buck A.D., Raghavachari K., Foresman J.B., Ortiz J.V.,
PhysRevB.54.16533
Cui Q., Baboul A.G., Clifford S., Cioslowski J., Stefa-
49. McLean A.D., Chandler G.S. // J. Chem. Phys. 1980.
nov B.B., Liu G., Liashenko A., Piskorz P., Komaromi I.,
Vol. 72. N 10. P. 5639. doi 10.1063/1.438980
Martin R.L., Fox D.J., Keith T., Al-Laham M.A.,
50. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Peng C.Y., Nanayakkara A., Challacombe M., Gill P.M.W.,
Robb M.A., Cheeseman J.R., Montgomery, Jr. J.A.,
Johnson B., Chen W., Wong M.W., Gonzalez C.,
Vreven T., Kudin K.N., Burant J.C., Millam J.M.,
Pople J.A. Pittsburgh PA: Gaussian Inc. 2009.
Polarity and Structure of Se-Esters of Diselenopsphinic Acids:
Experimental and Theoretical Conformational Analysis
in a Solution
Ya. A. Vereshchaginaa, *, R. R. Ismagilovaa, D. V. Chachkova,b,
S. F. Malyshevac, and N. A. Belogorlovac
a Kazan (Volga Region) Federal University, ul. Kremlyovskaya 18, Kazan, 420008 Russia
*e-mail: yavereshchagina@gmail.com
b Kazan Department of the Joint Supercomputer Center of the Russian Academy of Sciences,
Federal State Institution “Scientific Research Institute for System Analysis of the Russian Academy of Sciences”, Kazan, Russia
c A.E. Favorskii Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk, Russia
Received December 13, 2018; revised December 13, 2018; accepted December 23, 2018
A conformational analysis of diselenophosphinic acid Se-esters was performed and their polarities were
determined by the methods of dipole moments and quantum chemistry (DFT [B3PW91/6-311++G(df,p)]+CPCM).
In a solution, the studied compounds exist as of an equilibrium of several conformers with staggered gauche and
trans- or eclipsed cis-orientation of the substituents relative to the P=Se bond. The presence of eclipsed cis-
conformations is explained by the formation of intramolecular H···Se bonds with the participation of the
hydrogen atom of the Se-alkyl(benzyl) or phenyl substituents at the phosphorus atom and the selenium atom of
the P=Se group.
Keywords: dipole moments, conformational analysis, diselenophosphinates, DFT calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019