ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 766-778
УДК 541.49:546.(562+732):548.736:547.574
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ
АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
МЕДИ И КОБАЛЬТА С ЗАМЕЩЕННЫМИ
2-(2-ГИДРОКСИБЕНЗИЛИДЕН)-N-(ПРОП-2-ЕН-1-ИЛ)-
ГИДРАЗИНКАРБОТИОАМИДАМИ
© 2019 г. А. П. Гуляa, В. О. Граурa, Ю. М. Чумаковb,c, П. А. Петренкоb, Г. Г. Бэланd,
О. С. Бурдунюкd,e, В. И. Цапковa, *, В. Ф. Рудикf
a Молдавский государственный университет, ул. Матеевича 60, Кишинев, Молдова
*e-mail: vtsapkov@gmail.com
b Институт прикладной физики, Кишинев, Молдова
c Технический университет г. Гебзе, Гебзе, Турция
d Государственный университет медицины и фармации имени Н. Тестемицану, Кишинев, Молдова
e Национальное агентство общественного здоровья, Кишинев, Молдова
f Институт микробиологии и биотехнологии Академии наук Республики Молдова, Кишинев, Молдова
Поступило в Редакцию 29 ноября 2018 г.
После доработки 29 ноября 2018 г.
Принято к печати 22 февраля 2018 г.
Взаимодействием N-(проп-2-ен-1-ил)гидразинкарботиоамида с замещенными 2-гидроксибензальдегидами
получены соответствующие азометины, которые были использованы для синтеза координационных
соединений меди и кобальта составов Cu(НL1-6)Х·nH2O (X = Cl-, NO–; n = 0-3), Сo(НL2)2NO3 и Сo(НL6)2Сl.
Строение полученных соединений установлено методами спектроскопии ЯМР и рентгеноструктурного
анализа. Изучена противомикробная и противогрибковая активность синтезированных комплексов в
отношении серии стандартных штаммов золотистого стафилококка, кишечных палочек и
дрожжеподобных грибов, а также ингибирующее действие исходных тиоамидов и комплексов с
биометаллами в отношении раковых клеток HL-60 миелоидной лейкемии человека.
Ключевые слова: координационные соединения, 2-гидроксибензальдегид, аллилтиосемикарбазоны,
противомикробная и противораковая активность
DOI: 10.1134/S0044460X19050159
2-(2-Гидроксибензилиден)-N-(проп-2-ен-1-ил)-
бром-2-гидроксибензилиден)- (H2L1), 2-(3,5-дибром-
гидразинкарботиоамид обладает широким набором
2-гидроксибензилиден)- (H2L2), 2-(2,3-дигидрокси-
донорных атомов и образует с переходными
бензилиден)- (H2L3),
2-(2,4-дигидроксибензил-
металлами разнообразные по составу и строению
иден)- (H2L4), 2-(2-гидрокси-3-нитробензилиден)-
координационные соединения [1-6], проявляющие
(H2L5) и
2-(2-гидрокси-3-метоксибензилиден)-
селективную противораковую активность [7, 8].
(H2L6)-N-(проп-2-ен-1-ил)гидразинкарботиоамидами
Установлено, что биологическая активность таких
(схема
1), установление их состава, строения,
веществ хорошо согласуется с их строением. В
физико-химических и биологических свойств.
связи с этим синтез и исследование новых коор-
Тиоамиды H2L1-6 получали конденсацией N-(проп-
динационных соединений металлов с производ-
2-ен-1-ил)гидразинкарботиоамида (4-аллилтиосеми-
ными этого гидразинкарботиоамида представляет
карбазида) с замещенными
2-гидроксибензаль-
как научный, так и практический интерес.
дегидами в эквимолярном соотношении в этаноле.
Целью данной работы явился синтез коорди-
Выходы, температуры плавления и данные
национных соединений меди и кобальта с 2-(5-
элементного анализа замещенных 2-(2-гидрокси-
766
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
767
Схема 1.
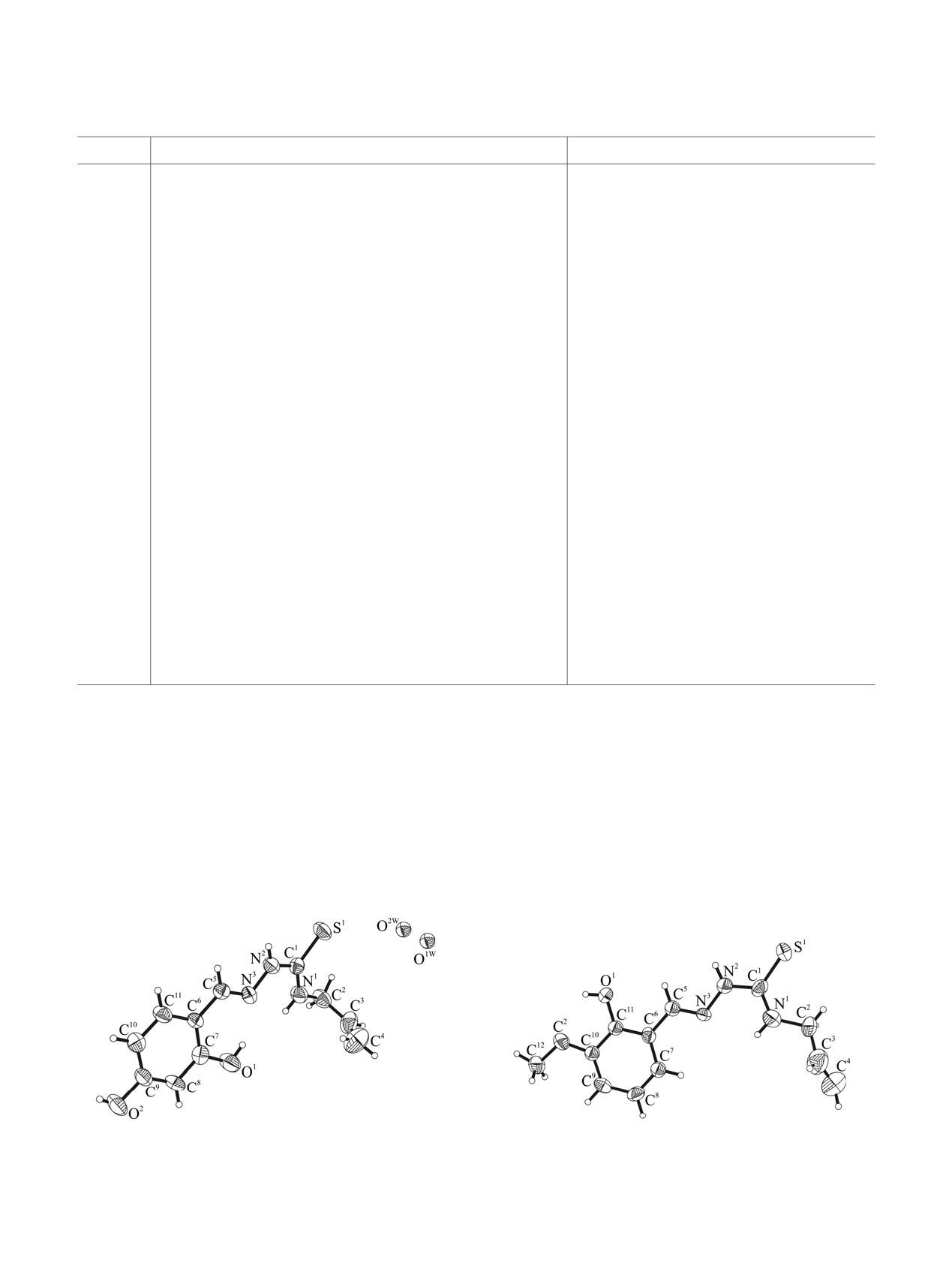
мальные отклонения от определяемых ими
плоскостей составляют
0.053,
0.07 и
0.062 Å
R1
OH
соответственно. При
этом в целом все
N NH
исследованные молекулы H2L4-6 не являются
R2
NH
плоскими. Так, среднеквадратичные плоскости
S
фенильных циклов С6-С11 ориентированы
R3
относительно фрагментов A под углами 17.3, 11.2
H2L1-6
и 10.7°, а торсионные углы N1С1C2С3 и С1C2С3С4
L2);
R1 = R2 =H, R3 = Br (H2L1); R1 = R3 = Br, R2 = H (H2
принимают значения 92.2, -134.7°, 109.6, 2.9° и
L4);
R1 = OH, R2 = R3 = H (H2L3); R1 = R3 = H, R2 = OH (H2
142.1, 128.8° соответственно. В тиоамиде H2L6 оба
R1 = NO2, R2 = R3 = H (H2L5); R1 = OCH3, R2 = R3 =
расстояния S1-C1 и N1-C1 сокращены по
H (H2L6).
сравнению с таковыми в тиоамидах H2L4 и H2L5 на
0.021, 0.026 Å и 0.024, 0.035 Å (табл. 4).
бензилиден)-N-(проп-2-ен-1-ил)гидразинкарботио-
В кристалле тиоамида H2L4 за счет двойной
амидов H2L1-6 приведены в табл.
1; данные
винтовой оси молекулы объединяются водород-
спектроскопии ЯМР представлены в табл. 2. При
ными связями O1-H···S1 и C2-H···O1 в цепочки
перекристаллизации гидразинкарботиоамидов H2L1-6
вдоль оси b (рис. 3, табл. 5). В свою очередь,
из этанола удалось получить монокристаллы
благодаря центру симметрии, цепочки связаны
соединений H2L4-6, структура которых была
между собой водородными связями N2-Н···S1. В
установлена методом рентгеноструктурного
кристаллах тиоамидов H2L5 и H2L6 молекулы
анализа (табл. 3).
объединяются в центросимметричные димеры
На рис. 1, 2 приведены общий вид фрагментов
водородными связями N2-Н···S1, N2-Н···O1 и
кристаллических структур гидразинкарботио-
O1-Н···S1 (рис. 4, 5, табл. 5). Между димерами в
амидов H2L4-6 и нумерация атомов в них. Во всех
данных соединениях осуществляется в основном
исследованных соединениях, в отличие от других
ван-дер-ваальсово взаимодействие. При этом,
описанных
ранее
тиосемикарбазидов
и
согласно критерию, предложенному в работе [16]
тиосемикарбазонов [12-15], заместители, располо-
(CgI···CgJ < 6.0 Å, β < 60.0°, где β - угол между
женные относительно связей N1-C1 находятся в Z-
вектором CgICgJ и нормалью к ароматическому
положении. Однако заместители, расположенные
циклу CgI), в кристаллах тиоамидов H2L4-6
относительно азометиновых связей N3-C5,
наблюдается также π-π-стекинг взаимодействие
находятся в Е-положении, что находится в
между фенильными циклами (С6-С11), которые в
согласии с уже цитированными литературными
лигандах H2L4 и H2L5 связанны между собой
данными. Фрагменты A (S1N1N2N3С1C5) в
центром инверсии, а в азометине H2L6 - двойной
тиоамидах H2L4-6 практически плоские, макси-
винтовой осью. Расстояния между центроидами
Таблица 1. Некоторые характеристики замещенных 2-(2-гидроксибензилиден)-N-(проп-2-ен-1-ил)-гидразинкарбо-
тиоамидов H2L1-6 а
Найдено, %
Вычислено, %
Тиоамид
Выход, %
Т. пл., °С
Формула
С
H
N
С
H
N
H2L1
87
172-174
41.82
3.73
13.21
C11H12BrN3OS
42.05
3.85
13.37
H2L2
90
210-212
33.72
2.65
10.93
C11H11Br2N3OS
33.61
2.82
10.69
H2L3
75
198-200
52.76
5.35
16.44
C11H13N3O2S
52.57
5.21
16.72
H2L4
78
186-188
52.36
5.18
16.56
C11H13N3O2S
52.57
5.21
16.72
H2L5
85
151-153
47.00
4.02
20.24
C11H12N4O3S
47.13
4.32
19.99
H2L6
92
225-227
54.14
5.54
15.77
C12H15N3O2S
54.32
5.70
15.84
а Некоторые характеристики тиоамидов H2L1, H2L4 и H2L6 приведены в работах [9-11].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
768
ГУЛЯ и др.
Таблица 2. Данные спектроскопии ЯМР для тиоамидов H2L1-6 а
Тиоамид
δH, м. д. (ацетон-d6)
δС, м. д. (ацетон-d6)
H2L1
10.56 уш. с ( 1H, OH), 9.41 уш. с (1H, NH), 8.47 уш. с (1H,
177.42 (C=S), 155.74, 133.52, 129.87, 122.24,
NH), 8.45 с (1H, CH=N), 7.90 д (1H, CH, Ar, J = 2.5 Гц), 7.38
118.30, 111.44 (Ar), 139.48 (CH=N), 134.73
м (1H, CH, Ar), 6.91 д (1H, CH, Ar, J = 8.8 Гц), 5.97 м (1H,
(CH, Allyl), 115.24 (CH2=), 46.37 (CH2N)
CH, Allyl), 5.15 м (2H, CH2=C), 4.35 м (2H, CH2N)
H2L2
10.71 уш. с (1H, OH), 9.88 уш. с (1H, NH), 8.45 уш. с (1H,
177.43 (C=S), 152.49, 135.66, 131.14, 122.35,
NH), 8.40 с (1H, CH=N), 7.77 д (1H, CH, Ar, J = 2.4 Гц), 7.73
111.49, 111.35 (Ar), 141.38 (CH=N), 134.51
д (1H, CH, Ar, J = 2.4 Гц), 5.98 м (1H, CH, Allyl), 5.16 м (2H,
(CH, Allyl), 115.41 (CH2=), 46.58 (CH2N)
CH2=C), 4.37 м (2H, CH2N)
H2L3
10.48 уш. с (1H, OH), 8.73 уш. с (1H, OH), 8.47 с (1H, CH=N),
178.32 (C=S), 145.31, 145.06, 142.92, 119.66,
8.27 уш. с (2H, NH), 7.15 д (1H, CH, Ar, J = 7.9 Гц), 6.91 д
119.61, 116.79 (Ar), 142.96 (CH=N), 134.75
(1H, CH, Ar, J = 7.9 Гц), 6.76 т (1H, CH, Ar, J = 7.9 Гц), 5.99
(CH, Allyl), 115.26 (CH2=), 46.40 (CH2N)
м (1H, CH, Allyl), 5.17 м (2H, CH2=C), 4.36 м (2H, CH2N)
H2L4
10.29 уш. с (1H, OH), 9.44 уш. с (1H, OH), 8.92 уш. с (1H,
177.85 (C=S), 160.84, 158.84, 131.50, 111.22,
NH), 8.35 c (1H, CH=N), 8.11 уш. с (1H, NH), 7.38 д (1H, CH,
108.10, 102.71 (Ar), 145.01 (CH=N), 134.86
Ar, J = 8.5 Гц), 6.45 д (1H, CH, Ar, J = 8.5 Гц), 6.41 с (1H,
(CH, Allyl), 115.15 (CH2=), 46.41 (CH2N)
CH, Ar), 5.98 м (1H, CH, Allyl), 5.15 м (2H, CH2=C), 4.35 м
(2H, CH2N)
H2L5
10.80 уш. с (1H, OH), 10.69 уш. с (1H, NH), 8.52 уш. с (1H,
178.56 (C=S), 161.61, 135.83, 133.55, 126.21,
NH), 8.58 с (1H, CH=N), 8.37 м, 8.16 м, 7.13 м (3H, CH, Ar),
119.85, 116.74 (Ar), 152.76 (CH=N), 134.63
5.98 м (1H, CH, Allyl), 5.16 м (2H, CH2=C), 4.36 м (2H,
(CH, Allyl), 115.33 (CH2=), 46.31 (CH2N)
CH2N)
H2L6 б
11.52 уш. с (1H, OH), 9.23 уш. с (1H, NH), 8.62 уш. с (1H,
177.46 (C=S), 148.39, 139.62, 121.30, 119.40,
NH), 8.42 с (1H, CH=N), 7.58 д (1H, CH, Ar, J = 7.9 Гц), 6.97
118.57, 113.23 (Ar), 146.42 (CH=N), 135.66
д (1H, CH, Ar, J = 7.9 Гц), 6.79 т (1H, CH, Ar, J = 7.9 Гц), 5.92
(CH, Allyl),
115.94 (CH2=),
56.35 (CH3),
м (1H, CH, Allyl), 5.13 м (2H, CH2=C), 4.22 м (2H, CH2N),
46.22 (CH2N)
3.82 с (3H, CH3)
а Некоторые характеристики тиоамидов H2L1, H2L4 и H2L6 приведены в работах [9-11]. б В ДМСО-d6.
этих фрагментов составляет 5.334, 5.613, 4.46 Å
действие (H···Cg < 3.0 Å, γ < 30.0°, где γ - это угол
соответственно, а величины β принимают значения
между вектором HCg и нормалью к аро-
53.5, 57.0, 12.2°. Наряду с указанным π-π-взаимо-
матическому циклу [16, 17]). Так, для C1-S1···Cg
действием в соединении H2L5 осуществляется
(С6-С11) (-x, -y, 1-z) взаимодействия расстояние
также Y-X···Cg (π-кольцо) взаимодействие (X···Cg <
между атомом серы S1 и центроидом фенильного
4.0 Å, γ < 30.0°, где γ - это угол между вектором
цикла равно
3.489 Å, а значения величины γ
XCg и нормалью к ароматическому циклу), а в
составляет 2.7°. В азометине H2L6 для C9-H···Cg
соединении H2L6 - X-H···Cg (π-кольцо) взаимо-
(С6-С11)
(-x,
0.5+y,
0.5-z) взаимодействия
Рис. 1. Общий вид молекулы соединения H2L4 в кристалле.
Рис. 2. Общий вид молекулы соединения H2L6 в кристалле.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
769
Таблица 3. Кристаллографические характеристики, данные эксперимента и уточнения структуры соединений H2L4-6 и
9
Соединение
H2L4
H2L5
H2L6
9
Формула
C11H13N3O2.75S
C11H12N4O3S
C12H15N3O2S
C12H20N4O8SCu
М
263.30
280.31
265.33
443.92
Сингония
Моноклинная
Моноклинная
Моноклинная
Триклинная
Пространственная группа
P21/c
P21/c
P21/c
P-1
Z
4
4
4
4
a, Å
15.236(4)
8.9728(5)
13.661(14)
6.8720(7)
b, Å
4.5098(13)
16.6764(7)
5.978(4)
14.0564(18)
c, Å
20.553(5)
8.8395(5)
16.834(6)
18.901(2)
α, град
90
90
90
79.178(10)
β, град
95.65(2)
104.396(6)
108.17(6)
89.523(9)
γ, град
90
90
90
87.640(10)
V, Å 3
1405.4(6)
1281.16(12)
1306.2(17)
1791.8(4)
dвыч, г/см3
1.244
1.453
1.349
1.646
λ, Å
0.71073
0.71073
0.71073
0.71073
μ, см-1
0.232
0.263
0.246
1.384
Т, K
293(2)
293(2)
293(2)
293(2)
Размеры образца, мм
0.80×0.05×0.02
0.20×0.18×0.30
0.40×0.03×0.01
0.50×0.27×0.04
θmax, град
25.05
25.04
28.96
25.05
Пределы h, k, l
-16 ≤ h ≤ 18
-7 ≤ h ≤ 10
-18 ≤ h ≤ 18
-8 ≤ h ≤ 8
-3 ≤ k ≤ 5
-17 ≤ k ≤ 19
-7 ≤ k ≤ 7
-16 ≤ k ≤ 15
-24 ≤ l ≤ 15
-9 ≤ l ≤ 10
-22 ≤ l ≤ 22
-22 ≤ l ≤ 14
Число отражений
4482/ 2409
2785/1926
4767/4915
9835/6197
измеренных/независимых (N1)
Rint с I>2σ(I) (N2)
0.0699
0.0186
0.00
0.0507
Число параметров
156
172
150
485
R1/wR2 по N1
0.0739/0.1345
0.0425/0.0851
0.0736/0.1064
0.0866/0.1625
R1/wR2 по N2
0.1822/0.1703
0.0657/0.0960
0.2974/0.2091
0.1751/0.2013
S
0.883
1.004
0.828
0.962
Δρmax/Δρmin, e/A3
0.291/-0.224
0.144/-0.201
0.310/-0.304
1.776/-0.473
расстояние H···Cg равно 2.83 Å, а значение угла γ
или 1:2 получены координационные соединения 1-
равно 7.6°.
10, для которых на основании данных элементного
анализа (табл. 6) предложен состав Cu(НL1-6)Х·
Взаимодействием горячих (50-55°С) этанольных
nH2O (1, 3-9) [X = Cl- (1, 5, 7, 8), NO– (3, 4, 6, 9);
растворов хлоридов или нитратов меди и кобальта
n = 0 (1, 5, 7, 8), 1 (3, 4, 6), 3 (9)], Сo(НL2)2NO3 (2) и
с тиоамидами H2L1-6 в мольном соотношении 1:1
Сo(НL6)2Сl
(10). Полученные координационные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
770
ГУЛЯ и др.
соединения
1-10 нерастворимы в диэтиловом
Таблица
4. Некоторые межатомные расстояния и
эфире, малорастворимы в воде, лучше растворимы
валентные углы для соединений H2L4-6
в спиртах, хорошо растворимы в ДМФА, ДМСО и
d, Å
ацетонитриле. Выходы и некоторые физико-
Связь
химические характеристики полученных комп-
H2L4
H2L5
H2L6
лексов приведены в табл. 6.
S1-C1
1.687(5)
1.683(3)
1.662(7)
При перекристаллизации комплексов 1-10 из
C5-N3
1.283(5)
1.276(3)
1.264(7)
этанола получены монокристаллы соединения 9,
C5-C6
1.460(6)
1.461(3)
1.448(8)
структура которого была установлена методом
РСА (табл. 3). Независимая элементарная ячейка
N3-N2
1.397(5)
1.374(3)
1.399(6)
кристаллической структуры комплекса 9 содержит
N1-C1
1.330(5)
1.325(3)
1.295(8)
два неэквивалентных комплексных катиона
N1-C2
1.437(5)
1.455(3)
1.476(9)
[Cu(НL6)H2O]+, два нитрат-иона и четыре
молекулы воды. В каждом комплексе атом меди
N2-C1
1.355(5)
1.354(3)
1.356(8)
координируют однократно депротонированную
C2-C3
1.463(7)
1.478(4)
1.462(10)
трехдентатную молекулу Н2L6 с образованием двух
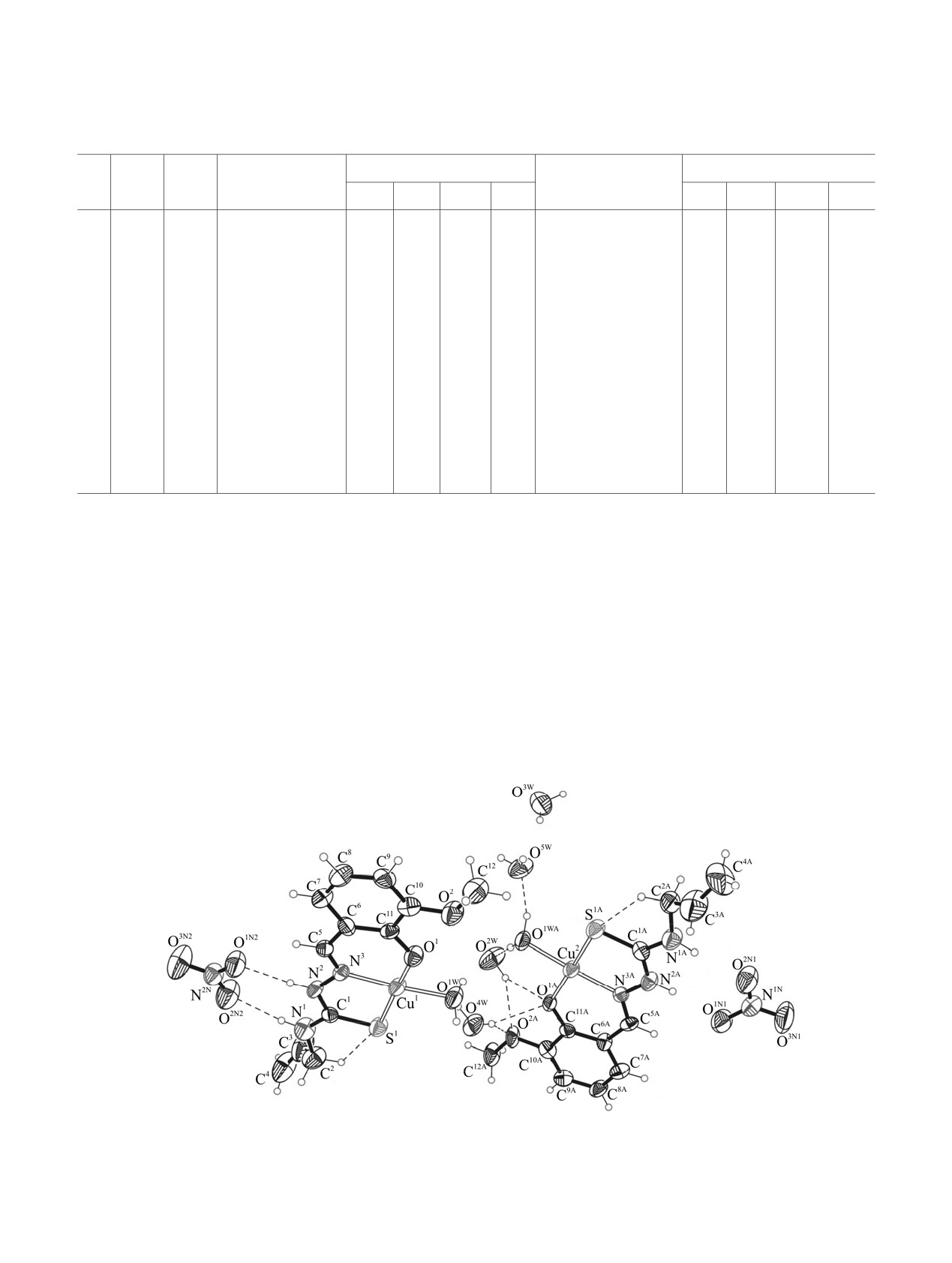
хелатных циклов и молекулу воды (рис. 6). Длины
Угол
ω, град
связей металла с донорными атомами равны
N3C5C6
122.0(4)
121.4(2)
121.0(6)
Сu1-O1
1.9152(2)
[1.9112(2)], Сu1-S1
2.2636(3)
[2.2591(3)], Cu1-N3 1.9270(2) [1.9331(2)], Cu1O1W
C5N3N2
115.9(4)
115.4(2)
115.9(5)
1.9430(2) [1.9605(3)] Å (табл. 7). Шестичленные и
C1N1C2
125.3(4)
123.9(2)
124.2(7)
пятичленные металлоциклы в обоих комплексах
C1N2N3
120.1(4)
121.1(2)
122.4(5)
лежат практически в одной плоскости,
соответствующие двугранные углы равны 3.83 и
N1C1N2
117.0(4)
115.7(2)
115.5(6)
3.79°. В кристалле комплексы связаны между
N1C1S1
123.9(4)
125.43(19)
125.0(6)
собой нитратными группами и молекулами воды,
образуя трехмерную систему межмолекулярных
N2C1S1
119.1(4)
118.87(18)
119.5(5)
водородных связей (рис. 7). При этом, согласно
C9C8C7
119.3(5)
119.6(2)
119.8(6)
N1C2C3
115.6(5)
112.3(2)
112.3(7)
C4C3C2
127.2(5)
126.0(3)
125.7(10)
критерию, предложенному в работе [16] (CgI···CgJ <
6.0 Å, β < 60.0°, где β - угол между вектором
CgICgJ и нормалью к ароматическому циклу CgI),
в кристалле наблюдается π-π-стекинг взаимо-
действие между металлоциклами Cu2O1AC11AC6AC5AN3A,
связанными центром симметрии. Расстояние
Cg1···Cg1 (1-x, 1-y, -z) между центроидами этих
фрагментов составляет
3.513 Å, а величина
Рис. 3. Фрагмент кристаллической упаковки соеди-
Рис. 4. Образование фрагмента Н-связаннoй цепочки в
нения H2L4.
молекуле тиоамида H2L5.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
771
Таблица 5. Геометрические параметры водородных связей для соединений H2L4-6
Расстояние, Å
Связь D-H···A
Угол DHA, град
Координаты атома A
D-H
H···A
D···A
H2L4
O1-H···N3
0.82
1.95
2.672
147
x, y, z
N2···H···S1
0.86
2.60
3.448
171
1-x, 2-y, 1-z
N1···H···N3
0.86
2.26
2.659
108
x, y, z
C2···H···S1
0.97
2.61
3.109
112
x, y, z
H2L5
O1···H···O3
0.82
1.90
2.594
142
x, y, z
O1···H···S1
0.82
2.82
3.367
126
-x, -1/2+y, 1/2-z
N1···H···N3
0.86
2.25
2.638
107
x, y, z
N2···H···S1
0.86
2.72
3.479
148
-x, -y, -z
C2···H···O1
0.97
2.46
3.349
153
-x, 1/2+y, 1/2-z
H2L6
N2···H···O1
0.86
2.19
2.978
151
-x, 2-y, -z
O1···H···O2
0.82
2.18
2.637
116
x, y, z
O1···H···S1
0.82
2.52
3.184
139
-x, 2-y, -z
N1···H···N3
0.86
2.26
2.664
109
x, y, z
C5···H···O1
0.93
2.43
2.754
100
x, y, z
C2···H···S1
0.97
2.64
3.081
108
x, y, z
9
N1···H···O2N2
0.86
2.04
2.897
174
x, y, z
N1A···H···O2N1
0.86
2.02
2.870
169
1-x, 1-y, -z
N2···H···O1N2
0.86
1.93
2.783
169
x, y, z
N2A···H···O1N1
0.86
1.96
2.815
170
1-x, 1-y, -z
O1W···H···O4W
0.85
2.21
2.685
115
-x, 1-y, 1-z
O1W···H···O4W
0.85
2.41
2.685
100
-x, 1-y, 1-z
O1WA···H···O2W
0.87
1.88
2.743
171
x, y, z
O1WA···H···O5W
0.87
190
2.655
144
x, y, z
O2W···H···O1N1
0.85
2.34
3.090
148
x, y, z
O2W···H···O1A
0.85
2.22
2.926
141
x, y, z
O2W···H···O2A
0.85
2.27
3.022
147
x, y, z
O3W···H···O5W
0.85
2.51
3.343
167
-1+x, y, z
O4W···H···O1A
0.85
2.23
2.977
146
x, y, z
O4W···H···O2A
0.85
2.48
3.233
147
x, y, z
O5W···H···O1N2
0.85
206
2.893
167
x, y, z
O5W···H···O1
0.85
2.18
3.005
163
1-x, 1-y, 1-z
C2A···H···S1A
0.97
2.62
3.089
110
x, y, z
C2···H···S1
0.97
2.60
3.112
113
x, y, z
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
772
ГУЛЯ и др.
Таблица 6. Некоторые межатомные расстояния и валентные углы для соединения 9
Связь
d, Å
Связь
d, Å
Угол
ω, град
Угол
ω, град
Cu1-O1
1.915(5)
S1-C1
1.705(8)
O1Cu1N3
93.6(3)
O1WACu2S1A
92.68(18)
Cu1-N3
1.927(6)
C5-N3
1.277(9)
O1Cu1O1W
86.6(2)
N3C5C6
126.1(8)
Cu1-S1
2.264(2)
C5-C6
1.458(10)
N3Cu1O1W
175.4(3)
C5N3N2
116.5(6)
Cu1-O1W
1.943(5)
N3-N2
1.393(8)
O1Cu1S1
173.98(19)
C1N1C2
125.6(8)
Cu2-O1A
1.911(5)
N1-C1
1.325(9)
N3Cu1S1
86.7(2)
C1N2N3
118.7(7)
Cu2-N3A
1.933(6)
N1-C2
1.472(10)
O1WCu1S1
93.54(17)
N1C1N2
116.1(8)
Cu2-S1A
2.259(2)
N2-C1
1.325(9)
O1ACu2N3A
93.8(2)
N1C1S1
122.6(7)
Cu2-O1WA
1.961(6)
C2-C3
1.389(14)
O1ACu2O1WA
86.8(2)
N2C1S1
121.3(6)
N3ACu2O1WA
176.8(3)
C9C8C7
120.7(8)
O1ACu2S1A
174.74(17)
N1C2C3
113.2(9)
N3ACu2S1A
86.99(19)
C4C3C2
125.7(13)
β принимает значение 13.8°. Наряду с указанным
Для установления индивидуальности состава и
π-π-взаимодействием в комплексе
9 также
строения полученных комплексов использовали
осуществляется взаимодействие металл Cg (π-
методы элементного анализа, молярной электро-
кольцо) (Cu···Cg < 4.0 Å). Так, для взаимодействий
проводности, магнетохимии и ИК спектроскопии
Cu1···Cg (C6C7C8C9C10C11) (-x, 1-y, 1-z) и Cu2···Cg
(табл. 6). На основании данных, полученных при
(C6AC7AC8AC9AC10AC11A)
(1-x, 1-y, -z) расстояния
определении молярной электропроводности (æ)
Cu···Cg равны 3.517 и 3.487 Å соответственно.
синтезированных соединений в ДМФА установ-
Рис.
5. Фрагмент кристаллической упаковки соеди-
нения H2L6.
Рис. 6. Общий вид молекулы соединения 9 в кристалле.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
773
Таблица 7. Физико-химические характеристики координационных соединений меди и кобальта с замещенными
2-(2-гидроксибензилиден)-N-(проп-2-ен-1-ил)гидразинкарботиоамидами 1-10
Найдено, %
Вычислено, %
Выход,
μэф,
æ,
№
Формула
%
М. Б. a
Ом-1·см2·моль-1 a
Сl
M
N
S
Сl
M
N
S
1
80
1.75
4
8.47
15.19
9.90
7.48
C11H11BrClCuN3OS
8.60
15.42
10.19
7.78
б
2
75
70
-
6.25
10.57
6.94
С22H20Br4CoN7O5S2
-
6.51
10.83
7.09
3
82
1.82
57
-
11.60
10.17
5.70
C11H12Br2CuN4O5S
-
11.86
10.46
5.99
4
67
1.81
65
-
15.87
13.98
7.91
C11H14CuN4O6S
-
16.13
14.22
8.14
5
78
1.92
4
9.88
17.93
11.94
8.89
C11H12ClCuN3O2S
10.15
18.19
12.03
9.18
6
69
1.83
67
-
15.87
14.01
7.99
C11H14CuN4O6S
-
16.13
14.22
8.14
7
77
1.79
2
9.14
16.59
14.60
8.31
C11H11ClCuN4O3S
9.37
16.80
14.81
8.48
8
73
1.78
3
9.55
17.32
11.39
8.74
C12H14ClCuN3O2S
9.76
17.49
11.57
8.83
9
69
1.87
61
-
14.17
12.47
6.98
C12H20CuN4O6S
-
14.31
12.62
7.22
б
10
72
54
5.47
9.17
13.32
10.07
C24H28ClCoN6O4S2
5.69
9.46
13.49
10.29
a При 294 K. б Диамагнитен.
лено, что комплексы
1,
5,
7,
8 являются
окружении (табл.
6).
Для соединений меди
неэлектролитами (æ
=
2-4 Ом-1·см2·моль-1), а
величины эффективных магнитных моментов
комплексы 2-4, 6, 9, 10 относятся к бинарным
соответствуют спиновым значениям для одного
электролитам (æ = 54-70 Ом-1·см2·моль-1).
неспаренного электрона. Эти экспериментальные
данные дают основание предположить для них
Магнетохимическое исследование комплексов
мономерное строение.
1-10 при комнатной температуре (294 K) показало,
что кобальтовые комплексы 2 и 10 диамагнитны, и,
C целью определения способа координации
судя по их магнетохимическим характеристикам,
лигандов с центральными ионами проведен
центральные атомы в них находятся в степени
сравнительный анализ ИК спектров синтези-
окисления +3 в псевдооктаэдрическом лигандном
рованных комплексов 1-10, исходных тиоамидов
Рис. 7. Фрагмент кристаллической упаковки соединения 9.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
774
ГУЛЯ и др.
Таблица 8. Минимальные подавляющие (МПК) и бактерицидные (МБК) концентрации (мкг/мл) координационных
соединений 1-10 по отношению к тест-микробам
Staphylococcus
Bacillus cereus
Escherichia coli
Salmonella abony
Candida albicans
aureus ATCC 25923
ГИСК 8035
ATCC 25922
ГИСК 03/03
ATCC 90028
№
МПК
МБК
МПК
МБК
МПК
МБК
МПК
МБК
МПК
МБК
Исходные солиа
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
H2L1
15
60
1.5
15
˃1000
˃1000
˃1000
˃1000
3
3
1
3
15
1.5
3
˃1000
˃1000
˃1000
˃1000
3
30
H2L2
1.5
3
1.5
3
>1000
>1000
>1000
>1000
1.5
3
2
3
7
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
1.5
3
3
1.5
1.5
1.5
3
>1000
>1000
>1000
>1000
1.5
3
H2L3
15
30
30
60
120
250
250
500
30
120
4
7
15
7
15
30
60
60
120
7
7
H2L4
3
15
30
60
˃1000
˃1000
˃1000
˃1000
3
15
5
7
15
7
15
500
500
250
500
3
7
6
3
7
3
7
12
250
12
60
3
7
H2L5
60
250
15
120
120
500
120
500
3
30
7
15
120
1.5
15
15
120
120
120
3
15
H2L6
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
8
7
60
7
30
30
120
15
60
15
60
9
7
7
120
120
500
500
500
500
7
7
а CuCl2·2H2O; Cu(NO3)2·3H2O; CoCl2·6H2O; Co(NO3)2·6H2O.
H2L1-6, а также координационного соединения 9,
центральным атомам посредством депротони-
строение которого установлено методом РСА.
рованного фенольного атома кислорода, азомети-
Установлено, что в ИК спектрах синтезированных
нового атома азота и атома серы в тионной форме.
соединений присутствуют полосы поглощения в
На вышеуказанную координацию тиоамидов H2L1-6
областях 3450-3100, 1660-1580 и 1400-1100 см-1,
указывает и то, что в ИК спектрах всех комплексов
которые характеризуют валентные колебания
появляется ряд новых полос поглощения в области
координированных молекул соответствующих
530-405 см-1, обусловленных ν(M-N) при 525-505,
лигандов. В области 3450-3100 см-1 ИК спектров
430-405 см-1 и ν(M-S) при 450-440 см-1. Участие
всех комплексов исчезает полоса поглощения
других функциональных групп тиоамидов H2L1-6 в
ν(O-H), что указывает на депротонизацию
координации с центральным ионом исключается,
фенольной ОН-группы в молекулах лигандов.
поскольку их характеристические полосы
Такой же вывод можно сделать по изменению
поглощения проявляются в тех же областях, что и
колебаний ν(C-O), которые в лигандах H2L1-6
в исходных тиосемикарбазонах.
наблюдаются в диапазоне
1260-1190 см-1. В
Полученные физико-химические данные позво-
спектрах комплексов 1-10 ее положение смещается
ляют представить распределение химических
на 40-50 см-1 в низкочастотную область. Кроме
связей в комплексах 1-10 в виде структур А (1, 5,
того, в спектрах наблюдается смещение полосы
7, 8), Б (3, 4, 6, 9) и В (2, 10) (схема 2).
поглощения ν(С=N) в низкочастотную область на
20-30 см-1 и полосы поглощения ν(С=S) в
В работах [7, 8] установлено, что комплексы
высокочастотную область на
25-40 см-1. Это
биометаллов с 2-(2-гидроксибензилиден)-N-(проп-
указывает на координацию тиоамидов H2L1-6 к
2-ен-1-ил)гидразинкарботиоамидом избирательно
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
775
Схема 2.
R2
R1
R2
R1
R3
O
Cl
R3
O
OH2
NO3. nH2O
Cu
Cu
S
S
N
N
N
N
N
N
H
H
H
H
А
Б
R2
R3
R1
NH
O
S N
NH
Co
HN
N
S
X
O HN
R1
R3
R2
В
Таблица 9. Концентрация полумаксимального ингиби-
подавляют рост и размножение некоторых видов
рования IC50 исследуемых веществ в отношении клеток
раковых клеток и некоторых видов микро-
HL-60 и MDCK
организмов. В связи с этим нами была изучена in
vitro противомикробная и противогрибковая
IC50
, мкМ.
Соединение
активность синтезированных координационных
HL-60
MDCK
соединений 1-10 в отношении серии стандартных
H2L1
8.0
˃100
штаммов грамположительных бактерий Staphylo-
coccus aureus и Bacillus cereus, грамотрицательных
1
1.8
18
кишечных палочек Escherichia coli и Salmonella
H2L2
>10
˃ 100
abony и представителя дрожжеподобных грибов
Candida albicans. Полученные экспериментальные
2
>10
>100
данные приведены в табл. 8, из которой видно, что
3
3.8
92
все исходные соли кобальта и меди не проявляют
противомикробной активности в отношении
H2L3
>10
>100
вышеуказанных микроорганизмов, в то время как
4
3.8
4.8
гидразинкарботиоамиды H2L1, H2L2 и H2L4
H2L4
>10
˃100
проявляют активность только в отношении к
грамположительным микроорганизмам и грибам и
6
>10
50
мало активны в отношении грамотрицательных
H2L5
>10
>100
микроорганизмов. Установлено, что комплексы 1-
10, проявляют селективную как бактерио-
7
0.6
˃100
статическую, так и бактерицидную активность в
H2L6
7.2
˃100
диапазоне концентраций
1.5-120 мкг/мл в
8
0.4
˃100
отношении стафилококков и грибов и 15-500 мкг/мл
в отношении кишечных палочек. Как показал
10
>10
˃100
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
776
ГУЛЯ и др.
эксперимент, на минимальную подавляющую
комплексов 1-10 определена их ингибирующая
(МПК) и минимальную бактерицидную (МБК)
активность в отношении и здоровых клеток
концентрации исследуемых комплексов
1-10
MDCK. В табл. 8 представлены значения кон-
основное влияние оказывает природа центрального
центрации полумаксимального ингибирования
атома и заместителя в азометинах Н2L1-6. Наиболее
IC50, являющегося показателем эффективности
активным в отношении грамположительных
цитостатического действия исследуемых веществ в
микроорганизмов является комплекс
3, а в
отношении клеток HL-60 и MDCK. Как видно, в
отношении грамотрицательных микроорганизмов -
большинстве
случаев
антипролиферативное
комплекс 8. Кроме того, близость значений МПК и
действие исследуемого ряда веществ в отношении
МБК для многих соединений указывает на
здоровых клеток в
10 и более раз слабее их
бактерицидный характер их действия.
действия в отношении раковых клеток HL-60
миелоидной лейкемии человека. Эти экспери-
Изучение антипролиферативной активности
ментальные данные указывают на то, что исследу-
выше приведенных веществ в отношении клеток
емые вещества проявляет селективную противо-
HL-60 миелоидной лейкемии человека и
раковую активность в отношении клеток HL-60
модельной линии нормальных клеток млеко-
миелоидной лейкемии человека, практически не
питающих MDCK (Madin-Darby Canine Kidney)
оказывая негативного влияния на рост и
показали, что как и в случае комплексов
3d-
размножение здоровых клеток.
металлов с 2-(2-гидроксибензилиден)-N-(проп-2-ен-
1-ил)гидразинкарботиоамидом,
данная серия
Вышеприведенные экспериментальные данные
веществ проявляет противораковую активность в
указывают на перспективность дальнейшего
интервале концентраций 0.1-10 мкМ (табл. 9). При
поиска противомикробных, противогрибковых и
этом следует отметить, что введение заместителей
противораковых веществ среди координационных
в бензольное кольцо салицилиденового фрагмента
соединений биометаллов с биолигандами на основе
приводит к изменению активности как тиоамидов
тиоамидов.
H2L1-6, так и координационных соединений
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
исследуемых металлов с ними. Так, введение двух
атомов брома в бензольное кольцо (тиоамид H2L2)
РСА соединений H2L4-6 и 9 проведены на
приводит к полной потере активности. Наибольшая
дифрактометре Xcalibur от Oxford Diffraction [18].
активность тиоамида наблюдается в случае
Их структуры решены прямыми методами и
введения в салицилиденовый фрагмент азометина
уточнены МНК в анизотропном приближении для
атома брома в пятое положение или
неводородных атомов по программам SHELX-97
метоксигруппы в третье положение. Данные
[19], при этом кристаллическую структуру
тиоамиды подавляют рост и размножение раковых
азометина H2L4 уточняли как рацемический
клеток более чем на
50% при концентрации
двойник. Атомы водорода включены в уточнение в
10 мкM. Комплексы меди с этими лигандами
геометрически рассчитанных позициях, а их
проявляют самую высокую активность по срав-
температурные факторы UH приняты в 1.2 раза
нению с другими комплексами данной серии.
большими, чем у связанных с ними атомов
Установлено, что, противораковая активность
углерода и кислорода. Основные параметры экспе-
координационных соединений сильно зависит от
римента, решение и уточнение структур приведены
природы центрального атома. Комплексы меди
в табл. 1, а некоторые межатомные расстояния и
проявляют более высокую активность по срав-
валентные углы - в табл. 2. Координаты базисных
нению с соответствующими тиоамидами, а
атомов исследованных структур депонированы в
комплексы кобальта малоактивны. Наиболее
Кембриджский банк данных (CCDC
929459-
высокую цитостатическую активность среди
929461,
1872426). Геометрические расчеты и
изученных соединений данной серии проявил
рисунки выполнены с помощью программы
комплекс 8, который подавляет рост и размноже-
PLATON
[16], для представления упаковок
ние раковых клеток на 100% при концентрациях 10
структур оставлены только те атомы водорода,
и
1 мкM., но практически полностью теряет
которые участвуют в водородных связях. Для
активность при более низкой концентрации.
анализа полученных структур использовались
Для определения селективности антипроли-
данные Кембриджского банка данных (версия.
феративного действия тиоамидов H2L1-6 и
5.39) [20, 21].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
777
Сопротивление растворов комплексов 1-10 в
осадок отфильтровывали на стеклянном фильтре,
ДМФА (20°С, с
=
0.001 моль/л) измеряли с
промывали небольшим количеством спирта, эфира
помощью реохордного моста Р-38. ИК спектры
и сушили на воздухе до постоянной массы.
регистрировали на спектрометре ALPHA (4000-
Аналогично, используя в качестве исходных
400 см-1). Эффективные магнитные моменты
веществ тиоамиды H2L2-6 и гидраты хлоридов или
определяли методом Гуи. Расчет молярной
нитратов кобальта(II) или меди(II), взятые в
магнитной восприимчивости с поправкой на диа-
мольном отношении
2:1 и
1:1 синтезировали
магнетизм проводили исходя из теоретических
соединения 2-10.
значений магнитной восприимчивости органи-
ческих соединений.
Авторы выражают благодарность профессору
Д. Пуарье (Университет Лаваль, Квебек, Канада) и
Противомикробную, противогрибковую и
О.С. Гарбуз за помощь при проведении био-
противораковую активности изучали по стан-
логических испытаний синтезированных веществ.
дартным методикам описанным в работе [22].
2-(5-Бром-2-гидроксибензилиден)-N-(проп-2-ен-
КОНФЛИКТ ИНТЕРЕСОВ
1-ил)гидразинкарботиоамид (H2L1) получен по
методике, описанной в работе [9].
Авторы заявляют об отсутствии конфликта
2-(3,5-Дибром-2-гидроксибензилиден)-N-(проп-
интересов.
2-ен-1-ил)гидразинкарботиоамид (H2L2). К
горячему (55-60°С) спиртовому раствору, содер-
СПИСОК ЛИТЕРАТУРЫ
жащему 10 ммоль 3,5-дибром-2-гидроксибензаль-
1. Bal-Demirci T. // Polyhedron. 2008. Vol. 27. P. 440. doi
дегида в
15 мл этанола, приливали раствор
10.1016/j.poly.2007.10.001
10 ммоль N-(проп-2-ен-1-ил)гидразинкарботиоамида
2. Bal-Demirci T., Akkurt M., Yalcm S. P, Buyukgungor O. //
(4-аллилтиосемикарбазида) в 35 мл этанола. При
Trans. Met. Chem. 2010. Vol. 35. P. 95. doi 10.1007/
охлаждении реакционной смеси наблюдалось
s11243-009-9300-2
образование осадка светло-желтого цвета, который
3. Бонь В.В., Орысык С.И., Пехньо В.И. // Коорд. хим.
отфильтровывали на стеклянном фильтре,
2011. Т.
37.
№ 2. С. 151; Bon V.V., Orysyk S.I.,
промывали небольшим количеством спирта и
Pekhnyo V.I. // Russ. J. Coord. Chem. 2011. Vol. 37.
сушили на воздухе.
N 2. Р. 149. doi 10.1134/s1070328411010027
Аналогично, используя в качестве исходных
4. Bon V.V. // Acta Cryst. 2010. Vol. 66. P. 300. doi
веществ N-(проп-2-ен-1-ил)гидразинкарботиоамид
10.1107/50108270110035754
(4-аллилтиосемикарбазид) и 2,3-дигидрокси- или 2-
5. Orysyk S.I., Bon V.V., Obolentseva O.O., Zborov-
гидрокси-3-нитробензальдегиды, взятые в моляр-
skii Yu.L., Orysyk V.V., Pekhnyo V.I., Staninets V.I.,
ном отношении
1:1 синтезировали остальные
Vovk M.V. // Inorg. Chim. Acta. 2012. Vol. 382. P. 127.
doi 10.1016/j.ica.2011.10.027
тиоамиды. Азометины H2L4 и H2L6 получали по
методикам, описанным в работах
[10,
11].
6. Orysyk S.I., Repich G.G., Bon V.V., Dyakonenko V.V.,
Orysyk V.V., Zborovskii Yu.I., Shishkin O.V., Pekh-
Некоторые характеристики замещенных
2-(2-
nyo V.I., Vovk M.V.
// Inorg. Chim. Acta.
2014.
гидроксибензилиден)-N-(проп-2-ен-1-ил)гидразин-
Vol. 423. P. 496. doi 10.1016/j.ica.2014.08.056
карботиоамидов H2L1-6 приведены в табл. 1,
2.
7. Kalinowski D.S.,Quach P., Richardson D.R. // Future
Тиоамиды H2L1-6 хорошо растворимы в ДМФА,
Med. Chem. 2009. Vol. 1. N 6. P. 1143. doi 10.4155/
ДМСО, при нагревании - в спиртах.
FMC.09.80
Хлоро-[2-(5-бром-2-гидроксибензилиден)-N-
8. Lovejoy D.B., Richardson D.R. // Blood. 2002. Vol. 100.
(проп-2-ен-1-ил)гидразин-карботиоамидо]медь
P. 666. doi 10.1182/blood.V100.2.666
(1).
К раствору
10 ммоль
2-(5-бром-2-гид-
9. Ülküseven B., Bal-Demirci T., Akkurt M., Yalçın, Ş.P.,
рокибензилиден)-N-(проп-2-ен-1-ил)гидразинкарбо-
Büyükgüngör O. // Polyhedron. 2008. Vol. 27. N 18.
тиоамида H2L1 в 50 мл этанола при непрерывном
P. 3646. doi 10.1016/j.poly.2008.08.024
перемешивании и нагревании (50-55°С) прибав-
10. Scott A.W., McCall M.A. // J. Am. Chem. Soc. 1945.
ляли раствор 10 ммоль дигидрата хлорида меди(II)
Vol. 67. N 10. P. 1767. doi 10.1021/ja01226a043
в
20 мл этилового спирта. После этого реак-
11. Bal-Demirci T., Akkurt M., Yalçın, Ş.P., Büyükgüngör O. //
ционную смесь кипятили в течение 50-60 мин.
Trans. Metal Chem. 2010. Vol. 35. N 1. P. 95. doi
После охлаждения до комнатной температуры
10.1007/s11243-009-9300-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
778
ГУЛЯ и др.
12. Duan C.-Y., Tian Y.-P., Zhao C.-Y., You X.-Z.,
17. Malone J.F., Murray C.M., Charlton M.H., Docherty R.,
Mak T.C.W. // Polyhedron. 1997. Vol. 16. P. 2857. doi
Lavery A.J. // J. Chem. Soc. Faraday Trans.
1997.
10.1016/S0277-5387(97)00013-2
Vol. 93. P. 3429. doi 10.1039/A700669A
13. Vrdoljak V., Cindric M., Milic D., Dubravka M.C.,
18. CrysAlisPro, Version 1.171.33.52 (release 06-11-2009
Predrag N., Kamenar B. // Polyhedron. 2005. Vol. 24.
CrysAlis171.NET). Oxford Diffraction Ltd.
P. 1717. doi 10.1016/j.poly.2005.05.002
19. Sheldrich G.M. // Acta Cryst. (A). 2008. Vol.
64.
14. Боурош П.Н., Ревенко М.Д., Гданец М., Стратулат Е.Ф.,
Р. 112. doi 10.1107/S0108767307043930
Симонов Ю.А. // ЖСХ. 2009. Т. 30. № 3. С. 532;
20. Allen F.H. // Acta Cryst. (B). 2002.Vol. 58. P. 380. doi
Bourosh P.N., Revenko M.D., Gdaniec M., Stratulat E.F.,
10.1107/S0108768102003890
Simonov Yu.A. // J. Struct. Chem. 2009. Vol. 50. N 3.
P. 510. doi 10.1007/s10947-009-0078-z
21. Addison A.W., Rao T.N., Reedijk J, Verschoor G.C. // J.
15. Чумаков Ю.М., Биюшкин В.Н., Бодю В.Г. // ЖСХ.
Chem. Soc. Dalton Trans. 1984. N 7. Р. 1349. doi
1985. T. 26. № 6. С. 114; Chumakov Y.M., Biyushkin V.N.,
10.1039/DT9840001349
Bodyu, V.G. // J. Struct. Chem. 1986. Vol. 26. N 6.
22. Gulea A., Poirier D., Roy J., Stavila V., Bulimestru I.,
P. 929. doi 10.1007/BF00748365
Tapcov V., Birca M., Popovschi L. // J. Enzyme Inhib.
16. Spek A.L. // J. Appl. Cryst. 2003. Vol. 36. P. 7. doi
Med. Chem.
2008. Vol.
23. N
6. P.
806. doi
10.1107/S0021889802022112
101080/147563607017443002
Synthesis, Structure and Biological Activity of Copper
and Cobalt Coordination Compounds with Substituted
2-(2-Hydroxybenzylidene)-N-(prop-2-en-1-yl)hydrazine
Carbothioamides
А. P. Guleaa, V. О. Graura, Yu. M. Chumakovb,c, P. A. Petrenkob, G. G. Baland,
O. S. Burduniucd,e, V. I. Tsapkova,*, and V. F. Rudicf
a State University of Moldova, ul. Mateevicha 60, Kishinev, Moldova
*e-mail: vtsapkov@gmail.com
b Institute of Applied Physics, Kishinev, Moldova
c Gebze Institute of Technology, Gebze/Kocaeli, Çayirova, Turkey
d State University of Medicine and Pharmacy "Nicolae Testemitanu", Kishinev, Moldova
e National Agency of Public Health, Kishinev, Moldova
f Institute of Microbiology and Biotechnology of Academy of Sciences of Moldova, Kishinev, Moldova
Received November 29, 2018; revised November 29, 2018; accepted February 22, 2018
Reaction of N-(prop-2-en-1-yl)hydrazine carbothioamide with substituted 2-hydroxybenzaldehydes yielded the
corresponding azomethines, which were used to synthesize coordination compounds with copper and cobalt
Cu(НL1-6)Х·nH2O (X = Cl-, NO–; n = 0-3), Сo(НL2)2NO3, and Сo(НL6)2Сl. Structure of the compounds
obtained was established by NMR spectroscopy and X-ray diffraction data. Antimicrobial and antifungal activity
of the synthesized complexes was studied in relation to a series of standard strains of Staphylococcus aureus,
Escherichia coli and yeast-like fungi, as well as the inhibitory effect of the original thioamides and their
complexes with biometals relative to HL-60 cancer cells of human myeloid leukemia.
Keywords: coordination compounds, 2-hydroxybenzaldehyde, allylthiosemicarbazones, antimicrobial and
anticancer activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019