ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 779-785
УДК 542.91:547.538
ФТОРИРОВАННЫЕ БИС-β-ДИКЕТОНЫ
КОНДЕНСИРОВАННОГО РЯДА
И ЛЮМИНЕСЦЕНТНО-СПЕКТРАЛЬНЫЕ СВОЙСТВА
ИХ КОМПЛЕКСОВ С ЕВРОПИЕМ
© 2019 г. Д. Е. Пугачёвa,b, Т. С. Кострюковаa, Н. П. Ивановскаяa, А. И. Ляминa ,
Д. В. Романовa, С. В. Моисеевa, Г. В. Затонскийa, Н. С. Осинa, Н. В. Васильевa,b, *
a Государственный научно-исследовательский институт биологического приборостроения,
Волоколамское ш. 75/1, Москва, 125424 Россия
*e-mail: nikolai-vasilev@mail.ru
b Московский государственный областной университет, Москва, Россия
Поступило в Редакцию 29 ноября 2018 г.
После доработки 29 ноября 2018 г.
Принято к печати 6 декабря 2018 г.
Конденсацией по Кляйзену диацетилированных конденсированных ароматических и гетеро-
ароматических соединений (флуорена, дибензофурана, дибензотиофена, карбазола) с эфирами поли-
фторкарбоновых кислот в присутствии оснований получены лиганды, содержащие две β-дикетонатные
группы. Люминесцентно-спектральным методом изучено их комплексообразование с ионами Eu3+.
Ключевые слова: β-дикетоны, комплексы европия, люминесценция
DOI: 10.1134/S0044460X19050160
Интенсивно флуоресцирующие фторированные
Существенным прогрессом в направлении повы-
β-дикетонатные комплексы лантанидов достаточно
шения стабильности β-дикетонатных комплексов,
давно находят применение в различных био-
достигнутым в последние годы, стало получение
аналитических приложениях, медицинской диагнос-
конденсированных ароматических и гетероаромати-
тике, экологических исследованиях. Нанотехно-
ческих соединений - тетракетонов, содержащих
логические подходы к созданию реагентов для
две β-дикетонатные группировки. Среди них
иммунофлуоресцентного анализа с исполь-
известны тетракетоны, в которых β-дикетонатные
зованием комплексов лантанидов в последнее
группировки разделены мостиком из одной, двух,
десятилетие позволили достигнуть высокого
четырех или шести дифторметиленовых групп, а
уровня чувствительности и создать мульти-
хромофорные группы (также в удвоенном
аналитные методики определения заболеваний
количестве) находятся на концах молекулы [4-6].
[1-3]. Наиболее часто используемый в медико-
Не отличаясь принципиально по люминесцентно-
биологическом анализе комплекс
2-нафтоил-
спектральным характеристикам от соответству-
трифторацетона с Eu3+ обладает интенсивной
ющих моно-β-дикетонатных комплексов, комп-
длительной люминесценцией при длине волны 615
лексы бис-β-дикетонат-Eu состава 1:1 по крайней
нм и возбуждении в области 340 нм (время жизни
мере на 4 порядка более устойчивы (Kстаб ≥ 1011 М.-1)
люминесценции τ в оптимальных условиях 700-
[4]. Другие варианты β-дикетонатных тетра-
800 мкс). Однако значение константы стабиль-
дентатных комплексонов, в которых хелати-
ности комплекса составляет только ~107 М.-1, что
рующие части разделены центральной
-
позволяет использовать его лишь при большом
хромофорной группой,
а
фторированные
избытке лиганда в варианте диссоциативно
алкильные цепочки различной длины расположены
усиленного лантанидного флуоресцентного иммуно-
по концам, образуют комплексы с Eu3+ приб-
анализа (DELFIA™) [1].
лизительно той же стабильности. Так, константа
779
780
ПУГАЧЁВ и др.
Схема 1.
OH
HO
O
O
O
O
Rf
Rf
NaOCH3
NaH, LiH
RfCOOMe
X
X
X = NH, Rf = CF3 (1a), C3F7 (1б), C4F9 (1в), CF2(CF2)3H (1г), CF2OCF3 (1д); Rf = CF3, X = NC2H5 (1е), O (2), S (3).
Схема 2.
Rf
Rf
NaOCH3
RfCOOMe
HO
OH
O
O
O
O
Rf = CF3 (а), C2F5 (б), C3F7 (в).
диссоциации
1:1
комплекса
на
основе
дешевые источники типа светодиодов, излуча-
трифторметильного производного
о-терфенила,
ющих в более длинноволновых областях спектра.
содержащего реакционноспособные хлорсульфо-
Сдвиг полос возбуждения в область видимой или
нильные группы, составляет 3.7×1011 М.-1 [6]. При
близкой к ней части электромагнитного спектра
возможности комплексообразования двух бис-β-
также предпочтителен вследствие снижения
дикетонатных лигандов вокруг одного Eu3+
фоновой
люминесценции
полистирольных
константа стабильности вырастает до 6.39×1013 М.-1
подложек, биологических сред и других ограни-
[7].
чений иммунологического анализа. Известны
примеры разработки лигандов тетракетонатного
Не существует общепринятого мнения
типа на основе карбазола [5, 13], вместе с тем не
относительно влияния длины перфторалкильной
выявлено влияние фторированных заместителей на
цепочки на люминесцентно-спектральные характе-
люминесцентно-спектральные свойства комплексов
ристики образующихся комплексов лантанидов.
европия.
Так, было показано, что наибольшей интенсив-
ностью и временем жизни люминесценции
Настоящая работа посвящена поиску тетра-
обладают комплексы терфенильного лиганда с
дентатных лигандов для комплексообразования с
самой короткой (CF3) группой [6]. В то же время у
ионами лантанидов. Основные усилия были
бис-β-дикетонатных лигандов с хромофорной
сосредоточены на получении бис-β-дикетонатных
частью,
образованной тремя фенильными
производных конденсированных ароматических и
группами,
соединенными
метиленовыми
гетероароматических соединений, обладающих
мостиками, влияние перфторалкильной цепочки
высокими константами связывания ионов
проявляется прямо противоположным образом:
лантанидов, а также поглощающих в длинно-
наивысшей интенсивностью и временем жизни
волновой области УФ спектра. При этом, как и в
люминесценции обладают лиганды, содержащие
ранее изученных примерах, представлялось
группу из 3 атомов углерода (С3F7) [8].
целесообразным получать соединения, содержащие
фторированные заместители различного размера,
К настоящему времени синтезировано доста-
поскольку их влияние на люминесцентно-
точное количество тетракетонатных лигандов,
спектральные
характеристики
лантанидных
содержащих различные хромофорные группи-
комплексов неоднозначно.
ровки: дифенильные, дибензотиофеновые, терфе-
нильные [9-11], бисбензотиофеновые [12]. Однако
Тетракетоны
1-4 синтезированы по реакции
основным недостатком комплексонов подобного
конденсации Кляйзена диацилзамещенных конден-
рода с практической точки зрения является
сированных соединений с эфирами фторированных
сравнительно коротковолновое положение полос
кислот (схема
1,
2).
Реакции производных
поглощения в области
330-356 нм, не
флуорена, дибензофурана и дибензотиофена идут
позволяющих использовать для их возбуждения
гладко в присутствии метилата натрия в среде
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ФТОРИРОВАННЫЕ БИС-β-ДИКЕТОНЫ КОНДЕНСИРОВАННОГО РЯДА
781
эфира с образованием тетракетонов 2-4 с доста-
точно высоким выходом.
В случае синтеза производных карбазола
1
реакции идут достаточно долго и осложнены
образованием побочных продуктов. Максимальная
конверсия реагентов достигается при кипячении
реакционной смеси в течение
30-50 ч при
перемешивании. Соединение
1а было синтези-
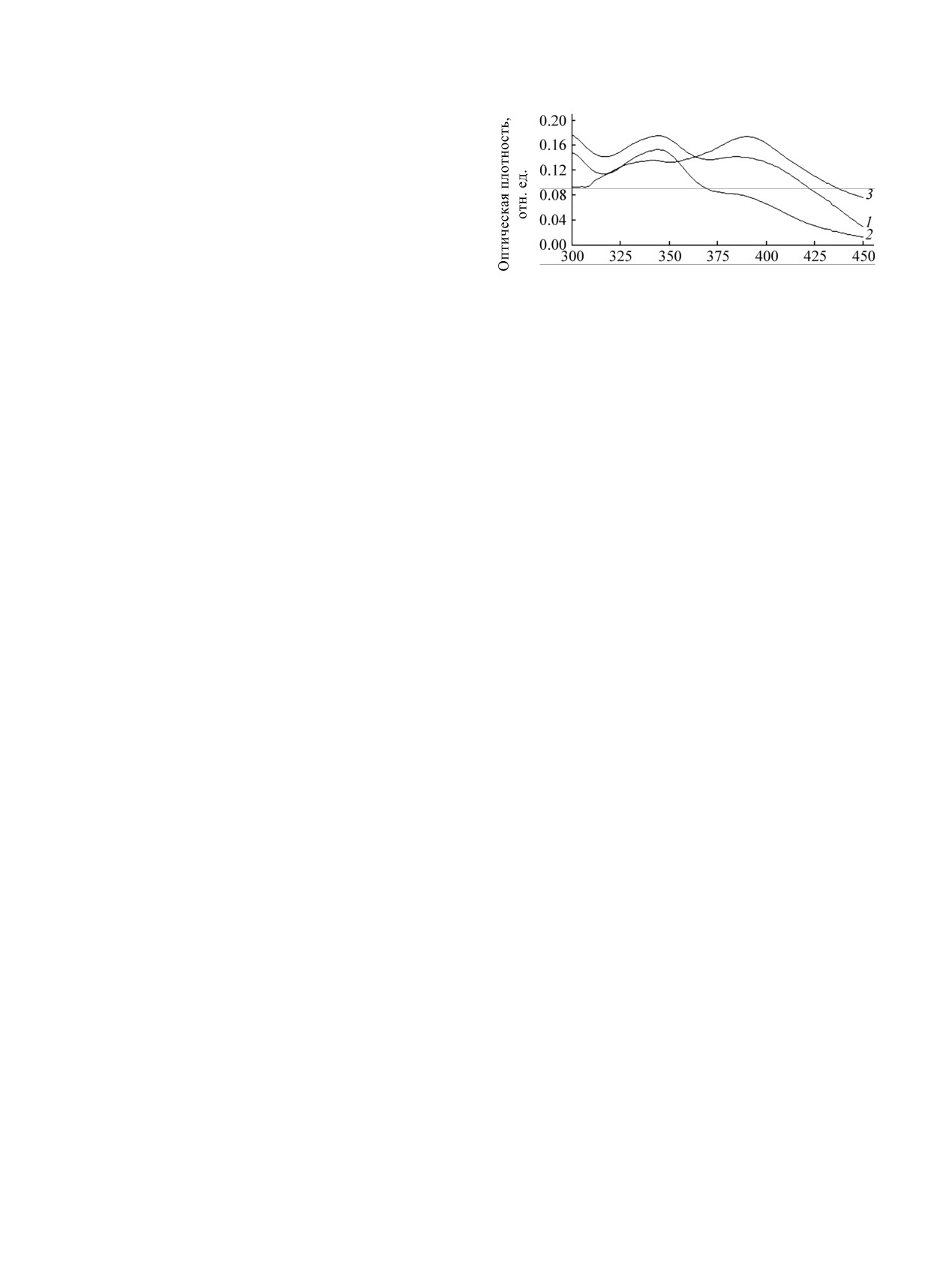
λ, нм
ровано в присутствии LiH и NaH с выходом 50.6 и
Спектры поглощения соединения 1а и комплекса с
73.6%
соответственно. Использование LiH
Eu3+. 1 - лиганд 1а; 2 - лиганд 1а + Eu3+; 3 - лиганд
предпочтительно, поскольку в коммерческом NaH
1а + Eu3+ + TOФO. [1а] = 10-5 М., [Eu3+] = 6.67×10-6 М.,
[TOФO] = 5×10-5 М.
содержится масло, от которого целевой продукт
реакции необходимо дополнительно очищать.
максимумы возбуждения для этих соединений
Данные спектроскопии ЯМР 1H, 19F, физико-
находятся в длинноволновой области ~370-380 нм,
химические характеристики, данные элементного
как и для известного аналога - 3,6-бис(7-метокси-
анализа, выход полученных соединений приведены
карбонил-1,3-диоксо-2,2-дигидроперфторгептил)-
в табл. 1, 2.
карбазола, который изучен в качестве биомаркера
[16]. При комплексообразовании тетракетонов на
Комплексообразование ионов Eu3+ c лигандами
основе карбазола 1a-е происходят существенные
оценивали люминесцентно-спектральным методом
изменения спектра, в котором, наряду с
в присутствии синергиста люминесценции
батохромным сдвигом, возрастает интенсивность
триоктилфосфиноксида, присутствие которого в
длинноволнового максимума поглощения (см.
водных растворах служит вытеснению воды из
рисунок).
внутренней сферы комплекса и снижает эффект
тушения люминесценции [14, 15].
При двухчасовой экспозиции люминесценция
комплексов соединений 1a-в увеличивается в ряду
В табл. 2 приведены люминесцентные характе-
CF3 < C3F7 < C4F9, что, учитывая увеличение
ристики комплексов: длины волн возбуждения
гидрофобности заместителей в этом ряду,
люминесценции
(λ,
нм),
интенсивность
указывает на ускоренное вытеснение воды из зоны
люминесценции (I, отн. ед.),
время жизни
комплексообразования. Следует отметить, что при
люминесценции (τ, мкс) через 2 ч и через 2 сут
двухдневной экспозиции такая закономерность
после смешения реагентов. Дополнительно
пропадает. Введение этильной группы к атому
спектральное изучение проводили и в условиях
азота карбазольного цикла (лиганд
1е) не
мицеллообразования в присутствии Тритона Х-100.
оказывает существенного влияния на спектральные
В нейтральной среде при молярном соот-
и комплексообразующие свойства, и можно
ношении лиганд (L):Eu3+:триоктилфосфиноксид
предположить, что атом азота в данном хромофоре
(ТОФО)
=
3:2:15 лиганды
1-4 образуют
не принимает активного участия в процессе
комплексы, что прослеживалось по смещению
комплексообразования.
полос поглощения лигандов в длинноволновую
Тетракетоны ряда флуорена
4a-в при
область на
10±4 нм, а также по появлению
комплексообразовании люминесцируют также при
люминесценции европия со временем жизни ~400-
возбуждении в длинноволновой области 368-380
700 мкс. Сравнение спектральных характеристик
нм, значения интенсивностей люминесценции
показало, что наибольшей активностью обладают
высоки и менее зависимы от экспозиции.
комплексы дибензофурана 2 и дибензотиофена 3.
Однако полосы возбуждения комплексов этих
Из табл. 3 следует, что практически во всех
лигандов находятся в области ~340-350 нм, что
изучаемых системах введение Тритона Х-100
затрудняет использование светодиодной техники
вызывает незначительное коротковолновое смещение
для практической реализации таких реагентов в
максимумов возбуждения люминесценции с
медико-биологическом анализе. В сравнении с
одновременным существенным
(1.5-2-кратным)
лигандами 2 и 3, люминесценция карбазолсодержащих
увеличением интенсивности люминесценции через
лигандов 1a-е с Eu3+ менее интенсивна, однако
2 ч. Вероятнее всего, данный эффект объясняется
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
782
ПУГАЧЁВ и др.
Таблица 1. Выходы, температуры плавления и данные элементного анализа бис-β-дикетонов 1-4
Найдено, %
Вычислено, %
№
Выход, %
Т. пл., °С
Формула
M
С
H
N
С
H
N
1а
29
260 (разл.)
54.07
2.74
3.26
C20H11F6NO4
54.19
2.50
3.16
443.3
1б
25
238
44.71
1.59
2.15
C24H11F14NO4
44.81
1.72
2.18
643.3
1в
31
224
42.18
1.45
1.96
C26H11F18NO4
42.01
1.49
1.88
743.3
1г
46
212
44.33
1.94
2.03
C26H13F16NO4
44.15
1.85
1.98
707.4
1д
38
218
45.59
2.19
2.31
C22H11F10NO6
45.93
1.93
2.43
575.3
1е
44
206
55.19
3.28
2.79
C22H15F6NO6
55.06
3.21
2.97
471.3
2
50
234
54.28
2.44
C20H10F6O5
54.07
2.27
444.3
3
45
203-206
52.10
2.36
C20H10F6O4S
52.18
2.19
460.3
4a
75
204-210
57.19
2.79
C21H12F6O4
57.02
2.73
442.3
4б
28
226-230
51.07
2.18
C23H12F10O4
50.97
2.23
542.3
4в
65
226-230
47.06
1.98
C25H12F14O4
46.75
1.88
642.3
Таблица 2. Данные ЯМР для бис-β-дикетонов 1-4
№
δН, м. д. (J, Гц)
δF, м. д. (J, Гц)
1а
7.1 с (2H, =CH), 7.6 д (2H, =CH, J = 11.4), 8.2 д (2H,
-73.2
=СH, J = 11.4), 9.2 с (2H, =CH), 12.4 уш. с (1H, NH)
1б
7.1 с (2H, =CH), 7.75 м (2H, =CH), 8.25 м (2H, =СH),
-83.4 (6F, CF3, J = 12.0), -127.1 м (4F, CF2), -129.4 м (4F,
9.2 м (2H, =CH), 11.35 уш. с (1H, NH)
CF2)
1в
7.1 с (2H, =CH), 7.8 д (2H, =CH, J = 10.5), 8.35 д (2H,
-82.2 т (6F, CF3, J = 6.0), -121.3 м (4F, CF2), -124.3 м (4F,
=СH, J = 10.5), 9.25 с (2H, =CH), 11.5 уш. с (1H, NH)
CF2), -127.0 м (4F, CF2)
1г
7.15 т. т (2H, CF2H, J = 52.0, 2.1), 7.2 с (2H, =CH), 7.7
-138.0 уш. д (4F, CF2Н, J = 50.0), -129.8 уш. д (4F, CF2,
д (2H, =CH, J = 10.5), 8.3 д (2H, =СH, J = 10.5),
J = 2.1), -124.8 уш. т (4F, CF2, J = 5.6), -120.5 уш. т (4F,
9.3 с (2H, =CH), 15.5 с (1H, NH)
CF2, J = 5.6)
1д
7.05 с (2H, =CH), 7.8 д (2H, =CH, J = 9.5), 8.25 д (2H,
-57.3 м (6F, CF3), -81.4 м (4F, CF2)
=CH, J = 9.5), 9.2 с (2H, =CH), 11.3 уш. с (1H, NH)
1е
1.5 т (3H, CH3, J = 7.5), 4.6 к (2Н, СН2, J = 7.5), 7.1 с
-76.4 уш. с (6F, CF3)
(2H, =CH), 7.95 д (2H, =CH, J = 10.5), 8.35 д (2H,
=CH, J = 10.5), 9.2 м (2H, =CH)
2
6.7 с (2H, =CH), 7.7 д (2H, =CH, J = 10.3), 8.2 д (2H,
-73.2 (6F, CF3)
=CH, J = 10.3), 7.7 с (2H, =CH)
3
6.75 с (2H, =CH), 8.0 д (2H, =СH, J = 10.5), 8.1 д (2H,
-77.4 (6F, CF3)
=CH, J = 10.5), 8.85 м (2H, =CH)
4a
4.11 с (2H, СН2), 6.68 с (2H, =CH), 7.99 д (2H, =CH,
-76.6 (6F, CF3)
J = 10.0), 8.08 д (2H, =CH, J = 10.0), 8.21 с (2H, =СН)
4б
4.10 с (2H, CH2), 6.71 с (2Н, =СН), 7.92 д (2H, =CH,
-71.6 т (6F, CF3), -121.3 м (4F, CF2)
J = 10.0); 8.09 д (2H, =CH, J = 10.0), 8.21 с (2H, =СН)
4в
4.13 с (2H, СН2), 6.71 с (2Н, =СН), 7.93 д (2H, =CH,
-81.5 т (6F, CF3), -122.5 м (4F, CF2), -127.7 уш. с (4F, CF2)
J = 10), 8.20 д (2H, =CH, J = 10), 8.21 с (2H, =СН)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ФТОРИРОВАННЫЕ БИС-β-ДИКЕТОНЫ КОНДЕНСИРОВАННОГО РЯДА
783
Таблица 3. Люминесцентно-спектральные характеристики комплексов полученных лигандов с европиема
λвозб, нм
I×103, отн. ед.
τ, мкс
№
2 ч
2 сут
2 ч
2 сут
2 ч
2 сут
1a
376
376
159±23
552±17
403±15
479±13
1б
380
376
371±19
939±16
456±17
460±12
1в
378
372
687±28
537±23
550±23
490±25
1г
378
376
356±40
1080±59
441±14
588±28
1д
370
376
455±23
823±41
451±26
518±27
1е
376
376
878±26
920±36
522±16
538±19
2
342
346
1167±57
1255±45
591±24
538±27
3
346
348
1546±29
2565±34
585±32
644±22
4a
368
376
692±15
1037±37
488±18
496±23
4б
376
380
704±16
740±19
459±25
489±28
4в
380
376
692±23
675±26
480±26
478±31
В присутствии Тритона X-100
1е
376
376
1691±27
1569±23
631±12
650±10
2
340
340
1714±13
1459±23
692±16
701±8
3
346
342
2435±49
2257±26
702±14
717±15
4a
364
360
1152±31
1075±39
570±6
573±8
4б
370
368
1175±13
1315±16
564±14
565±10
4c
370
366
680±51
825±43
534±16
539±15
а λвозб
- длина волны возбуждения люминесценции комплекса при регистрации эмиссии при 615 нм, I - интенсивность
люминесценции в максимуме возбуждения, τ - время жизни люминесценции.
вытеснением молекул воды при мицелло-
натрия в качестве основания предпочтительно
образовании. Вместе с тем через 2 сут люмине-
использовать гидрид лития. Независимо от
сценция в некоторых случаях начинала снижаться.
природы комплексообразования, лиганды
1-4 в
Тушение люминесценции во времени может быть
присутствии триоктилфосфиноксида проявляют
связано с известным для уплощенных арома-
активную люминесценцию с длительными
тических хромофоров стекинг-эффектом [17].
временами жизни (400-700 мкс), и по комплексу
полезных свойств превосходят применяющиеся в
Комплексы тетрадентатных лигандов
1-4
настоящее время в практике медико-биоло-
характеризуются высокими константами устой-
гического анализа аналоги. Использование
чивости, как и ранее изученные комплексы [6, 7]. В
соединений ряда карбазола 1 и флуорена 4 при
диапазоне концентраций
10-11-10-5 М. на
возбуждении в диапазоне
370-380 нм пред-
логарифмических зависимостях интенсивности
ставляется особенно важным при разработке
люминесценции комплексов от их концентрации
приборов медицинской диагностики с недорогими
отсутствуют перегибы, из чего можно заключить,
светодиодными источниками энергии.
что константа устойчивости этих комплексов не
менее 1011 М.-1
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Таким образом, конденсацией Кляйзена
получены тетрадентатные лиганды
1-4 с
Электронные спектры поглощения получены на
удовлетворительными выходами. Для
синтеза
спектрофотометре UV-1650PC Shimadzu. Спектры
тетракетонов ряда карбазола 1 вместо метилата
возбуждения и эмиссии люминесценции получены
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
784
ПУГАЧЁВ и др.
на микропланшетном ридере Varioscan Flash
выдерживали при перемешивании
~30 мин.
фирмы Thermofisher Scientific. Спектры ЯМР
Органический слой отделяли, промывали водой
регистрировали на спектрометре Bruker AC-300 с
(6×30 мл), сушили свежепрокаленным сульфатом
рабочей частотой 300.13 МГц (1H) в ДМСО-d6;
натрия и упаривали летучие компоненты в вакууме
спектры ЯМР 19F снимали на спектрометре Bruker
(~15 мм рт. ст.). Остаток промывали холодным
WP-200 SY с рабочей частотой
188.31 МГц.
хлороформом. Выход соединения 1а составил 50.6
Химические сдвиги приведены относительно ТМС
и 73.6% соответственно при применении LiH и
(1H) и CFCl3 (19F). Элементный анализ выполнен на
NaH.
приборе PerkinElmer CHN РЕ 2400 SII. Для ТСХ
Люминесцентно-спектральные свойства. Для
использовали пластинки силуфол UV-254
приготовления 2 мл комплекса навеску лиганда
(Chemapol). В работе использовали EuCl3·6Н2О
растворяли в ДМФА для получения концентрации
производства Новосибирского завода редких
10-3 М., после чего разбавляли Трис-буфером рН
металлов, остальные реагенты
- Sigma-Aldrich.
7.2 до концентрации 10-5 М., затем прибавляли
Коммерческие реагенты и растворители, исполь-
10-2 М. раствор Eu3+ в 10-3 М. НСl и 2×10--2 М.
зованные в работе, очищали и готовили в
раствор триоктилфосфиноксида в этаноле.
соответствии с известными рекомендациями [18].
Полученный раствор состава лиганд:Eu:триоктил-
Исходные диацетильные производные конденси-
фосфиноксид = 1×10-5:6.6×10-6:5×10-5 оставляли
рованных ароматических соединений синтези-
для комплексообразования в отсутствие света. В
ровали в соответствии с методикой [19].
некоторые образцы добавляли 10%-ный раствор
Общая методика синтеза лигандов. а. В
Тритона Х-100 в этаноле до достижения
присутствии метилата натрия. Метилат натрия
концентрации поверхностно-активного вещества
(0.9 ммоль), полученный растворением натрия в
0.1%. Через
2 ч и через
2 сут из растворов
абсолютированном метаноле и высушенный,
комплексов отбирали пробы объемом
100 мкл
суспендировали в абсолютном диэтиловом эфире,
для исследования люминесцентно-спектральных
затем при интенсивном перемешивании и
характеристик.
охлаждении (~2-4°С) по каплям прибавляли эфир
КОНФЛИКТ ИНТЕРЕСОВ
фторированной кислоты (0.9 ммоль) и через 20 мин
диацетильное ароматическое производное
(0.3
Авторы заявляют об отсутствии конфликта
ммоль). Реакционную смесь перемешивали при
интересов.
кипячении
4-20 ч (контроль методом ТСХ),
охлаждали до комнатной температуры, обраба-
СПИСОК ЛИТЕРАТУРЫ
тывали 20 мл 15%-ной серной кислоты со льдом.
1. Hemmilä I., Dakubu S., Mukkala V.M., Siitari H.,
Органический слой отделяли, промывали водой
Lövgren T. // Anal. Biochem. 1984. Vol. 137. N 2.
(6×30 мл). Осадок отфильтровывали, промывали
P. 335. doi 10.1016/0003-2697(84)90095-2
холодным эфиром и сушили. Данные спектров
2. Hemmilä I., Laitala V. // J. Fluorescence. 2005. Vol. 15.
ЯМР 1H, 19F, физико-химические характеристики,
N 4. P. 529. doi 10.1007/s10895-005-2826-6
данные элементного анализа, выход веществ
3. Hagan A.K., Zuchner T. // Anal. Bioanal. Chem. 2011.
приведены в табл. 1.
Vol. 400. N 9. P. 2847. doi 10.1007/s00216-011-5047-7
б. В присутствии гидридов металлов. К смеси
4. Yuan J., Matsumoto K. // J. Pharm. Biomed. Anal. 1997.
0.4 ммоль гидрида лития/натрия в
100 мл
Vol. 15. N 9-10. P. 1397. doi 10.1016/S0731-7085(96)
02036-5
абсолютного диэтилового эфира при интенсивном
5. Романов Д.В., Васильев Н.В., Лямин А.И., Иванов-
перемешивании и охлаждении (~2-4°С) по каплям
ская Н.П., Осин Н.С. // Изв. АН. Сер. хим. 2006.
прибавляли
0.4
ммоль метилового эфира
Т.
55.
№ 2. С. 276.; Romanov D.V., Vasil’ev N.V.,
трифторуксусной
кислоты. Через
20
мин
Lyamin A.I., Ivanovskaya N.P., Osin N.S. // Russ. Chem.
прибавляли
0.1 ммоль диацетильного произ-
Bull. 2006. Vol. 55. N 2. P. 276. doi 10.1007/s11172-
водного карбазола. Реакционную смесь пере-
006-0248-5
мешивали при кипячении в течение
4-5 ч
6. Wu F.B., Zhang C. // Anal. Biochem. 2002. Vol. 311.
(контроль методом ТСХ). После охлаждения до
N 1. P. 57. doi 10.1016/S0003-2697(02)00390-1
комнатной температуры выливали в смесь 250 мл
7. Li J., Zhou W., Ouyang X., Yu H., Yang R., Tan W.,
измельченного льда с
15 мл
15%-ной серной
Yuan J. // Anal. Chem. 2011 Vol. 83. N 4. P. 1356. doi
кислоты, прибавляли
100 мл хлороформа и
10.1021/ac102710w
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ФТОРИРОВАННЫЕ БИС-β-ДИКЕТОНЫ КОНДЕНСИРОВАННОГО РЯДА
785
8. Zhang L., Wang Y., Ye Z., Jin D., Yuan J. // Bioconjugate
Heterocycl. Compd. 2018. Vol. 54. N 5. P. 528.
Chem. 2012. Vol. 23. N 6. P. 1244. doi 10.1021/
14. Yamada S., Miyoshi F., Kano K., Ogawa T. // Anal.
bc300075t
Chim. Acta. 1981. Vol. 127. P. 195. doi 10.1016/S0003-
9. Yuan J., Sueda S., Somazawa R., Matsumoto K.,
2670(01)83975-1
Matsumoto K. // Chem. Lett. 2003. Vol. 32. N 6. P. 492.
15. Diamandis E. // Clin. Biochem. 1988. Vol. 21. N 2.
doi 10.1246/cl.2003.492
P. 139. doi 10.1016/S0009-9120(88)80104-8
10. Yuan J., Matsumoto K. // Anal. Chem. 1998. Vol. 70.
16. Кострюкова Т.С., Ивановская Н.П., Затонский Г.В.,
N 3. P. 596. doi 10.1021/ac970936z
Осин Н.С., Васильев Н.В. // Биоорг. хим. 2015. Т.
41. № 2. С. 212; Kostryukova T.S., Ivanovskaya N.P.,
11. Sueda S., Yuan J., Matsumoto K. // Bioconjugate Chem.
Zatonskii G. V., Osin N.S., Vasil’ev N.V. // Russ. J.
2000. Vol. 11. N 6. P.827. doi 10.1021/bc000030r
Bioorg. Chem. 2015. Vol. 41. N 2. P. 186. doi 10.7868/
12. Кострюкова Т.С., Ивановская Н.П., Лямин А.И.,
S0132342315010091
Романов Д.В., Осин Н.С. // ЖОХ. 2012. Т. 82. Вып. 3.
С. 455; Kostryukova T.S., Ivanovskaya N.P., Lyamin A.I.,
17. Steed J.W., Atwood J.L. Supramolecular chemistry.
Romanov D.V., Osin N.S., Zatonsky G.V., Vasil’ev N.V. //
Chichester: Willey&Sons, Ltd, 2000.
Russ. J. Gen. Chem. 2012. Vol. 82. N 3. P. 455. doi
18. Gordon A.J., Ford R.A. The Chemist's companion. New
10.1134/S1070363212030152
York; London; Sydney; Toronto: Wiley-Interscience
13. Пугачёв Д.Е., Кострюкова Т.С., Затонский Г.В.,
Publication, 1972.
Вацадзе С.З., Васильев Н.В. // ХГС. 2018. Т. 54. Вып. 5.
19. Романов Д.В., Осин Н.С., Васильев Н.В., Иванов-
С.
528; Pugachov D.E., Kostryukova T.S., Zaton-
ская Н.П., Лямин А.И., Жедулов А.Е. Пат. РФ
sky G.V., Vatsadze S.Z., Vasil’ev N.V.
// Chem.
2296756 (2007).
Fused Fluorinated Bis-β-diketones and Luminescent-Spectral
Properties of Their Complexes with Europium
D. E. Pugachyova,b, T. S. Kostryukovaa, N. P. Ivanovskayaa, A. I. Lyamina , D. V. Romanova,
S. V. Moiseyeva, G. V. Zatonskiia, N. S. Osina, and N.V. Vasilyeva,b, *
a State Research Institute for Biological Instrumentation, Volokolamskoe sh. 75/1, Moscow, 125424 Russia
*e-mail: nikolai-vasilev@mail.ru
b Moscow State Regional University, Moscow, Russia
Received November 29, 2018; revised November 29, 2018; accepted December 6, 2018
Claisen condensation of diacetylated fused aromatic and heteroaromatic compounds (fluorene, dibenzofuran,
dibenzothiophene, carbazole) with polyfluorocarboxylic acids esters in the presence of bases produced ligands
containing two β-diketonate groups. Their complexation with Eu3+ ions was studied by the luminescence spectral
method.
Keywords: β-diketones, europium complexes, luminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019