ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 5, с. 817-820
ПИСЬМА В
РЕДАКЦИЮ
УДК 547.836.3
ЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ
1,10-ФЕНАНТРОЛИН-5,6-ДИОНА
© 2019 г. C. А. Мильцовa, * В. С. Караванb, В. А. Боринc
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. В. О. 31, Санкт-Петербург, 199004 Россия
*e-mail: smiltsov2004@mail.ru
b Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
c Центр молекулярной динамики Ф. Хабера, Институт химии, Еврейский университет г. Иерусалима, Иерусалим, Израиль
Поступило в Редакцию 11 января 2019 г.
После доработки 25 марта 2019 г.
Принято к печати 27 марта 2019 г.
Разработан метод синтеза
1,10-фенантролин-5,6-диона окислением
1,10-фенантролина в системе
Br2-H2SO4-HNO3.
Ключевые слова: 1,10-фенантролин-5,6-дион, 1,10-фенантролин
DOI: 10.1134/S0044460X19050202
1,10-Фенантролин-5,6-дион 1 (фендион) и его
Авторы оригинальной методики, получившие
производные широко используются в качестве
соединение 1 c 86%-ным выходом, отмечали, что
лигандов для построения полиядерных комплек-
прибавление серной кислоты к смеси
1,10-
сных соединений [1, 2]. Впервые фендион был
фенантролина
2 и бромистого калия нужно
выделен в качестве минорного продукта при
проводить
«очень аккуратно по охлажденной
нитровании 1,10-фенантролина 2 с выходом 5% [3].
стенке реакционного сосуда», так как в противном
Впоследствии было обнаружено, что соединение 1
случае выход целевого продукта может снизиться
может быть получено с низким выходом (<20%)
до нуля
[5]. Причиной этого, по их мнению,
при окислении нитрующей смесью комплекса 2 с
является слишком быстрое выделение бромистого
трехвалентным кобальтом [4]. На данный момент
водорода, который вступает в побочные реакции. В
ходе нашей работы мы воспользовались их
основной и практически единственный способ
методикой, но в серии из
3 экспериментов,
получения фендиона 1, описанный более чем в 200
прибавляя серную кислоту при температурах 0, -30
публикациях, - окисление соединения 2 смесью
и -50°С получили соединение 1 c выходами 21, 30
серной и азотной кислот в присутствии бромистого
и 51% соответственно.
калия (схема 1, метод а) [5]. Обращает на себя
внимание то, что, несмотря на близкое сходство, а
Несмотря на то, что механизм протекания
зачастую и полную идентичность используемых
реакции неясен, очевидно, что бромид калия в
методик, выходы целевого продукта находятся в
данном процессе выступает исключительно в
широком диапазоне от 25 до 99% (например, 25%
качестве источника брома, а азотная кислота
[6], 30% [7], 35% [8], 96% [2], 96% [9], 99% [10]).
играет роль окислителя для генерации последнего.
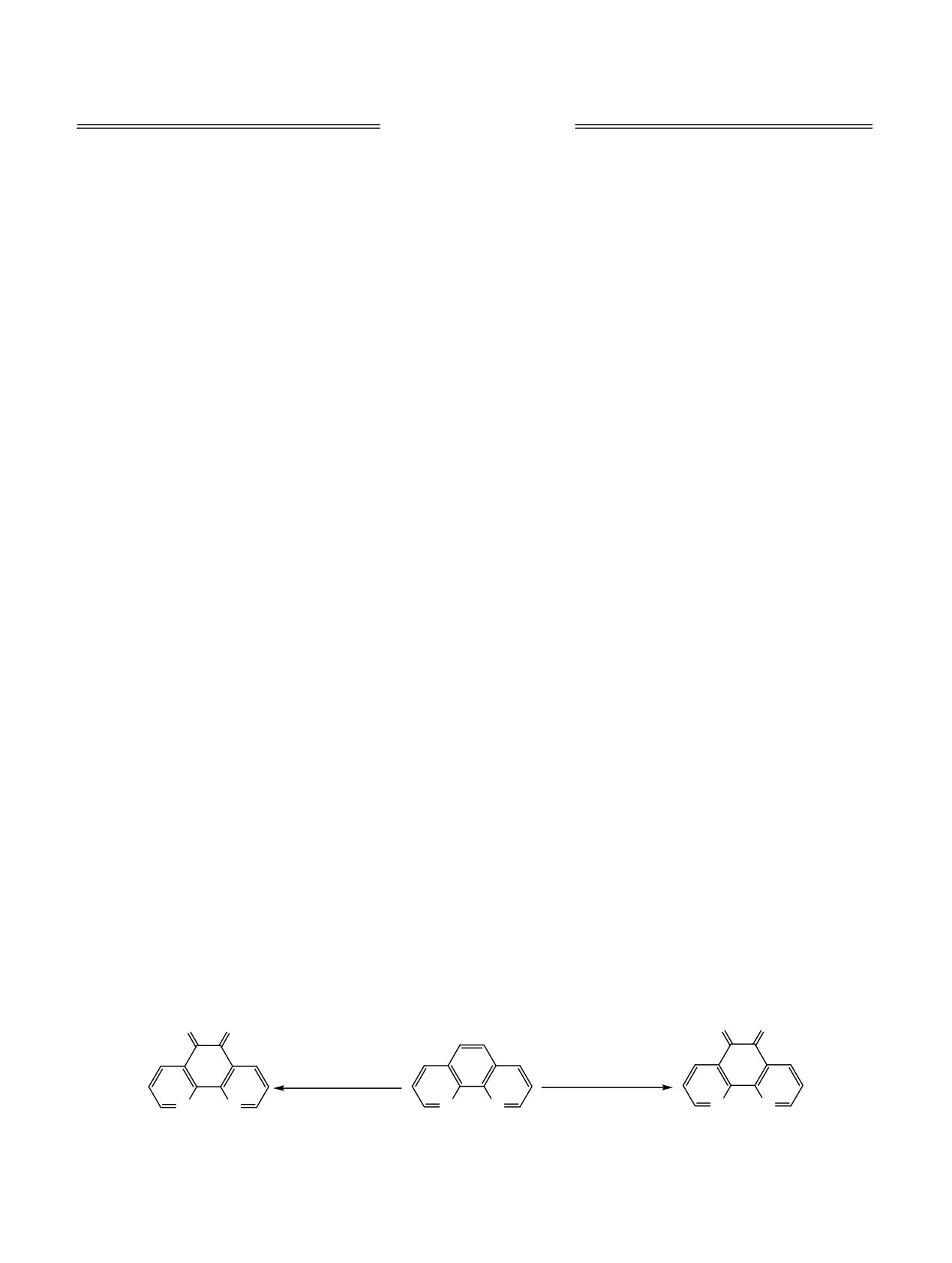
Схема 1.
O O
O
O
б, H2SO4, HNO3, Br2
а, H2SO4, HNO3, KBr
N N
90-95°C, 5 ч
N N
80-150°C, 2-8 ч
N N
2
1 (67-72%)
1 (25-99%)
817
818
МИЛЬЦОВ и др.
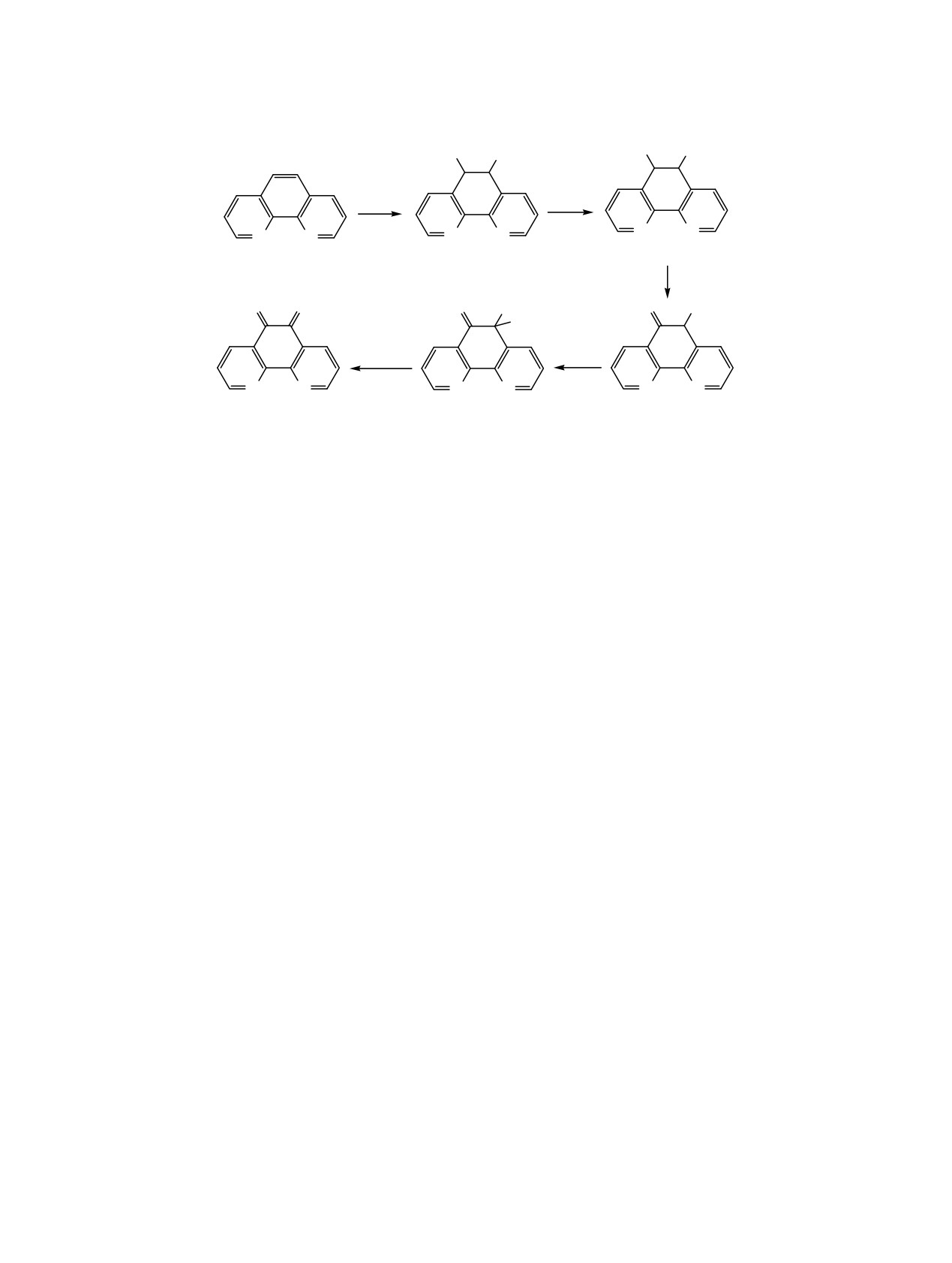
Схема 2.
HO Br
Br
Br
H2O
Br2
N N
N N
N
N
2
5
6
[O]
O O
O Br
O Br
Br
H+, H2O
Br2
N N
N N
N N
1
8
7
В связи с этим, чтобы исключить (или, по крайней
прекращается, поэтому необходимо добавлять
мере, свести к минимуму) образование бромистого
бром по мере его испарения из реакционной смеси.
водорода, мы сочли целесообразным заменить
Некоторые различия в величинах химических сдвигов
бромид калия (10 экв. по отношению к соединению
протонов фендиона объясняются тем, что съемку
2) молекулярным бромом (2.5 экв.). Первоначально
спектров производили без стабилизации по дейтерию.
реакция окисления была проведена при 80°С в
В спектрах ЯМР 1Н реакционной смеси отсут-
течение
2 ч, т. е. в условиях, предложенных
ствуют сигналы, которые можно было бы
авторами работы [5]. При этом в двух опытах
приписать продуктам электрофильного заместитель-
целевое соединение 1 было получено c выходами
ного нитрования или бромирования соединения 2.
58 и 61%. В связи с тем, что в ходе реакции
Следовательно, механизм образования соединения
происходило значительное улетучивание брома,
1 не предполагает их промежуточного получения.
мы попробовали добавлять его по ходу реакции. С
Мы не располагали спектрами
5-бром-1,10-
целью определения оптимальных условий
фенантролина 3 и 5-нитро-1,10-фенантролина 4 в
проведения реакции (времени и температуры)
нитрующей смеси, но сравнение спектров ЯМР 1Н
состав реакционной смеси по ходу процесса
соединений
1,
3
[11] и
4
[12] в ДМСО-d6
анализировали методом ЯМР 1Н. Таким образом,
показывает,
что в спектрах двух последних
мы выяснили, что наилучший выход фендиона 1
соединений присутствуют более низкопольные
(67-72%) достигается при нагревании смеси при 90-
сигналы, чем в спектре соединения 1.
95°С в течение 5 ч (схема 1, метод б). Дальнейшее
повышение температуры оказалось нецелесообраз-
Условия проведения реакции в предложенном
ным, поскольку приводило к закипанию реакцион-
нами варианте существенно более мягкие, чем те, в
ной смеси и очень быстрому улетучиванию брома.
которых синтезируют бром- и нитрозамещенные
производные 1,10-фенантролина 2. Так, например,
Согласно данным ЯМР, фендион образуется
бромирование соединения 2 проводят при 135-
непосредственно в ходе реакции, а не в результате
150°С в 10-30%-ном олеуме в течение 24-72 ч [11,
гидролиза интермедиатов при обработке реакцион-
13, 14]. При этом выход 5-бром-1,10-фенатролина 3
ной смеси. В спектре ЯМР зафиксированы сигналы,
при бромировании соединения 2 в 15%-ном олеуме
принадлежащие интермедиатам неустановлен-ного
существенным образом зависит от соотношения
строения. Можно предположить, что в начале
Br2-соединение 2, температуры и времени реакции,
реакции образуются промежуточные продукты
поскольку при температуре более 135°C и при
присоединения по связи С5-С6, имеющие атомы
соотношении
[Br2]:[2]
>
0.6
наблюдается
водорода неароматического характера с величи-
образование 5,6-дибромпроизводного соединения 2
нами химического сдвигов, лежащими в относи-
и фендиона 1 [11].
тельно высокопольном диапазоне (5.0-6.5 м. д.).
Нитрование соединения 2 проводят с исполь-
После полного обесцвечивания реакционной
зованием нитрующей смеси со 100%-ной азотной
смеси превращение интермедиатов в соединение 1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
ЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ 1,10-ФЕНАНТРОЛИН-5,6-ДИОНА
819
кислотой при 150°С [15], либо с нитратом калия в
СПИСОК ЛИТЕРАТУРЫ
серной кислоте [16].
1. Belser P., Bernhard S., Blum C., Beyeler A., De Cola L.,
На основании сделанных наблюдений нам
Balzani V. // Coord. Chem. Rev. 1999. Vol. 190-192.
представляется возможным предложить в качестве
P. 155. doi 10.1016/S0010-8545(99)00075-2
гипотезы механизм окисления 1,10-фенантролина 2
2. Wendlandt A.E., Stahl S.S. // J. Am. Chem. Soc. 2014.
в фендион 1 (схема 2).
Vol. 136. N 1. P. 506. doi 10.1021/ja411692v
Хлорированные аналоги предполагаемых
3. Inglett G.E., Smith G.F. // J. Am. Chem. Soc. 1950.
интермедиатов 5, 6, 8 описаны в работе [17]; в их
Vol. 72. N 2. P. 842. doi 10.1021/ja01158a051
спектрах ЯМР 1Н присутствуют сигналы в диапазоне
4. Gillard R.D., Hill R.E.E., Maskill E. // J. Chem. Soc.
5.0-6.0 м. д. При действии хлорноватистой кислоты
(A). 1970. N 5. P. 1217. doi 10.1039/j19700000707
происходит переход соединения 2 в фендион 1 (с
5. Yamada M., Tanaka Y., Yoshimoto Y., Kuroda S.
выходом 20%) по пути, включающему образование
Shimao I. // Bull. Chem. Soc. Japan. 1992. Vol. 65. N 4.
хлорированных интермедиатов, аналогичных
P. 1006. doi 10.1246/bcsj.65.1006
структурам 5, 6 и 8. Хотя условия проведения
6. Herrero C., Quaranta A., Fallahpour R-A., Leibl W.,
реакции окислительного хлорирования 2 (водная
Aukauloo A. // J. Phys. Chem. (C). 2013. Vol.
117.
уксусная кислота при 25°С) сильно отличаются от
N 19. P. 9605. doi 10.1021/jp4025816
наших, предложенный на схеме
2 механизм
7. Cardinaels T., Ramaekers J., Nockemann P., Driesen K.,
реакции представляется достаточно вероятным.
Van Hecke K., Van Meervelt Luc., Lei Shengbin., De
Feyter S., Guillon D., Donnio B., Binnemans K. //
Таким образом, нами разработан воспроизводи-
Chem. Mater. 2008. Vol. 20. N 4. P. 1278. doi 10.1021/
мый способ синтеза 1,10-фенантролин-5,6-диона 1
cm070637i
с хорошим выходом и предложен механизм его
8. Zhao Y-L., Hu L., Gruner G., Stoddart J. F. // J. Am.
образования.
Chem. Soc.
2008. Vol.130. N
50. P. 16996. doi
10.1021/ja805393b
1,10-Фенантролин-5,6-дион (1). К охлаждаемой
9. Ettedgui J., Diskin-Posner Y., Weiner L., Neumann R. //
льдом смеси 60 мл H2SO4 (96%) и 30 мл 70%-ной
J. Am. Chem. Soc. 2011. Vol. 133. N 2. P. 188. doi
HNO3 прибавляли при перемешивании последова-
10.1021/ja1078199
тельно 6 г (0.03 моль) тонкоизмельченного 1,10-
10. Zhong C., Huang H., He A., Zhang H. // Dyes Pigm.
фенантролина 2 и 3.8 мл (0.075 моль) брома, после
2008. Vol.
77. N
3.
P
578. doi
10.1016/
чего реакционную смесь нагревали при 90-95°С в
j.dyepig.2007.08.008
течение 5 ч. Через 2 ч нагревания к смеси через
11. Hissler M., Connick W.B., Geiger D.K., McGarrah J.E.,
каждый час добавляли по 1 мл брома, затем смесь
Lipa D., Lachicotte R.J., Eisenberg R. // Inorg. Chem.
выливали в 500 г льда, нейтрализовали 30%-ным
2000. Vol. 39. N 3. P. 447. doi 10.1021/ic991250n
раствором NaOH. Продукты реакции экстрагиро-
12. Nunes A., Djakovitch L., Khrouz L., Felpin F.-X.,
вали хлористым метиленом
(1200 мл). После
Dufaud V. // Mol. Catal. 2017. Vol. 437. P. 150. doi
высушивания экстракта сульфатом натрия раство-
10.1016/j.molcata. 2016.11.017
ритель отгоняли, остаток перекристаллизовывали
13. Pena B., Barhoumi R., Burghardt R.C., Turro C.,
из метанола. Выход 4.9 г (70%), т. пл. 256-259°С
Dunbar K.R. // J. Am. Chem. Soc. 2014. Vol. 136.
(т. пл. 258°С [1]). Спектр ЯМР 1Н (ДМСО-d6), δ, м.
N 22. P. 7861. doi 10.1021/ja503774m
д.: 8.9 д (2Н, J = 6.5 Гц), 8.3 д (2Н, J = 7.5 Гц), 7.6 д.
д (2Н, J1 = 6.5, J2 = 7.5 Гц). Спектр ЯМР 13С
14. Yang W., Nakano T. // Chem. Commun. Vol. 51. N 97.
P. 17269. doi 10.1039/c5cc07005h
(ДМСО-d6), δС, м. д.: 125.74, 129.53, 136.19, 152.76,
154.86, 178.26.
15. Monro S., Scott J., Chouai A., Lincoln R., Zong R.,
Thummel R.P., McFarland S.A. // Inorg. Chem. 2010.
Спектры ЯМР 1H и 13С получены на спектрометре
Vol. 49. N 6. P. 2889. doi 10.1021/ic902427r
BrukerТМ DPX-300 (300 и 75 МГц соответственно).
16. Kelly A.W., Wheaton A.M., Nicholas A.D., Barnes F.H.,
Patterson H.H., Pike R.D. // Eur. J. Inorg. Chem. 2017.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 2017. N. 43. P. 4990. doi 10.1002/ejic.201701052
Авторы заявляют об отсутствии конфликта
17. Antkowiak R., Antkowiak W.Z. // Heterocycles. 1998.
интересов.
Vol. 47. N. 2. P. 893. doi 10.3987/COM-97-S(N)99
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019
820
МИЛЬЦОВ и др.
Effective Method for the Synthesis of 1,10-Phenantroline-5,6-dione
S. A. Miltsova, * V. S. Karavanb, and V. A. Borinc
a Institute of Macromolecular Compounds of the Russian Academy of Sciences,
Bol’shoi pr. V. O. 31, St. Petersburg, 199004 Russia
*e-mail: smiltsov2004@mail.ru
bSt. Petersburg State University, St. Petersburg, Russia
c Fritz Haber Center for Molecular Dynamics, Institute of Chemistry, Hebrew University of Jerusalem, Jerusalem, Israel
Received January 11, 2019; revised March 25, 2019; accepted March 27, 2019
A method was developed for the synthesis of 1,10-phenanthroline-5,6-dione by oxidation of 1,10-phenanthroline
in the Br2-H2SO4-HNO3 system.
Keywords: 1,10-phenanthroline-5,6-dione, 1,10-phenanthroline
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 5 2019