ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 6, с. 860-878
УДК 544.34
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ
НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ В ТРОЙНЫХ
ВОДНО-СОЛЕВЫХ СИСТЕМАХ
© 2019 г. М. Ю. Скрипкин*, Л. В. Черных, О. Н. Пестова, В. Э. Баранаускайте,
К. А. Бурков, И. В. Замятин, Л. В. Степакова, И. М. Гусев, А. О. Горбунов,
Н. А. Богачев, Г. Л. Старова
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: m.skripkin@spbu.ru
Поступило в Редакцию 7 марта 2019 г.
После доработки 7 марта 2019 г.
Принято к печати 12 марта 2019 г.
Проанализировано влияние ионных взаимодействий в тройных водных и водно-органических растворах
галогенидов металлов на строение равновесной с раствором твердой фазы. Приведена оригинальная
классификация двойных и комплексных солей, отражающая особенности их структуры, и определены
условия формирования различных типов этих соединений. Выявлены факторы, определяющие
сохранение окружения иона металла при переходе раствор-твердая фаза.
Ключевые слова: водные и водно-органические растворы, галогениды металлов, двойные соли,
комплексные соли, кристаллосольваты
DOI: 10.1134/S0044460X19060051
Проблема генетической связи химических форм
(двойных, комплексных солей, индивидуальных и
в растворе и кристаллизующихся из него
смешанных кристаллосольватов) из растворов к их
соединениях - одна из наиболее актуальных в
направленному, теоретически обоснованному
неорганической химии растворов и гетерогенных
синтезу
- ключевому фактору дальнейшего
водно-солевых систем. Несмотря на то, что
развития столь перспективного направления
отдельные аспекты данного вопроса, такие как
современного материаловедения, как жидкофазный
сохранение или трансформация координационного
синтез неорганических материалов. Данная статья
полиэдра иона металла в процессе перехода
посвящена одному из основных аспектов указан-
раствор→твердая фаза, тождественность отдель-
ной проблемы, а именно, влиянию конкуренции
ных ионных группировок в растворе и твердой
сольватации, ацидокомплексообразования и ион-
фазе, динамика растворения и кристаллизации на
ионной ассоциации в растворах на формирование
молекулярном уровне, изучаются достаточно
твердой фазы.
давно, до сих пор отсутствуют четкие
представления о том, какие из протекающих в
К настоящему времени существует ограни-
многокомпонентных растворах процессов и в
ченное число работ, анализирующих связь форм
какой степени определяют состав, строение и
существования химических соединений в растворе
условия кристаллизации соединений. Это особенно
и в равновесной с ним твердой фазе. В работах
касается систем с конкурирующим ацидокомп-
шведских исследователей [1] основное внимание
лексообразованием и конкурирующей сольвата-
уделяется сопоставлению структурных параметров
цией. Раскрытие основных закономерностей
сольватокомплексов в растворе и в твердой фазе.
генезиса химических форм в растворе, а также их
При этом, как правило, рассматриваются разбав-
трансформации в процессе образования твердой
ленные растворы, что связано с определенными
фазы позволяет перейти от эмпирического поиска
ограничениями ключевого используемого метода -
путей получения различных типов соединений
EXAFS-спектроскопии, а изменение состава и
860
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
861
строения координационной сферы катиона с
именно такой электронной конфигурации (а в
увеличением
концентрации
рассматривается
случае систем MX2-M'X2-H2O - наличие указан-
крайне редко. Наблюдаемые различия между
ной конфигурации у обоих ионов).
строением сольватокомплексов в растворе и
Х. Баларев и Р. Духлев предложили также
твердой фазе увязываются обычно со стери-
подход [5], позволяющий предсказывать состав
ческими факторами, особенностями кристалли-
окружения ионов металла в соединениях. С их
ческой решетки и т. д.
точки зрения наиболее вероятный состав
В насыщенных растворах карбоксилатов
координационной сферы отвечает условию
металлов наблюдается образование агрегатов,
максимума суммы произведений параметров
строение которых подобно строению твердой фазы
жесткости катионов и лигандов. Данный подход
[2]. Однако при этом остается открытым вопрос о
позволил предсказать окружение ионов металлов в
том, какие именно процессы, протекающие в
некоторых неизвестных ранее соединениях [6].
жидкой фазе, определяют образование таких
Вместе с тем, неполный учет влияния процессов
агрегатов.
в растворе приводит к ряду исключений из
выведенной закономерности. Например, в работе
В работе [3] подробно рассматривается переход
[7] обосновывается отсутствие ветви кристал-
от разбавленного раствора (ионы в исходной сетке
лизации комплексных солей в системе KBr-CuBr2-
воды) к ионным или ионно-водным кластерам, а
H2O, тогда как нами было обнаружено присутствие
далее - к водно-электролитному расплаву. Предло-
соответствующей ветви кристаллизации на
жены типы наиболее вероятных ионных
изотерме растворимости данной системы при 25 и
группировок в концентрированных растворах и
50°С
[8], а сама соль KCuBr3 выделена и
показано соответствие изломов на концентра-
охарактеризована методами рентгеноструктурного
ционных зависимостях различных свойств (в
анализа и колебательной спектроскопии
[9].
первую очередь, диэлектрической проницаемости
Предсказание состава координационной сферы
раствора) точкам смены типа твердой фазы
иона металла достаточно успешно работает в
(эвтоническим точкам). Однако вопрос о соответ-
случае дискретных ионов, но при образовании
ствии строения ионных кластеров в растворе и
полимерных структур (в случае галогенидов цинка,
строения твердой фазы остается во многом открытым.
кадмия, меди и т. д.) оно выполняется плохо.
Одна из наиболее последовательных концепций,
В отличие от данного подхода на кафедре
описывающих критерии формирования твердой
общей и неорганической химии Санкт-
фазы в многокомпонентных водно-солевых растворах,
Петербургского государственного университета на
была развита Х. Баларевым и Р. Духлевым [4]. В
протяжении многих лет успешно ведутся работы
основе их подхода лежат представления об
по выявлению связи между процессами в растворе,
устойчивости образующихся кристаллических
присутствующими в нем химическими формами, с
структур, в то время как процессы в растворе
одной стороны, и типом кристаллизующихся
практически не рассматриваются. Образование
соединений, их строением, - с другой. Именно
сложных соединений (двойных и комплексных
подход, основанный на учете взаимодействий в
солей) в тройных водно-солевых системах
растворах, представляется наиболее плодотворным
происходит, по их мнению, в тех случаях, когда
и обладающим наибольшей предсказуемостью.
деформация координационных полиэдров ионов
металлов, происходящая при переходе от раствора,
Роль конкуренции сольватации и ион-
в котором окружение катиона имеет высокую
ионной ассоциации. Необходимым условием
симметрию, к твердой фазе не сопровождается
кристаллизации двойных и комплексных солей
существенным повышением свободной энергии
является образование в растворе термодина-
системы. Анализ возможных электронных конфи-
мически устойчивых и кинетически инертных
гураций ионов показывает, что такое условие
частиц - первичных строительных блоков твердой
выполняется для сферически симметричного
фазы. Ими могут быть инертные акваацидо-
распределения электронной плотности частицы: s0,
комплексы металлов (в случае галогенидов
p0, d10, d5 (высокоспиновая конфигурация). Фактор,
переходных металлов), а также контактные или
способствующий образованию двойных или
сольвато-разделенные ионные пары (в случае
комплексных солей, -наличие у центрального иона
солей непереходных элементов). Поскольку
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
862
СКРИПКИН и др.
Таблица
1. Энергии взаимодействия ион-вода (Е1), аквакатион-молекула воды или анион во второй
координационной сфере [E2(H2O), E2(Cl)] и времена пребывания молекул воды и хлорид-ионов (τ) в первой
координационной сфере катиона [10-13]
E2(H2O),
E2(Cl),
Существование двойных
Mz+
E1, кДж/моль
τ(Н2О), с
τ(Сl-), с
кДж/моль
кДж/моль
солей
Be2+
402.7
122
> 3×10-4
-
Mg2+
266.3
78
83.8
2×10-6
+
Ca2+
163.7
67
3×10-10
4×10-9
+
Sr2+
83.0
6×10-11
<10-10
-
Ba2+
71.8
4×10-11
<10-10
-
Li+
97.4
42.4
5×10-10
5×10-9
+
непосредственное экспериментальное определение
первой гидратной сфере вследствие существенно
энергии взаимодействия катион металла-молекула
меньшего значения энергии взаимодействия ион
воды, молекула воды в первой координационной
металла-вода. Ионы стронция и бария не образуют
сфере-молекула воды или анион во второй сфере
достаточно прочной первой гидратной сферы,
неосуществимо,
для
выявления
условий
чтобы протекало образование двойных солей по
формирования двойных солей были привлечены
типу внешнесферной координации катиона к
данные компьютерного моделирования - квантово-
акваиону металла, вместе с тем контактные ионные
химических расчетов, молекулярной динамики
пары М2+·Cl- в данном случае слишком лабильны,
(табл.
1). Из приведенных данных видно, что
чтобы служить центром образования двойных
причина отсутствия двойных солей в системах,
солей.
содержащих галогениды бериллия (за исклю-
чением фторида),
- высокая прочность второй
Анализ свойств жидкой и твердой фазы в
сольватной сферы; в случае галогенидов магния
системах MgX2-MX-H2O (X = Cl, Br) позволил
близкие значения энергий взаимодействия
сделать вывод о том, что несмотря на формальное
гексааквакатиона металла с молекулами воды и
сходство кристаллизующихся двойных солей (в
хлорид-ионами определяют возможность внешне-
большинстве систем происходит кристаллизация
сферной координации последнего с сохранением
карналлитов MX·MgX2·6H2O со схожей струк-
неизменной частицы Mg(H2O)2+; в растворах
турой, рис.
1)
процессы, обусловливающие
галогенидов кальция и лития вполне возможно
образование этих соединений, различны. Наиболее
частичное (или полное) замещение молекул воды в
отчетливо это различие проявляется на темпе-
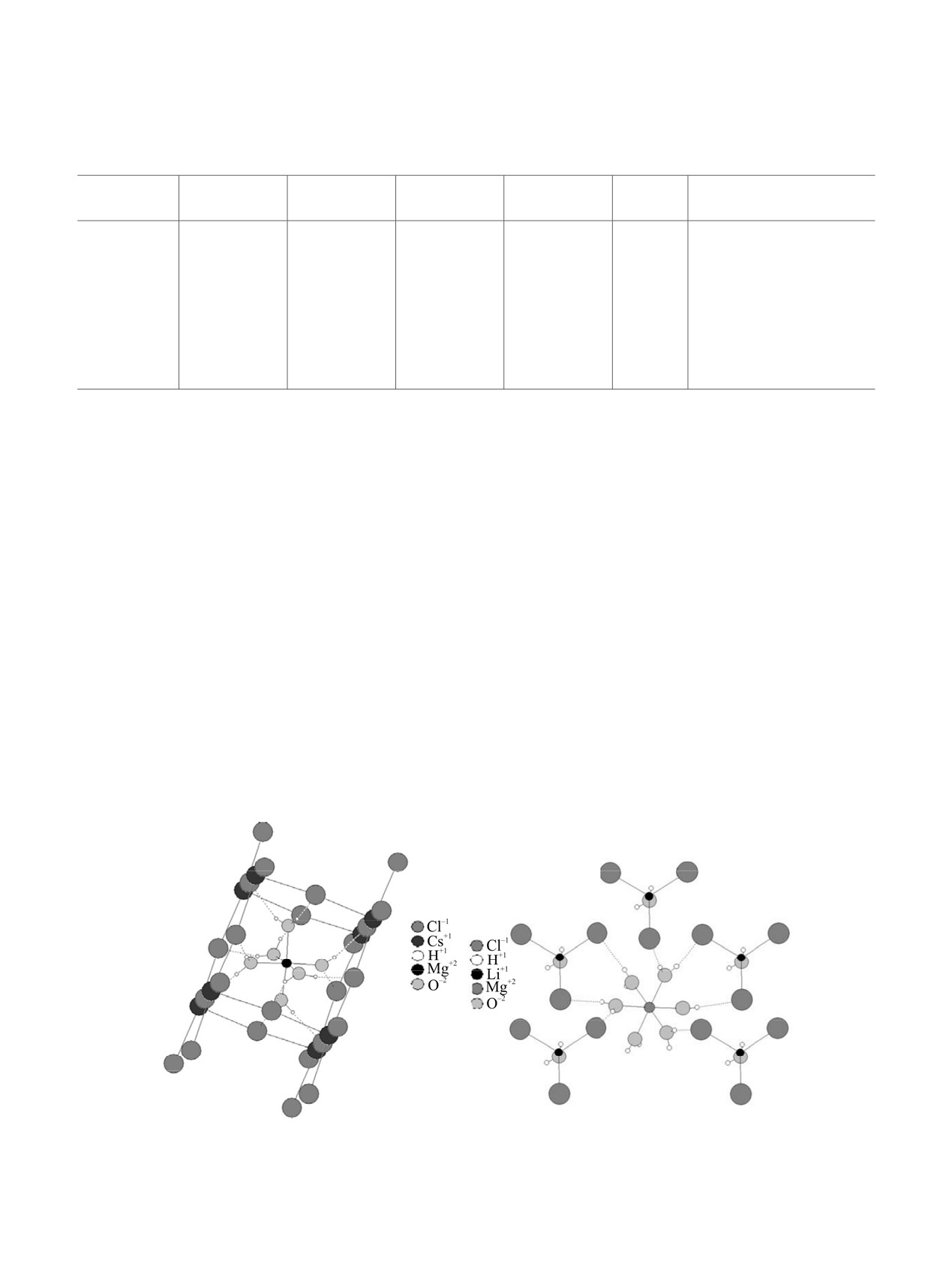
(а)
(б)
Рис. 1. Окружение иона магния в структуре карналлита [16] (а) и двойной соли LiCl·MgCl2·7H2O [17] (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
863
Таблица 2. Свойства двойных солей
ΔG°, кДж/моль [14, 15]
d(M-Cl), Å
М
r(M+) + r(Cl-), Å
[16]
0°С
25°С
50°С
Li
-0.20 ± 0.12
-1.57±0.10
-1.98 ± 0.11
K
-7.03±0.10
-6.69±0.08
-5.99±0.12
3.24
3.14
NH4
-10.61±0.10
-10.44±0.05
-10.27±0.08
3.34
3.24
Rb
-12.11±0.14
-14.35±0.06
-18.00±0.11
3.30
3.30
Cs
-7.30±0.17
-9.72±0.12
-13.85±0.15
3.40
3.48
ратурной зависимости отклонений активности
тройного раствора от аддитивной величины.
воды от правила Здановского (т. е. изменении
Свободная энергия образования двойных солей из
активности тройного раствора при смешении
исходных средних солей с увеличением тем-
изотонических бинарных растворов, рис.
2), а
пературы возрастает по абсолютному значению,
также на характеристиках твердой фазы
-
расстояния M-Х в тройной соли не превышает
температурной зависимости свободной энергии
суммы кристаллографических радиусов ионов.
образования двойных солей из исходных средних
Указанные факты позволяют предположить, что
солей (табл.
2)
и кристаллографических
образование двойных солей в данных системах
характеристиках двойных солей.
определяется во многом процессами образования
контактных ассоциатов
М+Х- (константы
В системах с галогенидами калия и аммония
ассоциации K°асс составляют при 25°С 0.62 для
наблюдаются небольшие отклонения изоактиват
хлорида цезия, 0.43 для хлорида рубидия, 1.17 для
воды от прямолинейности, уменьшающиеся с
бромида цезия [18]), усиливающимися как при
возрастанием температуры. Данный факт, а также
добавлении избыточного количества галогенид-
небольшие отклонения вязкости тройного раствора
ионов, так и с увеличением температуры.
от аддитивной величины указывают на отсутствие
Образующиеся ассоциаты вытесняют молекулы
в тройном растворе принципиально новых по
воды из второй гидратной сферы иона магния, и
сравнению с бинарными растворами взаимо-
образование двойных солей в этих системах
действий. Таким образом, можно предположить,
происходит как результат внешнесферной
что основной процесс, определяющий формиро-
ассоциации ионных пар М+Х- гексааквакатионом
вание твердой фазы в таком растворе, как и в
магния. Отличие в состоянии аквакатионов магния
бинарном растворе хлорида магния,
- это
в рассматриваемых тройных растворах отчетливо
внешнесферная ассоциация галогенид-ионов к
иллюстрирует
появление
низкочастотной
гексааквакатиону металла, несколько усиливаю-
компоненты у полосы колебания A1g в спектре КРС
щаяся при добавлении второго компонента. С
аквакатиона магния (рис.
3). Следует также
возрастанием
температуры
внешнесферная
отметить, что под влиянием аквакатиона магния
ассоциация, протекающая через образование
происходит сильное изменение окружения иона
водородных связей Mg2+-OH2-X-, ослабевает, что
цезия по сравнению с индивидуальным хлоридом
и приводит как к уменьшению отклонений от
цезия, координационное число катиона умень-
правила Здановского, так и к уменьшению
шается с 8 до 6.
значений ΔG° образования двойной соли из
исходных средних солей. Расстояние М-X в
Принципиально иная ситуация наблюдается в
двойной соли для этих соединений значительно
тройных системах MgX2-LiX-H2O. В этих системах
превышает сумму ионных радиусов.
строго
выполняется правило Здановского,
Иная ситуация наблюдается в тройных системах
наблюдаются большие положительные отклонения
с галогенидами рубидия и цезия. Эти растворы
вязкости раствора от аддитивности, что
характеризуются большими отклонениями актив-
свидетельствует об отсутствии в тройной системе
ности воды от правила Здановского, увеличиваю-
процессов, приводящих к высвобождению воды.
щимися с возрастанием температуры, большой
Образование двойных солей наблюдается только в
областью отрицательных отклонений вязкости
области высоких концентраций хлорида лития,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
864
СКРИПКИН и др.
(а)
ν, см-1
Рис. 3. Фрагмент спектров КРC 2 М. раствора MgCl2
(1) и смеси 2 М. раствора MgCl2 и 5 М. CsCl2 (2).
m(MgCl2), моль/кг H2O
(б)
когда в тройном растворе в расчете на 1 ион лития
приходится менее 2 молекул воды. Происходит
образование двойных солей по типу структурно-
вынужденного сопряжения
[20], при этом в
двойной соли, как и в растворе, ион лития
реализует координационное число 4, а не 6, как в
кристаллогидратах хлорида лития.
При
0°С еще не достигается концентрация
хлорида лития в бинарном растворе, необходимая
для формирования структуры одноводного хлорида
лития (из раствора кристаллизуется дигидрат). При
добавлении избыточного количества хлорид-ионов
происходит перестройка структуры, что и приво-
O
m(MgCl2), моль/кг H2
дит к очень небольшим отрицательным значениям
(в)
ΔG° образования этой двойной соли.
В системах с галогенидами кальция
наблюдается только два типа двойных солей. Один
из них представляет собой продукт структурно-
вынужденного сопряжения кристаллогидратов и
кристаллизуется
в
тройных системах с
галогенидами лития (например, двойная соль
LiCl·CaCl2·5H2O). Другой тип двойных солей
наблюдается в присутствии галогенидов цезия
(рис.
4). Как и в случае галогенидов магния
происходит
«сольватация» ионов металла
ассоциатами Cs+X-, при этом значительно меньшая
по сравнению с аквакатионом магния энергия
связи
Са2+-ОН2
определяет
возможность
m(MgCl2), моль/кг H2O
вхождения ионной пары в первую координацион-
ную сферу иона кальция. Среднее расстояние
Cs+-Cl--(Са2+)
в
образующейся структуре
практически равно сумме ионных радиусов (3.56 и
Рис. 2. Активность воды в системах MgCl2-MCl-H2O
3.55 Å соответственно).
вдоль линии смешения изотонических бинарных
растворов (aw
= 0.75) при 0 (а), 25 (б) и 50°С. На всех
В тройной системе LiCl-CsCl-H2O наблюдается
рисунках снизу-вверх M = K, NH4, Rb, Cs.
еще один тип двойных солей
[20]. Наряду с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
865
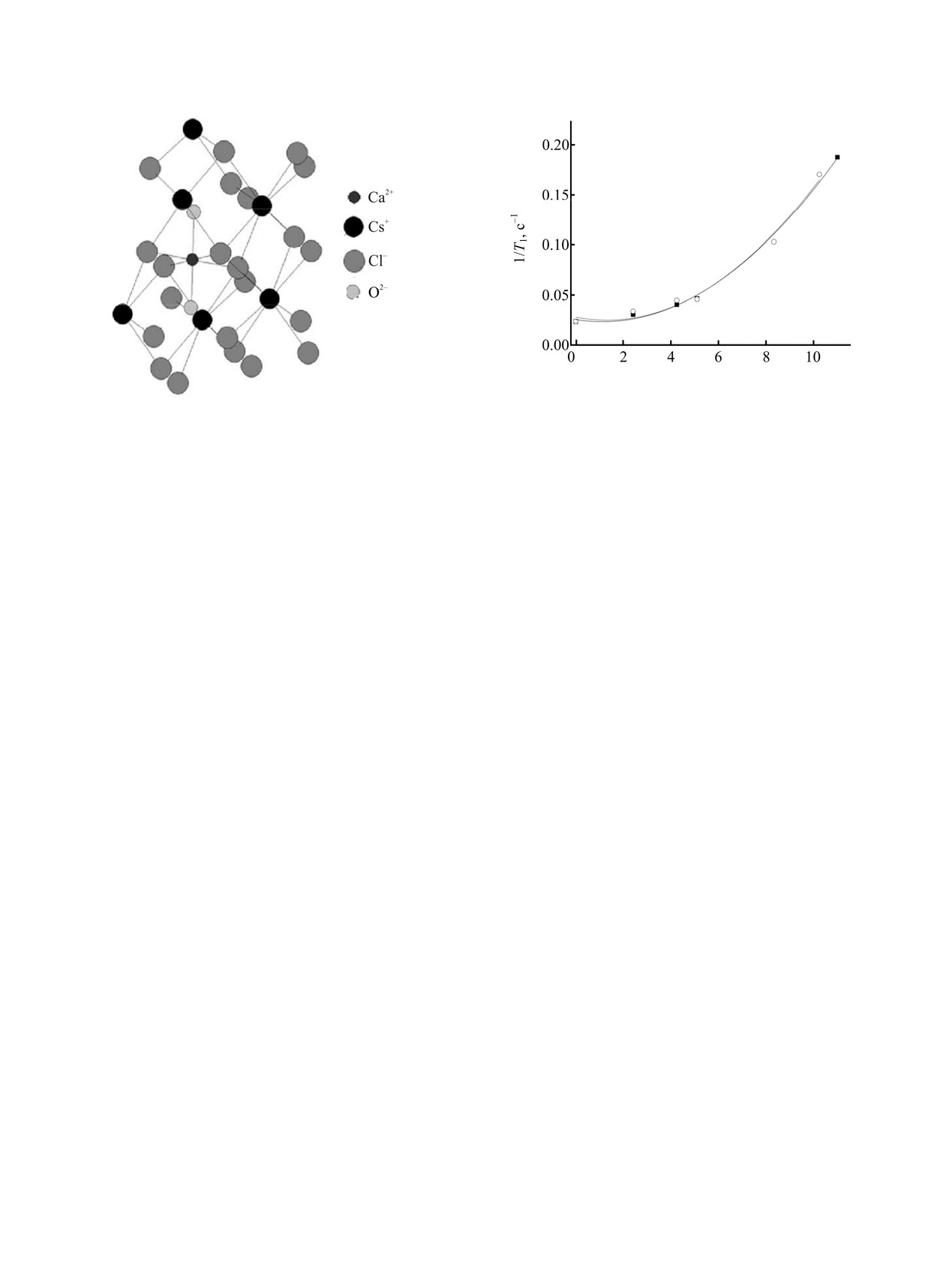
m(Cl-), моль/кг
Рис.
5. Изменение скорости ядерной магнитной
Рис.
4.
Фрагмент структуры двойной соли
релаксации на ядрах 7Li в бинарной системе LiCl-H2O
2CsCl·CaCl2·2H2O [19].
(○) и тройной системе LiCl-CsCl-H2O (■).
соединением 4LiCl·3CsCl·2H2O, при образовании
цепь, которая стабилизируется ионами хлора,
которого наблюдается сольватация иона лития
встраивающимися между звеньями цепи. Таким
ассоциатами Cs+Cl-, в области меньшей концен-
образом, процесс диффузии представляется как
траций иона лития происходит формирование
«скачкообразные» движения молекул воды, обмен
соединения LiCl·3CsCl·4H2O.
между звеньями. Тогда передача одной молекулы
воды дальше по цепи, т.е. удаление одной
На рис.
5 приведено изменение скорости
молекулы воды из тетраэдра лития, должен
ядерной магнитной релаксации на ядрах 7Li в
приводить к перераспределению оставшихся трех
бинарной системе LiCl-H2O и в тройной системе
молекул воды вокруг катиона Li+ и соответ-
по секущей, лежащей в поле кристаллизации
ствующему изменению градиента электрического
указанной двойной соли. Добавление хлорида
поля. Из полученных данных видно, что для
цезия практически не оказывает влияния на
бинарной и тройной системы, по сути, этот
скорость релаксации, т. е. зависимость скорости
механизм не изменяется на протяжении всего
релаксации 7Li от концентрации Cl-, как важного
концентрационного
диапазона.
В первом
фактора изменения градиента электрического поля,
приближении можно сказать, что идентичность
одинакова для бинарной и тройной систем.
механизмов релаксации свидетельствует об
Так как в исследуемой системе наиболее
идентичности ближайшего окружения иона лития в
вероятный механизм релаксации для лития
-
бинарном и тройном растворах. Известно [22], что
квадрупольный, т. е. определяющим фактором
наиболее устойчивым типом окружения иона лития
является изменение градиента электрического поля
в растворе является тетраэдр с 4 молекулами воды
(ГЭП), то следует уточнить, какие именно
в вершинах. Во всем концентрационном диапазоне
изменения происходят в растворе, и как они
существуют тетраэдры лития, окруженные
влияют на ГЭП. Логично было бы предположить,
молекулами воды, а ассоциация ионов цезия с
что основное влияние должен оказывать анион Cl-,
хлорид-ионами приводит к образованию второй,
так как в тетраэдре Li(H2O)+ электронная
относительно независимой структуры. Соответ-
плотность распределяется симметрично и не
ственно и двойная соль кристаллизуется в резуль-
создает никакого градиента электрического поля.
тате сочетания двух относительно независимых
Однако проведенные расчеты [21] показывают, что
структур и состоит из изолированных тетраэдров
ГЭП, который создавал бы анион хлора, находясь
Li(H2O)+ и слоев ассоциированного хлорида цезия
за пределами первой гидратной сферы лития, в
(рис. 6).
десять раз меньше, чем создаваемый молекулами
воды в гидратном комплексе лития.
Формированию двойных солей по типу внешне-
Согласно модели, описанной в работе
[21],
или внутрисферной ассоциации способствует раз-
гидратированные ионы лития выстраиваются в
упорядочения структуры раствора, а потому
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
866
СКРИПКИН и др.
(а)
(б)
Рис. 6. Структура двойных солей LiCl·3CsCl·4H2O (а) и 4LiCl·3CsCl·2H2O (б) [23].
наблюдается для крупных малозарядных катионов
чивость
которых
определяется
фактором
(калий-цезий). Ион натрия не относится к данному
толерантности t
= (rA
+ rC)/√2(rB
+ rC).
типу, а также не формирует кристаллогидратную
Перовскитоподобная структура реализуется при
структуру в растворе, что и определяет отсутствие
значениях фактора толерантности 0.80 ≤ t ≤ 1.05.
двойных солей в системах с галогенидами натрия.
Ниже приведены значения факторов толерантности
для перовскитов с различными катионами (табл. 3).
Правомочность сделанных заключений о
Как видно из приведенных данных, выход за
влиянии внешнесферного катиона на тип
пределы
указанного
значения
фактора
кристаллизующейся двойной соли была проверена
толерантности приводит не только
к смене
на ряде систем MgX2-NR4X-H2O (катионы
структурного типа, но даже к изменению состава
тетраалкиламмония часто рассматриваются как
двойной соли.
продолжение ряда щелочных катионов). Как и
следовало ожидать, в системе с достаточно сильно
Роль конкуренции ацидокомплексообразо-
ассоциированным галогенидом тетраметиламмо-
вания и ион-ионной ассоциации. Аналогичный
ния наблюдается образование двойной соли,
подход был применен нами и при рассмотрении
аналогичной цезиевому карналлиту, а в остальных
влияния процессов в растворе на образование
случаях наблюдается внешнесферная координация
комплексных солей в системах, содержащих
к иону магния не ионного ассоциата, а только
дигалогениды переходных металлов и галогениды
галогенид-аниона [24].
щелочных металлов или аммония. Очевидно, что
Если тип двойной соли зависит, на наш взгляд, в
для образования таких соединений должно
первую очередь от процессов, протекающих в
произойти замещение молекул воды в первой
концентрированных растворах, то ее структура во
гидратной сфере катиона галогенид-ионами.
многом определяется кристаллохимическим фак-
Данный процесс будет протекать
легче в
тором. Карналлиты MX·MgX2·6H2O относятся к
присутствии в растворе катионов, разрушающих
перовскитоподобным структурам АВС3, устой-
его структуру, в первую очередь, ионов цезия.
Таблица 3. Значения факторов толерантности для перовскитов с различными катионами
M+
K+
NH+
Rb+
Cs+
NMe+
NEt+
NBu+
t
1.02
1.00
0.99
0.94
0.83
0.72
0.59
Структура перовскита
-a
-a
а Образуются двойные соли NEt4Br·MgBr2·8H2O и 4NBu4Br·MgBr2·6H2O соответственно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
867
(а)
(б)
Рис. 7. Структура соединений LiCuCl3·2H2O [27] (а) и KCuCl3·2H2O [28] (б).
Поэтому в системах со слабым комплексо-
[CuXn(H2O)6-n]Mn-2. К данному типу относятся
образованием (β1 <
10-1: MX-CoX2-H2O, MX-
соли KCuCl3·2H2O, K2CuCl4·2H2O, (NH4)2CuCl4·
NiX2-H2O
[25]) кристаллизация комплексных
2H2O, (NH4)2CuBr4·2H2O, KCuBr3 (рис. 7). Если
солей при 25°С происходит только, если один из
катион второго электролита обладает высоким
компонентов - галогенид цезия. Дополнительными
сродством к аниону, и как следствие этого,
факторами, способствующими кристаллизации
константа устойчивости ацидокомплексов М'X+ и
комплексных солей, могут также служить образо-
константа ассоциации второго электролита M+-X-
вание клатратоподобных структур в растворе
различаются менее чем на порядок, то происходит
вокруг катионов алкиламмония, приводящее к
координация ионной пары M+-X-. В результате
уменьшению содержания воды, доступной для
кристаллизуются комплексные соли 3, образую-
гидратации катиона металла, и разрушению второй
щиеся в результате координации ионных пар M+Х-
сольватной сферы катиона. В таких тройных
ионом-комплексообразователем, - [X2Cu(X-Cs+)n]:
системах нами также обнаружено образование
сильная ассоциация хлорида цезия в бинарном
комплексных солей [26] и повышение темпера-
растворе определяет возможность участия ионных
туры, усиливающее ацидокомплексообразование.
пар Cs+Cl- наряду с хлорид-ионом в качестве
лиганда в процессе комплексообразования, как это
Константы устойчивости ацидокомплексов
происходит при образовании соединений CsCuCl3,
меди(II) на порядок выше, например, для комлекса
Cs2CuCl4, Cs3Cu2Cl7·2H2O, Cs4Cu3Cl10·2H2O, CsCuBr3,
CuCl+ константа устойчивости β1 = 4.4 [18]. В этом
Cs2CuBr4.
случае в тройных системах можно проследить
Указанные заключения полностью подтвер-
образование трех типов комплексных солей (1-3).
ждаются
кристаллографическими
данными
Если в системе присутствуют два сильногидра-
(сравнением расстояний М+-Х- в комплексной
тированных катиона, то по мере концентрирования
соли и суммы ионных радиусов), а также мень-
раствора происходит перекрывание гидратных
шими значениями валентных силовых постоянных
сфер катионов, наблюдаемое и в структуре
связи Cu-X ([9], табл. 4) для соединений 3 по
твердых солей LiCuCl3·2H2O, Li2CuBr4·2H2O (1,
сравнению с соединениями 2.
рис. 7). Если энергия гидратации катиона второго
электролита невелика, и он не образует
При усилении ацидокомплексообразования
-
устойчивых ассоциатов, то по мере концен-
при переходе к галогенидам кадмия (β1 =37 для
трирования раствора происходит замена молекул
CdCl+, 180 для CdBr+) и к галогенидам меди(I), β2
воды в координационной сфере катиона-комплексо-
(CuCl–) = 1.1×106 [18], происходит нивелирование
образователя на ацидолиганд. В результате
влияния внешнесферного катиона на строение
кристаллизуются комплексные соли 2, образую-
комплексных солей. Комплексные галогениды
щиеся вследствие ацидокомплексообразования
кадмия относятся к типу 2 или 3, а комплексные
галогенид-иона с центральным катионом меди и
галогениды меди(I) - исключительно к типу
2
внешнесферной координации катиона М+
-
(табл. 5).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
868
СКРИПКИН и др.
Таблица 4. Сравнение усредненных расстояний М-Х в
окружения ионов меди Cu+ при переходе из
комплексных галогенидах меди(II) и сумм ионных
твердой фазы в насыщенный раствор [35]. Для
радиусов, силовые постоянные связей CuX
[9] в
систем, включающих галогениды двухвалентной
комплексных соединениях
меди, существенное различие колебательных ИК
спектров насыщенных растворов и твердофазных
сложных соединений указывает на значительное
K(CuX),
Соединение
d(M-X), Å
изменение ближайшего окружения иона меди Cu2+
Н/см
при переходе из твердой фазы в раствор. Сдвиг и
уширение полос поглощения в ИК спектрах
LiCuCl3·2H2O
2.97 [27]
2.57
1.01, 0.73а
свидетельствует о замене галогенид-лиганда на
воду и сосуществовании нескольких форм
K2CuCl4·2H2O
3.32 [28]
3.19
1.23, 0.58
комплексов в насыщенном растворе.
(NH4)2CuCl4·2H2O
3.36 [29]
3.35
1.33, 0.65
Для определения усредненного строения первой
(NH4)2CuBr4·2H2O
3.51 [30]
3.63
1.06, 0.78
координационной сферы иона Cu2+ в жидкой фазе
были сняты EXAFS-спектры насыщенных
KCuBr3
3.46 [9]
3.34
0.91, 0.65
растворов комплексных галогенидов меди(II) [35]
CsCuCl3
3.44 [31]
3.48
1.03, 0.50
(табл. 6). Сопоставление полученных межатомных
Cs2CuCl4
3.48 [31]
3.48
1.09
расстояний медь-галоген в насыщенных растворах
с кристаллографическими данными твердофазных
CsCuBr3
3.55 [32]
3.63
0.83, 0.60
комплексных соединений показало, что в
Cs2CuBr4
3.63 [32]
3.63
0.88
насыщенных растворах изученных комплексов
а Наличие нескольких значений силовых постоянных связей
доминируют анионные формы комплексов. По-
обусловлено неравноценностью связей металл-лиганд в
видимому, их образование - необходимое условие
экваториальных и аксиальных положениях.
кристаллизации
данных
соединений.
В
большинстве систем доминируют моноядерные
формы: длины связей в ацидокомплексном анионе
Таблица 5. Сравнение усредненных расстояний М-Х в
твердофазного соединения K2CuCl4·2H2O
(1.97,
комплексных галогенидах меди(I) и сумм ионных
2.28 и
2.89 Å для Cu-Oeq, Cu-Cleq и Cu-Clax
радиусов
соответственно) практически равны межатомным
Соединение
d(M-X), Å
r(M+) + r(X-) , Å
расстояниям первой координационной сферы в
K2CuCl3
3.27 [33]
3.19
насыщенном растворе: 1.98, 2.29 и 2.90 Å для
Cu-Oeq, Cu-Cleq и Cu-Clax. Соответственно, усиление
NH4Cu2Cl3
3.42 [34]
3.35
конкуренции ионов металла за галогенолиганд
Cs3Cu2Cl5
3.55 [35]
3.48
приводит к переходу от соединений с дискретными
комплексными анионами к полимерным.
K2CuBr3
3.40 [35]
3.34
Только в системе, включающей галогениды
Cs3Cu2Br5
3.77 [35]
3.63
лития, возможно образование полиядерных частиц.
Соединение LiCuCl3·2H2O существует в твердой
Для выявления сохранения или трансформации
фазе в виде димерных ацидокомплексов
координационной сферы ионов одно- и
Cu2Cl8(H2O)4-, поскольку относится к типу
1
двухвалентной меди в процессе кристаллизации
комплексных соединений, кристаллизующихся в
были сопоставлены колебательные спектры
системах CuXn-MX-H2O в результате структурно-
твердой фазы и насыщенного раствора с
вынужденного сопряжения кристаллогидратов.
коррекцией на спектр растворителя. Можно
Длины концевых и мостиковых связей Cu-Cl в
предположить, что сохранение ближайшего
экваториальной плоскости димера 2.25 и 2.34 Å
окружения иона меди Cun+ должно приводить к
соответственно, - в среднем 2.29 Å, что совпадает
сходству колебательных спектров, а именно, к
с
полученным в насыщенном растворе
отсутствию сдвига полос соответствующих
межатомным расстоянием медь-хлорид (2.30 Å).
валентных колебаний Cu-X. Такая картина
Таким образом, в насыщенном растворе
наблюдается в случае одновалентной меди, что
LiCuCl3·2H2O комплексные анионы меди, по-
свидетельствует об идентичности ближайшего
видимому, образуют димеры.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
869
Таблица 6. Окружение иона меди(2+) в комплексных галогенидах и соответствующих насыщенных
Раствор
Твердая фаза
Раствор
Твердая фаза
Связь
Связь
К. ч.
r, Å
К. ч.
r, Å
К. ч.
r, Å
К. ч.
r, Å
LiCuCl3·2H2O
LiCuBr3·2H2O
Cu-Oeq
1.06а(12)
2.02(8)
0
Cu-Oeq
1.58(11)
2.02 (7)
Cu-Cleq
2.94(12)
2.31(10)
4
2.28
Cu-Breq
2.42(14)
2.43(8)
Cu-Oax
2.00б(14)
2.40(20)
2
2.60
Cu-Oax
2.00(16)
2.42 (18)
K2CuCl4·2H2O
KCuBr3
Cu-Oeq
2.88(12)
2.02(8)
2
1.97
Cu-Oeq
1.44(12)
1.98(6)
0
Cu-Cleq
1.12(12)
2.32(9)
2
2.28
Cu-Breq
2.56(10)
2.39(6)
4
2.43
Cu-Clax
2.00(14)
2.92(14)
2
2.89
Cu-Brax
2.00(14)
3.27(12)
2
3.31
(NH4)2CuCl4·2H2O
(NH4)2CuBr4·2H2O
Cu-Oeq
2.71(12)
1.96(6)
2
1.98
Cu-Oeq
2.64(11)
1.96(8)
2
1.94
Cu-Cleq
1.29(12)
2.26(8)
2
2.30
Cu-Breq
1.36(14)
2.38(7)
2
2.41
Cu-Clax
2.00(14)
2.93(12)
2
2.87
Cu-Brax
2.00(14)
3.21(11)
2
3.14
а Суммарное количество лигандов в экваториальном положении во всех случаях было принято равным четырем и не уточнялось в
ходе обработки данных. б Возможность присутствия различных лигандов в аксиальных положениях не рассматривалась.
Несмотря на изменение соотношения галогенид-
системах кристаллизация сложных соединений
и аквалигандов в составе первой координационной
начинается при доминировании различных
сферы меди(II) в растворе по сравнению с
анионных форм.
твердофазным соединением, молекулы воды
Системы с конкурирующим ацидокомплексо-
занимают в ближайшем окружении иона Cu2+
образованием. Системы, включающие галогениды
экваториальные положения, как и в твердой фазе.
нескольких
d-элементов,
MX2-M'X2-H2O,
Замещение галогенид-ионов аквалигандами также
характеризуются конкуренцией ионов металла в
происходит в экваториальной плоскости. В
растворе за галогенолиганд, то есть протеканием
насыщенных растворах галогенокупратов(II) лития
конкурирующего
ацидокомплексообразования.
при замещении галогенидов на воду в
Исследование растворов методами электронной
экваториальной плоскости координация молекул
спектроскопии поглощения и ЯМР на ядрах 113Cd
воды в аксиальных положениях сохраняется
[36] полностью подтвердило предположение о том,
(Cu-Oax 2.59 и 2.60 Å в насыщенном растворе и
что стандартные константы устойчивости
твердой фазе соответственно).
галогенокомплексов могут быть использованы для
Суммируя данные колебательной и EXAFS
оценки направления сдвига конкурирующих
спектроскопии, можно заключить, что сильное
равновесий в концентрированных растворах.
ацидокомплексообразование определяет высокое
Сопоставление литературных данных по
сходство галогенидных комплексов меди(I) в
константам устойчивости ацидокомплексов [18],
растворе и в твердой фазе. В обеих фазах
собственных и литературных [36-40] данных по
ближайшее окружение одновалентной меди
строению кристаллизующихся в системах данного
представляет собой искаженный тетраэдр.
типа соединений позволило установить опреде-
Существенный вклад гидратационных процессов в
ленные
корреляции
между
указанными
свойства растворов, включающих дигалогениды
характеристиками.
меди,
обусловливает
изменение строения
координационной сферы иона Cu2+ при переходе из
В случае большой (более одного порядка)
твердой фазы в раствор. Во всех исследованных
разницы в константах устойчивости ацидокомп-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
870
СКРИПКИН и др.
(а)
(б)
(в)
Рис. 8. Структура соединений 2MX2·M’X2·12H2O (а), MX2·2M’X2·12H2O (б) и MX2·4M’X2·10H2O (в).
лексов кристаллизуются соединения 1, в которых
состав моноядерного аниона) составляют четыре
катион (M2+), образующий комплексы с меньшими
хлорид-иона и две молекулы воды, тогда как в
константами устойчивости, окружен молекулами
аналогичном соединении с моноядерным анионом,
воды, а второй ион (M'2+) содержит в первой
включающим кадмий, - 2MgCl2·CdCl2·12H2O, -
координационной
сфере
галогенид-ионы.
окружение иона кадмия состоит из шести хлорид-
Соединения
1 кристаллизуются, например, при
ионов (рис. 8).
М = Mn, Co, Ni и M' = Cd. К этому же типу
Анализ литературных данных показал, что
относятся и сложные соединения, в которых один
состав большинства соединений указанного типа (в
из катионов вообще не образует комплексы с
том числе, кристаллизующихся в системах MX2-
хлорид-ионом, но обладает большим сродством к
CdX2-H2O, М = Mn, Co, Ni) соответствует одной из
воде (например, соединение MgCl2·2CdCl2·12H2O).
трех формул:
2MX2·M'X2·12H2O, MX2·2M'X2·
Если аквакатион всегда является моноядерным, то
12H2O или MX2·4M'X2·10H2O. С позиций
анион может быть как моно- (например, анион
концепции Баларева и Духлева [6], с повышением
CdCl4- в соединении 2NiCl2·CdCl2·12H2O), так и
жесткости катиона М2+ (Ni2+ < Co2+
< Mn2+)
полиядерным (полианион
{Cd4Cl10(H2O)2-}n в
преимущественно должна происходить кристалли-
соединении CoCl2·4CdCl2·10H2O). Если рассмат-
зация первого соединения. Однако на практике
ривать образование твердофазных сложных
наблюдается обратная картина (кристаллизация
соединений как результат комплексообразования,
всех трех соединений в системе с хлоридом никеля
то увеличение констант устойчивости анионных
и только одного - MX2·4M'X2·10H2O - в системе с
ацидокомплексов должно понизить отношение
хлоридом марганца), что полностью объясняется
количества молекул воды к количеству галогенид-
возрастанием устойчивости хлорокомплексов в
ионов n(H2O)/n(Х-) в первой координационной
растворе при переходе от никеля к марганцу.
сфере иона металла, входящего в состав
комплексного аниона. Эта закономерность действи-
Исходя из сформулированных выше принципов
тельно наблюдается: в соединении MgCl2·CoCl2·
можно ожидать, что при повышении устойчивости
8H2O окружение иона кобальта (входящего в
хлорокомплексов катиона M2+ будет возрастать
Рис.
9. Структура соединения 2ZnCl2·CdCl2·6H2O.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
871
(ΔрK1
<
0 и pK1
<
0 для обоих металлов)
хлорида цинка ZnCl2·4/3H2O, ZnCl2·5/3H2O и,
вероятность вхождения хлорид-ионов в первую
возможно, ZnCl2·5/2H2O [42]. В первом случае
координационную сферу иона M2+ в твердой фазе,
цинк частично замещает кобальт в катионе
т. е. образующиеся сложные соединения будут
Co(H2O)2+, тогда как в других происходит, по-
представлять собой гетерополиядерные ацидокомп-
видимому, частичное замещение цинка на кобальт.
лексы
2.
Анализ структур соединений
Такая способность к взаимному замещению
CuCl2·CdCl2·4H2O и 2ZnCl2·CdCl2·6H2O (рис.
9)
связана с тем, что кристаллографические радиусы
[36] показал правильность сделанных выводов: оба
ионов кобальта и цинка очень близки: 0.82 Å для
соединения не содержат дискретных аквакатионов,
Co2+ и 0.83 Å - для Zn2+ [43]. Подобного замещения
а являются гетерополиядерными хлорокомплексами:
не происходит в других аналогичных системах (см.
соединение CuCl2·CdCl2·4H2O содержит фрагменты
далее), что говорит о важности фактора близости
[-Cu-Cl-Cd-], а ZnCl2·CdCl2·2H2O - [-Zn-Cl-Cd-].
радиусов. Однако одного «размерного» фактора, по-
видимому, недостаточно для того, чтобы проис-
Образование такого рода структур не должно
ходило образование твердых растворов. Mета-
приводить к эквивалентности окружения обоих
стабильный безводный хлорид цинка, а также
атомов M и M'. Можно предположить, что в силу
гидраты хлорида кобальта в рассматриваемой
меньшей устойчивости комплексов отношение
тройной системе кристаллизуются в виде
n(H2O)/n(Cl) для первой координационной сферы
индивидуальных соединений
[42]. Образование
катиона M2+ (Zn2+, Cu2+) будет выше, чем для
твердых растворов в рассматриваемой системе
катиона M'2+ (Cd2+). Кроме того, указанное
можно связать с тем, что ступенчатые константы
соотношение для катиона M'2+ (Cd2+) в сложном
устойчивости всех хлорокомплексов цинка
соединении должно быть ниже, чем в гидрате
достаточно близки [18], в отличие от подавля-
бинарного хлорида (CdCl2·5/2H2O), а для катиона
ющего большинства других катионов, когда
M2+ - выше или таким же (в силу склонности к
наблюдается существенное понижение ступен-
поликонденсации), чем в соответствующих
чатых констант устойчивости хлорокомплексов
гидратах бинарных хлоридов (ZnCl2·4/3H2O и
при повышении ступени комплексообразования. В
CuCl2·2H2O). Данные рентгеноструктурного анализа
результате становится возможным своеобразное
[36] показали правильность такого предположения:
диспропорционирование промежуточных аква-
в то время, как ион кадмия во всех случаях
хлорокомплексов, что приводит к образованию в
окружен шестью хлорид-ионами, ион меди
твердой фазе полиэдров с разным окружением
окружен двумя молекулами воды и четырьмя
цинка (октаэдрическим и тетраэдрическим). Поэтому
хлорид-ионами (окружение Cu2+ полностью
замещение катиона Co(H2O)2+ на Zn(H2O)2+ можно
соответствует таковому в дигидрате хлорида
представить себе как реализацию подобной
меди), а ион цинка - двумя молекулами воды и
структуры с сосуществующими аквакатионом и
двумя хлорид-ионами, т. е. отношение n(H2O)/n(Cl)
тетрахлорокомплексом. Уместно также отметить,
для иона Zn2+ в этом соединении выше, чем в
что авторы работы
[42], исходя из факта
гидрате бинарного хлорида цинка ZnCl2·4/3H2O [41].
замещения кобальта на цинк в соединении
Из приведенного анализа следует, что подход,
CoCl2·ZnCl2·6H2O
в
достаточно
широком
основанный на учете влияния комплексообра-
диапазоне концентраций, не без оснований
зования в растворе на состав и структуру твердой
предполагают, что гидрат ZnCl2·3H2O, устойчивый
фазы, применим и в случае систем с
при низкой температуре, имеет координационную
конкурирующим комплексообразованием. Однако,
формулу
[Zn(H2O)2+][ZnCl2-]. К сожалению,
как уже было замечено ранее, большую роль в
структура этого кристаллогидрата пока не
образовании сложных соединений могут играть
подтверждена рентгенографически, однако на
кристаллохимические факторы, не связанные
возможность реализации такого строения косвенно
напрямую с процессами в растворе. Это становится
указывает известная структура ZnBr2·2H2O-
явным при рассмотрении некоторых деталей,
[Zn(H2O)2+][Zn2Br2-].
связанных с образованием сложных соединений.
В твердой фазе, благодаря способности к
B системе CoCl2-ZnCl2-H2O кристаллизуются
поликонденсации, катион Zn(H2O)2+ зачастую
сразу четыре ряда твердых растворов: на основе
заменяется на фрагмент
[-Cl-Zn(H2O)4-Cl-]. B
сложного соединения CoCl2·ZnCl2·6H2O, гидратов
гидрате ZnCl2·4/3H2O два атома цинка тетраэдрически
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
872
СКРИПКИН и др.
окружены хлорид-ионами, а третий входит во
способности (стабилизация катионной части) и
фрагмент Zn(H2O)4Cl2. Хотя структура как твердых
сильного ацидокомплексообразования (стабили-
растворов, кристаллизующихся в системе CoCl2-
зация анионной части). Смешанный растворитель
ZnCl2-H2O (исключая твердый раствор, основанный
вода-ТГФ
сильно
разупорядочен
из-за
на структуре соединения CoCl2·ZnCl2·6H2O), так и
гидрофобной гидратации объемных органических
большинства гидратов хлорида цинка до сих пор
молекул
[44]. Это приводит к разрушению
неизвестна, есть основания полагать, что в этих
межмолекулярных водородных связей воды,
твердых растворах происходит замещение
увеличению
числа
свободных
молекул
фрагментов Zn(H2O)4Cl2 на Co(H2O)4Cl2
[фраг-
растворителя и, как следствие, к усилению
менты Zn(H2O)4Cl2, как было указано выше, входят
сольватирующей силы растворителя. Среди общих
в состав гидрата ZnCl2·4/3H2O], связанное с
черт систем 1 стоит отметить сильно выраженное
тенденцией иона кобальта быть окруженным
ацидокомплексообразование, высокую сольватиру-
преимущественно молекулами воды (из-за
ющую способность растворителя и переход
сравнительно малой устойчивости хлорокомплек-
структуры твердой фазы от полимера (гидрат) к
сов) и цинка - иметь в одном соединении два
островной (координационное диспропорциони-
разных типа окружения (тетраэдрическое и окта-
рование в чистом органическом растворителе).
эдрическое). Этот пример наглядно показывает,
что при образовании сложных соединений важную
Растворимость систем 2 лежит ниже линии,
роль играют как чисто химические (константы
соединяющей крайние точки изотермы. Системы 2
устойчивости), так и кристаллохимические факторы.
разделены на три группы: включающие сульфаты
металлов (а), бинарный растворитель вода-диоксан
Системы, содержащие бинарный водно-
(б) и часть галогенидных систем (в), особенно с
органический растворитель. В развитие
хлоридами никеля и кадмия, а также с бромидами
указанных исследований в последние годы на
меди, кадмия и кобальта. Несмотря на одинаковый
кафедре общей и неорганической химии активно
вид изотерм растворимости, причины такого
ведется изучение формирования твердой фазы в
поведения в системах трех групп разные.
системах с конкурирующей сольватацией, в том
Растворитель вода-диоксан обладает наимень-
числе, в системах, содержащих бинарный водно-
шими значениями диэлектрической проницаемости
органический растворитель, растворимость в
среди всех изученных [12], что приводит к сильной
которых меньше (системы
1) или больше
ионной ассоциации. Немаловажно здесь также то,
аддитивной
величины
(системы
2),
и
что молекула диоксана - бидентатный лиганд -
промежуточный вариант (системы 3). Установлена
выступает связкой между атомами металла при
связь
между протекающими в растворе
построении полимерной структуры твердой фазы
взаимодействиями, растворимостью в тройной
[45]. Подобные полимеры, как правило, обладают
системе и строением кристаллизующейся твердой
низкой растворимостью, что в сочетании с низкой
фазы (табл.
7). Как видно из приведенных в
диэлектрической проницаемостью и донорной
таблице данных, системы
1 включают иодид
способностью растворителей приводит к резкому
кадмия и бромид меди, а в качестве органического
уменьшению растворимости.
компонента - тетрагидрофуран. Эти две группы,
хоть и отнесены к одному типу, имеют различную
В растворах сульфатов металлов доминирует
природу доминирующих процессов. Иодид кадмия
образование сольваторазделенных ионных пар
и бромид меди - единственные из всех изученных
между двухзарядными катионом и анионом. В
солей существуют при 25°С в виде безводной соли,
смешанных и особенно в органических раство-
а не в качестве кристаллогидрата. Этот важный
рителях это выражено еще сильнее, чем в воде, так
факт обусловливает то, что при растворении соли
как взаимодействие молекул воды с сильно
ее структура легко разрушается за счет
донорными
органическими
растворителями
сольватации и, как следствие, растворимость при
приводит к ослабеванию гидратации сульфат-
добавлении органического растворителя возрастает.
ионов. Органические растворители, как известно,
В чистых органических растворителях эти соли
обладают низкими значениями акцепторных чисел
образуют кристаллосольваты с островной
[12], т. е. слабо сольватируют анионы, поэтому те,
структурой, в которых анионная и катионная части
в свою очередь, сильнее притягиваются к катионам
разделены вследствие сильной сольватирующей
металлов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
873
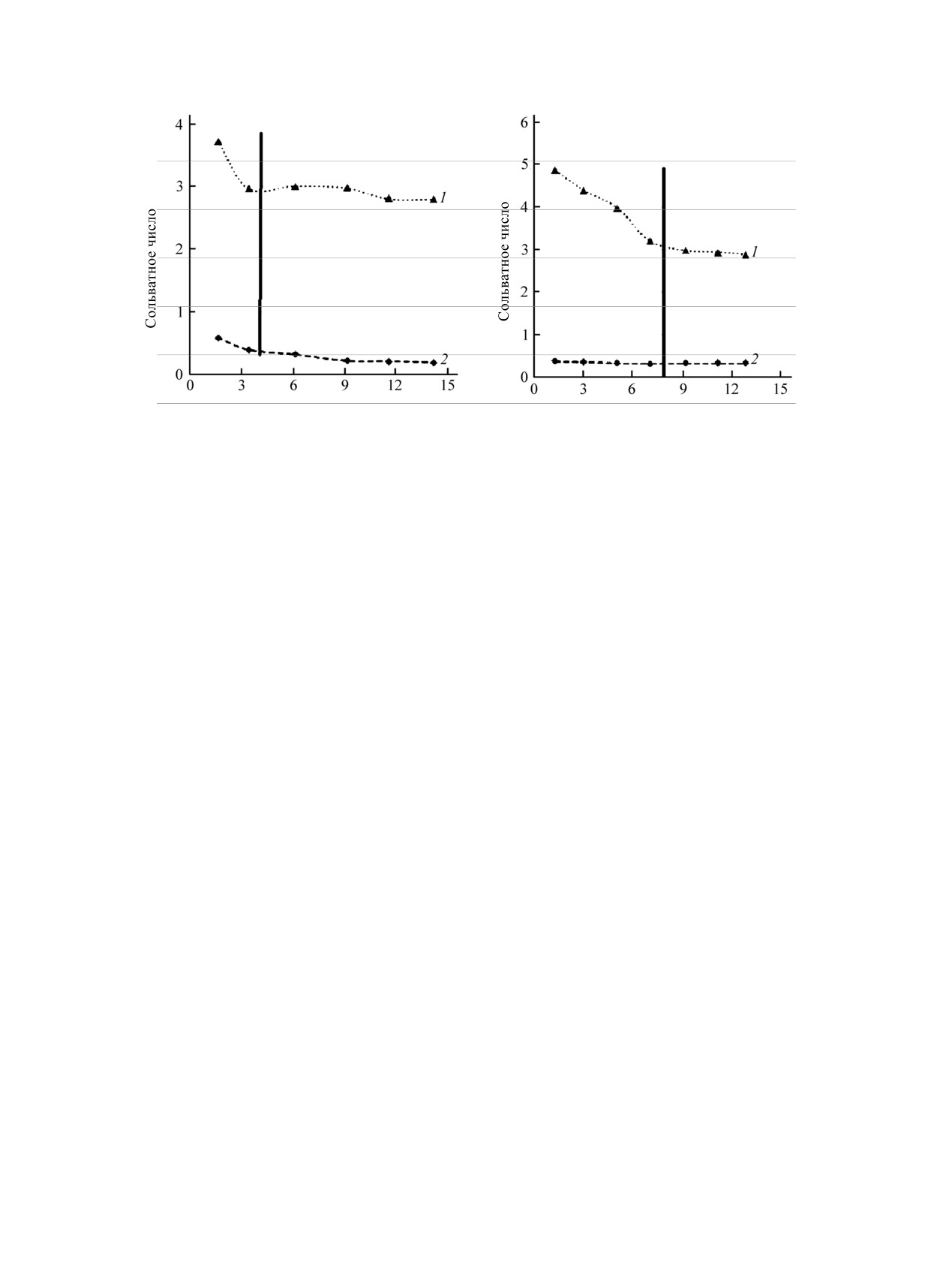
Таблица 7. Связь между взаимодействиями в водно-органических растворах, растворимостью и строением
равновесной твердой фазыа
Параметр
Системы 1
Примеры тройных систем
CdI2-H2O-Solvа,
MX2-H2O-TГФб
CuBr2-H2O-ДМФА/диметилацетамид
Устойчивость ацидокомплексов
Высокая
Донорная способность
Высокая
растворителя
Степень ассоциации
Высокая
Низкая (разупорядоченность)
растворителя
Доминирующие процессы
Координационное диспропорционирование
Сольватация
Строение твердой фазы
Полимер (безводная соль)→островная (координационное диспропорционирование)
Параметр
Системы 2
Примеры тройных систем
MSO4-H2O-Solvв
MX2-H2O-диоксан
NiCl2-H2O-Solv, CuHlg2-H2O-
ДМСО,
CoBr2-H2O-ДМСО/
ДМФА, CdCl2-H2O-Solv, CdBr2-
H2O-ДМФА/диметилацетамид
Устойчивость ацидокомплексов
-
Высокая
Средняя
Донорная способность
Высокая
Низкая
Высокая
растворителя
Степень ассоциации
Высокая
Низкая
Высокая
растворителя
Доминирующие процессы
Ионная ассоциация
Молекулярная
Конкуренция сольватации и
ассоциация
комплексообразования
Строение твердой фазы
Полимер (гидрат) → полимер (сольват)
Параметр
Системы 3
Примеры тройных систем
CuCl2-H2O-ДМФА/диметилацетамид,
CoCl2-H2O-Solv, CoBr2-H2O-диметилацетамид, CdBr2-H2O-ДМСО
Устойчивость ацидокомплексов
Средняя
Донорная способность
Высокая
растворителя
Степень ассоциации
Высокая
растворителя
Доминирующие процессы
Конкуренция сольватации и комплексообразования
Строение твердой фазы
Полимер (гидрат)→ островная (координационное диспропорционирование)
а Кроме системы с диоксаном. б Кроме CdCl2. в Кроме CuSO4-H2O-ДМСО.
Группа систем 2 включает хлориды никеля и
фазы: все перечисленные соли образуют
кадмия, а также бромиды меди, кобальта и кадмия.
полимерные кристаллогидраты в воде, при
К общим чертам этой группы можно отнести
переходе от воды к чистому органическому
среднее по силе комплексообразование (например,
растворителю сохраняется полимерная структура,
кадмий образует более слабые комплексы с хлорид-
причем как правило, мостиковыми лигандами
ионами, чем с иодидами), высокую ассоцииро-
являются галогенид-ионы. Такое же сохранение
ванность бинарного растворителя. Наиболее
полимерной структуры по всей изотерме
важная особенность систем 2 - структура твердой
наблюдается и для систем с сульфатами металлов и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
874
СКРИПКИН и др.
Таблица 8. Состояние растворителей в смешанных кристаллосольватаха
Состав кристаллосольвата
Органический растворитель
Вода
Строение, по данным РСА
CuSO4·3.5Н2О·DMSO
К
Оба типа
CuCl2·H2O·2DMSO
К
Н
CuCl2·H2O·DMF
К
Кeq
Полимер (мостиковый Cl)
CuCl2·0.5DMA·1.5H2O
К
К
CuCl2·H2O·0.5THF
К
К
CuBr2·DMF·H2O
К
Н
CuBr2·0.5THF·H2O
К
К
CoCl2·2DMF·4H2O
К
К
Мономер
CoCl2·2DMF·2H2O
К
К
мономер
CoBr2·3DMA·2H2O
К
К
CoBr2·2DMA·H2O
К
К
CoBr2·2DMF·1.5H2O
К
К
CoCl2·DX·2H2O
К
К
Полимер (мостиковый DX)
CuCl2·2DX·2H2O
К
Кeq
Мономер
CuCl2·2DX·H2O
К
К
CuBr2·2DX·2H2O
Оба типа
Кeq
Полимер (мостиковый DX)
CuBr2·DX·2H2O
К
Кeq
Полимер (мостиковый DX)
а К - координированный к иону металла, Н - нет координации, DX - диоксан, eq - указание на координацию в экваториальном
положении.
растворителем вода-диоксан. Таким образом,
гипотетической линии. Принципиальное отличие
несмотря на различия между этими тремя
от систем
1
- более слабо выраженное
группами системы 2, их общая черта - полимерная
комплексообразование и наличие полимерных
структура твердой фазы.
кристаллогидратов. В то же время в системах 3
происходит переход к островной структуре в
Системы 3 включают хлориды меди и кобальта,
отличие от систем 2.
а также по одной системе с бромидами кобальта и
кадмия. Изотерма растворимости лежит ниже
Таким образом, природа доминирующих
линии, соединяющей крайние точки, но при
процессов в растворах и структура равновесной
повышении доли органического растворителя
твердой фазы определяют форму изотермы
растворимость увеличивается (в некоторых
растворимости в тройной системе. В ряде
системах достаточно резко) и становится выше
изученных систем наблюдалось образование не
гипотетического значения. При этом происходит
только индивидуальных, но и смешанных
переход от полимерной структуры (кристалло-
кристаллосольватов. В табл. 8 приведены основные
гидрат) к островной (координационное диспропор-
сведения о строении таких соединений. Из
ционирование). При увеличении доли органи-
приведенных данных видно, что во всех
ческого растворителя уменьшается концентрация
кристаллосольватах,
включающих диоксан,
воды, что и приводит к уменьшению раство-
молекулы воды координированы к центральному
римости кристаллогидрата. Именно из-за этого
атому в экваториальную позицию, так как
уменьшения
растворимость
лежит
ниже
донорная способность воды выше, чем у диоксана.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
875
n(CdBr2)/100 моль растворителя
n(CdI2)/100 моль растворителя
Рис. 10. Диаграммы сольватации ионов кадмия в смесях вода-ДМСО с мольной долей органического компонента 0.88.
1 - доля молекул ДМСО, 2 - доля молекул воды; вертикальной линией отмечена аддитивная растворимость.
Вместе с тем, органические молекулы в одном из
растворах должны образовываться частицы с
соединений занимают обе позиции - как в первой
составом, близким к равновесной твердой фазе, т.
координационной сфере, так и в пустотах решетки.
е. прекурсоры твердой фазы. Для определения
В случае смесей вода-ТГФ, где оба растворителя
среднего состава координационной сферы ионов
близки по донорной способности (18.9 и 20.0 ккал/моль
металла в растворе был использован метод ИК
соответственно) наблюдается наиболее сильная
спектроскопии, позволяющий при определенной
конкуренция за координационные позиции у
математической
обработке
интенсивностей
центрального атома. В системах с наиболее
соответствующих
сигналов
растворителя
донорными органическими растворителями (ДМСО),
определить индивидуальные сольватные числа,
в некоторых соединениях молекулы воды не
т. е. количество молекул растворителя, координи-
координированы к центральному атому, так как
рованных к иону металла [46].
вытеснены органическими и анионными лигандами.
Как показали полученные результаты [46, 47],
Изучение растворимости и состава и строения
сходство составов первой сольватной сферы и
твердой фазы, а также сольватации катионов в
равновесной твердой фазы характерно для систем
смешанных растворителях в широком диапазоне
1, где растворимость лежит выше аддитивной
концентраций соли позволило проследить связь
величины. В системах 1 и 2 (только в тех областях
между процессами в растворе и формированием
изотермы, где растворимость лежит выше линии,
твердой фазы. B ряде случаев должна
соединяющей крайние точки) состав сольватной
существовать
связь
и между формами
сферы в концентрированных растворах корре-
существования
ионов металла в растворе и
лирует с составом равновесной твердой фазы:
равновесной с ним твердой фазе. На качественном
после достижения определенной концентрации
уровне эта взаимосвязь проявляется в сходстве
состав сольватной оболочки уже не изменяется,
формы и положения полос в ИК спектрах
наблюдается формирование прекурсоров твердой
насыщенных растворов и равновесной твердой
фазы.
По-видимому, именно превышение
фазы для некоторых соединений. Указанное
растворимостью линии, соединяющей крайние
сходство проявляется при соблюдении следующих
точки изотермы, приводит к формированию
условий: координационное число ионов металлов в
прекурсоров твердой фазы в растворе, т.е.
твердой фазе равно 4 или 6, достаточно высокая
концентрация раствора становится выше, чем если
концентрация насыщенного раствора.
бы растворитель представлял собой чисто
Это качественное
сходство
позволило
механическую смесь. B качестве примера (рис. 10)
предположить, что совпадение должно быть и на
приведены диаграммы сольватации бромида и
количественном уровне - в концентрированных
иодида кадмия в системе CdX2-ДМСО-Н2О. Как
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
876
СКРИПКИН и др.
структурных единиц, которые составляют
впоследствии твердую фазу.
В результате проведенного анализа раскрыта
роль конкурирующих процессов сольватации,
ацидокомплексообразования
и
ион-ионной
ассоциации в формировании твердой фазы из
тройных растворов. Конкретный тип двойных и
комплексных солей определяется значениями
констант устойчивости ацидокомплексов и
констант ассоциации и их соотношением. Условием
сохранения состава и формы координационного
полиэдра иона металла являются высокие (β
i
> 106)
константы устойчивости ацидокомплексов в
Мольная доля ДМФА
растворе. Для водно-органических растворов
раскрыта связь между типом доминирующих
Рис. 11. Диаграмма сольватации (10 моль/100 моль
растворителя, 1 - общее сольватное число, 2 - мольная
взаимодействий в растворе, строением твердой
доля ДМФА,
3 - мольная доля воды
) и изотерма
фазы и формой изотерм растворимости и показана
растворимости (4) системы CuBr2-H2O-ДМФА. А -
тождественность состава координационной сферы
Cu(DMF)1.5-2.5(H2O)0.7-1.8Br2, B - Cu(DMF)2.7-3.0(H2O)0-0.7Br2,
иона металла в растворе и в твердой фазе в
C -[Cu(DMF)6][CuBr4], D - [Cu(DMF)4][CuBr4].
постаддитивной (при превышении аддитивной
растворимости) области концентраций.
видно, после пересечения линии аддитивной
Авторы
выражают
благодарность
растворимости сольватные числа фактически
А.Б. Никольскому (Санкт-Петербургский государ-
перестают изменяться, а состав частиц в растворе
ственный университет) за конструктивную критику
хорошо коррелирует с составом твердой фазы
и ряд ценных замечаний, а также К.К. Спектор,
{усредненный состав комплексных ионов в
А.А.Тихомировой и Н.А. Цырульникову (Санкт-
растворе
- Сd(DMSO)3X2, состав равновесной
Петербургский государственный университет) за
твердой фазы - [Cd(DMSO)6][CdX4]}.
существенный вклад в получение и обсуждение
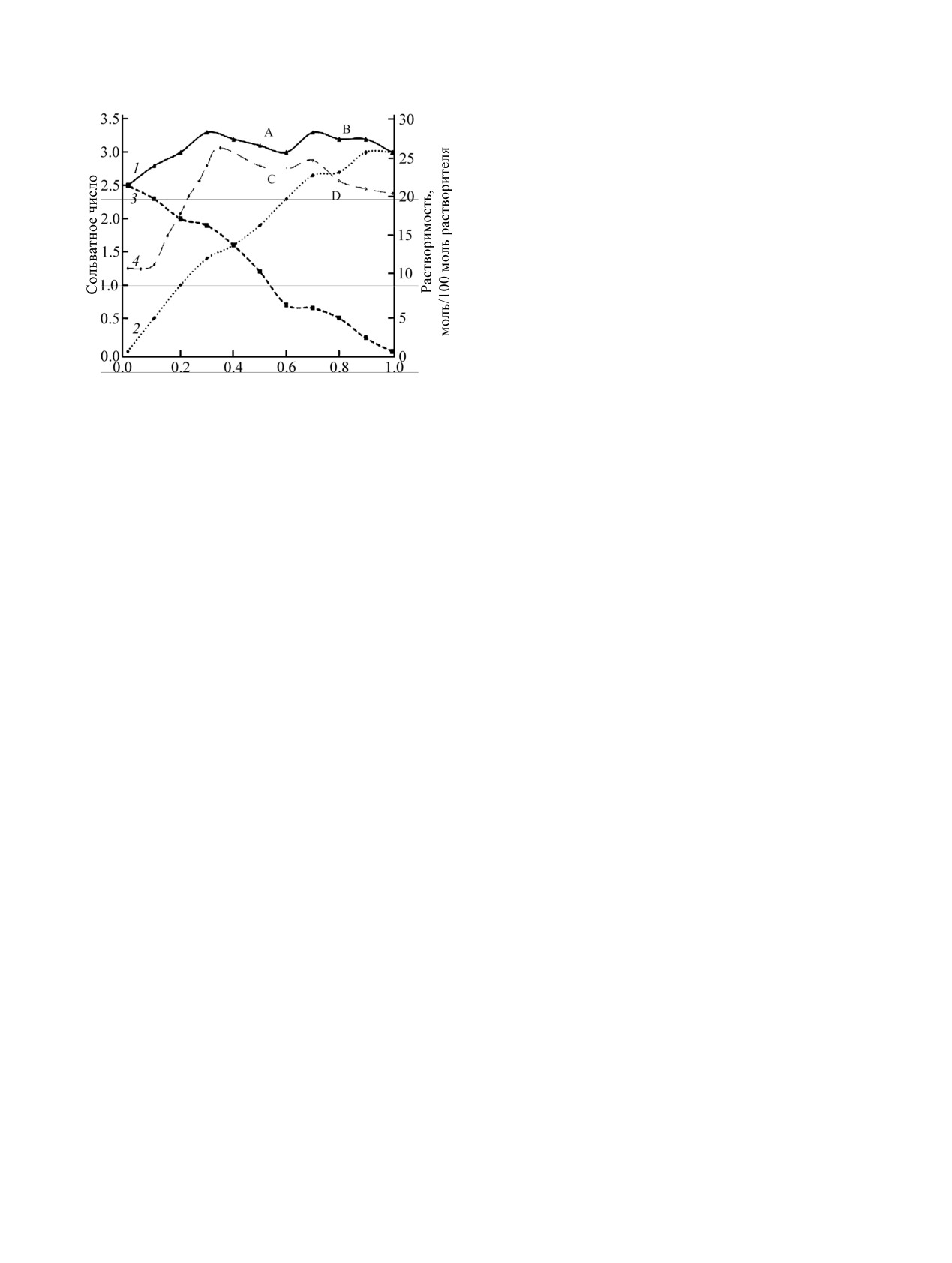
На рис.
11 в качестве примера приведены
данных работы.
диаграмма сольватации ионов меди в концентри-
рованном растворе ДМФА-H2O (10 моль/100 моль
ФОНДОВАЯ ПОДДЕРЖКА
р-ля) и изотерма растворимости бромида меди в
Работа выполнена при частичной финансовой
смесях вода-ДМФА для сравнения. На графике
поддержке Российского фонда фундаментальных
зависимости общего сольватного числа (сплошная
исследований (проект 18-33-00636, Н.А. Богачев) с
линия) от состава растворителя видны два
использованием оборудования Ресурсных центров
максимума, которые делят диаграмму на три
«Рентгенодифракционные методы исследования»,
области. Границы этих областей почти совпадают с
«Оптические и лазерные методы исследования»,
положением эвтонических точек на изотерме
«Термогравиметрические и рентгенодифрак-
растворимости.
ционные методы исследования» и
«Методы
На средней ветви изотермы растворимости в
анализа состава вещества» Научного парка Санкт-
данной системе кристаллизуется соединение,
Петербургского государственного университета.
представляющее собой координационную пару из
квадрата [Cu(DMF)4]2+ и тетраэдра [CuBr4]2-. В
КОНФЛИКТ ИНТЕРЕСОВ
растворе, по данным электронной спектроскопии
Авторы заявляют об отсутствии конфликта
поглощения, также протекает координационное
интересов.
диспропорционирование, поэтому брутто-состав
Cu(DMF)2(H2O)Br2 можно представить в виде пары
СПИСОК ЛИТЕРАТУРЫ
[Cu(DMF)4(Н2О)2]2+ и [CuBr4]2-, причем молекулы
воды наиболее вероятно занимают аксиальные
1. Persson I., D’Angelo P., De Panfilis S., Sandstrom M.,
позиции из-за более низкой донорной способности.
Eriksson L. // Chem. Eur. J. 2008. Vol. 14. P. 3056. doi
Их отрыв и приводит, вероятно, к образованию тех
10.1002/chem.200701281
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ВЛИЯНИЕ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ НА ФОРМИРОВАНИЕ ТВЕРДОЙ ФАЗЫ
877
2. Борина А.Ф., Орлова В.Т., Кондакова И.В. // ЖНХ.
21. Sutter E.J., Harmon J.F. // J. Phys. Chem.
1975.
1999. Т. 44. С. 2105; Borina A.F., Orlova V.T.,
Vol. 79. P. 1958. doi 10.1021/j100585a015
Kondakova I.V. // Russ. J. Inorg. Chem.1999. Vol. 44.
22. Varma S., Rempe S.B. // Biophys. Chem. 2006. Vol. 124.
P. 1998.
P. 192. doi 10.1016/j.bpc.2006.07.002
3. Лященко А.К. // Концентрированные и насыщенные
23. Пестова О.Н.. Баранаускайте В.Э., Хрипун М.К. //
растворы / Под ред. А. М.Кутепова. М.: Наука, 2002.
ЖOX.
2016. Т.
86. С.
577; Pestova O.N.,
С. 923.
Baranauskaite V.E., Khripun M.K. // Russ. J. Gen.
4. Duhlev R., Balarew C. // Z. anorg. allg. Chem. 1987.
Chem.
2016. Vol.
86. P.
767. doi
10.1134/
Bd 549. S. 225. doi 10.1002/zaac.19875490624
s1070363216040010
5. Balarew C., Duhlev R. // J. Solid State Chem. 1984.
24. Гусев И.М., Скрипкин М.Ю. // ЖПX. 2011. Т. 84.
Vol. 55. P. 1. doi 10.1016/0022-4596(84)90240-8
С. 25; Gusev I.M., Skripkin M.Yu. // Russ. J. Appl.
6. Duhlev R., Brown I.D., Balarew C. // J. Solid State
Chem.
2011. Vol.
84. P.
25. doi
10.1134/
Chem. 1991. Vol. 95. P. 39. doi 10.1016/0022-4596(91)
S1070427211010046
90374-Q
25. Tepavitcharova S., Balarew C., Trendafilova S.
//
7. Tepavitcharova S., Balarew C., Trendafilova S. // J.
Monat. Chem. 2003. H. 134. S. 721. doi 10.1007/
Solid State Chem. 1995. Vol. 114. P. 385. doi 10.1006/
S00706-002-0584-6
jssc.1995.1059
26. Старова Г.Л., Скрипкин М.Ю., Гусев И.М. // ЖOX.
8. Chernykh L.V., Eysseltova J., Skripkin M.Yu. // Monat.
2010. Т. 80. С. 1070; Starova G.L., Skripkin M.Yu.,
Chem. 2003. H. 134. S. 751. doi 10.1007/S00706-002-
Gusev I.M. // Russ. J. Gen. Chem. 2010. Vol.
80.
0583-7
P. 1236. doi 10.1134/S1070363210070030
9. Stepakova L.V., Skripkin M.Yu., Chernykh L.V., Staro-
27. Заводник В.Е., Бельский В.Р., Диаз С., Фернандес С. //
va G.L., Hajba L., Mink J., Sanstrom M. // J. Raman
Кристаллография. 1999. Т. 44. С. 623.
Spectrosc. 2008. Vol. 39. P. 15. doi 10.1002/jrs.1778
28. Chidambaram R., Navarro Q.O., Garcia A., Linggo-
10. Waizumi K., Masuda H., Fukushima M. //Chem. Phys.
atmodjo K., Lin S.B., Suh I.H., Sequeira A., Srikanta S. //
Let. 1993. Vol. 205. P. 317. doi 10.1016/0009-2614(93)
Acta Cryst. (B). 1970. Vol. 26. P. 827. doi 10.1107/
89249-H
S0567740870003187
11. Pavlov M., Siegbahn P.E.M., Sandstrom M. // J. Phys.
29. Bhakay-Tamhane S.N., Sequeira A., Chidambaram R. //
Chem. (A). 1998. Vol. 102. P. 219. doi 10.1021/
Acta Cryst. (B). 1980. Vol. 36. P. 2925. doi 10.1107/
jp972072r
S0567740880010539
12. Ohtaki H. // Monatsh. Chem. 2001. H. 132. S. 1237. doi
30. McGinnery J.A. // J. Am. Chem. Soc. 1972. Vol. 94.
10.1007/s00760170016
P. 8406. doi 10.1021/ja00779a020
13. Helm L., Merbach A.E. // Chem. Rev. 2005. Vol. 1056.
31. Crama W.J. // Acta Cryst. (B). 1981. Vol. 37. P. 2133.
P. 1923. doi 10.1021/cr030726o
doi 10.1107/S0567740881008224
14. Скрипкин М.Ю., Румянцев А.В., Солечник Н.Д. //
32. Li T.I., Stuoky G.D. // Inorg. Chem. 1973. Vol. 12.
ЖПX. 1993. Т. 66. С. 983; Skripkin M.Yu., Rumyan-
P. 441. doi 10.1021/ic50120a040
tsev A.V., Solechnik N.D. // Russ. J. Appl. Chem. 1993.
33. Brink C., MacGillarry C.H. // Acta Cryst. 1949. Vol. 2.
Vol. 66. P. 807.
P. 158. doi 10.1107/S0365110X49000436
15. Скрипкин М.Ю. Автореф. дис
канд. хим. Наук. Л.,
34. Brink C., van Arkel A.E. // Acta Cryst. 1952. Vol. 5.
1990. 16 с.
P. 506. doi 10.1107/S0365110X5200143X
16. Waizumi K., Masuda H., Ohtaki H., Skripkin M.Yu.,
35. Степакова Л.В. Автореф. дис
канд. хим. наук.
Burkov K.A. // Am. Mineralog. 1991. Vol. 76. P. 1884.
СПб., 2007. 16 с.
17. Schmidt H., Euler B., Voigt W., Heide G. // Acta Cryst.
36. Замятин И.В. Автореф. дис
канд. хим. наук. СПб,
(C).
2009. Vol.
65.
P. I57. doi
10.1107/
2009. 16 с.
S0108270109029448
37. Leclaire A., Borel M. // Acta Cryst. (B). 1980. Vol. 36.
18. Новый справочник химика и технолога. Химическое
P. 3088. doi 10.1107/S0567740880010850
равновесие. Свойства растворов / Под ред. С.А.
38. Ledesert M., Monier J.-C. // Acta Cryst. (B).
1981.
Симановой. СПб: НПО «Профессионал», 2007. С. 98.
Vol. 37. P. 652. doi 10.1107/S0567740881003798
19. Evans H.T.jr., Konnert J.A., Chou I.W., Romankiw L.A. //
39. Duhlev R., Macicek J. // Acta Cryst. (C). 1991. Vol. 47.
Acta Cryst. (B). 1984. Vol. 40. P. 86. doi 10.1107/
P. 1573. doi 10.1107/S0108270191001798
S0108768184001798
40. Waizumi K., Matsumoto T., Abe T., Fukushima N.,
20. Хрипун М.К., Караван С.В., Булгаков С.А.
//
Masuda H. // J. Solid State Chem. 2003. Vol. 174.
Проблемы современной химии координационных
P. 182. doi 10.1016/S0022-4596(03)00210-X
соединений / Под ред. А.Б. Никольского. Л.: ЛГУ,
41. Follner H., Brehler B. // Acta Cryst. (B). 1970. Vol. 26.
1987. С. 122.
P. 1679. doi 10.1107/S0567740870004715
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
878
СКРИПКИН и др.
42. Hennings E., Schmidt H., Voigt W. // Acta Cryst. (E).
P. 1768. doi 10.1134/S1070363211090052
2014. Vol. 70. P. 515. doi 11.1107/S1600536814024738
46. Кочемировский В.А., Скрипкин М.Ю., Тверьянович Ю.С.,
Мерещенко А.С., Горбунов А.О., Панов М.С., Тум-
43. Эмсли Дж. Элементы. М.: Мир, 1993. 256 с.
кин И.И., Сафонов С.В. // Усп. хим. 2015. Т. 84.
44. Lechat S., Khan M.A., Bouet G., Vierling F. // Inorg.
С.
1059; Kochemirovsky V.A., Skripkin M.Yu.,
Chim. Acta. 1993. Vol. 211. P. 33. doi 10.1016/S0020-
Tveryanovich Y.S., Mereshchenko A.S., Gorbunov A.O.,
1693(00)82840-6
Panov M.S., Tumkin I.I., Safonov S.V. // Russ. Chem.
45. Старова Г.Л., Спектор К.К., Скрипкин М.Ю. //
Rev. 2015. Vol. 84. P. 1059. doi 10.1070/RCR4535
ЖОХ. 2011. Т. 81. С. 1428; Starova G.L., Spektor K.K.,
47. Горбунов А.О. Автореф. дис
канд. хим. наук.
Skripkin M.Yu. // Russ. J. Gen. Chem. 2011. Vol. 81.
СПб, 2017. 16 с.
Effects of Interactions in Solutions on the Formation
of a Solid Phase in Ternary Water-Salt Systems
M. Yu. Skripkin*, L. V. Chernykh, O. N. Pestova, V. E. Baranauskaite,
K. A. Burkov, I. V. Zamyatin, L. V. Stepakova, I. M. Gusev, A. O. Gorbunov,
N. A. Bogachev, and G. L. Starova
St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
* e-mail: m.skripkin@spbu.ru
Received March 7, 2019; revised March 7, 2019; accepted March 12, 2019
The influence of ionic interactions in ternary aqueous and aqueous-organic solutions of metal halides on the
structure of the solid phase is analyzed. An original classification of binary and complex salts, reflecting the
peculiarities of their structure, is given. The conditions for the formation of various types of these compounds are
determined. The factors that determine the preservation of the environment of the metal ion during the solution-
solid phase transition are revealed.
Keywords: aqueous and aqueous-organic solutions, metal halides, double salts, complex salts, crystal solvates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019