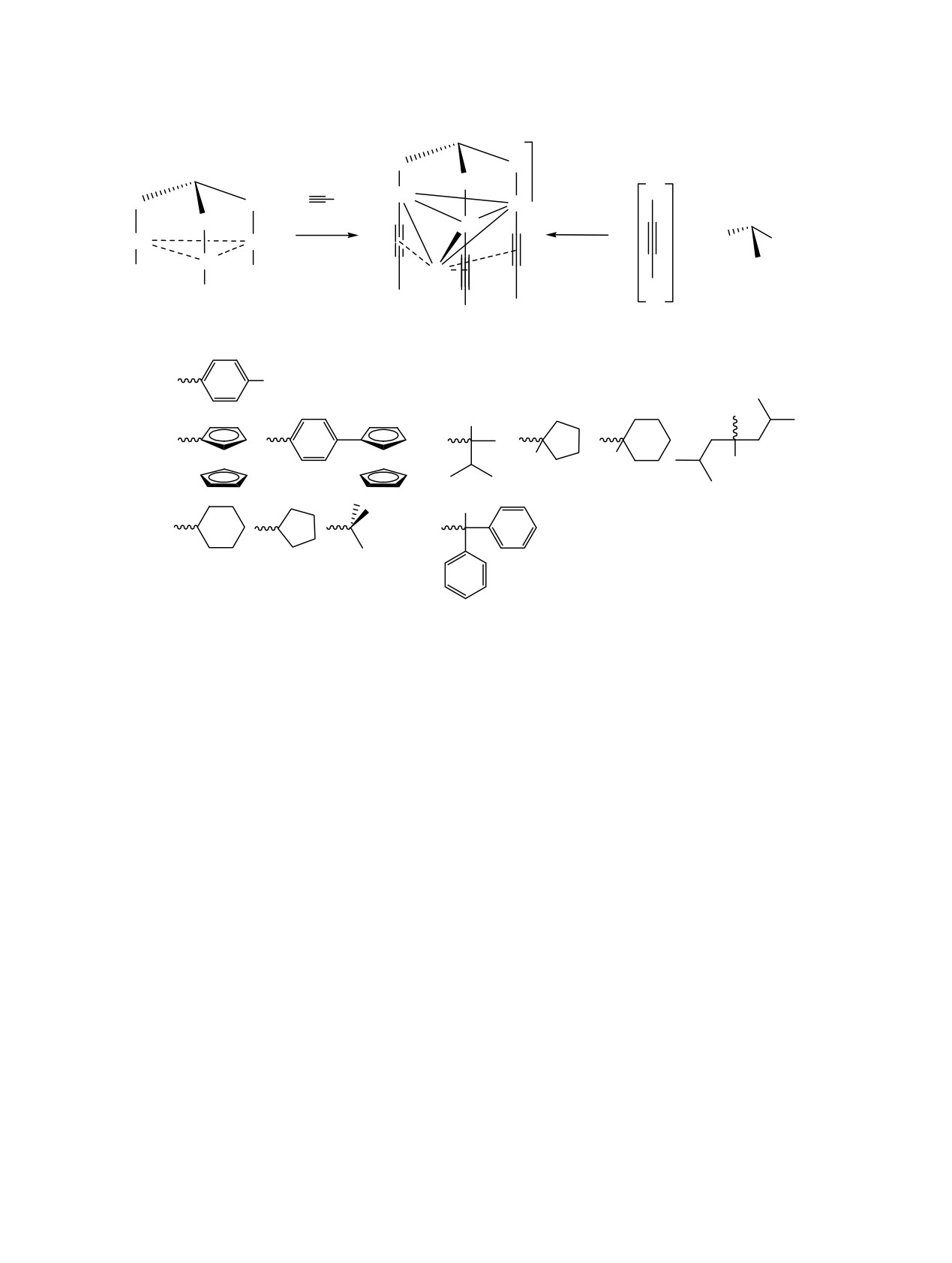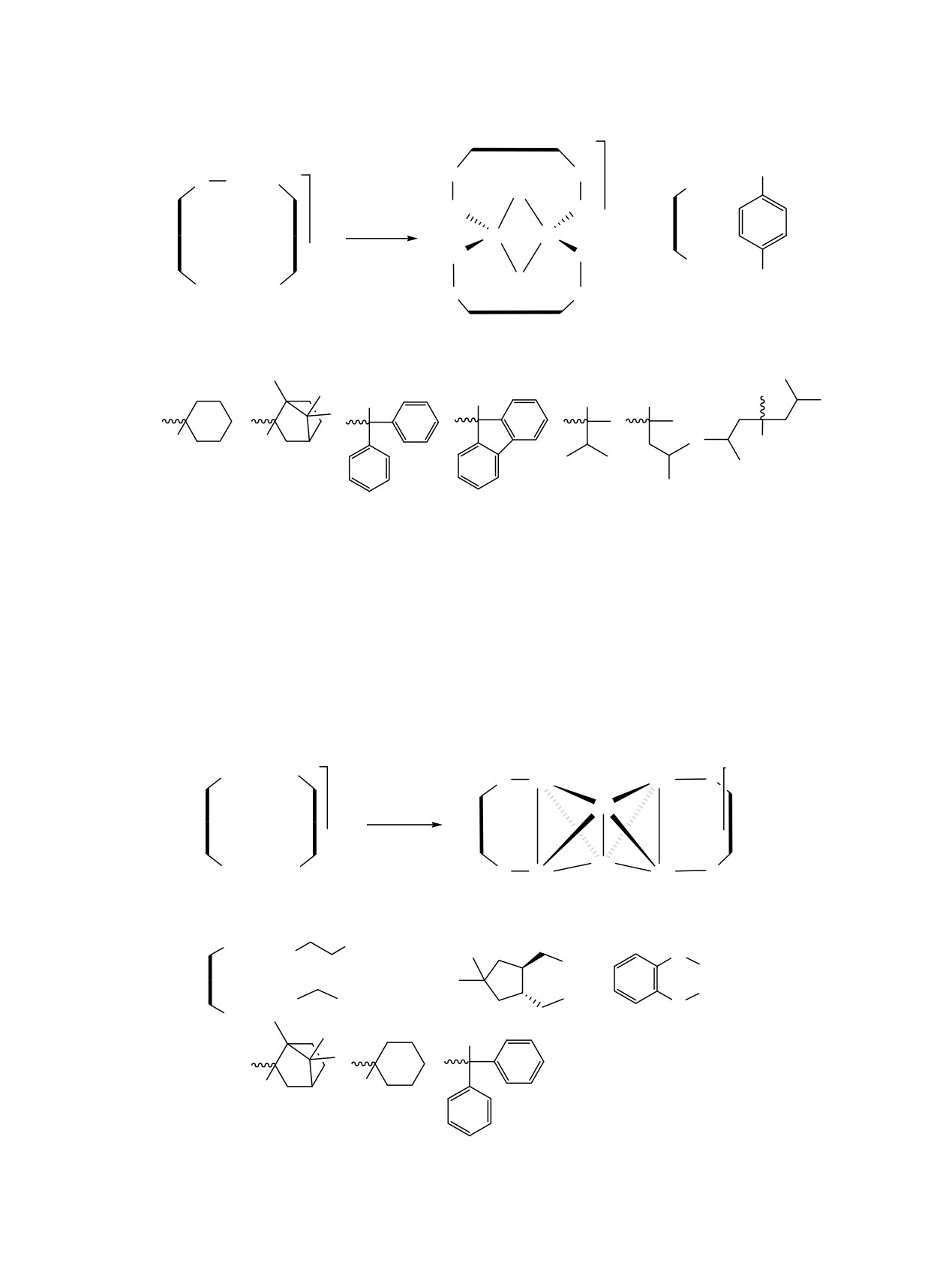ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 6, с. 879-892
УДК 546.55/.59
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ
СОЕДИНЕНИЙ МЕТАЛЛОВ ПОДГРУППЫ МЕДИ НА
ОСНОВЕ ПОЛИДЕНТАТНЫХ ФОСФИНОВЫХ ЛИГАНДОВ
© 2019 г. Е. В. Грачёва*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: e.grachova@spbu.ru
Поступило в Редакцию 7 марта 2019 г.
После доработки 7 марта 2019 г.
Принято к печати 12 марта 2019 г.
Рассмотрены принципы и примеры сборки гетеролептических супрамолекулярных кластерных
соединений металлов подгрупы меди на основе полидентатных фосфиновых лигандов различной
топологии. Выбор органического линкера в составе фосфина позволяет управлять формированием
трехмерных агрегатов с регулярной архитектурой, а выбор алкинильных лигандов определяет их
люминесцентные свойства.
Ключевые слова: металлы подгруппы меди, металлофильные и аурофильные взаимодействия,
фосфиновые лиганды, кластерные соединения, каркасные молекулы, молекулярные эмиттеры
DOI: 10.1134/S0044460X19060063
Начиная с 80-х годов прошлого столетия химия
подгруппы меди, возникло еще одно направление,
кластерных соединений на кафедре общей и
активность которого на данный момент только
неорганической химии Санкт-Петербургского
возрастает, а именно - контролируемый синтез
государственного университета сформировалась в
триплетных люминофоров на основе комплексных
отдельное направление и стала развиваться
соединений Cu(I), Ag(I) и Au(I).
быстрыми темпами. Работы, посвященные синтезу
[1], исследованию структуры [2-4], динамических
Кластерные соединения малой нуклеарности
характеристик [5-10] и реакционной способности
представляют собой уникальный класс молекул,
[11-15] карбонильных кластеров переходных
занимающий положение между моноядерными
металлов заложили фундамент для контроля
комплексами и наночастицами. Они обладают
химических и физико-химических свойств этих
рядом удивительных химических и физико-
нетривиальных объектов. В фокусе исследований в
химических свойств из-за наличия кластерного
основном находились переходные металлы:
остова со связями металл-металл разной энергии.
кобальт, родий, иридий, платина, рутений, осмий.
Эти связи могут быть следствием как образования
Особое внимание уделялось направленному
электронодефицитного кластерного скелета (карбо-
синтезу так называемых смешанных соединений, а
нильные и халькогенидные кластеры переходных
именно кластерных систем с гетерометаллическим
металлов), так и проявления металлофильных
скелетом [16-19], или систем, в составе которых
взаимодействий
[24] (кластерные соединения
присутствует прямая связь между металлами
металлов подгруппы меди). В отличие от
разной природы
[20-23]. Состав последних
ковалентных связей металл-металл металлофиль-
контролировали с помощью процессов, которые
ные взаимодействия имеют супрамолекулярный
позволяют перестраивать связи внутри кластера
характер и относятся к слабым взаимодействиям,
путем обмена лигандов. Когда в конце 90-х годах
однако обладают критическим влиянием на физико-
прошлого столетия было описано явление
химические свойства кластерных соединений
аурофильности [24] и показано его критическое
влияние на физико-химические свойства супра-
металлов подгруппы меди, в частности, на их
молекуляных кластерных соединений металлов
люминесцентные свойства [25].
879
880
ГРАЧЁВА
Соединения, обладающие люминесцентными
В настоящей работе рассмотрены принципы и
свойствами, или молекулярные эмиттеры, - на
примеры сборки супрамолекулярных кластерных
сегодняшний день один из наиболее востребо-
соединений металлов подгрупы меди на основе
ванных классов соединений. Области их приме-
полидентатных фосфиновых лигандов различной
нения включают визуализацию биологических
топологии.
структур, объектов и процессов, контроль pH,
Супрамолекулярные кластерные соединения
картирование кислорода, контроль температуры,
на основе стереохимически жесткого три-
отслеживание доставки лекарств in vivo и in vitro,
дентатного фосфина трис(дифенилфосфино)
генерацию синглетного кислорода и фотодинами-
метана HC(PPh2)3 (tppm). Кластерные соединения
ческую терапию, контроль концентрации ионов в
с гетерометаллическим Au(I)-Cu(I) скелетом.
растворе (включая клиническую диагностику),
Реакция самосборки между трехъядерным
защиту и безопасность ценных бумаг, пре-
комплексом золота
[tppm(AuCl)3], арилацети-
образование и усиление света, создание электро-
ленами HC2R и Cu+ в присутствии слабого
люминесцентных устройств, преобразование
органического основания или деполимеризация
солнечной энергии, определение и контроль малых
«золотого полимера»
[Au(C2R)]n при помощи
молекул, в том числе молекул взрывоопасных
лиганда tppm в присутствии Cu+ приводят к
веществ, контроль давления кислорода, отслежи-
образованию гетерометаллических комплексов 1-6
вание наночастиц, получение наногибридных
[tppm(AuC2R)3Cu]+ (схема
1)
[26-29]. Все эти
композитов и т. д.
соединения изоструктурны и содержат гетеро-
Для создания молекулярных эмиттеров на
металлический скелет
{(AuC2R)3Cu}, стабили-
основе металлов подгруппы меди необходимо
зированный стереохимически жестким триден-
использовать лиганды, позволяющие построить
татным фосфином. Гетерометаллический каркас
строго организованный в пространстве металли-
поддерживается за счет металлофильных взаимо-
ческий каркас, расстояния металл-металл в
действий Au···Au и Au···Cu, а также дополни-
котором должны способствовать реализации
тельной координацией Cu(I) к тройной связи алкина.
металлофильных взаимодействий. Для этой цели
Для синтеза соединений 1 были использованы
подходят фосфиновые лиганды различной
замещенные ароматические производные HC2C6H4X
дентатности, стереохимической жесткости и
(X = H, COOMe, CN, OMe, NH2). Все соединения
топичности, которые позволяют построить гомо- и
этой серии проявляют фосфоресценцию в растворе
гетеролептические супрамолекулярные кластерные
при комнатной температуре с максимумами
системы, в том числе и большие «молекулярные
излучения в диапазоне от 550 до 680 нм. Эта
клетки», обладающие уникальной топологией и
люминесценция обеспечивается электронными
необычными фотофизическими свойствами.
переходами, локализованными в основном на
Природа заместителей у атома фосфора определяет
кластерном ядре с вовлечением тройной связи, т.е.
стерические и электронные свойства полученных
на фрагменте {(C≡C-Au)3Cu}. Люминесцентные
металлорганических систем, а вариативность спейсеров
свойства этих супрамолекулярных кластеров
позволяет организовать пространственную структуру
зависят от электронодонорных свойств аромати-
металлического скелета. Выбором органического
ческих заместителей алкинильных лигандов.
линкера в составе фосфина можно управлять форми-
Увеличение основности заместителей X вызывает
рованием трехмерных агрегатов с регулярной
батохромный сдвиг максимумов эмиссии и
архитектурой. Последний тип соединений особо
коррелирует с соответствующими константами
привлекателен, поскольку они могут обладать
Гаммета. Максимумы полос излучения соединений
наноразмерными внутренними полостями и
1
демонстрируют систематическое красное
эффективно служить в качестве молекулярных
смещение с увеличением донорных свойств
контейнеров с богатой химией гость-хозяин. В
заместителя X, симбатно уменьшению времен
качестве
«дополнительных» лигандов наиболее
жизни возбужденных состояний и квантовых
широко используются замещенные алкины HC≡CR
выходов эмиссии [26].
(где R
- органические радикалы различной
природы), CCOR3-, NR2-, S2-, SPh-, также
Введение в ацетилен дополнительных бензоль-
определяющие пространственное строение и
ных колец приводит к расширению ароматической
фотофизические свойства кластерных соединений.
системы алкильных лигандов (схема 1, соединения 2)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
881
Схема 1.
+
P
P
P
Au
Au
P
P
R
Au
Cu+
P
Au
Cu+
P
Au
Au
+
P
Et3N
Au
P
Cl
Cl
Cu
R
Cl
R
n
R
R
1-6
R =
X , X = H, NH2, CN, COOMe, OMe (1); X = H, C6H5, (C6H4)C6H5 (2);
OH
R =
(3);
(4);
Fe
Fe
OH
OH
OH
OH
(5);
(6);
P = P(C6H5)2.
с сохранением основного структурного фрагмента
зрения, что даже введение объемных заместителей
кластерной системы [tppm(AuC2(С6H4Х))3Cu]+, Х =
не препятствует самосборке этих кластерных
C6H5, C6H4(C6H5) [27]. Расширение ароматической
систем. Использование алкинов с ферроцениль-
системы алкильных лигандов в соединениях
2
ными заместителями позволяет синтезировать
приводит к проявлению феномена двойной
супрамолекулярные кластерные комплексы
3
эмиссии с четко разделенными компонентами
[tppm(AuC2R)3Cu]+, R = Fc, C6H4Fc (схема 1), в
флуоресценции и фосфоресценции (голубая и
которых металлический каркас
{Au3Cu} связан
красная
полосы эмиссии соответственно).
металло-фильными взаимодействиями
[28]. В
Относительные интенсивности обоих спектраль-
отличие от соединений серии 1 и 2, кластеры серии
ных составляющих зависят от длины волны
3 не демонстрируют эмиссии ни в растворе, ни в
возбуждающего света и от концентрации раствора.
твердом состоянии из-за безызлучательной
Высокоэнергетическая полоса эмиссии имеет
релаксации через редокс-активные ферроцениль-
флуоресцентную природу и связана с внутренними
ные фрагменты.
переходами в алкильном лиганде с основным
Замена заместителя R в алкинильном лиганде
вкладом от ароматических колец. Низкоэнергети-
на алифатический заместитель или на производное
ческая полоса эмиссии, напротив, имеет
пропаргилового спирта также не оказывает
триплетную природу и связана с переносом заряда
существенного влияния на самосборку и состав
внутри кластерного фрагмента {(C≡C-Au)3Cu} с
целевого соединения 4-6 (схема 1) [29]. Однако
небольшим вкладом от орбиталей атомов золота.
слабые взаимодействия, такие как внутримоле-
Этот переход может быть инициирован двумя
кулярная водородная связь могут приводить к
разными способами, а именно прямым фото-
некоторым структурным искажениям централь-
возбуждением и поглощением молекулами
ного ядра гетерометаллического кластера.
кластеров собственной флуоресценции аромати-
ческого фрагмента.
Соединения
4-6 проявляют умеренную или
Структурный фрагмент
{tppm(AuC2R)3Cu}
слабую фосфоресценцию в растворе и значительно
настолько выгоден с пространственной точки
более яркую эмиссию при переходе в твердую
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
882
ГРАЧЁВА
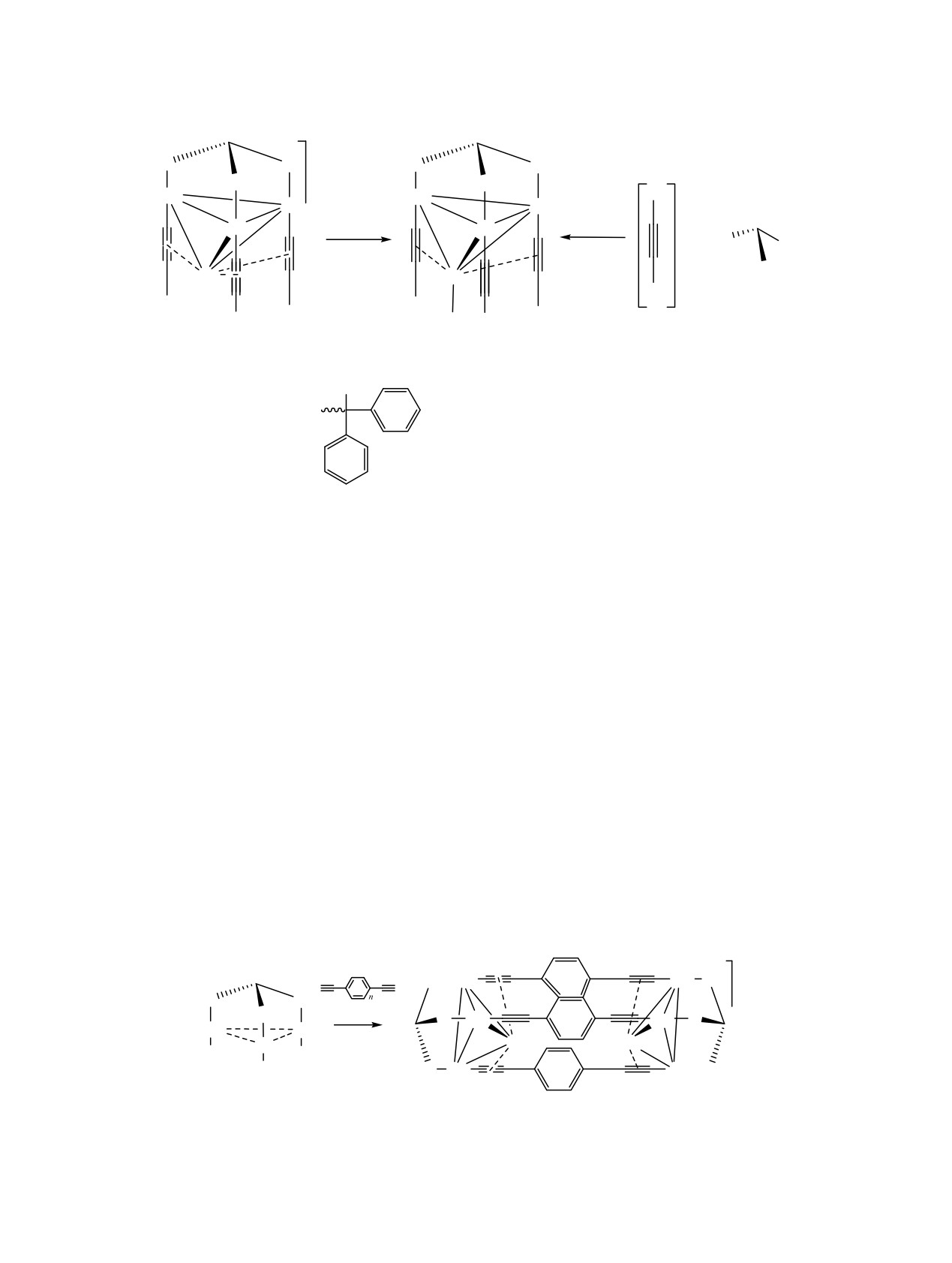
Схема 2.
+
P
P
P
P
P
P
Au
Au
Au
Au
Au
Au
NBu4X
Au
CuX
+
P
P
P
Cu
Cu
R
R
R
n
R
R
R
X
R
7
OH
R =
; X = Cl, Br; P = P(C6H5)2.
фазу. Было обнаружено, что комплексы
5,
умеренную триплетную эмиссию в растворе,
содержащие в качестве заместителей алкинильные
которая разгорается при переходе в твердую фазу.
лиганды без гидроксильных групп, имеют самые
Соединения 6 и 7 демонстрируют такой редкий
низкие значения квантовых выходов. Причина
феномен, как люминесцентный вапохромизм. Это
существенного увеличения эффективности эмиссии
явление заключается в значительном изменении
для комплексов 4 и 6 с гидроксильными группами -
фотофизических характеристик соединения при
внутри- и межмолекулярные водородные связи в
поглощении паров полярных органических раство-
кристалле, которые блокируют колебательную
рителей в твердой фазе. В частности, обработка
безызлучательную релаксацию возбужденных
порошков соединений 6 и 7 парами метанола,
состояний.
тетрагидрофурана, ацетона или ацетонитрила
Замена синтона [Cu(NCMe)4]+ на CuX (X = Cl,
приводит к существенному гипсохромному сдвигу
Br) или обработка кластера 6 стехиометрическим
полосы эмиссии и сопровождается трехкратным
количеством соответствующего галогенида тетра-
увеличением интенсивности свечения. Эффект
бутиламмония приводит к получению родственных
хорошо виден невооруженным глазом при
соединений
7 (схема
2)
[29]. Отличие от
облучении образцов УФ светом. Наблюдаемый
соединений
1-6 состоит в том, что галоген
вапохромный отклик люминесценции соединений
координирован к Cu(I) и одна из дативных связей
6 и 7 - результат фазового перехода из аморфной
Cu-C≡CR отсутствует при сохранении параметров
формы в кристаллическую с образованием
фосфин-металлического структурного фрагмента
упорядоченной фазы
[30]. Квантово-химические
{tppm(Au3Cu)}. Комплексы
7 демонстрируют
расчеты методом DFT с использованием QM и QM/
Схема 3.
n
2+
P Au
Au
P
P
P
P
Cu+
P
Au
Au
P
Au
Au
Et3N
n
Au
Cu
Cu
Cl
Cl
Cl
P
Au
Au P
n
8
P = P(C6H5)2; n = 1-3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
883
Схема 4.
4+
P
P
P
Cu+
Au
Au
Au
Et3N
S
S
S
9
P
P
P
=
Au
Au
=
Au
Cu
P = P(C6H5)2; n = 1-2.
MM подходов [31] показали, что основной фактор,
тем, что в растворе молекулы 9 подвергаются
влияющий на спектр излучения кристаллов
обмену Cu(I) на Ag(I) без изменения общей
соединений 6 и 7, - это взаимодействие комплекса
архитектуры. Такая модификация сопровождается
с другими комплексами в кристаллической ячейке.
изменением природы переноса энергии на
переходы внутри алкиновых лигандов без потери
Структурный фрагмент
{tppm(Au3Cu)}
-
триплетного характера эмиссии.
стабильный строительный блок, и увеличение
топичности ацетиленовых лигандов позволяет
Кластерные соединения с гомометаллическим
синтезировать сложные симметричные наноразмер-
Ag(I) скелетом. Использование tppm как тем-
ные молекулы. Например, использование
платного лиганда для стабилизации фрагмента M3
бидентатных алкинов позволило получить
возможно не только для Au(I), но также и для
замкнутые протяженные структуры 8 (схема 3),
других металлов 11 группы, т. е. для Ag(I) и Cu(I).
фотофизические свойства которых аналогичны
Простой протокол, основанный на процессе
свойствам соединений 2 [27].
самосборки и заключающийся в стабилизации
металлического ядра при помощи темплатного
Комбинация тридентатных алкинильных лиган-
фосфинового лиганда, мостиковых алкильных
дов с кластерными фрагментами {tppm(Au3Cu)}
лигандов, координирующихся противоионов и
приводит к образованию уникальных трехмерных
металлофильных взаимодействий, приводит к
агрегатов 9 (схема
4)
[32]. Эти наноразмерные
получению полиядерных систем Ag(I)
10-13
молекулы демонстрируют фосфоресценцию в
(схема
5)
[33]. Алкинильные лиганды и коор-
растворе благодаря переносу заряда от металла к
динирующийся трифлат-анион не приведены в
лиганду в кластерных фрагментах. Соединения 9
структурах для простоты изображения, а указаны
можно рассматривать не только как супра-
под соответствующей структурой.
молекулярные кластерные комплексы, но и как
системы гость-хозяин, где Cu(I) является гостем.
В отличие от фрагмента
{tppm(Au3Cu)}
Правомерность такого подхода подтверждается
соединений
1-7,
ядерность и топология
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
884
ГРАЧЁВА
Схема 5.
P
P
Ag+
+
P
HC2R,
HC2R,
[Ag(C2R)n]
[Ag(C2R)n]
NEt3
NEt3
2+
2+
+
P
P
P
P
P
P
P
P
P
P
P
P
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
HC2R,
Ag
Ag
Ag
Ag
Ag
NEt3
Ag+
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
Ag
P
Ag
Ag
P
P
P
P
P
P
P
P
P
P
P
(C2R)4(CF3SO3)2
(C2R)4(CF3SO3)
(C2R)3(CF3SO3)3
(C2R)3(CF3SO3)3
13
12
11
10
R =
X (X = H, NH2, CF3, OMe);
; P = P(C6H5)2.
кластерного скелета соединений серий
10-13
металлического каркаса соединений 14, 15 зависит
зависит от электроно-донорных свойств замести-
от электроно-донорных свойств заместителей в
телей в алкинильных лигандах. Более того, в серии
алкинильных лигандах и от стехиометрии
соединений
10-12 реализуется переход между
реакционной смеси (схема 6) [34]. Алкинильные
различными топологиями кластерного скелета.
лиганды и координирующийся трифлат-анион не
Соединения 10-13 демонстрируют динамическое
приведены на формулах для простоты
поведение в растворе, связанное с диссоциацией и/
изображения, а указаны под соответствующей
или стереохимической нежесткостью.
структурой.
Супрамолекулярные кластерные соединения
Кластеры
14 и
15 демонстрируют динами-
10-13 - яркие триплетные люминофоры в твердой
ческое поведение в растворе, что в основном,
фазе с энергией излучения в диапазоне от 485 до
объясняется стереохимической нежесткостью
725 нм. Гептоядерные системы 11 демонстрируют
алкинильного окружения. В твердом состоянии
люминесцентный отклик на пары ацетона или
полученные соединения проявляют интенсивную
метанола, который выражается в гипсохромном
фосфоресценцию при комнатной температуре. При
сдвиге излучения на 160 нм относительно образца
этом энергия как возбуждения, так и эмиссии
без растворителя. Этот феномен был описан в
напрямую зависит от электронодонорных свойств
терминах перегруппировки упаковки в твердой
заместителей в алкинильных лигандах и состава
фазе с сопутствующей модуляцией межмоле-
кластерного ядра
[34]. Это указывает на
кулярных взаимодействий Ag···Ag [33].
доминирующую роль π-орбиталей связи C≡C и d-
орбиталей металлов в низколежащих возбужден-
Кластерные соединения с гетерометаллическим
ных состояниях, отвечающих за поглощение и
Ag(I)-Cu(I) скелетом. Применение принципа
излучение энергии.
самосборки кластерных систем на основе темплат-
ного фосфина tppm позволило синтезировать
Кластерные соединения с гомометаллическим
гетерометаллические Ag(I)-Cu(I) супрамолекуляр-
скелетом Cu(I). Комбинация темплатного
ные кластерные соединения, обладающие яркой
трифосфинового лиганда tppm и замещенных
люминесценцией. Аналогично соединениям 10-13,
алкинов позволила получить серию люминесцен-
состав лигандного окружения и топология
тных гомометаллических кластеров Cu(I) 16, 17
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
885
Схема 6.
P
P
xAg+ + yCu+ + zHC2R + zNEt3 + 2
P
x = 6
x = 6
y = 1
y = 4
z = 3
z = 8
+
2+
P
P
P
P
P
P
Ag
Ag
Ag
Ag
Ag
Ag
Cu
Cu
Cu
Cu
Cu
Ag
Ag
Ag
Ag
Ag
Ag
P
P
P
P
P
P
(C2R)3(CF3SO3)3
(C2R)8
14
15
OH
R =
X (X = H, NH2, CF3, OMe);
;
P = P(C6H5)2.
(схема 7, алкинильные лиганды не приведены на
[35]
показали, что координация молекул
формулах для простоты изображения, а указаны
растворителя
приводит
к
существенному
под
соответствующей
структурой)
[35].
изменению природы и энергии молекулярных
Использование 2-этинилпиридина (соединения 16)
орбиталей, ответственных за излучение.
вместо производных фенилацетилена (соединения
Супрамолекулярные кластерные соединения
17) приводит к существенному изменению
на основе стереохимически жестких би- и
архитектуры кластера. Наличие дополнительных
тридентатных фосфинов с линейной аромати-
координирующих функций (пиридиновых циклов)
ческой системой. Дизайн и создание трехмерных
приводит к реализации открытой геометрии
супрамолекулярных каркасных молекул - одна из
металлического скелета со значительно меньшей
актуальных областей современной координацион-
степенью металлофильности.
ной химии, а полидентатные стереохимически
Комплексы
16 и
17 проявляют умеренную
жесткие фосфиновые лиганды с линейной гео-
фотолюминесценцию в твердом состоянии, демон-
метрией представляют собой удобные строи-
стрируя изменение цвета излучения в диапазоне от
тельные блоки для синтеза такого рода
темно-красного до зеленого. Соединения
16
молекулярных архитектур.
проявляет вапохромный люминесцентный отклик
на присутствие паров ацетона и ацетонитрила.
При помощи простого и эффективного метода
Наблюдаемая модуляция фотофизических свойств
самосборки были синтезированы каркасные молекулы
объясняется образованием сольватов, что было
18, состоящие из стереохимически жестких дитопных
подтверждено структурными исследованиями.
фосфиновых лигандов и четырехядерных фраг-
Квантово-химические расчеты методом TDDFT
ментов {Au4(μ4-CCOPh)} (схема 8) [36].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
886
ГРАЧЁВА
Схема 7.
P
Cu+ + HC2R + NEt3 +
P
P
2+
2+
P
P
P
P
P
P
Cu
Cu
Cu
Cu
Cu
Cu
Cu
Cu
Cu
Cu
P
Cu
Cu
P
P
P
P
P
(C2R)4
(C2R)4
16
17
R =
(16);
X, X = H, NMe2, CF3, OMe, Ph (17);
N
P = P(C6H5)2.
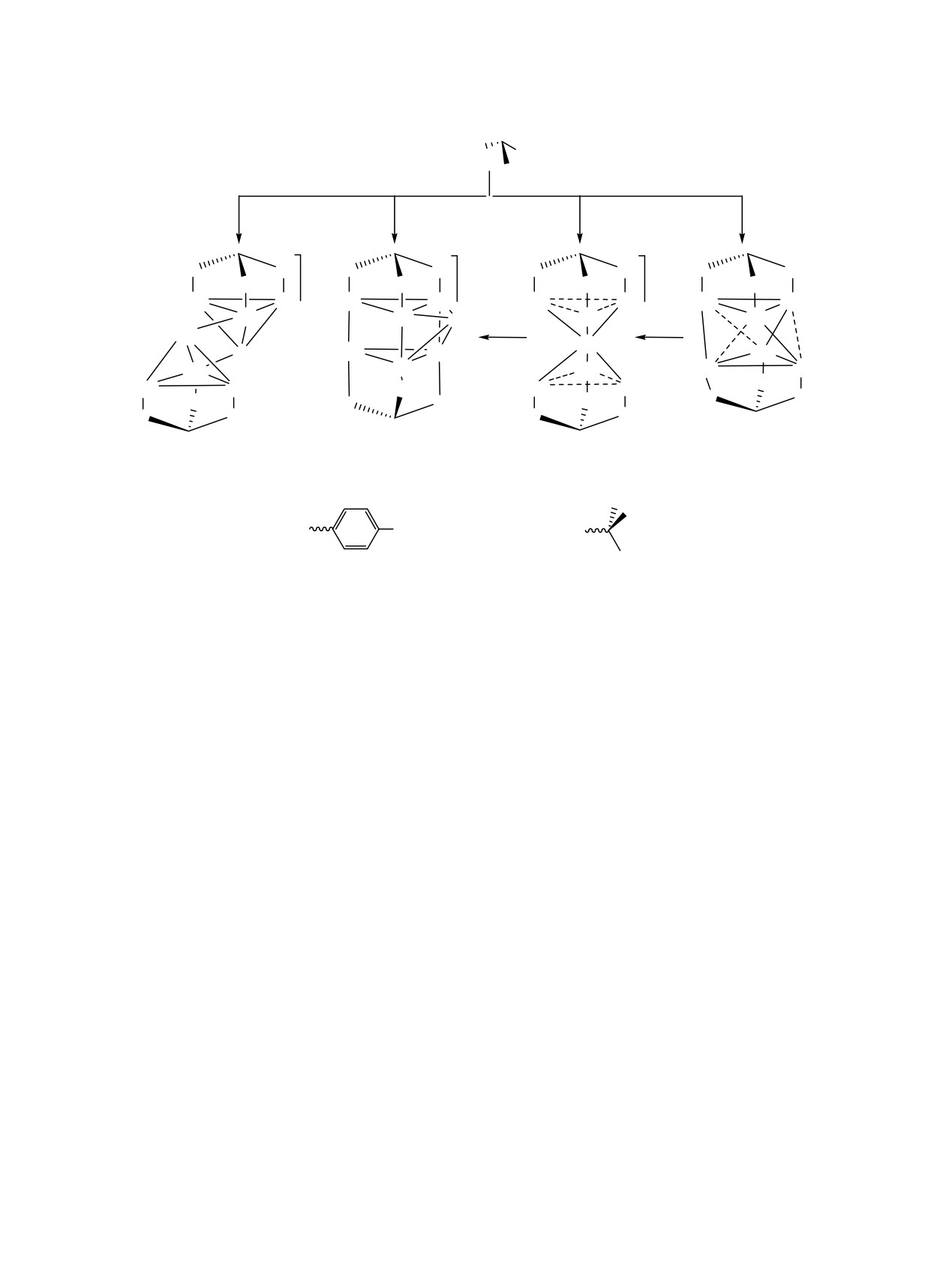
Схема 8.
Ключевой этап самосборки этого молеку-
лярного каркаса включает беспрецедентное
превращение алкинила в темплатный μ4-метил-
= Au
O
идиновый лиганд в мягких условиях. Было обна-
P S P
ружено, что соединения серии 18 могут выступать
в роли хозяина, предоставляя внутрен-нюю полость
2+
P = P(C6H5)2
для размещения малой молекулы гостя.
Замена темплатного лиганда, формирующего
кластерное ядро {Aun} с тридентатными группами
S =
NR2- или S2-, позволило синтезировать каркасные
n
молекулы 19 и 20 (схема 9) [37,38]. Самосборка
n = 1-3
этих агрегатов
крайне чувствительна к
геометрическим параметрам всех строительных
N
N
блоков системы. Разница в величине углов в
пирамидальном фрагменте {Au3X} между кластер-
образующими лигандами NR2- и S2- определяет
оптимальную длину ароматического линкера в
фосфиновом лиганде и силу металлофильного
взаимодействия, что отражается на составе и
O
стабильности кластерного соединения.
В отличие от соединений
19 каркасные
18
структуры 20 проявляют фотолюминесценцию как
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
887
Схема 9.
Схема 10.
X
N
4+
= Au
2+
P
P
n
N
P = P(C6H5)2
N
X = NR2-, n = 1-3 (19);
X = S2-, n = 2-4 (20)
X
N
19, 20
21
= Au
в растворе, так и в твердой фазе, демонстрируя при
этом двойную и совершенно уникальную тройную
P
эмиссию. Эта эмиссия определяется комбинацией
синглетных и триплетных внутрилигандных
переходов без существенного вклада от орбиталей
кластерного фрагмента
{Au3S}. Соотношение
компонентов синглетного и триплетного излучения
=
;
зависит от расстояния между хромофорным
центром фосфинового лиганда и кластерным
металлоцентром Au(I) [38].
Замена дитопного фосфинового лиганда на
P
P
тритопный позволила синтезировать супра-
P = P(C6H5)2
;
молекулярный агрегат
21 (схема
10)
[37]
-
структурный аналог соединения 9 (схема 4) [32].
N = Nt-Bu2-.
Наноразмерная трехмерная молекула
21 не
проявляет люминесцентных свойств, но также, как
стерической защиты эмиссионных центров органи-
агрегаты серии 18, способна выступать в роли
ческими лигандами.
молекулярного
контейнера,
принимая во
внутреннюю полость малые молекулы гостей.
При помощи квантово-химических расчетов
методом DFT
[39] было показано, что для
Использование алкинильных производных в
соединений
22
доминирующую роль в
качестве кластеробразующих лигандов приводит к
фотоэмиссионных свойствах играют металл-
совершенно другим результатам. Реакция
центрированные переходы с переносом заряда
комплекса
[Au2(PPh2(C6H4)PPh2)2]2+ с
«золотым
Au→Au с примесью переходов с переносом заряда
полимером»
[AuC2R]n приводит к образованию
с металла на лиганд с участием π-системы
восьмиядерных
кластеров
[Au8(C2R)6·
алкинильного лиганда.
(PPh2C6H4PPh2)2]2+ 22 (схема 11) [39]. Алкинильные
лиганды (С≡СR)6 не приведены на формулах для
Супрамолекулярные кластерные соединения
простоты изображения, а указаны под структурой.
на основе стереохимически нежестких биден-
Этот тип кластеров, несмотря на стерео-
татных фосфинов. Конформационная нежесткость
химическую нежесткость в растворе, представляет
темплатного фосфинового лиганда, в отличие от
собой набор интенсивных триплетных люмино-
жесткой системы, предоставляет большее
форов с высокими квантовыми выходами эмиссии,
количество степеней свободы для самосборки
а люминесценция этих соединений практически не
супрамолекулярных кластерных
соединений
подвергается
гашению кислородом из-за
металлов подгруппы меди. Одновременно этот
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
888
ГРАЧЁВА
Схема 11.
2+
PPh2
P
P
P
Au P
2+
P
Au
Au
Au
=
[Au(C2R)]n
Au Au
Au
Au
P
Au
PPh2
P Au P
P
P
(C2R)6
22
OH
OH
OH
OH
R =
;
;
;
;
;
;
HO
HO
OH
фактор делает результат менее предсказуемым. В
Комплексы 23 - яркие люминофоры в твердой
частности, сборка алкинилфосфиновых агрегатов
фазе - демонстрируют квантовые выходы фото-
Au(I) с использованием семейства дифосфиновых
эмиссии от
0.6 до максимально возможной
лигандов PR2-X-PR2 с различной стереохимией
величины 1.0. Полосы излучения соединений 23
нежесткого линкера X приводит к получению шести-
лежат в узком диапазоне энергий от 485 до 500 нм,
ядерных соединений [Au6(C2R)4(PR2-X-PR2)2]2+ 23
что указывает на небольшой электронный вклад
с необычной архитектурой кластерного ядра
алкинильных заместителей и остовов фосфиновых
(схема 12) [40]. Алкинильные лиганды (С≡СR)4 не
лигандов в излучающие возбужденные состояния.
приведены на формулах для простоты изобра-
Величина энергии эмиссии соединений 23 связана
жения, а указаны под структурой.
с различиями в морфологии кристаллического
Схема 12.
P Au P
2+
P
Au
Au
P2+
[Au(C2R)]n
Au
Au
P Au P
P
Au
Au
P
(C2R)4
23
P
PCy2
Cy2P
O
PPh2
;
PPh2
=
, n = 2-4;
;
n
PPh2
PPh2
Ph2P
PPh
O
2
P
OH
;
;
R =
HO
HO
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
889
Схема 13.
R
R
R
R
Cl
Cl
Cu
Au
Au
Au
Au
Au
Au
N
P
PH
N
N
P
P
N
N
P
P
N
N
N
+
N
HC2R
Cu
N
N
N
24
25
26
OH
OH
;
R =
;
;
;
HO
HO
состояния для одной и той же молекулы, что
ющих солей металлов со стехиометрическим
демонстрирует влияние параметров упаковки на
количеством трифосфинового лиганда. Эти
фотофизические свойства этого типа соединений.
комплексы способны подвергаться в растворе
диссоциации, которая делает возможным прямой
Стереохимически нежесткие темплатные
обмен металлических центров и получение
фосфины открывают новый подход к созданию
гетерометаллических систем [43].
супрамолекулярных систем на основе комплексов
Au(I), люминесцентные свойства которых реаги-
Реакция гомолептического комплекса Au(I) 27
руют на внешнее воздействие, например, на
с «золотым полимером» или тиолатом C6H5SH в
присутствие молекул растворителей или на
присутствии избытка фосфинового лиганда
различную упаковку в твердой фазе. Полиядерные
приводит к формированию соединений 28 и 29
комплексы Au(I)
24-26 на основе амино-
(схема 14) [28, 44]. Супрамолекулярные кластеры
метилфосфинового лиганда (схема 13) способны
этого типа имеют в своем составе уникальный
демонстрировать конформационную изомерию,
ромбический скелет
{Au4}, способный к
которая определяет свойства этих соединений в
динамической изомеризации в растворе [44].
твердой фазе [41, 42].
Соединения
28 и 29 демонстрируют яркую
При незначительной модификации условий
фосфоресценцию в твердом состоянии с
кристаллизации, в том числе при использовании
максимумом эмиссии в широком диапазоне
различных растворителей, были получены
энергии от 440 до 615 нм. Квантово-химические
различные кристаллические фазы этих комплексов.
расчеты методом DFT подтверждают важную роль
Данные рентгеноструктурного анализа показали,
кластерного скелета в реализации эмиссионных
что конформация молекулы, параметры кристал-
свойств этих комплексов. Относительно высокая
лической ячейки и нековалентные взаимодействия
квантовая эффективность соединений позволила
с молекулами растворителя
- взаимозависимые
использовать их в изготовлении устройства OLED
факторы, и именно их сочетание определяет
[44], которое представляет собой первый успеш-
люминесцентные свойства этих систем в твердой фазе.
ный пример электролюминесцентного устройства с
использованием полиядерного алкинил-фосфи-
Стереохимически нежесткие политопные
нового комплекса Au(I).
фосфиновые лиганды могут быть использованы
для сборки гомолептических комплексов металлов
Замена тридентатного фосфина на разветвлен-
подгруппы меди, как гомо- так и гетерометал-
ный тетрадентатный фосфиновый лиганд
лических (схема
14)
[28,
43]. Образование
позволяет укрупнить металлическое ядро супра-
гомометаллических соединений 27 можно легко
молекулярного кластера и получить соединения 30
осуществить путем взаимодействия соответству-
(схема 15) [43].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
890
ГРАЧЁВА
Схема 14.
Ph
R
Ph
2+
Ph
3+
2+
P
P
P
P
P
P
P
P
P
S Ph
Au
Au
Au
Au
M
Au
M
Au
Au
Au
Au
S
Ph
P
P
P
P
P
P
P
P
P
Ph
Ph
Ph
R
28
27
29
R =
;
X X = H, NMe2, OMe, CF3, C6H5, (C6H4)C6H5;
HO
;
;
P = P(C6H5)2; M = Cu, Ag, Au.
Fe
Fe
Так же, как и соединения 27, эти комплексы,
Целенаправленный подбор политопных фосфи-
стереохимически нежесткие в растворе, способны
новых лигандов с различными заместителями,
подвергаться обмену металлами. Для Cu(I)
позволяет синтезировать разнообразные по составу
кластеры с топологией, аналогичной комплексам
и пространственной организации гомо- и
30, не были получены, а гомометаллический
гетеролептические супрамолекулярные кластерные
кластер Ag(I)
30 не демонстрирует люмине-
системы. Использование в качестве
«дополни-
сцентных свойств.
тельных» лигандов замещенных алкинилов C≡CR-,
а также CCOR3-, NR2-, S2-, SPh-, позволяет
В заключение можно сказать, что способность
контролировать не только пространственное
металлов подгруппы меди M(I) (M = Cu, Ag, Au) к
строение, но и фотофизические свойства этих
проявлению металлофильных взаимодействий
соединений. Необходимо отметить, что именно
делает возможным создание супрамолекулярных
благодаря
вариативности
металлофильных
кластерных соединений различной нуклеарности и
взаимодействий, молекулярные эмиттеры на
открывает перспективы использования этих
основе кластерных комплексов M(I) (M = Cu, Ag,
металлов в дизайне трехмерных каркасных
Au) демонстрируют уникальные фотофизические
архитектур. Несмотря на то, что металлофильные
свойства, в частности, высокие квантовые выходы
взаимодействия усложняют контроль процесса
фосфоресценции, нелинейно оптические свойства,
самосборки, зачастую делая его мало предска-
люминесцентный отклик на внешнее воздействие,
зуемым, осознанный подбор кластер- и каркас-
что открывает широкие перспективы их приме-
образующих лигандов позволяет контролировать
нения для различных практических приложений.
структуру и стехиометрию целевых объектов.
ФОНДОВАЯ ПОДДЕРЖКА
Схема 15.
Работа выполнена при финансовой поддержке
P'
4+
Российского научного фонда (грант №16-13-10064)
P
P'
с использованием оборудования Научного парка
P'
M
Санкт-Петербургского госуниверситета, а также
M'
M
Аналитического центра нано- и биотехнологий
P'
M
Санкт-Петербургского политехнического университета.
P
P'
P'
КОНФЛИКТ ИНТЕРЕСОВ
30
Авторы заявляют об отсутствии конфликта
P' = P(C6H5)2; M, M' = Ag, Au.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ДИЗАЙН СУПРАМОЛЕКУЛЯРНЫХ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
891
СПИСОК ЛИТЕРАТУРЫ
14. Грачева Е.В., Крупеня Д.В., Пилюгина Т.С., Туник С.П.,
Пурсиаинен Й., Хаукка М. // ЖОХ. 2006. Т. 76. Вып. 5.
1. Туник С.П. // Изв. АН. Сер. хим. 2004. Т. 12. С. 2547;
С. 718; Gracheva E.V., Krupenya D.V., Pilyugina T.S.,
Tunik S.P. // Russ. Chem. Bull. 2004. Vol. 53. N 12.
Tunik S.P., Pursiainen J., Haukka M. // Russ. J. Gen.
P. 2657. doi 10.1007/s11172-005-0172-0
Chem.
2006. Vol.
76. P.
682. doi
10.1134/
S1070363206050033
2. Farrar D.H., Grachova E.V., Lough A., Patirana C.,
Poë A.J., Tunik S.P. // J. Chem. Soc. Dalton Trans.
15. Tunik S.P., Khripun V.D., Balova I.A., Nordlander E.,
2001. N 13. P. 2015. doi 10.1039/b010109p
Haukka M., Pakkanen T.A., Raithby P.R.
//
Organometallics. 2001. Vol. 20. N 18. P. 3854. doi
3. Грачева Е.В., Линти Г.// ЖОХ. 2010. Т. 80. Вып. 3.
10.1021/OM010400A
С. 389; Gracheva E.V., Linti G. // Russ. J. Gen. Chem.
2010. Vol. 80. P. 414. doi 10.1134/S1070363210030072
16. Dolgushin F.M., Grachova E.V., Heaton B.T., Iggo J.A.,
Koshevoy I.O., Podkorytov I.S., Smawfield D.J., Tunik S.P.,
4. Monakhov K.Y., Grachova E.V., Starova G.L., Zessin T.,
Whyman R., Yanovskii A.I. // J. Chem. Soc. Dalton
Linti G. // J. Organomet. Chem. 2012. Vol. 714. P. 22.
Trans. 1999. N 10. P. 1609. doi 10.1039/a809118h
doi 10.1016/j.jorganchem.2012.03.003
17. Koshevoy I.O., Grachova E.V., Tunik S.P., Haukka M.,
5. Grachova E.V., Heaton B.T., Iggo J.A., Podkorytov I.S.,
Pakkanen T.A., Heaton B.T., Iggo J.A., Podkorytov I.S. //
Smawfield D.J., Tunik S.P., Whyman R. // J. Chem. Soc.
Dalton Trans. 2004. N 22. P. 3893. doi 10.1039/
Dalton Trans. 2001. N 22. P. 3303. doi 10.1039/
b410216a.
b101962g
18. Koshevoy I.O., Tunik S.P., Jääskeläinen S., Haukka M.,
6. Farrar D.H., Grachova E.V., Haukka M., Heaton B.T.,
Pakkanen T.A. // J. Chem. Soc. Dalton Trans. 2001.
Iggo J.A., Pakkanen T.A., Podkorytov I.S., Tunik S.P. //
N 20. P. 2965. doi 10.1039/b108224h
Inorg. Chim. Acta. 2003. Vol. 354. P. 11. doi 10.1016/
S0020-1693(03)00315-3
19. Koshevoy I.O., Haukka M., Pakkanen T.A., Tunik S.P. //
Dalton Trans. 2006. N 47. P. 5641. doi 10.1039/
7. Grachova E.V., Haukka M., Heaton B.T., Nordlander E.,
B609253E
Pakkanen T.A., Podkorytov I.S., Tunik S.P. // Dalton
20. Grachova E.V., Jutzi P., Neumann B., Schebaum L.O.,
Trans. 2003. N 12. P. 2468. doi 10.1039/b211790h
Stammle rH.-G., Tunik S.P. // J. Chem. Soc. Dalton
8. Ponomarenko V.I., Krupenya D.V., Grachova E.V.,
Trans. 2002. N 3. P. 302. doi 10.1039/b109327d
Gindin V.A., Selivanov S.I., Koshevoy I.O., Tunik S.P.,
21. Grachova E.V., Jutzi P., Neumann B., Stammle rH.-G. //
Haukka M., Pursiainen J., Pirilä P.// Z. anorg. allg.
Dalton Trans. 2005. N 22. P. 3614. doi 10.1039/b513015h
Chem. 2009. Vol. 635. N 15. P. 2515. doi 10.1002/
zaac.200900259
22. Grachova E.V., Linti G., Stammle r H.-G., Neumann B.,
Tunik S.P., Wadepohl H. // Eur. J. Inorg. Chem. 2007.
9. Андреев И.А., Грачева Е.В., Туник С.П., Опарина Л.А.,
N 1. P. 140. doi 10.1002/ejic.200600705
Сухов Б.Г., Малышева С.Ф., Киношита И., Нишиока Т. //
23. Grachova E.V., Linti G. // Eur. J. Inorg. Chem. 2007.
Изв. АН. Сер. хим. 2007. Т. 7. С. 1294; Andreev I.A.,
Grachova E.V., Tunik S.P., Oparina L.A., Sukhov B.G.,
N 22. P. 3561. doi 10.1002/ejic.200700198
Malysheva S.F., Kinoshita I., Nishioka T. // Russ. Chem.
24. Schmidbaur H.// Chem. Soc. Rev. 1995. Vol. 24. N 6.
Bull. 2007. Vol. 56. N 7. P. 1343. doi 10.1007/s11172-
P. 391. doi 10.1039/cs9952400391
007-0205-y
25. Yam V.W.-W., Lo K.K.-W. // Chem. Soc. Rev. 1999.
10. Heaton B.T., Grachova E.V., Tunik S.P., Podkorytov I.S. //
Vol. 28. N 5. P. 323. doi 10.1039/a804249g
Dalton Trans. 2015. Vol. 44. N 37. P. 16611. doi
26. Shakirova J.R., Grachova E.V., Gurzhiy V.V., Koshe-
10.1039/c5dt01099c
voy I.O., Melnikov A.S., Sizova O.V., Tunik S.P., Lagu-
na A.// Dalton Trans. 2012. Vol. 41. N 10. P. 2941. doi
11. Tunik S.P., Grachova E.V., Denisov V.R., Starova G.L.,
Nikol’skii A.B., Dolgushin F.M., Yanovsky A.I.,
10.1039/c2dt11710j
Struchkov Y.T. // J. Organomet. Chem. 1997. Vol. 536-
27. Shakirova J.R., Grachova E.V., Melekhova A.A.,
537. P. 339. doi 10.1016/S0022-328X(96)06719-8
Krupenya D.V., Gurzhiy V.V., Karttunen A.J., Koshe-
voy I.O., Melnikov A.S., Tunik S.P. // Eur. J. Inorg.
12. Ponomarenko V.I., Pilyugina T.S., Khripun V.D.,
Chem. 2012. N 25. P. 4048. doi 10.1002/ejic.201200362
Grachova E.V., Tunik S.P., Haukka M., Pakkanen T.A. //
J. Organomet. Chem. 2006. Vol. 691. N 1-2. P. 111. doi
28. Dau T.M., Shakirova J.R., Doménech A., Jänis J.,
10.1016/j.jorganchem.2005.08.007
Haukka M., Grachova E.V., Pakkanen T.A., Tunik S.P.,
Koshevoy I.O. // Eur. J. Inorg. Chem. 2013. N 28.
13. Пономаренко В.И., Грачева Е.В., Кошевой И.О.,
P. 4976. doi 10.1002/ejic.201300615
Гиндин В.А., Туник С.П., Пурсиаинен Й., Хаукка М. //
ЖОХ. 2010. Т. 80. Вып. 3. С. 382; Ponomarenko V.I.,
29. Shakirova J.R., Grachova E.V., Melnikov A.S., Gur-
Gracheva E.V., Koshevoi I.O., Gindin V.A., Tunik S.P.,
zhiy V.V., Tunik S.P., Haukka M., Pakkanen T.A.,
Pursiainen I., Haukka M. // Russ. J. Gen. Chem. 2010.
Koshevoy I.O. // Organometallics. 2013. Vol. 32. N 15.
Vol. 80. P. 408. doi 10.1134/S1070363210030060
P. 4061. doi 10.1021/om301100v
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
892
ГРАЧЁВА
30. Jobbágy C., Deák A.// Eur. J. Inorg. Chem. 2014. Vol.
38. Shakirova J.R., Grachova E.V., Sizov V.V., Starova G.L.,
2014. N 27. P. 4434. doi 10.1002/ejic.201402249
Koshevoy I.O., Melnikov A.S., Gimeno M.C., Laguna A.,
31. Ramazanov R.R., Kononov A.I., Nesterenko A.M.,
Tunik S.P. // Dalton Trans. 2017. Vol. 46. N 8. P. 2516.
Shakirova J.R., Grachova E.V., Koshevoy I.O., Tunik S.P. //
doi 10.1039/C6DT04126D
J. Phys. Chem. (C). 2016. Vol. 120. P. 25541. doi
39. Koshevoy I.O., Chang Y.-C., Karttunen A.J., Selivanov S.I.,
10.1021/acs.jpcc.6b0871
Jänis J., Haukka M., Pakkanen T.A., Tunik S.P.,
Chou P.-T. // Inorg. Chem. 2012. Vol. 51. N
13.
32. Shakirova J.R., Grachova E.V., Gurzhiy V.V.,
P. 7392. doi 10.1021/ic300856h
Thangaraj S.K., Jänis J., Melnikov A.S., Karttunen A.J.,
Tunik S.P., Koshevoy I.O. // Angew. Chem. Int. Ed.
40. Koshevoy I.O., Chang Y.-C., Chen Y.-A., Karttunen A.J.,
2018. Vol.
57. N
43. P.
14154. doi
10.1002/
Grachova E.V., Tunik S.P., Jänis J., Pakkanen T.A.,
anie.201809058
Chou P.-T. // Organometallics. 2014. Vol. 33. N 9.
P. 2363. doi 10.1021/om5002952
33. Chen Y.-T., Krytchankou I.S., Karttunen A.J., Grachova E.V.,
41. Strelnik I.D., Gurzhiy V.V., Sizov V.V., Musina E.I.,
Tunik S.P., Chou P.-T., Koshevoy I.O.
//
Karasik A.A., Tunik S.P., Grachova E.V.
//
Organometallics. 2017. Vol. 36. N 2. P. 480. doi
CrystEngComm. 2016. Vol. 18. N 39. P. 7629. doi
10.1021/acs.organomet.6b00866
10.1039/C6CE01272H
34. Kritchenkov I.S., Gitlina A.Y., Koshevoy I.O., Melni-
42. Strelnik I.D., Musina E.I., Grachova E.V., Karasik A.A.,
kov A.S., Tunik S.P. // Eur. J. Inorg. Chem.
2018.
Sinyashin O.G. // Phosphorus, Sulfur, Silicon, Relat.
Vol. 2018. N 34. P. 3822. doi 10.1002/ejic.201800631
Elem.
2016. Vol.
191. N
11-12. P.
1518. doi
35. Krytchankou I.S., Koshevoy I.O., Gurzhiy V.V.,
10.1080/10426507.2016.1212346
Pomogaev V.A., Tunik S.P. // Inorg. Chem. 2015. Vol. 54.
43. Dau M.T., Shakirova J.R., Karttunen A.J., Grachova E.V.,
N 17. P. 8288. doi 10.1021/acs.inorgchem.5b00239
Tunik S.P., Melnikov A.S., Pakkanen T.A., Koshevoy I.O. //
36. Koshevoy I.O., Haukka M., Selivanov S.I., Tunik S.P.,
Inorg. Chem. 2014. Vol. 53. N 9. P. 4705. doi 10.1021/
Pakkanen T.A. // Chem. Commun. 2010. Vol. 46. N 47.
ic500402m
P. 8926. doi 10.1039/c0cc03953e
44. Dau T.M., Chen Y.-A., Karttunen A.J., Grachova E.V.,
37. Shakirova J.R., Grachova E.V., Karttunen A.J., Gur-
Tunik S.P., Lin K.-T., Hung W.-Y., Chou P.-T.,
zhiy V.V., Tunik S.P., Koshevoy I.O. // Dalton Trans.
Pakkanen T.A., Koshevoy I.O. // Inorg. Chem. 2014.
2014. Vol. 43. N 16. P. 6236. doi 10.1039/c3dt53645a
Vol. 53. N 24. P. 12720. doi 10.1021/ic501470v
Design of Supramolecular Cluster Compounds
of Copper Subgroup Metals Based on Polidentate Phosphine Ligands
E. V. Grachova*
St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: e.grachova@spbu.ru
Received March 7, 2019; revised March 7, 2019; accepted March 12, 2019
Principles and examples of the assembly of heteroleptic supramolecular cluster metal compounds of copper
subgroups based on polydentate phosphine ligands of various topologies are considered. The choice of an
organic linker in the phosphine molecule allows one to control the formation of three-dimensional aggregates
with a regular architecture, and the choice of alkynyl ligands determines their luminescent properties.
Keywords: copper subgroup metals, metallophilic and aurophilic interactions, phosphine ligands, cluster
compounds, cage molecules, molecular emitters
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019