ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 6, с. 893-908
УДК 541(64+49):539.199
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА ДЛЯ
ВЫЧИСЛЕНИЯ ВНУТРЕННИХ КОНСТАНТ РАВНОВЕСИЯ
И МИКРОКОНСТАНТ КОМПЛЕКСООБРАЗОВАНИЯ
© 2019 г. А. Г. Кудрев*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: kudrevandrei@mail.ru
Поступило в Редакцию 12 марта 2019 г.
После доработки 12 марта 2019 г.
Принято к печати 15 марта 2019 г.
Настоящий обзор посвящен матричному методу моделирования комплексообразования в растворе.
Показана применимость метода для интерпретации спектрометрических и калориметрических данных
для систем, содержащих одновременно большое число форм комплексов. Проанализированы работы,
где данный
метод
был
использован для вычисления равновесных внутренних констант
комплексообразования и для расчета констант цис/транс-изомеризации комплексов. С помощью
матричного метода моделирования продемонстрирована кооперативность связывания аммиака ионами
Mg2+, Сa2+, Zn2+, Cd2+ и Ni2+ в водном растворе. Для галогенидных комплексов Pt(II), Pd(II) и Au(III),
имеющих плоскоквадратное строение, показано различие между взаимовлиянием лигандов в цис- и
транс-изомерах. Рассмотрен вопрос о верификации гипотезы о геометрии координационного полиэдра
соединений Cu2+, образующихся в процессах равновесного ступенчатого комплексообразования в
смешанных растворителях.
Ключевые слова: матричный метод, матричная модель комплексообразования, внутренние константы
DOI: 10.1134/S0044460X19060075
К настоящему времени известно огромное
большого числа форм смешанолигандных
число примеров систем, в которых ступенчато
комплексов. Как отмечено в работе М. Бека:
образуются моноядерные комплексы, содержащие
«Совершенно очевидно, что обычные химические
разное число молекул растворителя и лигандов
методы непригодны для определения всех
M(Solv)xLm. При традиционном подходе устойчи-
составляющих равновесного раствора, а соответст-
вость и спектральные характеристики отдельных
вующие константы равновесной реакции рассчи-
(молекулярных форм) комплексов вычисляются
таны быть не могут»
[1]. При применении
согласно стандартной модели ступенчатого комп-
традиционной модели ступенчатого присоедине-
лексообразования. Однако присутствие одно-
ния для описания связывания лигандов с
временно большого числа смешанно-лигандных
комплексообразователем, имеющим N экви-
комплексов затрудняет полное термодинамическое
валентных сайтов, необходимо N ступенчатых
описание равновесий в этих системах и часто
констант устойчивости. Однако если сайты не
вызывает модельную неопределенность.
эквивалентны, например в случае плоско-
квадратной геометрии координационного поли-
Для газофазных систем характеристики комп-
эдра, необходимо определить четыре ступенчатые
лексообразования можно получить с исполь-
константы равновесия и еще одну из
зованием квантово-химических расчетов, что
микроконстант (константу равновесного процесса,
позволяет полностью охарактеризовать образую-
протекающего между различными структурными
щиеся соединения. Однако для растворов такие
формами) для полного описания системы [1].
расчеты пока не дают результатов, удовлетво-
рительно совпадающих с экспериментом. Хими-
Матричный метод расчета параметров и
ческие методы также непригодны для установ-
верификации модели комплексообразования был
ления всех параметров сложных равновесий из-за
первоначально разработан с целью упрощения
893
894
КУДРЕВ
описания систем, в которых содержится большое
микроформ), которые может иметь комплексо-
число форм комплексов. Матричная модель
образователь со связанными лигандами, харак-
комплексообразования позволила сократить число
теризуется микроконстантами. В концепции
параметров, необходимых для вычисления равно-
микроконстант расчет всегда основан на каком-
весных концентраций, диаграмм распределения и
либо очевидном предположении, но это
функции образования.
предположение невозможно доказать в строгом
термодинамическом смысле этого слова
[1]. В
Матричная модель комплексообразования. В
матричной модели комплексообразования рассмат-
данной модели в отличие от традиционной модели
ривается система, в которой лиганд присо-
ступенчатого
комплексообразования
вместо
единяется к комплексообразователю, имеющему
независимых ступенчатых констант равновесия
набор сайтов связывания. В публикациях по
вычисляются внутренние равновесные константы
биофизике и молекулярной биологии по
связывания лиганда центральным ионом с
отношении к молекуле такого комплексо-
фиксированными координационными вакансиями
образователя используют термин
«матрица», а
(сайтами). В матричная модель комплексо-
модель комплексообразования называют матрич-
образования для описания связывания лигандов с
ной моделью. Очевидно, такие термины
комплексообразователем, имеющим эквивалентные
применимы и для координационных соединений, в
сайты, например, когда образуется тетра-
которых комплексообразователем, как правило,
эдрический комплекс достаточно двух незави-
является
сольватированный
ион металла.
симых переменных, а именно внутренней
Параметрами матричной модели комплексо-
константы связывания первого лиганда (Kin) и
образования являются внутренние константы
поправки на взаимное влияние (ω) вместо четырех
обратимого связывания лиганда центральным
ступенчатых констант. Матричная модель
ионом с фиксированными сайтами (¯ ≡ Kin).
комплексообразования дает возможность полного
Согласно данной модели, в комплексах металлов
описания равновесного образования плоско-
сайты находятся в вершинах координационного
квадратного комплекса с помощью трех незави-
полиэдра на определенных, расстояниях от
симых параметров: Kin и двух поправок на
центрального атома, не сильно меняющихся после
взаимное влияние ωcis и ωtrans вместо пяти констант
присоединения очередного лиганда. В матричной
в традиционном методе.
модели комплексообразования не нарушаются
представления о константах равновесия, характе-
По математическому описанию равновесия
ризующих изменение свободной энергии в системе
матричная модель комплексообразования анало-
в ходе комплексообразования. Допущение о том,
гична модели адсорбции, широко используемой
что присоединение очередной молекулы лиганда к
для моделирования связывания маленьких молекул
центральному иону детерминировано тем, в каких
полимерами, макромолекулами и олигомерами
положениях находятся ранее присоединившиеся
различной длинны
[2-11]. Для таких систем
лиганды, позволяет вычислить соотношение между
применяют модели, в которых вычисляются
ступенчатыми константами равновесия. В
усредненные константы связывания лиганда
простейшем случае комплексообразование в
мультисайтовым
комплексообразователем
и
инертных растворителях, как и в газовой фазе,
учитывается взаимное влияние между связанными
сводится к
«чистой ассоциации»
[19]. В этом
молекулами лигандов [12-18]. Эти методы обычно
случае при координации первого лиганда
не используются для координационных соеди-
изменение свободной энергии обусловлено
нений из-за существенного различия значений
энергетическими эффектами образования связи
ступенчатых констант образования.
металл-лиганд. Последующее присоединение
Ступенчатые формы комплексов (молекулярные
лигандов сопровождается таким же энерге-
формы) характеризуются числом связанных
тическим эффектом в дополнение к изменению
лигандов независимо от того, к каким
энергии связи M-L за счет взаимного влияния
координационным вакансиям (сайтам) они присо-
между лигандами. Разница констант присо-
единены. Константа равновесия присоединения
единения первого и последующих лигандов в
очередного лиганда известна как ступенчатая или
матричной модели учитывается в каждой
стехиометрическая, макроскопическая константа
конкретной конфигурации поправкой на взаимное
[1]. Полный набор конфигураций (микросостояний,
влияние между входящими лигандами. Если
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
895
процесс идет в растворе, то при координации
cX - [X]
[X]s SBk
(5)
первого лиганда изменение свободной энергии
Nform =
=
cMe
1 + [X]sBk
обусловлено разницей в энергиях связи металл-
лиганд, металл-связанный растворитель, а также
Здесь S
- сумма элементов строки матрицы
изменением свободной энергии за счет
M(2N, N); строка матрицы M отображает
пересольватации лиганда и комплекса.
возможную конфигурацию комплекса c после-
ΔG1 = ΔGM-L + ΔGsolv = -RTln¯.
(1)
довательностью нулей в положениях, где сайты
свободны, и с последовательностью единиц в
Логарифм константы устойчивости каждой
положениях, где сайты заняты лигандами.
микроформы является суммой логарифмов
микроконстант равновесий присоединения лиганда
Уравнения (3) и (5) формально соответствуют
к отдельным сайтам с поправкой (ω) на взаимное
простейшей схеме чистой ассоциации лиганда и
влияние, которая определяется геометрией
центрального иона при условии, что число
координационного полиэдра (2).
микросостояний вычисляем по уравнению (4). При
выводе этих уравнений не учитывалось то, что при
lgBk = N lg(Kω).-
(2)
комплексообразовании в растворе лиганд замещает
i=1
координированные молекулы растворителя. Как
было отмечено выше, изменение свободной
Сумма констант Bk устойчивости конфигураций
энергии при координации первого лиганда
(микросостояний) характеризует устойчивость
описывается уравнением
(1).
Допустим, что
комплекса с определенным числом и положением
последующее присоединение лигандов сопровож-
координированных лигандов. Когда сайты комп-
дается таким же энергетическим эффектом
лексообразователя эквивалентны по отношению
пересольватации плюс изменением энергии связи
друг к другу, параметры взаимного влияния
M-L за счет взаимного влияния лигандов. Разница
подчиняются соотношению ωn = ωn(n-1). Равно-
констант присоединения первого и последующих
весные концентрации всех форм, присутствующих,
лигандов в рамках такого приближения, также как
например, в системе
[MeLn] (n
=
1,
2…N)
и в адсорбционной схеме, будет задаваться
вычисляем в обобщенном виде по формуле (3).
поправкой на взаимное влияние лигандов и
-
координированным растворителем по аналогии с
{(Ksω)Τ [X]s}T
(3)
cform =
cMe,
тем, как вводится поправка w.
Ksω)Τ [X]s-
Когда сайты эквивалентны и координационное
где матрицы, входящие в формулу, имеют вид:
¯s =
число (КЧ) центрального иона не меняется в ходе
[1,
¯,
¯2 …
¯N]; [X]s = (1, [X], [X]2 …[X]N)T; w =
замещения растворителя, то константу устой-
[1, N
… mnωn(n-1)…mNωN(N-1)]. Общее число
чивости комплекса определяет не только число
возможных вариантов (m) координации N лигандов
связанных лигандов, но и число незамещенных
к центральному иону, имеющему N мест для
молекул растворителя находящиеся во внутренней
присоединения, связано с mn и энтропиями Sn
координационной сфере. Как было показано в
состояний с определенным числом координи-
работе [20], для центрального иона с КЧ = 4
рованных лигандов уравнением (4).
физический смысл вычисляемых констант при
этом будет определяться соотношениями
¯ = Kω3 и
N
N
N!
m = Σ mn = Σ
= 1+ Σ exp(Sn/k) = 2N.
(4)
ω = ωl/ωs, где
¯ - внутренняя константа с учетом
n=0
n!(N - n)!
влияния растворителя; ωs - коэффициент взаим-
n=0
ного влияния растворителя; ωl - коэффициент
Здесь k
- постоянная Больцмана, n
- число
взаимного влияния лигандов. В приведенном
координированных лигандов. Изображая cform как
примере учет влияния растворителя меняет физико-
функцию концентрации лиганда в растворе,
химический смысл независимых параметров, но не
получаем диаграмму распределения иона комп-
меняет их число (см. табл. 1 в работе [20]).
лексообразователя по формам комплексов.
Функция образования с учетом определения
Экспериментальная функция образования Nexp
константы устойчивости конфигурации может
либо равновесные концентрации cexp подходят для
быть вычислена при заданных общих концен-
использования в качестве целевых функций для
трациях металла и лиганда сX и сMe
по формуле (5).
нахождения параметров матричной модели.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
896
КУДРЕВ
Указанные функции вычисляли по ступенчатым
групповая дисперсия (чистая ошибка) для функции
константам равновесия βi, которые обычно
образования для каждой отдельно взятой формы
приводятся в справочниках. Матричная модель, так
комплекса (7).
же как и модель ступенчатого комплексо-
1
Np Nr
образования, позволяет для произвольной концен-
2
σ
(7)
PE =
Σ Σ (−j - Fij)2.
трации лиганда и металла вычислить значение
Np Nr - 1
j
i
функции образования и распределение централь-
Здесь Np - число концентрации лиганда. Груп-
ного иона между комплексами, образующимися в
повая дисперсия имеет следующий вид (8).
условиях равновесия. Параметры матричная
Np
модель комплексообразования, вычисленные путем
1
(8)
Σ (yj - ∧j)2.
подгонки к построенным по константам равно-
σLOF =2 Np - 1
j
весия диаграммам, эквивалентны параметрам,
найденным непосредственно из результатов
Здесь ¯j - среднее из Nr значений Yij для j-ой
измерений в пределах погрешности эксперимента.
концентрации
[X], ¯j
- значения, лежащие на
Зная модель комплексообразования, в принципе,
линиях, рассчитанных по уравнениям (3) или (5) и
можно построить диаграмму при любых
соответствующие j-ой концентрации [X]. Расчет
концентрациях компонентов раствора. Если
вышеприведенных дисперсий позволяет проверить
математическая модель (в нашем случае набор
расхождение рассчитанной и экспериментальной
констант равный числу образующихся комплексов)
величины в пределах изменений вызванных
адекватно описывает экспериментальные данные,
случайной ошибкой параметров исходной модели.
то расхождение их с результатом решения
Модель принимается, если выполняется условие
обратной задачи должно лежать в пределах
(9).
погрешности.
Ftabl < σLOF/ σPE.
(9)
В рассмотренных ниже работах набор констант,
Здесь Ftabl табличное значение критерия Фишера
использованный для построения функции образо-
[22]. Выполнение условия (9) говорит о том, что в
вания и диаграмм распределения, считается исход-
исследованном интервале концентраций объект
ной моделью, а профили, вычисленные исходя из
отвечает матричной модели с внутренней
этой модели ступенчатого присоединения
-
константой
¯ и поправками на взаимное влияние
восстановленными профилями. Параметры модели
между лигандами w. В качестве критерия
соответствуют минимуму суммы квадратов
соответствия, рассчитанных и теоретических
отклонений всех экспериментальных значений Nexp
концентрационных профилей, был использован
или cexp (Fexp) от соответствующих значений,
фактор Гамильтона (PE). Как правило, соответ-
рассчитываемых по уравнениям
(3) и
(5) на
ствие считалось приемлемым, если PE < 4%.
очередном итерационном шаге (Fcalc). Согласно
принципу максимального правдоподобия, при
Экспериментальные примеры. Галогенидные
условии однородности значений дисперсии
комплексы Cu(II) в метаноле. Для координа-
параметры,
соответствующие
минимуму
ционных соединений Cu(II) с бромид- и хлорид-
среднеквадратичного
отклонения,
отвечают
ионами в метаноле была использована упрощенная
максимально правдоподобной модели системы.
модель эквивалентных сайтов
[23,
24]. Как
Проверка адекватности модели проводилась путем
показали проведенные расчеты, процесс последо-
анализа однородности дисперсий
[21]. При
вательного замещения молекул координиро-
многократном воспроизведении матрицы Nexp,
ванного спирта на анион имеет антикооперативный
также как и cexp, имеем набор Fi матриц. Каждую
характер. Такое поведение было объяснено
экспериментальную матрицу можно представить в
проявлением электростатического отталкивания,
виде матрицы нормально распределенных
возникающего между координированными анио-
случайных величин (6).
нами, что приводит к эффекту, аналогичному
эффекту полиэлектролита [23, 24]. При образо-
Fi = Fexp + ΔFi.
(6)
вании комплексов Cu(II) с галогенид-ионами в
Здесь ΔFi - матрица случайных погрешностей. Для
этом растворителе образуются тетраэдрические
каждой j-ой концентрации лиганда эксперимент
комплексы. Присоединение хлорид-иона к
воспроизводится Nr раз. Рассчитывалась внутри-
центральному иону меди соответствует простей-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
897
шей аддитивной схеме связывания лиганда с
эквивалентными координационными вакансиями.
Возникает вопрос: можно ли с помощью
матричной модели комплексообразования увидеть
стереоселективное взаимное влияние лигандов из
термодинамических данных о процессе заполнения
внутренней координационной сферы? Для ответа
на этот вопрос были изучены плоскоквадратные
комплексы Pt(II) и Pd(II) и Au(III).
Галогенидные комплексы Pt(II) и Pd(II). Для
галогенидных комплексов Pt(II) и Pd(II) вери-
фицирована гипотеза о возможности описания
lg[Cl]-
распределения центрального иона по комплексным
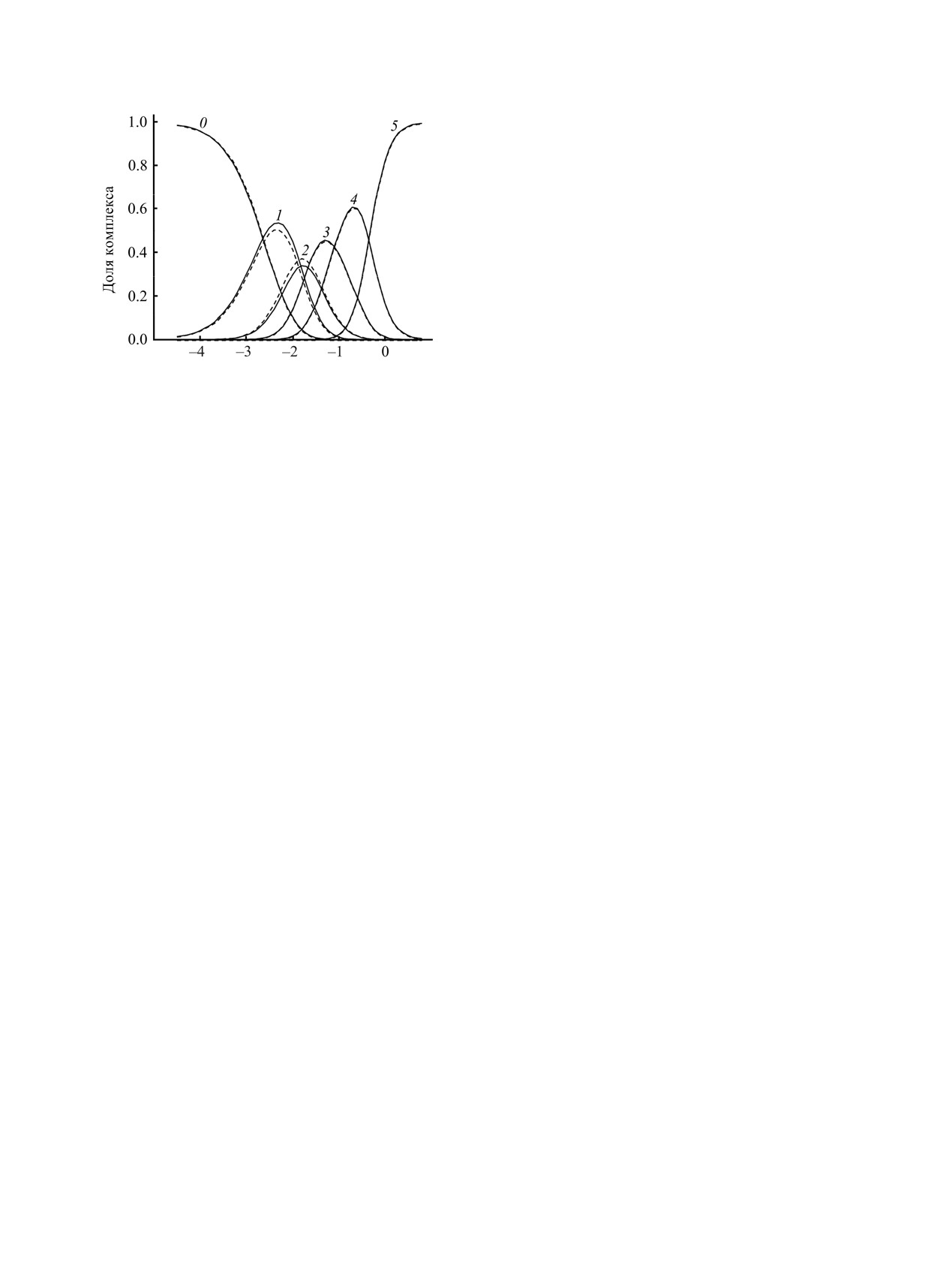
Рис. 1. Диаграмма распределения хлоридных комп-
формам с учетом неэквивалентности координации
лексов платины в зависимости от логарифма
лигандов [20].
равновесной концентрации хлорид-иона в водном
растворе, рассчитанная в соответствии с моделью
Образование галогенидных комплексов Pt(II) и
ступенчатого процесса lgK1 = 5.61, lgβ2 = 9.92, lgβ3 =
Pd(II) в водном растворе рассмотрено в работе [20].
12.82, lgβ4 = 14.61. 1 - Pt(H2O)2+ , 2 - Pt(H2O)3Cl+, 3 -
Для этих соединений присоединение лиганда идет
Pt(H2O)2Cl2,
4
- Pt(H2O)Cl–,
5
- PtCl2-. Точками
с эффектом, значительно отклоняющимся от
обозначены доли равновесных форм, рассчитанных с
аддитивной схемы с эквивалентными сайтами.
использованием матричной модели комплексо-
образования (lgK = 4.96, ωcis = 0.29, ωtrans = 0.57),
Была поставлена задача выяснить устойчивость цис-
пунктиром показано содержание цис- и транс-форм
и транс-изомеров M(Solv)2L2 в растворе [20]. В
Pt(H2O)2Cl2.
случае
D4h-геометрии
при присоединении
очередного лиганда в цис-положение к уже
ризующей октаэдрическое строение комплекса.
координированному в экваториальной плоскости
Концентрационные зависимости cform, рассчи-
лиганду внутренняя константа для обоих сайтов
танные с помощью уравнения
(3)
путем
умножается на величину ωcis, а в случае
варьирования
¯ и w также приведены на рис. 1.
присоединения лиганда в транс-положение по
Отношение дисперсий, вычисленное для каждой из
отношению к занятому сайту внутренняя константа
форм, имеет следующие значения: σLOF/σPE = [0.31,
умножается на величину ωtrans. Для учета этого в
0.14, 2.22, 3.12, 1.07], Ftabl = 1.38 (α = 0.01). Как
матричном уравнении (3) необходимо заменить
видно, для двух форм отношение дисперсий
матрицу w на матрицу, рассчитанную по
превосходят предельно допустимое табличное
уравнению (10).
значение. Таким образом, модель, в которой
w = [1, 4, 2ωtrans + 4ωcis, 4ωtransωcis, ωtransωcis ].
(10)
использованы только два параметра комплексо-
На основе матричной модели комплексо-
образования
¯ и ω, при заданной доверительной
образования с использованием уравнения
(10)
вероятности попадает в критическую область.
были проанализированы экспериментальные
Такой результат дал основание для проверки
данные по комплексообразованию в системе
взаимного влияния лигандов. При оптимизации в
[Pt(H2O)4]2+-Cl-, опубликованные в работах [25-
пространстве трех переменных экспериментальные
31]. По известным ступенчатым константам
диаграммы
распределения
Pt(II)
между
устойчивости были восстановлены концентрацион-
комплексами в растворе описываются лучше, чем
ные зависимости cexp, соответствующие распре-
при оптимизации в пространстве двух незави-
делению Pt(II) между формами комплексов,
симых переменных. Оптимизация с учетом
образованных при присоединении лиганда Cl- во
различного взаимного влияния между лигандами в
внутреннюю координационную сферу металла.
цис- и транс-положениях позволяет уменьшить
Зависимости долей комплексов от логарифма
расхождение между cexp и рассчитанными
равновесной концентрации лиганда показаны на
концентрациями Cform. Погрешность описания cexp
рис.
1. Была проверена возможность описания
также как и функции образования составляет ~3%.
системы в рамках модели, допускающей экви-
Отношение дисперсий, для отдельных форм
валентное взаимное влияние лигандов, характе-
σLOF/σPE = [0.93, 0.92, 0.47, 0.73,
0.47], меньше
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
898
КУДРЕВ
критического значения табличного параметра
значения критического табличного параметра
Ftabl = 1.38 (α = 0.01). Следовательно, исходя из
Ftabl = 1.43 (α = 0.01). Параметрами модели в
статистического критерия, модель, построенная в
данном случае являются внутренняя константа
предположении, что связывание лиганда опреде-
lgKin = 3.28 и поправки на взаимное влияние ωcis =
ляется внутренней константой
¯ и параметрами
0.53 и ωtrans = 0.76. Значение константы цис/транс-
взаимного влияния ωcis и
ωtrans,
адекватно
изомеризации, найденное из кинетики процесса
описывает экспериментальные диаграммы для
замещения воды хлорид-ионом в координационной
системы [Pt(H2O)4]2+-Cl- в растворе. Проведенные
сфере акваиона Pd(II) (2.1±0.3) [30], близко к тому,
расчеты показывают возможность распознавания
что было вычислено с помощью матричной модели
тетраэдрического и плоскоквадратного строения
комплексообразования (Kct = 1.5).
координационного полиэдра комплексообразователя.
При образовании хлорокомплексов Pt(II) и
Была рассчитана константа цис/транс-
Pd(II) из аквакомплексов наблюдается анти-
изомеризации (Kct = 1.89) и поправки на взаимное
кооперативность присоединения хлорид-иона как в
цис-, так и в транс-положение. Возникает вопрос,
влияние (ωcis
=
0.29, ωtrans =
0.57). Величина
найденной в работе [20] константы цис/транс-
проявляется ли стереоселективное взаимное
изомеризации достаточно близка к величине Kct =
влияние при замещении одного галогенид-иона
1.2±0.1, вычисленной по кинетике замещения воды
другим. Внутрисферное замещение одного
хлорид ионом в координационной сфере [Pt(H2O)4]2+
ацидолиганда на другой формально отличается от
в растворе при различных температурах [30].
замещения молекулы растворителя во внутренней
координационной сфере сольватированного иона
Аналогичным способом была установлена
металла при ступенчатом комплексообразовании
неэквивалентность образования цис- или транс-
только тем, что константы равновесия не имеют
конфигураций хлоридных комплексов в системе
размерности. При этом равновесная концентрация
[Pd(H2O)4]2+-Cl-
[20] по экспериментальным
ацидолиганда заменяется отношением входящего и
значениям ступенчатых констант равновесия,
замещаемого лигандов. Оптимизация ступенчатой
приведенным в работах [32-36]. Можно заметить,
модели системы Pd(II)-Cl--Br- (K1 = 1.55, β2 = 2.64,
что поведение системы
[Pd(H2O)4]2+-Cl- очень
β3
=
3.58, β4
=
4.13
[31]) проводилась в
похоже на поведение платиновой системы. Для
пространстве переменных
¯, ωcis и ωtrans.
проверки гипотезы о возможности описания
Расхождение профилей рассчитанных исходя из
кривых титрования без учета неэквивалентности
матричной модели комплексообразования и
координации в цис- и транс-положение учиты-
экспериментальных зависимостей незначительно и
вались две независимых переменных Kin и ω.
однородно во всех точках. Проведенные расчеты
Однако отношение дисперсий для одной из форм
показали, что расхождение составляет менее 3%,
превосходит предельно допустимое табличное
что находится в пределах обычной погрешности
значение, σLOF/σPE = [1.10, 1.71, 0.42, 0.79, 0.41],
эксперимента. Отношения дисперсий, рассчи-
Ftabl = 1.43 (α = 0.01). Таким образом, модель, в
танные по уравнению (9) для отдельных форм
которой использованы только два параметра
σLOF/σPE = [0.13 0.83 1.56 0.05 0.008], Ftabl = 1.60
комплексообразования, при заданной доверитель-
(α = 0.01), при заданном уровне значимости не
ной вероятности попадает в критическую область.
попадают в критическую область. Однако
проведенный расчет с оптимизацией в
Чтобы добиться адекватного описания данных
пространстве двух независимых переменных
эксперимента для системы [Pd(H2O)4]2+-Cl- при
показал, что диаграммы распределения Pd(II)
варьировании концентрации ацидолиганда в
между комплексами для обеих моделей
растворе проведена оптимизация в пространстве
практически полностью совпадают. Следова-
трех независимых переменных. В этом случае
тельно, координацию хлорид-иона невозможно
вычисленные и экспериментальные диаграммы
отличить от координации бромид-иона при
распределения Pd(II) между комплексами в
образовании смешанно-лигандных галогенидных
растворе практически совпадают. Погрешность
комплексов Pd(II) в растворе.
описания концентрационных профилей составляет
~0.2%, что ниже обычной погрешности экспери-
Приведенные в работе [20] примеры показы-
мента. Отношение дисперсий для отдельных форм
вают возможность применения матричной модели
σLOF/σPE = [0.88, 1.25, 0.46, 0.70, 0.28] меньше
комплексообразования в качестве альтернативы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
899
традиционной модели в тех случаях, когда погреш-
ность описания концентрационных профилей с
помощью матричного метода находится в пределах
обычной экспериментальной погрешности. Исполь-
зуя матричную модель комплексообразования,
удается вычислить микроконстанту цис/транс-
изомеризации. Вычисленные значения микро-
констант цис/транс-изомеризации аквагалогенидных
комплексов Pt(II) и Pd(II) близки к значениям,
найденным экспериментально в независимых
кинетических исследованиях. Из анализа диаграмм
распределения
и
функции
образования
галогенидных комплексов [Me(H2O)4-nCln]2-n Me =
lg[NH3]
Pt(II), Pd(II) и [PdCl4-nBrn]2- (n = 0-4) в растворе
Рис.
2.
Диаграмма распределения аммиачных
можно сделать вывод, что процесс замещения воды
комплексов магния в зависимости от lg[NH3],
хлорид-ионом в координационной сфере Pt(II) и
рассчитанная в соответствии с моделью ступенчатого
Pd(II)
носит антикооперативный характер.
процесса (K1 = 1.7, β2 = 1.2, β3 = 0.44, β4 = 0.08).
0 -
Mg2+, 1 - Mg(NH3)2+, 2 - Mg(NH3)2+, 3 - Mg(NH3)2+, 4 -
Замещение хлорид-иона бромид-ионом в координа-
Mg(NH3)2+. Пунктиром обозначены доли равновесных
ционной сфере
[PdCl4]2- носит слабо коопера-
форм, рассчитанных с использованием матричной
тивный характер.
модели (Kin = 0.41, ω = 1.09).
Проверка выводов, сделанных на основе
матричной модели комплексообразования с
помощью квантово-химических расчетов (см.
растворов с помощью матричной модели комп-
рис. 2.3 в работе [20]) показала, что цис-изомеры
лексообразования весьма близки между собой.
комплексов Pt(II) и Pd(II) в газовой фазе
Аммиачные комплексы катионов Mg, Ca, Zn,
термодинамически менее устойчивы, чем транс-
Cd, Hg, Ni в растворе. Матричный метод был
изомеры
[20]. Величины констант цис/транс-
применен для изучения связывания аммиака в
изомеризации в газовой фазе, вычисленные
водном растворе катионами ряда металлов с целью
методом DFT и найденные для растворов с
выявления взаимного влияния в аммиачных
помощью матричной модели комплексо-
комплексах [37, 38].
образования, имеют одинаковый порядок. По
данным
квантово-химических
расчетов,
Для систем [M]aq2+-NH3 (M = Mg, Ca, Zn, Cd,
распределение [PdCl2Br2]2- между цис- и транс-
Hg, Ni) комплексообразование обычно описы-
формой в газовой фазе несколько отличается от
ваются формами комплексов [M(NH3)n]2+ (n = 1…
ожидаемого при отсутствии неэквивалентности
N)
[39,
40]. Исходя из известных значений
сайтов, но оно ближе к статистическому, чем при
ступенчатых констант устойчивости комплексов
замещении галогенид-ионом молекул воды.
Mg2+ с NH3, были восстановлены концентра-
Квантово-химический расчет показал, что
ционные зависимости cexp. Как видно из рис. 2,
распределение [Pt(H2O)2Cl2] между цис- и транс-
расхождение графиков, рассчитанных исходя из
изомерами существенно отличается от чисто
матричной модели комплексообразования и
статистического распределения. В газовой фазе
восстановленных экспериментальных зависимо-
равновесие сдвинуто в сторону образования транс-
стей, очень незначительно и однородно во всех
формы. С такой схемой согласуется соотношение
точках. Значения параметров матричной модели
параметров взаимного влияния ωcis
< ωtrans,
комплексообразования, рассчитанных из восста-
подтвержденное матричной моделью комплексо-
новленной функции образования, практически не
образования.
DFT-Расчет
для
комплекса
отличаются. Погрешность описания концентра-
[Pd(H2O)2Cl2] показал, что равновесие в газовой
ционных профилей и функции образования
фазе также сдвинуто в сторону образования транс-
составляет около 1%, что значительно меньше
формы. Интересно отметить, что величины
обычной погрешности эксперимента. Следова-
констант цис/транс-изомеризации в газовой фазе,
тельно, модель адекватно описывает процесс
вычисленные методом DFT, и найденные для
присоединения аммиака во внутреннюю сферу
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
900
КУДРЕВ
иона магния. Оптимальные параметры модели:
модели для описания изученных профилей.
Kin = 0.41 и w = 1.09.
Параметр взаимного влияния w = 1.15 между
лигандами для системы Ca2+-NH3 немного больше
Анализируя найденные значения констант,
единицы. Следовательно, процесс связывания
любопытно отметить, что присоединение первого
аммиака
имеет
кооперативный
характер.
лиганда к свободному сайту термодинамически
Отношение ступенчатых констант K1/K2, K2/K3, K3/K4
невыгодно. Параметр взаимного влияния немного
(2.4:1.9:2.0)
меньше статистического,
что
больше единицы. Таким образом, процесс
соответствует найденной матричным методом
связывания первой молекулы аммиака хоть и
кооперативности присоединения аммиака к Сa2+. В
слабо, но способствует последующему комплексо-
соответствии с матричной моделью комплексо-
образованию. Согласно модели ступенчатого
образования, замещение воды на аммиак при
процесса константы последовательно уменьша-
образовании тетрааминового комплекса в растворе
ются: K1 =1.70, K2 = 0.71, K3 = 0.36, K4 = 0.18.
идет в тетраэдрических или близких к ним
Однако влияние предыдущей ступени на
позициях. Это не противоречит строению
последующее характеризует не абсолютные
известных кристаллогидратов. В кристаллическом
значения ступенчатых констант, а их отношения.
состоянии в кристаллогидратах координационное
Отношение ступенчатых констант K1/K2, K2/K3, K3/K4
число меняется в зависимости от состава от 6 для
(2.4:2.0:2.0) меньше статистического (2.7:2.2:2.7).
CaCl2·2H2O до 9 для CaCl2·6H2O. Координацион-
Это означает, что
«заполнение некоторых
ный полиэдр в кристаллогидратах не имеет жестко
координационных мест иона металла увеличивает
закрепленной геометрии [41].
возможность вступления следующего лиганда» [1].
При построении матричной модели для данной
В работах [37, 38] было показано, что при
системы использовано предположение о том, что
образовании прочных комплексов с аммиаком
все сайты эквивалентны. Логично было бы считать,
характер взаимного влияния существенно зависит
что найденное соответствие восстановленных
от природы центрального иона. Для иона Zn2+
экспериментальных зависимостей и зависимостей,
отношение ступенчатых констант K1/K2, K2/K3, K3/K4
найденных с помощью матричной модели,
(0.85:0.87:2.24) значительно меньше статистически
указывает на тетраэдрическое строение акваиона и
ожидаемого. Гипотетически это происходит за счет
тетрааминового комплекса в растворе. В
кооперативности комплексообразования. Предполо-
кристаллических кристаллогидратах ион Mg2+
жение подтверждается результатом расчета в
окружен 6 молекулами Н2O. Известен гексааммин
рамках матричной модели комплексообразования.
магния Mg(NH3)6Cl2, имеющий в кристаллическом
Модель комплексообразования в предположении
состоянии структуру флюорита. Очевидно,
тетраэдрического
строения
тетрааминового
полученный результат указывает на то, что при
комплекса цинка определяется внутренней
образовании очень непрочных комплексов
константой Kin ~
60 и параметром взаимного
стереоселективность практически не проявляется.
влияния ω
=
1.45. Аналогичное строение
Либо замещение воды на аммиак при образовании
приводится для
[Cd(NH3)4]2+
[42]. Поэтому в
тетрааминового комплекса идет с тетрагональным
качестве первоначальной матричной модели
искажением структуры, приближающей позиции
заполнения координационных сайтов была
лигандов в растворе к тетраэдрической геометрии.
выбрана модель тетраэдрической геометрии
Взаимодействие аммиака с акваионом Ca2+
координационного окружения центрального иона
очень похоже на комплексообразование с Mg2+.
Td с константами устойчивости, взятыми из базы
Диаграмма относительного содержания аммиач-
данных
[31] для четырех комплексов кадмия.
ных комплексов в зависимости от логарифма
Однако оказалось, что если взять в качестве
равновесной концентрации лиганда для этой
целевой функции матрицу равновесных концен-
системы, вычисленная методом матричной модели
траций, то наблюдается значимое расхождение
комплексообразования, хорошо совпадает c
экспериментальных и рассчитываемых значений.
диаграммой, построенной в соответствии со
Наибольшее отклонение наблюдается в области
справочными значениями констант. Такое решение
первой и второй форм. Такое поведение
наряду с положительным результатом F-теста
однозначно свидетельствует о дополнительном
полностью подтверждает корректность гипотезы о
специфическом взаимовлиянии, проявляющемся
возможности применения двухпараметрической
при координации второго лиганда. Специфическое
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
901
lg[NH3]
lg[NH3]
Рис. 3. Относительное содержание аммиачных комп-
лексов кадмия в соответствии с моделями ступенчатого
Рис.
4.
Относительное содержание аммиачных
процесса: K1 = 398, β2 = 4.47×104, β3 = 1.1×106, β4 =
комплексов ртути как функция lg[NH3] в соответствии
8.3×106 (сплошная линия) и K1 = 398, β2 = 4.47×104,
с моделью ступенчатого процесса (K1 = 5.89×108, β2 =
β3 = 1.1·106, β4 = 8.3×106, β5 = 3.98×106, β6 = 7.9×104
2.75×1017, β3 = 2.57×1018, β4 = 1.51×1019). 0 - Hg2+, 1 -
(точки). 0 - Cd2+, 1 -Cd(NH3)2+, 2 - Cd(NH3)2+, 3 -
Hg(NH3)2+, 2 - Hg(NH3)2+, 3 - Hg(NH3)2+, 4 - Hg(NH3)2+.
Cd(NH3)2+, 4 - Cd(NH3)2+, 5 - Cd(NH3)2+. Пунктиром
Пунктиром обозначены доли равновесных форм, рас-
обозначены доли равновесных форм, рассчитанных с
считанных с использованием матричной модели комп-
использованием матричной модели (Kin = 97.7, ωcis =
лексообразования (Kin = 1.5×108, ωcis = 0.013, ωtrans =
0.68, ωtrans = 1.18).
2.45).
поведение при координации проявляется и в
женными в экваториальной плоскости и в
ступенчатой модели. Согласно этой модели
аксиальных позициях будут существенно
отношение первых двух ступенчатых констант
различаться. В случае иона Cd2+ пятый и шестой
меньше статистического, а отношение второй и
лиганды связываются значительно слабее, чем
третьей больше статистического K1/K2, K2/K3, K3/K4
предыдущие четыре. Присоединение первых
(2.51:6.31:1.99), указывающее на то, что при
четырех лигандов можно считать независимым
заполнении внутренней координационной сферы
процессом, идущим в области высоких
есть стерическая неэквивалентность координи-
концентраций. Диаграммы распределения без
рованных лигандов. Учет цис- и транс-влияния
учета комплексообразования по
5-ой и
6-ой
позволяет оптимизировать расхождение между
ступеням и с их учетом показаны на рис. 3. Как
рассчитанными и экспериментальными целевыми
видно из рисунка, профили, построенные исходя из
функциями (оптимальные параметры: Kin = 94.8,
модели [32], учитывающей образование 4 или 6
ωcis = 0.66, ωtrans = 1.64).
комплексов почти совпадают в интервале
концентраций лиганда -4.5 < lg[X] < -0.5. При
Рассмотренный выше пример показывает
расчете в соответствии с матричной моделью
чувствительность матричной модели к строению
комплексообразования присоединение лиганда в
координационного
полиэдра.
Недостаточно
транс-положение к уже занятому сайту можно
хорошее описание с помощью модели Td указывает
описать
как
кооперативный процесс, а
на необходимость применения более гибкой
присоединение в цис-положение как анти-
модели D4h. Это очень важная особенность
кооперативный процесс. Это говорит о
рассматриваемой модели. Модель D4h может также
термодинамически более предпочтительном образо-
описывать заполнение экваториальной плоскости
вании транс-конфигурации комплекса. Известно,
октаэдрического комплекса. Такая возможность
что в кристаллическом состоянии в комплексах
вполне очевидна с точки зрения электронного
кадмия
[Cd(H3O)4(NH3)2]2+ молекулы аммиака
строения. Если при координации в экваториальной
координированы в транс-положение относительно
плоскости и в аксиальные позиции участвуют
друг друга [41]. В соответствии с этим можно
разные орбитали атома металла, то внутренняя
полагать, что в растворе преобладал транс-изомер
константа связывания лиганда сайтами, располо-
комплекса.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
902
КУДРЕВ
Для акваиона Ni2+ применение матричной
механизма формирования внутренней координа-
модели комплексообразования подтверждает
ционной сферы. Поэтому была разработана особая
октаэдрическое
строение
комплексов
модель - матричная модель комплексообразования,
[Ni(H2O)6-n(NH3)n]2+ в водном растворе. Входящие
позволяющая описывать изменения геометрии
лиганды равновероятно присоединяются в
координационного полиэдра при заполнении
экваториальной плоскости и в аксиальных
внутренней координационной сферы иона
позициях. Для описания такой схемы образования
комплексообразователя в растворах [38, 43].
октаэдрического комплекса с помощью матричной
Отклонение от закономерного изменения
модели комплексообразования достаточно два
концентраций форм комплексов в растворе было
параметра вместо шести независимых ступенчатых
интерпретировано как следствие изменения КЧ
констант в классической модели [22]. Наилучшее
центрального иона или изменения строения
согласие экспериментальных профилей и расчета
координационной сферы в ходе ступенчатого
достигается при параметрах матричной модели
процесса
[38,
43]. В матричной модели
комплексообразования Kin = 100, w = 0.76 (см.
комплексообразования при трансформации гео-
приложение к работе [38]). Процесс комплексо-
метрии и КЧ необходимо учитывать изменение
образования имеет слабо выраженную анти-
числа микросостояний mn, а также изменение
кооперативность.
показателей
степеней при коэффициентах
Вид функции образования и диаграмма
взаимного влияния ωs и ωl. Для описания
концентрационных профилей (рис. 4) при образо-
замещения растворителя с изменением координа-
вании комплексов Hg2+ с аммиаком резко
ционного числа в математической модели нужно
отличаются от рассмотренных выше примеров. Для
добавить коэффициент, учитывающий энергети-
иона этого металла присоединение первых двух
ческий эффект изменения числа замещаемых
лигандов идет в области низкой концентраций.
молекул растворителя ωr, и заменить матрицу w на
Различие в константах присоединения первых и
матрицу, в которой коэффициенты взаимного
последующих лигандов и отношение констант
влияния будут определяться произведениями ωl и
K1/K2, K2/K3, K3/K4
(1.26:5.01·107:1.58) говорит о
ωs в степенях, соответствующих строению
том, что модель Td не может быть правильной. Как
комплекса [43].
следует из анализа дисперсией, данная модель
Трансформация полиэдра при последователь-
попадает в критическую область и должна быть
ном замещении растворителя наблюдается в
отвергнута. Наибольшее несоответствие наблю-
системах Cu(II)-Solv-Cl- (Solv
= диметил-
дается в области форм [Hg(NH3)2]2+ и [Hg(NH3)3]2+.
формамид, диметилсульфоксид, триметилфосфат).
В кристаллической решетке комплексов ртути с
В ДМФА переход от октаэдра к тетраэдру
аммиаком в ионах [(NH3)Hg(NH3)]2+ одноименные
сопровождается скачкообразным увеличением
лиганды координированы в транс-положение
энтропии за счет выхода трех молекул раство-
относительно друг друга [41]. Этой химической
рителя из внутренней сферы в толщу раствора [1].
особенности
Hg2+
соответствует
модель
Эта гипотеза была протестирована с помощью
кооперативного присоединения NH3 в
транс-
матричной модели комплексообразования. На
положение и антикооперативности присоединения
рис. 5 показано изменение долей образующихся
в цис-положение (Kin = 1.5×108, ωtrans = 2.45, ωcis =
комплексов в зависимости от lg[Cl-], вычисленное
0.013).
по матричной модели комплексообразования
Смешанно-лигандные комплексы Cu(II) в
исходя из предположения, что изменение КЧ с 6 до
неводных растворителях. Как отмечалось выше, в
4 происходит на второй ступени процесса.
некоторых растворителях присоединение хлорид-
Вычисленные
профили
отличаются
от
иона к Cu(II) возможно аппроксимировать схемой
экспериментальных
[44] на
24%, что намного
чистой ассоциации. Однако экспериментальные
превосходит обычную экспериментальную погреш-
исследования показывают, что в зависимости от
ность. Профили, соответствующие изменению КЧ
природы растворителя меняется не только
с 6 до 4 на третьей ступени процесса, также
прочность, но и строение образующихся в них
отличаются от экспериментальных более чем на
комплексных соединений Cu2+. Традиционная
20%. Обе протестированные модели попадают в
ступенчатая модель не рассматривает простран-
критическую область. Оптимизация достигается,
ственное строение, что затрудняет понимание
если считать коэффициенты mn, как независимые
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
903
переменные. Расчеты показали, что m1, m3, m4
близки к значениям, заданным уравнением
(4).
Отличается от значения, рассчитанного по
уравнению (4) только параметр m2. Второй лиганд
присоединяется с антикооперативным эффектом
значительно превышающим эффект ожидаемый из
аддитивной схемы. Найденное значение параметра
m2 возможно интерпретировать как уменьшение
числа реализующихся микросостояний из-за очень
сильного
антикооперативного
цис-влияния.
Уменьшение числа микросостояний соответствует
тому, что дихоридный комплекс практически не
образует цис-формы. Наблюдаемое поведение
lg[Cl]-
представляется возможным для такого лабильного
Рис.
5.
Диаграмма распределения комплексов
соединения, в котором сильное электростатическое
Cu(Solv)4-nCl2-n (n = 0-4) в зависимости от концен-
отталкивание между отрицательно заряженными
трации лиганда в растворе, соответствующих модели
лигандами приводит к цис/транс-изомеризации.
lgβ1-4 = [6.79, 11.33, 15.33, 16.85]. (ДМФА, 25°C). 0 -
Очевидно, сильное антикооперативное цис-
Cu(Solv)2+,
1
- Cu(Solv)5Cl+,
2
- Cu(Solv)4Cl2,
3
-
Cu(Solv)Cl–, 4 - СuCl2-. Пунктиром обозначены доли
влияние является также причиной того, что три
равновесных форм, рассчитанных согласно матричной
лиганда не могут быть координированы в одной
модели комплексообразования (lgKin = 6.51, ωl = 0.17,
плоскости. На третьей ступени система вынуждена
ωs = 0.82, ωr = 1, m2 = 3. Точками обозначены доли
находить энергетически более выгодный путь
форм, вычисленные для той же схемы комплексо-
образования, но с коэффициентами mn по аддитивной
изменения геометрии координационного полиэдра
схеме.
с координацией трех лигандов в эквивалентные
положения. Поскольку замещение растворителя на
анион при образовании высших комплексов идет с
образования в этих двух растворителях совпадают
искажением структуры, приближающей позиции
с описанными выше для ДМФА. Также как и в
лигандов в растворе к тетраэдрической геометрии
растворе ДМФА, диаграммы распределения меди
происходит изменение первоначального КЧ при
по формам комплексов описывает модель, учиты-
образовании комплекса
[Cu(Solv)Cl3]-. Присо-
вающая переход от октаэдрической геометрии
единение третьего и четвертого лигандов
сольвата к тетраэдрическому окружению меди в
соответствуют
ситуации,
когда
сайты
тетрахлоридном комплексе.
эквивалентны для входящих лигандов. Найденные
Несколько отличается схема связывания
значения параметров составляют: lgKin = 6.15, ωs =
лиганда Cl- металлом в пропиленкарбонате (PC).
0.17 и ωl = 0.82. Установленная схема подтвер-
Вычисления проведены с использованием констант
ждается с достоверными данным спектро-
равновесия, опубликованных в работе [45]. Второй
фотометрии и рентгеновской дифракции. Во
лиганд присоединяется к иону Cu2+ с эффектом,
внутренней сфере сольватированного иона Cu(II)
значительно отличающимся от аддитивной схемы с
находятся шесть молекул ДМФА (D4h) [45]. На
эквивалентными сайтами. Наблюдаемое поведение
первой ступени комплексообразования образуется
нельзя объяснить изменением КЧ. Максимальное
монохлоридный комплекс
[Cu(ДМФА)5Cl]+. В
согласование получается для матричной модели
комплексе
[Cu(ДМФА)Cl3]-,
по
данным
комплексообразования замещения растворителя
рентгеновской дифракции [45], центральный ион
без изменения КЧ с образованием устойчивых цис-
связан только с одной молекулой растворителя.
и транс-форм комплекса
[CuS2Cl2]. Для учета
Комплекс
[CuCl4]2- не содержит молекул
этого в математической модели (3) необходимо
растворителя во внутренней сфере и имеет
заменить матрицу w на матрицу, рассчитываемую
геометрию несколько искаженного тетраэдра Td.
по уравнению (10). Данная подстановка соответ-
Данные спектрофотометрических исследований
ствует модели связывания лиганда, определяемой
взаимодействия Cu2+ с хлорид-ионом в триметил-
внутренней константой и параметрами взаимного
фосфате и ДМСО, опубликованные в работах [46,
влияния ωcis и ωtrans. Комплекс [Cu(PC)2Cl2] имеет
47], показывают, что особенности комплексо-
плоскоквадратное строение, но в отличие от
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
904
КУДРЕВ
более 27%, что намного превосходит обычную
экспериментальную погрешность. Для учета роли
растворителя для рассматриваемого случая в
математической модели в уравнении
(3)
необходимо заменить матрицу w на матрицу,
определяемую уравнением (11).
w = [1, m1ω5, m2ω4ω2, m3ωrω3ω6, m4ωrω12, ω30].
(11)
Здесь ωr - коэффициент, учитывающий вытеснение
дополнительных молекул растворителя при
связывании 3 и 4 лигандов.
Необходимость введения дополнительного
lg[ДМФА]
коэффициента обусловлена тем, что третий и
четвертый лиганды присоединяются с анти-
Рис. 6. Диаграмма распределения комплексов Cu(II) в
кооперативным эффектом, значительно превы-
растворе CH3CN в зависимости от равновесной концен-
трации добавляемого растворителя lg[ДМФА],
шающим эффект ожидаемый из аддитивной схемы.
соответствующих общим константам устойчивости
Найденное отклонение от аддитивной схемы
lgβ1-4,6 = [2.64, 4.46, 6.12, 7.21, 7.9]. 0 - Cu(CH3CN)2+,
говорит о том, что на третьей ступени лиганд
1 - Cu(CH3CN)5(ДМФА)2+, 2 - Cu(CH3CN)2(ДМФА)2+,
замещает три молекулы связанного растворителя.
3
- Cu(CH3CN)(ДМФА)2+,
4
- Сu(ДМФА)2+,
5
-
Cu(ДМФА)2+. Пунктиром обозначены доли равно-
Число микросостояний первого и второго
весных форм, рассчитанных в соответствии с
комплекса соответствуют координации лиганда
матричной моделью комплексо-образования (lgKin =
только в экваториальной плоскости. При
3.37, ωl = 0.41, ωs = 0.56, ωr = 0.07).
подстановке числа микросостояний, соответ-
ствующих координации по всем
6 вакансиям,
ДМФА в растворе присутствуют как цис-, так и
модель попадает в критическую область (РЕ =
транс-изомеры.
7.4%). Следует отметить, что, согласно модели, у
комплекса
[Cu(ДМФА)4]2+ все четыре лиганда
Показанная в работе
[43] возможность
эквивалентны. Совпадение экспериментального и
применения матричной модели комплексо-
рассчитанного распределения говорит о тетра-
образования для детектирования изменения гео-
эдрическом или сильно искаженном плоско-
метрии координационного полиэдра комплексо-
квадратном строении комплекса.
образователя, открывает перспективы данного
метода для использования в химии коор-
На рис.
6 показано изменение долей
динационных соединений. Но для того, чтобы
образующихся комплексов в зависимости от
убедиться в неслучайном характере обнаруженных
равновесной концентрации лиганда, вычисленное
совпадений, экспериментальных и рассчитанных
из данных эксперимента и с использованием
концентрационных
диаграмм,
необходимо
матричной модели комплексообразования (lgKin =
тестирование модели на широком круге объектов.
3.37, ωl = 0.41, ωs = 0.56, ωr = 0.07). Отклонение
С этой целью была изучена пересольватация Cu2+ в
вычисленных профилей от экспериментальных
неводных растворах [38].
составляет 3.5%, что укладывается в допустимую
погрешность эксперимента. Следовательно, исходя
Для вычисления параметров матричной модели
из статистического критерия, модель адекватно
комплексообразования замещения координиро-
описывает экспериментальные диаграммы для
ванного растворителя CH3CN молекулами более
системы Cu2+-CH3CN-ДМФА при варьировании
сильного донора ДМФА использованы результаты
концентрации лиганда в растворе. В целом процесс
калориметрических измерений, опубликованные в
пересольватации можно представить в виде схемы 1.
[48] (значения ступенчатых констант равновесия
lgβ1-4,6 = [2.64, 4.46, 6.12, 7.21, 7.9]). Расчет показал,
Предполагается, что на третьей и пятой
что изменение долей образующихся комплексов в
ступенях меняется КЧ и происходит изменение
зависимости от lg[L], вычисленное в соответствии
симметрии лигандного окружения. Описанная
с моделью чистой ассоциации, заметно отличается
схема структурных превращений соответствует
от данных эксперимента. Расхождение составляет
экспериментальным исследованиям. По данным
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
905
Схема 1.
○ - CH3CN, ● - ДМФА.
рентгеновской дифракции [49], молекула ацето-
Возникает вопрос, является ли введение
нитрила в экваториальной плоскости [Cu(CH3CN)6]2+
дополнительной формы статистически оправ-
замещается одной молекулой ДМФА. На второй
данным. Проверка показывает, что матричная
ступени реакция, по-видимому, протекает
модель комплексообразования, учитывающая
аналогично, но данные о строении образующегося
образование 6 комплексов попадает в критическую
комплекса отсутствуют. На третьей ступени из
область, РЕ = 19%. Таким образом, можно сделать
внутренней координационной сферы вытесняются
вывод, что дополнительная форма является
также молекулы растворителя, находившиеся на
избыточной, т. е. схема замещения CH3CN
аксиальной оси. Четыре молекулы ДМФА
одинакова в случае ДМФА и ДМСО.
замещают первоначально координированный
Смешанно-лигандные
комплексы
Au(III).
растворитель в экваториальной плоскости, при
Успешное применение матричной модели комп-
этом на аксиальной оси не детектируются ни
лексообразования для получения информации,
CH3CN, ни ДМФА. При дальнейшем увеличении
дополняющей традиционную ступенчатую модель
доли ДМФА в растворе образуется комплекс
комплексообразования, было продемонстрировано
[Cu(ДМФА)6]2+.
на примере вычисления параметров взаимного
влияния лигандов при комплексообразовании в
Как было показано в работе [38], структурные
системе Au3+-Cl--Br- по данным спектро-
превращения при замещении CH3CN на ДМСО в
фотометрического титрования [51, 52]. Выбранная
сольвате Cu2+ совпадают с описанными выше для
в качестве объекта исследования система Au3+-Cl--
ДМФА. Экспериментальные диаграммы распре-
Br- имеет не только теоретический, но и
деления меди по формам комплексов
[50]
практический интерес, обусловленный тем, что
описывает матричная модель комплексообразо-
галогенидные комплексы золота выступают в
вания, учитывающая отклонение от аддитивной
качестве активных катализаторов при гомогенном
схемы присоединения лигандов. Замещение
катализе, а также применяются для приготовления
первоначально координированного растворителя
нанесенных катализаторов, при этом важную роль
идет с понижением КЧ на третьей ступени
играет природа форм комплексов в растворе
процесса. Параметры матричной модели комплексо-
[53-55].
образования: lgKin = 3.82, ωl = 0.37, ωs = 0.50, ωr =
0.06. В отличие от системы Cu2+-CH3CN-ДМФА
По данным УФ спектроскопии, в системе Au3+-
для системы Cu2+-CH3CN-ДМСО наилучшее
Cl--Br- детектируются
5 спектральных форм,
совпадение с данными калориметрии [50] дости-
которым, исходя из химических соображений,
гается для модели, учитывающей образование всех
отвечают комплексы AuBr–, AuBr3Cl-, AuBr2Cl–,
6 комплексов [Cu(DMSO)n]2+ (n = 1-6). Точность
AuBrCl–, AuCl–. Используя ступенчатую схему
описания калориметрической кривой титрования
комплексообразования, были вычислены значения
для моделей 1-6 и 1-4, 6 практически одинакова.
констант равновесия
[51]. Обращает на себя
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
906
КУДРЕВ
внимание тот факт, что отношение констант
образования смешанно-галогенидных комплексов
заметно отличается от статистических ожидаемых
золота(III).
значений при отсутствии взаимного влияния
Таким образом, на примере аммиачных
между координированными лигандами (K0/K1:
комплексов Mg2+, Сa2+, Zn2+, Cd2+, Hg2+, Ni2+,
K1/K2:K2/K3
=
2.7:2.2:2.7).
Данный факт
галогенидных комплексов Pt(II), Pd(II), Au(III) и
свидетельствует о наличии специфических взаимо-
смешанно-лигандных комплексов Cu2+ показано,
действий между координированными лигандами
что с помощью модели матричной модели
одного вида. Практически все известные
комплексообразования можно количественно
комплексы золота(III) имеют плоскоквадратное
учитывать взаимное влияние лигандов и
строение. В случае этой геометрии сайты
определять наиболее вероятную геометрию
неэквивалентны по отношению друг к другу.
координационных полиэдров, что открывает
Следовательно, справедливо предположение, что
возможность для альтернативной интерпретации
связывание лиганда определяется внутренней
данных
спектрометрического
и
калори-
константой и двумя параметрами взаимного
метрического изучения ступенчатого комплексо-
влияния. Погрешность (PE = 1.0%), возникающая
образования и позволяет раскрыть тонкие детали
при описании экспериментальных данных с
процесса этого процесса.
использованием матричной модели комплексо-
образования, адекватно описывает наблюдаемые
КОНФЛИКТ ИНТЕРЕСОВ
изменения спектров поглощения в данной системе
и не превышает погрешность, возникающую в
Авторы заявляют об отсутствии конфликта
результате применения традиционной модели
интересов.
ступенчатого комплексообразования. Согласно
СПИСОК ЛИТЕРАТУРЫ
матричной модели комплексообразования, функция
образования и равновесные концентрации хими-
1. Бек М., Надьпал И. Исследование комплексообразо-
ческих форм будут определяться параметрами:
вания новейшими методами. М.: Мир, 1989. 411 с.
Kin= 50, ωcis = 1.3 и ωtrans = 0.7.
2. McGhee, J.D., von Hippel, P.H. // J. Mol. Biol. 1974.
Vol. 86. P. 469.
Особенность рассматриваемой системы состоит
3. Klotz I.M. // Science. 1982. Vol. 217. P. 1247. doi
в том, что образование цис- и транс-конфигураций
10.1126/science.6287580
имеет разные скорости. Это позволило по
4. Кудрев А.Г. // ЖОХ. 2018. Т. 88. Вып. 12. C. 2063;
кинетическим измерениям определить микро-
Kudrev A.G. // Russ. J. Gen. Chem. 2018. Vol. 88.
константы для реакций образования изомеров (11,
P. 2578. doi 10.1134/S1070363218120198
12) [55].
5. Кудрев А.Г. // ЖОХ. 2016. Т. 86. Вып. 6. C. 1024;
AuCl3Br- + Br- = cis-AuCl2Br– + Cl-,
Kudrev A.G. // Russ. J. Gen. Chem. 2016. Vol. 86.
Kc = 64±13,
(11)
P. 1353. doi 10.1134/S1070363216060219
AuCl3Br- + Br- = trans-AuCl2Br– + Cl-,
6. Kudrev A. // J. Anal. Meth. Chem. 2017. Vol. 2017.
Kt = 34±7.
(12)
Article ID 6780521. doi 10.1155/2017/6780521
7. Кудрев А.Г. // ЖОХ. 2014. Т. 84. Вып. 3. С. 364;
Отношение приведенных констант немного
Kudrev A.G. // Russ. J. Gen. Chem. 2014. Vol. 84. N 3.
отличается от статистически ожидаемой величины
P. 424. doi 10.1134/S1070363214030037
2, что означает более выгодное образование цис-
8. Kudrev A.G. // Talanta. 2013. Vol. 116. P. 541. doi
изомера. С такой схемой согласуется соотношение
10.1016/j.talanta.2013.07.012
параметров взаимного влияния. В рассмат-
9. Кудрев А.Г. // Высокомол. cоед. 2013. Т. 55. № 10.
риваемом случае замещение хлорид-иона бромид-
С. 1245. doi 10.7868/S0507547513090055; Kudrev A.G. //
ионом в цис-положении носит слабокоо-
Polym. Sci. (A). 2013. Vol. 55. P. 586. doi 10.1134/
перативный (ωcis > 1) характер, а замещение в trans-
S0965545X13090022
положении является слабоантикооперативным
10. Кудрев А.Г. // ЖОХ. 2006. T. 76. Вып. 11. C. 1865;
(ωtrans < 1) процессом. Установленное с помощью
Kudrev A.G. // Russ. J. Gen. Chem. 2006. Vol. 76.
матричной
модели
комплексообразования
P. 1782. doi 10.1134/S107036320611020X
сочетание одновременно кооперативности и
11. Кудрев А.Г. // ЖОХ. 2002. Т. 72. Вып. 10. С. 1591;
антикооперативности при комплексообразовании
Kudrev A.G. // Russ. J. Gen. Chem. 2002. Vol. 72.
стоит отметить как интересную особенность
P. 1501. doi 10.1023/A:1023315112622
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
ПРИМЕНЕНИЕ МАТРИЧНОГО МЕТОДА
907
12. Job P. // Ann. Chim. 1928. Vol. 9. P. 113.
Кононова М.А. // Вестн. ЛГУ. 1961. Т. 10. Вып. 1.
13. Scatchard G. // Ann. NY Acad. Sci. 1949. Vol. 51.
С. 152.
P. 660.
35. Cosen J. // Geochim. Cosmochim. Acta. 2003. Vol. 63.
14. Cera E. Thermodynamic Theory of Site-Specific
N 7. P. 1331. doi 10.1016/S0016-7037(02)01271-1
Binding Processes in Biological Macromolecules.
36. Kragten J. // Talanta. 1980. Vol. 27. P. 375. doi
Cambridge: Cambridge University Press, 1995. 296 p.
10.1016/0039-9140(80)80100-7
15. Nechipurenko Yu.D. // Biophysics. 2014. Vol. 59. P. 12.
37. Кудрев А.Г. // ЖОХ. 2009. Т. 79. Вып. 10. С. 1591;
16. Chaires J.B. // Methods in Enzymology. 2001. Vol. 340.
Kudrev A.G. // Russ. J. Gen. Chem. 2009. Vol. 79.
P. 3.
N 10. P. 2087. doi 10.1134/S1070363209100028
17. Le Vu H., Buscaglia R., Chaires J.B., Lewis E.A. //
38. Kudrev A.G. // Talanta. 2012. Vol. 101. P. 157. doi
Analyt. Biochem. 2013. Vol. 434. P. 233. doi 10.1016/
10.1016/j.talanta.2012.09.014
j.ab.2012.11.030
39. NIST Standard Reference Database
46. Critically
18. Bhattacharjee A.J., Ahluwalia K., Taylor S., Jin O.,
Selected Stability Constants of Metal Complexes
Nicoludis J.M., Buscaglia R., Chaires J.B., Korn-
Database
/
Eds R.M. Smith, A.E. Martell,
filt D.J.P., Marquardt D.G.S., Yatsunyk L.A.
//
R.J. Motekaitis. Version 7.0 for Windows. 2003. US
Biochimie.
2011. Vol.
93. P.
1297. doi
10.1016/
National Institute of Standards and Technology
j.biochi.2011.05.038
Standard Reference Data Program, Gaithersburg, MD
19. Костромина Н.А., Кумок В.Н., Скорик Н.А. Химия
координационных соединений М.: ВШ, 1990. 432 с.
40. Бьеррум Я. Образование аминов металлов в водном
20. Тимошкин А.Ю., Кудрев А.Г. // ЖНХ. 2012. Т. 57.
растворе. Теория обратимых ступенчатых реакций.
№ 10. С. 1447; Timoshkin A.Yu., Kudrev A.G. // Russ. J.
М.: ИЛ, 1961. 140 с.; Bjerrum J. Metal Ammine
Inorg. Chem. 2012 Vol. 57. N 10 P. 1362. doi 10.1134/
Formation in Aqueous Solution: Theory of the
S0036023612100142
Reversible Step Reactions. Copenhagen: Haase, 1957.
21. Massart D.L., Vandeginste B.G.M., Deming S.N.,
41. Уэллс А. Структурная неорганическая химия. М.:
Michotte, Y., Kaufman L. Chemometrics: A Textbook.
Мир, 1987. Т. 3 C. 308.
Amsterdam; New York: Elsevier Publ., 1988. 488 p.
42. Коттон Ф., Уилкинсон Дж. Современная неоргани-
22. Бронштейн И.Н., Семендяев К.А. Справочник по
ческая химия. М.: Мир, 1969. Т. 2. C. 475.
математике. М.: Наука, 1986. 544 c.
43. Кудрев А.Г. // Коорд. хим. 2010. Т. 36. № 9. C. 710;
23. Кудрев А.Г. // Коорд. хим. 2008. Т. 34. № 1. C. 37;
Kudrev A.G. // Russ. J. Coord. Chem. 2010. Vol. 36.
Kudrev A.G. // Russ. J. Coord. Chem. 2008. Vol. 34.
P. 704. doi 10.1134/S1070328410090113
P. 34. doi 10.1134/S1070328408010065
44. Ishiguro S., Jeliazkova B.G., Ohtaki H. // Bull. Chem.
24. Кудрев А.Г. // ЖНХ. 2010. T. 55 № 5. С. 874; Kudrev A.G. //
Soc. Japan. 1985. Vol. 58. N 6. P. 1749. doi 10.1246/
Russ. J. Inorg. Chem. 2010. Vol. 55. N 5. P. 814. doi
bcsj.58.1749
10.1134/S0036023610050268
45. Ozutsumi K., Ishiguro S., Ohtaki H. // Bull. Chem. Soc.
25. Гринберг A.A., Гелфман М.И. // Докл. АН СССР.
Japan. 1988. Vol. 61. N 1. P. 715. doi 10.1246/
1961. Т. 137. С. 87.
bcsj.61.715
26. Latimer W. Oxidation potentials. New York: Prentice
46. Amuli C., Elleb M., Meullemeestre J., Schwing M.J.,
Hall, 1952. P. 206.
Vierling F. // Inorg. Chem. 1986. Vol. 25. P. 856. doi 10.1021/
27. Ginstrup O., Leden I. // Acta Chem. Scand.
1967.
ic00226a027
Vol. 21. P. 2689. doi 10.3891/acta.chem.scand.21-2689
47. Ishiguro S., Jeliazkova B.G., Ohtaki H. // Bull. Chem.
28. Ginstrup O., Leden I. // Acta Chem. Scand.
1968.
Soc. Japan. 1985. Vol. 58. P. 1143. doi 10.1246/
Vol. 22. P. 1163. doi 10.3891/acta.chem.scand.22-1163
bcsj.58.1143
29. Elding L.I. // Acta Chem. Scand. 1970. Vol. 24. P. 1331.
48. Ishiguro S., Jeliazkova B.G., Ohtaki H. // J. Solution
doi 10.3891/acta.chem.scand.24-1331
Chem.
1987. Vol.
16. N
1. P.
1. doi
10.1007/
30. Elding L.I. // Acta Chem. Scand. 1970. Vol. 24. P. 1527.
BF00647009
doi 10.3891/acta.chem.scand.24-1527
49. Ozutsumi K., Ishiguro S., Ohtaki H. // Bull. Chem. Soc.
31. Equilibrium-constants
Database
2001
Meduza.
Japan. 1988. Vol. 61. N 3. P. 945. doi 10.1246/
bcsj.61.945
32. Инценди Я. Применение комплексов в анали-
50. Ishiguro S., Jeliazkova B.G., Ohtaki H. // Bull. Chem.
тической химии. М.: Мир, 1979. 376 с.
Soc. Japan. 1989. Vol. 62. N 1. P. 39. doi 10.1246/
33. Burger K., Dyrsen D. // Acta Chem. Scand. 1963. Vol. 17.
bcsj.62.39
N 2. P. 1489. doi 10.3891/acta.chem.scand.17-1489
51. Kudrev A.G. // Talanta. 2008. Vol. 75. P. 380. doi
34. Щукарев С.А., Лобанева О.А., Иванова М.А.,
10.1016/j.talanta.2007.11.034
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
908
КУДРЕВ
52. Кудрев А.Г. // ЖОХ. 2008. Т. 79. Вып. 4. С. 529;
j.gca.2009.01.036
Kudrev A.G. // Russ. J. Gen. Chem. 2008. Vol. 78. N 4.
54. Hashmi A.S.K., Hutchings G.J. // Angew. Chem. Int.
P. 513. doi 10.1134/S1070363208040014
Ed. 2006. Vol. 45. P. 7896. doi 10.1002/anie.200602454
53. Usher A., McPhail D.C., Brugger J.
// Geochim.
55. Elding L.I., Groning A.-B. // Acta Chem. Scand. (A). 1978.
Cosmochim. Acta. 2009. Vol. 73. P. 3359. doi 10.1016/
Vol. 32. N 9. P. 867. doi 10.3891/acta.chem.scand.32a-0867
Application of The Matrix Method for Calculating Internal
Equilibrium Constants and Complex Formation Microconstants
A. G. Kudrev*
St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: kudrevandrei@mail.ru
Received March 12, 2019; revised March 12, 2019; accepted March 15, 2019
This review is devoted to the matrix method of modeling complexation in solution. The applicability of the
method for the interpretation of spectrometric and calorimetric data for systems containing simultaneously a
large number of complex forms is shown. The works where this method was used to calculate the internal
equilibrium constants and cis/trans isomerization constants were analyzed. Using the matrix modeling method,
the cooperativity of ammonia binding with Mg2+, Ca2+, Zn2+, Cd2+ and Ni2+ ions in aqueous solution was
demonstrated. For halide complexes of Pt(II), Pd(II) and Au(III), having a square-planar structure, the difference
between the interaction of ligands in the cis and trans isomers is shown. The question of verifying the hypothesis
about the geometry of the coordination polyhedron of Cu2+ compounds formed in the processes of equilibrium
step complexing in mixed solvents is considered.
Keywords: matrix method, matrix model of complexation, internal constants
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019