ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 6, с. 923-936
УДК 544.344.3
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ
СИСТЕМАХ, СОДЕРЖАЩИХ СОЛИ d-ЭЛЕМЕНТОВ И
СМЕШАННЫЙ КИСЛОРОД-ДОНОРНЫЙ РАСТВОРИТЕЛЬ
© 2019 г. Н. А. Богачев*, А. О. Горбунов, М. Ю. Скрипкин, А. Б. Никольский
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: n.bogachev@spbu.ru
Поступило в Редакцию 20 марта 2019 г.
После доработки 20 марта 2019 г.
Принято к печати 23 марта 2019 г.
Обобщены результаты исследования тройных систем, содержащих галогениды и сульфаты меди,
кобальта, никеля и кадмия в бинарных водно-органических и смешанных органических растворителях.
Проанализировано влияние донорно-акцепторных свойств компонентов тройной системы,
относительной диэлектрической проницаемости растворителя и межмолекулярной ассоциации в
смешанном растворителе на растворимость солей и строение кристаллических сольватов.
Ключевые слова: соли d-элементов, растворимость, тройные системы, конкурирующая сольватация,
кристаллосольваты, растворы электролитов
DOI: 10.1134/S0044460X19060105
Несмотря на широкое развитие исследований в
Отдельные аспекты указанной проблемы
области химии растворов электролитов, проблема
достаточно подробно разработаны для много-
качественного и количественного прогнозирования
компонентных водных растворов. В некоторых
растворимости электролитов до настоящего
работах [1] на основе структурно-кинетического
момента остается мало разработанной. Существу-
подхода установлены корреляции между
ющие подходы касаются ограниченного числа
изменениями свойств раствора и сменой форм
объектов, как правило, разбавленных водных растворов
кристаллизующихся соединений на изотерме
солей, и не позволяют рассчитывать макросвойства
растворимости определен состав кластеров-
насыщенных растворов, предсказывать их строение
прекурсоров образования твердой фазы в ряде
во всем концентрационном диапазоне вплоть до
водно-солевых систем. В других исследованиях [2]
границы насыщения, а также интерпретировать
постулируется сходство структуры концентри-
механизмы формирования равновесных твердых
рованных растворов и соединений, кристалли-
фаз, и прогнозировать их строение без эксперимен-
зующихся при понижении температуры, а
тального исследования конкретных систем.
образование сложных соединений рассматривается
Отмеченные затруднения во многом обуслов-
как конечный результат процессов, определяемых
лены широким набором факторов, влияющих на
структурой раствора. В работах [3, 4] проводится
равновесие раствор-твердая фаза. Необходимость
исследование процессов растворение-кристал-
учета специфических свойств как солевого
лизация на молекулярном уровне с помощью
компонента, так и растворителя делает практи-
методов компьютерного моделирования. Вопросы
чески невозможным достижения общего решения
сохранения и трансформации формы координа-
данной проблемы. В связи с этим представляется
ционного полиэдра, а также изменения меж-
актуальным поиск отдельных закономерностей,
атомных расстояний в процессе перехода раствор-
определение круга объектов, для которых они
твердая фаза являются одними из основных в
выполнимы, выявление ключевых факторов,
работах
[5-9], однако в большинстве случаев
определяющих состав и строение равновесной с
авторы ограничиваются констатацией фактов, а
раствором твердой фазой.
объяснение результатов, главным образом, связы-
923
924
БОГАЧЕВ и др.
вают со стерическими эффектами и эффектами
перекристаллизации целевых продуктов. Эти
упаковки. Прогнозирование зависимости строения
компоненты образуют смеси друг с другом во всем
координационного полиэдра от химической
диапазоне составов, что позволяет проследить, как
природы компонентов в данных работах практи-
состав и свойства бинарного растворителя влияют
чески отсутствует.
на растворимость солевого компонента, а также на
состав и строение кристаллизующихся из тройных
Что касается исследования трехкомпонентных
систем сольватов. В качестве ключевых свойств
солевых систем, содержащих смешанный
компонентов, которые оказывают влияние на
бинарный растворитель, то оно ограничено
растворимость и формирование твердой фазы,
областью низких концентраций, и касается систем,
можно выделить кислотно-основные свойства по
в которых ацидокомплексообразование отсут-
Пирсону, донорно-акцепторные свойства, относи-
ствует. Для таких систем, как правило, состоящих
тельную диэлектрическую проницаемость раство-
из смесей вода-спирт, вода-эфир, спирт-эфир, и
рителей, а также межмолекулярные взаимо-
включающих в качестве солевого компонента соли,
действия между молекулами растворителя. Именно
содержащие однозарядные ионы Na+, K+, Li+ или
анализу влияния этих факторов на растворимость
двухзарядные Ca2+, Mg2+, Ba2+, разработан ряд
солевого компонента и строение твердой фазы в
эмпирических и полуэмпирических методов расчета,
тройных системах, содержащих смешанный
позволяющий предсказывать форму диаграмм
растворитель, посвящена данная работа.
равновесия раствор-твердая фаза [10-14]. Главным
недостатком таких расчетных моделей является
Влияние диэлектрической проницаемости
невозможность учета комплексообразования в
растворителя на растворимость солевого ком-
растворах, что не позволяет распространить их на
понента. Если в качестве основного фактора,
системы, содержащие соли переходных элементов,
определяющего растворимость солевого компо-
а также на высококонцентрированные насыщенные
нента, рассматривать диэлектрическую прони-
растворы, образуемые растворителями с высокими
цаемость среды, то можно ожидать, что раство-
донорными способностями. Именно такие системы
римость ионных соединений будет изменяться
наиболее распространены в практике получения
симбатно изменению относительной диэлектри-
координационных соединений, включая металлор-
ческой проницаемости растворителя: чем выше
ганические каркасные структуры, определение
диэлектрическая проницаемость растворителя, тем
оптимальных условий для синтеза которых до
выше растворимость соли. В случае бинарных
настоящего момента напрямую связано с
систем, например, для хлорида меди раство-
эмпирическим подбором состава синтетической
римость должна повышаться в ряду диоксан-ТГФ-
среды
[15]. Однако для систем данного типа
ДМФА-диметилацетамид-ДМСО-вода, так как
встречаются только отдельные экспериментальные
диэлектрическая проницаемость растворителей
исследования, затрагивающие исключительно
повышается в этом ряду. Как показывают данные
жидкую фазу [16]. Вопрос о влиянии процессов в
табл.
1, этот прогноз не оправдывает себя:
растворе на формирование твердой фазы в
растворимость этой соли в диметилацетамиде
системах данного типа не рассматривается.
больше (25.4 моль/100 моль растворителя), чем в
воде (10.45 моль/100 моль растворителя).
На кафедре общей и неорганической химии
Санкт-Петербургского университета за последние
Сравнивая растворимости разных солей в
десять лет выполнена серия исследований
растворителе с высоким значением проницаемости,
трехкомпонентных растворов, содержащих соли
можно ожидать, что солевой компонент,
переходных металлов (галогениды и сульфаты
межатомная связь в котором имеет более ионный
меди, никеля, кобальта и кадмия) и бинарный
характер, будет обладать большей раствори-
растворитель
[17-27]. В качестве компонентов
мостью. Это предположение также не всегда
бинарного растворителя были выбраны кислород-
находит экспериментальное подтверждение. Так,
донорные
[вода, диметилсульфоксид, диметил-
растворимость бромида кадмия в ДМСО
ацетамид (DMA), диметилформамид, 1,4-диоксан
оказывается наиболее высокой среди галогенидов
(DX), тетрагидрофуран и вода], широко распро-
кадмия
(22.7 моль/100 моль), хотя, согласно
страненные в практике органического синтеза и
указанному подходу, можно ожидать, что
применяемые не только в качестве среды для
наибольшая концентрация насыщенного раствора
синтеза, но и в качестве растворителей для
должна наблюдаться в системе CdCl2-ДМСО
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
925
Таблица 1. Свойства компонентов бинарной системы соль-растворитель и растворимости хлоридов меди, никеля,
кобальта и кадмия
Солевой компонент
S, моль/100 моль
Растворитель
DN, ккал/моль
ε
растворителя
соль
σкатион (σанион)
CuCl2
+0.38 (-0.16)
ДМСО
29.8
47.2400
0.97
Диметилацетамид
27.8
38.8500
25.40
ДМФА
26.6
38.2500
9.65
Вода
18.0
80.1000
10.45
1,4-Диоксан
14.8
2.2189
~0.00
ТГФ
20.0
7.5200
0.50
CuBr2
+0.38 (+0.1)
ДМСО
29.8
47.2400
1.96
ДМФА
26.6
38.2500
20.40
1,4-Диоксан
14.8
2.2189
0.23
ТГФ
20.0
7.5200
1.10
CoCl2
-0.11 (-0.16)
ДМСО
29.8
47.2400
0.53
ДМФА
26.6
38.2500
14.90
CoBr2
-0.11 (+0.1)
ДМСО
29.8
47.2400
0.90
ДМФА
26.6
38.2500
4.10
NiCl2
-0.11 (-0.16)
ДМСО
29.8
47.2400
3.54
Диметилацетамид
27.8
38.8500
10.14
ДМФА
26.6
38.2500
2.80
Вода
18.0
80.1000
9.08
1,4-Диоксан
14.8
2.2189
~0.00
CdCl2
+0.58 (-0.16)
ДМСО
29.8
47.2400
21.91
Диметилацетамид
27.8
38.8500
1.80
ДМФА
26.6
38.2500
0.38
Вода
18.0
80.1000
13.30
1,4-Диоксан
14.8
2.2189
~0.00
CdBr2
+0.58 (+0.1)
ДМСО
29.8
47.2400
22.70
Диметилацетамид
27.8
38.8500
26.20
ДМФА
26.6
38.2500
23.00
Вода
18.0
80.1000
7.60
1,4-Диоксан
14.8
2.2189
~0.00
CdI2
+0.58 (+0.4)
ДМСО
29.8
47.2400
20.10
Диметилацетамид
27.8
38.8500
30.20
ДМФА
26.6
38.2500
30.90
Вода
18.0
80.1000
4.30
1,4-Диоксан
14.8
2.2189
~0.00
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
926
БОГАЧЕВ и др.
(а)
щимися к одному типу, и обладающими сопоста-
вимой мягкостью: мягкие частицы (ионы или
молекулы) образуют более устойчивые комплексы
с мягкими частицами, жесткие - с жесткими. В
качестве численного выражения жесткости и
мягкости катионов и анионов, молекул раство-
рителей нами использованы шкалы мягкости
Маркуса
[29,
30]. Также для характеристики
свойств растворителей использовались донорные
числа по Гутману [31], позволяющие сопоставлять
относительную донорную способность растворителей.
Можно предполагать, что растворимость
солевого компонента должна уменьшаться при
Молярная доля амида
увеличении прочности связи частиц в растворе.
(б)
Результаты исследования (табл.
1) также не
подтверждают этот подход, из чего следует, что
растворимость солевого компонента не имеет
четкой корреляции ни со значениями мягкости
катионов и анионов соли, ни с диэлектрической
проницаемостью растворителя. Не менее важным
фактором является строение равновесной твердой
фазы (островное или полимерное), которое будет
рассмотрено далее.
Обратимся к тройным системам соль-бинарный
растворитель. Если соединить прямой линией
крайние точки на изотерме (бинарные смеси соль-
Молярная доля амида
растворитель), то экспериментальное значение
(в)
растворимости может лежать либо выше этой
гипотетической линии, либо ниже, либо пересекать
ее (рис. 1). Эта линия - аддитивная изотерма
растворимости, рассчитанная в предположении,
что растворимость в смеси растворителей зависит
только от их соотношения - для каждой тройной
системы типа соль-А-В может быть выражена
уравнением (1).
Sсоль = хASA + (1-хA)SB,
(1)
где хA
- мольная доля растворителя A, SA
-
Молярная доля ДМСО
растворимость соли в растворителе А.
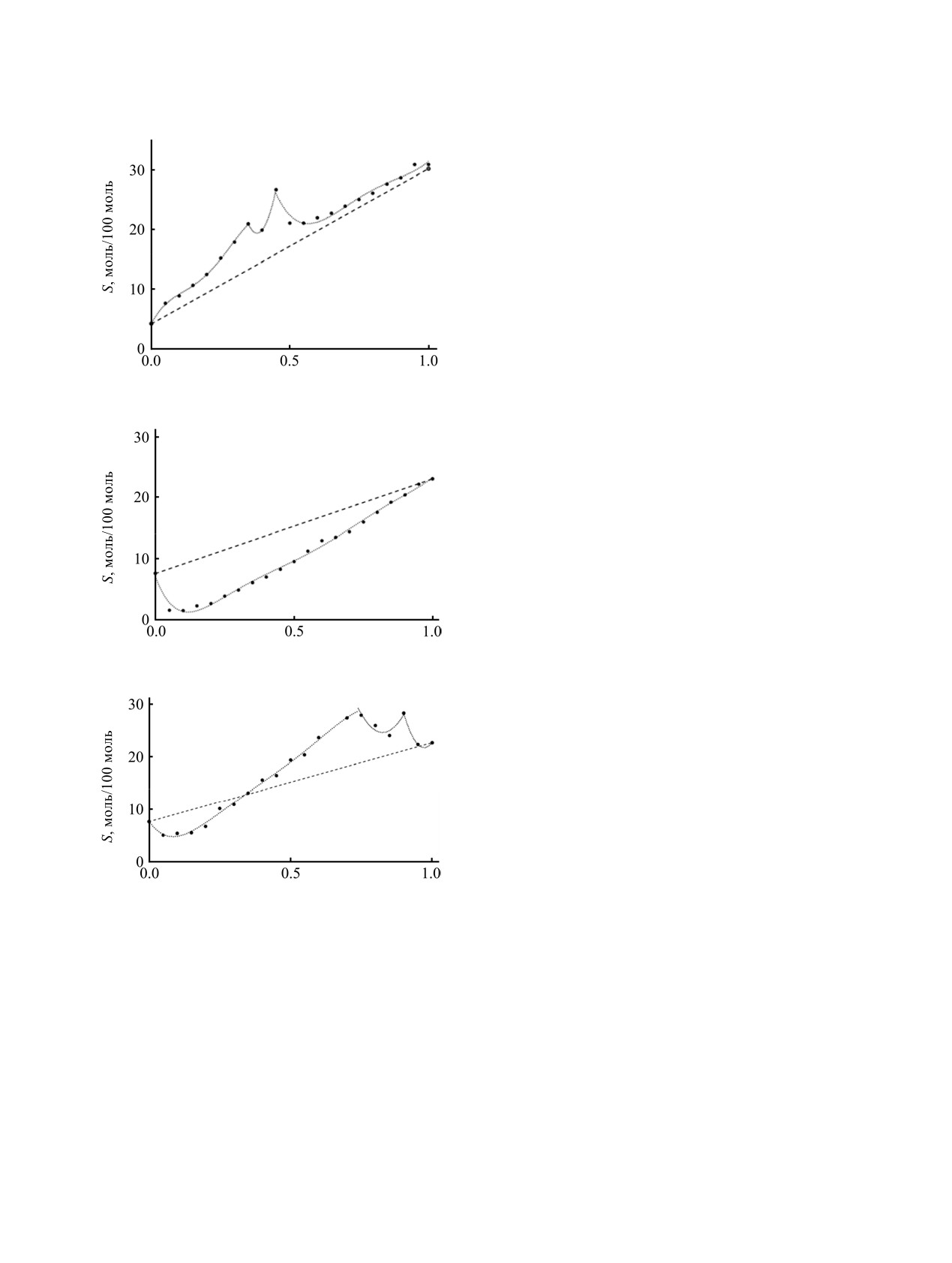
Рис. 1. Диаграммы растворимости в системах CdI2-
Четвертый возможный случай
- совпадение
ДМФА-вода (a), CdBr2-ДМФА-вода (б), CdBr2-ДМСО-
аддитивной и реальной изотерм
- экспери-
вода (в). Составы равновесных сольватов указаны в
ментально не наблюдается.
табл. 2
Результаты определения растворимости в
(21.9 моль/100 моль). Хлорид кадмия имеет, с этой
тройных системах показывают, что положительные
точки зрения, аномально высокую растворимость в
отклонения растворимости от аддитивности
ДМСО; растворимость в более полярной воде
наблюдаются для систем, в которых доминиру-
составляет только 13.3 моль/100 моль.
ющим процессом является образование сольво-
комплексов.
Согласно теории жестких и мягких кислот и
оснований (ЖМКО) [28], более устойчивые комп-
Отрицательные отклонения наблюдаются в
лексы образуются между частицами, относя-
большинстве исследованных систем. В первую
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
927
Таблица 2. Области кристаллизации сольватов в некоторых тройных водно-органических солевых системах
Тройная система
Область изотермы
Состав сольвата
CuCl2-ДМСО-H2O
0 < х(H2O) < 0.65
{CuCl2(DMSO)2}n
0.7 < х(H2O) < 0.85
CuCl2·2DMSO·H2O
0.9 < х(H2O) < 1
CuCl2·2H2O
CuBr2-ДМСО-H2O
0 < х(H2O) < 0.55
CuBr2·3DMSO
0.55 < х(H2O) < 0.85
CuBr2·2DMSO
0.9 < х(H2O) < 1
CuBr2
CuBr2-H2O-диоксан
хDX = 0
CuBr2
0.05 < хDX < 0.2
CuBr2·2H2O·DX
0.25 < хDX < 0.75
CuBr2·2H2O·2DX
0.8 < хDX < 1
CuBr2·2DX
CuBr2-H2O-ТГФ
хTHF = 0
CuBr2
0.1 < хTHF < 0.6
CuBr2·H2O·0.5THF
0.65 < хTHF < 1
CuBr2·THF
CoCl2-ДМСО-H2O
0 < х(H2O) < 0.6
CoCl2·3DMSO
0.7 < х(H2O) < 1
CoCl2·6H2O
CoBr2-ДМСО-H2O
0 < х(H2O) < 0.8
CoBr2·3DMSO
0.9 < х(H2O) < 1
CoBr2·6H2O
NiCl2-ДМСО-H2O
0 < х(H2O) < 0.05
[Ni(DMSO)6][NiCl4]
0.05 < х(H2O) < 0.2
[Ni(DMSO)4(H2O)2]Cl2
0.25 < х(H2O) < 0.63
NiCl2·5DMSO·4H2O
0.65 < х(H2O) < 0.9
NiCl2·2DMSO·9H2O
0.95 < х(H2O) < 1
[Ni(H2O)4Cl2](H2O)2
CdCl2-ДМСО-H2O
0 < х(H2O) < 0.6
{CdCl2(DMSO)1.4}n
0.65 < х(H2O) < 0.95
CdCl2·1.5DMSO·2H2O
х(H2O) = 1
CdCl2·4H2O
CdBr2-ДМСО-H2O
0 < х(H2O) < 0.1
[Cd(DMSO)6][CdBr4]
0.15 < х(H2O) < 0.25
{CdBr2(DMSO)(H2O)}n
0.3 < х(H2O) < 0.95
CdBr2·2DMSO
х(H2O) = 1
CdBr2·4H2O
CdBr2-ДМФА-H2O
0 < х(H2O) < 0.95
{CdBr2(DMF)}n
х(H2O) = 1
CdBr2·4H2O
CdI2-ДМФА-H2O
0 < х(H2O) < 0.55
[Cd(DMF)6][Cd2I6]
0.6 < х(H2O) < 0.65
{CdI2(DMF)}n
0.7 < х(H2O) < 1
CdI2
CdI2-H2O-диоксан
хDX = 0
CdI2
0.05 < хDX < 1
{CdI2(DX)}n
CdSO4-ДМСО-H2O
0 < х(H2O) < 0.4
CdSO4
0.45 < х(H2O) < 0.95
CdSO4·2H2O
х(H2O) = 1
CdSO4·8.3H2O
0.2 < хDX < 1
CdSO4
CuSO4-ДМСО-H2O
0 < х(H2O) < 0.42
CuSO4·DMSO
0.45 < х(H2O) < 0.6
CuSO4·DMSO·3.5H2O
0.6 < х(H2O) < 1
CuSO4·5H2O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
928
БОГАЧЕВ и др.
(табл.
2).
Исключением являются системы,
содержащие соли, для которых нехарактерно
образование кристаллосольватов с органическими
растворителями, поэтому на всей области составов
бинарного растворителя твердой фазой являются
либо гидраты, либо индивидуальная соль.
Исключением является система CuSO4-ДМСО-
H2O. В этой системе образуется сольват,
содержащий в своем составе диметилсульфоксид,
Молярная доля органического
и для этой системы также наблюдается указанная
растворителя
выше закономерность
- область составов
Рис.
2. Изотермы растворимости сульфата кадмия в
смешанного растворителя, в которой происходит
водно-органических растворителях при 25°С. ○ - ДМСО,
кристаллизация сольватов с ДМСО, максимальна.
▲ - диметилацетамид, ■ - ДМФА, ● - диоксан.
Как следствие, если во всем диапазоне составов
смешанного растворителя образуется сольват
очередь это характерно практически для всех
постоянного состава, то он содержит лиганд,
систем, содержащих сульфаты, что вызвано
характеризующийся более высоким значением
низкими значениями диэлектрической проница-
донорного числа.
емости смесей растворителей, а также отсутствием
сильного сольвокомплексообразования. Интенсив-
Чем больше донорное число растворителя, тем
ность понижения растворимости в тройных
более прочная связь образуется между его
системах, содержащих воду, находится в
молекулами и катионами, в результате чего
симбатной зависимости от уменьшения диэлектри-
катионы металла преимущественно сольвати-
ческой проницаемости смеси растворителей в ряду
руются молекулами более донорного растворителя
ДМСО-диметилацетамид-ДМФА-диоксан
[32].
в составе тройной системы. Как было показано в
Пример показан на рис. 2 для систем, содержащих
работе
[33], по результатам исследования
сульфат кадмия. Исключением является система
сольватации катионов в смешанном растворителе и
CuSO4-ДМСО-H2O, в которой происходит
определения сольватных чисел ионов, в некоторых
кристаллизация соединения CuSO4·DMSO·3.5H2O,
системах наблюдается немонотонность изменения
что повышает растворимость сульфата меди. Во
состава сольватной оболочки катионов в
всех системах, содержащих в качестве одного из
зависимости от концентрации соли. По мере
компонентов бинарного растворителя 1,4-диоксан,
увеличения концентрации соли происходит
дополнительным фактором, определяющим малые
уменьшение содержания, в первую очередь, менее
значения растворимости, особенно при высоком
донорного растворителя, а по достижении
содержании органического компонента является
определенной концентрации соли в растворе
образованием сольватов, в которых молекулы 1,4-
состав первой сольватной сферы практически не
диоксана выступают в качестве мостикового
изменяется, и образуются частицы постоянного
бидентатного лиганда, формирующего полимерные
состава, которые, вероятно, и являются пре-
цепи в структуре сольвата.
курсорами равновесной твердой фазы. Для разных
солей концентрационная область закрепления
Влияние донорных свойств растворителя на
состава сольватной оболочки имеет свое значение,
протяженность областей кристаллизации соль-
но в общем случае она, как правило, лежит в
ватов. Общим для всех исследованных систем
интервале концентраций 6-10 моль соли на 100
является наличие связи между протяженностью
моль растворителя. В ряде случаев наблюдается
областей кристаллизации кристаллосольватов и
практически полная тождественность состава
донорным числом растворителя. Обнаружено, что
твердой фазы и усредненного состава
протяженность полей кристаллизации сольватов
координационных сфер ионов металлов в растворе.
меняется симбатно донорному числу растворителя
Его условием является превышение эксперимен-
(табл.
1), входящего в состав образующегося
тальной изотермы растворимости гипотетической
комплекса: практически во всех изученных
прямой, соединяющей крайние точки изотермы.
тройных системах большую суммарную протяжен-
ность имеют ветви кристаллизации сольватов,
Влияние свойств компонентов системы на
содержащих лиганд с большим донорным числом
структуру кристаллосольватов. Связь строения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
929
(а)
(б)
(в)
(г)
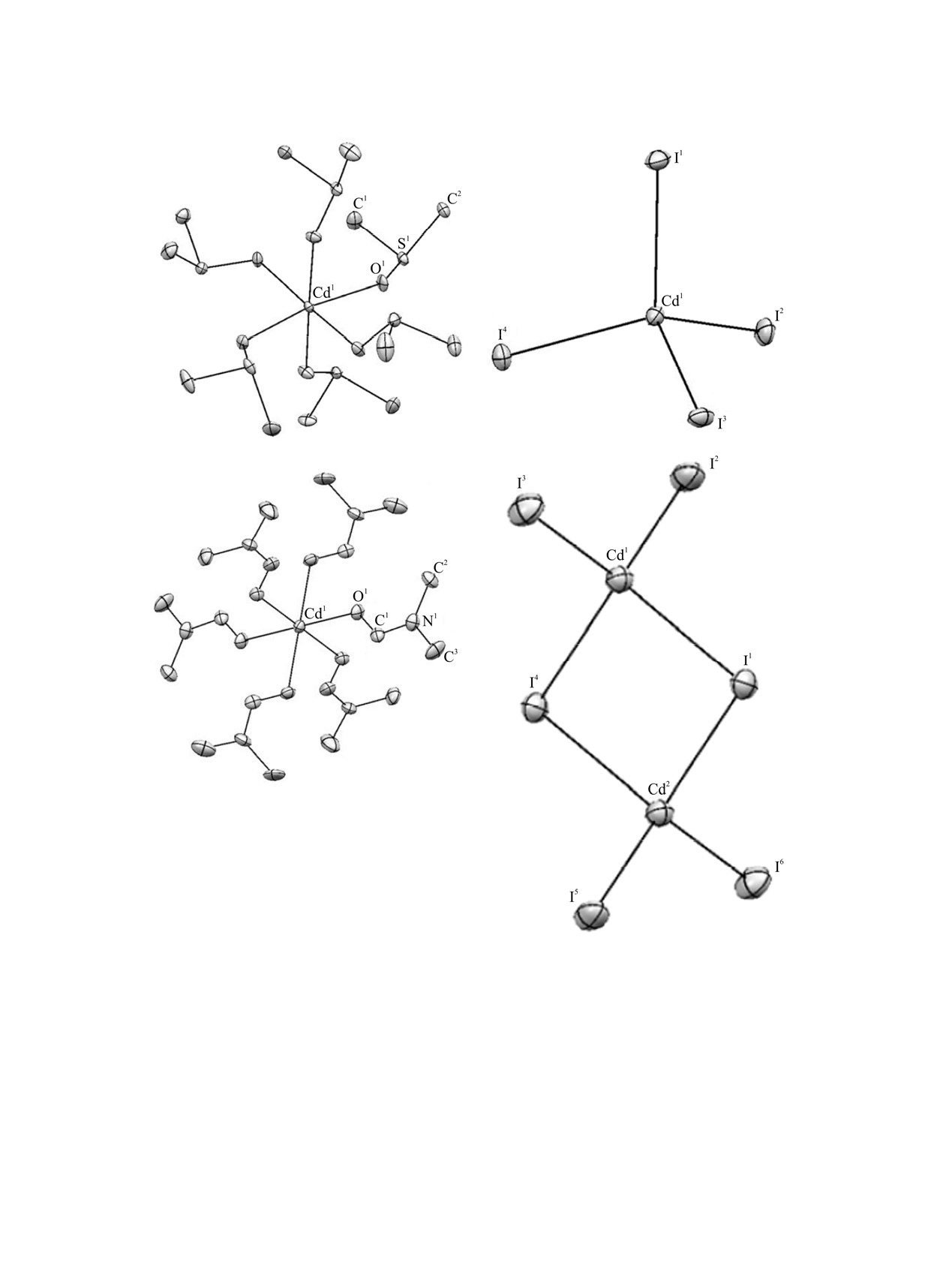
Рис. 3. Структура комплексных катионов (a, в) и анионов (б, г) некоторых сольватов островного мотива структуры,
образующихся в бинарных системах соль-растворитель.
сольватов и концентрации насыщенного раствора.
сольватов, так как только в этом случае появляется
Если в число рассматриваемых факторов включить
возможность выделить структурные параметры
данные о строении твердой фазы, то сама
сольватов, влияющих на растворимость. Такой
процедура анализа осложняется тем, что
подход является обоснованным в связи с тем, что в
сравнению подлежат только те системы, в которых
равновесии с насыщенным раствором находится
происходит образование идентичных по строению
именно кристаллический сольват, а не индиви-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
930
БОГАЧЕВ и др.
Таблица 3. Состав и мотив структуры сольватов, растворимость солевого компонента при 25°Са
Состав равновесной
Соль
Растворитель
S, моль/100 моль
Мотив структуры
Ссылка
твердой фазы
CuCl2
ДМСО
0.97
{CuCl2(DMSO)2}n
Полимер
[34]
Диметилацетамид
25.40
CuCl2·DMA
-б
ДМФА
9.65
[Cu2Cl4(DMF)4]
Островной
[35]
Вода
10.45
{CuCl2(H2O)2}n
Островной
1,4-Диоксан
0.05
{CuCl2(DX)0.7}n
Полимер
[36]
ТГФ
0.50
CuCl2·0.8THF
-б
CuBr2
ДМСО
1.96
CuBr2·3DMSO
Островной
[37]
ДМФА
20.40
CuBr2·3DMF
-б
1,4-Диоксан
0.23
CuBr2·2DX
-б
ТГФ
1.10
CuBr2·THF
-б
NiCl2
ДМСО
3.54
[Ni(DMSO)6][NiCl4]
Островной
[38]
Диметилацетамид
10.14
[Ni(DMA)6][NiCl4]
Островной
[27]
ДМФА
2.80
[Ni(DMF)6][NiCl4]
Островной
[39]
Вода
9.08
[Ni(H2O)6]Cl2
Островной
1,4-Диоксан
0.00
NiCl2·DX
-б
CoCl2
ДМСО
0.53
[Co(DMSO)6][CoCl4]
Островной
[40]
ДМФА
14.90
[Co(DMF)6][Co(DMF)Cl3]2
Островной
[41]
CoBr2
ДМСО
0.90
CoBr2·3DMSO
-б
ДМФА
4.10
CoBr2·8.3DMF
-б
CdCl2
ДМСО
21.90
{CdCl2(DMSO)1.4}n
Полимер
[42]
Диметилацетамид
1.80
CdCl2·DMA
-б
ДМФА
0.40
{CdCl2(DMF)2}n
Полимер
[43]
Вода
13.30
{CdCl2(H2O)4}n
Полимер
1,4-Диоксан
0.00
{CdCl2(DX)}n
Полимер
[44]
CdBr2
ДМСО
22.70
[Cd(DMSO)6][CdBr4]
Островной
[42]
Диметилацетамид
26.20
{CdBr2(DMA)}n
Полимер
[18]
ДМФА
23.00
{CdBr2(DMF)}n
Полимер
[18]
Вода
7.60
{CdBr2(H2O)4}n
Полимер
1,4-Диоксан
0.00
{CdBr2(DX)}n
Полимер
[45]
CdI2
ДМСО
20.10
[Cd(DMSO)6][CdI4]
Островной
[46]
Диметилацетамид
30.20
[Cd(DMA)6][Cd2I6]
Островной
[47]
ДМФА
30.90
[Cd(DMF)6][Cd2I6]
Островной
[18]
1,4-Диоксан
0.00
{CdI2(DX)}n
Полимер
[48]
а Термин «островной» здесь и далее означает наличие отдельных пар комплексный катион-комплексный анион в составе сольвата.
б Не установлено.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
931
дуальный солевой компонент. В табл. 3 сведены
данные о строении сольватов, кристаллизующихся
в исследованных бинарных системах.
Сульфаты никеля и кадмия не образуют кристал-
лосольватов, за исключением кристаллогидратов
составов NiSO4·7H2O и CdSO4·8.3H2O. Сульфат
меди, кроме кристаллогидрата CuSO4·5H2O
образует также сольват с диметилсульфоксидом
Молярная доля ДМСО
CuSO4·DMSO. Растворимости этих солей в
Рис. 4. Диаграмма растворимости бромида кадмия в
органических растворителях практически равны
системе ДМСО-вода.
нулю, что, вероятно, вызвано низкой диэлектри-
ческой проницаемостью этих растворителей,
ограничивающими растворимость сульфатов, как
эффект наблюдается и для сольватов хлорида и
соединений с ионным типом связи; соответ-
бромида кобальта с DMSO. Для сольватов
ственно, обратное наблюдается для бинарных
[Cd(DMA)6][Cd2I6] и
[Cd(DMF)6][Cd2I6] такой
систем соль-вода.
порядок рассуждений приводит к аналогичному
заключению, единственное отличие заключается в
Все сольваты, кристаллизующиеся в пред-
том, что разница в растворимости между этими
ставленных бинарных системах, можно разделить
соединениями определяется различием состава
на два типа согласно мотиву их структуры:
катионов. Так как донорное число диметил-
сольваты полимерного строения и островного. Для
ацетамида больше, чем у ДМФА, можно сделать
изученных тройных систем характерно сохранение
вывод, что сольват с диметилацетамидом будет
во всей области составов структурного мотива
обладать меньшей растворимостью за счет
сольватов, кристаллизующихся в бинарных
образования более прочных связей металл-амид.
подсистемах.
Это рассуждение также находит свое подтвер-
Наиболее правомочно сравнение растворимости
ждение в экспериментальных данных: концен-
можно проводить в случае одинакового строения
трация насыщенного раствора иодида кадмия в
твердой фазы, под которым мы понимаем не
диметилацетамиде меньше, чем в ДМФА. Анализ
кристаллохимическую идентичность, а выполнение
связи между растворимостью хлорида никеля в
следующих требований: одинаковое координа-
ДМСО, диметилацетамиде и ДМФА и донорной
ционное число катиона, одноименный донорный
способностью лигандов показывает, что корре-
атом молекул лиганда, через который осущест-
ляции между ними не наблюдается, и, хотя
вляется координационная связь, однотипное
растворимость NiCl2 в менее донорном диметил-
строение аниона (рис. 3).
ацетамиде выше, чем для диметилсульфоксида,
растворимость сольвата [Ni(DMF)6][NiCl4] имеет
Примером таких соединений являются сольваты
аномально низкое значение. Не выполняется такая
[Cd(DMSO)6][CdI4] и [Cd(DMSO)6][CdBr4], отли-
корреляция и для систем хлорид и бромид кобальта-
чающиеся составом аниона. Следовательно,
диметилацетамид и ДМФА, в которых кристал-
разница в растворимости этих соединений в
лизуются сольваты предположительно подобного
диметилсульфоксиде определяется именно анионом.
строения
[Co(амид)6][Co(амид)Cl3]2 (данных для
Согласно теории ЖМКО в паре комплексов CdI2- и
бромида кобальта нет).
CdBr2- большую устойчивость следует ожидать в
первом случае, так как взаимодействие между
Влияние межмолекулярных взаимодействий
ионом кадмия и более мягким иодид-ионом
в бинарном растворителе на растворимость
выгоднее, чем между ионом кадмия и менее
солевого компонента. Для некоторых систем
мягким бромид-ионом. Таким образом, при
было отмечено соответствие особых точек на
условии подобного строения аниона, менее
изотермах растворимости и на диаграммах теплот
растворимым должен быть сольват с анионом
образования бинарного растворителя. Эти особые
состава [CdI4]2-. Из табл. 3 видно, что этот подход
точки можно выявить, если совместить изотерму и
оправдывает себя, и соединение [Cd(DMSO)6][CdI4]
линию аддитивной растворимости. К примеру, для
действительно обладает меньшей растворимостью,
системы CdBr2-ДМСО-H2O пересечение такой
чем соединение [Cd(DMSO)6][CdBr4]. Аналогичный
гипотетической и реальной изотерм происходит в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
932
БОГАЧЕВ и др.
1
1
2
2
Молярная доля органического
растворителя
Молярная доля амида
Рис. 5. Диаграммы растворимости иодида кадмия в
Рис. 6. Диаграммы растворимости иодида кадмия в
системах ДМСО-вода (1) и 1,4-диоксан-вода (2).
системах амид-вода. 1 - диметилацетамид, 2 - ДМФА (2).
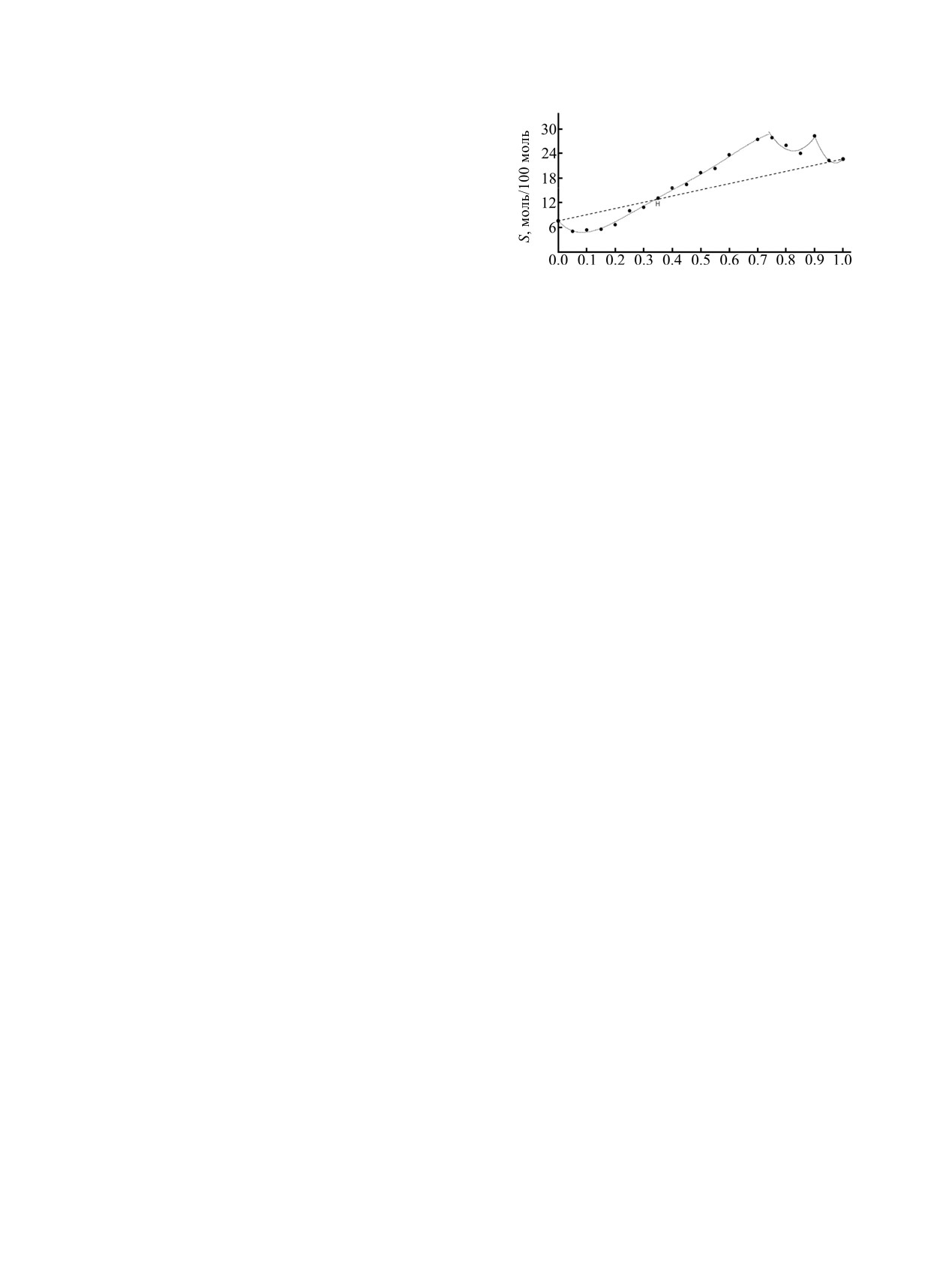
области около 0.35 мол. доли диметилсульфоксида
твердых фаз, точки смены состава твердой фазы
(рис. 4, точка Н), в которой, согласно данным
находятся в областях содержания 1,4-диоксана с
[49, 50], обнаруживается самая устойчивая форма
мольной долей
0.45 и
0.9. Эти особые точки
межмолекулярных ассоциатов состава DMSO·
изотермы соответствуют структурным изменениям
2H2O, а также минимум избыточной энтальпии
смешанного растворителя [51, 52] для системы 1,4-
смешения растворителей.
диоксан-вода.
Из диаграммы видно, что до точки Н
Диаграммы растворимости иодида кадмия в
наблюдается отклонение от линии аддитивной
четырех водно-органических растворителях
растворимости в сторону меньших значений
приведены на рис. 5 и 6. В трех системах из
концентрации соли, после точки пересечения
четырех (кроме CdI2-диоксан- H2O) растворимость
линий
- повышение растворимости. Вероятно,
лежит выше аддитивных значений, локальные
высаливание бромида кадмия на первом участке
максимумы на изотермах приближены к точкам
связано с повышенным содержанием в этой
эвтоник. В системе с 1,4-диоксаном наблюдается
области несвязанной с диметилсульфоксидом
высаливание соли в виде сольвата {CdI2(DX)}n во
воды, в которой растворимость соли ниже, чем в
всем диапазоне составов смешанного раство-
органическом растворителе. За точкой Н
рителя. Локальный максимум на изотерме в
наблюдается всаливание бромида кадмия, так как
области хDX
=
0.4 не является точкой смены
доминирующей молекулярной формой в растворе
твердой фазы, и скорее связан со структурными
становятся ассоциаты из молекул ДМСО,
изменениями бинарного растворителя, позволя-
связанных с меньшим числом молекул воды. Это
ющими минимизировать энергетические затраты
увеличивает сольватирующую способность ДМСО
при образовании раствора.
и повышает растворимость соли, приближая ее к
значениям растворимости в чистом органическом
Действительно, как было отмечено в ряде работ
по исследованию смеси диоксан-вода в этой
растворителе, из которого кристаллизуется сольват
области составов смешанного растворителя
островного мотива структуры [Cd(DMSO)6][CdBr4],
растворимость которого больше, чем полимерного
наблюдается изменение доминирующих форм
молекулярных ассоциатов. В области хDX = 0.5
CdBr2·2DMSO.
энтальпия смешения растворителей равна нулю
В системе CdBr2-H2O-диоксан наблюдается
[52], что свидетельствует о максимальной
резкое уменьшение растворимости при небольшом
деструктурированности смешанного растворителя
добавлении диоксана к насыщенному раствору
и может являться причиной повышения
бромида кадмия в воде: резкое падение
растворимости. Вторая половина изотермы
растворимости соли с
7.6 моль/100 моль до
прилегает к линии аддитивной растворимости.
0.16 моль/100 моль происходит уже при 0.05 мол.
доли
1,4-диоксана. При варьировании состава
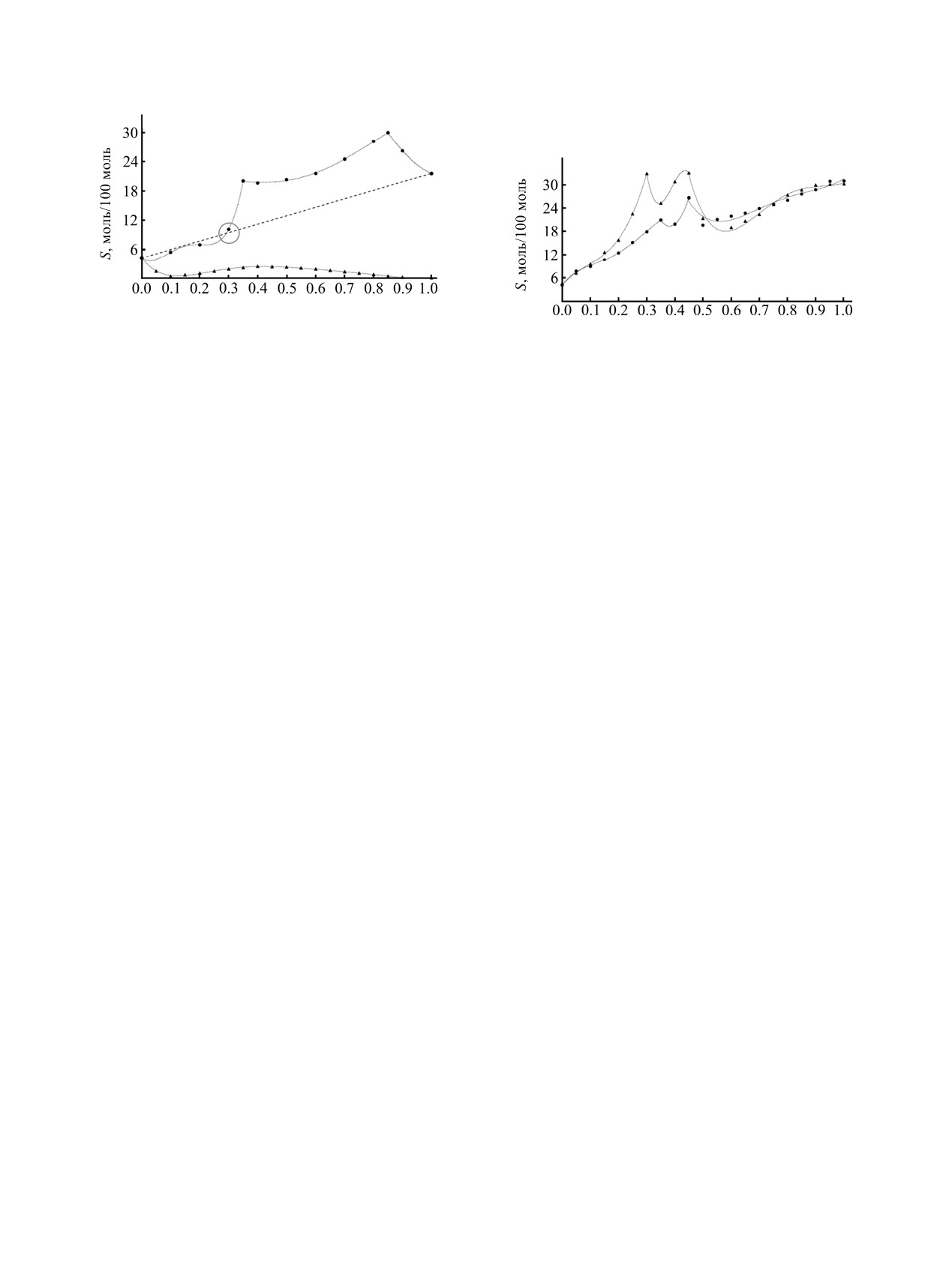
Растворимость иодида кадмия в смеси вода-
бинарного растворителя в системе происходит
ДМСО изменяется скачкообразно в области хDMSO =
последовательная смена состава равновесных
0.3, где резко увеличивается отклонение изотермы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
933
Таблица 4. Области кристаллизации сольватов в тройных системах, содержащих бинарный органический растворитель
Тройная система
Область изотермы
Состав сольвата
NiCl2-ДМСО-диметилацетамид
0 < хDMA < 0.9
[Ni(DMSO)6][NiCl4]
хDMA = 1
[Ni(DMA)6][NiCl4]
NiCl2-ДМСО-диоксан
0 < хDX < 0.9
[Ni(DMSO)6][NiCl4]
хDX = 1
NiCl2(DX)
CuCl2-ДМСО-диметилацетамид
0 < хDMA < 0.9
{CuCl2(DMSO)2}n
0.95 < хDMA < 1
CuCl2(DMA)
CuCl2-ДМСО-диоксан
0 < хDX < 0.9
{CuCl2(DMSO)2}n
0.95 < хDX < 1
{CuCl2(DX)0.7}n
CuCl2-диметилацетамид-диоксан
0 < хDX < 0.9
CuCl2(DMA)
0.95 < хDX < 1
{CuCl2(DX)0.7}n
растворимости от аддитивной. В этой области
ацетамид будет иметься сходство. Все четыре
(отмечена на рис.
5) обнаруживается самая
сольвата содержат в своем составе комплексный
устойчивая форма межмолекулярных ассоциатов
катион, в котором комплексообразующий ион
состава DMSO·2H2O. Из диаграммы видно, что до
металла имеет октаэдрическое окружение молекул
этой области наблюдается совпадение положения
растворителя. Однако в то время как для иодида
экспериментально полученных значений раствори-
кадмия в этом смешанном растворителе
мости и линии аддитивной растворимости, при ее
наблюдается образование смешаннолигандных
переходе растворимость повышается.
сольватов, в составе которых изменяется состав
катиона
[Cd(DMSO)6-n(DMA)n]2+, и образуются
Тройные системы соль-бинарный органи-
сольваты со значением n = 2, 4, в системе NiCl2-
ческий растворитель. Естественным продолжением
ДМСО-диметилацетамид не происходит образо-
исследования тройных систем, содержащих
вание сольватов смешанного состава. Во всей
бинарный растворитель, молекулы которого имеют
области составов смешанного растворителя
донорный атом одной природы (кислород-
кристаллизуется сольват, содержащий более
донорные растворители), является исследование
донорный растворитель
[Ni(DMSO)6][NiCl4].
систем соль
- бинарный органический раство-
Растворимости солей в бинарных органических
ритель. Были исследованы системы, содержащие
растворителях находятся ниже линии аддитивной
хлориды меди и никеля в смесях ДМСО-
растворимости, что также можно связать с
диметилацетамид, ДМСО-диоксан и диметил-
понижением диэлектрической проницаемости
ацетамид-диоксан (последняя только для хлорида
среды при образовании смешанного растворителя,
меди
[17]). Найденная для водно-органических
что понижает растворимость хлоридов меди и
систем связь донорного числа растворителя и
никеля, как солей с большим вкладом электро-
протяженности областей кристаллизации, а именно
статического взаимодействия в межатомную связь.
большая протяженность полей кристаллизации
сольватов, содержащих более донорный раство-
Растворимость в тройных системах, содер-
ритель (табл. 4), выполняется и для этих систем.
жащих два растворителя и солевой компонент,
Результаты, полученные для систем с хлоридом
имеет связь со свойствами бинарного растворителя
никеля оказались неожиданными. Предполагалось,
(диэлектрическая проницаемость), свойствами
что подобие строения сольватов хлорида никеля и
солевого компонента (природа кристаллической
иодида кадмия в диметилсульфоксиде ([Cd(DMSO)6]·
решетки), и со структурным типом сольватов.
[CdI4], [Ni(DMSO)6][NiCl4]) и диметилацетамиде
Доминирующее влияние только одного фактора
([Cd(DMA)6][Cd2I6],
[Ni(DMA)6][NiCl4]) позволит
наблюдается лишь в отдельных случаях, а в общем
провести параллель между этими соединениями, и
случае каждая тройная система может быть
в тройных системах для обеих солей с одинаковым
охарактеризована только с учетом влияния всех
бинарным растворителем ДМСО-диметил-
указанных факторов. Структурный мотив
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
934
БОГАЧЕВ и др.
кристаллосольватов определяется относительной
Vol. 43. N 48. P. 17971. doi 10.1039/C4DT02706J
мягкостью ионов: образование сольватов с
10. Marcus Y. // J. Chem. Thermodyn. 2007. Vol. 39. N 10.
островным мотивом структуры происходит
P. 1338. doi 10.1016/j.jct.2007.04.003
преимущественно в системах, образованных
11. Marcus Y. // J. Chem. Soc. Dalton Trans. 1991. N 9.
парами либо мягких, либо жестких ионов (иодид
P. 2265. doi 10.1039/DT9910002265
кадмия, хлорид никеля, хлорид кобальта),
12. Marcus Y. // J. Solution Chem. 2007. Vol. 36. N 11-12.
независимо от донорной способности раство-
P. 1385. doi 10.1007/s10953-007-9196-4
рителя. Наблюдается тождественность структур-
13. Tanaka F., Kawasaki Y., Yamashita S. // J. Chem. Soc.
ного типа сольватов, кристаллизующихся в
Faraday Trans. 1. 1988. Vol. 84. N 4. P. 1083. doi
10.1039/F19888401083
тройных и бинарных системах.
14. Marcus Y. // J. Chem. Soc. Faraday Trans. 1. 1989.
Авторы выражают благодарность Г.Л. Старовой
Vol. 85. N 9. P. 3019. doi 10.1039/F19898503019
(Санкт-Петербургский государственный университет),
15. Li L., Wang S., Chen T., Sun Z., Luo J., Hong M. //
Н.А. Цырульникову и А.А. Тихомировой (Государ-
Cryst. Growth Des. 2012. Vol. 12. N 8. Р. 4109. doi
ственный университет Боулинг Грин) за помощь в
10.1021/cg300
получении и интерпретации ряда результатов.
16. Sreekumar T. K., Kalidas C. // Ber. Bunsenges. Phys.
Chem. 1994. Vol. 98. N 1. P. 102. doi 10.1002/
ФОНДОВАЯ ПОДДЕРЖКА
bbpc.19940980114
17. Богачев Н.А., Любичев Д.А., Старова Г.Л.,
Работа выполнена при финансовой поддержке
Никольский А.Б., Скрипкин М.Ю. // ЖОХ.
2018.
Российского фонда фундаментальных исследо-
Т. 88. Вып. 4. С. 529; Bogachev N.A., Lyubichev D.A.,
ваний (проект № 18-33-00636) с использованием
Starova G.L., Nikolskii A.B., Skripkin M.Y. // Russ. J.
оборудования Ресурсных центров
«Рентгено-
Gen. Chem. 2018. Vol. 88. N 4. P. 617. doi 10.1134/
дифракционные методы исследования» и «Методы
S1070363218040011
анализа состава вещества» Научного парка Санкт-
18. Богачев Н.А., Старова Г.Л., Разживин А.В.,
Петербургского университета.
Скрипкин М.Ю., Никольский А.Б. // ЖОХ.
2018.
Т. 88. Вып. 1. С. 3; Bogachev N.A., Starova G.L.,
КОНФЛИКТ ИНТЕРЕСОВ
Razzhivin A.V., Skripkin M.Y., Nikolskii A.B. // Russ. J.
Gen. Chem. 2018. Vol. 88. N 1. P. 1. doi 10.1134/
Авторы заявляют об отсутствии конфликта
S1070363218010012
интересов.
19. Богачев Н.А., Цырульников Н.А., Старова Г.Л.,
СПИСОК ЛИТЕРАТУРЫ
Скрипкин М.Ю., Никольский А.Б. // ЖОХ.
2017.
Т. 87. Вып. 11. С. 1926; Bogachev N.A., Tsyrulnikov N.A.,
1. Лященко А.К. // Концентрированные и насыщенные
Starova G.L., Skripkin M.Y., Nikolskii A.B. // Russ. J.
растворы / Под ред. А.М. Кутепова. М.: Наука, 2002.
Gen. Chem. 2017. Vol. 87. N 11. P. 2748. doi 10.1134/
С. 93.
S1070363217110378
2. Давидьян А.Г. Автореф. дис. … канд. хим. наук.
20. Богачев Н.А., Цырульников Н.А., Горбунов А.О.,
СПб, 2014. 19 с.
Никольский А.Б., Скрипкин М.Ю., Бурков К.А. //
3. Rook R., Dost S. // Int. J. Eng. Sci. 2007. Vol. 45. N 1.
ЖОХ. 2016. Т. 86. Вып. 11. С. 1761; Bogachev N.A.,
P. 75. doi 10.1016/j.ijengsci.2006.09.004
Tsyrulnikov N.A., Gorbunov A.O., Nikolskii A.B.,
Skripkin M.Y., Burkov K.A. // Russ. J. Gen. Chem. 2016.
4. Vito S., Ifti M., Malollari I. // J. Environ. Protect. Ecol.
Vol.
86.
N
11.
P.
2405.
doi
10.1134/
2011. Vol. 12. N 2. P. 752.
S1070363216110013
5. Krakowiak J., Lundberg D., Persson I. // Inorg. Chem.
21. Горбунов А.О., Цырульников Н.А., Тихомирова А.А.,
2012. Vol. 51. N 18. P. 9598. doi 10.1021/ic300202f
Богачев Н.А., Скрипкин М.Ю., Никольский А.Б.,
6. Persson I., Lyczko K., Lundberg D., Eriksson L.,
Пестова О.Н. // ЖОХ. 2016. Т. 86. Вып. 4. С. 581;
Płaczek A. // Inorg. Chem. 2011. Vol. 50. N 3. P. 1058.
Gorbunov A.O., Tsyrul’nikov N.A., Tikhomirova A.A.,
doi 10.1021/ic1017714
Bogachev N.A., Skripkin M.Y., Nikolskii A.B., Pesto-
7. D’Angelo P., Migliorati V., Guidoni L. // Inorg. Chem.
va O.N. // Russ. J. Gen. Chem. 2016. Vol. 86. N. 4.
2010. Vol. 49. N 9. P. 4224. doi 10.1021/ic9025574
P. 771. doi 10.1134/S1070363216040022
8. Eklund L., Hofer T.S., Persson I. // Dalton Trans. 2015.
22. Богачев Н.А., Горбунов А.О., Никольский А.Б.,
Vol. 44. N 4. P. 1816. doi 10.1039/C4DT02580F
Скрипкин М.Ю. // ЖОХ. 2016. Т. 86. Вып. 7. С. 1057;
9. Bajnóczi E.G., Czeglédi E., Kuzmann E., Homonnay Z.,
Bogachev N.A., Gorbunov A.O., Nikolskii A.B., Skrip-
Bálint S., Dombi G., Forgo P., Berkesi O., Pálinkó I.,
kin M.Y. // Russ. J. Gen. Chem. 2016. Vol. 86. N. 7.
Peintler G., Sipos P., Persson I. // Dalton Trans. 2014.
P. 1539. doi 10.1134/S107036321607001X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
РАВНОВЕСИЕ РАСТВОР-ТВЕРДАЯ ФАЗА В ТРОЙНЫХ СИСТЕМАХ
935
23. Богачев Н.А., Горбунов А.О., Тихомирова А.А.,
Spektor K.K., Skripkin M.Yu. // Russ. J. Gen. Chem.
Пушихина О.С., Скрипкин М.Ю., Никольский А.Б. //
2011. Vol.
81. N
9. P.
1768. doi
10.1134/
ЖОХ. 2015. Т. 85. Вып. 11. С. 1765; Bogachev N.A.,
S1070363211090052
Gorbunov A.O., Tikhomirova A.A., Pushikhina O.S.,
37. Спектор К.К., Старова Г.Л., Скрипкин М.Ю.,
Skripkin M.Y., Nikolskii A.B. // Russ. J. Gen. Chem.
Степакова Л.В. // ЖОХ. 2011. Т. 81. Вып. 9. С. 1432;
2015. Vol.
85. N.
11. P.
2509. doi
10.1134/
Spektor K.K., Starova G.L., Skripkin M.Yu., Stepako-
S107036321511002X
va L.V. // Russ. J. Gen. Chem. 2011. Vol. 81. N 9.
24. Кочемировский В.А., Скрипкин М.Ю., Тверьянович И.С.,
P. 1772. doi 10.1134/S1070363211090064
Мерещенко А.С., Горбунов А.О., Панов М.С.,
38. Bobicz D., Kristiansson O., Persson I. // J. Chem. Soc.
Сафонов С.В. // Усп. хим. 2015. Т. 84. № 10. С. 1059;
Dalton Trans. 2002. N 22. P. 4201-4205. doi 10.1039/
Kochemirovsky V.A., Skripkin M.Y., Tveryanovich Y.S.,
b204128f
Mereshchenko A.S., Gorbunov A.O., Panov M.S.,
39. Hay R.W., Albedyhl S., Lightfoot P. // Trans. Met.
Safonov S.V. // Russ. Chem. Rev. 2015. Vol. 84. N 10.
Chem. 1998. Vol. 23. N 3. P. 257. doi 10.1023/
P. 1059. doi 10.1070/RCR4535
A:1015744413792
25. Горбунов А.О., Спектор К.К., Скрипкин М.Ю.,
40. Ciccarese A., Clemente D.A., Marzotto A., Valle G. // J.
Цырульников Н.А. // ЖОХ. 2012. Т. 82. Вып. 6.
Crystallogr. Spectrosc. Res. 1993. Vol. 23. N 3. P. 223.
С. 885; Gorbunov A.O., Spektor K.K., Skripkin M.Y.,
doi 10.1007/BF01190050
Tsyrulnikov N.A. // Russ. J. Gen. Chem. 2012. Vol. 82.
41. Filatov A.S., Anderson J.S. // CSD Commun. 2015. doi
N 6. P. 1053. doi 10.1134/S1070363212060023
10.5517/cc1k4fpt
26. Степакова Л.В., Скрипкин М.Ю., Корнеева В.В.,
42. Nieuwenhuyzen M., Wilkins C.J. // J. Chem. Soc. Dalton
Григорьев Я.М., Бурков К.А. // ЖОХ. 2009. Т. 79.
Trans. 1993. N 18. P. 2673. doi 10.1039/DT9930002673
Вып.
6. С.
881; Stepakova L.V., Skripkin M.Y.,
43. De Oliveira O.A., Chagas P., Airoldi C. // Inorg. Chem.
Korneeva V.V., Grigoriev Y.M., Burkov K.A. // Russ. J.
1983. Vol. 22. N 1. P. 136. doi 10.1021/ic00143a030
Gen. Chem. 2009. Vol. 79. N 6. P. 1053. doi 10.1134/
S1070363209060012
44. Wang J.-Q., Du R.-J., Wang W., Luan C.-J., Guo C. //
Acta Cryst. (E). 2010. Vol. 66. P. m1682. doi 10.1107/
27. Богачев Н.А., Цырульников Н.А., Макарова А.А.,
Толмачев М.В., Старова Г.Л., Скрипкин М.Ю.,
S1600536810048634
Никольский А.Б. // ЖОХ. 2019. Т. 89. Вып. 5. С. 659.
45. Barnes J.C., Sesay L.J // Inorg. Nucl. Chem. Letters.
doi 10.1134/S0044460X19050019
1977. Vol. 13. N 3-4. P. 153. doi 10.1016/0020-1650
28. Pearson R.G. // J. Am. Chem. Soc. 1963. Vol. 85. N 22.
(77)80085-8
P. 3533. doi 10.1021/ja00905a001
46. Nieuwenhuyzen M., Wen H., Wilkins C.J. // Z. anorg.
29. Marcus Y. // J. Phys. Chem. 1987. Vol. 91. N 16.
allg. Chem. 1992. Vol. 615. N 9. P. 143. doi 10.1002/
P. 4422. doi 10.1021/j100300a044
zaac.19926150929
30. Marcus Y. // Isr. J. Chem. 1972. Vol. 10. N 3. P. 659.
47. Savinkina E.V., Zamilatskov I.A., Kuzovlev A.S., Albov D.V.,
doi 10.1002/ijch.197200065
Golubev D.V., Chernyshev V.V. // Polyhedron. 2014.
31. Gutmann V. // Coord. Chem. Rev. 1976. Vol. 18. N 2.
Vol. 69. P. 68. doi 10.1016/ j.poly.2013.11.024
P. 225. doi 10.1016/S0010-8545(00)82045-7
48. Ahuja I.S., Rastogi P. // J. Inorg. Nucl. Chem. 1969.
32. Haynes W.M., Lide D.R., Bruno T.J. // CRC Handbook
Vol. 31. N 11. P. 3690. doi 10.1016/0022-1902(69)
of Chemistry and Physics. Boca Raton: CRC Press,
80365-9
Taylor & Francis Group, 2017.
49. Checoni R.F., Volpe P.L.O. // J. Solution Chem. 2010.
33. Горбунов А.О. Автореф. дис. … канд. хим. наук.
Vol. 39. N 2. P. 259. doi 10.1007/s10953-010-9500-6
СПб, 2017. 19 с.
50. Lotze S., Groot C.C.M., Vennehaug C., Bakker H.J. // J.
34. Ravindran K., Drumheller J.E. // J. Magn. Magn. Mater.
Phys. Chem. (B). 2015. Vol. 119. N 16. P. 5228. doi
1992. Vol. 104. N 107. P. 833. doi 10.1016/0304-8853
10.1021/jp512703w
(92)90382-X
51. Guang Y., Masaaki W., Toshiyuki T. // J. Mol. Liq.
35. Suzuki H., Fukushima N., Ishiguro S. // Acta Cryst. (C).
2001. Vol. 94. N 3. P. 273. doi 10.1016/S0167-7322(01)
1991.
Vol.
47.
N
9.
P.
1838.
doi
00275-6
10.1107SO108270191002937
52. Suzuki T., Fujisawa M., Takagi S., Kimura T. // J.
36. Старова Г.Л., Спектор К.К., Скрипкин М.Ю. //
Therm. Anal. Calorim. 2006. Vol. 85. N 3. P. 545. doi
ЖОХ. 2011. Т. 81. Вып. 9. С. 1428; Starova G.L.,
10.1007/s10973-006-7658-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019
936
БОГАЧЕВ и др.
A Solution-Solid Phase Equilibrium in Ternary Systems
Containing d-Elements Salts and Mixed Oxygen-Donor Solvent
N. A. Bogachev*, A. O. Gorbunov, M. Yu. Skripkin, and A. B. Nikol’skii
St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: n.bogachev@spbu.ru
Received March 20, 2019; revised March 20, 2019; accepted March 23, 2019
The results of the study of ternary systems containing copper, cobalt, nickel and cadmium halides and sulfates in
binary aqueous-organic and mixed organic solvents are summarized. The influence of the donor-acceptor
properties of the components of the ternary system, the relative dielectric constant of the solvent, and the
intermolecular association in the mixed solvent on the salts solubility and the structure of crystalline solvates is
analyzed.
Keywords: d-elements salts, solubility, ternary systems, competing solvation, crystal solvates, electrolyte solutions
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 6 2019