ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 987-994
УДК 547.594.3;547.779.1
ВЗАИМОДЕЙСТВИЕ 2-АЦЕТИЛ-5-ГИДРОКСИ-5-МЕТИЛ-
3-ФЕНИЛЦИКЛОГЕКСАНОНА И АЛКИЛ-
4-ГИДРОКСИ-4-МЕТИЛ-2-ОКСО-
6-ФЕНИЛЦИКЛОГЕКСАНКАРБОКСИЛАТОВ
С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
© 2019 г. В. Л. Гейнa, *, Н. В. Носоваa, А. В. Вагаповa, Н. В. Дозмороваa, А. Н. Янкинb
a Пермская государственная фармацевтическая академия Министерства здравоохранения
Российской Федерации, ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
b Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 4 февраля 2019 г.
После доработки 4 февраля 2019 г.
Принято к печати 10 февраля 2019 г.
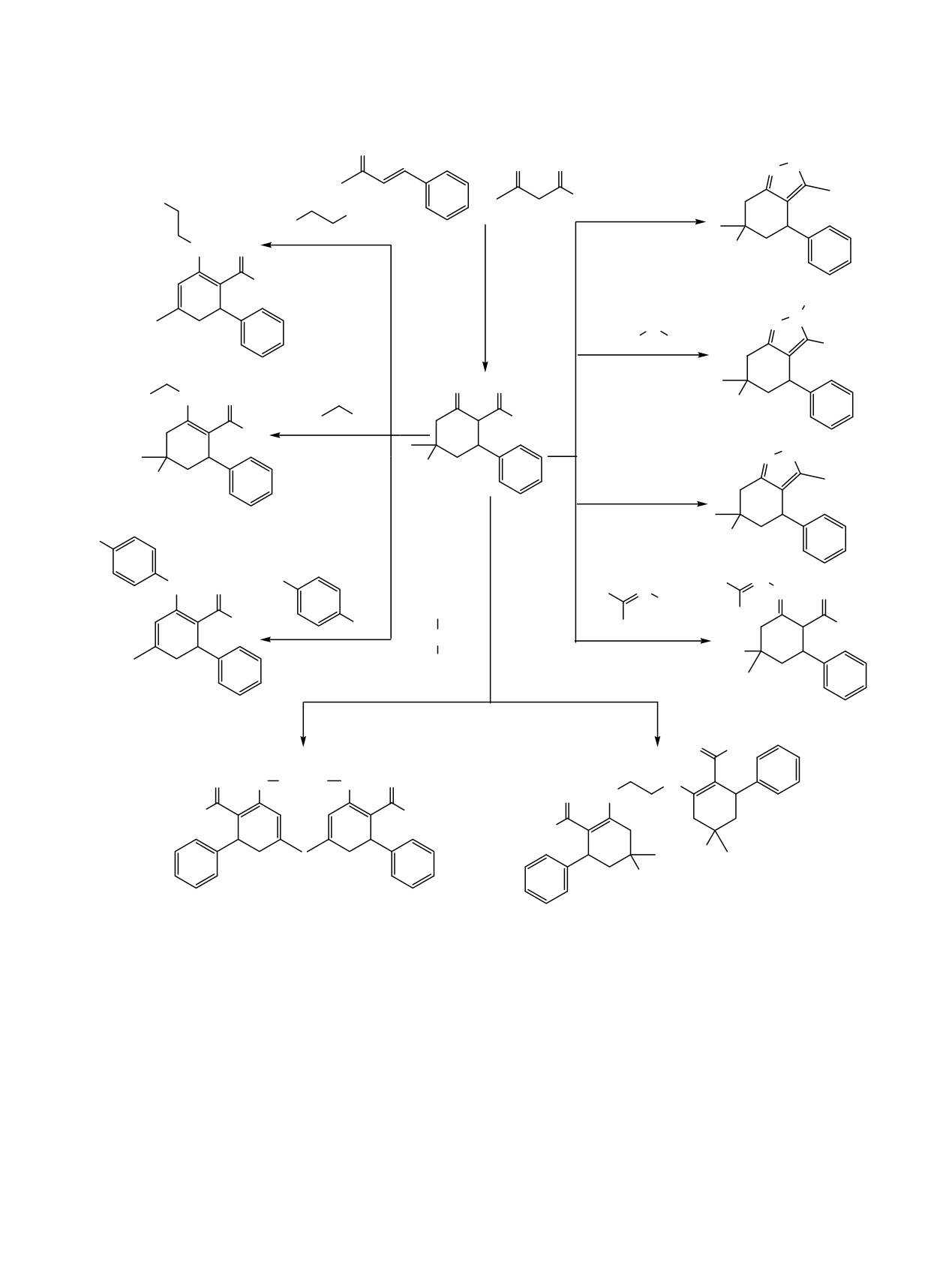
На основе реакций
2-ацетил-5-гидрокси-5-метилциклогексанона и алкил-4-гидрокси-4-метил-2-
оксоциклогексанкарбоксилатов с такими нуклеофильными реагентами, как алифатические и
ароматические амины, диамины, гидроксиламин, гидразин, фенилгидразин, гидразон бензофенона были
получены новые енамины, бис(енамины), бензизоксазолы, тетрагидроиндазолы и гидразоны
бензофенона. Структура всех полученных соединений доказана с помощью ИК и ЯМР 1Н спектроскопии.
Ключевые слова: 2-ацетилциклогексанон, алкил 2-оксоциклогексанкарбоксилаты, енамины, индазолы,
бензизоксазолы, гидразоны
DOI: 10.1134/S0044460X19070011
Циклогексаноны и их производные являются
Ранее нами были получены 2-ацетил-5-гидрокси-
важным структурным объектом для синтеза новых
5-метил-3-фенилциклогексанон
1а и алкил-4-
гетероциклических соединений, обладающих
гидрокси-4-метил-2-оксо-6-фенилциклогексанкар-
антимикробной [1-4], анальгетической [5], анти-
боксилаты
1б-з реакцией бензальацетона с
фаговой
[6], антиаритмической
[7], гипоглике-
ацетилацетоном и эфирами ацетоуксусной кислоты
мической
[8], противораковой
[9], противо-
соответственно в присутствии гидроксида калия в
судорожной [10], противовоспалительной [11] и
этаноле при комнатной температуре и изучено их
психоседативной активностью [5, 10]. Известно,
антимикробное действие по отношению к
что продукты взаимодействия соединений, содер-
штаммам St. aureus и E. coli [19]. В настоящей
жащих в своей структуре фрагмент цикло-
работе представлен синтез новых соединений 2-9
гексанона, с нуклеофильными реагентами являются
на основе реакций циклогексанонов 1а-з с N-
хорошими диуретиками
[12],
ингибиторами
нуклеофильными реагентами.
ферментов, таких как холинэстераза [13], и могут
использоваться в качестве антипротозойных [14],
Взаимодействие с мононуклеофильными реаген-
антитрипаносомальных
[15] и антигельмитных
тами представлено на примере реакций 2-ацетил-
фармацевтических препаратов [16]. Кроме того,
циклогексанона
1а и алкил-2-оксоциклогексан-
существуют положительные результаты исследо-
карбоксилатов 1б, г, д с алкил- и ариламинами.
ваний данных соединений в качестве лигандов-
Показано, что при кипячении эквимолярных
агонистов Н1-рецепторов организма, что имеет
количеств реагентов в этиловом спирте, в
фармакотерапевтический потенциал в лечении нейро-
некоторых случаях с добавлением каталитического
дегенеративных и нейропсихиатрических расстройств,
количества
уксусной кислоты, проходило
а также различных видов аллергии [17, 18].
аминирование карбонильной группы алицикла, что
987
988
ГЕЙН и др.
Схема 1.
O
O
O
N
O
+
HO
R1
H2N OH
NH2
HO
EtOH, t°
NH O
HO
AcOH,
6
EtOH, t°
KOH
EtOH
R1
R3
H
N
N
N
H2N
R3
2
OH
EtOH, t°
O O
Ph
NH O
HO
Ph
NH2
R1
7а, б
R1
EtOH, t°
NH
N
HO
HO
1а-з
H2N NH2
3
EtOH, t°
R2
HO
7в
2
R
Ph
N
NH O
Ph
N
N O
NH2
NH2
Ph
R1
NH
Ph
2
R1
(CH2)n
EtOH, t°
AcOH,
HO
NH
EtOH, t°
EtOH, t°
2
8а-в
4а-з
AcOH
O R1
H
O HN
(CH
NH
O
N
2)n
O HN
R1
R1
R1
HO
OH
5а, б
5в
R1=Me (1а, 6); R1=OMe (1б, 2, 3, 9); R1=Me, R2=OMe (1а, 4а); R1=OMe, R2=OMe (1б, 4б); R1=OMe, R2=F (1б, 4в);
R1=OMe, R2=Н (1б, 4г); R1=OMe, R2=Cl (1б, 4д); R1=O-iPr, R2=Me (1г, 4е); R1=O-iBu, R2=Me (1д, 4ж); R1=O-iBu, R2=Me
(1д, 4з); R1=O-iPr, n = 2 (1г, 5а); R1=O-iPr, n = 3 (1г, 5б); R1=O-iBu, n = 2 (1д, 5в); R1=OEt, R3=Ph (1в, 7а); R1=OEt, R3=Н
(1в, 7б); R1=OBn (1е, 8а); R1=O-iPr (1г, 8б); R1=OEt (1в, 8в).
приводило к образованию соответствующих
диамин и 1,3-пропандиамин, в этиловом спирте
енаминов 2-4 (схема 1).
при нагревании в течение
2-4 ч протекала
региоселективно с участием обеих аминогрупп
Реакция между алкил-4-гидрокси-4-метил-2-
диамина и карбонильной группы алицикла двух
оксо-6-фенилциклогексан-1-карбоксилатами 1г, д и
молекул циклогексанона с образованием новых
алифатическими диаминами, такими как этилен-
производных бис(енаминов) 5а-в (схема 1).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ВЗАИМОДЕЙСТВИЕ 2-АЦЕТИЛ-5-ГИДРОКСИ-5-МЕТИЛ-3-ФЕНИЛЦИКЛОГЕКСАНОНА
989
Полученные соединения
2-5 представляют
Бензизоксазол 6 и тетрагидроиндазолы
7а-в
собой желтые кристаллические вещества, раство-
представляют собой бесцветные кристаллические
римые в ацетоне, ДМСО, ДМФА, при нагревании -
вещества, растворимые в ДМФА и ДМСО, трудно
в этиловом, изопропиловом, н-бутиловом спиртах
растворимые в этиловом и н-бутиловом спиртах,
и ацетонитриле, нерастворимые в воде.
ацетонитриле, диоксане и нерастворимые в воде.
В ИК спектрах енаминов 3, 4а-з и бис(енаминов)
В ИК спектрах соединений
6,
7а-в имеются
5а-в имеются интенсивные полосы поглощения NH-
интенсивные полосы поглощения OH-группы (3312-
группы (3296-3266 см-1) и сложноэфирной группы
3400 см-1) и сопряженной C=N связи (1600-1640 см-1).
(1696-1740 см-1). В спектрах соединений 4а-з
Полосы, обусловленные валентными колебаниями
присутствует полоса поглощения связи С=С (1596-
карбонильных групп, характерные для исходных
1564 см-1). В спектрах ЯМР 1Н соединений 2-5
циклогексанонов, в спектрах соединений 6, 7а-в
присутствуют синглетные сигналы протонов
отсутствуют. В спектре соединении 7в наблюдается
метильной группы при атоме С5 цикла (1.21-1.78
полоса, обусловленная колебаниями вторичной NH-
группы (3312 см-1). В спектрах ЯМР 1Н соединений
м. д.), мультиплеты ароматических протонов (6.98-
7.40 м. д.) и дублеты протонов при атоме С6 (1.82-
6, 7а-в присутствуют синглетные сигналы метиль-
2.88 м. д.) с константами спин-спинового взаимо-
ных групп при атоме С6 (1.21-1.32 м. д.), триплет
действия в пределах
15.8-17.0 Гц. Отсутствие
(2.46--2.62 м. д., J = 14.3-16.8 Гц) и дублет
сигнала протона при атоме С2 в спектре соединения
дублетов протонов метиленовой группы при атоме
1а (С1 для соединений 1б, г, д), а также наличие
С5 (2.56-2.74 м. д., J 14.3-16.5, 1.4-1.6 Гц) и
сигнала протона NH-группы
(9.07-13.07 м. д.)
дублеты при атоме С7 (1.40-1.62 и 1.62-1.96 м. д.) в
подтверждает образование енаминов. В масс-
виде АВ-системы с КССВ в пределах 11.6-13.4 Гц,
спектре соединения 4ж присутствует пик молеку-
а также мультиплетные сигналы ароматических
лярного иона с m/z
375, а также пики
протонов (7.13-7.68 м.д.). В спектрах соединений 6
фрагментарных ионов с m/z 360 [М - CH3]+, 318
и
7в наблюдаются дополнительные синглеты
[М - CH2CH(CH3)2]+, 298 [М - C6H5]+ и 274 [M -
протонов метильных групп при атоме С3 (1.72 и
COOCH2CH(CH3)2]+, подтверждающих предпола-
1.48 м. д.). В случае тетрагидроиндазола
7б
гаемую структуру.
обнаружен уширенный синглет двух протонов ОН-
и NH-групп (10.20 м. д).
Образование енаминной формы соединений 2-5
Соединения 7а, б дают качественную реакцию
объясняется существованием внутримолекулярной
со спиртовым раствором хлорида железа(III), что
водородной связи между атомом водорода
наряду с литературными данными для близких по
аминогруппы и атомом кислорода сложноэфирной
структуре соединений, строение которых подтвер-
карбонильной группы. Дегидратация соединений
ждено с помощью данных РСА [20] и результатами
2-5 с участием протона при атоме С3 обусловлена
ИК, ЯМР 1Н спектроскопии, свидетельствует о
наличием каталитического количества уксусной
енолизации карбонильной группы при С3 гетеро-
кислоты в реакционной среде.
цикла.
С целью получения новых бициклических
Взаимодействие алкил-4-гидрокси-4-метил-2-
производных, содержащих в своей структуре
оксо-6-фенилциклогексан-1-карбоксилатов 1в, г, е
биологически активные фрагменты изоксазола и
с гидразоном бензофенона привело к образованию
пиразола, нами были проведены реакции цикло-
соответствующих гидразонов
8а-в (схема
1).
гексанонов 1а, в с гидроксиламином, фенилгидра-
Структура соединений 8а-в была подтверждена
зином и гидразингидратом в этиловом спирте при
данными ИК, ЯМР 1Н спектроскопии и масс-
нагревании. При взаимодействии указанных
спектрометрии.
реагентов наблюдалось нуклеофильное замещение
атома кислорода карбонильной группы цикла с
Таким образом, реакция 2-ацетил-5-гидрокси-5-
последующей гетероциклизацией и образованием
метилциклогексанона и алкил-4-гидрокси-4-метил-
новых
4,5,6,7-тетрагидробензо[c]изоксазола
6 и
2-оксоциклогексанкарбоксилатов с алкил- и арил-
4,5,6,7-тетрагидро-2H-индазолов 7а-в с выходами
аминами приводит к образованию соответству-
41 и 61-93% соответственно (схема 1). Выход
ющих енаминов и бис(енаминов). Взаимодействие
соединения 6 ниже в сравнении с производными
функционализированных циклогексанонов с такими
7а-в из-за меньшей нуклеофильности реагента.
бинуклеофильными реагентами, как гидроксил-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
990
ГЕЙН и др.
амин и гидразин, сопровождается циклизацией с
15.8 Гц), 1.98 д (1Н, C6HAHB, J = 15.9 Гц), 2.26 д (1Н,
образованием новых производных бензизоксазола
C4HAHB, J = 12.8 Гц), 2.72 д (1Н, C4HAHB, J = 12.8 Гц),
и 4,5,6,7,-тетерагидро-2H-индазола. В случае взаимо-
3.38 с (3Н, OMe), 3.71 м (1Н, C1H), 4.35 д (2Н,
действия циклогексанонов с гидразоном бензо-
NHCH2C6H5, J = 6.5 Гц), 7.01-7.25 м (10Н, 2Ph), 9.15 т
фенона образуются к соответствующие гидразоны.
(1H, NH, J = 6.3 Гц). Найдено, %: С 75.01; Н 7.14; N
4.10. C22H25NO3. Вычислено, %: С 75.19; Н 7.17; N 3.99.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общая методика синтеза соединений 4а-з. К
раствору 0.005 моль 4-гидрокси-4-метил-6-фенил-
ИК спектры сняты на приборе Specord М-80 в
циклогексанона
1а в
5 мл этилового спирта
вазелиновом масле. Спектры ЯМР 1Н записаны на
добавляли
0.005 моль соответствующего арил-
приборе Bruker AM-300 с рабочей частотой
амина и
0.1 мл ледяной уксусной кислоты.
300 МГц в ДМСО-d6, внутренний стандарт
-
Полученную смесь кипятили в течение 3-4 ч, затем
тетраметилсилан. Масс-спектры сняты на приборе
охлаждали. Осадок отфильтровывали, сушили и
Finnigan MAT INCOS-50 (энергия ионизирующего
перекристаллизовывали из этанола.
излучения - 70 эВ). Элементный анализ выполнен
на приборе PerkinElmer 2400. Температуры плавле-
5-Метил-1-{3-[(4-метоксифенил)амино]-1,6-ди-
ния определены на приборе Melting Point M-565.
гидро-(1,1'-бифенил)-2-ил}этанон
(4а). Выход
60%, т. пл. 120-122°С. ИК спектр, ν, см-1: 3223
2-Ацетил-5-гидрокси-5-метил-3-фенилцикло-
(NH), 1660 (C=O), 1592 (С=С). Спектр ЯМР 1Н, δ,
гексанон 1а и алкил-4-гидрокси-4-метил-2-оксо-6-
м. д.: 1.69 с (3Н, Me), 1.88 с (3Н, COMe), 2.33 д (1Н,
фенилциклогексанкарбоксилаты 1б-з получали по
C6HAHB, J = 16.8 Гц), 2.93 д (1Н, C6HAHB, J = 16.5 Гц),
известной методике [19].
3.77 с (3Н, OMe), 4.08 м (1Н, C1H), 5.99 с (1Н, С4Н), 6.98-
7.21 м (9Н, Ph, С6Н4), 13.07 с (1H, NH). Найдено, %: С
Метил-5-гидрокси-3-[(2-гидроксиэтил)амино]-
79.06; Н 7.00; N 4.02. C22H23NO2. Вычислено, %: С
5-метил-1,4,5,6-тетрагидро-(1,1'-бифенил)-2-кар-
79.25; Н 6.95; N 4.20.
боксилат
(2). К раствору
0.01 моль метил-4-
гидрокси-4-метил-2-оксо-6-фенилциклогексан-1-
Метил-5-метил-3-[(4-метоксифенил)амино]-
карбоксилата
1б в
19.6 мл этанола добавляли
1,6-дигидро-(1,1'-бифенил)-2-карбоксилат
(4б).
0.02 моль этаноламина и 0.4 мл ледяной уксусной
Выход 57%, т. пл. 132-134°С. ИК спектр, ν, см-1:
кислоты. Полученную смесь кипятили в течение
3240 (NH), 1664 (C=O), 1592 (С=С). Спектр ЯМР
6 ч. Осадок отфильтровывали, сушили и пере-
1Н, δ, м. д.: 1.67 с (3Н, Me), 2.27 д (1Н, C6HAHB, J =
кристаллизовывали из этанола. Выход 51%, т. пл.
15.9 Гц), 2.83 д (1Н, C6HAHB, J = 16.1 Гц), 3.51 с
143-145°С. Спектр ЯМР 1Н, δ, м. д.: 1.76 с (3Н, Me),
(3Н, OMe), 3.76 с (3Н, OMe), 4.07 м (1Н, C1H), 5.90
2.22 д. д (1Н, C6HAHB, J = 16.9, 1.4 Гц), 2.71 д. д (1Н,
с (1Н, С4Н), 6.96-7.23 м (9Н, Ph, С6Н4), 10.52 с (1H,
C6HAHB, J = 16.5, 8.1 Гц), 3.33 м (2Н, NHCH2CH2OH),
NH). Найдено,
%: С
75.48; Н
6.67; N
4.19.
3.44 с (3Н, OMe), 3.53 м (2Н, NHCH2CH2OH), 3.98 м
C22H23NO3. Вычислено, %: С 75.62; Н 6.63; N 4.01.
(1Н, C1H), 4.76 т (1Н, NHCH2CH2OH, J = 5.5 Гц), 6.20 с
Метил-5-метил-3-[(4-фторфенил)амино]-1,6-
(1Н, C4H),
7.05-7.17 м
(5Н, Ph),
9.13 т
(1Н,
дигидро-(1,1'-бифенил)-2-карбоксилат
(4в).
NHCH2CH2OH, J = 5.8 Гц). Найдено, %: С 71.23; Н
Выход 44%, т. пл. 127-128°С. ИК спектр, ν, см-1:
7.41; N 4.68. C17H21NO3. Вычислено, %: С 71.06; Н
3260 (NH), 1670 (C=O), 1580 (С=С). Спектр ЯМР
7.37; N 4.87.
1Н, δ, м. д.: 1.70 с (3Н, Me), 2.32 д (1Н, C6HAHB, J =
16.7 Гц), 2.78 д (1Н, C6HAHB, J = 16.7 Гц), 3.49 с
Метил-3-(бензиламино)-5-гидрокси-5-метил-
(3Н, OMe), 4.06 м (1Н, C1H), 5.86 с (1Н, С4Н), 6.98-
1,4,5,6-тетрагидро-(1,1'-бифенил)-2-карбоксилат
7.16 м (9Н, Ph, С6Н4), 10.44 с (1H, NH). Найдено,
(3). К раствору
0.01 моль метил-4-гидрокси-4-
%: С 74.98; Н 5.92; N 4.29. C21H20FNO2. Вычислено,
метил-2-оксо-6-фенилциклогексан-1-карбоксилата
%: С 74.76; Н 5.97; N 4.15.
1б в 10 мл этанола добавляли 0.01 моль бензил-
амина. Полученную смесь кипятили 10 мин, затем
Метил-5-метил-3-(фениламино)-1,6-дигидро-
охлаждали. Осадок отфильтровывали, сушили и
(1,1'-бифенил)-2-карбоксилат (4г). Выход 29%,
перекристаллизовывали из этанола. Выход 24%,
т. пл. 96-97°С. ИК спектр, ν, см-1: 3240 (NH), 1668
т. пл. 115-117°С. ИК спектр, ν, см-1: 3472 (OH),
(C=O), 1572 (С=С). Спектр ЯМР 1Н, δ, м. д.: 1.69 с
3272 (NH), 1740 (C=O), 1592 (Ar). Спектр ЯМР 1Н,
(3Н, Me), 2.29 д (1Н, C6HAHB, J = 15.9 Гц), 2.86 д
δ, м. д.: 1.21 с (3Н, Me), 1.82 д (1Н, C6HAHB, J =
(1Н, C6HAHB, J = 16.1 Гц), 3.52 с (3Н, OMe), 4.07 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ВЗАИМОДЕЙСТВИЕ 2-АЦЕТИЛ-5-ГИДРОКСИ-5-МЕТИЛ-3-ФЕНИЛЦИКЛОГЕКСАНОНА
991
(1Н, C1H), 6.01 с (1Н, С4Н), 7.12-7.38 м (10Н, 2Ph),
Найдено, %: С 79.71; Н 7.02; N 3.90. C24H26FNO2.
10.55 с (1H, NH). Найдено, %: С 78.74; Н 6.55; N 4.57.
Вычислено, %: С 75.96; Н 6.91; N 3.69.
C21H21NO2. Вычислено, %: С 78.97; Н 6.63; N 4.39.
Общая методика синтеза соединений 5а, б. К
Метил-5-метил-3-[(4-хлорфенил)амино]-1,6-
раствору 0.01 моль алкил-4-гидрокси-4-метил-2-
дигидро-(1,1'-бифенил)-2-карбоксилат (4д). Выход
оксо-6-фенилциклогексан-1-карбоксилата в 9.5 мл
37%, т. пл. 120-121°С. ИК спектр, ν, см-1: 3296
этанола добавляли 0.01 моль диамина и 0.5 мл
(NH), 1660 (C=O), 1584 (С=С). Спектр ЯМР 1Н, δ,
ледяной уксусной кислоты. Полученную смесь
м. д.: 1.70 с (3Н, Me), 2.30 д (1Н, C6HAHB, J =
кипятили в течение 2-4 ч. Растворитель упаривали.
15.9 Гц), 2.86 д (1Н, C6HAHB, J = 16.0 Гц), 3.53 с (3Н,
Осадок отфильтровывали, промывали водой,
OMe), 4.07 м (1Н, C1H), 5.99 с (1Н, С4Н), 7.14-7.40 м
сушили и перекристаллизовывали из этанола.
(9Н, Ph, С6Н4), 10.55 с (1H, NH). Найдено, %: С 71.54;
Диизопропил-3,3''-[этан-1,2-диилбис(азандиил)]-
Н 5.63; N 4.19. C21H20ClNO2. Вычислено, %: С
бис[5-метил-1,6-дигидро-(1,1'-бифенил)-2-кар-
71.28; Н 5.70; N 3.96.
боксилат] (5а). Выход 26%, т. пл. 154-155°С. ИК
Изопропил-5-метил-3-(п-толиламино)-1,6-ди-
спектр, ν, см-1: 3300 (NH), 1750 (C=O). Спектр
гидро-(1,1'-бифенил)-2-карбоксилат (4е). Выход
ЯМР 1Н, δ, м. д.: 0.87 д (6Н, ОСНMe2, J = 6.0 Гц),
61%, т. пл. 83-84°С. ИК спектр, ν, см-1: 3240 (NH),
1.14 д (6Н, ОСНMe2, J = 6.0 Гц), 1.78 с (6Н, 2Me),
1660 (C=O), 1564 (С=С). Спектр ЯМР 1Н, δ, м. д.:
2.22 д (2Н, 2C6HAHB, J = 16.1 Гц), 2.68 д (2Н,
0.89 д (3Н, СНMe2, J = 6.0 Гц), 1.17 д (3Н, ОСНMe2,
2C6HAHB, J = 16.2 Гц), 3.47 м (4Н, 2СН2NH), 3.94 м
J = 6.0 Гц), 1.72 с (3Н, Me), 2.28 д (1Н, C6HAHB, J =
(2Н, 2C1H), 4.78 м (2Н, 2ОСНMe2), 6.21 с (2Н,
16.2 Гц), 2.29 с (3Н, 4-Me-С6Н4), 2.85 д (1Н,
2С4Н), 7.12-7.24 м (10Н, 2Ph), 9.09 с (2H, 2NH).
C6HAHB, J = 17.0 Гц), 4.04-4.06 м (1Н, C1H), 4.82 м
Найдено, %: С 76.26; Н 7.75; N 5.19. C36H44N2O4.
(1Н, ОСНMe2), 5.97 с (1Н, С4Н), 6.99-7.22 м (9Н,
Вычислено, %: С 76.02; Н 7.80; N 4.93.
Ph, С6Н4), 10.59 с (1H, NH). Найдено, %: С 79.69; Н
Диизопропил-3,3''-[пропан-1,2-диилбис(азанди-
7.55; N 3.52. C24H27NO2. Вычислено, %: С 79.74; Н
ил)]бис[5-метил-1,6-дигидро-(1,1'-бифенил)-2-
7.53; N 3.87.
карбоксилат] (5б). Выход 34%, т. пл. 103-104°С.
Изобутил-5-метил-3-(п-толиламино)-1,6-ди-
ИК спектр, ν, см-1: 3256 (NH), 1736 (C=O). Спектр
гидро-(1,1'-бифенил)-2-карбоксилат (4ж). Выход
ЯМР 1Н, δ, м. д.: 0.86 д (6Н, 2ОСНMe2, J = 6.0 Гц),
59%, т. пл. 87-89°С. ИК спектр, ν, см-1: 3296 (NH),
1.13 д (6Н, 2ОСНMe2, J = 6.0 Гц), 1.77 с (6Н, 2Me),
1696 (C=O), 1567 (С=С). Спектр ЯМР 1Н, δ, м. д.:
1.82 м [2Н, СН2(СН2NH)2], 2.25 д (2Н, 2C6HAHB, J =
0.69 д (3Н, ОСН2СНMe2, J = 6.0 Гц), 0.71 д (3Н,
17.1 Гц), 2.70 д (2Н, 2C6HAHB, J = 16.7 Гц), 3.40 м
ОСН2СНMe2, J
=
6.0 Гц),
1.67-1.68 м
(3Н,
[4Н, СН2(СН2NH)2], 3.95-3.96 м (2Н, 2C1H), 4.77-
ОСН2СНMe2), 1.69 с (3Н, Me), 2.26 д (1Н, C6HAHB,
4.78 м (2Н, 2ОСНMe2), 6.20 с (2Н, 2С4Н), 7.11-7.23
J = 16.1 Гц), 2.30 с (3Н, 4-Me-С6Н4), 2.87 д (1Н,
м (10Н, 2Ph), 9.07 с (2H, 2NH). Найдено, %: С
C6HAHB, J
=
16.8 Гц),
3.67-3.68 м
(1Н,
76.54; Н 7.83; N 5.14. C37H46N2O4. Вычислено, %: С
ОСН2СНMe2), 3.77-3.78 м (1Н, ОСН2СНMe2), 4.11
76.26; Н 7.96; N 4.81.
м (1Н, C1H), 5.99 с (1Н, С4Н), 6.01-7.17 м (9Н, Ph,
Диизобутил-3,3''-[этан-1,2-диилбис(азандиил)]-
С6Н4), 10.59 с (1H, NH). Масс-спектр, m/z (Iотн, %):
бис[5-метил-1,6-дигидро-(1,1'-бифенил)-2-кар-
375 (56) [M]+. Найдено, %: С 79.73; Н 7.72; N 3.89.
боксилат] (5в). К раствору 0.01 моль изобутил-4-
C25H29NO2. Вычислено, %: С 79.96; Н 7.78; N 3.73.
гидрокси-4-метил-2-оксо-6-фенилциклогексан-1-
карбоксилата
1д в
20 мл этанола добавляли
Изобутил-5-метил-3-[(4-фторфенил)амино]-
0.01 моль этилендиамина. Полученную смесь
1,6-дигидро-(1,1'-бифенил)-2-карбоксилат
(4з).
кипятили в течение 3 ч. Растворитель упаривали.
Выход 66%, т. пл. 80-82°С. ИК спектр, ν, см-1: 3240
Осадок отфильтровывали, промывали водой, затем
(NH), 1664 (C=O), 1580 (С=С). Спектр ЯМР 1Н, δ,
спиртом, сушили и перекристаллизовывали из
м. д.: 0.68 д (3Н, ОСН2СНMe2, J =6.0 Гц), 0.70 д
этанола. Выход 11%, т. пл. 171-172°С. ИК спектр,
(3Н, ОСН2СНMe2, J = 6.0 Гц), 1.67-1.68 м (3Н,
ν, см-1: 3408 (ОH), 3266 (NH), 1720 (C=O). Спектр
ОСН2СНMe2), 1.69 с (3Н, Me), 2.26 д (1Н, C6HAHB,
ЯМР 1Н, δ, м. д.: 0.47 д (6Н, ОСН2СНMe2, J =
J = 16.3 Гц), 2.88 д (1Н, C6HAHB, J = 16.6 Гц), 3.68-
7.5 Гц), 0.57 д (6Н, ОСН2СНMe2, J = 7.5 Гц), 1.16 с
3.69 м
(1Н, ОСН2СНMe2),
3.78-3.79 м
(1Н,
(6Н, 2Me), 1.32 м (6Н, 2ОСН2СНMe2), 1.65 д (2Н,
ОСН2СНMe2), 4.09 м (1Н, C1H), 5.94 с (1Н, С4Н),
2C4HAHB, J = 13.2 Гц), 1.87 д (2Н, 2C4HAHB, J =
7.16-7.21 м (9Н, Ph, С6Н4), 10.56 с (1H, NH).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
992
ГЕЙН и др.
13.2 Гц), 2.22 д (2Н, 2C6HAHB, J = 16.5 Гц), 2.45 д
J = 16.5, 1.4 Гц), 3.82 к (1Н, C4H, J = 16.1 Гц), 4.45 с (1Н,
(2Н,
2C6HAHB, J
=
16.5 Гц),
3.38 м
(4Н,
ОН), 7.13-7.23 м (5Н, Ph), 10.20 уш. с (2Н, NH, OH).
2ОСН2СНMe2), 3.41 м (4Н, 2СН2NH), 3.86 м (2Н,
Найдено, %: С 68.60; Н 6.66; N 11.73. C14H16N2O2.
2C1H), 4.78 м (2Н, 2ОСНMe2), 4.32 с (1Н, ОН), 7.02-
Вычислено, %: С 68.83; Н 6.60; N 11.47.
7.11 м (10Н, 2Ph), 9.18 с (2H, 2NH). Найдено, %: С
3,6-Диметил-4-фенил-4,5,6,7-тетрагидро-2H-
71.47; Н 8.25; N 4.17. C38H52N2O4. Вычислено, %: С
индазол-6-ол (7в) получали аналогично. Выход
71.12; Н 8.28; N 4.43.
93%, т. пл. 226-228°С. ИК спектр, ν, см-1: 3400
3,6-Диметил-4-фенил-4,5,6,7-тетрагидробензо-
(ОH), 3312 (NH), 1600 (C=N). Спектр ЯМР 1Н, δ,
[c]изоксазол-6-ол
(6).
К раствору
0.1 моль
м. д.: 1.24 с (3Н, Me), 1.48 с (3Н, Me), 1.62 д (1Н,
солянокислого гидроксиламина в 30 мл этанола
C7HAHB, J = 11.6 Гц), 1.85 д (1Н, C7HAHB, J = 12.0 Гц),
добавляли
0.1 моль гидроксида калия. Осадок
2.57 м (2Н, C5H2), 3.87 к (1Н, C4H, J = 16.0 Гц), 4.37 с
отфильтровывали. К фильтрату добавляли 0.05 моль
(1Н, ОН), 7.14-7.26 м (5Н, Ph), 11.76 с (1Н, NH).
2-ацетил-5-гидрокси-5-метил-3-фенилциклогекса-
Найдено, %: С 74.61; Н 7.56; N 11.77. C15H18N2O.
нона 1а. Полученную смесь кипятили в течение 2 ч.
Вычислено, %: С 74.35; Н 7.49; N 11.56.
Растворитель упаривали. Осадок отфильтровывали и
Общая методика синтеза соединений 8а-в.
перекристаллизовывали из этанола. Выход 41%, т.
Смесь 0.005 моль соответствующего циклокетола,
пл. 134-136°С. ИК спектр, ν, см-1: 3376 (ОH), 1640
0.005 моль гидразона бензофенона и 10 мл этанола
(C=N). Спектр ЯМР 1Н, δ, м. д.: 1.32 с (3Н, Me), 1.62
кипятили
2-3 ч. После удаления растворителя
д (1Н, C7HAHB, J = 13.2 Гц), 1.72 с (3Н, Me), 1.94 д (1Н,
осадок отфильтровывали и перекристаллизовывали
C7HAHB, J = 13.4 Гц), 2.62 т (1Н, C5HAHB, J = 16.5 Гц),
из этанола.
2.74 д. д (1Н, C5HAHB, J = 16.5, 1.6 Гц), 3.98 м (1Н, C4H),
4.67 с (1Н, ОН), 7.22-7.31 м (5Н, Ph). Найдено, %: С
Бензил-2-[(дифенилметилен)гидразоно]-4-гид-
74.34; Н 7.01; N 5.93. C15H17NO2. Вычислено, %: С
рокси-4-метил-6-фенилциклогексанкарбоксилат
74.05; Н 7.04; N 5.76.
(8а). Выход 87%, т. пл. 195-196°С. ИК спектр, ν, см-1:
3440 (ОH), 1728 (С=О), 1624 (C=N). Спектр ЯМР
6-Метил-2,4-дифенил-4,5,6,7-тетрагидро-2H-
1Н, δ, м. д.: 1.23 с (3Н, Me), 1.76 т (1Н, C5HAHB, J =
индазол-3,6-диол (7а). К раствору 0.01 моль этил-
12.5 Гц), 1.89 д (1Н, C5HAHB, J = 13.0 Гц), 2.15 д (1Н,
4-гидрокси-4-метил-2-оксо-6-фенилциклогексан-1-
C3HAHB, J = 14.2 Гц), 3.34 д (1Н, C3HAHB, J = 14.2 Гц),
карбоксилата
1в в
20 мл этанола добавляли
3.60-3.61 м (1Н, C6H), 3.75 д (1Н, C1H, J = 12.1 Гц), 4.48
0.01 моль фенилгидразина. Смесь кипятили в
с (2Н, СН2Ph), 4.78 с (1Н, ОН), 7.18-7.57 м (20Н, 4Ph).
течение 6 ч. После удаления растворителя осадок
Найдено, %: С 78.71; Н 6.29; N 5.73. C34H32N2O3.
декантировали, обрабатывали ацетоном и
Вычислено, %: С 79.04; Н 6.24; N 5.42.
перекристаллизовывали из этанола. Выход 74%, т. пл.
217-219°С. ИК спектр, ν, см-1: 3312 (ОH), 3200
Изобутил-2-[(дифенилметилен)гидразоно]-4-
(ОH), 1680 (C=N). Спектр ЯМР 1Н, δ, м. д.: 1.26 с
гидрокси-4-метил-6-фенилциклогексанкарбокси-
(3Н, Me), 1.47 д (1Н, C7HAHB, J = 12.2 Гц), 1.96 д (1Н,
лат (8б). Выход 88%, т. пл. 165-166°С. ИК спектр,
C7HAHB, J = 13.2 Гц), 2.46 т (1Н, C5HAHB, J = 14.3 Гц),
ν, см-1: 3424 (ОH), 1728 (С=О), 1624 (C=N). Спектр
2.63 д. д (1Н, C5HAHB, J = 14.3, 1.6 Гц), 3.76 к (1Н, C4H,
ЯМР 1Н, δ, м. д.: 0.50 д (3Н, ОCH2CHMe2, J =
J = 14.1 Гц), 4.67 с (1Н, ОН), 7.15-7.68 м (10Н, 2Ph),
6.0 Гц), 0.51 д (3Н, ОCH2CHMe2, J = 6.0 Гц), 1.23 с
10.68 с (OH). Найдено, %: С 74.61; Н 6.31; N 8.96.
(3Н, Me), 1.32 м (1Н, ОCH2CHMe2), 1.75 т (1Н,
C20H20N2O2. Вычислено, %: С 74.98; Н 6.29; N 8.74.
C5HAHB, J = 12.3 Гц), 1.85 д (1Н, C5HAHB, J = 13.0 Гц),
2.14 д (1Н, C3HAHB, J = 14.2 Гц), 3.16 м (2Н,
6-Метил-4-фенил-4,5,6,7-тетрагидро-2H-индазол-
ОCH2CHMe2), 3.32 д (1Н, C3HAHB, J = 14.2 Гц), 3.56-
3,6-диол
(7б). Смесь
0.005 моль
4-гидрокси-4-
3.57 м (1Н, C6H), 3.67 д (1Н, C1H, J = 12.1 Гц), 4.68 с
метил-6-фенилциклогексанона, 10 мл этанола и
(1Н, ОН), 7.16-7.56 м (15Н, 3Ph). Найдено, %: С
0.005 моль гидразингидрата кипятили в течение
77.26; Н 7.17; N 5.61. C31H34N2O3. Вычислено, %: С
30 мин. Осадок отфильтровывали и промывали
77.15; Н 7.10; N 5.80.
этанолом. Выход
61%, т. пл.
261--263°С. ИК
спектр, ν, см-1: 3360 (ОH), 3280 (NH), 1600 (C=N).
Этил-2-[(дифенилметилен)гидразоно]-4-гид-
Спектр ЯМР 1Н, δ, м. д.: 1.21 с (3Н, Me), 1.40 д (1Н,
рокси-4-метил-6-фенилциклогексанкарбоксилат
C7HAHB, J = 13.2 Гц), 1.89 д (1Н, C7HAHB, J = 13.2 Гц),
(8в). Выход 63%, т. пл. 178-179°С. ИК спектр, ν,
2.47 т (1Н, C5HAHB, J = 16.8 Гц), 2.56 д. д (1Н, C5HAHB,
см-1: 3496 (ОH), 1728 (С=О), 1624 (C=N). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ВЗАИМОДЕЙСТВИЕ 2-АЦЕТИЛ-5-ГИДРОКСИ-5-МЕТИЛ-3-ФЕНИЛЦИКЛОГЕКСАНОНА
993
ЯМР 1Н, δ, м. д.: 0.66 т (3Н, ОCH2Me2, J = 7.5 Гц),
Plotnikov O.P. // Pharm. Chem. J. 2001. Vol. 35. N 9.
1.23 с (3Н, Me), 1.32 м (1Н, ОCH2CHMe2), 1.73 т (1Н,
P. 488. doi 10.1023/A:1014090608261
C5HAHB, J = 13.0 Гц), 1.87 д (1Н, C5HAHB, J = 12.8 Гц),
7. Пучина Г.Р. Автореф. дис. … канд. хим. наук. Уфа,
2.13 д (1Н, C3HAHB, J = 14.1 Гц), 3.31 д (1Н, C3HAHB, J =
2007. 24 с.
14.1 Гц), 3.43 к (2Н, ОCH2Me2, J = 7.5 Гц), 3.55-3.56 м
8. Зорина А.А. Автореф. дис. … канд. фарм. наук.
(1Н, C6H), 3.61 д (1Н, C1H, J = 12.1 Гц), 4.67 с (1Н, ОН),
Пермь, 2006. 17 с.
7.17-7.56 м (15Н, 3Ph). Найдено, %: С 76.92; Н 6.73;
9. Sharma A., Chakravarti B., Gupt M. P., Siddiqui J.A.,
Konwar R., Tripathi R.P. // Bioorg. Med. Chem. 2010.
N 6.38. C29H30N2O3. Вычислено, %: С 76.63; Н 6.65;
Vol. 18. N 13. P. 4711. doi 10.1016/j.bmc.2010.05.015
N 6.16.
10. Said M.M., Ahmed A.A.E., El-Alfy A.T. // Arch. Pharm.
Исследования проведены с использованием
Res. 2004. Vol. 27. P. 1194. doi 10.1007/BF02975880
оборудования Ресурсного образовательного центра
11. Прусакова А.С., Гейн В.Л., Носова Н.В., Сыропя-
по направлению «Химия» Научного парка Санкт-
тов Б.Я., Ковалева М.Ю. Маркова Л.Н. Пат. 2428410
Петербургского государственного университета.
(2011). РФ. Бюл. № 25.
12. Cooling M.J., Sim M.F. // Br. J. Pharmacol.
1977.
КОНФЛИКТ ИНТЕРЕСОВ
Vol.
60. N
4.
N
569. doi
10.1111/j.1476-
5381.1977.tb07536.x
Авторы заявляют об отсутствии конфликта
13. Colovic M.B., Krstic D.Z., Lazarevic-Pasti T.D.,
интересов.
Bondzic A.M., Vasic V.M. // Curr. Neuropharmacol.
2013. Vol.
11. N
3.
P.
315. doi
10.2174/
СПИСОК ЛИТЕРАТУРЫ
1570159X11311030006
14. Seebacher W., Kaiser M., Brun R., Saf R.,
1. Rajveer Ch., Stephenrathinaraj B., Sudharshini S.,
Weis R. // Monatsh. Chem. 2007. Vol. 138. P. 709. doi
Kumaraswamy D., Shreshtha B., Choudhury P.K. // Res.
10.1007/s00706-007-0670-x
J. Pharm. Biol. Chem. Sci. 2010. Vol. 1. N 3. P. 99.
15. Weis R., Berger H., Kaiser M., Brun R., Saf R.,
2. Vyas D.H., Tala S.D., Akbari J.D., Dhaduk M.F.,
Seebacher W. // Arch. Pharm. Res. 2008. Vol. 3. N 6.
Joshi H.S. // Indian J. Chem. (B). 2009. Vol. 48. N 10.
P. 688. doi 10.1007/s12272-001-1214-5
P. 1405.
16. Niwas S., Kumar S., Bhaduri A.P. // Indian J. Chem.
3. Гейн В.Л., Зорина А.А., Носова Н.В., Воронина Э.В.,
1985. Vol. 24. N 7. P. 747.
Вахрин М.И., Кривенько А.П. // Хим.-фарм. ж. 2007.
17. Bucholtz E.C., Brown R. L., Tropsha A., Booth R.G.,
Т. 41. № 6. С. 31; Gein V.L., Zorina A.A., Nosova N.V.,
Wyrick S.D. // J. Med. Chem. 1999. Vol. 42. N 16.
Voronina E.V., Vahrin M.I., Kriven’ko A.P. // Pharm.
P. 3041. doi 10.1021/jm980428x
Chem. J. 2007. Vol. 41. N 6. P. 319. doi 10.1007/
18. Ghoneim O.M., Legere J.A., Golbraikh A., Tropsha A.,
s11094-007-0072-8
Booth R.G. // Bioorg. Med. Chem. 2006. Vol. 14. N 19.
4. Гейн В.Л., Прусакова А.С., Носова Н.В., Вахрин М.И.,
P. 6640. doi 10.1016/j.bmc.2006.05.077
Воронина Э.В., Кривенько А.П. // Хим.-фарм. ж.
19. Гейн В.Л., Вагапов А.В., Носова Н.В., Воронина Э.В.,
2010. Т. 44. № 8. С. 25; Gein V.L., Prusakova A.S.,
Вахрин М.И., Кривенко А.П. // Хим.-фарм. ж. 2010.
Nosova N.V., Vahrin M.I., Voronina E.V., Kriven’ko A.P. //
Т. 44. № 5. С. 13; Gein V.L., Vagapov A.V., Noso-
Pharm. Chem. J. 2010. Vol. 44. N 8. P. 427. doi
va N.V., Voronina E.V., Vahrin M.I., Krivenko A.P. //
10.1007/s11094-010-0483-9
Pharm. Chem. J. 2010. Vol. 44. N 5. P. 245. doi
5. Ghodse A.H., Galea S.
// Side Effects of Drugs
10.1007/s11094-010-0440-7
Annual. 2011. Vol. 33. P. 205. doi 10.1016/B978-0-444-
20. Усова Е.Б., Лысенко Л.И., Крапивин Г.Д., Завод-
53741-6.00008-8
ник В.Е., Кульневич В.Г. // ХГС. 1997. № 11. С. 1459;
6. Сорокин В.В., Кривенько А.П., Виноградова Н.А.,
Usova E.B., Lysenko L.I., Krapivin G.D., Zavodnik V.E.,
Плотников О.П. // Хим.-фарм. ж. 2001. Т. 35. № 9.
Kul’nevich V.G. // Chem. Heterocycl. Compd. 1997.
С. 24; Sorokin V.V., Kriven’ko A.P., Vinogradova N.A.,
Vol. 33. N 11. P. 1259. doi 10.1007/BF02320324
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
994
ГЕЙН и др.
Reactions of 2-Acetyl-5-hydroxy-5-methyl-
3-phenylcyclohexanone and Alkyl 4-Hydroxy-4-methyl-
2-oxo-6-phenylcyclohexanecarboxylates
with Nucleophilic Reagents
V. L. Geina, * N. V. Nosovaa, A. V. Vagapovaa, N. V. Dozmorovaa, and A. N. Yankinb
a Perm State Pharmaceutical Academy, ul. Polevaya 2, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
b St. Petersburg State University, St. Petersburg, Russia
Received February 4, 2019; revised February 4, 2019; accepted February 10, 2019
A series of novel enamines, bis(enamines), benzisoxazoles, tetrahydroindazoles, benzophenone hydrazones were
obtained via reactions of
2-acetyl-5-hydroxy-5-methylcyclohexanone and alkyl
4-hydroxy-4-methyl-2-
oxocyclohexanecarboxylates with nucleophilic reagents such as aliphatic and aromatic amines, diamines,
hydroxylamine, hydrazine, phenylhydrazine, benzophenone hydrazone. The structures of the compounds
obtained were proved by IR and 1H NMR spectroscopy methods.
Keywords: 2-acetylcyclohexanone, alkyl 2-oxocyclohexanecarboxylates, enamines, indazoles, benzisoxazoles,
hydrazones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019