ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1004-1012
УДК 547.26’118
К 70-летию со дня рождения А. В. Кучина
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ
АКТИВНОСТИ ВОДОРАСТВОРИМЫХ АММОНИЕВЫХ
АЦИЛГИДРАЗОНОВ НА ОСНОВЕ НОВЫХ
1,ω-АЛКИЛЕНДИИЗАТИНОВ
© 2019 г. А. В. Богданов*, И. Ф. Зарипова, Л. К. Мустафина, А. Д. Волошина,
А. С. Сапунова, Н. В. Кулик, В. Ф. Миронов
Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Росийской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
*e-mail: abogdanov@inbox.ru
Поступило в Редакцию 21 февраля 2019 г.
После доработки 21 февраля 2019 г.
Принято к печати 28 февраля 2019 г.
Алкилированием изатина 1,ω-дигалогеналканами синтезированы бис(гетероциклы), соединенные гибкой
олигометиленовой цепочкой. Взаимодействие полученных бис(изатинов) с реагентами Жирара Т и Р
привело к образованию с высокими выходами симметричных водорастворимых ацилгидразонов. Оценка
антимикробной активности новых соединений показала зависимость уровня активности от длины
углеводородного спейсера. Установлена селективная активность нона- и декаметиленовых производных
в отношении грамположительных бактерий S. aureus
209p и B. cereus
8035. Показана низкая
гемотоксичность полученных гетероциклов.
Ключевые слова: изатин, гидразоны, гидразиды, антимикробная активность, пиридиниевые соли
DOI: 10.1134/S0044460X19070035
Платформа оксиндола является удобным строи-
органических функциональных материалов различ-
тельным блоком в синтезе функционализирован-
ного назначения [14].
ных гетероциклических и открытоцепных структур
Несмотря на многообразие описанных к
(спирооксиндолов, индирубинов, изоиндиго, арил-
настоящему времени производных оксиндола,
глиоксиламидов и др.) [1-6]. Фрагмент индолин-2-
значительный интерес привлекают соединения,
она входит в качестве базовой субструктуры в
содержащие экзоциклическую C=X (C=C, C=O,
многочисленные синтетические и природные
C=N) связь (схема 1).
биологически активные вещества. Постоянно
растущее количество исследований по способам
Среди таковых наиболее исследованными
синтеза и модификации оксиндола обусловлено,
являются
3-алкенилоксиндолы
[15] и
2,3-
прежде всего, проявлением этими соединениями
диоксиндолы (изатины) [16-20]. Особое внимание
широкого спектра физиологической активности -
исследователей в этой области в последние годы
противовирусной, противогрибковой, антибакте-
привлекают бисизатины, производные которых
риальной,
антипролиферативной,
противо-
обладают высокой противотуберкулезной [21-24],
опухолевой, противовоспалительной, антигипертен-
противоопухолевой
[25], анти-ВИЧ
[26] и
зивной и противосудорожной [7-13]. К тому же,
антимикробной [27-29] активностью. При этом
высокая реакционная способность, особенности
легкость функционализации молекулы оксиндола
пространственного строения и электронная
по положению 3 создает хорошие предпосылки для
природа этого гетероцикла обусловливают широкое
поиска эффективных антимикробных препаратов в
применение его производных в конструировании
ряду изатин-3-ацилгидразонов [30-32].
1004
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
1005
Схема 1.
Cl
NEt2
Br
O
O
O
O
N
Cl
H
O
N NH
Cl
N
Br
N
F
H
O
O
O
BzO
N
N
H
BzO
BzO
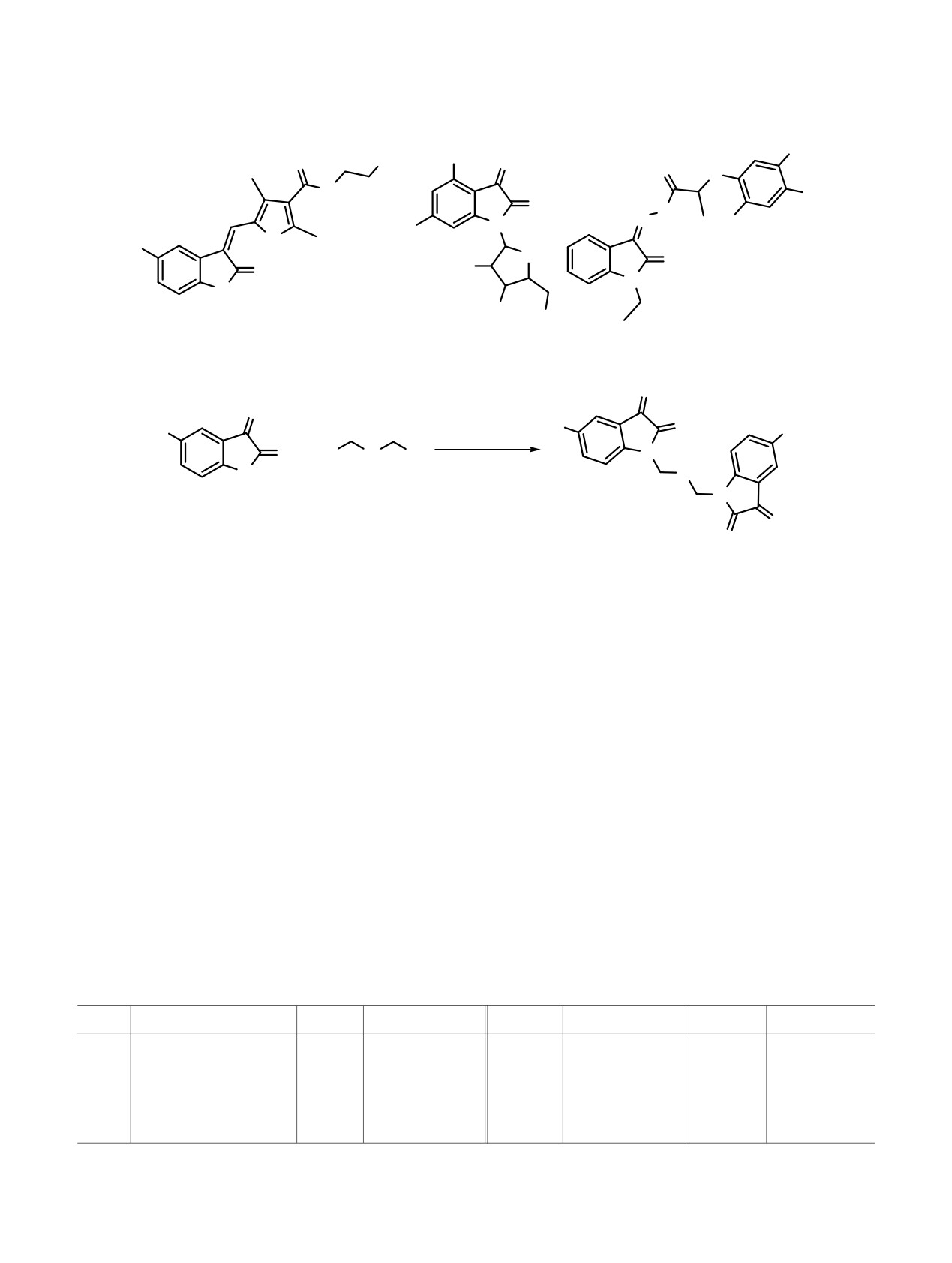
Схема 2.
O
O
R
NaH
R
O
R
O
+
X
Y
X
N
ДМФА, 20°C, 6 ч
N
Y
H
N
O
O
1-8
X = Br, I.
В продолжение работ по направленному поиску
Далее в условиях, разработанных нами для
антимикробных производных изатина, содержащих
получения
триметиламмониевых
изатин-3-
кватернизованный атом азота [33-36], в данном
ацилгидразонов [33-36], был получен ряд сим-
исследовании представлен синтез и оценена
метрично-замещенных
водорастворимых
антимикробная активность новых изатин-3-
ацилгидразонов 9-19, содержащих четвертичный
ацилгидразонов. Целевые структуры представляют
атом азота (cхема 3). При этом следует отметить,
собой бис(гетероциклы), в которых два положи-
что реагент Жирара Р впервые был введен во
тельно заряженных оксиндольных фрагмента
взаимодействие с производными изатина.
связаны между собой гибким полиалкиленовым
Синтез целевых соединений 9-19 проводили в
спейсером с длиной цепочки от трех до десяти
кипящем этаноле в присутствии 2 экв. реагента
метиленовых звеньев. На первом этапе работы
Жирара и каталитического количества трифтор-
алкилированием двукратного избытка натриевой
уксусной кислоты. В табл. 2 приведены формулы
соли изатина (5-бромизатина) дигалогеналканами с
заместителей и выходы полученных солей 9-19.
высокими выходами получены диизатины
1-8
На примере реакции гексаметилендиизатина 4 с
(cхема 2, табл. 1).
эквимольным
количеством
пиридиниевого
Следует отметить, что соединения 1-8 были
ацетогидразида нами была предпринята попытка
выделены в чистом виде сразу после выделения из
получения продукта конденсации только по одной
реакционной массы без дополнительной очистки.
кетонной группе с сохранением второго
Таблица 1. Выходы соединений 1-8
№
Y
R
Выход, %
№
Y
R
Выход, %
1
CH2
H
95
5
(CH2)6
H
93
2
(CH2)2
H
89
6
(CH2)7
H
97
3
CH2CH(Me)CH2
H
87
7
(CH2)8
H
93
4
(CH2)4
H
93
8
CH2
Br
84
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1006
БОГДАНОВ и др.
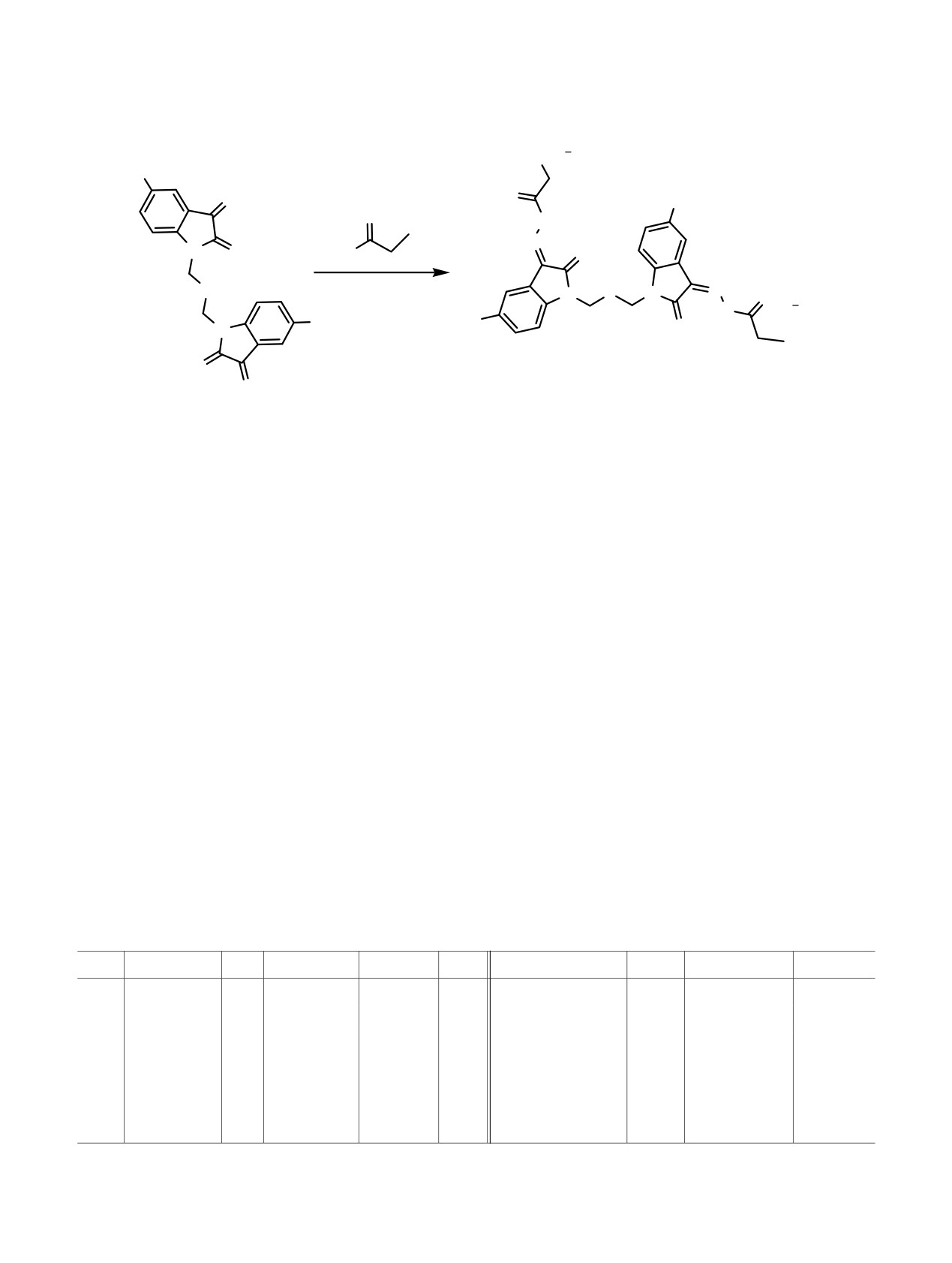
Схема 3.
+
R1N Cl
3
R
O
O
R
O
+
NH
N2R1 Cl-3
N
N O
H2NHN
O
EtOH, 78°C, 2 ч
N
Y
N
Y N
O
HN
Cl
R
R
N
O
+
1
NR
3
9-19
O
O
1-8
1 = NMe3 (реагент Жирара T), NR1 = Py (реагент Жирара P).
NR
3
3
диоксиндольного фрагмента. Однако в результате
проявляется резонанс протона NH-группы.
взаимодействия, осуществленного в выше-
Протоны метиленовой группы гидразонного фраг-
описанных условиях, было выделено соединение
мента триметиламмониевых
(9-12) и пириди-
16 и полуэквивалентное количество диизатина 4.
ниевых (13-19) производных проявляются в виде
уширенных синглетов с δ 4.8-4.9 и 6.2-6.3 м. д.
Строение новых соединений было доказано
соответственно.
Характерной
особенностью
методами ЯМР и ИК спектроскопии, состав -
спектров ЯМР 1Н аммониевых изатин-3-ацилгид-
данными масс-спектрометрии и элементного
разонов является также уширение и смещение
анализа. Так, сравнивая ИК спектры исходных
сигнала протона Н4 (δ ~7.6 м. д.), в то время как в
изатинов 1-8 и продуктов реакций 9-19 можно
исходных изатинах 1-8 его сигнал проявляется при
отметить исчезновение полос поглощения, отно-
~ 7.3 м. д. в виде дублета дублетов.
сящихся к валентным колебаниям связи
карбонильной группы при 1720 и 1740 см-1 и
Полученные соединения 9-19 были впервые
появление уширенной полосы поглощения при
исследованы на предмет их антимикробной
~1680 см-1, соответствующей валентным коле-
(бактериостатической, фунгистатической, бактери-
баниям связей С=О лактамного и гидразонного
цидной и фунгицидной) активности in vitro в
фрагментов. К тому же, в ИК спектрах ацил-
диапазоне концентраций 500-0.97 мкг/мл (табл. 3).
гидразонов 9-19 присутствуют полосы поглощения
Полученные данные указывают, что наиболее
средней интенсивности связей N-H и C=N при
активными оказались пиридиниевые производные
~3390 и 1635 см-1 соответственно. В спектрах ЯМР
17 и 18, в которых два оксиндольных фрагмента
1Н соединений 9-19, зарегистрированных в CDCl3
связаны нона- и декаметиленовыми цепочками
или его смеси с ДМСО-d6, в области 12.7 м. д.
соответственно. По бактериостатическому действию
Таблица 2. Выходы соединений 9-19
№
Y
R
NR3
Выход, %
№
Y
R
NR3
Выход, %
9
CH2
H
N(CH3)3
97
15
CH2CH(Me)CH2
H
Py
83
10
(CH2)2
H
N(CH3)3
95
16
(CH2)4
H
Py
89
11
(CH2)4
H
N(CH3)3
98
17
(CH2)7
H
Py
95
12
(CH2)6
H
N(CH3)3
92
18
(CH2)8
H
Py
97
13
CH2
H
Py
92
19
CH2
Br
Py
90
14
(CH2)2
H
Py
90
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
1007
Таблица 3. Антимикробная активность соединений 9-19
МИК, мкг/мл
№
Staphylococcus
Bacillus
Escherichia
Pseudomonas
Pseudomonas
Trichophyton
Candida
aureus
сereus
coli
aerginosa
aeruginosa
mentagrophytes
аlbicans
9
>500
>500
>500
>500
>500
>500
>500
10
>500
>500
>500
>500
>500
>500
>500
11
125±11
>500
>500
>500
>500
>500
>500
12
62.5
125
>500
>500
>500
>500
>500
13
>500
>500
>500
>500
>500
>500
>500
14
>500
>500
>500
>500
>500
>500
>500
15
>500
250
>500
>500
>500
>500
>500
16
>500
>500
>500
>500
>500
>500
>500
17
15.6±1.2
31.3±2.5
>500
>500
>500
>500
>500
18
15.6±1.3
31.3±2.7
>500
>500
>500
>500
>500
19
>500
>500
>500
>500
>500
>500
>500
Хлорамфеникол
62.5
62.5
125
-
-
-
-
Кетоконазол
-
-
-
-
-
3.9
3.9
Бактерицидная и фунгицидная активность
9
>500
>500
>500
>500
>500
>500
>500
10
>500
>500
>500
>500
>500
>500
>500
11
250±20
>500
>500
>500
>500
>500
>500
12
125±11
>500
>500
>500
>500
>500
>500
13
>500
>500
>500
>500
>500
>500
>500
14
>500
>500
>500
>500
>500
>500
>500
15
>500
250
>500
>500
>500
>500
>500
16
>500
>500
>500
>500
>500
>500
>500
17
62.5±5.7
62.5±5.8
>500
>500
>500
>500
>500
18
31.3±2.6
62.5±5.6
>500
>500
>500
>500
>500
19
>500
>500
>500
>500
>500
>500
>500
эти соединения превосходят препарат сравнения в
гемолитической активностью в концентрациях
отношении S. aureus 209p в 4 раза, в отношении B.
≤ 62.5 мкг/мл, при которых вызываемый ими гемолиз
cereus 8035 - в 2 раза. При этом наличие двух
не превышает 5% (табл. 4). Важно отметить, что
атомов брома в молекуле дигидразида
19 не
токсичное действие данных соединений в
привело к увеличению активности против тест-
отношении эритроцитов крови человека значи-
штаммов микроорганизмов по сравнению с его
тельно ниже, чем у препарата сравнения
незамещенным аналогом 13. Среди исследованных
Грамицидина С.
триметиламмониевых производных
9-12 соеди-
нение
12, содержащее наиболее длинный
Таким образом, первоначальное изучение
алкиленовый линкер, проявило активность на
антимикробных свойств полученных триметил-
уровне хлорамфеникола. Нами была проведена
аммониевых и пиридиниевых бис(ацилгидразонов)
оценка гемолитического действия пиридиниевых
изатина показало, что уровень активности
производных
13-18 в отношении эритроцитов
определяется длиной метиленовой цепочки,
крови человека в диапазоне концентраций 125-
связывающей два гетероциклических фрагмента.
3.9 мкг/мл. Полученные данные показывают, что
Низкая гемолитическая активность наряду с
исследуемые соединения не обладают высокой
селективностью действия обусловливают высокие
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1008
БОГДАНОВ и др.
Таблица 4. Гемолитическое действие исследуемых соединений 9-19
Гемолиз, %
Соединение
c, мкг/мл
125±10
62.5±5.3
31.3±2.7
15.6±1.2
7.8±0.6
3.9±0.3
13
2.4±0.2
0
0
0
0
0
14
1.6±0.1
0
0
0
0
0
15
0
0
0
0
0
0
16
0.6
0
0
0
0
0
17
15.8±1.3
4.9±0.4
0.90±0.07
0.3±0.02
0
0
18
38.1±3.1
4.1±0.3
0.8±0.06
0.50±0.04
0.3±0.02
0
Грамицидин С
100.0±9.2
99.2±7.8
98.2±8.4
24.2±2.2
1.5±0.1
0.50±0.03
перспективы дальнейшего поиска противо-
1.91 к (2H, СH2, 3JHH = 7.2), 3.59 т (4H, NCН2, 3JHH =
микробных препаратов в ряду данных произ-
7.2), 6.70 уш. д (2H, 3JHH = 7.9), 6.85 д. д. д (2H, 3JHH =
водных изатина.
7.6, 3JHH = 7.5, 4JHH = 0.6), 7.29 уш. д (2H, 3JHH =
7.5), 7.31 д. д. д (2H, 3JHH = 7.8, 3JHH = 7.6, 4JHH =
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1.3). Найдено,
%: C
68.18; H
4.19; N
8.30.
C19H14N2O4. Вычислено, %: C 68.26; H 4.22; N 8.38.
ИК спектры записаны на спектрометре Bruker
1,1'-(Бутан-1,4-диил)бис(индолин-2,3-дион) (2).
Vector-22 для суспензий веществ в пластинках
Выход 89%, красный порошок, т. пл. 220°С (т. пл.
KBr. Спектры ЯМР 1H и 13C зарегистрированы на
205°С [27]). ИК спектр, ν, см-1: 3088, 2929, 1723,
приборе Bruker Avance-400
(400 и
100.6 МГц
1604, 1468, 1361, 1342, 1311, 1163, 1147, 1092, 754.
соответственно) и Bruker Avance-600
(600 и
Спектр ЯМР 1Н (CDCl3-ДМСО-d6), δ, м. д. (J, Гц):
150.9 МГц соответственно). Значения химических
1.57-1.54 м (4H, СH2), 3.52-3.55 м (4H, NCН2), 6.72
сдвигов приведены относительно остаточных
уш. д (2H, 3JHH = 7.9), 6.86 д. д (2H, 3JHH = 7.5, 3JHH =
сигналов дейтерированного растворителя. Тем-
7.5), 7.29 д. д (2H, 3JHH = 7.4, 4JHH = 0.8), 7.34 д. д. д
пературы плавления измеряли на приборе SMP10
(2H, 3JHH = 7.9, 3JHH = 7.7, 4JHH = 1.3). Найдено, %:
Stuart. Элементный анализ проведен с исполь-
C 68.85; H 4.50; N 7.89. C20H16N2O4. Вычислено, %:
зованием анализатора CHNS-3.
C 68.96; H 4.63; N 8.04.
Общая методика синтеза производных бис(иза-
1,1'-(3-Метилпентан-1,5-диил)бис(индолин-
тинов) 1-8. К раствору 1.47 г изатина (10 ммоль ) в
2,3-дион) (3). Выход 87%, красный порошок, т. пл.
20 мл ДМФА при
10°С при перемешивании
126°С. ИК спектр, ν, см-1: 3061, 2932, 1730, 1611,
добавляли 0.42 г (1 ммоль) гидрида натрия (60%-
1471, 1361, 1301, 1191, 1095, 755. Спектр ЯМР 1Н
ная суспензия в минеральном масле). Через 30 мин
(CDCl3), δ, м. д. (J, Гц): 1.13 д (3H, CН3, 3JHH = 5.8),
к полученному темно-фиолетовому раствору
1.65-1.55 м (4H, CН2), 1.88-1.79 м (1H, СH), 3.70-
добавляли
20 ммоль соответствующего
1,ω-
3.63 м (2H, NCНb), 3.88-3.80 м (2H, NCНa), 6.98 уш.
дигалогеналкана. Смесь перемешивали в течение
д (2H, 3JHH = 8.0), 7.12 д. д. д (2H, 3JHH = 7.5, 3JHH =
6 ч. Полученный раствор выливали в смесь воды со
7.7, 4JHH = 0.5), 7.63-7.59 м (4H). Найдено, %: C
льдом. Образовавшийся осадок отфильтровывали,
70.07; H 5.25; N 7.30. C22H20N2O4. Вычислено, %: C
промывали водой и петролейным эфиром, сушили
70.20; H 5.36; N 7.44.
на воздухе до постоянной массы.
1,1'-(Гексан-1,6-диил)бис(индолин-2,3-дион) (4).
1,1'-(Пропан-1,3-диил)бис(индолин-2,3-дион) (1).
Выход 93%, красный порошок, т. пл. 190°С (т. пл.
Выход 95%, оранжевый порошок, т. пл. 240°С
190°С [27]). ИК спектр, ν, см-1: 2963, 2942, 2864,
(т. пл. 241°С [27]). ИК спектр, ν, см-1: 3094, 2942,
1739, 1611, 1468, 1358, 1289, 1163, 1096,
767.
1735, 1610, 1468, 1364, 1296, 1187, 1092,
757.
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.43-1.46 м
Спектр ЯМР 1Н (CDCl3-ДМСО-d6), δ, м. д. (J, Гц):
(4H, CН2), 1.68-1.75 м (4H, CН2), 3.72 т (4H, NCН2,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
1009
3
JHH = 7.2), 6.88 д (2H, 3JHH = 7.8), 7.11 д. д (2H, 3JHH =
Общая методика синтеза соединений 9-19. К
7.7, 3JHH = 7.4), 7.56-7.60 м (4H). Найдено, %: C
смеси соответствующего бис(изатина) 1-8 (5 ммоль)
69.93; H 5.30; N 7.39. C22H20N2O4. Вычислено, %: C
и реагента Жирара (2.5 ммоль) в 7 мл абсолютного
70.20; H 5.36; N 7.44.
этанола добавляли три капли трифторуксусной
кислоты. Реакционную смесь нагревали при
1,1'-(Октан-1,8-диил)бис(индолин-2,3-дион) (5).
кипении растворителя в течение
2 ч. После
Выход 93%, красный порошок, т. пл. 169°С (т. пл.
самопроизвольного охлаждения раствора до ком-
168°С [27]). ИК спектр, ν, см-1: 2916, 2860, 1745,
натной температуры выпавший осадок отфиль-
1722, 1610, 1470, 1356, 1187, 1140, 1095,
751.
тровывали, промывали абсолютным диэтиловым
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.33-1.38 м
эфиром и сушили в вакууме (12 мм рт. ст.).
(8H, СH2), 1.65-1.72 м (4H, СH2), 3.70 т (4H, NCН2,
3JHH = 7.3), 6.89 д (2H, 3JHH = 8.0), 7.10 д. д (2H, 3JHH =
Хлорид 2,2'-[1,1'-(пропан-1,3-диил)бис(2-оксо-
3JHH
=
7.5),
7.56-7.60 м
(4H). Масс-спектр
индолин-3-илиден-1-ил)]бис(гидразин-2-илиден-
(МАЛДИ), m/z: 427 [M + Na]+. Найдено, %: C 71.19;
1-ил)бис(N,N,N-триметил-2-оксоэтиламмония)
H 5.90; N 6.88. C24H24N2O4. Вычислено, %: C 71.27;
(9). Выход 97%, желтый порошок, т. пл. 267°С
H 5.98; N 6.93.
(разл.). ИК спектр, ν, см-1: 3401, 3017, 2927, 1700,
1677, 1614, 1490, 1471, 1418, 1373, 1349, 1277,
1,1'-(Нонан-1,9-диил)бис(индолин-2,3-дион) (6).
1232, 1167, 1103, 1007, 857. Спектр ЯМР 1Н (D2O),
Выход 97%, оранжевый порошок, т. пл. 102°С. ИК
δ, м. д.: 2.33-2.41 м (2H, СH2), 3.43 с (18H, NCН3),
спектр, ν, см-1: 3061, 2929, 2853, 1736, 1611, 1470,
3.72-3.79 м (4H, NCН2), 4.50 с [4H, С(О)CН2], 6.76-
1353, 1301, 1188, 1161, 1095, 751. Спектр ЯМР 1Н
6.80 м (2H), 6.95-7.03 м (2H), 7.20-7.35 м (4H).
(CDCl3), δ, м. д. (J, Гц): 1.35-1.31 м (10H, CН2),
Масс-спектр (МАЛДИ), m/z:
561
[M
- H]+.
1.64-1.72 м (4H, СH2), 3.70 т (4H, NCН2, 3JHH = 7.4),
Найдено, %: C 54.87; H 5.90; Cl 11.08; N 17.53.
6.89 уш. д (2H, 3JHH = 8.3), 7.10 д. д. д (2H, 3JHH =
C29H38Cl2N8O4. Вычислено, %: C 54.98; H 6.05; Cl
7.8, 3JHH = 7.7, 4JHH = 0.5), 7.57-7.59 м (4H). Спектр
11.19; N 17.69.
ЯМР 13C{1H} (CDCl3), δC, м. д.: 26.7 (CH2), 27.2
(CH2), 28.9 (CH2), 29.2 (CH2), 40.2 (CH2),
110.2
Хлорид
2,2'-[1,1'-(бутан-1,4-диил)бис(2-оксо-
(CH), 117.6, 123.6 (CH), 125.4 (CH), 138.3 (CH),
индолин-3-илиден-1-ил)]бис(гидразин-2-илиден-
151.0,
158.1 (C=O),
183.6 (C=O). Масс-спектр
1-ил)бис(N,N,N-триметил-2-оксоэтиламмония)
(МАЛДИ), m/z: 457 [M + K]+. Найдено, %: C 71.68;
(10). Выход 95%, желтый порошок, т. пл. 270°С
H 6.19; N 6.53. C25H26N2O4. Вычислено, %: C 71.75;
(разл.). ИК спектр, ν, см-1: 3413, 3014, 2923, 1701,
H 6.26; N 6.69.
1678, 1615, 1471, 1417, 1367, 1309, 1283, 1237,
1,1'-(Декан-1,10-диил)бис(индолин-2,3-дион) (7).
1153, 1109, 1005, 855. Спектр ЯМР 1Н (D2O:ДМСО-
Выход 93%, оранжевый порошок, т. пл. 119°С. ИК
d6 = 5:1), δ, м. д.: 1.92-1.96 м (4H, СH2), 3.49 с (18H,
спектр, ν, см-1: 3063, 2923, 2850, 1741, 1722, 1608,
NCН3), 3.78-3.85 м (4H, NCН2), 4.92 с [4H, С(О)
1470, 1357, 1291, 1184, 1137, 1094, 760. Спектр
CН2], 7.08-7.12 м (2H), 7.25-7.27 м (2H), 7.48-7.50
ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.37-1.26 м (12H,
м (2H), 7.65-7.69 м (2H). Масс-спектр (МАЛДИ),
CН2), 1.70-1.68 м (4H, СH2), 3.70 т (4H, NCН2, 3JHH =
m/z: 575 [M - H]+. Найдено, %: C 55.51; H 6.09; Cl
7.4), 6.89 уш. д (2H, 3JHH = 8.1), 7.10 д. д (2H, 3JHH =
10.81; N 17.19. C30H40Cl2N8O4. Вычислено, %: C
3JHH = 7.5), 7.59-7.56 м (4H). Найдено, %: C 72.07;
55.64; H 6.23; Cl 10.95; N 17.30.
H 6.43; N 6.32. C26H28N2O4. Вычислено, %: C 72.20;
Хлорид 2,2'-[1,1'-(гексан-1,6-диил)бис(2-оксо-
H 6.53; N 6.48.
индолин-3-илиден-1-ил)]бис(гидразин-2-илиден-
1,1'-(Пропан-1,3-диил)бис(5-броминдолин-2,3-
1-ил)бис(N,N,N-триметил-2-оксоэтиламмония)
дион) (8). Выход 74%, оранжевый порошок, т. пл.
(11). Выход 98%, желтый порошок, т. пл. 250°С
245°С (т. пл. 245°С [37]). ИК спектр, ν, см-1: 2926,
(разл.). ИК спектр, ν, см-1: 3401, 3010, 2930, 1705,
2855, 1740, 1607, 1471, 1439, 1341, 1290, 1177,
1676, 1614, 1470, 1416, 1377, 1283, 1237, 1139,
1128, 824, 707. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
1108, 1001, 856. Спектр ЯМР 1Н (D2O:ДМСО-d6 =
Гц): 2.14-2.21 м (2H, CН2), 3.83 т (4H, NCН2, 3JHH =
5:1), δ, м. д. (J, Гц): 1.15-1.23 м (4H, СH2), 1.45-
7.0), 6.83 д
(2H, 3JHH = 8.9), 7.70-7.71 м (4H).
1.54 м (4H, СH2), 3.24 с (18H, NCН3), 3.52-3.61 м
Найдено, %: C 46.28; H 2.31; Br 32.29; N 5.50.
(4H, NCН2), 4.73 с [4H, С(О)CН2], 6.90-6.94 м (2H),
C19H12Br2N2O4. Вычислено, %: C 46.37; H 2.46; Br
7.02-7.07 м (2H), 7.33 д. д (2H, 3JHH = 8.2, 3JHH =
32.47; N 5.69.
7.5), 7.52 уш. д (2H, 3JHH = 5.6). Спектр ЯМР 13C
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1010
БОГДАНОВ и др.
{1H} (D2O:ДМСО-d6 = 1:9), δC, м. д.: 166.6 (C=O),
ден-1-ил)бис(2-оксоэтан-2,1-диил)}дипиридиния
161.2 (C=O), 143.9, 136.1, 133.1 (СН), 124.0 (CH),
(14). Выход 90%, желтый порошок, т. пл. 272°С.
121.9 (СН), 119.2, 110.9 (СН), 62.6 (СН2),
54.4
ИК спектр, ν, см-1: 3391, 3046, 2972, 1713, 1672,
(СН3), 40.0 (NCH2), 27.2 (СН2), 26.3 (СН2). Масс-
1631, 1612, 1470, 1452, 1384, 1352, 1258, 1145,
спектр (МАЛДИ), m/z: 603 [M - H]+. Найдено, %: C
1104, 754, 700. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 =
56.75; H 6.40; Cl 10.32; N 16.43. C32H44Cl2N8O4.
1:1), δ, м. д. (J, Гц): 1.66-1.69 м (4H, СH2), 3.78-
Вычислено, %: C 56.88; H 6.56; Cl 10.49; N 16.58.
3.82 м (4H, NCН2), 6.26 с [4H, С(О)CН2], 7.05 д (2H,
3JHH = 8.8), 7.13 д. д (2H, 3JHH = 8.3, 3JHH = 8.5), 7.41
Хлорид
2,2'-[1,1'-(октан-1,8-диил)бис(2-оксо-
д. д (2H, 3JHH = 8.8, 3JHH = 8.7), 7.58 д (2H, 3JHH =
индолин-3-илиден-1-ил)]бис(гидразин-2-илиден-
7.9), 8.14 д. д (4H, 3JHH = 7.2, 3JHH = 7.1), 8.63 т (2H,
1-ил)бис(N,N,N-триметил-2-оксоэтиламмония)
3JHH = 7.1), 9.17-9.20 м (4H), 12.75 уш. с (2Н, NН).
(12). Выход 92%, желтый порошок, т. пл. 252°С
Масс-спектр (МАЛДИ), m/z:
615
[M
- Н]+.
(разл.). ИК спектр, ν, см-1: 3387, 3010, 2929, 1716,
Найдено, %: C 60.31; H 4.90; Cl 9.82; N 15.59.
1685, 1615, 1490, 1469, 1361, 1277, 1232, 1142,
C36H36Cl2N8O4. Вычислено, %: C 60.42; H 5.07; Cl
1104, 923, 860. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 =
9.91; N 15.66.
4:1), δ, м. д. (J, Гц): 1.24-1.30 м (8H, СH2), 1.57-
1.65 м (4H, СH2), 3.38 с (18H, NСH3), 3.66 т (4H,
Хлорид 1,1'-{2,2'-[1,1'-(3-метилпентан-1,5-диил)-
NCН2, 3JHH = 7.3), 4.95 с [4H, С(О)CН2], 6.92 д (2H,
бис(2-оксоиндолин-3-илиден-1-ил)]бис(гидразин-
3JHH = 7.9), 7.08 д. д (2H, 3JHH = 7.8, 3JHH = 7.6), 7.38
2-илиден-1-ил)бис(2-оксоэтан-2,1-диил)}дипири-
д. д. д (2H, 3JHH = 7.9, 3JHH = 7.8, 4JHH = 1.1,), 7.63
диния (15). Выход 83%, желтый порошок, т. пл.
уш. д
(2Н,
3JHH
=
7.0). Спектр ЯМР
13C{1H}
208°С (разл.). ИК спектр, ν, см-1: 3395, 3053, 2934,
(CDCl3:ДМСО-d6 = 2:1), δC, м. д.: 166.4 (C=O),
1684, 1636, 1614, 1491, 1468, 1378, 1259, 1200, 1158,
160.9 (C=O), 143.7, 135.7, 132.8 (СН), 123.7 (CH),
1100, 791, 698. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 =
121.5 (СН), 118.9, 110.7 (СН), 62.3 (СН2),
54.1
5:1), δ, м. д. (J, Гц): 1.06 д (3H, СH3, 3JHH = 7.0), 1.48-
(СН3), 40.0 (NCH2), 28.7 (СН2), 27.1 (СН2),
26.4
1.59 м (4H, СH2), 1.74-1.82 м (1H, СH), 3.71-3.80 м
(СН2). Масс-спектр (МАЛДИ), m/z: 631 [M - H]+.
(4H, NCН2), 6.35 с [4H, С(О)CН2], 7.03 д (2H, 3JHH =
Найдено, %: C 57.89; H 6.68; Cl 9.89; N 15.86.
8.0), 7.11 д. д (2H, 3JHH = 7.3, 3JHH = 7.2), 7.40 д. д
C34H48Cl2N8O4. Вычислено, %: C 58.03; H 6.88; Cl
(2H, 3JHH = 7.6, 3JHH = 7.5), 7.60 уш. д (2Н, 3JHH =
10.08; N 15.92.
7.3), 8.13-8.17 м (4H), 8.64 т (2H, 3JHH = 7.5), 9.30 д
(4H, 3JHH = 4.7), 12.66 уш. с (2Н, NН). Масс-спектр
Хлорид 1,1'-{2,2'-[1,1'-(пропан-1,3-диил)бис(2-
(МАЛДИ), m/z: 643 [M]+. Найдено, %: C 60.37; H
оксоиндолин-3-илиден-1-ил)]бис(гидразин-2-или-
4.91; Cl 9.79; N 15.50. C36H36Cl2N8O4. Вычислено,
ден-1-ил)бис(2-оксоэтан-2,1-диил)}дипиридиния
%: C 60.42; H 5.07; Cl 9.91; N 15.66.
(13). Выход 92%, желтый порошок, т. пл. 182°С.
ИК спектр, ν, см-1: 3395, 3053, 2934, 1684, 1636,
Хлорид 1,1'-{2,2'-[1,1'-(гексан-1,6-диил)бис(2-
1614, 1491, 1468, 1378, 1259, 1200, 1158, 1100, 791,
оксоиндолин-3-илиден-1-ил)]бис(гидразин-2-или-
698. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 = 4:1), δ,
ден-1-ил)бис(2-оксоэтан-2,1-диил)}дипиридиния
м. д. (J, Гц): 2.30-2.23 м (2H, СH2), 3.93-3.85 м (4H,
(16). Выход 89%, желтый порошок, т. пл. 232°С
NCН2), 6.24 с [4H, С(О)CН2], 7.20 д. д (2H, 3JHH =
(разл.). ИК спектр, ν, см-1: 3393, 3020, 2926, 1712,
7.5, 3JHH = 7.2), 7.27 д (2H, 3JHH = 7.7), 7.46 д. д (2H,
1679, 1634, 1616, 1488, 1469, 1375, 1249, 1143,
3JHH = 7.7, 3JHH = 7.8), 7.62 уш. д (2Н, 3JHH = 7.3),
1104, 852, 769. Спектр ЯМР 1Н (D2O:ДМСО-d6 =
8.21 д (4H, 3JHH = 7.0), 8.70 т (2H, 3JHH = 7.8), 9.10 д
1:1), δ, м. д. (J, Гц): 1.20-1.27 м (4H, СH2), 1.52-
(4H, 3JHH = 4.4), 12.68 уш. с (2Н, NН). Спектр ЯМР
1.59 м (4H, СH2), 3.59-3.65 м (4H, NCН2), 5.99 с
13C{1Н} (CDCl3:ДМСО-d6 = 1:2), δC, м. д.: 167.3
[4H, С(О)CН2], 7.03 д (2H, 3JHH = 7.3), 7.12 д. д (2H,
(C=O), 160.6 (C=O), 146.42 (CH), 146.41 (CH),
3JHH = 8.7, 3JHH = 7.1), 7.40 д. д (2H, 3JHH = 8.7, 3JHH =
142.9, 135.3, 132.0 (СН), 127.5 (СН), 123.2 (CH),
6.6), 7.63 уш. д (2Н, 3JHH = 7.5), 8.03-8.06 м (4H),
120.6 (СН), 118.5, 110.3 (СН), 60.8 (СН2),
36.9
8.57 т (2H, 3JHH = 7.5), 8.76 д (4H, 3JHH = 4.9). Масс-
(NCH2), 28.5 (СН2). Масс-спектр (МАЛДИ), m/z:
спектр (МАЛДИ), m/z: 643 [M]+. Найдено, %: C
601 [M - Н]+. Найдено, %: C 58.69; H 4.38; Cl 10.40;
60.33; H 5.00; Cl 9.81; N 15.57. C36H36Cl2N8O4.
N 16.50. C33H30Cl2N8O4. Вычислено, %: C 58.85; H
Вычислено, %: C 60.42; H 5.07; Cl 9.91; N 15.66.
4.49; Cl 10.53; N 16.64.
Хлорид
1,1'-{2,2'-[1,1'-(нонан-1,9-диил)бис(2-
Хлорид
1,1'-{2,2'-[1,1'-(бутан-1,4-диил)бис(2-
оксоиндолин-3-илиден-1-ил)]бис(гидразин-2-или-
оксоиндолин-3-илиден-1-ил)]бис(гидразин-2-или-
ден-1-ил)бис(2-оксоэтан-2,1-диил)}дипиридиния
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
1011
(17). Выход 95%, желтый порошок, т. пл. 179°С.
Авторы выражают благодарность Центру
ИК спектр, ν, см-1: 3393, 3020, 2926, 1712, 1679,
коллективного пользования Спектрально-аналити-
1634, 1616, 1488, 1469, 1375, 1249, 1143, 1104, 852,
ческого центра Федерального исследовательского
769. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 = 1:1), δ,
центра
«Казанский научный центр РАН» за
м. д. (J, Гц): 1.25-1.33 м (10H, СH2), 1.62-1.68 м
техническую поддержку проведенных исследований.
(4H, СH2), 3.72 т (4H, NCН2, 3JHH = 6.8), 6.32 с [4H,
КОНФЛИКТ ИНТЕРЕСОВ
С(О)CН2], 7.06 д (2H, 3JHH = 7.8), 7.12 д. д (2H, 3JHH =
7.5, 3JHH = 7.2), 7.43 д. д (2H, 3JHH = 7.5, 3JHH = 7.4),
Авторы заявляют об отсутствии конфликта
7.60 д (2Н, 3JHH = 7.2), 8.19 д. д (4H, 3JHH = 6.7, 3JHH =
интересов.
6.8), 8.67 т (2H, 3JHH = 7.6), 9.24 д (4H, 3JHH = 4.5),
СПИСОК ЛИТЕРАТУРЫ
12.78 уш. с (2Н, NН). Масс-спектр (МАЛДИ), m/z:
685 [M - Н]+. Найдено, %: C 61.70; H 5.42; Cl 9.21;
1. Borad M.A., Bhoi M.N., Prajapati N.P., Patel H.D. //
Synth. Commun.
2014. Vol.
44. P.
1043. doi
N 14.63. C39H42Cl2N8O4. Вычислено, %: C 61.82; H
10.1080/00397911.2013.858361
5.59; Cl 9.36; N 14.79.
2. Singh, G.S., Desta, Z.Y. // Chem. Rev. 2012. Vol. 112.
Хлорид 1,1'-{2,2'-[1,1'-(декан-1,10-диил)бис(2-
P. 6104. doi 10.1021/cr300135y
оксоиндолин-3-илиден-1-ил)]бис(гидразин-2-или-
3. Moradi R., Ziarani G.M. Lashgari N. // Arkivoc 2017.
ден-1-ил)бис(2-оксоэтан-2,1-диил)}дипиридиния
Vol. 1. P. 148. doi 10.3998/ark.5550190.p009.980
(18). Выход 97%, желтый порошок, т. пл. 162-164°С.
4. Богданов А.В., Зарипова И.Ф. // ХГС. 2018. Т. 54.
ИК спектр, ν, см-1: 3391, 3051, 2929, 1681, 1634,
C.
686; Bogdanov A.V., Zaripova I.F.
// Chem.
1614, 1489, 1468, 1370, 1263, 1158, 1139, 1103, 854,
Heterocycl. Compd. 2018. Vol. 54. P. 686. doi 10.1007/
792. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 = 1:1), δ,
s10593-018-2331-x
м. д. (J, Гц): 1.25-1.30 м (12H, СH2), 1.62-1.67 м
5. Мусин Л.И., Богданов А.В., Миронов В.Ф. // ХГС.
(4H, СH2), 3.74 т (4H, NCН2, 3JHH = 7.3,), 6.26 с [4H,
2015. Т. 51. C.421; Musin L.I., Bogdanov A.V., Miro-
nov V.F. // Chem. Heterocycl. Compd. 2015. Vol. 51.
С(О)CН2], 7.10 д (2H, 3JHH = 8.2), 7.14 д. д (2H, 3JHH =
P. 421. doi 10.1007/s10593-015-1717-2
7.6, 3JHH = 7.5), 7.45 д. д (2H, 3JHH = 7.7, 3JHH = 7.6),
6. Rudrangi Sh.R.S., Bontha V.K., Manda V.R., Bethi S. //
7.60 д (2Н, 3JHH = 7.5), 8.20 д. д (4H, 3JHH = 7.3, 3JHH =
Asian J. Res. Chem. 2011. Vol 4. P. 335.
6.9), 8.69 т (2H, 3JHH = 7.8), 9.18 д (4H, 3JHH = 5.6),
7. Saraswat P., Jeyabalan G., Hassan M.Z., Rahman M.U.,
12.79 уш. с (2Н, NН). Масс-спектр (МАЛДИ), m/z:
Nyola N.K. // Synth. Commun. 2016. Vol. 46. P. 1643.
699 [M - Н]+. Найдено, %: C 62.09; H 5.63; Cl 9.06;
doi 10.1080/00397911.2016.1211704
N 14.40. C40H44Cl2N8O4. Вычислено, %: C 62.25; H
8. Design of Hybrid Molecules for Drug Development /
5.75; Cl 9.19; N 14.52.
Ed. M. Decker. Amsterdam: Elsevier, 2017.
Хлорид 1,1'-{2,2'-[1,1'-(пропан-1,3-диил)бис(5-
9. Vine K.L., Matesic L., Locke Ju.M., Skropeta D. // Adv.
бром-2-оксоиндолин-3-илиден-1-ил)]бис(гидразин-
Anticancer Agents Med. Chem. 2013. Vol. 2. P. 254.
2-илиден-1-ил)бис(2-оксоэтан-2,1-диил)}дипири-
doi 10.2174/97816080549611130201
диния (19). Выход 90%, желтый порошок, т. пл.
10. Hou J., Jin K., Li J., Jiang Yu., Li X., Wang X., Huang Y.,
217°С (разл.). ИК спектр, ν, см-1: 3369, 3228, 3026,
Zhang Y., Xu W. // Anti-Cancer Drugs 2016. Vol. 27.
2974, 1680, 1637, 1614, 1489, 1442, 1357, 1252,
P. 496. doi 10.1097/CAD.0000000000000351
1157, 731. Спектр ЯМР 1Н (CDCl3:ДМСО-d6 = 2:1),
11. Xua Zh., Zhang Sh., Gao Ch., Fan J., Zhao F., Lv Z.-Sh.,
δ, м. д. (J, Гц): 2.16-2.25 м (2H, СH2), 3.87 т (4H,
Feng L.-Sh. // Chin. Chem. Lett. 2017. Vol. 28. P. 159.
doi 10.1016/j.cclet.2016.07.032
NCН2, 3JHH = 6.3), 6.25 с [4H, С(О)CН2], 7.30 д (2H,
3JHH = 8.7), 7.63 д (2H, 3JHH = 7.7), 7.77 с (2Н), 8.21 д
12. Chadha N., Silakari O. // Eur. J. Med. Chem. 2017.
(4H, 3JHH = 7.5), 8.71 т (2H, 3JHH = 7.8), 9.10 д (4H,
Vol. 134. P. 159. doi 10.1016/j.ejmech.2017.04.003
3JHH = 5.6), 12.56 уш. с (2Н, NН). Спектр ЯМР 13C
13. Zhang G.-F., Liu X., Zhang Sh., Pan B., Liu M.-L. //
{1Н} (CDCl3:ДМСО-d6 = 2:1), δC, м. д.: 167.3, 160.6,
Eur. J. Med. Chem. 2018. Vol. 146. P. 599. doi 10.1016/
j.ejmech.2018.01.078
146.42 (СН), 146.42 (СН), 142.9, 135.3, 132.0 (СН),
127.5 (СН), 123.2 (CH), 120.6 (СН), 118.5, 110.3
14. Bogdanov A.V., Musin L.I., Mironov V.F. // Arkivoc
2015. Vol. 6. P. 362. doi 10.3998/ark.5550190.p009.090
(СН), 60.8 (СН2), 47.5 (CH2), 36.4 (СН2), 27.9 (СН2).
Масс-спектр (МАЛДИ), m/z:
759
[M
- Н]+.
15. Millemaggi A., Taylor R.J.K. // Eur. J. Org. Chem.
Найдено, %: C 47.50; H 3.21; Br 19.02; Cl 8.41; N
2010. N 24. P. 4527. doi 10.1002/ejoc.201000643
13.29. C33H28Br2Cl2N8O4. Вычислено, %: C 47.68; H
16. Kumar S., Saha S.T., Gu L., Palma G., Perumal Sh.,
3.39; Br 19.22; Cl 8.53; N 13.48.
Singh-Pillay A., Singh P., Anand A., Kaur M., Kumar V. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1012
БОГДАНОВ и др.
ACS Omega 2018. Vol. 3. P. 12106. doi 10.1021/
28. Parthasarathy K., Praveen Ch., Saranraj K.,
acsomega.8b01513
Balachandran C., Senthil Kumar P. // Med. Chem. Res.
17. Martelli G., Giacomini D. // Eur. J. Med. Chem. 2018.
2016. Vol. 25. P. 2155. doi 10.1007/s00044-016-1645-4
Vol. 158. P. 91. doi 10.1016/j.ejmech.2018.09.009
29. Parthasarathy K., Praveen Ch., Jeyaveeran J.C.,
Prince A.A.M. // Bioorg. Med. Chem. Lett.
2016.
18. Jaiswal Sh., Tripathi R.K.P., Ayyannan S.R. // Biomed.
& Pharmacother. 2018. Vol. 107. P. 1611. doi 10.1016/
Vol. 26. P. 4310. doi 10.1016/j.bmcl.2016.07.036
j.biopha.2018.08.125
30. Sahoo S., Mahendrakumar C.B., Setty C.M. // Int. J.
Chem. Sci. 2015. Vol. 13. P. 613.
19. Eldehna W.M., Almahli H., Al-Ansary Gh.H., Ghabbour H.A.,
Aly M.H., Ismael O.E., Al-Dhfyan A., Abdel-Aziz H.A. //
31. Akhtar R., Yousaf M., Naqvi S.A.R., Irfan M., Zahoor A.F.,
J. Enzyme Inhib. Med. Chem. 2017. Vol. 32. P. 600. doi
Hussain A.I., Chath Sh.A.Sh. // Synth. Commun. 2016.
10.1080/14756366.2017.1279155
Vol. 46. P. 1849. doi 10.1080/00397911.2016.1234622
32. Zahoor A.F., Yousaf M., Siddique R., Ahmad S.,
20. Rane R.A., Karunanidhi S., Jain K., Shaikh M.,
Naqvi S.A.R., Rizvi S.M.A. // Synth. Commun. 2017.
Hampannavar G., Karpoormath R. // Curr. Top. Med.
Chem.
2016. Vol.
16. P.
1262. doi
10.2174/
Vol. 47. P. 1021. doi 10.1080/00397911.2017.1300921
1568026615666150915112334
33. Богданов А.В., Гильфанова А.Р., Зарипова И.Ф.,
Миронов В.Ф. // ЖОХ 2018. Т. 88. С. 131; Bogdanov A.V.,
21. Hu Yu.-Q., Song X.-F., Fan J. // J. Heterocycl. Chem.
Gil’fanova A.R., Zaripova I.F., Mironov V.F. // Russ. J.
2018. Vol. 55. P. 265. doi 10.1002/jhet.3042
Gen. Chem. 2018. Vol. 88. P. 124. doi 10.1134/
22. Deng J.-L., Liu X.-Ch., Cai G.-W., Zhang G., Hu L., Qiu L.,
S1070363218010206
Li Z.-Y., Xu Zh. // J. Heterocycl. Chem. 2018. Vol. 55.
34. Богданов А.В., Зарипова И.Ф., Волошина А.Д.,
P. 1509. doi 10.1002/jhet.3186
Стробыкина А.С., Кулик Н.В., Бухаров С.В.,
23. Hua X., Zhang G., Zhang D., Wu Y. // J. Heterocycl.
Миронов В.Ф. // ЖОХ. Т. 88. С. 61; Bogdanov A.V.,
Chem. 2018. Vol. 55. P. 1504. doi 10.1002/jhet.3185
Zaripova I.F., Voloshina A.D., Strobykina A.S.,
24. Xu Y., Guan J., Xu Zh., Zhao Sh. // Fitoterapia. 2018.
Kulik N.V., Bukharov S.V., Mironov V.F. // Russ. J. Gen.
Vol. 127. P. 383. doi 10.1016/j.fitote.2018.03.018
Chem.
2018. Vol.
88. P.
57. doi
10.1134/
S1070363218010097
25. Jain R., Gahlyan P., Dwivedi S., Konwar R., Kumar S.,
Bhandari M., Arora R., Kakkar R., Kumar R., Prasad A.K. //
35. Bogdanov A.V., Zaripova I.F., Voloshina A.D., Stro-
Chemistry Select 2018. Vol. 3. P. 5263. doi 10.1002/
bykina A.S., Kulik N.V., Bukharov S.V., Voronina Ju.K.,
slct.201800420
Khamatgalimov A.R., Mironov V.F. // Monatsh. Chem.
2018. Vol. 149. P. 111. doi 10.1007/s00706-017-2049-y
26. Li W., Zhao Sh.-J., Gao F., Lv Z.-Sh., Tu J.-Y., Xu Zh. //
Chemistry Select 2018. Vol. 3. P. 10250. doi 10.1002/
36. Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapu-
slct.201802185
nova A.S., Kulik N.V., Voronina Ju.K., Mironov V.F. //
Chem. Biodiversity 2018. Vol. 15. P. 1800088. doi
27. Singh A., Nisha, Bains T., Hahn H.J., Liu N., Tam Ch.,
10.1002/cbdv.201800088
Cheng L.W., Kim J., Debnath A., Land K.M., Kumar V. //
Med. Chem. Commun. 2017. Vol. 8. P. 1982. doi
37. Rahmati A., Khalesi Z. // Tetrahedron 2012. Vol. 68.
10.1039/c7md00434f
P. 8472. doi 10.1016/j.tet.2012.07.073
Synthesis and Study of Antimicrobial Activity of Water-Soluble
Ammonium Acylhydrazones Based on New 1,ω-Alkylenebis(isatins)
A. V. Bogdanov*, I. F. Zaripova, L. K. Mustafina, A. D. Voloshina,
A. S. Sapunova, N. V. Kulik, and V. F. Mironov
Arbuzov Institute of Organic and Physical Chemistry, FRC Kazan Scientific Center, Russian Academy of Science,
ul. Akademika Arbuzova 8, Kazan, Tatarstan, 420088 Russia
*e-mail: abogdanov@inbox.ru
Received February 21, 2019; revised February 21, 2019; accepted February 28, 2019
Alkylation of isatin with 1,ω-dihaloalkanes afforded bis(heterocycles) connected by an oligomethylene linker.
The reaction of the resulting bis(isatins) with Girard’s T and P reagents led to the formation of symmetrical
water-soluble acyl hydrazones with high yields. Evaluation of antimicrobial activity of new compounds showed
the dependence of the activity level on the hydrocarbon spacer length. The selective activity of nona- and
decamethylene derivatives was established with respect to gram-positive bacteria S. aureus 209p and B. cereus
8035. Low hemototoxicity of the obtained heterocycles was revealed.
Keywords: isatin, hydrazones, hydrazides, antimicrobial activity, pyridinium salts
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019