ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1026-1032
УДК 547.722.6
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
N-АРИЛ(АЛКИЛ)-2-[2-(9Н-ФЛУОРЕН-
9-ИЛИДЕН)ГИДРАЗОНО]-5,5-ДИМЕТИЛ-
4-ОКСОГЕКСАНАМИДОВ
© 2019 г. А. И. Сюткинаa,*, Н. М. Игидовa,
М. В. Дмитриевb, Р. Р. Махмудовb, c, В. В. Новиковаa
a Пермская государственная фармацевтическая академия Министерства здравоохранения
Российской Федерации, ул. Екатерининская 101, Пермь, 614990Россия
*e-mail: syutkina.alyona@yandex.ru
b Пермский государственный национальный исследовательский университет, Пермь, Россия
c Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения,
Пермь, Россия
Поступило в Редакцию 27 февраля 2019 г.
После доработки 27 февраля 2019 г.
Принято к печати 5 марта 2019 г.
Дециклизацией 3-(9Н-флуорен-9-илиден)гидразоно-5-трет-бутилфуран-2(3Н)-она под действием первичных
аминов получен ряд новых
2-[(9Н-флуорен-9-илиден)гидразоно]-5,5-диметил-4-оксогексанамидов.
Исследована антиноцицептивная и противомикробная активность синтезированных соединений.
Ключевые слова: 3-(9Н-флуорен-9-илиден)гидразоно-5-трет-бутилфуран-2(3Н)-он, N-арил(алкил)-2-
[(9Н-флуорен-9-илиден)гидразоно]-5,5-диметил-4-оксогексанамиды, антиноцицептивная активность,
противомикробная активность, противогрибковая активность
DOI: 10.1134/S0044460X19070060
Ранее было показано, что 3-имино(гидразоно)-
спектроскопии. Так, в ИК спектре соединения
2
3Н-фуран-2-оны широко используются для получе-
присутствуют полосы поглощения валентных
ния различных ациклических и гетероциклических
колебаний лактонного карбонила фуранового цикла
соединений, обладающих широким спектром
(1796 см-1), а также связей С=С и С=N (1596 см-1).
фармакологического действия [1-5]. Сведения о
В спектре ЯМР
1Н наблюдаются синглетные
химических превращениях гидразонов 2,3-фуран-
сигналы девяти протонов трет-бутильного
дионов, имеющих в положении 5 цикла алкильный
заместителя при 1.27 м. д. и винильного протона
заместитель, ограничиваются лишь двумя при-
С4Н фуранового цикла при 6.17 м. д., а также
мерами [5].
мультиплет ароматических протонов при 7.70 м. д.
Нами осуществлен синтез
3-(9Н-флуорен-9-
Дециклизация 3-(9Н-флуорен-9-илиден)гидразоно-
илиден)гидразоно-5-трет-бутилфуран-2(3Н)-она и
5-трет-бутилфуран-2(3Н)-она
2 под действием
изучена его реакционная способность по
первичных аминов приводит к образованию 2-[(9Н-
отношению к NН-нуклеофилам. Исходный 3-(9Н-
флуорен-9-илиден)гидразоно]-5,5-диметил-4-оксо-
флуорен-9-илиден)гидразоно-5-трет-бутилфуран-
гексанамидов 3а-с (схема 1), что не противоречит
2(3Н)-он 2 был получен по известной методике
литературным данным [9-11].
[6-8] внутримолекулярной циклизацией
5,5-
диметил-4-оксо-2-[2-(9Н-флуорен-9-илиден)гидра-
Полученные гидразоноамиды
3а-с представ-
зино]гекс-2-еновой кислоты 1 в среде уксусного
ляют собой желтые или оранжевые кристал-
ангидрида (схема
1).
Строение полученного
лические вещества. В ИК спектрах гидразоно-
соединения подтверждено данными ИК и ЯМР
амидов 3а-с присутствуют полосы поглощения NH-
1026
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1027
Схема 1.
O
R
t-Bu
COOH
t-Bu
N
O N
O N
H
A
N
N
A
N N
Ac2O
R-NH2
-2AcOH
O
t-Bu
O O
t-Bu
COOH
2
R
t-Bu
N
O NH
O NH
H
N
Б
N
Б
1
3а-с
R = t-Bu (3а), C6H5CH2 (3б), C6H5(CH2)2 (3в), Ph (3г), 4-MeC6H4 (3д), 4-MeOC6H4 (3е), 2-FC6H4 (3ж), 3-FC6H4 (3з), 4-
FC6H4 (3и), 2-ClC6H4 (3к), 4-ClC6H4 (3л), 2-BrC6H4 (3м), 4-BrC6H4 (3н), 2-IC6H4 (3о), 4-IC6H4 (3п), 2,4-(Br)2C6H3 (3р), 2-
OH-3-iPr-6-MeC6H3 (3с).
группы амидного фрагмента в области
3297-
полученных данных видно, что обезболивающий
3397 см-1, карбонильной группы в области 1666-
эффект всех изученных соединений превышает
1770 см-1, а также полоса поглощения в области
эффект препарата сравнения - метамизола натрия.
1573-1687 см-1, характерная для валентных
Наиболее активные соединения - 3г, 3л, 3н и 3р -
колебаний связей C=C и C=N. В спектрах ЯМР 1Н
соединений
3в-р наблюдается картина, харак-
терная для резонанса протонов исключительно
гидразонной формы А, которая характеризуется
наличием синглета двух протонов метиленовой
группы при 3.98-4.20 м. д. и синглета протона NH-
группы при 8.56-9.90 м. д. В спектре ЯМР 1Н
соединений 3а, б, с, помимо сигналов протонов
метиленовой группы формы А при 3.90-4.19 м. д.,
появляется сигнал метинового протона в области
5.60-6.66 м. д. енгидразинной формы Б.
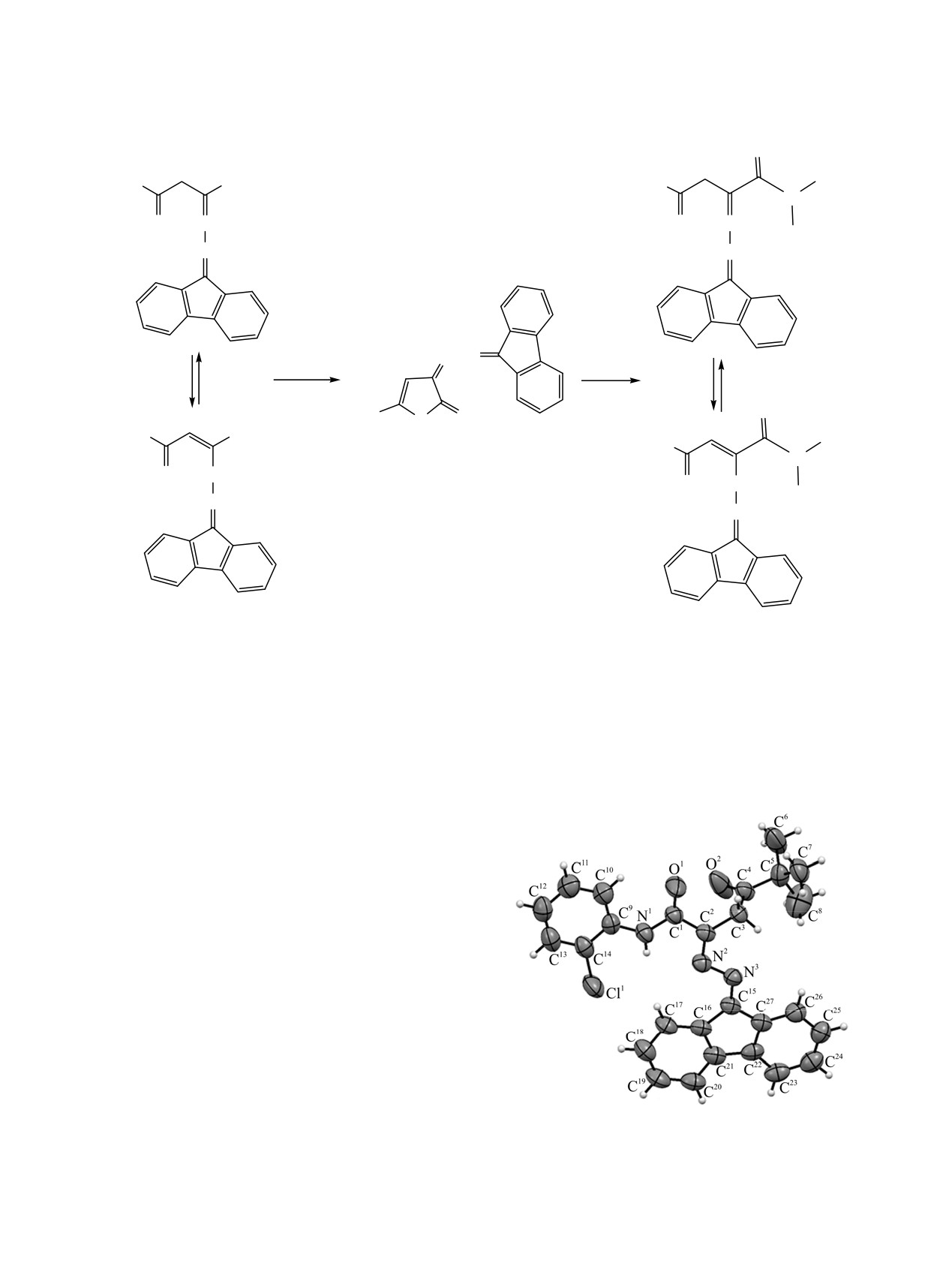
Структура соединения 3к также подтверждена
данными рентгеноструктурного анализа (см.
рисунок).
Некоторые из полученных соединений исследо-
вали на антиноцицептивную, противомикробную и
противогрибковую активность (cм. таблицу). Из
Общий вид молекулы соединения 3к в кристалле
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1028
СЮТКИНА и др.
Антиноцицептивная активность соединений 3а, 3в-д, 3ж-са
Время оборонительного
Время оборонительного
Соединение
c, мг/кг
рефлекса на пике
Соединение
c, мг/кг
рефлекса на пике
действия, с
действия, с
3а
50
24.00±2.28
3м
50
21.80±0.66
3в
50
19.80±2.13
3н
50
30.80±1.93
3г
50
27.80±2.24
3о
50
23.20±1.83
3д
50
20.80±0.37
3п
50
23.20±1.36
3ж
50
22.60±2.04
3р
50
27.00±1.26
3з
50
21.40±1.21
3с
50
24.40±0.93
3и
50
25.20±1.59
Метамизол натрия
93 (ЕД50)
16.33±3.02
3к
50
20.40±1.33
Диклофенак натрия
10
26.20±0.96
3л
50
26.40±3.76
Контроль
-
10.30±0.60
a Достоверность различий по сравнению с контролем p < 0.05.
сопоставимы или превышают эффект референ-
туры плавления (разложения) определяли на
тного диклофенака натрия. Выявлено, что введение
приборе ПТП-2. Данные элементного анализа
фенильного заместителя в амидный фрагмент
соответствуют расчетным.
увеличивает активность основной структуры (3г),
Рентгеноструктурный анализ соединения 3к
при этом наличие электроноакцептора в пара-
выполнен на дифрактометре Xcalibur Ruby с ССD-
положении фениламида наиболее перспективно
детектором по стандартной методике (ω-скани-
(3и, 3л, 3н). Приведенные данные указывают на
рование, шаг сканирования - 1°) при 295(2) K с
целесообразность дальнейшего исследования
использованием излучения MoKα (λ = 0.71073 Å) и
биологической активности енгидразинопроизводных
графитового монохроматора. Поглощение учтено
пивалоилпировиноградной кислоты и их амидов с
эмпирически с использованием алгоритма SCALE3
целью поиска веществ, обладающих анальгетической
ABSPACK [12]. Сингония кристалла (C27H24ClN3O2,
активностью.
M = 457.94) моноклинная, пространственная группа
P21, a = 5.647(2) Å, b = 18.607(6) Å, c = 11.099(4) Å,
Все исследуемые соединения обладают низкой
β = 93.57(3)°, V = 1164.1(7) Å3, Z = 2, dвыч = 1.306 г/см3,
бактериостатической активностью и противо-
μ = 0.194 мм-1.Структура расшифрована с помощью
грибковой активностью или неактивны вовсе, в
программы SHELXS
[13] и уточнена полно-
связи с чем дальнейшее изучение противо-
матричным МНК по F2 в анизотропном приб-
микробной активности в ряду 2-[(9Н-флуорен-9-
лижении для всех неводородных атомов с
илиден)гидразоно]-5,5-диметил-4-оксогексанамидов
использованием программы SHELXL
[14] с
является нецелесообразным.
графическим интерфейсом OLEX2
[15]. Атомы
водорода помещены в геометрически рассчи-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
танные положения и включены в уточнение в
модели наездника. Окончательные параметры
Контроль за ходом реакций и чистотой синте-
уточнения: R1 = 0.0565, wR2 = 0.1314 [для 2602
зированных соединений осуществляли методом
отражений с I > 2σ(I)], R1 = 0.0867, wR2 = 0.1606
ТСХ на пластинках Silufol в системе диэтиловый
(для всех 3981 независимого отражения), S = 1.031.
эфир-бензол-ацетон,
10:9:1, проявление парами
Результаты РСА зарегистрированы в Кембрид-
иода. ИК спектры записывали в вазелиновом масле
жском центре кристаллографических данных
на Фурье-спектрометре ФСМ-1202. Спектры ЯМР
(CCDC 1896729).
1Н и ЯМР 13С снимали на приборе Bruker Avance
III HD в CDCl3 и ДМСО-d6 при рабочих частотах
Исходная 5,5-диметил-4-оксо-2-[2-(9Н-флуорен-
400
(1H) и 100 МГц (13С). Элементный анализ
9-илиден)-гидразино]гекс-2-еновая
кислота
1
проводили на приборе Leco CHNS-932. Темпера-
получена по известной методике [16].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1029
3-[(9Н-Флуорен-9-илиден)гидразоно]-5-трет-
(CDCl3), δ, м. д.: 1.04 с (9Н, t-Bu), 2.92 т (2Н,
бутилфуран-2(3Н)-он (2). Смесь
5,5-диметил-4-
NHСН2СН2), 3.55 к (2Н, NHСН2СН2), 3.98 с (2Н,
оксо-2-[2-(9Н-флуорен-9-илиден)гидразино]гекс-2-
СН2), 7.53 м (13НAr), 8.56 т (1Н, CONH). Найдено,
еновой кислоты 1 (3.48 г, 0.01 моль) и уксусного
%: C 77.15; H 6.49; N 9.34. C29H29N3O2. Вычислено,
ангидрида
(5 мл) нагревали до кипения с
%: C 77.14; H 6.47; N 9.31. M 451.57.
последующим охлаждением до
0°С. Осадок
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
отфильтровывали, промывали
на фильтре
метил-4-оксо-N-фенилгексанамид
(3г). Выход
абсолютным эфиром и перекристаллизовывали из
0.35 г (83%), оранжевые кристаллы, т. пл. 141-143°С
абсолютного толуола. Выход 2.64 г (84%), красные
(пропан-2-ол). ИК спектр, ν, см-1: 3358 (NH), 1674
кристаллы, т. пл. 110-112°С (толуол). ИК спектр, ν,
(С=О), 1628, 1598 (С=С, С=N). Спектр ЯМР 1Н
см-1: 1796 (С=О), 1596 (С=С, С=N). Спектр ЯМР 1Н
(CDCl3), δ, м. д.: 1.15 с (9Н, t-Bu), 4.10 с (2Н, СН2),
(CDCl3), δ, м. д.: 1.27 с (9Н, t-Bu), 6.17 с (1Н, СН),
7.51 м (13НAr), 9.19 с (1Н, CONH). Найдено, %: C
7.7 м (8НAr). Найдено, %: C 76.34; H 5.52; N 8.50.
76.60; H 5.98; N 9.90. C27H25N3O2. Вычислено, %: C
C21H18N2O2. Вычислено, %: C 76.36; H 5.49; N 8.48.
76.57; H 5.95; N 9.92. M 423.52.
M 330.39.
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
Общая методика синтеза 2-[(9Н-флуорен-9-
метил-4-оксо-N-(4-метилфенил)гексанамид (3д).
илиден)гидразоно]-5,5-диметил-4-оксогексанамидов
Выход 0.33 г (76%), оранжевые кристаллы, т. пл.
3а-с. К смеси 3-(9Н-флуорен-9-илиден)гидразоно-
142-144°С (пропан-2-ол). ИК спектр, ν, см-1: 3358
5-трет-бутилфуран-2(3Н)-она 2 (0.33 г, 0.001 моль)
(NH), 1705 (С=О), 1669, 1623 (С=С, С=N). Спектр
и соответствующего амина (0.001 моль) добавляли
ЯМР 1Н (CDCl3), δ, м. д.: 1.19 с (9Н, t-Bu), 2.38 с
30 мл абсолютного толуола. Реакционную смесь
(3Н, Me), 4.15 с (2Н, СН2), 7.54 м (12НAr), 9.11 с
кипятили в течение 10-20 мин, затем охлаждали.
(1Н, CONH). Найдено, %: C 76.88; H 6.25; N 9.58.
После удаления растворителя осадок перекристал-
C28H27N3O2. Вычислено, %: C 76.86; H 6.22; N 9.60.
лизовывали.
M 437.54.
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
метил-4-оксо-N-трет-бутилгексанамид (3а). Выход
метил-4-оксо-N-(4-метоксифенил)гексанамид
0.27 г (66%), бледно-желтые кристаллы, т. пл. 139-
(3е). Выход 0.40 г (89%), оранжевые кристаллы,
141°С (этанол). ИК спектр, ν, см-1: 3373(NH), 1670
т. пл. 158-160°С (этанол). ИК спектр, ν, см-1: 3356
(С=О), 1615, 1575 (С=С, С=N). Спектр ЯМР 1Н
(NH), 1702 (С=О), 1669, 1620 (С=С, С=N). Спектр
(CDCl3), δ, м. д.: 1.16 с (9Н, t-Bu), 1.29 с (9Н, t-Bu),
ЯМР 1Н (CDCl3), δ, м. д.: 1.18 с (9Н, t-Bu), 3.85 с
1.55 с (9Н, t-BuNH), 1.57 с (9Н, t-BuNH), 4.02 с (2Н,
(3Н, MeO), 4.14 с (2Н, СН2), 7.48 м (12НAr), 9.11 с
СН2), 6.50 с (1Н, СН), 7.50 м (8НAr), 8.30 с (1Н,
(1Н, CONH). Найдено, %: C 74.20; H 6.01; N 9.30.
CONH), 13.77 с (1Н, NH). Найдено, %: C 74.45; H
C28H27N3O3. Вычислено, %: C 74.15; H 6.00; N 9.27.
7.20; N 10.43. C25H29N3O2. Вычислено, %: C 74.41;
M 453.54
H 7.24; N 10.41. M 403.53.
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
метил-4-оксо-N-бензилгексанамид
(3б). Выход
метил-4-оксо-N-(2-фторфенил)гексанамид
(3ж).
Выход 0.37 г (84%), оранжевые кристаллы, т. пл.
0.30 г (68%), оранжевые кристаллы, т. пл. 137-139°С
(этанол). ИК спектр, ν, см-1: 3397 (NH), 1666 (С=О),
146-148°С (этанол). ИК спектр, ν, см-1: 3377 (NH),
1689 (CO), 1619, 1605 (С=С, С=N). Спектр ЯМР 1Н
1616, 1589 (С=С, С=N). Спектр ЯМР 1Н (ДМСО-
(CDCl3), δ, м. д.: 1.22 с (9Н, t-Bu), 4.20 с (2Н, СН2),
d6), δ, м. д.: 1.06 с (9Н, t-Bu), 1.21 с (9Н, t-Bu), 2.87
д (2Н, NHСН2), 3.90 с (2Н, СН2), 5.60 с (1Н, СН),
7.55 м (12НAr), 9.55 с (1Н, NH). Спектр ЯМР 13С, δC,
м. д.: 25.97, 44.29, 114.27, 114.46, 119.46, 119.69,
7.46 м (13НAr), 8.40 с (1Н, CONH). Найдено, %: C
120.84, 122.40, 122.49, 124.04, 125.62, 127.64, 127.92,
76.90; H 6.25; N 9.61. C28H27N3O2. Вычислено, %: C
76.86; H 6.22; N 9.60. M 437.54.
129.42, 131.09, 131.62, 135.61, 141.07, 142.25, 151.11,
153.91, 156.95, 160.30, 208.69. Найдено, %: C 73.49;
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
H 5.51; N 9.55. C27H24FN3O2. Вычислено, %: C 73.45;
метил-4-оксо-N-фенетилгексанамид (3в). Выход
H 5.48; N 9.52. M 441.51.
0.20 г (45%), оранжевые кристаллы, т. пл. 131-133°С
(этанол). ИК спектр, ν, см-1: 3384 (NH),
1710
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
(С=О), 1654, 1608 (С=С, С=N). Спектр ЯМР 1Н
метил-4-оксо-N-(3-фторфенил)гексанамид
(3з).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1030
СЮТКИНА и др.
Выход 0.35 г (79%), оранжевые кристаллы, т. пл.
Найдено, %: C 64.57; H 4.81; N 8.39. C27H24BrN3O2.
122-123°С (этанол). ИК спектр, ν, см-1: 3315 (NH),
Вычислено, %: C 64.55; H 4.82; N 8.36. M 502.41.
1683 (CO),
1599 (С=С, С=N). Спектр ЯМР 1Н
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
(CDCl3), δ, м. д.: 1.20 с (9Н, t-Bu), 4.13 с (2Н, СН2),
метил-4-оксо-N-(4-бромфенил)гексанамид
(3н).
7.55 м (12НAr), 9.26 с (1Н, NH). Спектр ЯМР 13С, δC,
Выход 0.42 г (83%), оранжевые кристаллы, т. пл.
м. д.: 25.93, 34.59, 44.27, 110.56, 110.77, 114.48,
134-136°С (этанол). ИК спектр, ν, см-1: 3317 (NH),
119.49, 119.80, 122.43, 127.72, 127.82, 128.99, 129.58,
1669 (С=О), 1623, 1588 (С=С, С=N). Спектр ЯМР
129.67, 130.52, 131.06, 131.65, 135.49, 138.35, 140.89,
1Н (CDCl3), δ, м. д.: 1.15 с (9Н, t-Bu), 4.09 с (2Н,
142.25, 155.72, 160.24, 208.64. Найдено, %: C 73.47;
СН2), 7.55 м (12НAr), 9.19 с (1Н, CONH). Найдено,
H 5.49; N 9.50. C27H24FN3O2. Вычислено, %: C 73.45;
%: C
64.53; H
4.81; N
8.32. C27H24BrN3O2.
H 5.48; N 9.52. M 441.51.
Вычислено, %: C 64.55; H 4.82; N 8.36. M 502.41
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
метил-4-оксо-N-(4-фторфенил)гексанамид
(3и).
метил-4-оксо-N-(2-иодфенил)гексанамид
(3о).
Выход 0.40 г (90%), оранжевые кристаллы, т. пл.
Выход 0.48 г (87%), оранжевые кристаллы, т. пл.
150-152°С (толуол-гексан). ИК спектр, ν, см-1:
140-142°С (этанол). ИК спектр, ν, см-1: 3337 (NH),
3324 (NH), 1701 (CO), 1670, 1609 (С=С, С=N).
1704, 1674 (С=О), 1608, 1573 (С=С, С=N). Спектр
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.19 с (9Н, t-Bu),
ЯМР 1Н (CDCl3), δ, м. д.: 1.19 с (9Н, t-Bu), 4.16 с
4.13 с (2Н, СН2), 7.53 м (12НAr), 9.18 с (1Н, NH).
(2Н, СН2), 7.69 м (12НAr), 9.70 с (1Н, CONH).
Спектр ЯМР 13С, δC, м. д.: 25.93, 34.65, 44.26,
Найдено, %: C 59.02; H 4.40; N 7.64. C27H24IN3O2.
115.10,
115.32,
119.49,
119.78,
120.87,
120.95,
Вычислено, %: C 59.03; H 4.40; N 7.65. M 549.41.
122.40,
122.48,
127.11,
127.78,
129.00,
131.02,
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
131.60,
133.00,
135.51,
140.88,
142.24,
152.99,
метил-4-оксо-N-(4-иодфенил)гексанамид
(3п).
155.65, 157.75, 160.18, 208.69. Найдено, %: C 73.48;
Выход 0.44 г (80%), оранжевые кристаллы, т. пл.
H 5.50; N 9.54. C27H24FN3O2. Вычислено, %: C
184.5-185.5°С (этанол). ИК спектр, ν, см-1: 3297
73.45; H 5.48; N 9.52. M 441.51.
(NH), 1709, 1684 (С=О), 1598 (С=С, С=N). Спектр
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
ЯМР 1Н (CDCl3), δ, м. д.: 1.16 с (9Н, t-Bu), 4.15 с
метил-4-оксо-N-(2-хлорфенил)гексанамид
(3к).
(2Н, СН2), 7.77 м (12НAr), 9.70 с (1Н, CONH).
Выход 0.41 г (90%), оранжевые кристаллы, т. пл.
Найдено, %: C 59.01; H 4.39; N 7.65. C27H24IN3O2.
138-139°С (этанол). ИК спектр, ν, см-1: 3355 (NH),
Вычислено, %: C 59.03; H 4.40; N 7.65. M 549.41.
1683 (С=О), 1596 (С=С, С=N). Спектр ЯМР 1Н
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
(CDCl3), δ, м. д.: 1.18 с (9Н, t-Bu), 4.18 с (2Н, СН2),
метил-4-оксо-N-(2,4-дибромфенил)гексанамид (3р).
7.82 м (12НAr), 9.90 с (1Н, CONH). Найдено, %: C
Выход 0.50 г (86%), оранжевые кристаллы, т. пл.
70.82; H 5.31; N 9.20. C27H24ClN3O2. Вычислено, %:
158-160°С (толуол-гексан). ИК спектр, ν, см-1:
C 70.81; H 5.28; N 9.18. M 457.96.
3328 (NH), 1711 (CO), 1687, 1605 (С=С, С=N).
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.19 с (9Н, t-Bu),
метил-4-оксо-N-(4-хлорфенил)гексанамид
(3л).
4.20 с (2H, СН2), 7.67 м (11НAr), 9.87 с (1Н, NH).
Выход 0.39 г (85%), оранжевые кристаллы, т. пл.
Спектр ЯМР 13С, δC, м. д.: 25.95, 34.60, 44.31,
137-138°С (этанол). ИК спектр, ν, см-1: 3352 (NH),
113.63,
116.22,
119.50,
119.71,
121.65,
122.48,
1669 (С=О), 1628, 1593 (С=С, С=N). Спектр ЯМР
127.68,
130.86,
131.14,
131.71,
134.09,
135.58,
1Н (CDCl3), δ, м. д.: 1.15 с (9Н, t-Bu), 4.09 с (2Н,
141.04,
142.26,
153.68,
156.76,
160.35,
208.67.
СН2), 7.56 м (12НAr), 9.20 с (1Н, CONH). Найдено,
Найдено, %: C 55.80; H 3.97; N 7.25. C27H23Br2N3O2.
%: C 70.84; H 5.29; N 9.22. C27H24ClN3O2. Вычис-
Вычислено, %: C 55.79; H 3.99; N 7.23. M 581.31.
лено, %: C 70.81; H 5.28; N 9.18. M 457.96.
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
2-[(9Н-Флуорен-9-илиден)гидразоно]-5,5-ди-
метил-4-оксо-N-(2-гидрокси-3-изопропил-6-метил-
метил-4-оксо-N-(2-бромфенил)гексанамид
(3м).
фенил)гексанамид
(3с). Выход
0.25 г
(50%),
Выход 0.26 г (51%), оранжевые кристаллы, т. пл.
оранжевые кристаллы, т. пл. 206-208°С (этанол).
137.5-139.5°С (этанол). ИК спектр, ν, см-1: 3352
ИК спектр, ν, см-1: 3368 (NH), 1698 (CO), 1673,
(NH), 1719, 1674 (С=О), 1603, 1573 (С=С, С=N).
1625 (С=С, С=N). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.17 с (9Н, t-Bu),
1.19 с (9Н, t-Bu), 1.34 с (9Н, t-Bu), 1.32 д [6Н,
4.18 с (2Н, СН2), 7.78 м (12НAr), 9.89 с (1Н, CONH).
(CH3)2CH], 2.31 c (3Н, CH3), 3.21 м [1Н, (CH3)2CH],
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1031
4.19 с (2Н, СН2), 6.66 с (1Н, СН), 7.58 м (14НAr,
1000 мкг/мл, оценивали как обладающие низкой
ОН), 9.01 с (1Н, CONH), 13.80 с (1Н, NH). Найдено,
бактериостатической
активностью,
15.6-
%: C 75.13; H 6.70; N 8.50. C31H33N3O3. Вычислено,
62.5 мкг/мл - средней, 7.8 мкг/мл и менее -
%: C 75.13; H 6.71; N 8.48. M 495.62.
высокой бактериостатической активностью. Анти-
бактериальный эффект соединений сравнивали с
Исследование антиноцицептивной активности
действием диоксидина
(1%-ный раствор, ОАО
проводили в научно-исследовательской лабора-
«Новосибхимфарм»). Фунгистатический эффект
тории биологически активных веществ Пермского
исследуемых соединений сравнивали с действием
государственного национального исследовательского
флуконазола [20].
университета. Антиноцицептивная активность
была определена на беспородных белых мышах
КОНФЛИКТ ИНТЕРЕСОВ
обоего пола массой
18-22 г по методике
термического раздражения «горячая пластинка» [17].
Авторы заявляют об отсутствии конфликта
Исследуемые соединения вводили внутри-
интересов.
брюшинно в виде взвеси в 2%-ном крахмальном
растворе в дозе 50 мг/кг за 30 мин до помещения
СПИСОК ЛИТЕРАТУРЫ
животных на нагретую до 53.5°С металлическую
пластинку [18]. Исследования проводили через 30,
1. Шипиловских С.А., Рубцов А.Е., Махмудов Р.Р.,
60, 90 и 120 мин после введения соединения. В
Залесов В.В. Пат. 2389724 (2008). РФ // Б.И. 2010.
качестве препаратов сравнения использовали
№ 14.
метамизол натрия (ООО «Фармхимкомплект») в
2. Шипиловских С.А., Махмудов Р.Р., Лупач Д.Ю.,
дозе 93 мг/кг (ЕД50), ибупрофен (ГК «ЭнСиФарм»)
Павлов П.Т., Бабушкина Е.В., Рубцов А.Е. // Хим.-
в дозе 50 мг/кг, диклофенак натрия (AlfaAesar®) в
фарм. ж. 2013. Т. 47. № 7. С. 26; Shipilovskikh S.A.,
дозе 10 мг/кг. Статистическую обработку экспери-
Lupach D.Y., Pavlov P.T., Babushkina E.V., Rubtsov A.E.,
ментального материала проводили с исполь-
Makhmudov R.R. // Pharm. Chem. J. 2013. Vol. 47. N 7.
P. 366. doi 10.1007/s11094-013-0960-z
зованием критериев достоверности Стьюдента.
Эффект считали достоверным при р < 0.05 [19].
3. Быков Р.А., Трапезникова Н.Н., Баландина С.Ю.,
Комарова О.А., Махмудов Р.Р., Пулина Н.А., Со-
Для определения противомикробной активности
бин Ф.В., Рубцов А.Е. // Хим.-фарм. ж. 2018. Т. 52.
использовали метод двукратных серийных
№ 5. С. 33; Bykov R.A., Balandina S.Y., Komarova O.A.,
разведений в жидкой питательной среде по
Makhmudov R.R., Sobin F.V., Rubtsov A.E.,
отношению к штаммам S. aureus АТСС 6538-Р, E.
Trapeznikova N.N., Pulina N.A. // Pharm. Chem. J.
сoli АТСС 25922 и С. albicans ATCC 885-653 [18].
2018. V. 52. N 5. P. 415. doi 10.1007/s11094-018-1833-2
Для приготовления основного раствора исследу-
4. Пулина Н.А., Кожухарь В.Ю., Кузнецов А.С., Руб-
емое соединение в количестве 0.05 г растворяли в
цов А.Е., Старкова А.В. // Изв. АН. Сер. хим. 2017.
5 мл диметилсульфоксида, получая концентрацию
№ 8. С. 1497; Pulina N.A., Kozhukhar V.Y., Kuzne-
tsov A.S., Starkova A.V., Rubtsov A.E. // Russ. Chem.
раствора
104 мкг/мл. Далее готовили рабочий
Bull. 2017. Vol. 66. N 8. P. 1497. doi 10.1007/s11172-
раствор
вещества: в стерильную пробирку
017-1914-5
помещали 4 мл питательной среды, добавляли 1 мл
5. Игидов Н.М., Махмудов Р.Р., Федоровцева А.Н. Пат.
основного раствора исследуемого соединения,
234072 (2007). РФ // Б. И. 2009. №3.
получая концентрацию 2 000 мкг/мл. После чего
6. Комарова О.А., Игидов Н.М., Рубцов А.Е., Зале-
готовили ряд серийных разведений соединений с
сов В.В., Макаров А.С., Токсарова Ю.С. // ЖОрХ.
двукратно уменьшающейся концентрацией (от
2010. Т. 46. Вып. 2. С. 242; Komarova O.A, Rubtsov A.E.,
1000 до 0.06 мкг/мл). В качестве отрицательного
Zalesov V.V., Igidov N.M., Makarov A.S., Toksarova Y.S. //
контроля использовали интактную питательную
Russ. J. Org. Chem. 2010. Vol. 46. N 2. P. 236. doi
среду, в качестве положительного контроля - среду
10.1134/S1070428010020156
с внесенной культурой без исследуемого
7. Тюнева А.В., Игидов Н.М., Корягина Н.Н., Боро-
соединения. Учет результатов проводили через 18-
дин А.Ю., Захматов А.В., Макаров А.С., Токсаро-
24 ч термостатирования при
35-37°С. Мини-
ва Ю.С., Рубцов А.Е. // ЖОрХ. 2011. Т. 47. Вып. 2.
мальную подавляющую концентрацию (МПК)
С. 266; Tyuneva A.V., Koryagina N.N., Rubtsov A.E.,
устанавливали по отсутствию визуальных
Igidov N.M., Borodin A.Y., Zakhmatov A.V., Makarov A.S.,
признаков роста микробов на питательной среде.
Toksarova Y.C. // Russ. J. Org. Chem. 2011. Vol. 47.
Вещества, имеющие МПК в диапазоне
125-
N 2. P. 258. doi 10.1134/S1070428011020163
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1032
СЮТКИНА и др.
8. Пулина Н.А., Кузнецов А.С., Рубцов А.Е. // ЖОрХ.
P. 3. doi 10.1107/S2053229614024218
2015. Т. 51. Вып. 7. С. 986; Pulina N.A., Kuzne-
15. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
tsov A.S., Rubtsov A.E. // Russ. J. Org. Chem. 2015.
ward J.A.K., Puschmann H.J. // Appl. Cryst.
2009.
Vol. 51. N 7. P. 967. doi 10.1134/S1070428015070131
Vol. 42. P. 339. doi 10.1107/S0021889808042726
9. Шипиловских С.А., Рубцов А.Е. // ЖОрХ. 2014. Т. 50.
16. Комарова О.А., Игидов Н.М., Корягина Н.Н.,
Вып. 2. С. 305; Shipilovskikh S.A., Rubtsov A.E. //
Макаров А.С., Токсарова Ю.С., Рубцов А.Е.
//
Russ. J. Org. Chem. 2014. Vol. 50. N 2. P. 298. doi
ЖОрХ. 2011. Т. 47. Вып. 1. С. 110; Komarova O.A.,
10.1134/S1070428014020286
Koryagina N.N., Rubtsov A.E., Igidov N.M., Makarov A.S.,
10. Шипиловских С.А., Рубцов А.Е. // Изв. АН. Сер. хим.
Toksarova Yu.S. // Russ. J. Org. Chem. 2011. Vol. 47.
2014. № 9. С. 2205; Shipilovskikh S.A., Rubtsov A.E. //
N 1. P. 109. doi 10.1134/S1070428011010131
Russ. Chem. Bull. 2014. Vol. 63. N 9. P. 2205. doi
17. Eddy N.B., Leimbach D.J. // J. Pharmacol. Exp. Ther.
10.1007/s11172-014-0722-4
1953. Vol. 107. N 3. P 385.
11. Кузнецов А.С., Пулина Н.А., Рубцов А.Е. // Тезисы
18. Миронов А.Н. Руководство по проведению
докл. Междунар. конгр. KOST-2015. Москва, 2015.
доклинических
исследований
лекарственных
С. 456.
веществ. М.: Гриф и К, 2012. Ч. 1. С. 509.
12. CrysAlisPro.
Agilent
Technologies.
Version
19. Беленький М.Л. Элементы количественной оценки
1.171.37.33 (release 27-03-2014 CrysAlis171 .NET).
фармакологического эффекта. Ленинград: Медгиз,
13. Sheldrick G.M. // Acta Cryst. (A). 2008. Vol. 64. N 1.
1963. 146 с.
P. 112. doi 10.1107/S0108767307043930
20. Новикова В.В., Русских А.А. // Разработка и регис-
14. Sheldrick G.M. // Acta Cryst. (С). 2015. Vol. 71. N 1.
трация лекарственных средств. 2018. №2 (23). С. 32.
Synthesis and Biological Activity of N-Aryl(alkyl)-
2-[2-(9H-fluoren-9-ylidene)hydrazone]-5,5-dimethyl-4-
oxohexanoic Acids Amides
A. I. Siutkinaa, *, N. M. Igidova, M. V. Dmitrievb, R. R. Makhmudovb, c, and V. V. Novikovaa
a Perm State Pharmaceutical Academy of the Ministry of Health of the Russian Federation,
ul. Ekaterininskaya 101, Perm, 614990Russia
*e-mail: syutkina.alyona@yandex.ru
b Perm State National Research University, Perm, Russia
c Federal Research Center for Medical and Preventive Health Risk Management Technologies, Perm, Russia
Received February 27, 2019; revised February 27, 2019; accepted March 5, 2019
A series of new 2-[(9H-fluoren-9-ylidene)hydrazono]-5,5-dimethyl-4-oxohexanoic acids amides were obtained
by ring-opening of 3-(9H-fluoren-9-ylidene)hydrazono-5-tert-butylfuran-2(3H)-one under the action of primary
amines. Antinociceptive and antimicrobial activity of the synthesized compounds was studied.
Keywords:
3-(9H-fluoren-9-ylidene)hydrazono-5-tert-butylfuran-2(3H)-one, N-aryl(alkyl)-2-[(9H-fluoren-9-
ylidene)hydrazono]-5,5-dimethyl-4-oxohexanoic acids amides, antinociceptive activity, antimicrobial activity,
antifungal activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019