ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1038-1046
УДК 547.794.2;547.794.3;547.917
CИНТЕЗ ГЛИКОЗИДОВ С 4-(4-ГИДРОКСИФЕНИЛ)-1,2,3-ТИА-
И СЕЛЕНАТИАЗОЛЬНЫМИ АГЛИКОНАМИ
© 2019 г. Л. М. Певзнерa, *, М. Л. Петровa, Е. Б. Эрхитуеваb, В. А. Полукеевc, А. В. Степаковb
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
bСанкт-Петербургский государственный университет, Санкт-Петербург, Россия
с Институт экспериментальной медицины, Санкт-Петербург, Россия
Поступило в Редакцию 13 декабря 2018 г.
После доработки 13 декабря 2018 г.
Принято к печати 20 декабря 2018 г.
Гликозилированием 4-(4-гидроксифенил)-1,2,3-тиа(селена)диазолов 1-α-бром-2,3,4,6-тетра-O-ацетил-D-
глюкопиранозой, 1-α-бром-2,3,4,6-тетра-O-ацетил-D-галактопиранозой и 1-α-бром-2,3,4-три-O-ацетил-D-
ксилопиранозой в условиях межфазного катализа синтезированы соответствующие ацетилированные
гликозиды. Разработан альтернативный путь синтеза селенадиазольных гликозидов исходя из
семикарбазонов 1-β-О-(4-ацетилфенил)-2,3,4,6-тетра-O-ацетил-D-глюкопиранозы, -2,3,4,6-тетра-O-ацетил-
D-галактопиранозы и -2,3,4-три-O-ацетил-D-ксилопиранозы путем окисления их двуокисью селена.
Ключевые слова: гликозилирование, реакция Кеннигса-Кнорра, межфазный катализ, 1,2,3-тиадиазолы,
семикарбазиды, 1,2,3-селенадиазолы
DOI: 10.1134/S0044460X19070084
В настоящее время решение проблемы доставки
трансферазы, влиять на проницаемость клеточных
синтетических лекарственных препаратов к месту
мембран, выступать антагонистами анафилато-
их действия является актуальной задачей. Из-за
ксиновых рецепторов, оказывать антинеобласти-
малой биодоступности многие из них для
ческое действие и использоваться для лечения
достижения лечебного эффекта приходится
рестеноза. Напротив, вероятность антимикробного
применять в высоких концентрациях, что сопровож-
и противогрибкового действия для таких
дается побочными эффектами. Возможным
соединений прогнозируется в области 0.6. Таким
способом решения этой проблемы может быть
образом, оказывается, что гликозиды по сравнению
использование существующих в живых системах
со свободным агликоном могут обладать значи-
транспортных каналов, по которым осущест-
тельно более широким спектром биологической
вляется обмен веществ. Один из таких каналов
активности. Разработка методов синтеза подобных
обеспечивает обмен углеводов, по которому
соединений без сомнения актуальна.
помимо моно- и олигосахаридов в клетку посту-
Удобным методом синтеза фенилгликозидов
пают разнообразные гликозиды и, в частности, О-
является
межфазно-каталитический
вариант
арилгликозиды. Мы решили воспользоваться им
реакции Кеннигса-Кнорра
[4,
5].
Реакцию
для повышения биодоступности
4-(4-гидрокси-
проводят в среде вода-хлороформ, используя
фенил)-1,2,3-тиа(селена)диазолов которые обладают
избыток фенола и гидроокиси калия или натрия в
противовирусной
[1], антимикробной
[2] и
виде
1.0-1.25 н. раствора по отношению к
фунгицидной активностью [2]. Оценка возможной
ацетилгалогенозе. Мы использовали данную
биологической активности с помощью программы
методику для гликозилирования
4-(4-гидрокси-
PASS [3] показала, что О-глюкозиды, О-галак-
фенил)-1,2,3-тиа(селена)диазолов.
тозиды и О-ксилозиды с такими агликонами с
вероятностью
>0.7 могут проявлять ингибиру-
Реакцию
4-(4-гидроксифенил)-1,2,3-тиадиазола
ющую активность в отношении глицерофосфо-
с 1-α-бром-2,3,4,6-тетра-O-ацетил-D-глюкопиранозой
1038
CИНТЕЗ ГЛИКОЗИДОВ С 4-(4-ГИДРОКСИФЕНИЛ)-1,2,3-ТИА-
1039
Схема 1.
AcO
OAc
Y
O
O
Y
X
X
O
Z TEBA-Br, KOH
AcO
+
HO
AcO
OAc
N
CHCl3-H2O
N
N N
OAc
Br
Z
1, 2
4, 5, 7, 8
O
O
OAc
AcO
Z TEBA-Br, KOH
N
O
+
HO
AcO
OAc
AcO
CHCl3-H2O
N
N N
OAc
Z
Br
3
6, 9
X = OAc, Y = H (1); X = H, Y = OAc (2); X = OAc, Y = H, Z = S (4), Se (7); X = H, Y = OAc, Z = S (5), Se (8); Z = S (6), Se (9).
1, 1-α-бром-2,3,4,6-тетра-O-ацетил-D-галактопиранозой
глюкозида 7 и ксилозида 9, что соответствует
2 и 1-α-бром-2,3,4-три-O-ацетил-D-ксилопиранозой
тенденции, наблюдавшейся авторами работы [5]
3 проводили по стандартной методике при
для других фенолов. Наличие селенадиазольного
мольном соотношении галогеноза:тиадиазол:
кольца в соединениях
7-9 подтверждалось
бромид триэтилбензиламмония:KOH = 1:2:0.8:2.2 в
присутствием сигналов протона при 9.3-9.4 м. д.
системе вода-хлороформ при 55°С в течение 8 ч.
(2JHSe = 40.4 Гц для сателлитов) и атомов углерода
Поскольку производные 1,2,3-тиадиазола чувстви-
около 136 (С5) и 157 м. д. (С4).
тельны к действию оснований, гидроокись калия
Низкий выход гликозидов на основе селена-
вводили в реакцию в виде 0.6 н. водного раствора,
диазола побудил нас использовать другой вариант
что заметно увеличило выход целевого продукта
их синтеза, а именно построение селенадиазоль-
по сравнению с более концентрированными
ного кольца в заранее полученном гликозиде.
растворами щелочи, использованными авторами
Стандартным способом получения селенадиазолов
работ [4, 5]. После разделения реакционной массы
является окисление семикарбазонов метилкетонов
и кристаллизации из этанола гликозиды 4-6 были
двуокисью селена в уксусной кислоте [6]. Поэтому
получены с выходами 26, 45 и 41% соответственно
был выбран путь синтеза, включающий получение
(схема 1). Наличие 1,2,3-тиадиазольного кольца в
гликозида
4-гидроксиацетофенона, синтез его
полученных соединениях подтверждено присут-
ствием сигнала протона тиадиазольного кольца в
спектре ЯМР 1Н при 8.5-8.6 м. д. и сигналов ядер
углерода тиадиазольного кольца при 129.2 (С5) и
157.3-157.6 м. д. (С4) в спектрах ЯМР 13С.
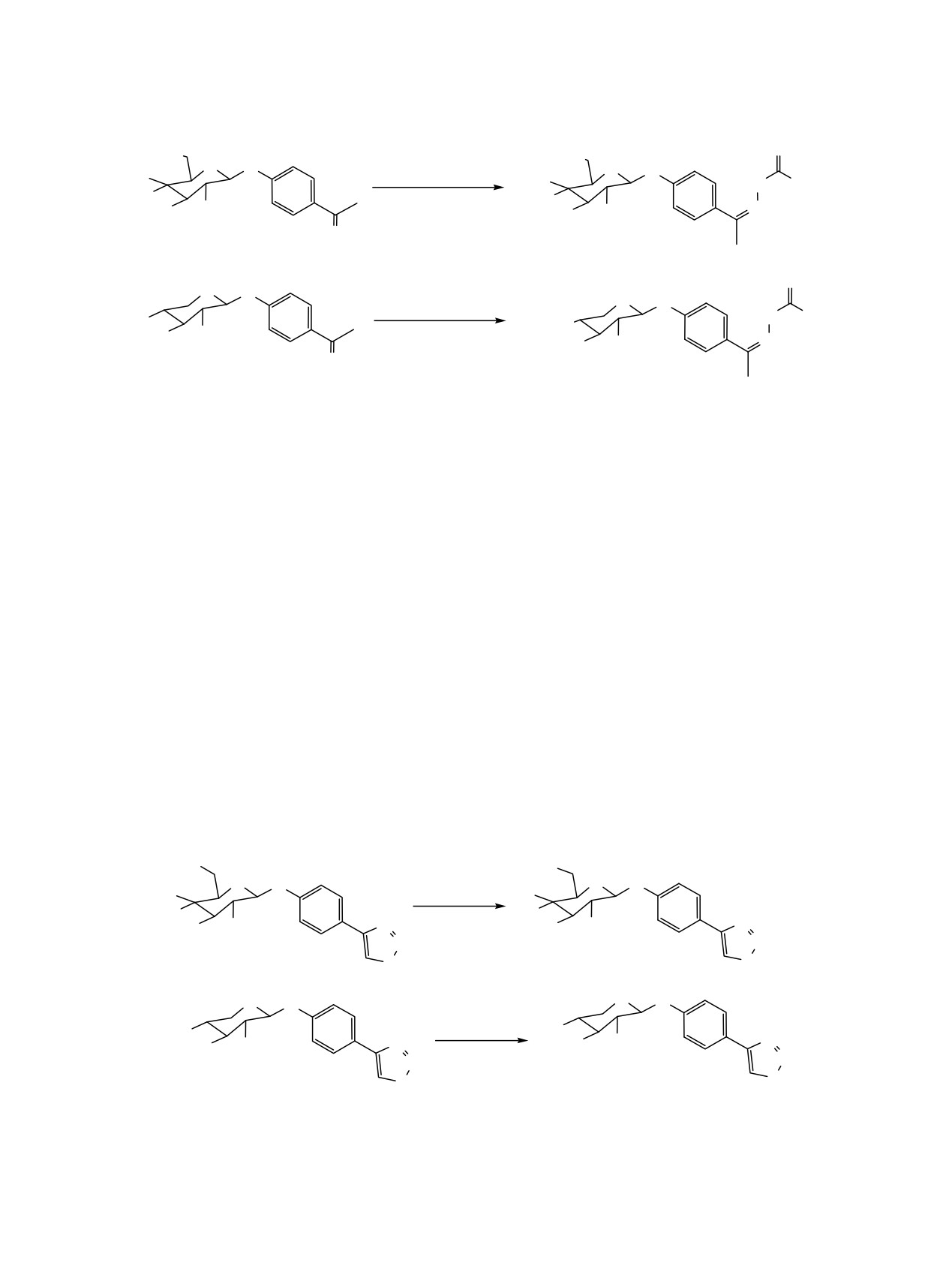
Строение полученных соединений было
подтверждено также данными рентгенострук-
турного анализа на примере гликозида
6 (см.
рисунок).
Реакцию
4-(4-гидроксифенил)-1,2,3-селенади-
азола с галогенозами 1-3 проводили аналогично. В
условиях реакции селенадиазольное кольцо
оказалось значительно более лабильным и во всех
случаях наблюдали заметное выделение колло-
идного селена. Гликозиды 7-9 были получены с
Общий вид молекулы 1-β-О-[4-(1,2,3-тиадиазол-4-ил)-
выходами 15, 30 и 19% соответственно (схема 1).
фенил]-2,3,4-три-O-ацетил-D-ксилопиранозы
6 в
Как видно из приведенных данных, выход
кристалле в представлении эллипсоидами тепловых
галактозида 8 оказался значительно выше, чем
колебаний с вероятностью 50%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1040
ПЕВЗНЕР и др.
Схема 2.
AcO
O
AcO
O
O
H2N-NHCONH2·HCl
O
O
Y
Y
HN NH2
X
CH3COONa
X
AcO
OAc
N
AcO
OAc
O
10, 11
13, 14
O
O
O
H2N-NHCONH2·HCl
O
O
AcO
HN NH
2
CH3COONa
AcO
AcO
OAc
N
AcO OAc
O
12
15
X = OAc, Y = H (10, 13); X = H, Y = OAc (11, 14).
семикарбазона и окисление последнего до 1,2,3-
группы кетона при ~197 м. д. исчезал, и появлялся
селенадиазола. Основной проблемой такого метода
сигнал ядра углерода гидразонного фрагмента
синтеза являлась селективность окисления
около 144 м. д. Кроме того, в области 157 м. д.
двуокисью селена, поскольку мог затрагиваться и
появлялся сигнал углерода карбонильной группы
углеводный фрагмент.
амидного фрагмента. Уширенные сигналы
протонов фрагментов NH2 и NH располагались при
Глюкозид 10, галактозид 11 и ксилозид 12 были
~ 6.5 и 9.3 м. д. соответственно.
получены гликозилированием
4-гидроксиацето-
фенона по методике [4]. Их взаимодействие с
Окисление семикарбазонов
13-15 проводили
гидрохлоридом семикарбазида проводили в
двуокисью селена в уксусной кислоте при 68-70°С
этаноле в присутствии ацетата натрия в мольном
в течение
4 ч по методике
[7] при мольном
соотношении гликозид:гидрохлорид семикарбазида:
соотношении семикарбазон:двуокись селена
=
ацетат натрия
=
1:1.2:2.4 в течение
8 ч при
1:1.2. При окислении глюкозида
13 после
кипячении. Семикарбазоны 13-15 были получены
разделения реакционной смеси и перекристал-
с выходами 78, 59 и 79% соответственно (схема 2).
лизации из этанола с выходом 17% был выделен
В спектрах ЯМР 1Н полученных соединений в
селенадиазол 7. Окисление галактозида 14 также
ДМСО-d6 сигнал метильной группы сдвигался в
привело к получению селенадиазола 8 с выходом
сильное поле от 2.57 м. д. в кетоне до 2.16-2.23 м. д.,
28%. Окисление ксилозида
15 идет по двум
а сигнал соответствующего атома углерода с ~26 м.
маршрутам с образованием селенадиазола
9 и
д. до ~14 м. д. Сигнал углерода карбонильной
кетона 12 в мольном соотношении 1:0.3. Выходы
Схема 3.
AcO
HO
O
O
O
O
Y
MeONa
Y
X
MeOH-CHCl3
X
AcO
OAc
N
HO
OH
N
N
N
4, 5, 7, 8
Z
Z
16-19
O
O
O
O
MeONa
HO
AcO
OH
N
AcO
OAc
N
HO
MeOH-CHCl3
N
N
Z
6, 9
Z
20, 21
X = OAc, Y = H, Z = S (4), Se (7); X = H, Y= OAc, Z = S (5), Se (8); X = OH, Y = H, Z = S (16), Se (18); X = H, Y= OH,
Z = S (17), Se (19); Z = S (6, 20) Se (9, 21).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
CИНТЕЗ ГЛИКОЗИДОВ С 4-(4-ГИДРОКСИФЕНИЛ)-1,2,3-ТИА-
1041
соединений
9 и
12 составили
34 и
12%
эксперимент проводили на дифрактометре Bruker
соответственно. Разделить эту смесь перекристал-
APEX2 CCD, графитовый монохроматор, λ(CuKα) =
лизацией не удалось.
1.5418 Å. Кристаллы соединения
6 орто-
ромбической сингонии, бесцветные, C19H20N2O8S,
Таким образом, показана возможность как
M = 436.43, a = 48.5414(14) Å, b = 7.1361(3) Å, c =
прямого гликозилирования
4-(4-гидроксифенил)-
5.8921(2) Å, Z = 4, dвыч = 1.420 г/см3, V = 2041.00(13) Å3,
1,2,3-тиа- и -селенадиазолов, так и построения 1,2,3-
пространственная группа P21212. Измерено
селенадиазольного кольца путем модификации
отражений 46857, независимых отражений
4275
агликона непосредственно в гликозиде, хотя оба
(Rint = 0.0905, Rσ = 0.0292). Полные кристалло-
процесса несомненно требуют подбора более
графические данные соединения 6 помещены в
подходящих условий.
Кембриджский банк структурных данных (CCDC
Последней стадией синтеза стало снятие
1919454).
ацетильной защиты с углеводного фрагмента. Из-за
Гликозилирование 4-(4-гидроксифенил)-1,2,3-
низкой растворимости гликозидов 4-9 в метаноле
тиа(селена)диазолов (общая методика). К смеси
реакцию вели в смеси метанола и хлороформа в
5 ммоль ацетилгалогенозы 1-3, 10 ммоль 4-(4-
соотношении 2:1 в присутствии каталитических
гидроксифенил)-1,2,3-тиа- или -селенадиазола,
4
количеств метилата натрия (схема 3). Несмотря на
ммоль бромида триэтилбензиламмония и 50 мл
высокую чувствительность селенадиазольного
хлороформа прибавляли при перемешивании со
кольца к действию сильных оснований метанолиз
скоростью
750 об/мин
18 мл
0.6 н. раствора
проходил без заметного выделения коллоидного
гидроксида калия. Реакционную смесь нагревали
селена. Кристаллизация свободных гликозидов 16-
до 55°С и выдерживали при перемешивании с
21 из реакционной массы продолжалась в течение
указанной скоростью 8 ч. После охлаждения до
2-3 сут.
комнатной температуры отделяли водную фазу,
Выход свободных гликозидов 16-21 сущест-
органическую фазу промывали 0.6 н. раствором
венно зависит от природы углевода, тогда как
гидроксида калия (2 × 10 мл), 10 мл воды и сушили
влияние строения агликона практически не
хлористым кальцием. После удаления хлороформа
сказывается. Глюкозиды 16 и 18 были получены с
остаток перекристаллизовывали из этанола.
выходами
34 и
41% соответственно, для
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-2,3,4,6-
галактозидов 17 и 19 он составлял 73 и 79%, тогда
тетра-O-ацетил-D-глюкопираноза
(4).
Выход
как для ксилозидов 20 и 21 он был равен 82 и 73%
20
26%, белые кристаллы, т. разл. 215°С, [α]
-16.8
соответственно. Синтезированные гликозиды
(с = 0.83, хлороформ). Спектр ЯМР 1Н (CDCl3), δ,
представляли собой стабильные кристаллические
м. д.: 2.06 с (3Н, СН3СО), 2.08 с (3Н, СН3СО), 2.10
вещества, растворимые в воде, что особенно
с (3Н, СН3СО), 2.11 с (3Н, СН3СО), 3.94 д. д. д (1Н,
удобно для тестирования их в качестве про-
Н5-Glu, JH6AH5 = 2.4, JH6ВH5 = 5.6, JH4H5 = 10.0 Гц),
лекарств, активируемых гидролазами организма.
4.22 д. д (1Н, Н6А-Glu, JАВ = 10.4, JH6AH5 = 2.4 Гц),
4.33 д. д (1Н, Н6В-Glu, JАВ = 10.4 Гц, JH6ВH5 =
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5.6 Гц), 5.19-5.23 м и 5.30-5.37 м (4Н, Н1-4-Glu),
7.14 д (2Н, Н2,6-Ph, JНН = 8.8 Гц), 8.01 д (2Н, Н3,5-Ph,
Спектры ЯМР
1Н,
13С, и 31Р получали на
JНН = 8.8 Гц), 8.60 с (1Н, Н5-тиадиазол). Спектр
приборе Bruker AVANCE-400 [400.13 (1H), 100.16
ЯМР 13С (CDCl3), δС, м. д.: 20.16 (СН3), 20.63 (СН3),
(13C) МГц соответственно]. Масс-спектры высокого
20.67 (СН3), 20.73 (СН3), 61.95 (С6-Glu), 68.25 (С5-
разрешения регистрировали на масс-спектрометре
Glu), 71.15 (С4-Glu), 72.20 (С3-Glu), 72.67 (С2-Glu),
Bruker MicrOTOF. Температуры плавления
98.80 (С1-Glu), 117.47 (С2,6-Ph), 126.13 (С4-Ph),
измеряли на приборе Boёtius. Удельное вращение
128.81 (С3,5-Ph), 129.29 (С5-тиадиазол), 157.57 (С4-
определяли на поляриметре Optical Activity LTD
тиадиазол), 162.16 (С1-Ph), 169.31 (С=О), 169.42
AA-55 в хлороформе и ДМСО.
(С=О), 170.23 (С=О), 170.56 (С=О). Масс-спектр,
Рентгеноструктурный анализ соединения 6.
m/z:
531.1036
[M
+ Na]+ (вычислено для
Монокристаллы гликозида 6 были получены путем
C22H24N2O10S: 531.1044).
медленного испарения его раствора в смеси этанол-
хлороформ-этилацетат при комнатной темпе-
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-2,3,4,6-
ратуре на воздухе. Рентгенодифракционный
тетра-O-ацетил-D-галактопираноза
(5). Выход
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1042
ПЕВЗНЕР и др.
45%, белые кристаллы, т. пл. 158°С, [α]
20 +8.6 (с =
(2Н, Н3,5-Ph, JНН =
8.8 Гц),
9.33 с
(1Н, Н5-
1.13, хлороформ). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
селенадиазол, сателлит JНSe = 40.4 Гц). Спектр
2.04 с (3Н, СН3СО), 2.09 с (3Н, СН3СО), 2.11 с (3Н,
ЯМР 13С (CDCl3), δС, м. д.: 20.07 (СН3), 20.08 (СН3),
СН3СО), 2.21 с (3Н, СН3СО), 4.14 д. д. д (1Н, Н5-
20.11 (СН3), 20.12 (СН3), 61.97 (С6-Glu), 68.26 (С5-
Gal, JH6AH5 = 6.0 Гц, JH6BH5 = 7.2 Гц, JH4H5 = 0.8 Гц),
Glu), 71.17 (С4-Glu), 72.20 (С3-Glu), 72.62 (С2-Glu),
4.20 д.д (1Н, Н6А-Gal, JАВ = 11.2, JH6AH5 = 6.0 Гц),
98.88 (С1-Glu), 117.50 (С2,6-Ph), 127.45 (С4-Ph),
4.27 д. д (1Н, Н6В-Gal, JАВ = 11.2, JH6ВH5 = 7.2 Гц),
129.11 (С3,5-Ph), 136.19 (С5-селенадиазол), 157.17
5.16 д (1Н, Н4-Gal, JH3H4 = 8.0 Гц), 5.17 д. д (1Н,
(С4-селенадиазол), 162.24 (С1-Ph), 169.32 (С=О),
Н2-Gal, JH2H3 = 10.4, JH1H2 = 3.0 Гц), 5.50 уш. д (1Н,
169.41 (С=О), 170.25 (С=О), 170.58 (С=О). Масс-
Н1-Gal, JH1H2 = 3.0 Гц), 5.54 д. д (1Н, Н3-Gal, JH2H3 =
спектр, m/z: 579.0477 [M + Na]+ (вычислено для
10.4, JH3H4
= 8.0 Гц), 7.16 д (2Н, Н2,6-Ph, JНН =
C22H24N2O10Sе: 5791.0490).
8.8 Гц), 8.01 д (2Н, Н3,5-Ph, JНН = 8.8 Гц), 8.60 с (1Н,
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,4,6-
Н5-тиадиазол). Спектр ЯМР 13С (CDCl3), δС, м. д.:
тетра-O-ацетил-D-галактопираноза
(8). Выход
20.60 (СН3), 20.67 (СН3), 20.70 (СН3), 20.76 (СН3),
20
30%, розовые кристаллы, т. пл. 148°С (разл.), [α]
61.41 (С6-Gal), 66.87 (С5-Gal), 68.60 (С3-Gal), 70.79,
+18.2 (с =
0.43, хлороформ). Спектр ЯМР 1Н
71.21 (С2,4-Gal), 99.34 (С1-Gal), 117.42 (С2,6-Ph),
(CDCl3), δ, м. д.: 2.05 с (3Н, СН3СО), 2.10 с (3Н,
126.08 (С4-Ph),
128.21 (С3,5-Ph),
129.28 (С5-
СН3СО), 2.11 с (3Н, СН3СО), 2.22 с (3Н, СН3СО),
тиадиазол), 157.65 (С4-тиадиазол), 162.18 (С1-Ph),
4.14 уш. д. д (1Н, Н5-Gal, JH6AH5 = 6.2, JH6ВH5 =
169.41 (С=О), 170.12 (С=О), 170.24 (С=О), 170.39
7.2 Гц), 4.21 д. д (1Н, Н6А-Gal, JАВ = 11.2, JH6AH5 =
(С=О). Масс-спектр, m/z:
531.1062
[M
+ Na]+
6.2 Гц), 4.27 д. д (1Н, Н6В-Gal, JАВ = 11.2, JH6ВH5 =
(вычислено для C22H24N2O10S: 531.1044).
7.2 Гц), 5.15-5.18 м и 5.50-5.58 м (4Н, Н1-4-Gal),
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-2,3,5-
7.16 д (2Н, Н2,6-Ph, JНН = 8.6 Гц), 8.02 д (2Н, Н3,5-Ph,
три-O-ацетил-D-ксилопираноза (6). Выход 41%,
JНН = 8.6 Гц), 9.34 с (1Н, Н5-селенадиазол, сателлит
20
белые кристаллы, т. разл. 190-192°С, [α]
-40.7
JНSe = 40.4 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
(с = 1.09, хлороформ). Спектр ЯМР 1Н (CDCl3), δ,
20.61 (СН3), 20.69 (СН3), 20.71 (СН3), 20.77 (СН3),
м. д.: 2.11 с (3Н, СН3СО), 2.12 с (6Н, СН3СО), 3.61
61.87 (С6-Gal), 66.87 (С5-Gal), 68.62 (С3-Gal), 70.81,
д. д (1Н, Н5А-Xyl, JАВ = 12.0, JH5AH4 = 7.4 Гц), 4.27
71.20 (С2,4-Gal), 99.43 (С1-Gal), 117.44 (С2,6-Ph),
д. д (1Н, Н5В-Xyl, JАВ = 12.0 Гц, JH5ВH4 = 4.6 Гц),
127.40 (С4-Ph),
129.11 (С3,5-Ph),
136.17 (С5-
5.05 д. д. д (1Н, Н4-Xyl, JH5AH4 = 7.4, JH5ВH4 = 4.6,
селенадиазол), 157.25 (С4-селенадиазол), 162.26 (С1-
JH3H4 = 7.4 Гц), 5.21-5.31 м (3Н, Н1-3-Xyl), 7.15 д
Ph), 169.40 (С=О), 170.13 (С=О), 170.24 (С=О),
(2Н, Н2,6-Ph, JНН = 8.8 Гц), 8.01 д (2Н, Н3,5-Ph, JНН =
170.38 (С=О). Масс-спектр, m/z 579.0468 [M + Na]+
8.8 Гц), 8.59 с (1Н, Н5-тиадиазол). Спектр ЯМР 13С
(вычислено для C22H24N2O10Sе: 579.0490).
(CDCl3), δС, м. д.: 20.73 (СН3), 20.77 (СН3), 20.80
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,5-
(СН3), 61.87 (С5-Xyl), 68.39 (С4-Xyl), 69.97 (С2-Xyl),
три-O-ацетил-D-ксилопираноза (9). Выход 19%,
70.47 (С3-Xyl), 98.18 (С1-Xyl), 117.36 (С2,6-Ph),
20
серые кристаллы, т. пл. 172°С (разл.), [α]
-24.7
125.86 (С4-Ph),
128.84 (С3,5-Ph),
129.18 (С5-
(с = 0.87, хлороформ). Спектр ЯМР 1Н (CDCl3), δ,
тиадиазол), 157.34 (С4-тиадиазол), 162.25 (С1-Ph),
м. д.: 2.11 с (3Н, СН3СО), 2.12 с (6Н, СН3СО), 3.60
169.40 (С=О), 169.85 (С=О), 169.91 (С=О). Масс-
д. д (1Н, Н5А-Xyl, JАВ = 11.0, JH5AH4 = 7.4 Гц), 4.28
спектр, m/z: 459.0847 [M + Na]+ (вычислено для
д. д (1Н, Н5В-Xyl, JАВ = 11.0, JH5ВH4 = 4.6 Гц), 5.05 д.
C19H20N2O8S: 459.0833).
д. д (1Н, Н4-Xyl, JH5AH4 = 7.4, JH5ВH4 = 4.8, JH3H4 =
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,4,6-
7.4 Гц), 5.21-5.30 м (3Н, Н1-3-Xyl), 7.15 д (2Н, Н2,6-
тетра-O-ацетил-D-глюкопираноза
(7).
Выход
Ph, JНН = 8.8 Гц), 8.02 д (2Н, Н3,5-Ph, JНН = 8.8 Гц),
15%, красноватые кристаллы, т. пл. 167°С (разл.),
9.32 с (1Н, Н5-селенадиазол, сателлит JНSe = 40.4 Гц).
[α]
20 -7.53 (c = 0.199, хлороформ). Спектр ЯМР 1Н
Спектр ЯМР 13С (CDCl3), δС, м. д.: 20.74 (СН3),
(CDCl3), δ, м. д.: 2.07 с (3Н, СН3СО), 2.08 с (3Н,
20.77 (СН3), 20.80 (СН3), 61.88 (С5-Xyl), 68.41 (С4-
СН3СО), 2.11 с (3Н, СН3СО), 2.12 с (3Н, СН3СО),
Xyl), 70.01 (С2-Xyl), 70.51 (С3-Xyl), 98.25 (С1-Xyl),
3.94 д. д. д (1Н, Н5-Glu, JH6AH5 = 2.4, JH6ВH5 = 5.4,
117.37 (С2,6-Ph), 127.17 (С4-Ph), 129.14 (С3,5-Ph),
JH4H5 = 9.6 Гц), 4.22 д. д (1Н, Н6А-Glu, JАВ = 12.4,
136.10 (С5-селенадиазол), 156.92 (С4-селенадиазол),
JH6AH5 = 2.4 Гц), 4.33 д. д (1Н, Н6В-Glu, JАВ = 12.4,
162.32 (С1-Ph), 169.40 (С=О), 169.86 (С=О), 169.92
JH6ВH5 = 5.4 Гц), 5.19-5.24 м и 5.31-5.38 м (4Н,
(С=О). Масс-спектр, m/z:
506.0280
[M
+ Na]+
Н1-4-Glu), 7.13 д (2Н, Н2,6-Ph, JНН = 8.8 Гц), 8.02 д
(вычислено для C19H20N2O8Se: 507.0277).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
CИНТЕЗ ГЛИКОЗИДОВ С 4-(4-ГИДРОКСИФЕНИЛ)-1,2,3-ТИА-
1043
Синтез семикарбазонов гликозидов
13-15
m/z:
546.1675
[M
+ Na]+ (вычислено для
(общая методика). К смеси 5 ммоль глюкозида 10,
C23H29N3O11: 546.1694).
галактозида 11 или ксилозида 12 и 25 мл этанола
Семикарбазон 1-β-О-(4-ацетилфенил)-2,3,5-три-
прибавляли при перемешивании 6 ммоль гидро-
O-ацетил-D-ксилопиранозы
(15). Выход
79%,
хлорида семикарбазида и 12 ммоль ацетата натрия.
20
белые кристаллы, разлагаются выше 250°С, [α]
Реакционную смесь кипятили при перемешивании
+14.7 (c = 0.304, ДМСО). Спектр ЯМР 1Н (ДМСО-
8 ч, затем выливали в 70 мл воды. Осадок через
d6), δ, м. д.: 2.11 с (6Н, СН3С=N, СН3СО), 2.13 с
несколько часов отфильтровывали и сушили на
(3Н, СН3СО), 2.23 с (3Н, СН3СО), 3.57 д. д (1Н, Н5А-
воздухе.
Xyl, JАВ = 12.0, JH5AH4 = 7.4 Гц), 4.24 д. д (1Н, Н5В-
Семикарбазон 1-β-О-(4-ацетилфенил)-2,3,4,6-
Xyl, JАВ = 12.0, JH5ВH4 = 4.6 Гц), 5.03 д. д. д (1Н, Н4-
тетра-O-ацетил-D-глюкопиранозы
(13). Выход
Xyl, JH5AH4 = 7.4, JH5ВH4 = 4.6, JH3H4 = 7.4 Гц), 5.18-
78%, белые кристаллы, разлагаются выше 250°С,
5.28 м (3Н, Н1-3-Xyl), 6.23 уш. с (2Н, NH2), 7.02 д
20
[α]
-1.8 (c = 0.274, ДМСО). Спектр ЯМР 1Н
(2Н, Н2,6-Ph, JНН = 8.8 Гц), 7.66 д (2Н, Н3,5-Ph, JНН =
(CDCl3), δ, м. д.: 1.98 с (3Н, СН3С=N), 2.02 с (6Н,
8.8 Гц), 8.40 уш. с (1Н, NH). Спектр ЯМР 13С
СН3СО), 2.09 с (3Н, СН3СО), 2.16 с (3Н, СН3СО),
(ДМСО-d6), δС, м. д.: 13.27 (СН3С=N), 20.71 (СН3),
4.07 д (1Н, Н6А-Glu, JАВ = 11.6 Гц), 4.21 д. д (1Н,
20.75 (СН3), 20.79 (СН3), 61.82 (С5-Xyl), 68.21 (С4-
Н6В-Glu, JАВ = 11.6, JH6ВH5 = 5.2 Гц), 4.24-4.28 м
Xyl), 69.96 (С2-Xyl), 70.46 (С3-Xyl), 98.15 (С1-Xyl),
(1Н, Н5-Glu, JH6ВH5 = 5.2, JH4H5 = 9.6 Гц), 5.07 д. д
116.58 (С2,6-Ph), 127.47 (С3,5-Ph), 132.99 (С4-Ph),
(1Н, Н2-Glu, JH1H2 = 7.8 Гц, JH2H3 = 9.6 Гц), 5.23 м,
145.45 (С=N), 157.23, 157.72 (С1-Ph, С=О-амид),
5.01 т и 5.45 т (2Н, Н3-4-Glu, JH2H3 = JH3H4 = JH4H5 =
169.41 (С=О), 169.87 (С=О), 169.94 (С=О). Масс-
9.6 Гц), 5.62 д (1Н, Н1-Glu, JН1Н2 = 7.8 Гц), 6.46 уш.
спектр, m/z:
490.1213
[M
+ K]+ (вычислено для
с (2Н, NH2), 6.97 д (2Н, Н2,6-Ph, JНН = 8.8 Гц), 7.82 д
C20H25N3O9: 490.1222).
(2Н, Н3,5-Ph, JНН = 8.8 Гц), 9.25 с (1Н, NH). Спектр
Реакция семикарбазонов глюкозидов 13-15 с
ЯМР 13С (ДМСО-d6), δС, м. д.: 13.72 (СН3С=N),
двуокисью селена (общая методика). К суспензии
20.77 (СН3), 20.82 (СН3), 20.87 (СН3), 20.98 (СН3),
5 ммоль семикарбазона в 15 мл ледяной уксусной
62.09 (С6-Glu), 68.52 (С5-Glu), 71.19 (С4-Glu), 71.28
кислоты прибавляли при перемешивании 6 ммоль
(С3-Glu), 72.39 (С2-Glu), 97.41 (С1-Glu), 116.38 (С2,6-
мелкорастертой двуокиси селена. Реакционную
Ph), 127.91 (С3,5-Ph), 133.58 (С4-Ph), 143.94 (С=N),
массу нагревали при
68-78°С в течение
4 ч,
157.04, 157.76 (С1-Ph, С=О-амид), 169.59 (С=О),
охлаждали и выливали в 60 мл воды. Полученную
169.79 (С=О), 170.08 (С=О), 170.47 (С=О). Масс-
смесь экстрагировали хлороформом (3 × 10 мл),
спектр, m/z: 546.1685 [M + Na]+ (вычислено для
промывали
10 мл воды,
10 мл насыщенного
C23H29N3O11: 546.1694).
раствора бикарбоната натрия, 10 мл раствора NaCl
и сушили хлористым кальцием. После этого
Семикарбазон 1-β-О-(4-ацетилфенил)-2,3,4,6-
пропускали раствор через слой силикагеля, отгоняли
тетра-O-ацетил-D-галактопиранозы (14). Выход
хлороформ, остаток кристаллизовали из этанола.
59%, белые кристаллы, разлагаются выше 250°С,
20
[α]
+24.0 (c = 0.250, ДМСО). Спектр ЯМР 1Н
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,4,6-
(ДМСО-d6), δ, м. д.: 1.96 с (3Н, СН3С=N), 2.03 с
тетра-O-ацетил-D-глюкопираноза
(7).
Выход
(3Н, СН3СО), 2.05 с (3Н, СН3СО), 2.16 с (6Н,
17%, розовые кристаллы, т. пл.
164°С (разл.).
СН3СО), 4.11 уш. с (2Н, С6Н2-Gal), 4.46 уш. с (1Н,
Спектры ЯМР 1Н и13С идентичны описанным выше.
Н5-Gal), 5.24-5.36 уш. с (3Н, Н2-4-Gal), 5.53 д (1Н,
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,4,6-
Н1, JH1H2 = 7.6 Гц), 6.48 уш. с (2Н, NH2), 6.97 д (2Н,
тетра-O-ацетил-D-галактопираноза
(8). Выход
Н2,6-Ph, JНН = 8.8 Гц), 7.82 д (2Н, Н3,5-Ph, JНН =
28%, светло-серые кристаллы, т. пл. 150°С. Спектры
8.8 Гц), 9.28 уш. с (1Н, NH). Спектр ЯМР 13С
ЯМР 1Н и13С идентичны описанным выше.
(ДМСО-d6), δС, м. д.: 13.74 (СН3С=N), 20.81 (СН3),
20.86 (СН3), 20.91 (СН3), 20.98 (СН3), 61.77 (С6-
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-2,3,4-
Gal), 67.71 (С5-Gal), 68.83 (С3-Gal), 70.60,
70.85
три-O-ацетил-D-ксилопираноза
(9) и
1-β-О-(4-
(С2,4-Gal), 98.03 (С1-Gal), 116.39 (С2,6-Ph),
127.93
ацетилфенил)-2,3,4-три-O-ацетил-D-ксилопираноза
(С3,5-Ph),
133.56 (С4-Ph),
144.01 (С=N),
157.15,
(12). Светло-серый порошок. Согласно данным
157.81 (С1-Ph, С=О-амид), 169.71 (С=О),
170.04
спектра ЯМР 1Н, соотношение соединений 9 и 12
(С=О), 170.37 (С=О), 170.45 (С=О). Масс-спектр,
составляет 1:0.3, выходы 34 и 12% соответственно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1044
ПЕВЗНЕР и др.
Спектры ЯМР 1Н и 13С продукта 9 идентичны
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-D-гала-
20
описанным выше.
ктопираноза (17). Выход 73%, [α]
-14.4 (c =
0.656, ДМСО), белый порошок. Спектр ЯМР 1Н
1-β-О-(4-Ацетилфенил)-2,3,4-три-O-ацетил-D-
(ДМСО-d6), δ, м. д.: 3.43-3.48 м (1Н, Н3-Gal), 3.49-
ксилопираноза (12). Спектр ЯМР 1Н (CDCl3), δ,
3.66 м (4Н, Н2,5,6А,6В-Gal), 3.73 уш. т (1Н, Н4-Gal),
м. д.: 2.10 с (3Н, СН3СО), 2.11 с (3Н, СН3СО), 2.14
4.54 д (1Н, ОН, J = 4.8 Гц), 4.68 т (1Н, ОН, JОНН6 =
с (3Н, СН3СО), 2.57 с (3Н, СН3-кетон), 3.60 д. д
5.6 Гц), 4.89 д (1Н, ОН, J = 5.6 Гц), 4.94 д (1Н, Н1-
(1Н, Н5А-Xyl, JАВ = 12.0, JH5AH4 = 7.2 Гц), 4.24 д. д
Gal, JH1H2 = 7.6 Гц), 5.22 д (1Н, ОН, J = 5.2 Гц), 7.20
(1Н, Н5В-Xyl, JАВ = 12.0, JH5ВH4 4.4 Гц), 5.02 д. д. д
д (2Н, Н2,6-Ph, J = 8.8 Гц), 8.08 д (2Н, Н3,5-Ph, J =
(1Н, Н4-Xyl, JH5AH4 = 7.2, JH5ВH4 = 4.4, JH3H4 =
8.8 Гц), 9.51 с (1Н, Н5-тиадиазол). Спектр ЯМР 13С
7.2 Гц), 5.19 д. д (1Н, Н2-Xyl, JH1H2 = 5.6, JH2H3 =
(ДМСО-d6), δС, м. д.: 60.86 (С6-Gal), 68.62 (С4-Gal),
7.2 Гц), 5.25 д. д (1Н, Н3-Xyl, JH2H3 = 7.2, JH3H4 =
70.74 (С3-Gal), 73.76 (С2-Gal), 76.07 (С5-Gal), 101.23
7.2 Гц), 5.31 д (1Н, Н1-Xyl, JH2H3 = 5.6 Гц), 7.05 д
(С1-Gal), 117.29 (С2,6-Ph), 124.83 (С4-Ph), 128.88
(2Н, Н2,6-Ph, JНН = 8.8 Гц), 7.95 д (2Н, Н3,5-Ph, JНН =
(С3,5-Ph),
132.23
(С5-тиадиазол),
158.67 (С4-
8.8 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 20.69
тиадиазол),
162.14 (С1-Ph). Масс-спектр, m/z:
(СН3), 20.74 (СН3), 20.78 (СН3), 26.45 (СН3-кетон),
363.0630 [M + Na]+ (вычислено для C14H16N2O6S:
61.77 (С5-Xyl), 68.21 (С4-Xyl), 69.67 (С2-Xyl), 70.16
363.0621).
(С3-Xyl), 97.53 (С1-Xyl), 116.16 (С2,6-Ph),
130.52
(С3,5-Ph), 132.19 (С4-Ph), 160.05 (С1-Ph),
169.32
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-D-ксило-
20
(С=О), 169.81 (С=О), 196.97 (С=О-кетон).
пираноза (20). Выход 82%, [α]
-4.8 (c = 1.141,
ДМСО), светло-коричневый порошок. Спектр ЯМР
Метанолиз ацетатов гликозидов (общая
1Н (ДМСО-d6), δ, м. д.: 3.25-3.29 м (2Н, Н2,3-Xyl),
методика). К раствору 5 ммоль ацетата гликозида
3.35 д. д (1Н, Н5А-Xyl, JН5АН5B = 10.4, JН4Н5А =
в 10 мл хлороформа добавляли 20 мл метанола,
10.4 Гц), 3.38-3.44 м (1Н, Н4-Xyl), 3.78 д. д (1Н, Н5В-
затем прибавляли 6 капель 1 н. раствора метилата
Xyl, JН5АН5B = 10.4, JН4Н5В = 4.4 Гц), 4.99 д (1Н, Н1-
натрия в метаноле. После этого реакционную
Xyl, JН1Н2 = 6.8 Гц), 5.12 уш. с (2Н, ОН), 5.38 уш. с
массу оставляли при комнатной температуре на
(1Н, ОН), 7.18 д (2Н, Н2,6-Ph, J = 8.8 Гц), 8.08 д
2 сут, гликозиды селенадиазолов - в темноте.
(2Н, Н3,5-Ph, J = 8.8 Гц), 9.50 с (1Н, Н5-тиадиазол).
Выделившиеся кристаллы отфильтровывали,
Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 66.22 (С5-
промывали 3 мл метанола и сушили на воздухе
Xyl), 69.82 (С4-Xyl), 73.54 (С2-Xyl), 76.90 (С3-Xyl),
(производные селенадиазола - в темноте).
101.11 (С1-Xyl), 117.31 (С2,6-Ph), 125.03 (С4-Ph),
128.92 (С3,5-Ph), 132.32 (С5-тиадиазол), 158.34 (С4-
1-β-О-[4-(1,2,3-Тиадиазол-4-ил)фенил]-D-
тиадиазол), 162.08 (С1-Ph).
глюкопираноза (16). Выход 34%, [α]
20 -33.7 (c =
0.430, ДМСО), белый порошок. Спектр ЯМР 1Н
1-β-О-[4-(1,2,3-Cеленадиазол-4-ил)фенил]-D-
(ДМСО-d6), δ, м. д.: 3.16-3.22 м (1Н, Н2-Glu), 3.25-
глюкопираноза (18). Выход 41%, [α]
20 +208.3 (c =
3.41 м (2Н, Н3-4-Glu), 3.39 д. д. д (1Н, Н5-Glu, JH5H6А =
0.708, ДМСО), серый порошок. Спектр ЯМР 1Н
6.0, JH5H6B = 1.2, JH5H4 = 9.2 Гц), 3.49 д. д. д (1Н, Н6А-
(ДМСО-d6), δ, м. д.: 3.19 уш. с (1Н, Н2-Glu), 3.29-
Glu, JH6АH6B = 11.6, JH5H6А = 6.0, JH6АОH = 5.8 Гц),
3.41 м (3Н, Н3-5-Glu), 3.49 уш. д. д (1Н, Н6А-Glu,
3.72 д. д. д (1Н, Н6В-Glu, JH6АH6B = 11.6, JH5H6B =
JH6АH6B = 11.2, JH5H6А = 5.4 Гц), 3.72 уш. д. д (1Н,
1.2, JH6ВОH = 5.8 Гц), 4.59 т (1Н, СН2ОН, JH6АОH =
Н6В-Glu, JH6АH6B = 11.2, JH5H6B = 2.8 Гц), 4.59 уш. т
JH6ВОH = 5.8 Гц), 4.98 д (1Н, Н1-Glu, JH1H2 = 7.2 Гц),
(1Н, СН2ОН), 4.98 д (1Н, Н1-Glu, JH1H2 = 6.8 Гц),
5.05 с (1Н, ОН, JHОH = 5.2 Гц), 5.12 д (1Н, ОН,
5.05 уш. с (1Н, ОН), 5.12 уш. с (1Н, ОН), 5.37 уш. с
JHОH = 4.8 Гц), 5.37 д (1Н, ОН, JHОH = 4.8 Гц), 7.20 д
(1Н, ОН), 7.19 д (2Н, Н2,6-Ph, J = 8.3 Гц), 8.08 д
(2Н, Н2,6-Ph, J = 8.8 Гц), 8.08 д (2Н, Н3,5-Ph, J =
(2Н, Н3,5-Ph, J = 8.3 Гц), 10.09 с (1Н, Н5-селена-
8.8 Гц), 9.52 с (1Н, Н5-тиадиазол). Спектр ЯМР 13С
диазол, сателлит JНSe = 41.2 Гц). Спектр ЯМР 13С
(ДМСО-d6), δС, м. д.: 61.15 (С6-Glu), 70.17 (С5-Glu),
(ДМСО-d6), δС, м. д.: 61.16 (С6-Glu), 70.17 (С5-Glu),
73.71 (С4-Glu),
77.08 (С3-Glu),
77.59 (С2-Glu),
73.72 (С4-Glu),
77.09 (С3-Glu),
77.59 (С2-Glu),
100.62 (С1-Glu), 117.27 (С2,6-Ph), 124.91 (С4-Ph),
100.69 (С1-Glu), 117.27 (С2,6-Ph), 126.31 (С4-Ph),
128.88 (С3,5-Ph), 132.27 (С5-тиадиазол), 158.61 (С4-
129.13 (С3,5-Ph), 139.39 (С5-селенадиазол), 158.16
тиадиазол),
162.12 (С1-Ph). Масс-спектр, m/z:
(С4-селенадиазол),
162.31 (С1-Ph). Масс-спектр,
363.0620 [M + Na]+ (вычислено для C14H16N2O6S:
m/z:
411.0077
[M
+ Na]+ (вычислено для
363.0621).
C14H16N2O6Sе: 411.0066).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
CИНТЕЗ ГЛИКОЗИДОВ С 4-(4-ГИДРОКСИФЕНИЛ)-1,2,3-ТИА-
1045
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-D-
ФОНДОВАЯ ПОДДЕРЖКА
галактопираноза (19). Выход 79%, [α]
20 -13.3 (c =
Работа выполнена в рамках базовой части
0.764, ДМСО), розовый порошок. Спектр ЯМР 1Н
государственного задания Министерства образования
(ДМСО-d6), δ, м. д.: 3.43-3.47 м (1Н, Н3-Gal), 3.49-
и науки России (№ 4.5554.2017/8.9) с использо-
3.65 м (4Н, Н2,5,6А,6В-Gal), 3.73 уш. с (1Н, Н4-Gal),
ванием оборудования ресурсных центров Санкт-
4.54 д (1Н, ОН, J = 4.4 Гц), 4.68 т (1Н, ОН, JОНН6 =
Петербургского государственного университета
5.6 Гц), 4.89 д (1Н, ОН, J = 5.6 Гц), 4.94 д (1Н, Н1-
«Методы анализа состава вещества» и «Рентгено-
Gal, JH1H2 = 7.6 Гц), 5.21 д (1Н, ОН, J = 5.2 Гц), 7.19
дифракционные методы исследования».
д (2Н, Н2,6-Ph, J = 8.8 Гц), 8.08 д (2Н, Н3,5-Ph, J =
8.8 Гц), 10.09 с (1Н, Н5-селенадиазол, сателлит
КОНФЛИКТ ИНТЕРЕСОВ
JНSe = 39.6 Гц). Спектр ЯМР 13С (ДМСО-d6), δС,
м. д.: 60.86 (С6-Gal), 68.62 (С4-Gal), 70.62 (С3-Gal),
Авторы заявляют об отсутствии конфликта
73.77 (С2-Gal), 76.06 (С5-Gal), 101.29 (С1-Gal),
интересов.
117.29
(С2,6-Ph), 126.23 (С4-Ph), 129.12 (С3,5-Ph),
139.35 (С5-селенадиазол), 158.24 (С4-селенадиазол),
СПИСОК ЛИТЕРАТУРЫ
162.35 (С1-Ph). Масс-спектр, m/z: 411.0085 [M + Na]+
1. Zuo X., Mi N., Fan Zh., Zheng Q., Zhung H., Wang H.,
(вычислено для C14H16N2O6Sе: 411.0066).
Yang Z. // J. Agric. Food Chem. 2010. Vol. 58. P. 2755.
1-β-О-[4-(1,2,3-Селенадиазол-4-ил)фенил]-D-
doi 10.1021/jf902863z
20
ксилопираноза (21). Выход 73%, [α]
+0.7 (c =
2. Jadhav A.A., Dhanwe V.P., Joshi P.G., Khanna P.K. //
0.705, ДМСО), светло-коричневый порошок. Спектр
Cogent Chem.
2016. N
2.
P.
1144670. doi
10.1080/23312009.2016.11444670
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.25-3.31 м (2Н, Н2,3),
3. Way2Drug.com©2011-2018.Version 2.0
3.50 д. д (1Н, Н5А-Xyl, JН5АН5B = 10.6, JН4Н5А =
10.4 Гц), 3.39-3.45 м (1Н, Н4-Xyl), 3.79 д. д (1Н, Н5В
4. Павлов А.Е., Соколов В.М., Захаров В.И. // ЖОХ
2001. Т. 71. № 11. С. 1915; Pavlov A.E., Sokolov V.M.,
-Xyl, JН5АН5B = 10.6, JН4Н5В = 4.8 Гц), 4.99 д (1Н, Н1-
Zakharov V.I. // Russ. J. Gen. Chem. 2001. Vol. 71.
Xyl, JН1Н2 = 7.2 Гц), 5.10 д (1Н, ОН, JНН = 4.4 Гц),
N 11. P. 1814. doi 10.1023/A:101397121
5.16 д (1Н, ОН, JНН = 4.0 Гц), 5.40 д (1Н, ОН, JНН =
5. Dess D., Kleine H.P., Weinberg D.V., Kaufman R.J.,
4.4 Гц), 7.17 д (2Н, Н2,6-Ph, J = 8.8 Гц), 8.08 д (2Н,
Sidhu R.S. // Synthesis. 1981. N 11. P. 883. doi 10.1055/
Н3,5-Ph, J = 8.8 Гц), 10.07 с (1Н, Н5-селенадиазол,
s-1981-29361
сателлит JНSe = 39.6 Гц). Спектр ЯМР 13С (ДМСО-
6. Сaplin A. // J. Chem. Soc. Perkin Trans. 1. 1974. P. 30.
d6), δС, м. д.: 66.22 (С5-Xyl), 69.84 (С4-Xyl), 73.55
doi 10.1039/P19740000030
(С2-Xyl), 76.91 (С3-Xyl), 101.18 (С1-Xyl),
117.32
7. Петров М.Л., Ляпунова А.Г., Андросов Д.А. // ЖОрХ.
(С2,6-Ph), 126.43 (С4-Ph), 129.17 (С3,5-Ph),
139.45
2012. Т. 48. № 1. С. 151; Petrov M.L., Lyapunova A.G.,
(С5-селенадиазол), 157.89 (С4-селенадиазол), 162.29
Androsov D.A. // Russ. J. Org. Chem. 2012. Vol. 48.
(С1-Ph).
N 1. P. 147. doi 10.1134/s1070428012010265
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1046
ПЕВЗНЕР и др.
Synthesis of Glycosides
with 4-(4-Hydroxyphenyl)-1,2,3-thia(selena)thiazole Aglycones
L. M. Pevznera, *, M. L. Petrova, E. B. Erkhiteuevab, V. A. Polukeevc, and A. V. Stepakovb
a St. Petersburg State Institute of Technology (Technical University), Moscovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
b St. Petersburg State University, St. Petersburg, Russia
c Institute of Experimental Medicine, St. Petersburg, Russia
Received December 13, 2018; revised December 13, 2018; accepted December 20, 2018
Glycosylation of 4-(4-hydroxyphenyl)-1,2,3-thia(selena)thiazoles with 1-α-bromo-2,3,4,6-tetra-O-acetyl-D-gluco-
pyranose, 1-α-bromo-2,3,4,6-tetra-O-acetyl-D-galactopyranose and 1-α-bromo-2,3,4-tri-O-acetyl-D-xylopyranose
under the phase transfer catalysis conditions afforded the corresponding acetylated glycosides. An alternative
route for the synthesis of selenadiazole glycosides was developed by oxidation of 1-β-O-(4-acetylphenyl)-2,3,4,6-
tetra-O-acetyl-D-glucopyranose, -2,3,3,4,6-tetra-O-acetyl-D-galactopyranose and -2,3,4-tri-O-acetyl-D-xylopyranose
semicarbazones with selenium dioxide.
Keywords: glycosylation, Koenigs-Knorr reaction, phase transfer catalysis, 1,2,3-thiadiazoles, semicarbazides,
1,2,3-selenadiazoles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019