ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1051-1057
УДК 544.016.2:526:547:8
ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩЕЙ
СПОСОБНОСТИ ГЕТЕРОАРОМАТИЧЕСКИХ N-ОКСИДОВ
ПО ОТНОШЕНИЮ К ПРОТОНОДОНОРНЫМ
СОЕДИНЕНИЯМ
© 2019 г. Н. Ш. Лебедеваa, Ю. А. Губаревa, *, Е. С. Юринаa, С. С. Гусейновa,
А. И. Вьюгинa, В. П. Андреевb
a Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
*e-mail: gua@isc-ras.ru
b Петрозаводский государственный университет, Петрозаводск, Россия
Поступило в Редакцию 12 декабря 2018 г.
После доработки 12 декабря 2018 г.
Принято к печати 22 февраля 2019г.
Изучено взаимодействие стирильных производных N-оксидов пиридина с протонодонорами в различных
растворителях. Методами электронной спектроскопии и термогравиметрического анализа и получены
спектральные и термохимические сведения о молекулярных комплексах, установлены зависимости
термодинамических параметров комплексов от структуры N-оксидов и сольватирующей среды.
Методом ДСК определены температурные и энтальпийные характеристики процессов десольватации и
плавления как для N-оксидов, так и для их комплексов с протонодонорами.
Ключевые слова: N-оксиды, протонодоноры, термодинамические константы устойчивости,
дифференциальная сканирующая калориметрия
DOI: 10.1134/S0044460X19070102
Стирильные производные гетероциклических
связей. Ранее нами была изучена комплексо-
N-оксидов представляют несомненный научный и
образующая способность N-оксидов по отношению
практический интерес. Научный интерес обуслов-
к цинк(II)тетрафенилпорфирину
[5], их способ-
лен как особенностями передачи электронного
ность к фотоизомеризации
[6,
7], термическая
эффекта через стирильный фрагмент и наличием в
устойчивость N-оксидов в атмосфере воздухе [8] и
соединении гетероатомов, связанных семи-
их комплексов с цинк(II)тетрафенилпорфирином
полярной связью, так и способностью к транс/цис-
[9]. В связи со сложностью и неоднозначностью
изомеризации. Практический интерес к стириль-
передачи электронных эффектов в молекулах
ным производным N-оксидов пиридина обусловлен
стирильных N-оксидов, многообразия формиру-
потенциальной возможностью создания бифункци-
емых ими комплексов с протонодонорами, накоп-
ональных соединений для разработки материалов с
ленные к настоящему времени знания явно не
фотоуправляемой пропускной (фильтрующей)
достаточны для понимания (предсказания) соотно-
способностью, органических полупроводниковых
шения структура-свойство. Поэтому целью работы
приборов, таких как органические свето-
на данном этапе являлось сравнительное исследо-
излучающие диоды, органические полевые
вание взаимодействия стирильных производных N-
транзисторы и органические фотоэлементы [1-4].
оксидов пиридина с протонодонорами (бензойной
NO-Группа N-оксидов может рассматриваться как
и щавелевой кислотами).
потенциальная якорная группа, обеспечивающая,
иммобилизацию соединения на полимерном
В качестве объектов исследования в данной
(мембранном) носителе за счет образования Н-
работе были выбраны 4-замещенные стирильные
1051
1052
ЛЕБЕДЕВА и др.
λ, нм
λ, нм
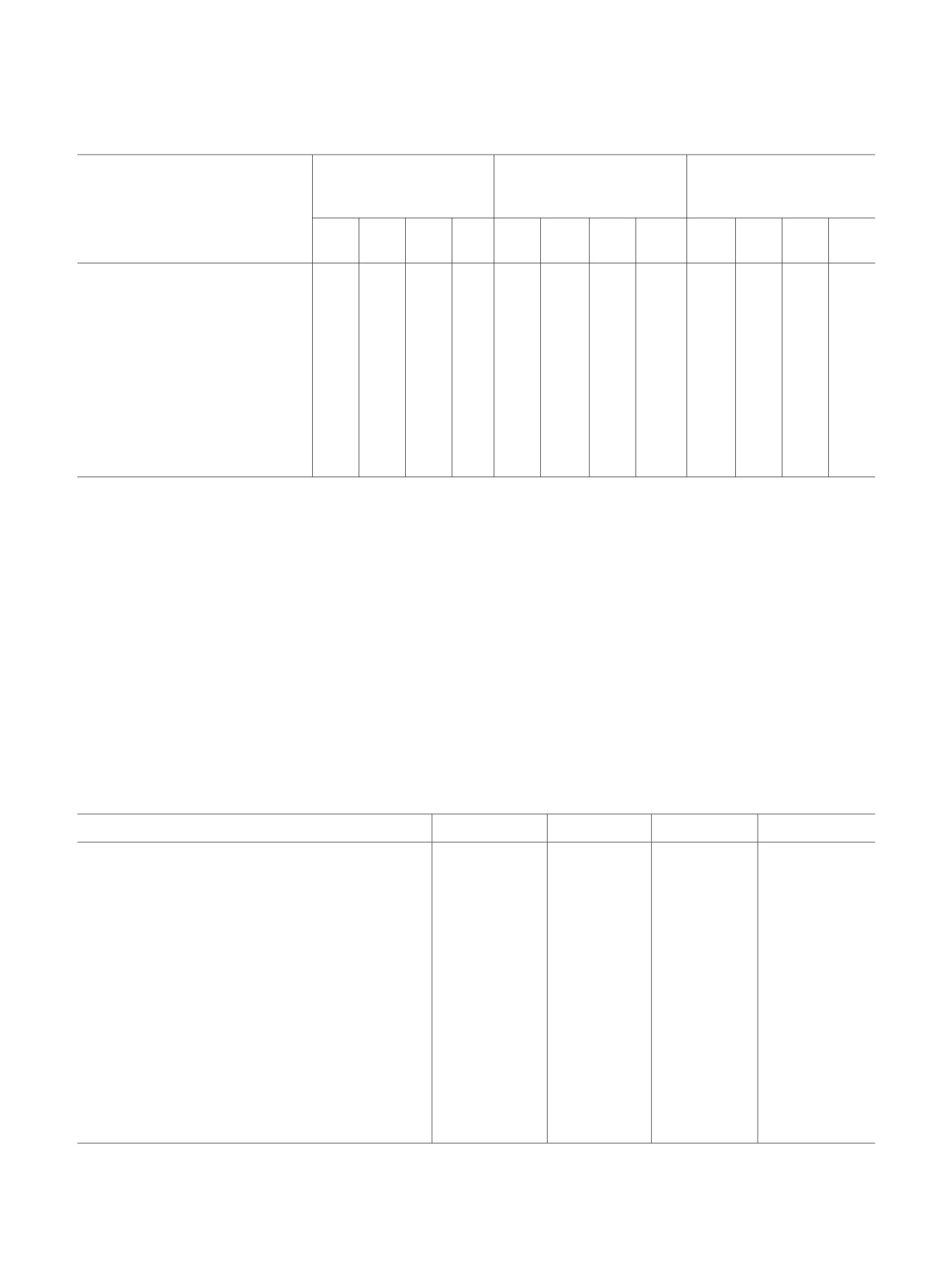
Рис. 2. Изменение ЭСП 4-стирилпиридин-1-оксида 1
(1) и 4-(4'-диметиламиностирил)пиридин-1-оксида 3 (2)
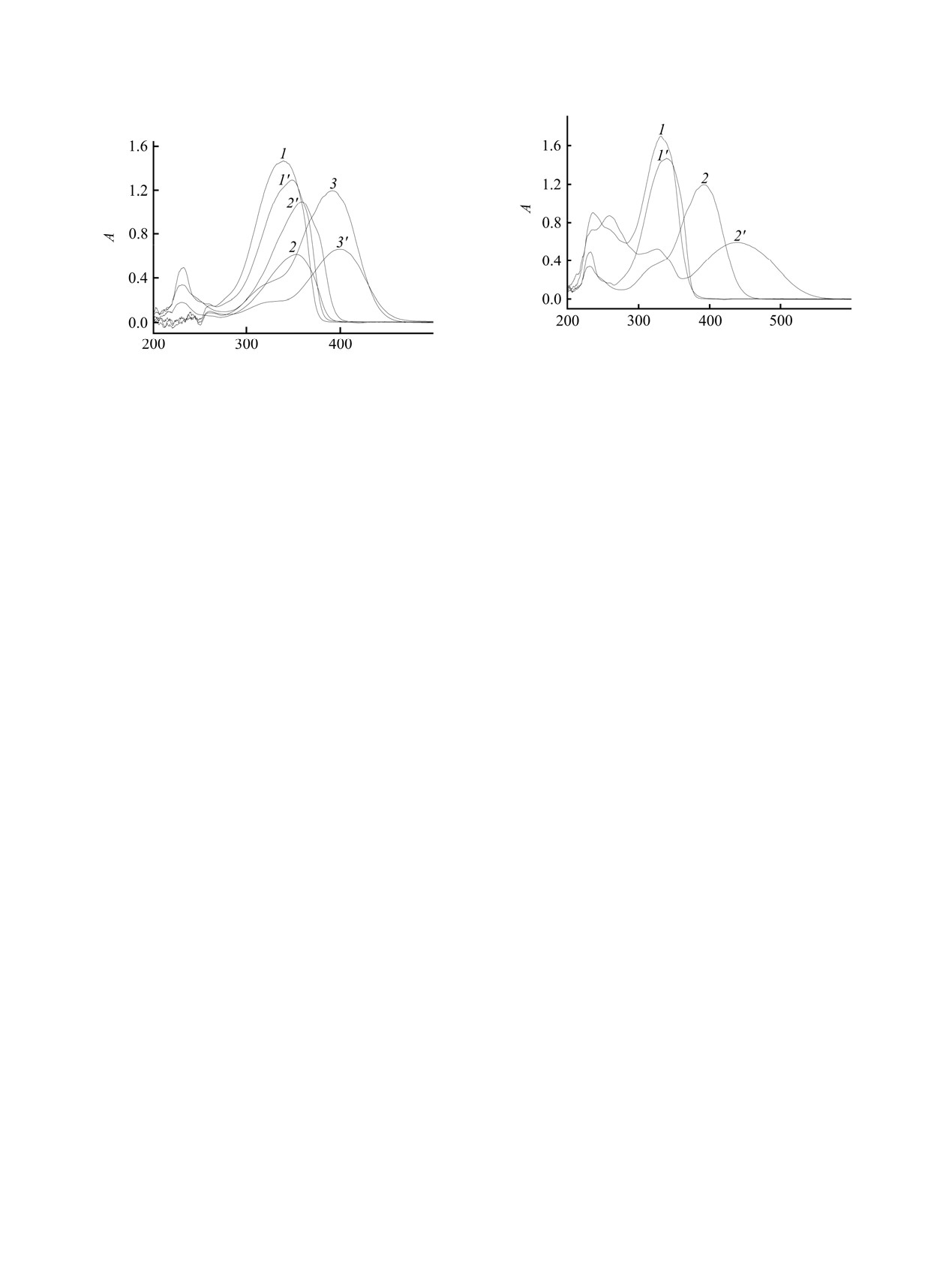
Рис. 1. ЭСП N-оксидов пиридина 1-3 в ацетонитриле
в ацетонитриле при добавлении щавелевой кислоты (1'
(1-3) и ДМСО (1'-3') соответственно.
и 2' соответственно).
производные N-оксида пиридина:
4-стирил-
ДМСО в пределах 1-2 нм положение длинно-
пиридина (1), 4-(4'-метоксистирил)пиридина (2) и
волновой полосы поглощения стирильных
4-(4'-диметиламиностирил)пиридина (3).
производных N-оксидов пиридина при добавлении
избытка кислоты сохраняется. В ацетонитриле в
Электронный спектр стирильных производных
случае соединений 1 и 3 наличие протонодонора
N-оксидов пиридина (рис. 1) содержит две полосы:
приводит к гипсохромному смещению длинно-
в области 225 нм - менее интенсивная полоса,
волновой полосы поглощения N-оксидов (рис. 2),
обусловленная n-π*-переходом, т. е. переносом
причем смещение полосы (Δλ) больше в случае 4-
заряда от атома кислорода N-оксидной группы в
(4'-диметиламиностирил)пиридин-1-оксида
3 по
ароматическое кольцо, и более интенсивная
сравнению со 4-стирилпиридин-1-оксидом 1. Пири-
длинноволновая полоса, связанная с π-π*-
дин-N-оксид 3 в отличие от стирилпиридин-N-
переходом [10], локализованная в случае 4-стирил-
оксида 1 имеет в молекуле два потенциальных
пиридин-1-оксида 1 и 4-(4'-метоксистирил)пири-
центра, способных к Н-связыванию [N(CH3)2 и NO-
дин-1-оксида 2 в области 340-355 нм и в случае 4-
группы].
(4'-диметиламиностирил)пиридин-1-оксида
3 при
λ = 395 нм. Видно, что электронные спектры
Если принять во внимание изменение в
поглощения N-оксидов демонстрируют существен-
положении дальневолновой полосы при введении
ный сольватохромный эффект, основная полоса
группы N(CH3)2 в молекулу 4-стирилпиридин-1-
поглощения стирильных производных N-оксидов
оксида 1 при переходе к N-оксиду 3 (рис. 1) и
пиридина в ДМСО смещена батохромно,
влияние взаимодействия последнего с протоно-
возможной причиной чего является большая
донором (рис. 2), то становится очевидным, что
полярность ДМСО по сравнению с ацетонитрилом,
данные эффекты разнонаправлены. Возможно, в
способствующая поляризации π-электронной
случае 4-(4'-диметиламиностирил)пиридин-1-оксида
системы и приводящая к возникновению π-π*-
3 Н-связывание осуществляется по аминогруппе N-
переходов при поглощении электромагнитного
оксида, при этом электронное воздействие данного
излучения меньшей энергии.
заместителя на ароматическую систему N-оксида
Оба растворителя являются апротонными и в
будет ослабляться. В подтверждение данной
дальнейшем были использованы в качестве
гипотезы можно привести литературные сведения
сольватирующей среды при титровании стириль-
о протонировании в водной среде 4-(4'-диметил-
ных производных N-оксидов пиридина бензойной
аминостирил)пиридин-1-оксида по аминогруппе
и щавелевой кислотой. Данные органические
[11], большее значение показателя основности
кислоты эффективно поглощают свет в области
N(CH3)2-группы
(4.3)
[12] по сравнению с NO-
n-π*-перехода исследуемых N-оксидов, поэтому
группой (1.43) [13]. С другой стороны, хорошо
спектральный анализ возможен только для
известно, что с реакции ацильного переноса и
длинноволновой полосы поглощения N-оксидов. В
взаимодействие с v-акцепторами идет по N-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩЕЙ СПОСОБНОСТИ
1053
Таблица 1. Термодинамические характеристики комплексообразования N-оксидов с бензойной и щавелевой кислотами
Ацетонитрил
ДМСО
N-Оксид
ΔH,
ΔS,
ΔG,
ΔH,
ΔS,
ΔG,
Т, K
Т, K
Дж/моль
Дж/(моль·K)
Дж/моль
Дж/моль
Дж/(моль·K)
Дж/моль
Щавелевая кислота
1
380
519
51
-14463
313
459
38
-10743
2
700
873
57
-15936
366
658
46
-12726
3
2441
8830
95
-18966
540
1497
53
-14094
Бензойная кислота
1
281
-200
46
-13720
212
-124
36
-10557
2
347
-200
48
-14231
248
-156
43
-12671
3
1212
-16229
4
-17301
626
-208
53
-15677
оксидной группе 4-(4'-диметиламиностирил)пири-
рителях. Вероятно, это обусловлено наличием
дин-1-оксида 3, кроме того она пространственно
второго энергозатратного равновесия, связанного с
более доступна для взаимодействия с протоно-
диссоциацией димеров щавелевой кислоты. В
донорными органическими кислотами, чем
подавляющем большинстве случаев процесс
третичный атом азота N(CH3)2-группы.
образования комплексов N-оксидов с исследу-
емыми органическими кислотами является
Иную спектральную картину демонстрирует 4-
энтропийно управляемым, что в общем случае не
(4'-метоксистирил)пиридин-1-оксид
2
при
характерно для образования Н-комплексов. В
взаимодействии с протонодонорами. Длинно-
менее полярном растворителе (ацетонитриле)
волновая π-π*-полоса N-оксида 2 при добавлении
термодинамическая устойчивость увеличивается в
избытка кислот смещается батохромно. Такой же
ряду: 1 < 2 < 3. Причем константа, вычисленная
направленности смещение (рис.
1) вызывает
для
комплексов
4-(4'-диметиламиностирил)
введение в молекулу стирильного производного N-
пиридин-1-оксида
3 в
2.5-3 раза превышает
оксида пиридина сильного электронодонорного
аналогичные значения, полученные для других N-
OCH3-заместителя, вызывающего увеличение
оксидов. Следует отметить, что константы
отрицательного остаточного заряда на N-оксидной
устойчивости комплексов коррелируют с σ-
группе. Вероятно, добавление органических кислот
константами заместителей (табл. 2), если полагать,
приводит к Н-связыванию NO-группы
4-(4'-
что Н-связывание N-оксида 3 с органическими
метоксистирил)пиридин-1-оксида
2, способствуя
кислотами осуществляется по N(CH3)2-группе, и
дальнейшему проявлению
+C-эффекта OCH3-
очень хорошо коррелируют с σ-константами,
группы, что и обусловливает значительный бато-
предложенными для стирильных производных N-
хромный сдвиг Δλ = 4 и 9 нм в случае бензойной и
оксидов пиридина, если полагать, что Н-
щавелевой кислот соответственно.
связывание N-оксида 3 с органическими кислотами
По результатам спектрофотометрического титро-
вания стирильных производных N-оксидов
пиридина органическими кислотами были получены
Таблица
2. Константы Гаммета для заместителей
константы термодинамической устойчивости обра-
N-оксидов 1-3
зующихся молекулярных Н-комплексов. Прове-
R2,
Заместитель
σ
Ссылка
дение исследований при различных температурах
CH3CN/ДМСО
позволило по уравнению Вант-Гоффа определить
N(CH3)2
-0.84
[14]
0.97/0.99
изменение энтальпии процесса. Полученные
термодинамические параметры представлены в
OCH3
-0.268
[15]
табл. 1. Как видно из представленных данных,
CH=CHC6H4N(CH3)2
-0.15
[16]
0.998/0.999
процесс взаимодействия N-оксидов со щавелевой
CH=CHC6H4OCH3
-0.03
[16]
кислотой протекает эндотермично в обоих раство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1054
ЛЕБЕДЕВА и др.
Таблица 3. Температурные характеристики термического разложения щавелевой кислоты, производных N-оксида
пиридина 1-3 и их комплексов со щавелевой кислотой состава 1:1
Деструкция комплекса
Деструкция N-оксида
Десольватация
(деструкция щавелевой
(после разрушения
кислоты)
комплекса)
Образец
tн,
tп,
tк,
Δm,
tн,
tп,
tк,
Δm,
tн,
tп,
tк,
Δm,
°С
°С
°С
%
°С
°С
°С
%
°С
°С
°С
%
Щавелевая кислота
60.0
74.9
80.6
26.8
154.2
172.7
177.3
73.1
Пиридин-1-оксид 1
105.7
118.1
124.6
3.81
259.0
274.9
282.1
80.6
Комплекс с пиридин-1-оксидом 1
178.4
199.7
209.8
30.4
256.7
272.5
280.3
53.3
Пиридин-1-оксид 2
265.9
282.9
294.3
76.9
Комплекс с пиридин-1-оксидом 2
174.1
199.6
209.3
26.4
250.8
271.5
282.7
55.8
Пиридин-1-оксид 3
285.1
297.3
305.8
69.1
Комплекс с пиридин-1-оксидом 3
58.7
80.6
111.4
2.0
181.0
197.9
211.3
24.4
265.5
280.1
301.2
39.4
229.1
236.8
241.8
9.9
осуществляется по NO-группе. Близость коэффи-
данном случае использовали ацетон (апротонный,
циентов множественной корреляции, а также
но более летучий растворитель). Выделенные и
ограниченное число N-оксидов не позволяет
высушенные образцы комплексов исследовали
однозначно судить о центрах специфической
термогравиметрически и методом ДСК. Для
сольватации N-оксидов.
сравнения были изучены и исходные соединения.
Полученные данные представлены в табл. 3. Так,
Следующим этапом работы были термо-
щавелевая кислота при нагревании теряет
химические исследования кристаллических комп-
кристаллизационную воду (до температуры 100°С),
лексов, которые были выделены из стехио-
а при достижении температуры 125°С подвергается
метрических растворов N-оксид-органическая
термодеструкции.
4-Стирилпиридин-1-оксид
1
кислота
(1:1) выпариванием растворителя при
начинает разрушаться при достижении 259°С. Н-
комнатной температуре. В качестве растворителя в
Комплексообразование 4-стирилпиридин-1-оксида
Таблица 4. Температурные и энтальпийные характеристики процессов десольватации, плавления и сублимации (в
случае щавелевой кислоты), полученные методом ДСК для щавелевой кислоты, стирильных производных N-оксида
пиридина 1-3 и их комплексов со щавелевой кислотой состава 1:1
Образец
tн, °С
tп, °С
tк, °С
ΔH, Дж/г
Щавелевая кислота
65.3
93.3
100.2
793.0
Пиридин-1-оксид 1
160.4
166.2
169.3
86.5
Комплекс с пиридин-1-оксидом 1
160.9
170.6
174.8
118.5
Пиридин-1-оксид 2
108.8
114.7
122.7
10.1
129.9
133.4
135.7
1.65
154.4
159.8
162.7
74.9
Комплекс с пиридин-1-оксидом 2
32.0
47.5
56.6
12.0
111.8
125.0
132.2
4.1
165.9
175.8
179.8
71.9
Пиридин-1-оксид 3
-
-
-
-
Комплекс с пиридин-1-оксидом 3
41.9
102.7
116.1
35.7
130.4
135.8
139.5
8.5
155.8
161.2
164.5
57.0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩЕЙ СПОСОБНОСТИ
1055
1 со щавелевой кислотой существенно повышает
взаимодействие стирильных производных N-
устойчивость кислоты к термолизу. Процесс
оксидов пиридина с моно- и дикарбоновой
разрушения комплекса начинается при 178°С и
кислотами. Установлено, что связывание N-оксида
протекает с одновременным разрушением кислоты.
стирилпиридина с органической кислотой по NO-
Образование H-комплексов кислоты с 4-стирил-
группе спектрально проявляется в гипсохромном
пиридин-1-оксидом 1 с увеличивает температуру
смещении максимума поглощения N-оксида.
плавления последнего, а также удельную теплоту
Введение электронодонорного заместителя в пара-
процесса (табл. 4). Увеличение удельной теплоты
положение N-оксида приводит к батохромному
плавления говорит о наличии достаточно
смещению полосы поглощения при связывании с
упорядоченной сетки Н-связей в исследуемой
протонодонорами. Причем в случае
4-(4'-
структуре комплекса.
диметиламиностирил)пиридин-1-оксида образуются
2 типа комплекса: за счет образования водородной
Деструкция комплекса
4-(4'-метоксистирил)-
связи между кислотой и NO- и N(CH3)2-группами
пиридин-1-оксида
2 со щавелевой кислотой
N-оксида.
Полученные
термодинамические
сопровождается
разрушением дикарбоновой
константы устойчивости молекулярных комп-
кислоты. Обращает на себя внимание тот факт, что,
лексов свидетельствуют о крайне низкой их
несмотря, на электронодонорный характер OCH3-
стабильности в растворах, в то время как в твердом
группы, термическая устойчивость комплекса
состоянии комплексы стабильны.
щавелевой кислоты с 4-(4'-метоксистирил)пиридин-
1-оксидом 2 оказалась несколько меньше (Тдес =
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
174°С) по сравнению с комплексом с 4-стирил-
пиридин-1-оксидом 1 (Тдес = 178°С). Возможным
Стирильные производные N-оксида пиридина
объяснением являются обнаруженные процессы,
1-3 были синтезированы по методике
[18].
протекающие в температурном интервале 110-120°С
Ацетонитрил (Lihrosolv, Merck), ацетон (Реахим,
для пиридин-1-оксида
2 и его комплекса со
марки ОСЧ), ДМСО (Реахим, марки ХЧ)
щавелевой кислотой в области 105-135°С, т. е. до
использовали без дополнительной очистки.
температур плавления. Следует отметить, что
Щавелевая (Реахим, марки Ч) и бензойная (Реахим,
данные процессы не сопровождаются убылью
ХЧ) кислоты были высушены в вакууме с
массы, и при последующих нагревах наблюдается
использованием сушильного пистолета Фишера.
изменение положения пиков на кривой ДСК. Они
Спектральные исследования выполнены на
смещаются в область более низких температур.
спектрометре AvaSpec-2048 (Avantes Gmbh,
Возможно, это переходы, связанные с конфор-
Нидерланды) в кварцевых кюветах с длиной
мационными изменениями в молекуле N-оксида
оптического пути 10 мм при температурах 20-40°С.
или полиморфным переходом. Аналогичное
Для регистрации спектральных изменений кювету
явление было обнаружено для 4-[4'-(4''-п-алкокси-
помещали в терморегулируемый кюветодержатель
пиперидино)стирил]пиридин-N-оксида [17]. Авторы
CUV-QPOD (Quantum Northwest, США).
отмечают, что данное соединение проявляет
Термодинамические характеристики комплексо-
жидкокристаллические свойства.
образования N-оксидов с органическими кисло-
Вид термограмм комплекса
4-(4'-диметил-
тами были определены на основании уравнения
аминостирил)пиридин-1-оксида
3 со щавелевой
Вант-Гоффа, как описано в работе [19].
кислотой существенно отличается от термограмм
Кристаллические образцы комплексов N-оксида
комплексов с другими N-оксидами. В области
со щавелевой кислотой были получены удалением
температур от 150 до 240°С регистрируются 2 пика
растворителя путем медленного выпаривания при
на кривой ДТГ. Мы полагаем, что первый отвечает
комнатной температуре до постоянной массы.
деструкции комплекса, образованного за счет NO-
группы, с одновременной деструкцией щавелевой
Исследования фазовых переходов в исходных
кислоты. Второй, при более высокой температуре,
N-оксидах, щавелевой кислоте и комплексах
связан с разрушением комплекса, образованного за
щавелевой кислоты с N-оксидами проводили с
счет N(CH3)2-группы, и также сопровождается
помощью дифференциального сканирующего
термолизом кислоты.
калориметра DSC 204 F1 (Netzsch Gerätebau GmbH,
Таким образом, проведено систематическое
Germany). Порошкообразные образцы помещали в
спектральное и термохимическое исследование
запрессованный
алюминиевый
тигель
с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1056
ЛЕБЕДЕВА и др.
проколотой крышкой, масса которых составляла
N 4. P. 804. doi 10.1134/s0036024418040052
4-5 мг. Измерения проводили в токе аргона
7. Кондратьева А.П., Лебедева Н.Ш., Губарев Ю.А.,
(70 мл/мин) со скорость нагрева и охлаждения
Павлычева Н.А., Андреев В.П., Альпер Г.А., Кумеев Р.С. //
10
град/мин по следующей программе.
ЖСХ. 2009. T. 50. № 4. C. 748; Kondratieva A.P.,
Lebedeva N.S., Gubarev Y.A., Pavlycheva N.A., Andre-
Исследуемые образцы охлаждали от комнатной
ev V.P., Alper G.A., Kumeev R.S. // J. Struct. Chem.
температуры до 5°С; изотермический режим при
2009. Vol. 50. N 4. P. 722. doi 10.1007/s10947-009-
5°С в течение 5 мин; нагрев до 180°С. Образцом
0110-3
сравнения был пустой алюминиевый тигель.
8. Губарев Ю., Лебедева Н., Андреев В., Нижник Я.,
Измерения проводили относительно базовой
Вьюгин А. // ЖОХ. 2007. T. 77. № 6. C. 1006; Guba-
линии, полученной для двух пустых тиглей при
rev Y.A., Lebedeva N.S., Andreev V.P., Nizhnik Y.P.,
аналогичной программе нагрева и охлаждения.
V’yugin A.I. // Russ. J. Gen. Chem. 2007. Vol. 77. N 6.
P. 1093. doi 10.1134/s1070363207060254
Термогравиметрический анализ исходных N-
9. Lebedeva N.S., Zielenkiewicz W., Utzig E., Gubarev Y.,
оксидов, щавелевой кислоты и комплексов
Andreev V., Nizhnik Y. P. // J. Therm. Anal. Calorim.
щавелевой кислоты с N-оксидами проводили на
2008. Vol. 91. N 2. P. 601. doi 10.1007/s10973-007-
термомикровесах TG 209 F1 (Netzsch Gerätebau
8444-6
GmbH, Germany). Порошкообразные образцы (4-
10. Teodorescu F., Nica S., Uncuta C., Bartha E., Filip P.I.,
7 мг) помещали в платиновый тигель и нагревали
Vanthuyne N., Roussel C., Mandi A., Toth L., Kurtan T.,
со скоростью
10 град/мин в динамической
Naubron J.V., Man I.C. // Tetrahedron Asym. 2015.
атмосфере сухого аргона расходом газа 30 мл/мин
Vol. 26. N 18-19. P. 1043. doi 10.1016/j.tetasy.2015.08.006
от комнатной температуры до 320-370°C.
11. Katritzky A., Boulton A., Short D. 596. // J. Chem. Soc.
1960. P. 2954. doi 10.1039/JR9600002954
КОНФЛИКТ ИНТЕРЕСОВ
12. Garvey R.G., Nelson J.H., Rasdale R.O. // Coord.
Chem. Rev. 1968. Vol. 3. N 3. P. 375. doi 10.1016/
Авторы заявляют об отсутствии конфликта
S0010-8545(00)80123-X
интересов.
13. Рыбаченко В., Шредер Г., Чотий К., Коваленко В.,
СПИСОК ЛИТЕРАТУРЫ
Редько А., Герчик Б. // ЖФХ. 2007. T. 81. № 10.
C. 1804. Rybachenko V.I., Shroeder G., Chotii K.Yu.,
1. Tang C.W., VanSlyke S.A., Chen C. // J. Appl. Phys.
Kovalenko V.V., Red’ko A.N., Gierzyk B. // Russ. J.
1989. Vol. 65. N 9. P. 3610. doi 10.1063/1.343409
Phys. Chem. (A). 2007. Vol. 81. N 10. P. 1608. doi
2. Markov R., Plekhanov A., Rautian S., Safonov V.,
10.1134/S0036024407100111
Orlova N., Shelkovnikov V., Volkov V. // Opt. Spectrosc.
14. Беккер Г. Введение в электронную теорию органи-
1998. Vol. 85. P. 588.
ческих реакций. М.: Мир, 1977. С. 658.
3. Burroughes J.H., Bradley D.D.C., Brown A.R., Marks R.N.,
15. Пальм В.А. Основы количественной теории органи-
Mackay K., Friend R.H., Burns P.L., Holmes A.B. //
ческих реакций. Л.: Химия, 1977. С. 360.
Nature. 1990. Vol. 347. P. 539. doi 10.1038/347539a0
16. Андреев В., Нижник Я., Лебедева Н. // ЖОрХ. 2008.
4. Friend R.H., Gymer R.W., Holmes A.B., Burroughes J.H.,
T.
44.
№ 6. C. 914; Andreev V.P., Nizhnik Ya.P.,
Marks R.N., Taliani C., Bradley D.D.C., Santos D.A.D.,
Lebedeva N.Sh. // Russ. J. Org. Chem. 2008. Vol. 44.
Brédas J.L., Lögdlund M., Salaneck W.R. // Nature.
N 6. P. 906. doi 10.1134/S1070428008060213
1999. Vol. 397. P. 121. doi 10.1038/16393
17. Tournilhac F., Nicoud J., Simon J., Weber P., Guillon D.,
5. Gubarev Y., Lebedeva N.S., Golubev S., Andreev V.,
Skoulios A. // Liq. Cryst. 1987. Vol. 2. N 1. P. 55. doi
Kumeev R., Vyugin A., Alpera G. // Macroheterocycles.
10.1080/02678298708086637
2013. Vol. 6. N 1. P. 106. doi 10.6060/mhc120986g
18. Тицкий Г., Туровская М. // ЖОрХ. 1992. T. 28. № 9.
6. Губарев Ю., Лебедева Н., Юрина Е., Андреев В.,
C. 1911.
Вьюгин А. // ЖФХ. 2018. T. 92. № 4. C. 665; Guba-
19. Xiao Q., Huang S., Liu Y., Tian F.-F., Zhu J.-C. // J.
rev Y.A., Lebedeva N.S., Yurina E.S., Andreev V.P.,
Fluoresc. 2008. Vol. 19. N 2. P. 317. doi 10.1007/
V’yugin A.I. // Russ. J. Phys. Chem. (A). 2018. Vol. 92.
s10895-008-0418-y
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩЕЙ СПОСОБНОСТИ
1057
A Study of Complexing Ability of Hetaryl N-Oxides Towards
Proton Donor Compounds
N. Sh. Lebedevaa, Yu. A. Gubareva, *, E. S. Yurinaa, S. S. Guseinova,
A. I. Vyugina, and V. P. Andreevb
a G.A. Krestov Institute of Solutions Chemistry of the Russian Academy of Sciences,
ul. Akademicheskaya 1, Ivanovo, 153045 Russia
*e-mail: gua@isc-ras.ru
b Petrozavodsk State University, Petrozavodsk, Russia
Received December 12, 2018; revised December 12, 2018; accepted February 22, 2019
The interaction of styryl derivatives of pyridine N-oxides with proton donors in various solvents was studied.
Electron spectroscopy and thermogravimetric analysis were used to determine spectral and thermochemical
characteristics of the molecular complexes. The dependencies of the thermodynamic parameters of the
complexes on the N-oxides structure and the solvating medium were established. The DSC method was used to
determine the temperature and enthalpy characteristics of the desolvation and melting processes for both N-
oxides and their complexes with proton donors.
Keywords: N-oxides, proton donors, thermodynamic stability constants, differential scanning calorimetry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019