ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1096-1100
УДК 546.07;547.442
ТВЕРДОФАЗНОЕ ВЗАИМОДЕЙСТВИЕ ХЛОРИДА МЕДИ(I)
С β-ДИКЕТОНАТАМИ НАТРИЯ ПРИ МЕХАНИЧЕСКОЙ
АКТИВАЦИИ: ОБРАЗОВАНИЕ НАНОДИСПЕРСНОЙ
МЕТАЛЛИЧЕСКОЙ МЕДИ
© 2019 г. В. Д. Махаев*, Л. А. Петрова, Ю. М. Шульга
Институт проблем химической физики Российской академии наук,
пр. Академика Семенова 1, Черноголовка, 142432 Россия
*e-mail: vim@icp.ac.ru
Поступило в Редакцию 29 декабря 2018 г.
После доработки 19 февраля 2019 г.
Принято к печати 23 марта 2019 г.
Твердофазное взаимодействие хлорида меди(I) с β-дикетонатами натрия при механической обработке на
вибрационной шаровой мельнице приводит к диспропорционированию CuCl с образованием
соответствующего β-дикетоната меди(II) и высокореакционноспособных рентгеноаморфных наночастиц
металлической меди. Изучено влияние условий реакции на ход процесса и некоторые свойства
активированных смесей.
Ключевые слова: механическая активация, твердофазный синтез, β-дикетонаты меди(II), наноматериалы,
нанодисперсная медь
DOI: 10.1134/S0044460X19070151
В настоящее время в связи с развитием
исследовано твердофазное механохимическое
«зеленой» химии большой интерес вызывают
взаимодействие хлорида меди(I) с β-дикетонатами
процессы взаимодействия твердых исходных
натрия. Обнаружено, что в результате реакции
реагентов в отсутствие растворителя
[1]. Для
происходит образование β-дикетонатов меди(II) и
ускорения таких процессов во многих случаях
высокореакционноспособных рентгеноаморфных
используется метод механической активации [2-5].
наночастиц металлической меди.
Ранее нами было показано, что механическая
В отличие от твердофазного механохими-
активация смесей хлорид переходного металла-
ческого взаимодействия ацетилацетоната натрия с
β-дикетонат щелочного металла приводит к
CuCl2, которое в условиях эксперимента
появлению на термограммах активированных
практически количественно протекает за 60 мин
смесей нового экзотермического эффекта, соответ-
[7], реакция с CuCl проходит значительно
ствующего взаимодействию диспергированных и
медленнее. Первоначально серый цвет реакцион-
тонко перемешанных в результате механической
ной смеси после
1 ч активации приобретает
обработки реагентов, приводящему к образованию
зеленоватый оттенок, который с увеличением
конечных продуктов (β-дикетонатов металлов) при
длительности воздействия постепенно усиливается.
повышении температуры или при продолжении
механического воздействия
[6-8]. В частности,
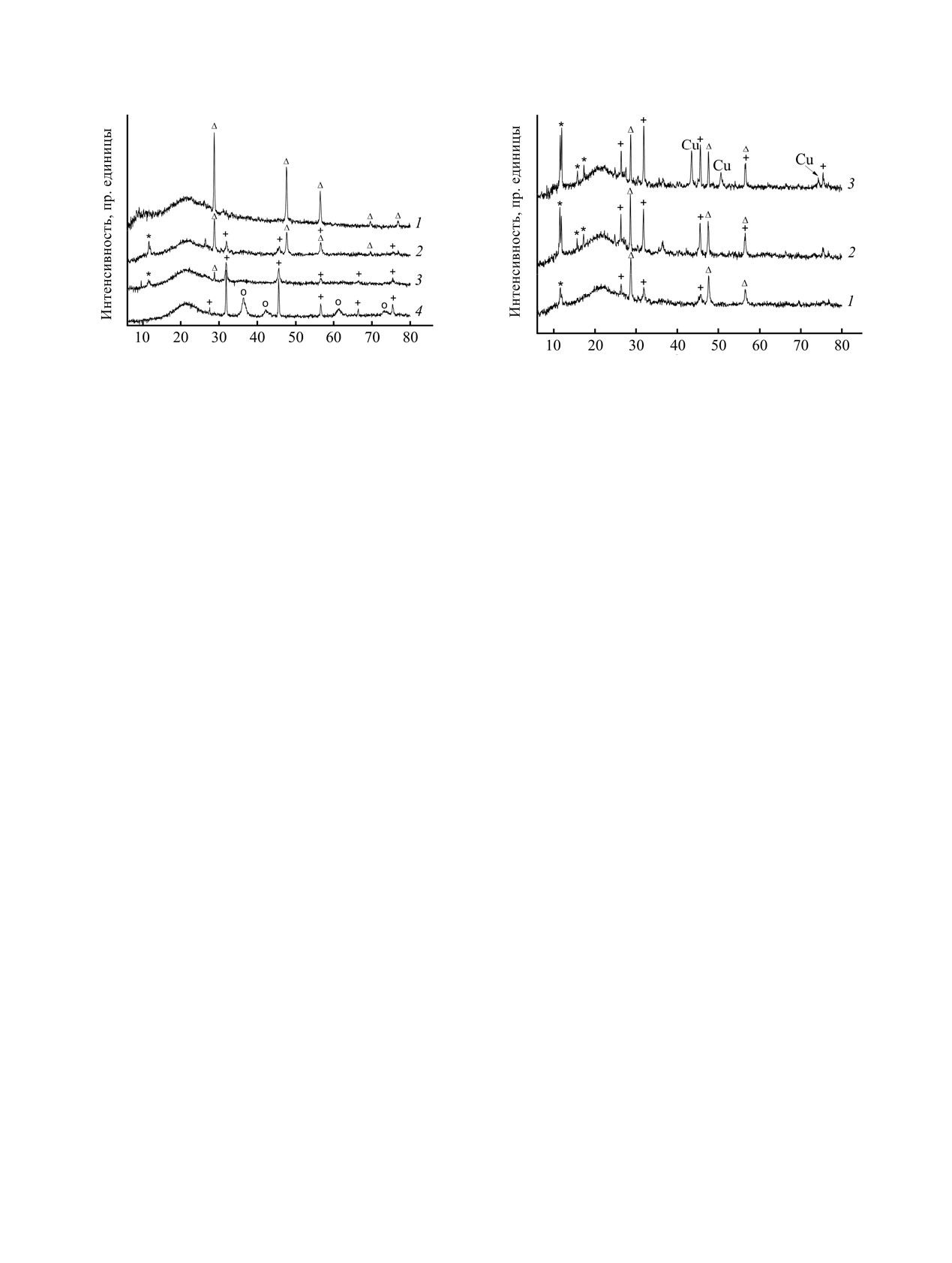
На рентгенограммах реакционных смесей после
твердофазная реакция хлорида меди(II) с β-дикето-
15-30 мин механической обработки наблюдаются
натами натрия приводит к образованию продуктов
интенсивные рефлексы CuCl. Интенсивность
реакции обмена
- β-дикетонатов меди(II)
- с
рефлексов исходного Na(acac) находится на уровне
выходом до 90% [7].
шума. При активации в течение 1-10 ч появляются
и постепенно усиливаются рефлексы продуктов
В данной работе с целью изучения влияния
реакции
- NaCl и ацетилацетоната меди(II),
степени окисления меди на ход процесса нами
интенсивность рефлексов CuCl уменьшается.
1096
ТВЕРДОФАЗНОЕ ВЗАИМОДЕЙСТВИЕ ХЛОРИДА МЕДИ(I)
1097
2θ, град
2θ, град
Рис. 2. Влияние температурного воздействия на состав
Рис. 1. Рентгенограммы реакционной смеси Na(acac) +
активированной в течение 4 ч смеси Na(acac)-CuCl.
CuCl в зависимости от длительности механической
1
- рентгенограмма смеси после
4 ч активации
активации. 1 - 0.5, 2 - 3, 3 - 10 ч, 4 - остаток после
(комнатная температура); 2 - после 4 ч + прогрев до
возгонки Cu(acac)2 и воздействия воздуха. + -NaCl, Δ -
100°С; 3 - после 4 ч + прогрев при ~ 200°С. + - NaCl,
CuCl, * - Cu(acac)2, ○ - Cu2O.
Δ - CuCl, * - Cu(acac)2.
Следует отметить значительное уширение
интенсивности рефлексов NaCl и Cu(acac)2. В связи
рефлексов исходного CuCl и образующегося NaCl
с этим, влияние термического воздействия на
в активированных смесях. После 8-10 ч активации
фазовый состав активированных смесей было
на рентгенограммах присутствуют широкий пик в
изучено нами более подробно. По данным
области 2θ ~ 20°, интенсивные рефлексы NaCl,
комплексного
термического
исследования,
рефлексы Cu(acac)2 и следы непрореагировавшего
механическая обработка смеси Na(acac) и CuCl
CuCl (рис. 1). При воздействии даже следовых
приводит к появлению на кривых ДТА нового
количеств воздуха на активированные смеси на
пика, относящегося к экзотермическому эффекту,
рентгенограммах появляются интенсивные уширен-
максимум которого смещается от 160°С при 30 мин
ные рефлексы Cu2O.
до
~70°С при
2-4 ч активации. Интегральная
интенсивность
данного пика с увеличением
В ИК спектрах реакционных смесей с
длительности активации постепенно возрастает
увеличением длительности активации наблю-
примерно на порядок и имеет наибольшую
дается смещение, уширение и/или исчезновение
величину после 3-4 ч активации, затем начинает
полос поглощения ацетилацетоната натрия. Так,
уменьшаться, и после
8 ч активации пик
наиболее интенсивная узкая полоса поглощения
экзоэффекта на кривых ДТА не наблюдается.
Na(acac)
(1408 см-1) после
10 ч активации
Указанному экзоэффекту соответствуют умень-
значительно уширяется и смещается до 1386 см-1,
шение интенсивности полос поглощения Na(acac),
но не исчезает полностью, т. е. в механохими-
появление и увеличение интенсивности полос
ческом режиме за указанное время реакция
поглощения Cu(acac)2 в ИК спектрах, уменьшение
протекает не до конца. В ходе активации в
интенсивности рефлексов CuCl и увеличение
спектрах реакционных смесей появляются полосы
интенсивности рефлексов NaCl на рентгено-
поглощения ацетилацетоната меди(II), ИК спектр
граммах. На термограммах реакционных смесей
которого детально изучен [9, 10], и после 4 ч
присутствует также пик эндотермического эффекта
активации эти полосы становятся наиболее
с потерей массы при
230-240°С (плавление и
интенсивными в спектре. Отметим, что полоса
возгонка Cu(acac)2 [11]).
поглощения νCu-O при ~ 455 см-1 появляется уже
через 30 мин активации.
Возгонкой в вакууме из активированных смесей
Прогрев при 100°С приводит к изменению цвета
выделен Cu(acac)2. Конверсия CuCl в Cu(acac)2
активированных смесей - из светло-зеленоватых
возрастает с увеличением длительности активации
они становятся коричневато-серыми, к дальней-
от ~ 16% после 1 ч до ~ 70% от теоретической
шему ослаблению рефлексов CuCl и росту
после 4 ч. Остаток после выделения Cu(acac)2 из
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1098
МАХАЕВ и др.
реакционных смесей, по данным рентгенофазового
жение согласуется с литературными данными. Так,
анализа, состоит из NaCl и следовых количеств
нанодисперсная медь с размером частиц ~ 30 нм
CuCl. Однако после прогрева реакционных смесей
дает
четкие
уширенные рефлексы на
или остатков после отделения Cu(acac)2 до ~200°С
рентгенограммах
[16]. Полученные методом
на рентгенограммах появляются интенсивные
контролируемого напыления нанофракталы меди
уширенные рефлексы металлической меди (рис. 2),
размером ~ 3 нм в течение 300 с полностью
оценка размеров кристаллитов которой по формуле
окисляются на воздухе до Cu2O (данные РФА для
Шеррера
[12] дает величину
~
20-30 нм.
этих образований не приведены)
[14]. Присут-
Полученные данные показывают, что при
ствующие в исследуемых нами реакционных
активации смесей CuCl-Na(acac) происходит
смесях исходные и/или конечные продукты,
взаимодействие компонентов с образованием
вероятно, играют роль разбавителя и препятствуют
продуктов реакции диспропорционирования:
агломерации
образующихся
наночастиц
металлической меди в ходе процесса. Нано-
2CuCl + 2Na(acac) → Cu(acac)2 + 2NaCl + Cu.
материалы, получаемые из широко распро-
Аналогично, с образованием β-дикетоната
страненных и недорогих металлов (в частности
меди(II) и металлической меди CuCl механо-
меди), вызывают значительный интерес в связи с
химически взаимодействует с трифторацетилацето-
возможностями их использования в качестве
натом, гексафторацетилацетонатом и дипивалоил-
альтернативы дорогостоящим катализаторам на
метанатом натрия. В качестве примера в
основе редких и благородных металлов, исполь-
экспериментальной части описана реакция CuCl с
зуемым во многих промышленных химических
гексафторацетилацетонатом натрия. В ИК спектрах
процессах [17]. Морфологические особенности и
полученных β-дикетонатов меди присутствуют
реакционная способность наночастиц метал-
характерные полосы поглощения валентных
лической меди, образующихся в условиях
… C) хелатного кольца в
твердофазной механохимической реакции, будут
области 1500-1700 см-1. Природа β-дикетонатного
предметом нашего дальнейшего исследования.
лиганда оказывает существенное влияние на
Таким образом, твердофазные механохими-
частоту указанных колебаний. С уменьшением
ческие реакции β-дикетонатов натрия с хлоридами
электронодонорных и увеличением электроно-
меди(I/II) проходят с промежуточным образо-
акцепторных свойств лигандов частота колебаний
ванием активированной смеси, экзотермическое
… C);
взаимодействие компонентов которой приводит к
1554,
… O) см-1] к Cu(HFacac)2 [1620
образованию конечных продуктов - β-дикетонатов
… C); 1652, 1566 ν(C—…O) см-1], что соответствует
меди(II). При переходе от CuCl2 к CuCl
литературным данным [9, 13].
длительность реакции значительно возрастает, что,
Отсутствие рефлексов металлической меди на
видимо, связано с меньшей реакционной способ-
рентгенограммах
активированных
смесей
ностью CuCl и различием в механизмах реакций: с
указывает на ее рентгеноаморфное состояние, т. е.
хлоридом меди(II) происходит реакция обмена, а с
в результате реакции в мягких условиях, при
хлоридом меди(I) обмен сопровождается диспро-
температуре ниже
100°С образуются нано-
порционированием исходного CuCl или про-
размерные частицы металлической меди, которые
межуточных продуктов и образованием метал-
легко окисляются в присутствии следов кислорода.
лической меди. Интересной особенностью
Высокая реакционная способность нанодисперсной
исследуемой реакции является образование
меди соответствует литературным данным [14].
высокореакционной нанодисперсной рентгено-
Уширение рефлексов Cu2O, образовавшегося в
аморфной металлической меди в мягких условиях.
реакционной смеси на воздухе, соответствует
размеру кристаллитов
~8 нм
[12]. Учитывая
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
меньшую плотность Cu2O (6 г/см3) по сравнению с
металлической медью
(8.94
г/см3)
[15] и
β-Дикетонаты натрия получали по описанным
возможность укрупнения частиц Cu2O при
ранее методикам
[7]. Товарный препарат CuCl
окислении первоначально образующихся частиц
(ЧДА) промывали 0.2 н. HCl, спиртом и сушили в
меди, можно предполагать, что они имеют
вакууме
[18]. Приготовление смесей исходных
значительно меньшие размеры. Это предполо-
веществ, образцов для физико-химических исследо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
ТВЕРДОФАЗНОЕ ВЗАИМОДЕЙСТВИЕ ХЛОРИДА МЕДИ(I)
1099
ваний, другие операции с чувствительными к
подвергали механической обработке на вибрацион-
воздуху веществами проводили в боксе в
ной шаровой мельнице в течение 4 ч. Из 0.8891 г
атмосфере азота.
реакционной смеси возгонкой в вакууме
(температура внешнего нагрева
160-170°С,
Механическую обработку реакционных смесей,
давление ~0.1 мм рт. ст.) получили 0.362 г Cu(acac)2
рентгенофазовый анализ, термические исследо-
в виде кристаллов синего цвета [конверсия CuCl в
вания исходных веществ, реакционных смесей и
Cu(acac)2 ~70%], т. пл. 228-230°С (т. пл. 230°С [11]).
продуктов реакций проводили, как описано ранее
ИК спектр, ν, см-1: 2953сл, 2919 с, 2850 ср, 1574 с
[8]. Твердофазные реакции проводили в реакторе
… O), 1463 с
из нержавеющей стали объемом
85 см3. Для
… O + C-H), 1419 сл, 1367 пл, 1360 с, 1275 с,
проведения механической обработки в реактор в
1015 ср, 931ср, 780 ср, 684 сл, 652 сл, 610 сл, 452 ср
атмосфере азота загружали взвешенные количества
(Cu-O), 429 сл (Cu-O). Найдено, %: C 45.40; H
исходных веществ и активирующую насадку из
5.66; Cu 23.9. C10H14O4Cu. Вычислено, %: C 45.88;
20 стальных шариков диаметром
12.3 мм
H 5.39; Cu 24.27.
(~150 г). Реактор герметизировали, устанавливали
на вибрационную шаровую мельницу и подвергали
Взаимодействие CuCl с гексафторацетил-
вибрации (амплитуда 11 мм, частота 12 Гц) в
ацетонатом натрия (NaHFacac). Смесь 0.5243 г
течение заданного времени. Затем реактор
(5.296 ммоль) CuCl и
1.2475 г
(5.423 ммоль)
вскрывали и отделяли реакционную смесь.
NaHFacac активировали аналогично вышеописан-
ному в течение 4 ч. Из 0.2461 г активированной
β-Дикетонаты меди выделяли возгонкой при
смеси возгонкой при 120°С в вакууме (~0.1 мм
нагревании реакционной смеси в вакууме. Часть
рт. ст.) получали 0.159 г Cu(HFacac)2 в виде синих
реакционной смеси использовали для физико-
кристаллов [конверсия CuCl в Cu(HFAcac)2 ~68%],
химических исследований (ИК, РФА, термические
т. пл. 96°C (т. пл. 95-98°C [19]). ИК спектр, ν, см-1:
свойства). Продукты реакций идентифицировали
… O),
по данным химического анализа и физико-
1538 сл, 1464 ср, 1377 сл (C-F), 1258 с (C-F), 1206
химических методов исследования. ИК спектры
оч. с. (C-F), 1148 с ( C-H) , 813 ср (C-F), 746 ср (C-
регистрировали на спектрометре Bruker Vertex 70v.
CF3),
680,
598,
527. Найдено Cu,
%:
13.12.
Рентгенофазовый анализ проводили на дифракто-
C10H2F12O4Cu. Вычислено Cu, %: 13.30.
метре АДН-2-01 (CuKα-излучение, Ni-фильтр) с
использованием программы для автоматизации
ФОНДОВАЯ ПОДДЕРЖКА
процессов получения, обработки и анализа данных
X-RAY, разработанной для рентгеновских ди-
Работа выполнена в рамках государственного
фрактометров серии ДРОН. Фазовый состав
задания (№ госрегистрации 01201361869).
реакционных смесей определяли с использованием
базы данных JCPDS International Centre for
КОНФЛИКТ ИНТЕРЕСОВ
Diffraction Data: карты
04-0836 (Cu),
05-0628
(NaCl), 06-0344 (CuCl), 34-1354 (Cu2O), 11-800
Авторы заявляют об отсутствии конфликта
[Cu(acac)2]. Термические исследования проводили
интересов.
на приборе Derivatograph Q-1500M System F.
Paulik, J. Paulik, L. Erdey (МОМ, Венгрия) в
СПИСОК ЛИТЕРАТУРЫ
температурном интервале
20-500°С, скорость
нагревания
10
град/мин,
масса образца
1. Cave G.W.V., Raston C.L., Scott J.L. // J. Chem. Soc.
~100 мг. Химический анализ, термические
Chem. Commun. 2001. N 21. P. 2159. doi 10.1039/
исследования, регистрация рентгенограмм и ИК
B106677N
спектров проведены в Аналитическом центре
2. Аввакумов Е.Г. // Механические методы активации
коллективного пользования Института проблем
химических процессов. Новосибирск: Наука, 1986.
297 с.
химической физики РАН.
3. Болдырев В.В. // Усп. хим. 2006. Т. 75. № 3. С. 203;
Взаимодействие CuCl с Na(acac). Смесь
Boldyrev V.V. // Russ. Chem. Rev. 2006. Vol. 75. N 3.
0.7130 г
(7.20 ммоль) CuCl и
0.8794 г
P. 177. doi 10.1070/RC2006v075n03ABEH001205
(7.20 ммоль) Na(acac) в присутствии
150 г
4. Beyer M.K., Clausen-Schaumann H. // Chem. Rev.
активирующей насадки (металлических шариков)
2005. Vol. 105. N 8. P. 2921. doi 10.1021/cr030697h
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1100
МАХАЕВ и др.
5. Rightmire N.R., Hanusa T.P. // Dalton Trans. 2016.
11. Мошьер Р., Сиверс Р. Газовая хроматография хелатов
Vol. 45. N 6. P. 2352. doi 10.1039/c5dt03866a
металлов. М.: Мир, 1967. С. 159.
12. Гусев А.И. Наноматериалы, наноструктуры, нано-
6. Борисов А.П., Петрова Л.А., Карпова Т.П., Махаев В.Д. //
технологии. М.: Физматлит. 2005. С. 169.
ЖНХ. 1996. Т. 41. № 3. C. 411; Borisov A.P., Petro-
13. Morris M.L., Moshier R.W., Sievers R.E. // Inorg. Chem.
va L.A., Karpova T.P., Makhaev V.D. // Russ. J. Inorg.
1963. Vol. 2. N 2. P. 411. doi 10.1021/ic50006a042
Chem. 1996. Vol. 41. N 3. P. 394.
14. Shyamal Mondat, Bhattacharyya S.R. // RSC Adv.
7. Петрова Л.А., Борисов А.П., Алешин В.В., Махаев В.Д. //
2015. Vol. 5. N 120. P. 99425. doi 10.1039/c5ra20694d
ЖНХ. 2001. Т. 46. № 10. С. 1655; Petrova L.A.,
15. Справочник химика / Под ред. Б.П. Никольского. Л.,
Borisov A.P., Aleshin V.V., Makhaev V.D. // Russ. J.
М.: Химия, 1964. Т. 2. С. 123.
Inorg. Chem. 2001. Vol. 46. N 10. P. 1501.
16. Suryanarayanan R., Frey C.A., Sastry S.M.L., Waller B.E.,
8. Махаев В.Д., Петрова Л.А. // ЖОХ. 2017. Т. 87.
Bates S.E., Buhro W.E. // J. Mater. Res. 1996. Vol. 11.
Вып. 6. С. 881; Makhaev V.D., Petrova L.A. // Russ. J.
N 2. P. 439. doi 10.1557/JMR.1996.0053
Gen. Chem. 2017. Vol. 87. N 6. P. 1105. doi 10.1134/
17. Gawande M.B., Goswami A., Felpin F-X., Asefa T.,
S1070363217060019
Huang X., Silva R., Zou X., Zboril R., Varma R.S. //
9. Nakamoto K., McCarthy P.J., Martell A.E. // J. Am.
Chem. Rev. 2016. Vol. 116. N 6. P. 3722. doi 10.1021/
Chem. Soc. 1961. Vol. 83. N 6. P. 1272. doi 10.1021/
acs.chemrev.5b00482
ja01467a003
18. Карякин Ю.В., Ангелов И.И. Чистые химические
10. Mikami M., Nakawaga I., Shimanouchi T.
//
вещества. М.: Химия, 1974. С. 240.
Spectrochim. Acta (A). 1967. Vol. 23. N 4. P. 1037. doi
19. Bertrand J.A., Kaplan R.J. // Inorg. Chem. 1966. Vol. 5.
10.1016/0584-8539(67)80027-8
N 3. P. 489. doi 10.1021/ic50037a039
Solid Phase Interaction of Copper(I) Chloride
with Sodium β-Diketonates under Mechanical Activation:
Formation of Nanosized Metallic Copper
V. D. Makhaev*, L. A. Petrova, and Yu. M. Shulga
Institute of Problems of Chemical Physics, Russian Academy of Sciences,
pr. Akademika Semenova 1, Chernogolovka, 142432 Russia
*e-mail: vim@icp.ac.ru
Received December 29, 2018; revised February 19, 2019; accepted March 23, 2019
The solid-phase interaction of copper(I) chloride with sodium β-diketonates under mechanical activation in a
vibratory ball mill leads to disproportionation of CuCl with the formation of the corresponding copper(II) β-
diketonate and highly reactive X-ray amorphous metallic copper nanoparticles. The influence of the reaction
conditions on the process and some properties of activated mixtures was studied.
Keywords: mechanical activation, solid-phase synthesis, copper(II) β-diketonates, nanomaterials, nanosized
copper
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019