ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 7, с. 1140-1144
ПИСЬМА В
РЕДАКЦИЮ
УДК 547.745;547.751
СИНТЕЗ И СТРОЕНИЕ
4-ГЕТ(АРИЛ)-3,5,5-ТРИМЕТОКСИКАРБОНИЛ-
2-ПИРРОЛИДОНОВ
© 2019 г. Н. В. Городничева, Е. С. Остроглядов, О. С. Васильева, С. В. Макаренко*
Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 28 февраля 2019 г.
После доработки 28 февраля 2019 г.
Принято к печати 7 марта 2019 г.
Конденсацией 2-гет(арил)-1,1-диметоксикарбонилэтенов с ацетиламиномалоновым эфиром синтезированы
(3R*,4S*)-4-(4-метоксифенил)-,
(3R*,4S*)-4-(3,4-метилендиоксифенил)-,
(3R*,4S*)-4-(4-диметиламино-
фенил)-, (3R*,4S*)-4-(2-фурил)-, (3R*,4S*)-4-(индол-3-ил)-, (3R*,4S*)-4-(1-метилиндол-3-ил)- и (3R*,4S*)-
4-(1-бензилиндол-3-ил)-3,5,5-трис(метоксикарбонил)-2-пирролидоны.
Ключевые слова: гетероциклические соединения, 2-пирролидон, эфиры 2-пирролидонкарбоновых кислот
DOI: 10.1134/S0044460X19070187
Известно, что эфиры пирролидонкарбоновых
новых представителей 4-гет(арил)-2-пирролидон-
кислот являются весьма удобными и перспектив-
3,5,5-трикарбоксилатов. Соединения 1-7 синтези-
ными прекурсорами для получения биологически
рованы по методике [6]. Оказалось, что только
активных производных γ-аминомасляной [1-3] и
соединения 1, 2 и 4 с ацетиламиномалоновым
глутаминовой [4, 5] кислот. Например, 4-гет(арил)-
эфиром в описанных нами условиях (эквимольное
2-пирролидон-3,5,5-трикарбоксилаты
являются
соотношение реагентов, температура реакции 10-
ключевыми соединениями в синтезе гидрохло-
15°С и выдержка реакционной массы в течение 2 ч
ридов (2R*,3R*)-3-(гет)арилглутаминовых кислот,
[5]) образуют ранее неизвестные 1-ацетил-3,5,5-
среди которых выявлены вещества, обладающие
триметоксикарбонил-2-пирролидоны 8, 9 и 11 с
широким спектром фармакологической активности
выходами 65-77% (схема 1). Реакции диметокси-
в сочетании с относительно низкой токсичностью
карбонилэтенов 3, 5-7 с ацетиламиномалоновым
[5]. Несомненный интерес в этом отношении
эфиром протекают в иных условиях и требуют
представляют изучаемые нами реакции соответ-
использования 1.5-кратного избытка ацетиламино-
ствующих 1,1-диметоксикарбонилэтенов с ацетил-
малонового эфира и увеличения выдержки
аминомалоновым эфиром, так как они протекают
реакционной смеси до 4 ч. В результате триэфиры
стереоспецифично и приводят к диастереоодно-
10, 12-14 получены с выходами от 30 до 70%
родным (3R*,4S*)-1-ацетил-3,5,5-трис(метоксикар-
(схема 1).
бонил)-4-гет(арил)-2-пирролидонам [5].
Отметим, что реакции 2-(индол-3-ил)-1,1-диме-
В продолжение этих исследований нами
токсикарбонилэтенов 1 и 3 с ацетиламиномало-
изучены взаимодействия 2-(4-метоксифенил)-, 2-
новым эфиром при выдержке реакционной массы в
(3,4-метилендиоксифенил)-,
2-(4-диметиламино-
течение 24 ч привели к синтезу ранее неизвестных
фенил)-,
2-(2-фурил)-,
2-(индол-3-ил)-,
2-(1-
N-незамещенных пирролидонкарбоксилатов 15 и
метилиндол-3-ил)- и
2-(1-бензилиндол-3-ил)-1,1-
16 с выходами
43 и
50% соответственно.
диметоксикарбонилэтенов
1-7 с ацетиламино-
Образование данных соединений можно объяснить,
малоновым эфиром, направленные на получение
по-видимому, не только внутримолекулярным
1140
СИНТЕЗ И СТРОЕНИЕ 4-ГЕТ(АРИЛ)-3,5,5-ТРИМЕТОКСИКАРБОНИЛ-2-ПИРРОЛИДОНОВ
1141
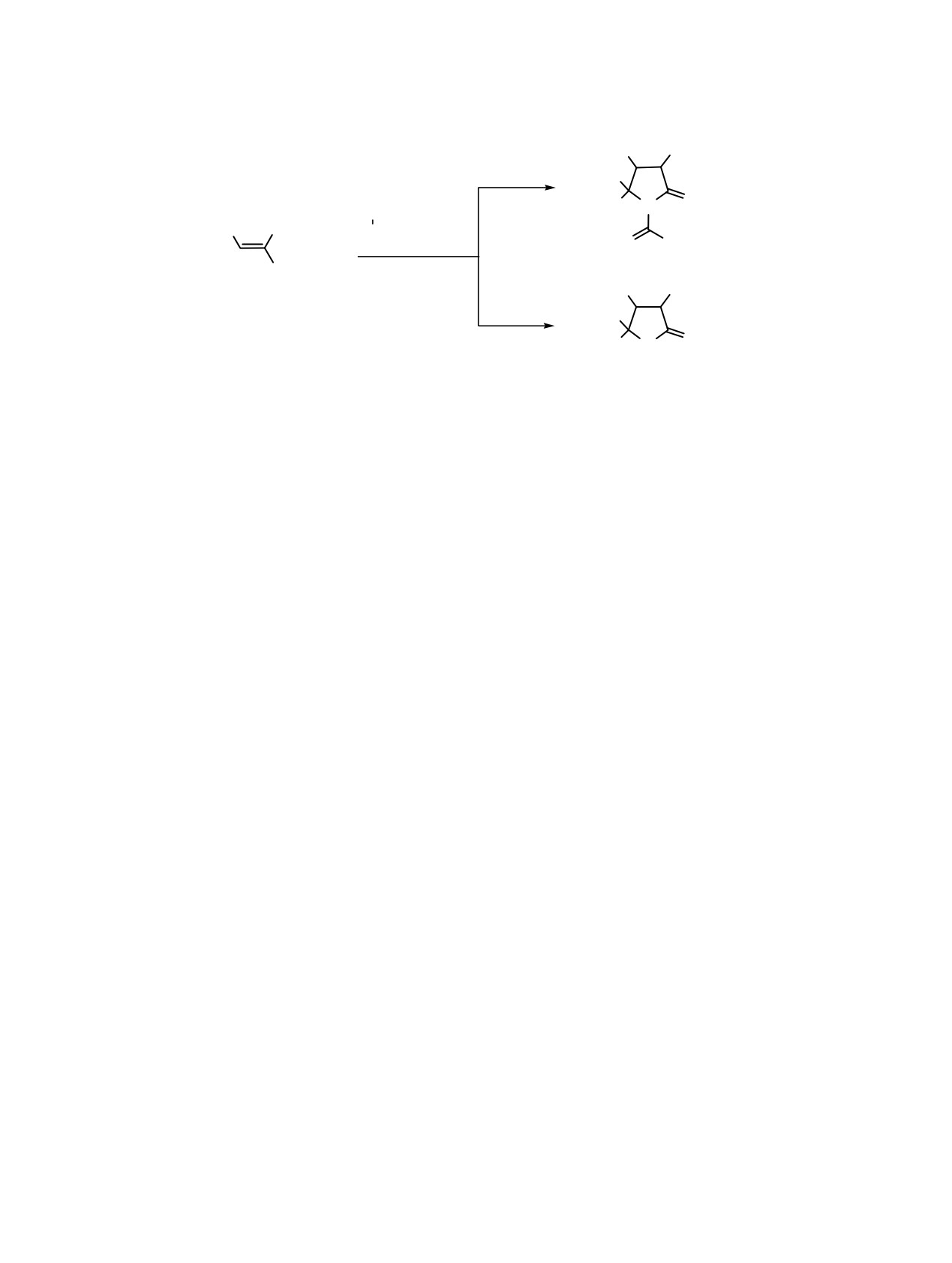
Схема 1.
R
COOCH3
20oC: 2-4 ч
H3COOC
4
3
5
2
1
O
H3COOC
N
CH(COOC2H5)2
R
COOCH3
NHCOCH3
,
O
CH3
CH3ONa, 10-15°C
8-14
COOCH3
R
COOCH3
1-7
20oC: 24 ч
H3COOC
4
3
5
2
1
O
H3COOC
N
H
15, 16
R = 4-метоксифенил (1, 8), 3,3-метилендиоксифенил (2, 9), 4-диметиламинофенил (3, 10), 2-фурил (4, 11), индол-3-ил
(5, 12, 15) 1-метилиндол-3-ил (6, 13), 1-бензилиндол-3-ил (7, 14, 16).
ацилированием аминогруппы первоначально
(CDCl3), δ, м. д.: 2.57 с [3H NC(O)CH3]; 3.46 с, 3.74
образующегося линейного аддукта, но и после-
с и 3.82 с (9H, COOCH3), 3.77 с (3H, OCH3), 4.18 д
дующим дезацилированием N-ацетильных групп в
и 4.22 д (2H, CH, 3J = 11.7 Гц), 6.85 м (2H, Ph), 7.06
условиях реакции.
м (2H, Ph). Спектр ЯМР 13С (CDCl3), δC, м. д.: 25.23
(COCH3), 47.49, 53.42, 73.10 (СH), 53.28, 55.34,
Все синтезированные соединения 8-16 пред-
53.55, 53.69 (CH3), 114.26, 124.02, 129.59, 160.10
ставляют собой бесцветные кристаллические
(Ph), 166.01, 166.38, 167.07, 168.66, 171.30 (C=O).
вещества. Их строение охарактеризовано данными
Найдено, %: С 56.15, 56.19; Н 5.15, 5.18; N 3.33,
физико-химических методов ИК, ЯМР
1Н, 13С
3.37. C19H21NO9. Вычислено, %: C 56.02; H 5.20; N
спектроскопии с использованием 1Н-13С HMBC
3.44.
эксперимента. Спектры ЯМР 1Н соединений 8-16
содержат один набор сигналов протонов, что
(3R*,4S*)-1-Ацетил-4-(3,4-метилендиоксифенил)-
указывает на их диастереооднородность. Отметим,
3,5,5-трис(метоксикарбонил)-2-пирролидон
(9)
что величины констант спин-спинового взаимо-
получали из
2-(3,4-метилендиоксифенил)-1,1-
действия протонов С3H и С4H (3JНН = 10.0-12.0 Гц)
диметоксикарбонилэтена
2 и ацетиламиномало-
в спектрах соединений 8-16 свидетельствуют об их
нового эфира. Выход
72%, т. пл.
154-156°С
транс-расположении, что соответствует 3R и 4S
(CH3OH). ИК спектр (CHCl3), ν, см-1: 1761, 1745
относительной конфигурации двух асимметри-
(C=O). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.56 с [3H,
ческих центров (атомы С3 и С4) в молекулах этих
NC(O)CH3]; 3.53 с, 3.73 с и 3.82 с (9H, COOCH3),
веществ. Эти данные хорошо согласуются с
4.23 д и 4.27 д (2H, CH, 3J = 12.0 Гц), 5.95 с (2H,
приведенными в литературе для (3R*,4S*)-1-ацетил-
CH2O), 6.59 м и 6.73 м (3H, Ph). Спектр ЯМР 13С
3,5,5-триметоксикарбонил-4-(гет)арил-2-пирролидонов
(CDCl3), δC, м. д.: 25.15 (COCH3), 47.94, 53.39, 72.98
[2]. Близкие значения КССВ всего ряда соединений
(СH), 53.31, 53.55, 53.74 (CH3), 101.56 (СH2O),
8-16 позволяют с большой долей вероятности
108.52, 108.66, 121.95, 125.69, 148.17, 148.32 (Ph),
приписать всем полученным продуктам реакции
165.87, 166.27, 166.91, 168.40, 171.22 (C=O). Найдено,
относительную (3R,4S)-конфигурацию.
%: C 54.23, 54.22; Н 4.48, 4.49; N 3.30, 3.29.
C19H19NO10
. Вычислено, %: C 54.16; H 4.55; N 3.32.
Ранее не описанные соединения
8,
9,
11
(3R*,4S*)-1-Ацетил-3,5,5-триc(метоксикарбонил)-
получали по методике [5].
4-(2-фурил)-2-пирролидон (11) получали из 2-(2-
(3R*,4S*)-1-Ацетил-4-(4-метоксифенил)-3,5,5-
фурил)-1,1-диметоксикарбонилэтена
4 и ацетил-
трис(метоксикарбонил)-2-пирролидон
(8)
аминомалонового эфира. Выход 65%, т. пл. 80-82°С
получали из 2-(4-метоксифенил)-1,1-диметоксикар-
(CH3OH). ИК спектр (CHCl3), ν, см-1: 1763, 1742
бонилэтена
1 и ацетиламиномалонового эфира.
(C=O). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.56 с [3H,
Выход 77%, т. пл. 93-95°С (CH3OH). ИК спектр
NC(O)CH3]; 3.60 с, 3.80 с и 3.85 с (9H, COOCH3),
(CHCl3), ν, см-1: 1760, 1740 (C=O). Спектр ЯМР 1Н
4.21 д и 4.40 д (2H, CH, 3J = 11.6 Гц); 6.29 м, 6.33 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1142
ГОРОДНИЧЕВА и др.
и 7.38 м (3H, Fur). Спектр ЯМР 13С (CDCl3), δC, м.
δC, м. д.: 25.27 (COCH3), 41.33, 53.67, 73.27 (CH),
д.: 25.21 (COCH3), 42.13, 52.13, 71.68 (СH), 53.56,
53.18, 53.36, 53.63 (CH3), 107.73, 111.84, 118.64,
53.66, 53.77 (CH3), 110.21, 111.05, 143.52, 146.22
120.18, 122.73, 123.55, 126.63, 136.35 (Ind), 166.48,
(Fur), 165.49, 166.16, 166.68, 167.87, 171.13 (С=O).
167.06, 167.30, 168.94, 171.52 (C=O). Найдено, %: C
Найдено, %: C 52.15, 52.15; H 4.70, 4.78; N 3.63,
57.52, 57.58; H 4.93, 4.93; N 6.61, 6.63. C20H20N2O8.
3.65. C16H17NO9. Вычислено, %: C 52.32; H 4.67; N
Вычислено, %: C 57.69; H 4.84; N 6.73.
3.81.
(3R*,4S*)-1-Ацетил-4-(1-метилиндол-3-ил)-
(3R*,4S*)-1-Ацетил-4-(4-диметиламинофенил)-
3,5,5-трис(метоксикарбонил)-2-пирролидон (13).
3,5,5-трис(метоксикарбонил)-2-пирролидон (10).
Выход 55%, т. пл. 173-175°С (CH3OH). ИК спектр
К раствору метилата натрия, приготовленному из
(CHCl3), ν, см-1: 1760, 1740 (C=O). Спектр ЯМР 1Н
10 мл метанола и 0.69 г (0.03 моль) металлического
(CDCl3), δ, м. д.: 2.61 с [3H, NC(O)CH3]; 3.41 с, 3.72
натрия, при перемешивании добавляли
6.51 г
с и 3.82 с (9H, COOCH3), 3.75 с (3H, NCH3), 4.32 д
(0.03
моль) ацетиламиномалонового эфира.
и 4.61 д (2H, CH, 3J = 11.9 Гц), 6.92-7.45 м (5H,
Полученную смесь выдерживали до полного
Ind). Спектр ЯМР 13С (CDCl3), δC, м. д.:
25.33
растворения осадка, затем охлаждали до 10-15°С и
(COCH3), 33.11 (NCH3), 41.19, 54.79, 73.41 (СH),
порциями прибавляли
5.26 г
(0.02 моль)
2-(4-
53.17, 53.34, 53.60 (CH3), 106.46, 109.83, 118.91,
диметиламинофенил)-1,1-диметоксикарбонилэтена
119.91, 122.42, 127.38, 127.71, 137.13 (Ind), 166.75,
3 в 19 мл метанола, поддерживая температуру 10-
166.99, 167.25, 168.90, 171.46 (C=O). Найдено, %: C
15°С. Реакционную массу выдерживали при пере-
58.60, 58.68; H 5.20, 5.23; N 6.44, 6.45. C21H22N2O8.
мешивании в течение 4 ч при 20°С, затем при
Вычислено, %: C 58.60; H 5.15; N 6.51.
интенсивном перемешивании выливали на
(3R*,4S*)-1-Ацетил-4-(1-бензилиндол-3-ил)-
мелкораздробленный лед с рассчитанным на
3,5,5-трис(метоксикарбонил)-2-пирролидон (14).
натрий количеством
12 н. соляной кислоты
Выход 30%, т. пл. 150-152°С (CH3OH). ИК спектр
(~2.5 мл), контролируя рН ~ 7. Образовавшийся
(CHCl3), ν, см-1: 1761, 1740 (C=O). Спектр ЯМР 1Н
кристаллический продукт отфильтровывали,
(CDCl3), δ, м. д.: 2.60 с [3H, NC(O)CH3]; 3.24 с, 3.72
промывали холодной водой и сушили на воздухе.
с и 3.80 с (9H, COOCH3), 4.25 д и 4.65 д (2H, CH,
Выход 5.90 г (70%), т. пл. 193-195°С (CH3OH). ИК
3J = 11.9 Гц), 5.21 д и 5.32 д (2H, СH2, 2J = 15.9 Гц),
спектр (CHCl3), ν, см-1: 1759, 1740 (C=O). Спектр
7.08-7.45 м (5H, Ind), 7.21-7.35 м (5H, Ph). Спектр
ЯМР 1Н (CDCl3), δ, м. д.: 2.57 с [3H, NC(O)CH3],
ЯМР 13С (CDCl3), δC, м. д.: 25.32 (COCH3), 40.94,
2.93 с (6H, NCH3); 3.48 с, 3.73 с и 3.82 с (9H,
54.88, 73.52 (СH), 50.17 (NCH2), 53.01, 53.36, 53.64
COOCH3), 4.14 д и 4.22 д (2H, CH, 3J = 11.9 Гц),
(CH3), 107.63, 110.15, 119.06, 120.18, 122.71, 126.97,
6.63 м и 6.97 м (4H, Ph). Спектр ЯМР 13С (CDCl3),
128.00, 136.69 (Ind), 126.71, 127.72, 128.97, 137.03
δC, м. д.: 25.23 (COCH3), 40.37 (NCH3), 47.76, 53.26,
(Ph), 166.51, 167.11, 167.23, 168.84, 171.46 (C=O).
73.27 (СH),
53.24,
53.44,
53.74 (CH3),
112.17,
Найдено, %: C 64.11, 64.21; H 5.22, 5.25; N 5.42,
129.14, 150.09 (Ph), 166.10, 166.51, 167.24, 169.02,
5.48. C27H26N2O8. Вычислено, %: C 64.02; H 5.17; N
171.34 (C=O). Найдено, %: С 57.35, 57.36; Н 5.61,
5.53.
5.61; N 6.49, 6.55. C20H24N2O8. Вычислено, %: C
57.14; H 5.75; N 6.66.
(3R*,4S*)-4-(Индол-3-ил)-3,5,5-трис(метокси-
карбонил)-2-пирролидон (15) получали по методике
Соединения
12-14 получали аналогично;
синтеза вещества
10 из
3.25 г
(0.015 моль)
реакционную массу нейтрализовали рассчитанным
ацетиламиномалонового эфира и 2.59 г (0.01 моль)
на натрий количеством ледяной уксусной кислоты
2-(индол-3-ил)-1,1-диметоксикарбонилэтена
1;
(рН ~ 7).
время реакции - 24 ч. Выход 1.95 г (43%), т. пл.
(3R*,4S*)-1-Ацетил-4-(индол-3-ил)-3,5,5-трис
215-217°С (CH3OH). ИК спектр (KBr), ν, см-1: 3470-
(метоксикарбонил)-2-пирролидон
(12). Выход
3310 ш (NH), 1745, 1729, 1716 (C=O). Спектр ЯМР
36%, т. пл.
193-195°С (CH3OH). ИК спектр
1Н (ДМСО-d6), δ, м. д.: 3.22 с, 3.56 с и 3.69 с (9H,
(CHCl3), ν, см-1: 3500-3320 ш (NH), 1759, 1740
COOCH3), 4.03 д и 4.78 д (2H, CH, 3J = 11.0 Гц),
(C=O). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.62 с [3H,
6.97-7.63 м (5H, Ind), 9.40 с и 11.08 с (2H, NH).
NC(O)CH3]; 3.38 с, 3.71 с и 3.81 с (9H, COOCH3),
Спектр ЯМР 13С (ДМСО-d6), δC, м. д.: 41.92, 54.48,
4.35 д и 4.63 д (2H, CH, 3J = 11.6 Гц), 6.99-7.45 м
72.25 (СH), 53.09, 53.13, 53.73 (CH3), 109.15, 112.05,
(5H, Ind), 8.54 с (1H, NH). Спектр ЯМР 13С (CDCl3),
119.34, 119.68, 121.82, 124.80, 127.33, 136.55 (Ind),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
СИНТЕЗ И СТРОЕНИЕ 4-ГЕТ(АРИЛ)-3,5,5-ТРИМЕТОКСИКАРБОНИЛ-2-ПИРРОЛИДОНОВ
1143
168.55, 169.32, 169.92, 171.28 (С=O). Найдено, %: C
КОНФЛИКТ ИНТЕРЕСОВ
57.60, 57.62; H 4.90, 5.06; N 6.72, 6.80. C18H18N2O7.
Вычислено, %: C 57.75; H 4.85; N 7.48.
Авторы заявляют об отсутствии конфликта
интересов.
Соединение 16 получали аналогично.
(3R*,4S*)-4-(1-Бензилиндол-3-ил)-3,5,5-трис-
СПИСОК ЛИТЕРАТУРЫ
(метоксикарбонил)-2-пирролидон
(16). Выход
1. Берестовицкая В.М., Васильева О.С., Остроглядов Е.С.
55%, т. пл. 175-177°С (CH3OH). ИК спектр (KBr),
2-Пирролидон и его производные. Монография.
ν, см-1: 3420-3090 (NH), 1759, 1739, 1719 (C=O).
СПб: Астерион, 2013. 192 с.
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.13 с, 3.58 с и
3.70 с (9H, COOCH3), 3.98 д и 4.80 д (2H, CH, 3J =
2. Мальцев О.В., Белецкая И.П., Злотин С.Г. // Усп.
хим. 2011. Т.
80.
№ 11. С. 1119; Maltsev O.V.,
11.0 Гц), 5.33 д и 5.40 д (2H, СH2, 2J = 15.7 Гц), 6.98-
Beletskaya I.P., Zlotin S.G. // Russ. Chem. Rev. 2011.
7.72 м (5H, Ind), 7.14-7.25 м (5H, Ph), 9.43 с (1H,
Vol.
80.
N
11.
P.
1067.
doi
10.1070/
NH). Спектр ЯМР 13С (ДМСО-d6), δC, м. д.: 41.61,
RC2011v080n11ABEH004249
54.71, 72.27 (СH), 49.54 (NCH2), 53.01, 53.11, 53.74
3. Резников А.Н., Головин Е.В., Климочкин Ю.Н. //
(CH3), 109.19, 110.75, 119.70, 120.06, 122.14, 127.91,
ЖОрХ. 2013. Т. 49. Вып. 5. С. 682; Reznikov A.N.,
127.99, 136.26 (Ind), 127.55, 127.92, 129.02, 138.60
Golovin E.V., Klimochkin Yu.N. // Russ. J. Org. Chem.
(Ph) 168.48, 169.16, 169.75, 171.05 (С=O). Найдено,
2013. Vol.
49. N
5.
P.
663. doi
10.1134/
%: C 64.56, 64.63; H 5.31, 5.32; N 5.97, 5.99.
S1070428013050047
C25H24N2O7. Вычислено, %: C 64.65; H 5.21; N 6.03.
4. Bunch L., Johansen T.H., Brauner-Osborne H., Stensbol T.,
Спектральные характеристики и данные
Johansen T.N., Krogsgaard-Larsen P., Madsen U. //
элементного анализа получены с использованием
Bioorg. Med. Chem. 2001. Vol. 9. N 4. P. 875. doi
оборудования Центра коллективного пользования
10.1016/S0968-0896(00)00304-7
факультета химии Российского государственного
5. Берестовицкая В.М., Васильева О.С., Острогля-
педагогического университета им. А. И. Герцена.
дов Е.С., Тюренков И.Н., Ананьев И.В., Лысенко К.А.,
Спектры ЯМР
1Н,
13C{1H} регистрировали на
Перфилова В.Н., Багметова В.В. // Изв. АН. Сер. хим.
2013. Т.
62.
№ 11. С. 2401; Berestovitskaya V.M.,
спектрометре Jeol ECX400A с рабочими частотами
Vasil’eva O.S., Ostroglyadov E.S., Tyurenkov I.N.,
399.78 (1Н), 100.525 МГц (13С) с использованием
Anan’ev I.V., Lyssenko K.A., Perfilova V.N., Bagmeto-
остаточного сигнала недейтерированного раство-
va V.V. // Russ. Chem. Bull. 2013. Vol. 62. N 11.
рителя как внутреннего стандарта. ИК спектры
P. 2401. doi 10.1007/s11172-013-0348-y
получали на Фурье-спектрометре Shimadzu
6. Берестовицкая В.М., Остроглядов Е.С., Васильева О.С. //
IRPrestige-21. Элементный анализ выполняли на
ЖОрХ. 2003. Т. 39. Вып. 2. С. 304; Berestovits-
анализаторе EuroVector EA 3000 (CHN Dual mode).
kaya V.M., Ostroglyadov E.S., Vasil’yeva O.S. // Russ.
Температуры плавления определяли на приборе
J. Org. Chem. 2003. Vol. 39. N 2. P. 282. doi 10.1023/
ПТП (М).
A:1025517025582
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019
1144
ГОРОДНИЧЕВА и др.
Synthesis and Structure
of 4-Het(aryl)-3,5,5-trimethoxycarbonyl-2-pyrrolidones
N. V. Gorodnicheva, E. S. Ostroglyadov, O. S. Vasilyeva, and S. V. Makarenko*
Herzen State Pedagogical University of Russia, nab. r. Moiki 48, St. Petersburg, 191186 Russia
*e-mail: kohrgpu@yandex.ru
Received February 28, 2019; revised February 28, 2019; accepted March 7, 2019
Condensation of 2-het(aryl)-1,1-dimethoxycarbonylethenes with acetylaminomalonic acid ester afforded (3R*,4S*)-4-
(4-methoxyphenyl)-, (3R*,4S*)-4-(3,4-methylenedioxyphenyl)-, (3R*,4S*)-4-(4-dimethylaminophenyl)-, (3R*,4S*)-
4-(2-furyl)-, (3R*,4S*)-4-(indol-3-yl)-, (3R*,4S*)-4-(1-methylindol-3-yl)-, and (3R*,4S*)-4-(1-benzylindol-3-yl)-
3,5,5-tris(methoxycarbonyl)-2-pyrrolidones.
Keywords: heterocyclic compounds, 2-pyrrolidone, 2-pyrrolidonecarboxylic acids esters
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 7 2019