ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 8, с. 1157-1163
УДК 547.56;547.26;544.47
АЛКИЛИРОВАНИЕ ФЕНОЛОВ трет-БУТАНОЛОМ
ПОД ДЕЙСТВИЕМ ЦЕОЛИТОВ Y В H-ФОРМЕ
С ИЕРАРХИЧЕСКОЙ ПОРИСТОЙ СТРУКТУРОЙ
А. Р. Байгузинаa, b,*, Р. А. Махияноваb, А. Н. Хазиповаa, Р. И. Хуснутдиновa,b
a Институт нефтехимии и катализа Российской академии наук, пр. Октября 141, Уфа, 450075 Россия
*e-mail: inklab4@gmail.com
b Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450062 Россия
Поступило в Редакцию 15 марта 2019 г.
После доработки 15 марта 2019 г.
Принято к печати 22 марта 2019 г.
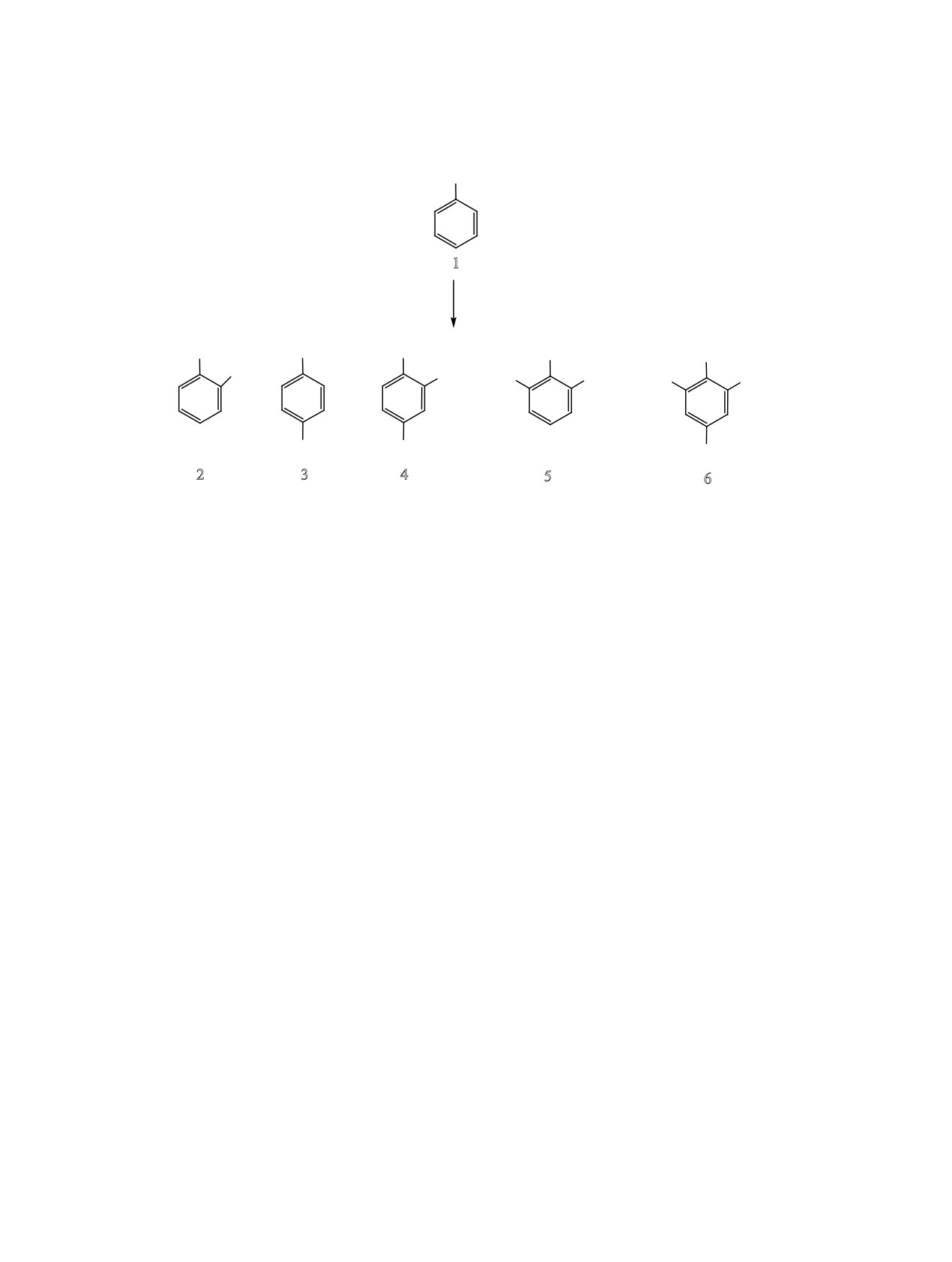
Осуществлен синтез трет-бутилилзамещенных фенолов реакцией фенола, о-, м- и п-крезолов с трет-бута-
нолом под действием цеолитов Y в H-форме с иерархической пористой структурой, промотированных CBr4.
Ключевые слова: фенол, трет-бутанол, трет-бутилфенолы, 2,4-ди-трет-бутилфенол, крезол, цеолит HY
DOI: 10.1134/S0044460X1908002X
Как известно, основная функция антиоксидан-
спиртами под действием кислотных гомогенных и
тов, входящих в состав полимерных материалов, -
гетерогенных катализаторов, отличающихся по се-
это замедление процессов (термо)окисления по-
лективности и активности. В процессе алкилиро-
лимеров, приводящих к ухудшению их свойств
вания фенолов и крезолов используются кислоты
вследствие обрыва или сшивки полимерных цепей.
Льюиса (AlCl3, FeCl3 и ZnCl2), кислоты Бренстеда
Наиболее эффективными антиоксидантами, кото-
(H3PO4, H2SO4, HF, HClO4), катионообменные
рые используются для стабилизации полимеров,
смолы, цеолиты, мезопористые материалы, суль-
являются экранированные (замещенные) фенолы:
фатированный диоксид циркония, гетерополикис-
пара-трет-бутилфенол, 2,6-ди-трет-бутил-4-ме-
лоты, а также ионные жидкости. Недостатками
тилфенол (ионол, выпускается под торговой маркой
кислот Бренстеда являются коррозия оборудова-
Агидол-1), 2-трет-бутил-4-метилфенол, 2-трет-
ния и загрязнение окружающей среды из-за обра-
бутил-5-метилфенол,
2-изопропил-5-метилфенол
зования токсичных сточных вод, а твердые кисло-
(тимол).
ты быстро дезактивируются [2-4].
В промышленности трет-бутилфенолы полу-
Особое внимание уделяется разработке кислот-
чают алкилированием фенола и его алкилпроиз-
ных катализаторов, на основе цеолитов различ-
водных изобутиленом в присутствии сульфокати-
ного структурного типа, для которых характерны
онных ионообменных смол. Несмотря на высокий
легкость отделения от продуктов реакции, воз-
выход целевого продукта у данной технологии
можность повторного использования и отсутствие
имеются серьезные недостатки: сравнительно бы-
проблем с коррозией [3, 5, 6]. Эффективным ката-
страя дезактивация используемых катализаторов,
лизатором образования п-трет-бутилфенола ал-
высокое давление, побочная реакция полимери-
килированием фенола трет-бутанолом является
зации изобутилена, и как следствие, образование
цеолит МСМ-22 [3]. Наибольшая селективность
отходов, требующих утилизации [1].
(81-91%) по п-трет-бутилфенолу наблюдается
при использовании цеолита Бета в H-форме, но
В последнее время растет интерес к разработ-
при этом конверсия фенола не превышает 20% [1].
ке в качестве альтернативы более экологичных и
экономически выгодных каталитических процес-
Целью настоящей работы является разра-
сов алкилирования фенола, о-, м- и п-крезолов
ботка нового и эффективного метода получения
1157
1158
БАЙГУЗИНА и др.
Схема 1.
OH
+ t-BuOH
1
HY-mmm
−H2O
OH
OH
OH
OH
OH
Bu-t
Bu-t
Bu
Bu-t
t-Bu
Bu-t
+
+
+
+
Bu-t
Bu-t
Bu-t
2
3
4
5
6
трет-бутилфенолов взаимодействием фенола и
шетки цеолита. С другой стороны, при замене в
крезолов с трет-бутиловым спиртом в присут-
структуре цеолита гидроксильных анионов на га-
ствии гетерогенного катализатора, в качестве кото-
логенид-ионы наблюдается усиление кислотных
рого были выбраны гранулированный цеолит Y в
свойств за счет сильного индукционного эффекта
H-форме высокой степени кристалличности (95%)
ионов галогена [9-11]. Учитывая это, мы попы-
с иерархической (микро-, мезо- и макропористая)
тались ввести в состав цеолита HY-mmm ионы
структурой (HY-mmm) [7] и ультрастабильный це-
галогена простым путем - обработкой с помощью
олит (USY-mmm), полученный посредством тер-
соляной и бромистоводородной кислот. Результат
мопаровой обработки в среде 100%-ного водяного
оказался отрицательным, что обусловлено необхо-
пара при 540°С в течение 3 ч аммонийной формы
димостью проведения реакции при повышенной
цеолита Y-mmm со степенью обмена катионов Na+
температуре 150-175°С, при которой HCl и HBr
на катионы NH4+ 0.72 [8].
почти полностью улетучиваются из цеолита при
Серией опытов мы установили, что цеолит HY-
достижении рабочей температуры.
mmm cо степенью обмена 0.94 катализирует ал-
В связи с тем, что побочным продуктом ал-
килирование фенола 1 трет-бутанолом. Реакция
килирования фенола трет-бутанолом является
проходит при 150-175°С в течение 2-6 ч и приво-
вода, мы решили использовать в качестве источ-
дит к образованию изомерных трет-бутилфено-
ника ионов хлора и брома галогенметаны CHCl3,
лов 2-6 (схема 1).
CCl4, CHBr3 и CBr4, которые могут подвергаться
гидролизу и выделять HCl и HBr постепенно. Как
Основными продуктами реакции являются
орто- (2), пара- (3) и 2,4-ди-трет-бутилфенолы
выяснилось в ходе экспериментов, CCl4, CHBr3 и
CBr4 действительно оказывают промотирующее
(4). Так, при 175°C через 6 ч конверсия фенола
действие на цеолит HY-mmm, причем оно макси-
составляет 54%, а соотношение фенолов 2:3:4 =
1.2:1:1.
мально в случае CBr4, который наиболее легко ги-
дролизуется в условиях реакции (табл. 1).
В дальнейшем мы поставили цель увеличить
С целью подтверждения протекания гидроли-
конверсию фенола путем добавления к цеоли-
за CBr4 был проведен меркурометрический ана-
ту HY-mmm, промотирующих добавок, способ-
ствующих увеличению его кислотных свойств.
лиз реакционной массы после завершения опыта.
Содержание HBr через 4 ч составляло 70 мг/мл.
Известно, что простая обработка цеолитов рас-
творами сильных кислот не приводит к заметному
Цеолит HY-mmm с добавкой CBr4 пригоден
увеличению их кислотности, более того кислоты
для повторного использования, он практически не
способствуют разрушению кристаллической ре-
теряет активности при 3-кратном использовании
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
АЛКИЛИРОВАНИЕ ФЕНОЛОВ трет-БУТАНОЛОМ ПОД ДЕЙСТВИЕМ ЦЕОЛИТОВ
1159
Таблица 1. Зависимость выхода трет-бутилфенолов 2-6 от концентрации реагентов и температуры в присутствии
цеолита HY-mmm (5 мас%)а
Конверсия
Выход продуктов реакции,%
CHlg4
[Фенол]:[t-BuOH]:[CHlg4]
Т, °С
фенола, %
2
3
4
5
6
–
100:200:0
150
37
14
15
8
0
0
CBr4
100:200:10
''
92
20
9
39
10
14
–
100:200:0
175
54
20
17
17
0
0
CBr4
100:200:5
''
94
9
33
49
3
CHBr3
100:200:10
''
64
21
21
22
1
1
CCl4
''
''
72
21
17
23
4
7
CBr4
''
''
100
4
39
52
0
5
CBr4
100:400:10
''
100
6
65
29
0
0
а Продолжительность реакции - 6 ч.
(табл. 2). Кроме соединений 2-6, в реакционной
ла 4. Действительно, при взаимодействии фенола
массе были зафиксированы в следовом количестве
с ButOH, в присутствии USY-mmm (5 мас%) при
изомерные трет-бутилпроизводные 7.
175°С в течение 6 ч при мольном соотношении
[фенол]:[ButOH]:[СBr4] =
100:200:(0:10) преиму-
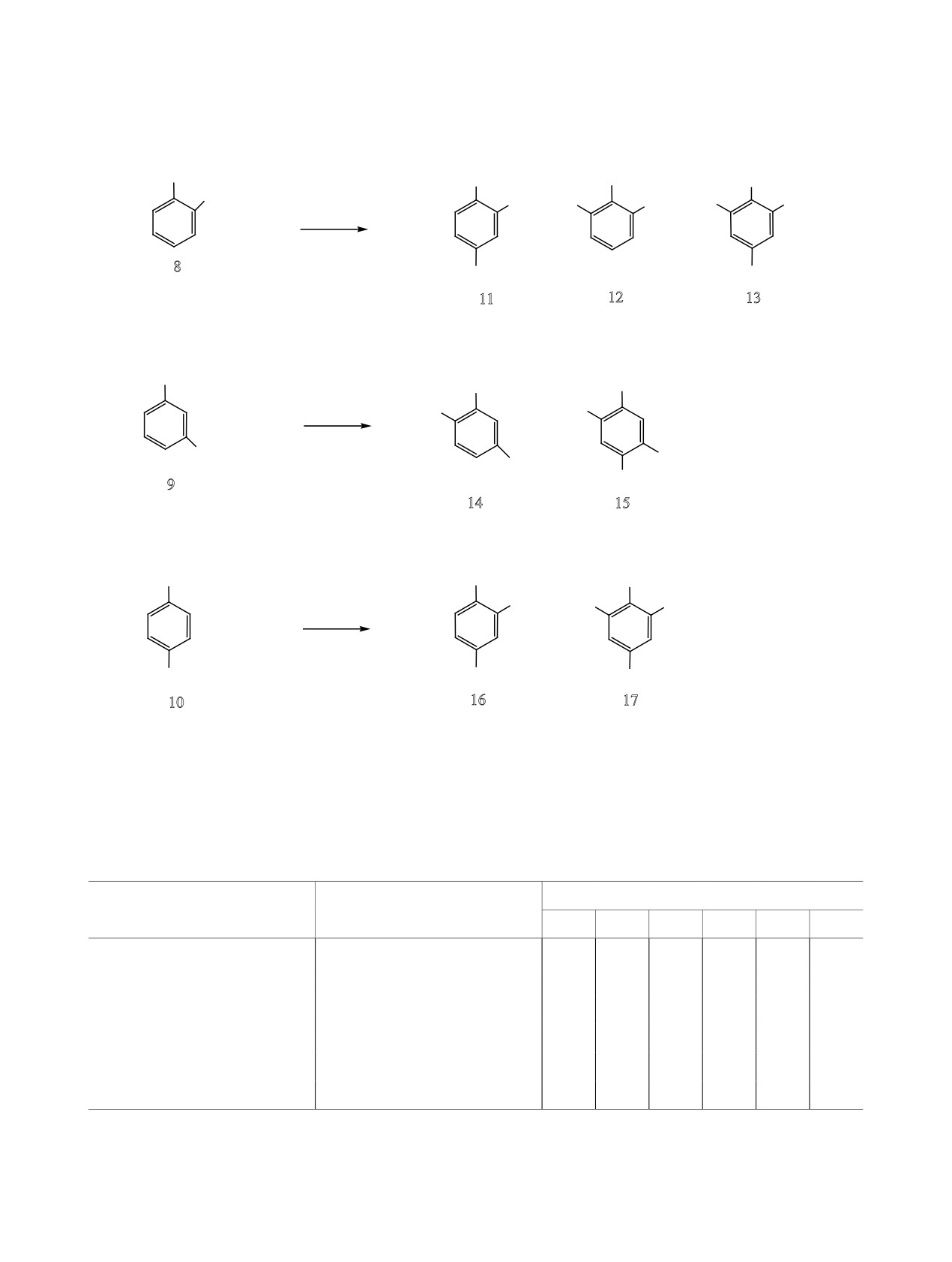
На следующем этапе работы мы исследовали
щественно образуется 2,4-ди-трет-бутилфенол 4
каталитическую активность цеолита USY-mmm,
приготовленного термопаровой обработкой цеоли-
(табл. 3). Эта тенденция сохраняется и в реакции
о-, м- и п-крезолов 8-10 с t-BuOH, катализируе-
та NH4Ymmm, в реакции алкилирования фенолов
мой цеолитом USY-mmm (5 мас%) с добавлением
трет-бутанолом. Предварительно было установ-
лено, что при термопаровой обработке происхо-
CBr4 (175°С, 6 ч). При увеличении температуры до
280°С реакция протекает неселективно с образова-
дит частичное деалюминирование кристалличе-
нием смеси изомеров (схема 2).
ской решетки цеолита. В результате уменьшается
концентрация кислотных центров и одновре-
В аналогичную реакцию с фенолами, в частно-
менно увеличивается объем мезо- и макропор
сти м-крезолом, в присутствии микро-, макро- и
за счет уменьшения объема микропор цеолита,
мезопористого цеолита HY-mmm (5мас%) всту-
вследствие чего возрастают выходы объемных
пает 2-пропанол с образованием двух продуктов:
4-трет-бутилфенола 3 и 2,4-дитрет-бутилфено-
2-изопропил-5-метилфенола 18 (выход 25-32%)
Таблица 2. Зависимость выхода трет-бутилфенолов 2-7 от концентрации реагентов и температуры в присутствии
цеолита HY-mmm (5 мас%), промотированного CBr4а
Конверсия фенола,
Выход продуктов реакции, %
Катализатор
[Фенол]:[t-BuOH]:[CBr4]
%
2
3
4
5
6
7
HY-mmm
100:200:10
100
4
39
52
0
5
0
HY-mmmб
100:200:10
95
3
26
53
0
10
3
HY-mmmв
100:200:10
100
3
44
50
0
1
2
HY-mmmв
100:200:0
76
23
11
29
6
7
0
а Условия реакции: 175°C, 6 ч.
б Повторное использование катализатора (второй цикл).
в Повторное использование катализатора (третий цикл).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1160
БАЙГУЗИНА и др.
Схема 2.
OH
OH
OH
OH
Me
Me
t-Bu
Me
t-Bu
Me
cat, CBr4
+ t-BuOH
+
+
175oС, 6 ч
8
Bu-t
Bu-t
11
12
13
HY-mmm:
68%
3%
27%
USY-mmm:
39%
8%
51%
OH
OH
OH
cat, CBr4
t-Bu
t-Bu
+ t-BuOH
+
175oС, 6 ч
Me
Me
Me
Bu-t
9
14
15
HY-mmm:
74%
8%
USY-mmm:
56%
36%
OH
OH
OH
Bu-t
t-Bu
Bu-t
cat, CBr4
+ t-BuOH
+
175oС, 6 ч
Me
Me
Me
10
16
17
HY-mmm:
68%
29%
USY-mmm:
62%
38%
и 2,4-диизопропил-5-метилфенола 19 (выход 33-
Первичные спирты, в частности n-PrOH, при
48%). Реакция проходит при более высоких темпе-
взаимодействии с фенолом в присутствии HY-
ратурах (220-250оС).
mmm (220°С, 6 ч) также дают С-алкилированные
Таблица 3. Зависимость выхода трет-бутилфенолов от условий реакции в присутствии HSY-mmm (5 мас%)а
Выход продуктов реакции, %
[Фенол]:[t-BuOH]:[CBr4]
Конверсия фенола, %
2
3
4
5
6
7
100:200:0
9
5
4
0
0
0
0
100:200:5
95
8
41
44
0
2
0
100:200:10
100
0
24
67
0
9
0
100:200:20
100
2
39
55
0
5
1
100:200:10
100б
3
38
49
0
3
7
100:400:10
94
16
6
34
13
25
0
а Условия реакции: 175°C, 6 ч. б 175°C, 8 ч.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
АЛКИЛИРОВАНИЕ ФЕНОЛОВ трет-БУТАНОЛОМ ПОД ДЕЙСТВИЕМ ЦЕОЛИТОВ
1161
продукты (смесь о- и п-пропилфенолов, 2,4-ди-
ли хлористым метиленом и фильтровали. После
пропилфенола), но наряду с ними образуется и
удаления растворителя из фильтрата остаток вы-
продукт О-алкилирования
- пропилфениловый
деляли с помощью колоночной хроматографии на
эфир, выход которого при следующем соотно-
силикагеле, элюируя смесью н-гексан-бензол (3:1)
шении реагентов и катализатора
[PhOH]:[n-
(колонка l = 21 см, d = 1.2 см).
PrOH]:[CBr4]:[HY-mmm] = 100:200:10:1 составля-
Строение полученных алкилфенолов 2-6, 11-
ет 49%. Цеолит HY-mmm (5 масс%) катализирует
19 доказано методами ЯМР, масс-спектрометрии,
также С- и О-алкилирование о-,м-,п-крезолов с
а также сравнением с известными образцами и
помощью н-пропанола.
литературными данными. Для идентификации со-
Таким образом, установлено, что цеолиты HY-
единений 2-6, 11-19 были использованы объеди-
mmm, USY-mmm, промотированные CBr4, являют-
ненные образцы, полученные в 3-6 экспериментах.
ся эффективными катализаторами алкилирования
2-трет-Бутилфенол (2). Выход 23%. Спектр
фенола и м-, п-крезолов трет-бутанолом в ядро.
ЯМР 1Н, δ, м. д.: 1.38 c [9H, С(СH3)3], 4.75 с (1H,
OH), 6.50-7.40 м (4Н, С3,4,5,6H). Спектр ЯМР 13С,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
δС, м. д.: 29.60 [С(СH3)3], 34.38 [С(СH3)3], 116.52
Спектры ЯМР 1Н и 13С регистрировали на спек-
(С6), 120.45 (С4), 126.78 (С5), 126.80 (С3), 153.90
трометре Bruker Avance-400 (400.13 и 100.62 МГц
(С1). Масс-спектр, m/z (Iотн, %): 150 (25) [М]+, 135
(100), 115 (85), 107 (100), 91 (20), 77 (15), 65 (10).
соответственно) в CDCl3. Масс-спектры снимали
на хромато-масс-спектрометре Shimadzu GCMS-
4-трет-Бутилфенол (3). Выход 65%. Спектр
QP2010Plus (капиллярная колонка SPB-5 30 м × 0.25
ЯМР 1Н, δ, м. д.: 1.37 c [9H, С(СH3)3], 5.32 с (1H,
мм, газ-носитель - гелий, температура программи-
OH),
6.88 д (2Н, С2,6H, J = 8.0 Гц), 7.32 д (2Н,
рования от 40 до 300°C со скоростью 8 град/мин,
С3,5H, J = 8.0 Гц). Спектр ЯМР 13С, δС, м. д.: 31.62
температура испарения - 280°C, температура ион-
[С(СH3)3], 34.11 [С(СH3)3], 115.01 (С2,6), 126.48
ного источника - 200°C, энергия ионизации - 70 эВ).
(С3,5), 143.41 (С4), 153.23 (С1). Масс-спектр, m/z
Хроматографический анализ проводили на прибо-
(Iотн, %): 150 (25) [М]+, 135 (100), 119 (4), 107 (49),
ре Shimadzu GC-9A, GC-2014 [колонка 2 м × 3 мм,
95 (18), 77 (10), 65 (7), 51 (4), 41 (14).
неподвижная фаза
- силикон SE-30
(5%) на
2,4-Ди-трет-бутилфенол
(4). Выход
52%.
Chromaton N-AW-HMDS, температурный режим
Спектр ЯМР 1Н, δ, м. д.: 1.61 c [9H, орто-С(СH3)3],
от 50 до 270°С со скоростью 8 град/мин, газ-
1.49 c [9H, пара-С(СH3)3], 5.35 с (1H, OH), 6.75 д
носитель - гелий (47 мл/мин)].
(1Н, С6H, J = 8.0 Гц), 7.25 д (1Н, С5H, J = 8.0 Гц),
В качестве исходных реактивов использовали
7.51 с (1Н, С3H). Спектр ЯМР 13С, δС, м. д.: 29.91
коммерчески доступные фенол, о-, м-, п-крезолы,
[орто-С(СH3)3],
31.72
[пара-С(СH3)3],
34.44
трет-бутанол, 2-пропанол, CBr4, CHBr3, CHCl3,
[орто-С(СH3)3], 34.93 [пара-С(СH3)3], 116.26 (С6),
CCl4 катализаторы HY-mmm и USY-mmm.
123.71 (С5), 124.20 (С3), 135.51 (С2), 143.05 (С4),
152.05 (C1). Масс-спектр, m/z (Iотн, %): 206 (33)
Общая методика синтеза. Реакции проводили
[М]+, 191 (100), 175 (4), 161 (3), 147 (2), 115 (3), 91
в стеклянной ампуле (V = 12 мл), помещенной в
(4), 74 (3), 57 (25), 41(10).
микроавтоклав из нержавеющей стали (V = 17 мл).
В ампулу в токе аргона загружали 5 мас% катали-
2,6-Ди-трет-бутилфенол
(5). Выход
13%.
затора (по отношению к ArOH), 100 ммоль фенола
Спектр ЯМР 1Н, δ, м. д.: 1.54 c [18H, С(СH3)3],
(или крезола), 200 ммоль спирта и 10 ммоль CBr4
4.85 уш. с (1H, OH), 6.75 т (1Н, С4H, J = 8.0 Гц),
(CHBr3, CHCl3, CCl4). Запаянную ампулу поме-
7.20 д (2Н, С3,5H, J = 8.0 Гц). Спектр ЯМР 13С,
δС, м. д.: 30.20 [С(СH3)3], 34.85 [С(СH3)3], 120.10
щали в автоклав, автоклав герметично закрывали
и нагревали при 150-250°С в течение 6-8 ч с по-
(С4), 124.30 (С3,5), 137.17 (С2,6), 153.95 (C1). Масс-
стоянным перемешиванием, затем автоклав охла-
спектр, m/z (Iотн, %): 206 (25) [М]+, 191 (100), 175
(5), 163 (15), 131 (10), 115 (10).
ждали до ~20°С, ампулу вскрывали. Реакционную
массу нейтрализовали 10%-ным водным раство-
2,4,6-Три-трет-бутилфенол (6). Выход 25%.
ром Na2CO3, органический слой экстрагирова-
Спектр ЯМР 1Н, δ, м. д.: 1.30 c [18H, орто-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1162
БАЙГУЗИНА и др.
С(СH3)3], 1.46 c [9H, пара-С(СH3)3], 5.02 с (1H,
Спектр ЯМР 13С, δС, м. д.: 20.63 (CH3), 31.12 [oр-
OH), 7.25 с (2Н, С3,5H). Спектр ЯМР 13С, δС, м. д.:
то-С(СH3)3], 31.30 [пара-С(СH3)3], 34.67 [oрто-
30.20 [орто-C(CH3)3], 32.10 [пара-С(СH3)3], 32.84
С(СH3)3], 35.66 [пара-С(СH3)3], 120.83 (С2), 125.26
[пара-С(СH3)3],
35.15
[орто-С(СH3)3],
142.10
(С5), 132.54 (С3), 134.84 (С6), 139.64 (С4), 151.79
(С4), 122.30 (С3,5), 138.97 (С2,6), 152.56 (C1). Масс-
(C1). Масс-спектр, m/z (Iотн, %): 220 (23) [М]+, 205
спектр, m/z (Iотн, %): 262 (20) [М]+, 247 (100), 205
(100), 177 (4), 149 (1), 121 (4), 91 (3), 81 (4), 57 (24), 41(7).
(5), 128 (5), 116 (5), 91 (5), 57 (30).
2-трет-Бутил-п-крезол
(16). Выход
68%.
4-трет-Бутил-о-крезол
(11). Выход
68%.
Спектр ЯМР 1Н, δ, м. д.: 1.54 c [9H, С(СH3)3], 2.37
Спектр ЯМР 1Н, δ, м. д.: 1.39 c [9H, С(СH3)3], 2.33
c (3H, CH3), 4.76 с (1H, OH), 6.63 д (1Н, С6H, J =
c (3H, CH3), 4.78 с (1H, OH), 7.23 с (1Н, С3H), 7.18
8.0 Гц), 6.96 д (1Н, С5H, J = 8.0 Гц), 7.17 с (1Н,
д (1Н, С5H, J = 8.0 Гц), 6.79 д (1Н, С6H, J = 8.0 Гц).
С3H). Спектр ЯМР 13С, δС, м. д.: 20.88 (CH3), 29.71
Спектр ЯМР 13С, δС, м. д.: 16.17 (CH3), 31.66
[С(СH3)3],
34.32
[С(СH3)3], 116.49 (С6),
127.28
[С(СH3)3],
34.04
[С(СH3)3], 114.57 (С6),
123.18
(С3), 127.81 (С5),129.51 (С4),
135.91 (С2), 152.06
(С2), 123.82 (С5), 128.06 (С3), 142.32 (С4),
150.39
(C1). Масс-спектр, m/z (Iотн, %): 164 (52) [М]+, 149
(C1). Масс-спектр, m/z (Iотн, %): 164 (47) [М]+, 149
(100), 121 (87), 91 (22), 77 (14), 51 (5), 41 (7).
(100), 121 (20), 109 (10), 91 (15), 77 (10).
2,6-Ди-трет-бутил-п-крезол (17). Выход 38%.
6-трет-Бутил-о-крезол
(12).
Выход
8%.
Спектр ЯМР 1Н, δ, м. д.: 1.51 c [18H, С(СH3)3], 2.38
Спектр ЯМР 1Н, δ, м. д.: 1.59 c [9H, С(СH3)3], 2.35
c (3H, CH3), 4.90 с (1H, OH),
7.10 с (1Н, С3,5H).
c (3H, CH3), 4.95 с (1H, OH),
6.80-7.10 м (3Н,
Спектр ЯМР 13С, δС, м. д.: 21.28 (CH3), 30.42
С3,4,5H). Спектр ЯМР 13С, δС, м. д.: 15.98 (CH3),
[С(СH3)3], 34.51 [С(СH3)3], 125.62 (С3,5), 128.36
29.78
[С(СH3)3],
32.30
[С(СH3)3], 120.03 (С4),
(С4), 135.91 (С2,6), 151.63 (C1). Масс-спектр, m/z
122.45 (С2), 124.14 (С5), 128.43 (С3), 135.46 (С6),
(Iотн, %): 220 (52) [М]+, 205 (100), 177 (13), 161 (5),
152.45 (C1). Масс-спектр, m/z (Iотн, %): 164 (30)
145 (14), 115 (6), 105 (12), 81 (8), 57 (28), 41 (11).
[М]+, 149 (100), 121 (75), 91 (20), 77 (15).
6-Изопропил-м-крезол
(18).
Выход
32%.
4,6-Ди-трет-бутил-о-крезол (13). Выход 51%.
Спектр ЯМР 1Н, δ, м. д.: 1.27 д [6H, СH(СH3)2, J =
Спектр ЯМР 1Н, δ, м. д.: 1.40 c [9H, пара-С(СH3)3],
8.0 Гц], 3.31-3.41 м [1H, СH(СH3)2], 2.31 c (3H,
1.53 c [(9H, орто-С(СH3)3], 2.34 c (3H, CH3), 4.90
CH3), 4.98 с (1H, OH),
6.62 с (1Н, С2H), 6.19 д
с (1H, OH),
7.11 с (1Н, С3H), 7.40 с (1Н, С5H).
(1Н, С4H, J = 8.0 Гц), 7.14 д (1Н, С5H, J = 8.0 Гц).
Спектр ЯМР 13С, δС, м. д.: 16.36 (CH3), 29.95 [ор-
Спектр ЯМР 13С, δС, м. д.: 20.68 (CH3), 22.72
то-С(СH3)3], 31.73 [пара-С(СH3)3], 34.27 [пара-
[СH(СH3)2], 26.71 [СH(СH3)2], 116.09 (С2), 120.80
С(СH3)3], 34.82 [орто-С(СH3)3], 122.08 (С5), 122.38
(С4),
126.71 (С5), 131.4 (С6), 136.63 (С3), 152.54
(С2), 125.43 (С3), 134.86 (С6), 143.42 (С4), 150.39
(C1). Масс-спектр, m/z (Iотн, %): 150 (40) [М]+, 135
(C1). Масс-спектр, m/z (Iотн, %): 220 (20) [М]+, 205
(100), 115 (24), 91 (100), 77 (8), 65 (6), 41 (3).
(100), 189 (5), 161 (3), 149 (3), 121 (3), 115 (3).
4,6-Изопропил-м-крезол
(19). Выход
48%.
6-трет-Бутил-м-крезол
(14). Выход
74%.
СпектрЯМР 1Н, δ, м. д.: 1.21 д [6H, пара-СH(СH3)2,
Спектр ЯМР 1Н, δ, м. д.: 1.50 c [9H, С(СH3)3], 2.35
J = 8.0 Гц], 1.31 д [(6H, орто-СH(СH3)2, J = 8.0 Гц],
c (3H, CH3), 5.07 с (1H, OH), 6.56 с (1Н, С2H), 6.70-
3.07-3.14 м [6H, пара-СH(СH3)2], 3.19-3.25 м [6H,
6.88 м (1Н, С4H), 7.18-7.30 с (1Н, С5H). Спектр
орто-СH(СH3)2], 2.29 c (3H, CH3), 4.83 с (1H, OH),
ЯМР 13С, δС, м. д.: 20.63 (CH3), 29.77 [С(СH3)3],
6.59 с (1Н, С2H), 7.11 с (1Н, С5H). Спектр ЯМР 13С,
34.27 [С(СH3)3], 117.46 (С2), 121.23 (С4), 126.98
δС, м. д.: 18.75 (CH3), 22.78 [орто-СH(СH3)2], 23.51
(С5), 133.27 (С6), 136.96 (С3), 154.15 (C1). Масс-
[пара-СН(СH3)2],
27.15
[орто-СH(СH3)2],
28.89
спектр, m/z (Iотн, %): 164 (35) [М]+, 149 (100), 133 (2),
[пара-СH(СH3)2], 117.09 (С2), 122.74 (С5), 131.81
121 (63), 115 (9), 91 (19), 77 (10), 65 (3), 51 (4), 41(7).
(С3), 133.46 (С6), 139.21 (С4),
150.16 (C1). Масс-
спектр, m/z (Iотн, %): 192 (30) [М]+, 177 (100), 149
4,6-Ди-трет-бутил-м-крезол (15). Выход 36%.
(4), 135 (20), 121 (5), 91 (11), 77 (4), 65 (2), 43(8).
Спектр ЯМР 1Н, δ, м. д.: 1.44 c [9H, пара-С(СH3)3],
1.45 c [9H, орто-С(СH3)3], 2.58 c (3H, CH3), 4.97
Структурные исследования полученных соеди-
с (1H, OH),
6.56 c (1Н, С2H), 7.45 с (1Н, С5H).
нений выполнены с использованием оборудования
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
АЛКИЛИРОВАНИЕ ФЕНОЛОВ трет-БУТАНОЛОМ ПОД ДЕЙСТВИЕМ ЦЕОЛИТОВ
1163
Регионального центра коллективного пользования
4. Harmer M.A., Sun Q. // Appl. Catal. (A). 2001. Vol. 221.
Агидель.
P. 45. doi 10.1016/S0926-860X(01)00794-3
5. Krishnan A.V., Keka O., Pradhan N.C. // Org. Proc. Res.
ФОНДОВАЯ ПОДДЕРЖКА
Dev. 2002. Vol. 6. P. 132. doi 10.1021/op010077n
Работа выполнена при финансовой поддержке
6. Dumitriu E., Hulea V. // J. Catal. 2003. Vol. 218. N 2.
Российского фонда фундаментальных исследова-
P. 249. Doi 10.1016/S0021-9517(03)00159-3
ний (грант № 17-43-020155p_a) и в рамках госу-
7. Travkina O.S., Agliullin M.R., Filippova N.A.,
дарственного задания Министерства образования
Khazipova A.N., Danilova I.G., Grigoreva N.G.,
и науки РФ (рег. № АААА-А19-119022290009-3).
Narender Nama, Pavlova M. L., Kutepov B.I. //
КОНФЛИКТ ИНТЕРЕСОВ
RSC Adv.
2017. Vol. 52. P. 32581. doi 10.1039/
C7RA04742H
Авторы заявляют об отсутствии конфликта
8. Хазипова А.Н., Танцева А.А., Кутепов Б.И. //
интересов.
ЖПХ. 2010. Т. 83. Вып. 12. С. 1972; Tantseva A.A.,
СПИСОК ЛИТЕРАТУРЫ
Khazipova A.N., Garieva G.F., Kutepov B.I. // Russ. J.
Appl. Chem. 2010. Vol. 83. N 12. P. 2100. doi 10.1134/
1. Терехов А.В., Занавескин Л.Н., Хаджиев С.Н. // Не-
S1070427210120062
фтехимия. 2017. Т. 57. № 4. С. 453; Terekhov A.V.,
Zanaveskin L.N., Khadzhiev S.N. // Petroleum
9. Bayer H.K. Dealumination techniques for zeolites.
Chem. 2017. Vol. 57. N 4. P. 714. doi 10.1134/
Molecular sieves. Berlin: Springer-Verlag, 2002. Vol. 3.
S096554411708014X
P. 203.
2. Selvam P., Krishna N.V., Sakthivel A. // Adv. Porous.
10. Lutz W. // Adv. Mat. Sci. Eng. 2014. P. 1. doi
Mate. 2013. N 3. P. 239. doi 10.1166/apm.2013.1028
10.1155/2014/724248
3. Song K., Guan J., Wu S., Yang Y., Liu B., Kan Q. //
11. Zeolites in Catalysis: Properties and Applications / Eds
Catal. Lett. 2008. Vol. 126. N 3. P. 333. doi 10.1007/
J. Čejka, R.E. Morris, P. Nachtigall. London: Royal
s10562-008-9626-y
Society of Chemistry, 2017. P. 310.
Alkylation of Phenols with tert-Butanol Catalyzed with H-Form
Y Zeolites of A Hierarchical Porous Structure
A. R. Bayguzinaa,b, *, R. A. Makhiyanovab, A. N. Khazipovaa, and R. I. Khusnutdinova,b
a Institute of Petrochemistry and Catalysis of The Russian Academy of Sciences, pr. Oktyabrya 141, Ufa, 450075 Russia
*e-mail: inklab4@gmail.com
bUfa State Petroleum Technological University, ul. Kosmonavtov 1, Ufa, 450062 Russia
Received March 15, 2019; revised March 15, 2019; accepted March 22, 2019
The synthesis of tert-butyl-substituted phenols by the reaction of phenol, o-, m- and p-cresols with tert-butanol
under the action of CBr4-promoted Y-zeolites in a H-form with a hierarchical porous structure was performed.
Keywords: phenol, tert-butanol, tert-butylphenols, 2,4-di-tert-butylphenol, cresol, zeolite HY
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019