ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 8, с. 1176-1181
УДК 547.822.7;547.821.3;547.781.3;543.51;543.429.23
СИНТЕЗ
2,3-ДИГИДРО-1Н-ИМИДАЗО[1,2-a]ПИРИДИНИЕВЫХ
СИСТЕМ ГАЛОГЕНЦИКЛИЗАЦИЕЙ ГАЛОГЕНИДОВ
1-АЛКЕНИЛ(ПРОПАРГИЛ)-2-АМИНОПИРИДИНИЯ
© 2019 г. Е. В. Калита*, Д. Г. Ким, Д. А. Рахматуллина, М. А. Пыльнева, Е. М. Крынина
Южно-Уральский государственный университет (национальный исследовательский университет),
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: berdnik_lena@mail.ru
Поступило в Редакцию 4 февраля 2019 г.
После доработки 4 февраля 2019 г.
Принято к печати 10 февраля 2019 г.
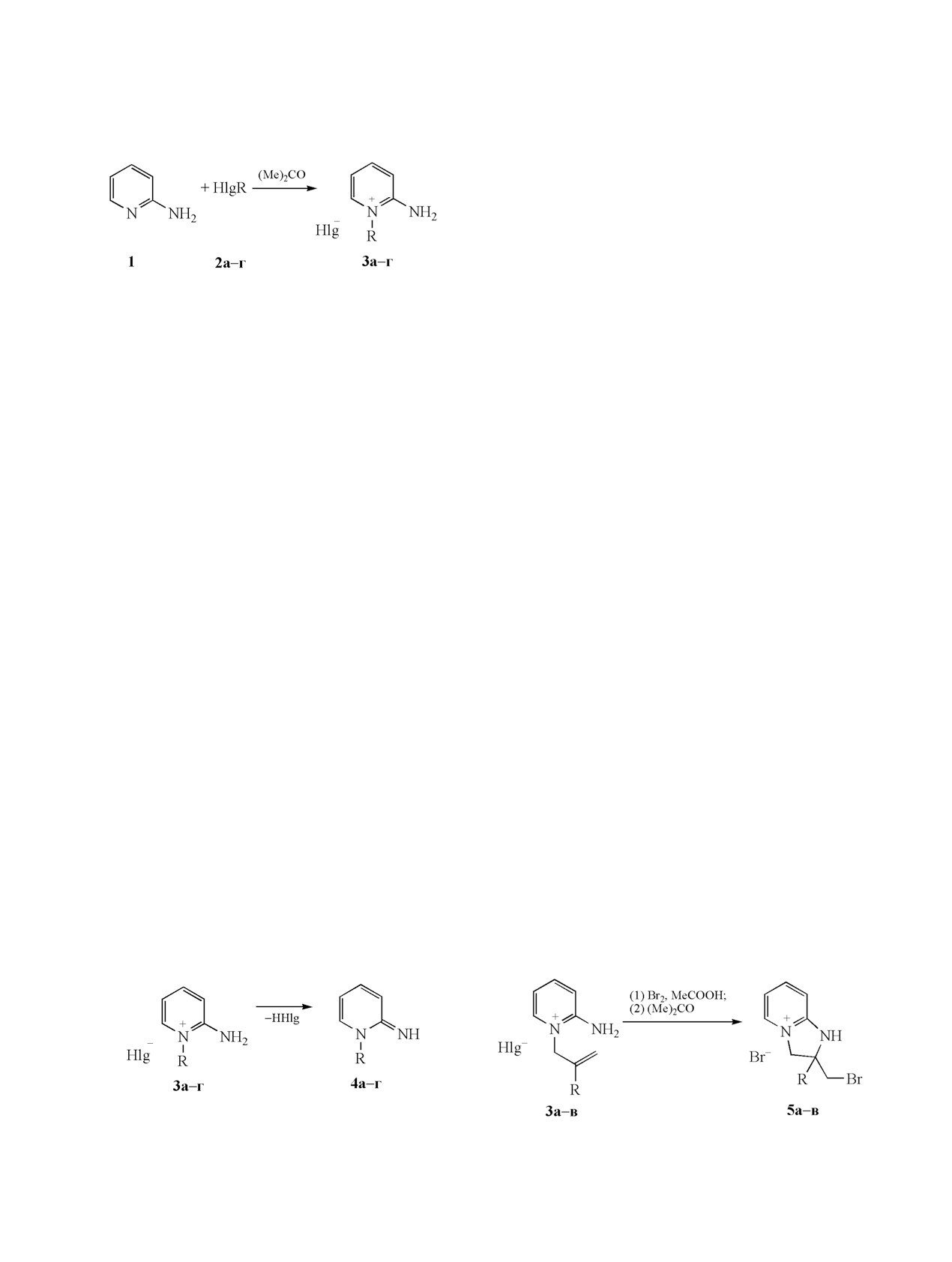
Взаимодействием 2-аминопиридина с аллилбромидом, металлилхлоридом, 2-бромаллилбромидом и
пропаргилбромидом в ацетоне синтезированы галогениды 2-амино-1-аллил-, металлил-, (2-бромал-
лил)- и пропаргилпиридиния. Галогениды 2-амино-1-аллил(металлил)пиридиния реагируют с бромом
и иодом с образованием 2-галогенметил-2,3-дигидро-1Н-имидазо[1,2-a]пиридиниевых систем. Бромид
2-амино-1-(2-бромаллил)пиридиния вступает в реакцию гетероциклизации под действием брома, а с
иодом не реагирует. Бромид 2-амино-1-пропаргилпиридиния вступает в реакцию с бромом и иодом с
образованием 2-галогенметилено-2,3-дигидро-1Н-имидазо[1,2-a]пиридиниевых систем.
Ключевые слова: 2-аминопиридин, галогенид 2-амино-1-алкенил(пропаргил)пиридиния, галогенциклиза-
ция, галогенид 2,3-дигидро-1H-имидазо[1,2-a]пиридиния
DOI: 10.1134/S0044460X19080055
Производные 2-аминопиридина нашли широ-
Известно, что 2-аминопиридин 1 алкилиру-
кое применение в качестве лекарственных средств.
ется галогеналканами в отсутствие основания
Например, пироксикам, теноксикам, сульфасала-
по эндоциклическому атому азота. В литературе
зин обладают противовоспалительными свойства-
имеются примеры синтеза галогенидов 2-ами-
ми, делавирдин используется как анти-ВИЧ пре-
но-1-метил- [5], этил- [6], бутил- [5], гептил- [5] и
парат, сульфапиридин в качестве антибактериаль-
додецилпиридния [7] взаимодействием 2-амино-
ного и трипеленамин в качестве антигистаминного
пиридина с соответствующими алкилирующими
препаратов [1]. Также соединения, содержащие в
агентами. Также известно, что пиридин 1 реаги-
своей структуре фрагмент 2-аминопиридина, про-
рует с аллил-бромидом 2а, металлилхлоридом 2б
являют антибактериальную, противогрибковую,
и пропаргил-бромидом 2г с образованием броми-
антигистаминную, кардиотоническую, противови-
да 1-аллил-2-аминопиридиния 3а [8, 9], хлорида
русную, противосудорожную, анальгетическую,
2-амино-1-металлилпиридиния 3б [10] и бромида
противопаразитарную, противовоспалительную
2-амино-1-пропаргилпиридиния
3г
[11] соответ-
активность [2]. Производные 2,3-дигидро-1Н-и-
ственно (схема 1). Структура соединений 3a, б под-
мидазо[1,2-a]пиридиновых систем используются
тверждена данными РСА.
для обнаружения бета-амилоидных бляшек в го-
В настоящей работе нами впервые взаимодей-
ловном мозге [3], а также обладают противоопухо-
ствием пиридина 1 с 2-бромаллилбромидом 2в в
левой активностью [4]. Целью настоящей работы
ацетоне в отсутствие основания получен бромид
является синтез
2,3-дигидро-1Н-имидазо[1,2-a]-
2-амино-1-(2-бромаллил)пиридиния 3в (схема 1).
пиридиниевых систем электрофильной гетеро-
циклизацией галогенидов 2-амино-1-алкенил(про-
В спектрах ЯМР 1Н галогенидов 3а-г хими-
паргил)пиридиния под действием галогенов.
ческие сдвиги сигналов протонов кольца по срав-
1176
СИНТЕЗ 2,3-ДИГИДРО-1Н-ИМИДАЗО[1,2-a]ПИРИДИНИЕВЫХ СИСТЕМ
1177
Схема 1.
нений 4а, б, г имеется пик иона [M - Н]+. Масс-
спектр имина 4в характеризуется наличием пиков
молекулярного иона [M]+· с m/z 212 и m/z 214, со-
держащих бром, а также пиков элиминирования
бром-радикала [M - Br]+ с m/z 133 и молекулы бро-
моводорода [M - НBr]+· с m/z 132.
В литературе имеется большое количество ра-
Hlg = Br (а, в, г); =Cl (б); R = CH2CH=CH2 (а),
бот, посвященных синтезу 2,3-дигидро-1Н-имида-
CH2C(CH3)=CH2 (б), CH2C(Br)=CH2 (в), CH2C≡СH (г).
зо[1,2-a]пиридиниевых систем на основе 2-ами-
нопиридина и его производных путем достройки
нению с соотвествующими сигналами 2-аминопи-
дигидроимидазольного кольца
[12-16]. Однако
ридина смещены в слабое поле на 0.2-0.6 м. д., а
практически отсутствуют данные о гетероцикли-
также наблюдается сильное смещение сигналов
зации N-алкенильных производных 2-аминопири-
протонов NH2-группы (∆δ = 3.8-4.2 м. д.), что
дина под действием галогенов.
обусловлено появлением положительного заряда
на атоме азота. Сигналы протонов NСH2-группы
Ранее нами было установлено, что гетеро-
находятся в области 4.84-5.20 м. д. В наиболее
циклизация N-аллильного производного 3a под
слабом поле находятся сигналы протонов бром-
действием брома в хлороформе протекает c об-
аллильной группы для бромида 3в, что обусловле-
разованием бромида
2-бромметил-2,3-диги-
но влиянием электроноакцепторного атома брома.
дро-1Н-имидазо[1,2-a]пиридиния 5a [8]. В насто-
Галогениды 3a-г были исследованы методом
ящей работе данная реакция изучена в уксусной
кислоте и установлено, что реакция протекает так-
масс-спектрометрии путем прямого ввода образ-
ца в ионный источник. В условиях съемки про-
же с образованием бромида 5a. Нам удалось уста-
исходит элиминирование молекулы галогеново-
новить мультиплетность сигналов и КССВ, что не
дорода с образованием оснований 4a-г (схема 2),
было осуществлено в работе [8].
масс-спектры которых мы и наблюдаем.
По аналогичной схеме протекает внутримоле-
кулярная электрофильная гетероциклизация хло-
Общим в масс-спектрах иминов 4а-г являет-
рида 3б и бромида 3в под действием брома в ук-
ся наличие пиков молекулярного иона, а также
сусной кислоте. При этом впервые синтезированы
пиков, соответствующих образованию катионов
бромиды 2-метил-2-бромметил-2,3-дигидро-1Н-и-
2-аминопиридина с m/z 94 и пиридина с m/z 79 (см.
мидазо[1,2-a]пиридиния 5б и 2-бром-2-бромме-
таблицу). Максимальными в спектрах соединений
тил-2,3-дигидро-1Н-имидазо[1,2-a]пиридиния
5в
4а и 4б являются пики, соответствующие элими-
(схема 3) с выходом 88 и 69% соответственно. В
нированию метильного радикала и образованию
спектре ЯМР 1Н бромида 5в по сравнению с бро-
ароматичнеского катиона
1Н-имидазо[1,2-a]пи-
ридиния. Также присутствует пик катиона 2-ими-
мидом 5б наблюдается слабопольное смещение
синглетов групп СH2Br (4.68 м. д.) и NСH2 (5.28 м. д.),
но-1-метилено-1,2-дигидропиридиния с m/z 107,
соответствующий элиминированию винильного
что связано с влиянием электроноакцепторного
и метилвинильного радикалов. В спектрах соеди-
атома брома.
Схема 2.
Схема 3.
Hlg = Br (а, в, г); =Cl (б); R = CH2CH=CH2 (а),
CH2C(CH3)=CH2 (б), CH2C(Br)=CH2 (в), CH2C≡СH (г)
Hlg = Br (3а, в), Cl (3б); R = H (а), Me (б), Br (в).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1178
КАЛИТА и др.
Данные масс-спектроскопии соединений 4а-г
Соединение
m/z (Iотн, %)
4a
135 (5) [M + 1]+, 134 (48) [M]+, 133 (39) [M - H]+, 132 (6), 131 (5), 120 (9), 119 (100) [M - CH3]+,
C8H10N2
118 (7), 117 (3), 116 (5), 107 (21), 106 (12), 94 (4) [M - C3H4]+, 93 (4), 92 (4), 80 (9), 79 (31) [С5Н5N]+,
78 (47), 67 (8), 66 (7), 65 (3), 56 (16), 54 (3), 53 (6), 52 (15), 51 (13)
4б
149 (7) [M + 1]+, 148 (67) [M]+, 147 (74) [M - H]+, 146 (3), 145 (4), 134 (9), 133 (100) [M - CH3]+,
C8H12N2
132 (44), 131 (8), 130 (6), 120 (4), 119 (4), 118 (6), 117 (8), 116 (3), 108 (5), 107 (34), 106 (11),
105 (4), 95 (3), 94 (7) [M - C3H6]+, 93 (6), 92 (3), 81 (5), 80 (13), 79 (15) [С5Н5N]+, 78 (37), 77 (3),
73 (4), 70 (6), 67 (15), 66 (17), 65 (4), 60 (3), 55 (7), 54 (3), 53 (12), 52 (10), 51 (11)
4в
214 (6) [M + 2]+, 212 (6) [M]+, 134 (41), 133 (100) [M - Br]+, 132 (52) [M - HBr]+, 131 (34) [M - HBr
C8H9BrN2
- Н]+, 119 (4), 118 (19), 117 (7), 116 (18), 107 (11), 106 (12), 105 (17), 104 (8), 95 (8), 94 (26) [M -
C3H3Br]+, 93 (13), 92 (12), 91 (3), 89 (3), 82 (36), 81 (16), 80 (46), 79 (39) [С5Н5N]+, 78 (92), 77 (11),
76 (3), 68 (3), 67 (47), 66 (47), 65 (14), 64 (7), 63 (3), 54 (6), 52 (22), 51 (24), 50 (8)
4г
133 (5) [M + 1]+, 132 (50) [M]+, 131 (64) [M - H]+, 105 (10), 104 (37), 94 (3) [M - C3H2]+, 93 (3), 92
C8H8N2
(4), 82 (29), 81 (12), 80 (43), 79 (100) [С5Н5N]+, 78 (38), 77 (14), 76 (4), 67 (13), 66 (16), 65 (11), 64
(4), 54 (17), 53 (10), 52 (34), 51 (19), 50 (7)
Схема 4.
пиридиния 6г (схема 5). Мы полагаем, что, как и
при галогенциклизации
6-пропаргилсульфанил-
пурина [18], реакция протекает как сопряженное
транс-присоединение с образованием Е-изомеров.
В спектрах ЯМР 1Н соединений 5г и 6г имеются
химические сдвиги протонов групп СHBr (7.34 м. д.)
и CHI (7.72 м. д.) экзоциклической двойной связи.
Hlg = Br (3а), Cl (3б); R = H (а), Me (б).
Таким образом, при взаимодействии галоге-
нидов 2-амино-1-аллил-, металлил- и пропаргил-
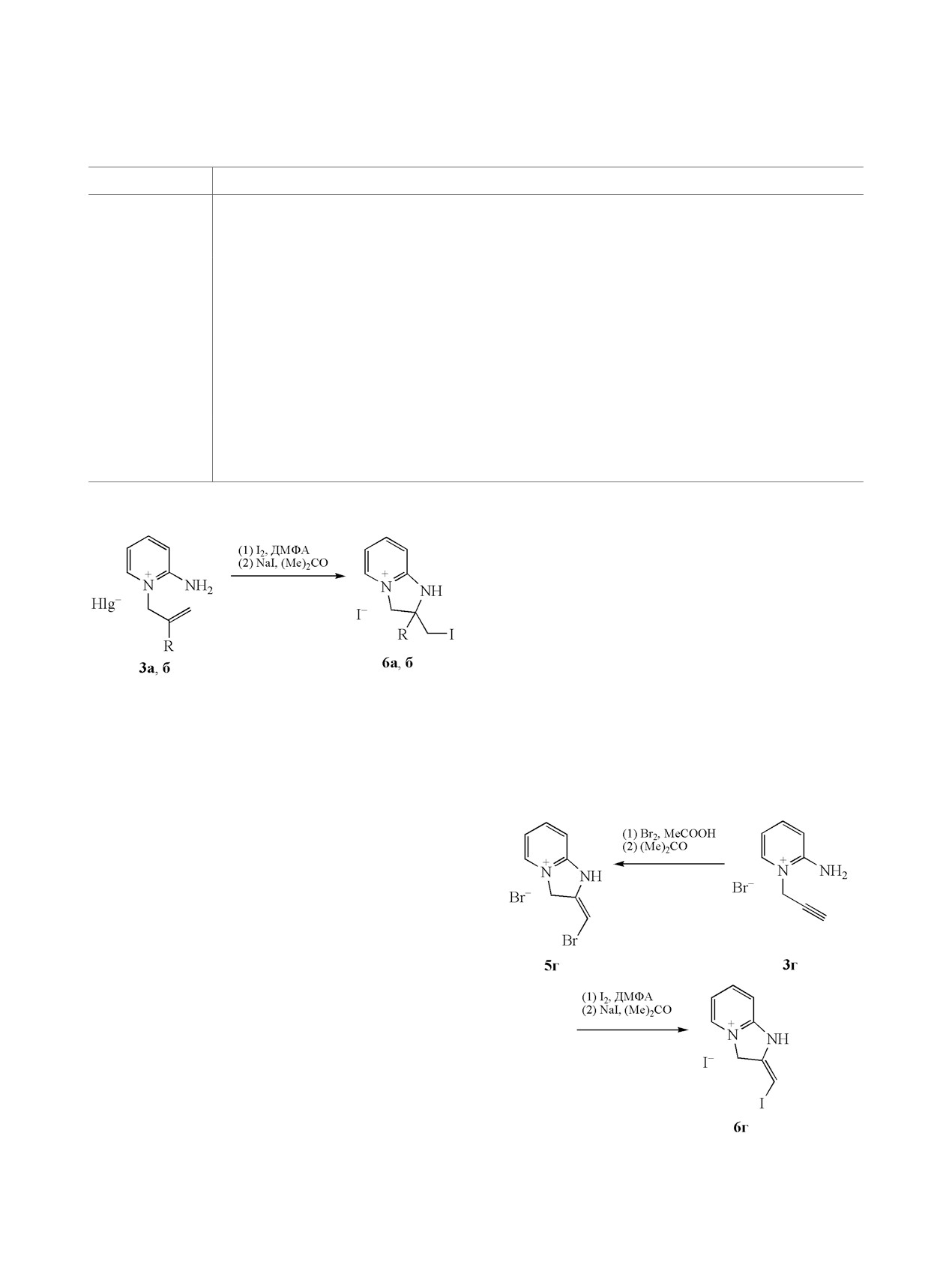
Нами впервые осуществлена иодциклизация
пиридиния с бромом и иодом, а также бромида
галогенидов 3а, б в ДМФА. Установлено, что
2-амино-1-(2-бромаллил)пиридиния с бромом
реакция протекает по схеме реакции галоген-
происходит аннелирование пятичленного цикла с
циклизации с образованием иодидов
2-иодме-
тил-2,3-ди-гидро-1Н-имидазо[1,2-a]пиридиния
Схема 5.
6а и 2-метил-2-иодметил-2,3-дигидро-1Н-имида-
зо[1,2-a]пиридиния 6б (схема 4).
При взаимодействии бромида 3в с иодом элек-
трофильная гетероциклизация не происходит что,
по-видимому, обусловлено ослаблением нуклео-
фильности двойной связи из-за влияния электро-
ноакцепторного атома брома.
В литературе описан синтез 2,3-дигидро-1Н-имида-
зо[1,2-a]пиридиниевой системы на основе взаи-
модействия 2-пропаргиламинопиридина с иодом
[17]. Нами при взаимодействии бромида 3г с бро-
мом получен бромид 2-бромметилено-2,3-диги-
дро-1H-имидазо[1,2-a]пиридиния 5г, а с иодом - иодид
2-иодметилено-2,3-дигидро-1H-имидазо[1,2-a]-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ 2,3-ДИГИДРО-1Н-ИМИДАЗО[1,2-a]ПИРИДИНИЕВЫХ СИСТЕМ
1179
образованием 2,3-дигидро-1Н-имидазо[1,2-a]пириди-
с (2H, NH2). Найдено, %: С 32.72; Н 3.48; N 9.50.
ниевых систем. Иодциклизация бромида 2-ами-
C8H10Br2N2. Вычислено, %: С 32.68; Н 3.43; N 9.53.
но-1-(2-бромаллил)пиридиния в данных условиях
Бромид 2-амино-1-пропаргилпиридиния (3г).
не протекает.
Выход 0.788 г (74%), бесцветные кристаллы, т. пл.
168-170°С (т. пл. 168-169°С [11]). Спектр ЯМР 1Н,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
δ, м. д.: 3.84 т (1H, ≡СН, J = 2.5 Гц), 5.11 д (2H,
Масс-спектры записаны на газовом хро-
NCH2, J = 2.5 Гц), 6.96 д. т (1H, Н5, J = 6.9, 1.3 Гц),
мато-масс-спектрометре GCMS-QP2010 Ultra
7.15 д (1H, Н3, J = 8.9 Гц), 7.92 д. д. д (1H, Н4, J =
Shimadzu (ЭУ, 70 эВ). Спектры ЯМР 1Н (400 МГц)
8.7, 7.0, 1.5 Гц), 8.19 д. д (1H, Н6, J = 6.7, 0.9 Гц),
записаны на приборе Bruker DRX-400, внутрен-
8.69 уш. с (1H, NH2).
ний стандарт - ТМС, растворитель - ДМСО-d6.
Синтез бромидов
2,3-дигидро-1Н-имидазо-
ИК спектры записаны на ИК Фурье спектро-
[1,2-a]пиридиния (5a-г). К раствору 2 ммоль га-
метре Shimadzu IRAffinity-1S в таблетках KBr.
логенида
2-амино-1-алкенил(пропаргил)пириди-
Элементный анализ выполнен на анализаторе
ния 3a-г в 3 мл уксусной кислоты, при охлажде-
Carlo Erba 1108. Температуры плавления опреде-
нии и перемешивании добавляли раствор 0.21 мл
лены на приборе ПТП (М).
(4 ммоль) брома в
2 мл уксусной кислоты.
Полученную смесь перемешивали 24 ч, затем от-
Синтез галогенидов 2-амино-1-алкенил(про-
паргил)пиридиния (3а-г). К раствору 0.47 г
фильтровывали кристаллы, сушили, обрабатывали
ацетоном, отфильтровывали и сушили.
(5 ммоль) 2-аминопиридина в 5 мл ацетона до-
бавляли 5 ммоль алкенил(пропаргил)галогенида.
Бромид 2-бромметил-2,3-дигидро-1Н-имида-
Полученную смесь перемешивали 24 ч, затем от-
зо[1,2-a]пиридиния (5а). Выход 0.382 г (65%), бе-
фильтровывали кристаллы и прекристаллизовыва-
лый порошок, т. пл. 173-175°С (разл.) (т. пл. 171°С
ли из изопропанола.
[8]). Спектр ЯМР 1Н, δ, м. д.: 4.10 д. к (2H, СН2Br,
Бромид
2-амино-1-аллилпиридиния
(3a).
J = 11.4, 5.0 Гц), 4.58 д. д (1H, NCH, J = 15.2, 10.3 Гц),
Выход 0.914 г (85%), бесцветные кристаллы, т. пл.
4.75 (1H, NCH, J = 15.2, 4.3 Гц), 4.89 д. т (1H, Н2,
140-142°С (т. пл. 146-148°С [9]). Спектр ЯМР 1Н,
J = 9.8, 4.6 Гц), 6.94 д. т (1H, Н7, J = 6.9, 1.2 Гц),
δ, м. д.: 4.84 д (2H, NCH2, J = 5.1 Гц), 5.08 д. д (1H,
7.12 д (1H, Н8, J = 8.9 Гц), 7.92 д. д. д (1H, Н7, J =
=СН, J = 17.2, 0.9 Гц), 5.33 д. д (1H, =СН, J = 10.5,
8.6, 7.1, 1.3 Гц), 8.07 д. д (1H, Н5, J = 6.7, 0.8 Гц),
0.9 Гц), 6.00 т. д. д (1H, СН=, J = 17.1, 10.4, 5.1 Гц),
8.70 с (1H, NH).
6.95 д. т (1H, Н5, J = 6.9, 1.3 Гц), 7.11 д (1H, Н3 J =
Бромид
2-метил-2-бромметил-2,3-дигидро-
8.8 Гц), 7.91 д. д. д (1H, Н4, J = 8.7, 7.1, 1.4 Гц), 8.06
1Н-имидазо[1,2-a]пиридиния (6б). Выход 0.542 г
д. д (1H, Н6 J = 6.7, 1.0 Гц), 8.47 уш. с (2H, NH2).
(88%), белый порошок, т. пл. 187-189°С (разл.).
Хлорид 2-амино-1-металлилпиридиния (3б).
Спектр ЯМР 1Н, δ, м. д.: 1.98-1.70 м (3H, Ме), 4.26-
Выход 0.481 г (52%), светло-желтые кристаллы,
3.99 м (2H, СН2Br), 4.90-4.76 м (1H, NCH), 4.97
т. пл. 213-215°С. (т. пл. 215°С [10]). Спектр ЯМР
д. д (1H, NCH, J = 15.5, 11.6 Гц), 6.88 т (1H, Н6,
1Н, δ, м. д.: 1.78 с (3H, Me), 4.34 c (1H, =CH), 4.83
J = 6.9 Гц), 7.21 д (1H, Н8, J = 9.0 Гц), 7.89 т (1H,
c (2H, NCH2), 4.95 c (1H, =CH), 6.93 т (1H, Н5,
Н7, J = 7.4 Гц), 8.04 д. д (1H, Н5, J = 12.4, 6.5 Гц),
J = 6.8 Гц), 7.23 д (1H, Н3, J = 8.7 Гц), 7.90 т (Н4,
9.01 с (1H, NH). Найдено, %: С 35.13; Н 3.89; N
J = 7.9 Гц), 7.99 д (1H, Н6, J = 6.3 Гц), 8.81 уш. с
9.05. C9H12Br2N2. Вычислено, %: С 35.09; Н 3.93;
(2H, NH2).
N 9.09.
Бромид 2-амино-1-(2-бромаллил)пиридиния
Бромид
2-бром-2-бромметил-2,3-дигидро-1Н-
(3в). Выход 1.367 г (93%), светло-желтые кри-
имидазо[1,2-a]пиридиния (6в). Выход 0.515 г
сталлы, т. пл. 197-200°С. Спектр ЯМР 1Н, δ, м. д.:
(69%), белый порошок, т. пл. 213-215°С (разл.).
5.24 с (2H, NCH2), 5.88 д (1H, =СН, J = 2.8 Гц),
Спектр ЯМР 1Н, δ, м. д.: 4.68 с (2H, СН2Br), 5.28 с
6.13 с (1H, =СН), 6.98 д. т (1H, Н5, J = 6.9, 1.3 Гц),
(2H, NCH2), 6.94 д. т (1H, Н6, J = 6.9, 1.2 Гц), 7.19 д
7.18 д (1H, Н3, J = 8.9 Гц), 7.95 д. д. д (1H, Н4, J =
(1H, Н8, J = 8.4 Гц), 7.94 т (1H, Н7, J = 7.9 Гц), 8.13
8.6, 7.1, 1.4 Гц), 8.07 д (1H, Н6, J = 6.7 Гц), 8.65 уш.
д (1H, Н5, J = 6.0 Гц), 9.03 с (1Н, NH). Найдено, %:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1180
КАЛИТА и др.
С 25.80; Н 2.46; N 7.45. C8H9Br3N2. Вычислено, %:
J = 9.0 Гц), 7.72 с (1H, = CHI), 7.78 д (1H, Н5, J =
С 25.77; Н 2.43; N 7.51.
6.7 Гц), 7.92 т (1H, Н7, J = 7.8 Гц), 8.68 с (1H, NH).
Бромид (Е)-2-бромметилено-2,3-дигидро-1Н-
Найдено, %: С 24.85; Н 2.04; N 7.30. C8H8I2N2.
имидазо[1,2-a]пиридиния (6г). Выход 0.514 г
Вычислено, %: С 24.89; Н 2.09; N 7.26.
(88%), светло-желтый порошок, т. пл. 206-208°С
ФОНДОВАЯ ПОДДЕРЖКА
(разл.). Спектр ЯМР 1Н, δ, м. д.: 5.36 с (2H, NCH2),
6.94 д. т (1H, Н7, J = 6.8, 0.9 Гц), 7.28 д (1H, Н8,
Работа выполнена при финансовой поддерж-
J = 8.9 Гц), 7.35 с (1H, =СНBr), 7.85 д (1H, Н5, J =
ке Правительства РФ (Постановление № 211 от
6.7 Гц), 7.91 т (1H, Н6, J = 7.9 Гц), 8.80 с (1H, NH).
16.03.2013 г., соглашение № 02.A03.21.0011) и
Найдено, %: С 32.87; Н 2.80; N 9.62. C8H8Br2N2.
в рамках выполнения государственного задания
Вычислено, %: С 32.91; Н 2.76; N 9.59.
Министерства образования и науки РФ (проект
Синтез иодидов
2,3-дигидро-1Н-имидазо-
№ 4.9665.2017/8.9).
[1,2-a]пиридиния (6a, б, г). К раствору 2 ммоль
галогенида
2-амино-1-алкенил(пропаргил)пириди-
КОНФЛИКТ ИНТЕРЕСОВ
ния 3a-г в 3 мл ДМФА добавляли раствор 1.016 г
Авторы заявляют об отсутствии конфликта ин-
(4 ммоль) иода в 3 мл ДМФА. Через 48 ч раствори-
тересов.
тель отгоняли, образующееся масло растворяли в
2 мл ацетона и добавляли раствор 0.744 г (4 ммоль)
СПИСОК ЛИТЕРАТУРЫ
NaI·2H2O в 4 мл ацетона. Соответствующие иоди-
ды отфильтровывали и сушили.
1.
Marinescu M. // Int. J. Pharm. and Bio Sci. 2017. Vol. 8.
N 2. P. 338. doi 10.22376/ijpbs.2017.8.2.p338-355
Иодид 2-иодметил-2,3-дигидро-1Н-имидазо-
2.
Cai Z.W., Wei D., Schroeder G.M., Cornelius L.A.M.,
[1,2-a]пиридиния
(6а). Выход
0.334 г
(43%),
Kim K., Chen X.T., Schmidt R.J. Williams D.K., Tokar-
светло-желтый порошок, т. пл. 198-200°С (разл.).
ski J.S., An Y., Sack J.S., Manne V., Kamath A., Zhang Y.,
Спектр ЯМР 1Н, δ, м. д.: 3.51 д (2H, CH2I, J =
Marathe P., Hunt J.T., Lombardo L.J., Fargnoli J.,
5.0 Гц), 4.34 д. д (1H, NCH, J = 12.8, 6.3 Гц), 4.45
Borzilleri R.M. // Bioorg. Med. Chem. Lett. 2008. Vol. 18.
т. д (1H, Н2, J = 10.8, 4.9 Гц), 4.80 д. д (1H, NCH,
N 11. P. 3224. doi 10.1016/j.bmcl.2008.04.047
J = 12.7, 10.4 Гц), 6.98 т (1H, Н6, J = 6.4 Гц), 7.08 д
3.
Hranjec M., Sovic I., Ratkaj I., Pavlovic G., Ilic N.,
(1H, Н8, J = 8.9 Гц), 7.98 д. д. д (1H, Н7, J = 8.6, 7.2,
Valjalo L., Pavelić K., Kraljević Pavelić S., Karminski-
1.2 Гц), 8.26 д (1H, Н5, J = 6.5 Гц), 9.47 с (1H, NH).
Zamola G. // Eur. J. Med. Chem. 2013. Vol. 59. P. 111.
Найдено, %: С 24.80; Н 2.64; N 7.18. C8H10I2N2.
doi 10.1016/j.ejmech.2012.11.009
Вычислено, %: С 24.77; Н 2.60; N 7.22.
4.
Amedio I. C. Jr., Lee G. T., Prasad K, Repic O. //
Иодид
2-метил-2-иодметил-2,3-дигидро-1Н-
Synth. Commun. 1995. Vol. 25. P. 2599. doi
имидазо[1,2-a]пиридиния (6б). Выход 0.314 г
10.1080/00397919508011806
(39%), белый порошок, т. пл. 202-204°С (разл.).
5.
Борисова И.А., Зубарев А.А., Родиновская Л.А., Ше-
Спектр ЯМР 1Н, δ, м. д.: 1.91-1.67 м (3H, Ме), 4.08
стопалов А.М. // Изв. АН. Сер. хим. 2018. Т. 1.
д. д (1H, CHI, J = 27.8, 11.0 Гц), 4.20 д (1H, CHI,
С. 168; Borisova I.A., Zubarev A.A., Rodinovskaya L.A.,
J = 14.9 Гц), 4.85-4.68 м (2H, NCH2), 6.94 т (1H,
Shestopalov A.M. // Russ. Chem. Bull. 2018. Vol. 67.
Н6, J = 6.9 Гц), 7.12 д (1H, Н8, J = 8.9 гц), 7.92 т
N 1. P. 168. doi 10.1007/s11172-018-2054-2.
(1H, Н7, J = 7.9 Гц), 8.00 д (1H, Н5, J = 6.9 Гц), 8.81
6.
Kabra V., Meel A., Mathur R., Kaushik P. // Phosphorus,
с (1H, NH). Найдено, %: С 26.85; Н 3.04; N 7.00.
Sulfur, Silicon. 2007. Vol. 182. N 6. P. 1403. doi
C9H12I2N2. Вычислено, %: С 26.89; Н 3.01; N 6.97.
10.1080/10426500601161056
Иодид (Е)-2-иодметилено-2,3-дигидро-1Н-
7.
Patil R.S., Kokate M.R., Salvi P.P., Kolekar S.S. // C. R.
имидазо[1,2-a]пиридиния (6г). Выход 0.517 г
Chimie. 2011. Vol. 14. N. 12. P. 1122. doi 10.1016/j.
crci.2011.07.009
(67%), светло-коричневый порошок, т. пл. 200-
202°С (разл.). Спектр ЯМР 1Н, δ, м. д.: 5.07 с (2H,
8.
Ким Д.Г., Успенская С.Е. // Изв. вузов. Сер. хим. и
NCH2), 6.96 т (1H, Н6, J = 6.8 Гц), 7.25 д (1H, Н8,
хим. технол. 1993. Вып. 9. С. 121.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ 2,3-ДИГИДРО-1Н-ИМИДАЗО[1,2-a]ПИРИДИНИЕВЫХ СИСТЕМ
1181
9. Seethalakshmi T., Venkatesan P., Nallu M., Lynch D.E.,
15. Kovalenko N.V., Cherepakha A.Yu., Kutrov G.P., Shi-
Thamotharan S. // Acta Crystallogr. (E). 2013. Vol. 69.
shkin O.V., Shishkina S.V. // Chem. Heterocycl. Comp.
N 6. P. 884. doi 10.1107/S1600536813012452
2012. Vol. 47. N 10. P. 1280. doi 10.1007/s10593-012-
10. Ким Д.Г., Бердникова Е.В., Слепухин П.А. // Вестн.
0903-8
ЮУрГУ. Сер. Хим. 2014. Т. 6. № 4. С. 5.
16. Groselj U., Bezensek J., Meden A., Svete J., Stanovnik B.,
11. Bakherad M., Nasr-Isfahani H., Keivanloo A.,
Oblak M., Anderluh P.S., Urleb U. // Heterocycles.
Doostmohammadi N. // Tetrahedron Lett. 2008. Vol. 49.
2008. Vol. 75. N 6. P. 1355. doi 10.3987/COM-07-11303
N 23. P. 3819. doi 10.1016/j.tetlet.2008.03.141
17. Sucunza D., Samadi A., Chioua M., Silva D.B., Yunta C.,
12. Paira R., Maity A., Mondal S., Naskar S., Sahu K.B.,
Infantes L., Carmo Carreiras M., Soriano E., Marco-
Saha P., Hazra A., Padmanaban E., Banerjee S., Mondal
Contelles J. // Chem. Commun. 2011. Vol. 47. N 17. P.
N.B. // Tetrahedron Lett. 2011. Vol. 52. N 14. P. 1653.
5043. doi 10.1039/c1cc10641d
doi 10.1016/j.tetlet.2011.01.134
13. Viscomi G.C., Campana M., Folegatti M., Cannata V.,
18. Ошеко К.Ю., Ким Д.Г., Ельцов О.С., Штукина Т.С. //
Righi P., Rosini G. Pat. WO 122436 (2010). Canada.
ЖОрХ. 2018. Т. 54. Вып. 9. С. 1390. doi 10.7868/
14. Dolzhenko A.V., Kolotova N.V., Kozminykh V.O., Chui
S0514749218090236; Osheko K.Yu., Kim D.G., El’t-
W.K., Heng P.W.S.. Khrustalev V.N. // Heterocycles.
sov O.S., Shtukina T.S. // Russ. J. Org. Chem. 2018. Vol. 54.
2004. Vol. 63. N 1. P. 55. doi 10.3987/COM-03-9909
N 9. P. 1406. doi 10.1134/S1070428018090233
Synthesis of 2,3-Dihydro-1H-imidazo[1,2-a]Pyridinium Systems
by Halocyclization
of 1-Alkenyl(propargyl)-2-aminopyridinium Halides
E. V. Kalita*, D. G. Kim, D. A. Rakhmatullina, M. A. Pylneva, and E. M. Krynina
South Ural State University (National Research University), pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: berdnik_lena@mail.ru
Received February 4, 2019; revised February 4, 2019; accepted February 10, 2019
Reaction of 2-aminopyridine with allyl bromide, methallyl chloride, 2-bromoallyl bromide and propargyl
bromide in acetone furnished 2-amino-1-allyl-, methallyl-, (2-bromoallyl)- and propargylpyridinium halides.
2-Amino-1-allyl(methallyl)pyridinium halides reacted with bromine and iodine to form 2-halomethyl-2,3-
dihydro-1H-imidazo[1,2-a]pyridinium systems.
2-Amino-1-(2-bromoallyl)pyridinium bromide underwent
heterocyclization under the action of bromine, and did not react with iodine. 2-Amino-1-propargylpyridinium
bromide reacted with bromine and iodine to form 2-halomethylene-2,3-dihydro-1H-imidazo[1,2-a]pyridinium
systems.
Keywords: 2-aminopyridine, 2-amino-1-alkenyl(propargyl)pyridinium halide, halocyclization, 2,3-dihydro-
1H-imidazo[1,2-a]pyridinium halide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019