ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 8, с. 1216-1232
УДК 547.341
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ
2(3)-ФУРОИЛФОСФОНАТОВ,
ФУНКЦИОНАЛИЗОВАННЫХ ПО СОСЕДНЕМУ
ПОЛОЖЕНИЮ ФУРАНОВОГО КОЛЬЦА
© 2019 г. Л. М. Певзнер*, Н. Б. Соколова
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 8 февраля 2019 г.
После доработки 8 февраля 2019 г.
Принято к печати 14 февраля 2019 г.
Изучены реакции хлорангидридов 2- и 3-фуранкарбоновых кислот имеющих хлорметильную или бу-
тилтиометильную группу в соседнем положении фуранового кольца, а также аналогично построен-
ных хлорангидридов гидрохлоридов N-морфолинометилфуранкарбоновых кислот с триэтилфосфитом.
Синтези-рованные хлорметилфуроилфосфонаты в реакцях с азидом натрия и тиоцианатом калия обра-
зуют соответствующие продукты нуклеофильного замещения в случае 4-хлорметил-3-фуроилфосфона-
та. В случае 3-хлорметил-2-фуроилфосфоната в реакции с азидом натрия параллельно с нуклеофиль-
ным замещением происходит расщепление связи Р-С. Тиоцианат калия в реакции с этим соединением
образует 3-тиоцианатометил-2-фуроилфосфонат. Все синтезированные стабильные фуроилфосфонаты
в реакции Виттига с резонансно-стабилизированными фосфоранами дают соответствующие фосфорили-
рованные фурилалкены. При наличии хлорметильной группы в фурановом кольце в реакциях с азидом
натрия и тиоцианатом калия данные соединения образуют соответствующие продукты нуклеофильного
замещения. Аналогично в реакции с морфолином при комнатной температуре они дают соответствую-
щие аминометильные производные.
Ключевые слова: хлорангидриды фуранкарбоновых кислот, реакция Арбузова, фуроилфосфонаты, ре-
акция Виттига, нуклеофильное замещение
DOI: 10.1134/S0044460X19080109
Ранее нами были изучены методы синтеза и хи-
илфосфонатов такого строения, а также реакций
мические свойства фуроилфосфонатов, имеющих
нуклеофильного замещения в фосфорилирован-
функциональную группу, удаленную от фосфор-
ных хлорметилфурилалкенах, получающихся в
содержащего заместителя [1, 2]. Продолжая работу
результате реакции Виттига.
в этом направлении, мы обратились к изучению
В качестве исходных веществ для синтеза хлор-
фуроилфосфонатов, имеющих заместитель, со-
метифуроилфосфонатов были использованы хло-
седствующий с ацилфосфонатной группой. Целью
рангидриды 1, 3 и 5. Реакцию проводили в моль-
нашего исследования было выявление влияния
ном соотношении хлорангидрид:триэтилфосфит =
соседствующего заместителя на протекание реак-
1:1.05 в бензоле при комнатной температуре. В
ции Арбузова, а также на реакции нуклеофильного
случае хлорангидридов 1 и 3 были получены соот-
замещения в фуроилфосфонатах такого строения,
ветствующие фуроилфосфонаты 2 и 4 с выходами
содержащих в качестве заместителя хлорметиль-
96 и 98% соответственно (схема 1). В спектре ЯМР
ную группу. Предполагалось также изучить осо-
1Н соединения 2 наблюдалось два сигнала хлорме-
бенности протекания реакции Виттига с резонанс-
тильной группы при 4.76 и 4.82 м. д. Фурановый
но-стабилизированными фосфоранами для фуро-
протон Н4 тоже проявлялся двумя сигналами при
1216
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1217
Схема 1.
CH2Cl
CH2Cl
P(OEt)3
PO(OEt)2
O
O COCl
O
1
2
ClOC
O
CH2Cl
P(OEt)
3
CH2Cl
(EtO)2OP
O
O
3
4
6.78 (уш. с) и 6.80 м. д. (д, JHH = 2.6 Гц).
[3]. Кипячение ее в бензоле с хлористым тиони-
Единственный уширенный сигнал фуранового
лом в присутствии ДМФА привело к получению
протона Н5 находился при 7.66 м. д.
лабиль-ного хлорангидрида 8 с т. кип. 69°С (1 мм
рт. ст.) с выходом 24% (схема 2). В спектрах ЯМР
Хлорангидрид
2-хлорметилфуран-3-карбо-
новой кислоты 5 реагировал в этих условиях
сигнал протона фуранового кольца наблюдался
при 6.56 м. д., а сигналы ядер углерода фуранового
иначе. Из реакционной массы было выделено
стабильное вещество с т. кип. 144-146°С (1 мм рт.
кольца располагались при 108.34 (С4), 120.25 (С3),
135.88 (С5) и 160.82 м. д. (С2).
ст.). Химический сдвиг фосфора в этом соеди-
нении был равен -2.33 м. д., что характерно для
Реакция Арбузова хлорангидрида 8 с триэтил-
ацил-фосфонатов. В спектре ЯМР 1Н наблюдался
фосфитом при комнатной температуре в бензо-
сигнал протонов метильной группы при 2.59 м. д.
ле привела к образованию фуроилфосфоната 6 с
и сигнал фуранового протона при 7.06 м. д. В спек-
выходом 98% (схема 2). Он оказался довольно
тре ЯМР 13С сигналы ядер углерода фуранового
лабильным, в вакууме не перегонялся, а при хра-
кольца наблюдались при 121.16 (С4), 122.63 (С3,
нении расщеплялся влагой воздуха с выделением
2JPС = 68.7 Гц), 142.76 (С5) и 162.54 м. д. (С2, 3JPС =
диэтилфосфита и кислоты 7. В спектре ЯМР сиг-
14.5 Гц). Сигнал ядра карбонильного углерода про-
нал ядра фосфора регистрировался при -2.19 м. д.,
являлся при 193.12 м. д. (1JPС = 184.1 Гц). Данные
уширенный сигнал метильной группы наблюдался
масс-спектрометрии высокого разрешения указы-
при 2.55 м. д., а сигнал фуранового протона Н3 -
вали на то, что в молекуле присутствует один атом
при 6.95 м. д. Сигналы ядер углерода фуранового
хлора. Мы предположили, что полученное соеди-
кольца находились при 107.16 (С4, 3JPС = 2.0 Гц),
нение - это 2-метил-5-хлор-3-фуроилфосфонат 6,
122.06 (С3, 2JPС = 68.8 Гц), 135.57 (С5) и 160.36 м. д.
и провели его встречный синтез исходя из извест-
(С2, 3JPС = 14.5 Гц). Сигнал ядра карбонильного
ной 2-метил-5-хлорфуран-3-карбоновой кислоты 7
углерода проявлялся при 193.25 м. д. (1JPС =
Схема 2.
O
Cl
PO(OEt)2
COCl
O
PO(OEt)3
9
O CH2Cl
5
O
COCl
COOH
P(OEt)3
PO(OEt)2
SOCl2
ДМФА
Cl
O
Cl
O
Cl
O
8
6
7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1218
ПЕВЗНЕР, СОКОЛОВА
Схема 3.
Схема 4.
184.2 Гц). Таким образом, как по стабильности,
73 м. д., что соответствует литературным данным
так и по спектральным характеристикам получен-
[4]. В ИК спектре наблюдалась полоса поглоще-
ные продукты сильно отличались. Поэтому мето-
ния при 2102 см-1 соответствующая алифатиче-
дом исключения веществу, синтезированному по
ской азидогруппе [5]. Образование ацилазидной
реакции Арбузова из хлорангидрида 5, была при-
группы при расщеплении связи Р-С доказывалось
писана структура
2-метил-4-хлор-3-фуроилфос-
присутствием полос поглощения при 2141 (ацила-
фоната 9.
зид) и 1687 см-1 (С=О), что хорошо согласуется с
данными работы [6] для фуроилазидов. В спектре
Фуроилфосфонаты 2 и 4 были введены в реак-
ции нуклеофильного замещения с тиоцианатом ка-
ЯМР 13С наблюдался сигнал углерода карбониль-
ной группы при 162.90 м. д. также характерный
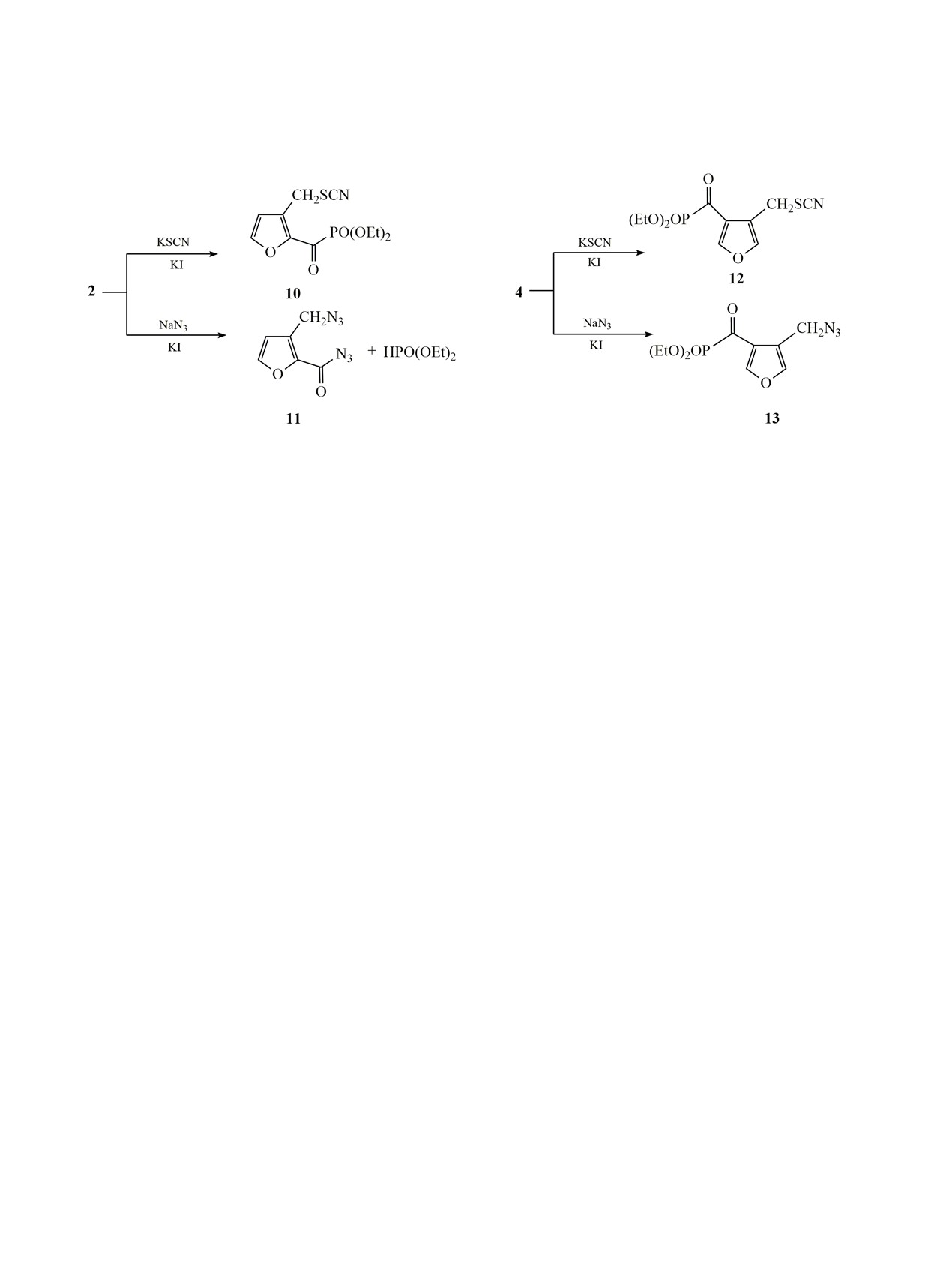
лия и азидом натрия. Взаимодействие соединения
2 с тиоцианатом калия проводили в ацетонитриле
для фуроилазилов. Имеющиеся данные позволя-
ют приписать полученному диазиду структуру 11.
при комнатной температуре (схема 3). Мольное со-
отношение тиоцианат-фосфонат составляло 2:1, в
Поскольку отделить диэтилфосфит от соединения
11 не удалось, выход был рассчитан исходя из от-
качестве катализатора использовали иодид калия в
количестве 10 мол%. Продуктом реакции являлся
носительной интенсивности сигналов фурана и
диэтилфосфита в спектре ЯМР 1Н и общей массы
тиоцианат 10 (выход 83%). Образование связи С-S
доказывалось с помощью данных спектроскопии
образца. Он составил 70%.
ЯМР. Сигнал протонов фрагмента Н2СS распола-
Хлорметилфуроилфосфонат 4 в аналогичных
гался при 4.33 м. д., сигнал ядра соответствующего
условиях нацело превращается в тиоцианатоме-
атома углерода регистрировали при 28.27 м. д., а сиг-
тильное производное 12 в течение 24 ч с выходом
нал ядра углерода фрагмента CN - при 111.68 м. д.
99% (схема 4). Реакция соединения 4 с азидом на-
трия завершается при комнатной температуре в те-
Реакцию с азидом натрия проводили анало-
чение 48 ч, азидометильное производное 13 обра-
гично в ацетоне, но из-за малой растворимости ази-
зуется с выходом 88%. Последнее соединение при
да процесс завершался в течение недели (схема 3).
нагревании выше 50°С разлагается.
Оказалось, что в этом случае параллельно про-
исходит замещение галогена и расщепление свя-
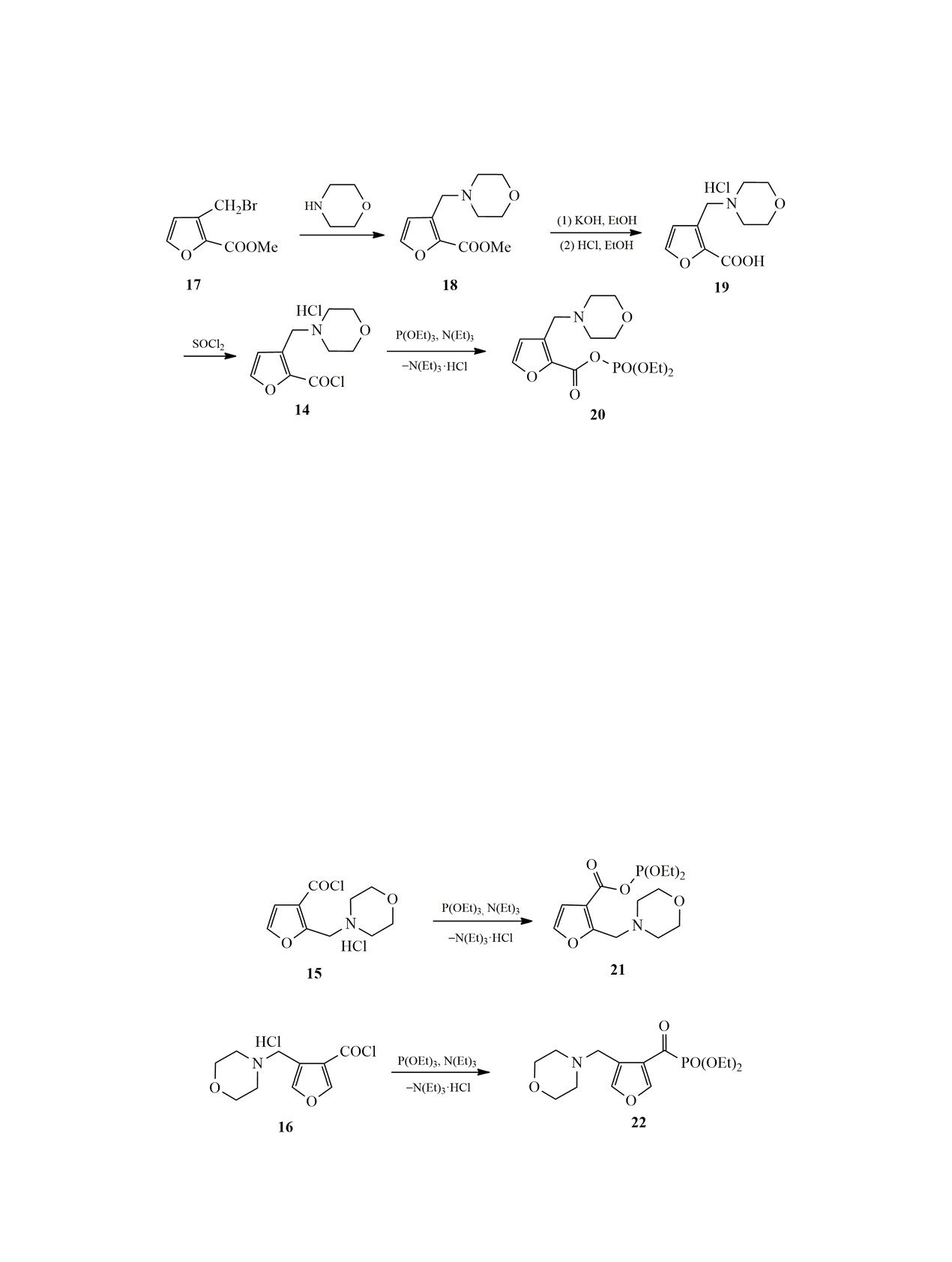
Далее мы решили изучить применимость ре-
зи Р-С с элиминированием диэтилфосфористого
акции Арбузова для получения аминометилфуро-
натрия, который, взаимодействуя с влагой возду-
илфосфонатов исходя из гидрохлоридов хлоранги-
ха, постепенно переходил в диэтилфосфит (РН,
дридов аминометилфуранкарбоновых кислот анало-
6.79 м. д., 1JPН = 692.8 Гц, δР 7.33 м. д.).
гично работе [2]. Гидрохлориды 14-16 были син-
Образование азидометильной группы доказыва-
тезированы исходя из галогенметильных произво-
лось присутствием сигнала протонов при 4.64 м. д.
дных эфиров соответствующих фуранкарбоновых
и сигнала соответствующего атома углерода при
кислот (схема 5). Схема реакции представлена на
45.60 м. д. С помощью NH-корреляций были опре-
примере синтеза соединения 14. Реакцию бромида
делены сдвиги ядер азота азидогруппы N1 249 и N2
17 с морфолином проводили при комнатной тем-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1219
Схема 5.
пературе в течение 10 ч в бензоле, выделенный
фосфора в его спектре ЯМР наблюдался при
аминоэфир 18 гидролизовали в течение 8 ч спир-
-0.98 м. д., а синглет ядра карбонильного атома
товым раствором гидроксида калия при 80°С, по-
углерода - при 151.51 м. д.
сле чего обрабатывали 2 экв. раствора хлористого
Реакцию хлорангидрида 15 с триэтилфосфитом
водорода в этаноле. Кристаллический гидрохло-
проводили аналогично, однако основным продук-
рид аминокислоты 19 выделяли после упаривания
том оказался смешанный ангидрид фуранкарбоно-
спиртового раствора обработкой смесью ацетона
вой и фосфористой кислот 21 (выход 65%, схема 6).
и этилацетата в объемном соотношении 1:1. Для
Химический сдвиг фосфора для данного соедине-
превращения в гидрохлорид хлорангидрида 14 его
ния равен 138.75 м. д., что хорошо согласуется с
кипятили 6 ч в хлористом тиониле.
литературными данными по смешанным ангидри-
дам карбоновой и фосфористой кислот [7]. В спек-
Реакцию гидрохлорида хлорангидрида 14 с
тре ЯМР 13С синглет ядра карбонильного атома
триэтилфосфитом проводили в бензоле при моль-
углерода располагался при 160.54 м. д.
ном соотношении хлорангидрид:фосфит = 1:1.02
в присутствии 1 экв. триэтиламина при комнатной
Хлорангидрид 16 в аналогичных условиях об-
температуре в течение 12 ч. Основным продуктом
разует фуроилфосфонат 22 с выходом 86% (схема 7).
реакции оказался смешанный ангидрид фуран-
Сигнал ядра фосфора в спектре ЯМР этого соеди-
карбоновой и фосфорной кислот 20, который был
нения наблюдается при -3.19 м. д., дублет карбо-
выделен с выходом 78% (схема 5). Сигнал ядра
нильного углерода регистрируется при 194.06 м. д.
Схема 6.
Схема 7.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1220
ПЕВЗНЕР, СОКОЛОВА
Схема 8.
O
O
ClH2C
COOEt
BuSH2C
BuSH2C
BuSH
OEt
(1) KOH, EtOH
OH
K2CO3
(2) HCl
O
O
O
24
25
26
O
BuSH2C
COCl
BuSH2C
SOCl2
P(OEt)3
PO(OEt)2
ДМФА
O
O
23
27
(1JPC = 179.5 Гц), а дублет углерода С3 фуранового
действием хлористого тионила в бензоле в при-
кольца - при 125.59 м. д. (2JPC = 69.4 Гц).
сутствии ДМФА при кипячении был получен
хлорангидрид 23 с выходом 96%. Хлорангидрид
Таким образом, взаимодействие гидрохлоридов
28 был получен аналогично. В случае кислоты 30
хлорангидридов морфолинометилфуранкарбо-но-
взаимодействие с хлористым тионилом проходило
вых кислот с триэтилфосфитом протекает, видимо,
сложно. В спектре ЯМР 1Н выделенного соедине-
по двум маршрутам. Можно предположить, что в
ния отсутствовали синглет протонов фрагмента
ходе одного из них гидрохлорид триэтиламина де-
фуран-СН2S и триплет протонов фрагмента SСН2
алкилирует триэтилфосфит с образованием хло-
бутильного заместителя. Вместо этого в области
ристого этила и эфиросоли диэтилфосфита. Атом
3.6-3.9 м. д. присутствовало несколько мультиплет-
фосфора в последней, видимо, находится пред-
ных сигналов. При хранении этот образец быстро
почтительно в трехкоординированном состоянии.
превращался в хрупкую нерастворимую массу, что
Затем следует нуклеофильное замещение хлора с
свидетельствовало об образовании сетчатого полимера.
образованием смешанного эфироангидрида кар-
боновой и фосфористой кислот. В зависимости от
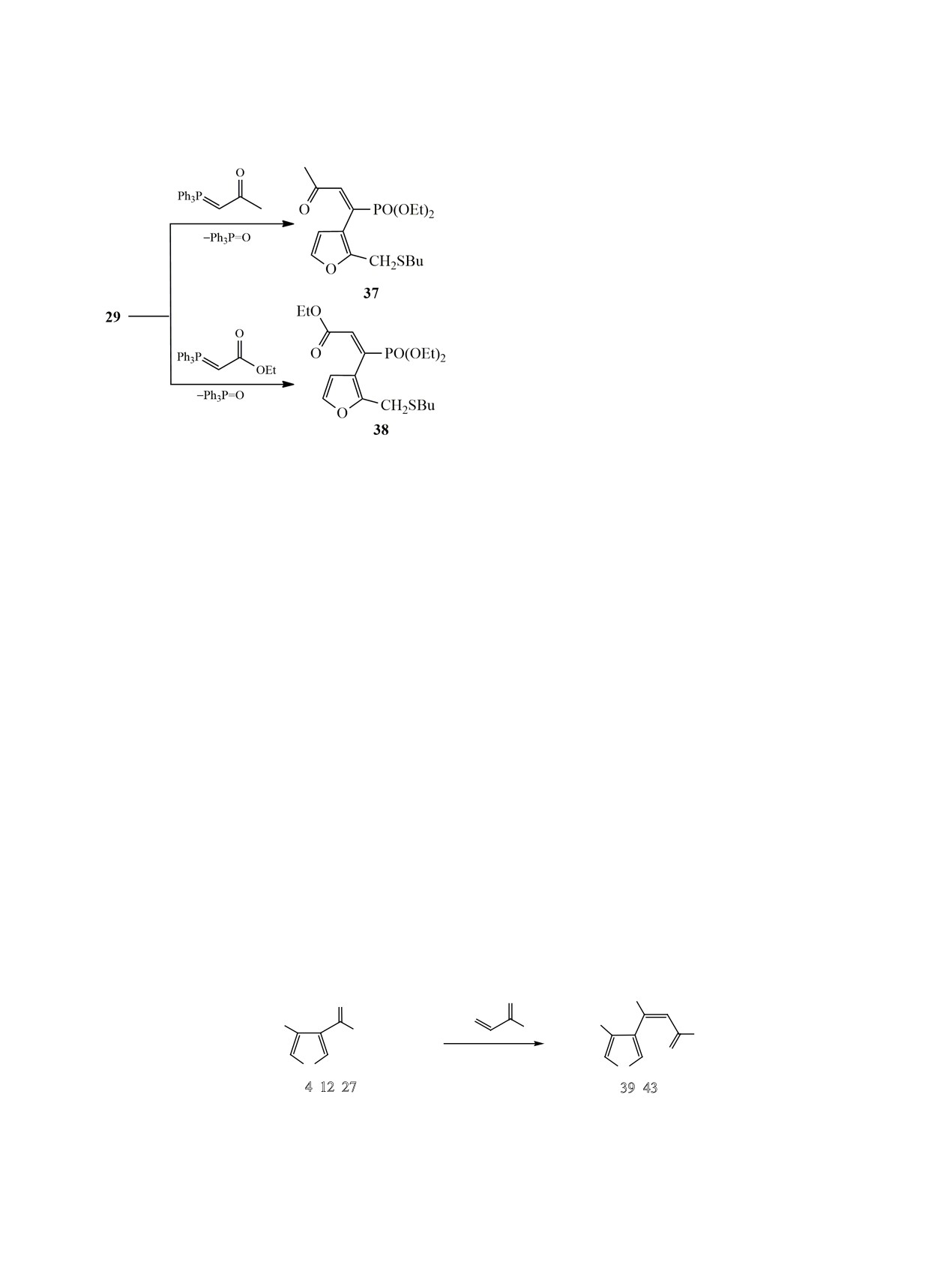
Хлорангидриды 23 и 28 реагируют с триэтил-
легкости окисления это соединение обнаружива-
фосфитом при комнатной температуре по схеме
ется или само по себе (продукт 21) или в виде фос-
реакции Арбузова с образованием ацилфосфона-
фата (продукт 20). Альтернативное направление
тов 27 и 29, имеющих бутилтиометильную группу
представлено реакцией Арбузова (продукт 22). В
в положениях 4 или 2 фуранового кольца (схема 9).
случае 2,3-дизамещенных фуранов преобладает
Выходы полученных соединений составили 96 и 95%.
первый маршрут, а в случае 3,4-дизамещенного -
Таким образом, используя реакцию Арбузова
второй.
была получена серия 2- и 3-фуроилфосфонатов,
Следующим шагом в нашей работе было изуче-
имеющих функциональную группу в соседнем по-
ние фуроилфосфонатов, в молекулах которых со-
ложении фуранового кольца. Влияние заместите-
седнее с ацилфосфонатной группой положение в
лей на направление протекания реакции с три- этил-
кольце занято бутилтиометильным заместителем.
фосфитом было обнаружено только у хлорангид-
Синтез исходных хлорангидридов проводился по
ридов морфолинометилфуранкарбоновых кислот.
одной и той же схеме. Он представлен на примере
Синтезированные фуроилфосфонаты были вве-
получения соединения 23 (схема 8). Эфир галоген-
дены в реакцию Виттига с резонансно-стабили-
метилфуранкарбоновой кислоты 24 при действии
бутантиола при мольном соотношении галогенид :
Схема 9.
тиол = 1:1.1 в ацетонитриле в присутствии твер-
O
дого карбоната калия при 30-40°С образует бу-
COCl
тилтиометильное производное 25 с выходом 84%.
P(OEt)3
PO(OEt)2
Гидролизом его спиртовым раствором гидроксида
калия с последующим подкислением была полу-
O CH2SBu
O CH2SBu
чена кислота 26 с выходом 67%. Последующим
28
29
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1221
Схема 10.
CH2SCN
PO(OEt)2
KSCN
O
O
CH2Cl
O
-Ph3P=O
34
2+
Ph3P
PO(OEt)2
O
CH2N3
32
O
NaN3
PO(OEt)2
O
O
35
зированными фосфоранами (схема 10). Реакции
офил = 1:2 в присутствии 10 мол% иодистого ка-
проводили при кипячении в бензоле, мольное со-
лия. Реакция тиоцианата калия с галогенметилке-
отношение фосфонат:фосфоран составляло 1:1.1.
тоном 33 завершалась в течение суток при комнат-
Контроль за протеканием реакции осуществляли
ной температуре и проходила исключительно по
с помощью спектроскопии ЯМР 31Р, отслеживая
атому серы. Тиоцианат 34 был выделен с выходом
постепенное уменьшение сигнала ядра фосфора
54%. Образование тиоцианатной группы под-
ацилфосфоната. Время, необходимое для заверше-
тверждалось наличием сигнала протонов тиоцианато-
ния процесса, составляло 9-10 ч и мало зависело
метильной группы при 4.21 м. д., сигнала соответ-
от структуры субстрата и природы фосфорана.
ствующего ядра углерода при 29.51 м. д. и сигна-
Реакция во всех случаях протекала стереоселек-
лом ядра углерода фрагмента SCN при 112.68 м. д.
тивно с образованием соединений, у которых фос-
Реакцию соединения 33 с азидом натрия из-за
фонатная и карбонильная группа имели транс-рас-
небольшой растворимости азида в ацетонитриле
положение относительно двойной связи.
проводили при 70°С, процесс сопровождался за-
В результате реакции ацилфосфоната 2 с аце-
метным осмолением и завершался в течение 9 ч.
тилметилентрифенилфосфораном 32 с выходом
Выход азида 35 составил 38%. Сигнал протонов
61% был получен непредельный кетон 33. Сигнал
азидометильной группы в спектре ЯМР получен-
ядра фосфора в этом соединении наблюдался при
ного соединения находился при 4.25 м. д., а сигнал
12.71 м.д., сигнал протонов метильной группы
соответствующего ядра углерода - при 45.59 м. д.
кетона располагался при 2.05 м.д., а дублет оле-
2-Бутилтиометил-3-фуроилфосфонат
29 реа-
финового протона при 7.13 м.д. (JPH = 22.0 Гц).
гировал с ацетилметилен- (32) и этоксикарбонил-
Уширенный сигнал углерода метильной группы
метилентрифенилфосфораном
(36) в условиях,
проявлялся при 29.68 м.д., дублет ядра углерода С1
описанных выше. Выход 4-фурилбут-3-ен-2-она
при двойной связи находился при 131.77 м.д. (2JPС =
37 составил 80%, а эфира 3-(фурил)акриловой
3.1 Гц), дублет углерода С2 при 128.97 м.д. (1JPС =
кислоты 38 - 86% (схема 11). Это стабильные на
179.0 Гц), а дублет кетонной карбонильной груп-
воздухе и в растворах при умеренном нагревании
пы при 198.67 м.д. (3JPС = 20.2 Гц).
соединения.
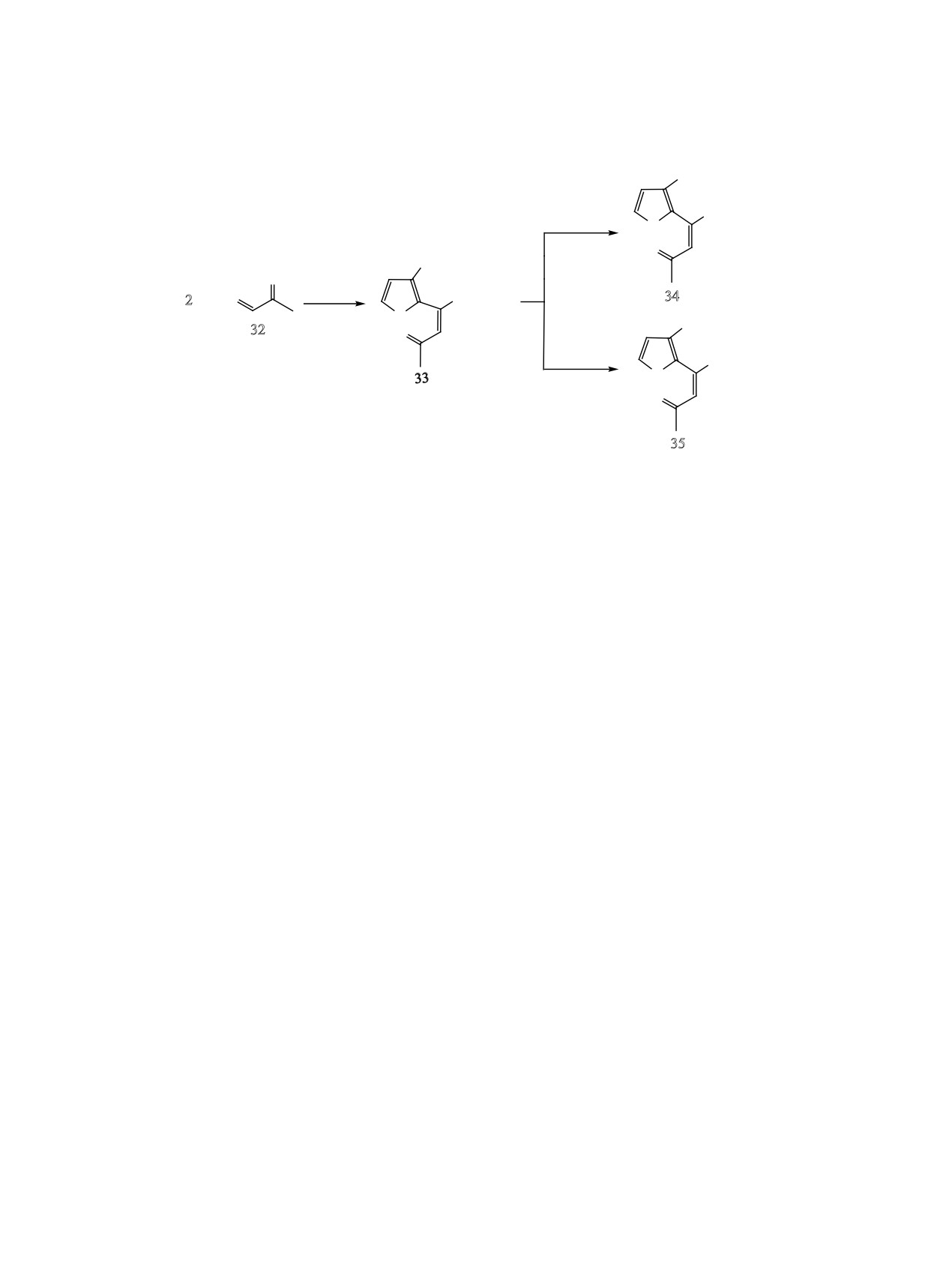
Учитывая, что в используемых условиях реак-
ции Виттига тиоцианатометилфуроилфосфонат 10
4-Замещенные 3-фуроилфосфонаты 4, 12, и 27
разлагается, а аналогичное азидометильное произ-
также были введены в реакцию с фосфоранами 32 и
водное при нуклеофильном замещении хлора в со-
36 в использованных ранее условиях. Выход хлор-
единении 2 не образуется, мы ввели непредельный
метильных (39, 40) и бутилтиометильных (42,43)
кетон 33 в реакции с тиоцианатом калия и азидом
производных колебался в пределах 80-90%, тогда
натрия (схема 10). Замещение проводили в ацето-
как для тиоцианатометильного производного 41 он
нитриле в мольном соотношении фосфонат:нукле-
составил всего 54% (схема 12).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1222
ПЕВЗНЕР, СОКОЛОВА
Схема 11.
дометильной группы в спектре этого соединения
наблюдался при 4.18 м. д., а сигнал соответствую-
щего атома углерода - при 44.82 м. д.
Таким образом, присутствие соседствующей
группы в фурановом кольце фуроилфосфонатов
заметным образом влияет как на протекание
реакции Арбузова в случае функционализо-
ванных фуроилхлоридов, так и на протекание
реакции Виттига в случае функционализован-
ных фуроилфосфонатов. Установлено, что в
случае
2-хлорметил-3-фуроилхлорида реакция
Арбузова сопровождается перемещением гало-
гена из боковой цепи в положение 4 фураново-
го кольца. Показано, что гидрохлориды хлоран-
гидридов
N-морфолинометилфуранкарбоновых
кислот в реакции с триэтилфосфитом проявля-
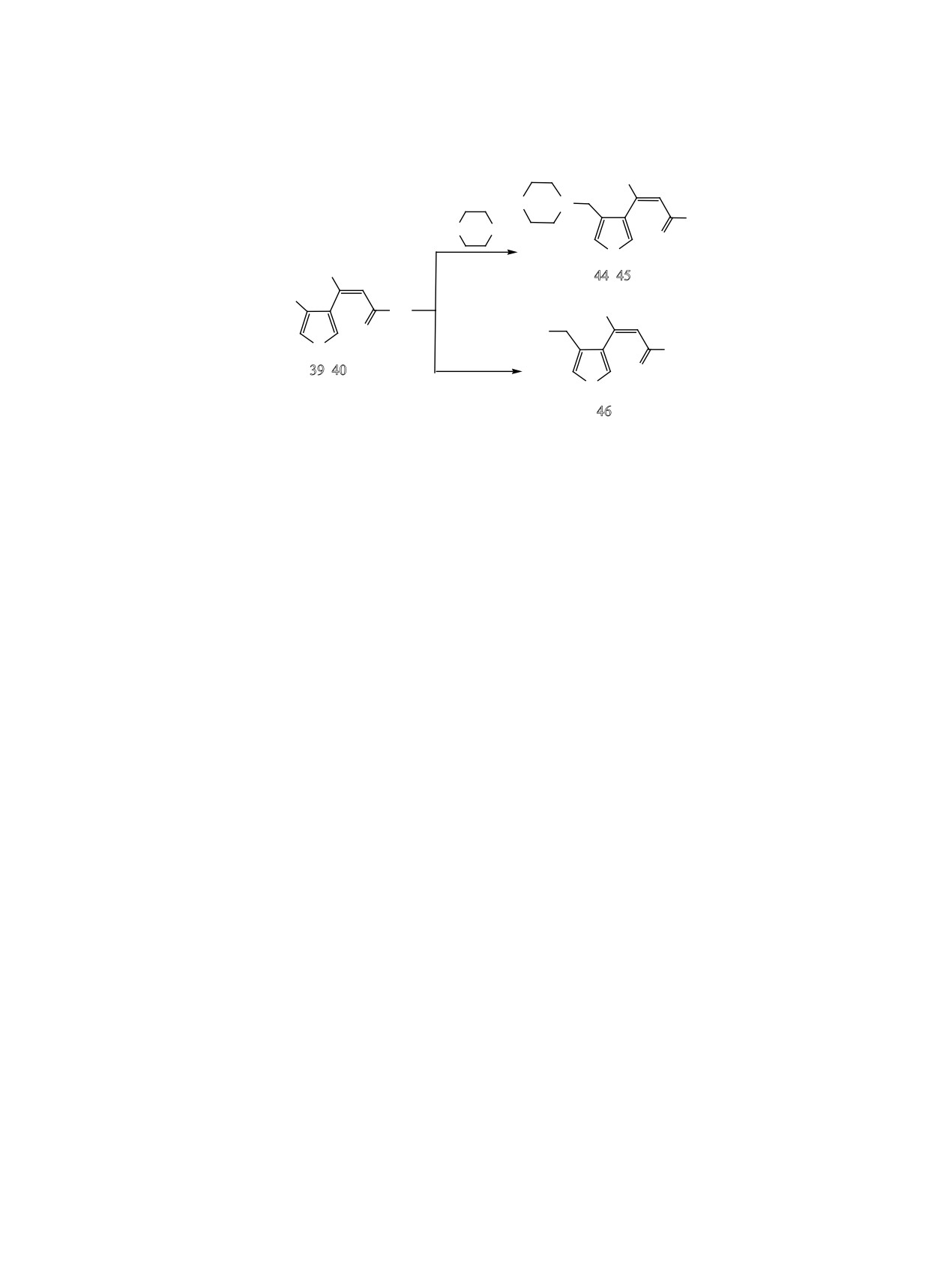
Хлорметильные производные 39 и 40 были вве-
ют двойственную реакционную способность.
дены в некоторые реакции нуклеофильного заме-
2,3-Дизамещенные фураны образуют смешанные
щения. Оказалось, что реакция этих соединений
ангидриды фосфористой и карбоновой кислот,
с аминами при повышенных температурах проте-
окисляющиеся затем до производных фосфорной
кает сложно, но при 25°С происходит гладкое за-
кислоты, тогда как 3,4-дизамещенный изомер об-
мещение хлора на морфолильный остаток с обра-
разует фуроилфосфонат. Присутствие сульфидной
зованием соответствующих непредельных амино-
группировки в боковой цепи на протекании реак-
фосфонатов фуранового ряда 44 и 45 с выходами
ции Арбузова не сказывается.
85 и 55% соответственно (схема 13). Более низкий
Азидометильная и тиоцианатометильная груп-
выход сложного эфира 45 по сравнению с кетоном
пы могут снижать термическую стабильность как
44 может быть связан с частичным гидролизом его
фуроилфосфонатов, так и фосфорилированных
при выделении.
фурилалкенов, что делает невозможным исполь-
Хлорметилкетофосфонат 39 был введен так-
зовать реакцию Виттига для синтеза некоторых
представителей фурилалкенов данного строения.
же в реакцию с азидом натрия. Учитывая терми-
ческую нестабильность фуроилфосфоната 13, не
Альтернативным подходом служит использование
аналогичных хлорметильных производных в реак-
дающую использовать его в реакции Виттига, это
циях нулеофильного замещения. Они иногда про-
единственный путь к соответствующим непре-
текают успешно только при ведении процесса при
дельным азидометилфурилфосфонатам. Реакцию,
комнатной температуре в полярных апротонных
как и раньше, проводили при мольном соотноше-
растворителях в течение длительного времени.
нии хлорид:азид натрия:иодистый калий = 1:2:0.1.
Оказалось, что в ацетонитриле при 80°С про-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дукт реакции осмоляется, но в ацетоне при 20°С
в течение недели замещение протекает гладко, и
Спектры ЯМР 1Н, 13С, 31Р и 15N получали на
фосфорилированный азидокетон 46 был выделен
приборе Bruker ASCENDTM-400 (400.13, 100.16,
с выходом 95% (схема 13). Сигнал протонов ази-
161.97 и 40.54 МГц соответственно). ИК спектры
Схема 12.
O
(EtO)2OP
O
XH2C
Ph3P
XH2C
PO(OEt)2
Y
Y
O
O
O
4, 12, 27
39-43
Y = Me, OEt; X = Cl (4), NCS (12), BuS (27); X = Cl, Y = Me (39), OEt (40); X = NCS, Y = Me (41); X = BuS, Y= Me (42),
OEt (43).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1223
Схема 13.
(EtO)2OP
O
N
Y
HN
O
O
O
(EtO)2OP
44, 45
XH2C
Y
(EtO)2OP
O
N3
O
Y
NaN3
39, 40
O
KI
O
46
X = Me (39, 44, 46), OEt (40, 45).
снимали на ИК Фурье-спектрометре Shimadzu
натрия. Отгоняли хлороформ, остаток выдержи-
IRTracer 100 c приставкой НПВО Specas с алмаз-
вали в вакууме (1 мм рт. ст.) 1 ч при комнатной
ным окном. Масс-спектры высокого разреше-
температуре.
ния был получены на масс-спектрометре Bruker
Метиловый эфир
3-(N-морфолинометил)фу-
MicrOTOF Температуры плавления измерены на
ран-2-карбоновой кислоты (18) получали из ме-
приборе Boёtius.
тилового эфира 3-бромметилфуран-2-карбоновой
2-Метил-5-хлор-3-фуроилхлорид
(8). К су-
кислоты. Выход 62%, светло-коричневое масло.
спензии 0.90 г 2-метил-5-хлорфуран-3-карбоновой
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.46 уш. с (4Н,
кислоты в 10 мл бензола прибавляли при переме-
NСН2-морфолин), 3.68 уш. с (4Н, ОСН2-морфо-
шивании 0.4 мл хлористого тионила и 1 каплю
лин), 3.73 с (2Н, NСН2-фуран), 3.89 с (3Н, СН3О),
ДМФА. Полученную смесь кипятили 8 ч, затем
6.58 уш. с (1Н, Н4-фуран), 7.47 уш. с (1Н, Н5-
отгоняли летучие компоненты, остаток перего-
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 51.67
няли в вакууме. Выход 0.20 г (20%), бесцветное
(СН3О), 52.98 (NСН2-фуран), 53.50 (NСН2-морфо-
масло, т. кип. 69°С (1 мм рт. ст.). Спектр ЯМР 1Н
(CDCl3), δ, м. д.: 2.60 с (3Н, СН3-фуран), 6.56 с
лин), 66.94 (ОСН2-морфолин), 113.94 (С4-фуран),
(1Н, Н4-фуран). Спектр ЯМР 13С (CDCl3), δС, м.
131.96 (С3-фуран), 140.59 (С5-фуран), 145.14 (С2-
д.: 14.30 (СН3-фуран), 108.34 (С4-фуран), 120.25
фуран), 159.60 (С=О).
(С3-фуран), 135.88 (С5-фуран), 160.82 (С2-фуран),
Этиловый эфир
2-(N-морфолинометил)фу-
161.03 (С=О).
ран-3-карбоновой кислоты получали из этилово-
Синтез (N-морфолино)метильных произво-
го эфира 2-бромметилфуран-3-карбоновой кисло-
дных эфиров фуранкарбоновых кислот (общая
ты. Выход 87%, светло-желтое масло. Спектр ЯМР
методика). К раствору 10 ммоль эфира гало-
1Н (CDCl3), δ, м. д.: 1.33 т (3Н, СН3, JНН = 7.2 Гц),
ген-метилфуранкарбоновой кислоты в 40 мл бен-
2.52 т (4Н, NСН2-морфолин, JНН = 4.4 Гц), 3.68 т (4Н,
зола прибавляли при перемешивании 25 ммоль
ОСН2-морфолин, JНН = 4.4 Гц), 3.91 с (2Н, NСН2-
морфолина. При использовании хлорида реакци-
фуран), 4.27 к (2Н, СН2О, JНН = 7.2 Гц), 6.66 д (1Н,
он-ную массу кипятили 8 ч при перемешивании.
Н4-фуран, JНН = 2.0 Гц), 7.33 д (1Н, Н5-фуран, JНН =
Бромметильные производные реагировали в тече-
2.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.29
ние 10 ч при комнатной температуре. После окон-
(СН3-эфир), 46.33 (NСН2-фуран), 53.54 (NСН2-
чания реакции смесь экстрагировали 10%-ной
морфолин),
60.33 (СН2О-эфир),
66.64 (ОСН2-
соляной кислотой (3×10 мл), промывали водный
морфолин), 110.69 (С4-фуран), 116.73 (С3-фуран),
экстракт 7 мл этилацетата и при перемешивании
141.80 (С5-фуран),
157.06 (С2-фуран),
163.60
доводили добавлением карбоната натрия рН реак-
(С=О).
ционной смеси до 9-10. Выделившееся масло экс-
трагировали хлороформом (3×15 мл), промывали
Этиловый эфир
4-(N-морфолинометил)фу-
экстракт 10 мл раствора NaCl и сушили сульфатом
ран-3-карбоновой кислоты получали из этилово-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1224
ПЕВЗНЕР, СОКОЛОВА
го эфира 4-хлорметилфуран-3-карбоновой кисло-
(NСН2-мор-фолин),
63.53
(ОСН2-морфолин),
ты. Выход 65%, светло-коричневое масло. Спектр
111.92 (С4-фуран), 121.50 (С3-фуран), 145.67 (С5-
ЯМР 1Н (CDCl3), δ, м. д.: 1.32 т (3Н, СН3, JНН =
фуран), 148.48(С2-фуран), 164.04 (С=О).
7.2 Гц), 2.50 т (4Н, NСН2-морфолин, JНН = 4.4 Гц),
Гидрохлорид 4-(N-морфолинометил)фуран-3-кар-
3.62 с (2Н, NСН2-фуран), 3.68 т (4Н, ОСН2-
боновой кислоты. Кристаллизуется при зати-
морфолин, JНН = 4.4 Гц), 4.27 к (2Н, СН2О, JНН =
рании с этилацетатом. Выход 95%, т. разл.
7.2 Гц), 7.35 уш. с (1Н, Н5-фуран), 7.90 д (1Н, Н2-
>250°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
фуран, JНН = 1.2 Гц). Спектр ЯМР 13С (CDCl3),
3.09 уш. с (4Н, NСН2-морфолин), 3.90 уш. с (4Н,
δС, м. д.: 14.30 (СН3-эфир), 52.03 (NСН2-фуран),
ОСН2-морфолин), 4.40 с (2Н, NСН2-фуран), 8.14 д
53.52 (NСН2-морфолин), 60.20 (СН2О-эфир), 67.01
(1Н, Н5-фуран, JНН = 1.6 Гц), 8.42 д (1Н, Н2-фуран,
(ОСН2-морфолин), 118.34 (С3-фуран), 121.53 (С4-
J
= 1.6 Гц), 11.44 уш. с (1Н, ОН). Спектр ЯМР
НН
фуран),
142.46 (С5-фуран),
148.83 (С2-фуран),
13С (ДМСО-d6), δС, м. д.: 48.58 (NСН2-фуран),
163.41 (С=О).
51.05 (NСН2-морфолин), 63.15 (ОСН2-морфолин),
Гидролиз эфиров (N-морфолинометил)фуран-
113.77 (С4-фуран), 119.05 (С3-фуран), 147.48 (С5-
карбоновых кислот (общая методика). К рас-
фуран), 150.23 (С2-фуран), 164.57 (С=О).
твору
10 ммоль эфира (N-морфолинометил)-
Получение гидрохлоридов хлорангидридов
фуранкарбоновой кислоты в 50 мл этанола при-
(N-морфолинометил)фуранкарбоновых кислот
бавляли 15 ммоль безводной гидроокиси калия.
(общая методика). Гидрохлорид соответствую-
Полученную смесь кипятили 8 ч при перемеши-
щей (N-морфолинометил)фуранкарбоновой кис-
вании, затем прибавляли 25 ммоль раствора хло-
лоты (10 ммоль) суспендировали в 30 мл хлори-
ристого водорода в этаноле и перемешивали 30 мин.
стого тионила. Полученную смесь кипятили 8 ч
Отфильтровывали осадок хлористого калия и про-
при интенсивном перемешивании. После отгонки
мывали его 20 мл этанола. Полученный спиртовый
хлористого тионила остаток затирали с гексаном.
раствор упаривали досуха, образовавшуюся массу
Образовавшиеся кристаллы отфильтровывали,
затирали с растворителем, указанным для каждого
промывали гексаном и выдерживали в вакууме
конкретного вещества. Выделившиеся кристаллы
(1 мм рт. ст) 20 мин при комнатной температуре.
отфильтровывали и сушили на воздухе до посто-
Полученные соединения нацело гидролизуются
янной массы.
остаточной влагой при растворении в ДМСО, их
Гидрохлорид
3-(N-морфолинометил)фуран-
спектральные данные идентичны данным соответ-
2-карбоновой кислоты
(19). Кристаллизуется
ствующих гидрохлоридов кислот.
из смеси ацетон-этилацетат (1:1). Выход 93%,
Гидрохлорид 3-(N-морфолинометил)-2-фуроил-
т. разл. 200°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
хлорида (14). Выход 88%, т. пл. 165°С (этилацетит-
3.06 уш. т (4Н, NСН2-морфолин, JНН = 4.4 Гц), 3.13
гексан, 1:3).
уш. т (4Н, ОСН2-морфолин, JНН = 4.4 Гц), 4.51 с
(2Н, NСН2-фуран), 7.18 д (1Н, Н4-фуран, JНН =
Гидрохлорид 2-(N-морфолинометил)-3-фуроил-
2.0 Гц), 7.98 д (1Н, Н5-фуран, JНН = 2.0 Гц), 11.95
хлорида (15). Выход 79%, светло-серые кристаллы,
уш. с (1Н, ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.:
т. пл. 146°С (гексан).
50.29 (NСН2-фуран),
51.32 (NСН2-морфолин),
Гидрохлорид 4-(N-морфолинометил)-3-фуроил-
63.40 (ОСН2-морфолин), 115.46 (С4-фуран), 122.12
хлорида (16). Выход 97%, белые кристаллы, т. пл.
(С3-фуран), 143.82 (С5-фуран), 146.68(С2-фуран),
182°С (гексан).
159.97 (С=О).
Синтез бутилтиометильных производных
Гидрохлорид 2-(N-морфолинометил)фуран-3-кар-
эфировфуранкарбоновыхкислот (общаяметодика).
боновой кислоты. Кристаллизуется из смеси аце-
К раствору 10 ммоль эфира галогенметилфуран-
тон-этилацетат (2:1). Выход 67%, т. разл. 185°С.
карбоновой кислоты в 40 мл ацетонитрила при-
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.20 уш. с
бавляли 11 ммоль бутантиола и 22 ммоль без-
(4Н, NСН2-морфолин), 3.83 уш. с (4Н, ОСН2-
водного карбоната калия. Реакционную смесь
морфолин), 4.64 с (2Н, NСН2-фуран), 6.83 д (1Н, Н4-
перемешивали при 30-40°С в течение 3-4 ч до
фуран, JНН = 2.0 Гц), 7.93 д (1Н, Н5-фуран, JНН =
полного прекращения выделения углекислого
2.0 Гц), 9.73 уш. с (1Н, ОН). Спектр ЯМР 13С
газа. Отфильтровывали неорганические соли и
(ДМСО-d6), δС, м. д.: 42.97 (NСН2-фуран), 51.36
промывали их на фильтре 10 мл ацетонитрила.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1225
Полученный раствор упаривали, остаток раство-
ран-СН2S), 6.58 уш. с (1Н, Н4-фуран), 7.47 уш. с
ряли в 30 мл хлороформа и промывали последо-
(1Н, Н5-фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.:
вательно 20 мл воды и 20 мл раствора NaCl. После
13.63 (С4Н3-бутил),
21.94 (С3Н2-бутил),
25.90
сушки хлористым кальцием отгоняли хлороформ,
(С1Н2S-бутил),
31.26 (С2Н2-бутил),
31.34 (фу-
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
ран-СН2S),
51.73 (СН3О),
113.95 (С4-фуран),
при комнатной температуре.
132.99 (С3-фуран), 140.08 (С5-фуран), 145.29 (С2-
фуран), 159.59 (С=О).
Этиловый эфир 4-(бутилтиометил)фуран-3-кар-
боновой кислоты (25) получали из этилового
Щелочной гидролиз эфиров (бутилтиометил)фу-
эфира 4-хлорметилфуран-3-карбоновой кислоты.
ранкарбоновых кислот (общая методика). К
Выход 84%, светло-желтое масло. Спектр ЯМР
раствору 10 ммоль эфира (бутилтиометил)фуран-
1Н (CDCl3), δ, м. д.: 0.91 т (3Н, С4Н3-бутил, JНН =
карбоновой кислоты в 50 мл этанола прибавляли
7.2 Гц), 1.34 т (3Н, СН3, JНН = 7.2 Гц), 1.40 сек-
12 ммоль гидроокиси калия. Полученную смесь
стет (2Н, С3Н2-бутил, JНН = 7.2 Гц), 1.57 квинтет
кипятили при перемешивании 8 ч, затем отгоняли
(2Н, С2Н2-бутил, JНН = 7.2 Гц), 2.50 т (2Н, С1Н2S-
этанол. Остаток растворяли в 15 мл воды и промы-
бутил, JНН = 7.2 Гц), 3.78 с (2Н, фуран-СН2S), 4.31
вали 8 мл этилацетата. Водный раствор подкисля-
к (2Н, СН2О, JНН = 7.2 Гц), 7.39 д (1Н, Н5-фуран,
ли концентрированной соляной кислотой до рН =
JНН = 1.6 Гц), 7.98 д (1Н, Н2-фуран, JНН = 1.6 Гц).
2-3, насыщали хлористым натрием и экстрагиро-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.67 (С4Н3-
вали хлоро-формом (3×15 мл). Экстракт сушили
бутил),
14.27 (СН3-эфир),
22.01 (С3Н2-бутил),
сульфатом натрия, отгоняли хлороформ, остаток
24.98 (С1Н2S-бутил), 31.42 (С2Н2-бутил),
31.68
выдерживали в вакууме (1 мм рт. ст.) 1 ч при ком-
(фуран-СН2S), 60.30 (СН2О), 117.50 (С4-фуран),
натной температуре.
122.81 (С3-фуран), 141.95 (С5-фуран), 149.09 (С2-
4-(Бутилтиометил)фуран-3-карбоновая кис-
фуран), 163.22 (С=О).
лота (26). Выход 67%, светло-желтые кристаллы,
Этиловый эфир 2-(бутилтиометил)фуран-3-кар-
т. пл. 62-63°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
боновой кислоты получали из этилового эфира
0.93 т (3Н, С4Н3-бутил, JНН = 7.2 Гц), 1.42 секстет
2-бромметилфуран-3-карбоновой кислоты. Выход
(2Н, С3Н2-бутил, JHH = 7.2 Гц), 1.59 квинтет (2Н,
98%, светло-желтое масло. Спектр ЯМР
1Н
С2Н2-бутил, JНН = 7.2 Гц), 2.53 т (2Н, С1Н2S-бутил,
(CDCl3), δ, м. д.: 0.90 т (3Н, С4Н3-бутил, JНН =
J
= 7.2 Гц), 3.80 с (2Н, фуран-СН2S), 7.44 (1Н,
НН
7.2 Гц), 1.36 т (3Н, СН3, JНН = 7.2 Гц), 1.38 сек-
Н5-фуран), 8.11 (1Н, Н2-фуран), 8.91 уш. с (1Н.
стет (2Н, С3Н2-бутил, JНН = 7.2 Гц), 1.56 квинтет
ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.72
(2Н, С2Н2-бутил, JНН = 7.2 Гц), 2.55 т (2Н, С1Н2S-
(С4Н3-бутил), 22.03 (С3Н2-бутил), 24.81 (С1Н2S-
бутил, JНН = 7.2 Гц), 4.08 с (2Н, фуран-СН2S), 4.31
бутил), 31.40 (С2Н2-бутил), 31.71 (фуран-СН2S),
к (2Н, СН2О, JНН = 7.2 Гц), 6.68 д (1Н, Н4-фуран,
117.22 (С3-фуран), 122.98 (С4-фуран), 142.37 (С5-
JНН = 1.8 Гц), 7.32 д (1Н, Н5-фуран, JНН = 1.8 Гц).
фуран), 150.65 (С2-фуран), 168.73 (С=О).
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.62 (С4Н3-
бутил),
14.32 (СН3-эфир),
21.96 (С3Н2-бутил),
2-(Бутилтиометил)фуран-3-карбоновая кис-
27.06 (С1Н2S-бутил), 31.47 (С2Н2-бутил),
31.72
лота. Выход 69%, светло-желтые кристаллы, т. пл.
(фуран-СН2S), 60.41 (СН2О), 110.86 (С4-фуран),
35°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.90 т (3Н,
114.51 (С3-фуран), 141.39 (С5-фуран), 158.74 (С2-
С4Н3-бутил, JНН = 7.2 Гц), 1.38 секстет (2Н, С3Н2-
фуран), 163.53 (С=О).
бутил, JНН = 7.2 Гц), 1.57 квинтет (2Н, С2Н2-бутил,
JНН = 7.2 Гц), 2.56 т (2Н, С1Н2S-бутил, JНН =
Метиловый эфир 3-(бутилтиометил)фуран-2-кар-
7.2 Гц), 4.09 с (2Н, фуран-СН2S), 6.72 уш. с (1Н,
боновой кислоты получали из метилового эфира
Н4-фуран), 7.36 уш. с (1Н, Н5-фуран), 11.63 уш. с
3-бромметилфуран-2-карбоновой кислоты, после отгон-
(1Н, ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.62
ки хлороформа остаток перегоняли в в акууме.
(С4Н3-бутил), 21.96 (С3Н2-бутил), 26.93 (С1Н2S-
Выход 70%, светло-желтое масло, т. кип. 154°С
бутил), 31.48 (С2Н2-бутил), 31.78 (фуран-СН2S),
(1 мм рт. ст.). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.86
111.02 (С4-фуран), 113.69 (С3-фуран), 141.75 (С5-
т (3Н, С4Н3-бутил, JНН = 7.0 Гц), 1.36 секстет (2Н,
фуран), 160.56 (С2-фуран), 169.48 (С=О).
С3Н2-бутил, JНН = 7.0 Гц), 1.54 квинтет (2Н, С2Н2-
бутил, JНН = 7.0 Гц), 2.44 т (2Н, С1Н2S-бутил,
3-(Бутилтиометил)фуран-2-карбоновая кис-
JНН = 7.0 Гц), 3.90 с (3Н, СН3О), 3.92 с (2Н, фу-
лота. Выход 71%, светло-желтые кристаллы, т. пл.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1226
ПЕВЗНЕР, СОКОЛОВА
40°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.88 т (3Н,
ответствующего фуроилхлорида в 30 мл бензола
С4Н3-бутил, JНН = 7.0 Гц), 1.37 секстет (2Н, С3Н2-
прибавляли при перемешивании 10.5 ммоль три-
бутил, JНН = 7.0 Гц), 1.56 квинтет (2Н, С2Н2-бутил,
этилфосфита. Реакционную массу перемешивали
JНН = 7.0 Гц), 2.65 т (2Н, С1Н2S-бутил, JНН =
1-2 ч и оставляли на ночь. На следующий день
7.0 Гц), 3.94 с (2Н, фуран-СН2S), 6.64 д (1Н, Н4-
отгоняли бензол, остаток выдерживали в вакууме
фуран, JНН = 7.0 Гц), 7.57 д (1Н, Н5-фуран,
(1 мм рт. ст.) 1 ч при комнатной температуре.
JНН = 7.0 Гц), 11.63 уш. с (1Н, ОН). Спектр ЯМР
Диэтил-3-хлорметил-2-фуроилфосфонат (2).
13С (CDCl3), δС, м. д.: 13.64 (С4Н3-бутил), 21.96
Выход
96%, светло-коричневое масло. Спектр
(С3Н2-бутил), 25.94 (С1Н2S-бутил), 31.32 (С2Н2-
ЯМР 1Н (CDCl3), δ, м. д.: 1.39 т (6Н, СН3, JНН =
бутил), 31.32 (фуран-СН2S), 114.41 (С4-фуран),
7.2 Гц), 4.32 д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.8 Гц),
135.48 (С3-фуран), 139.36 (С5-фуран), 146.58 (С2-
4.75 с (1Н, СН2Cl), 4.82 с (1Н, СН2Cl), 6.78 уш. с
фуран), 164.31 (С=О).
(0.5 Н, Н4-фуран), 6.80 д (0.5 Н, Н4-фуран, JНН =
2.6 Гц), 7.66 уш. с (1Н, Н5-фуран). Спектр ЯМР
Получение (бутилтиометил)фуроилхлоридов
13С (CDCl3), δС, м. д.: 16.39 д (СН3-фосфонат,
(общая методика). К раствору 10 ммоль бутилти-
2JРС = 5.8 Гц), 35.90 (СН2Cl), 36.36 (СН2Cl), 64.28
ометилфуранкарбоновой кислоты в 40 мл бензола
д (СН2ОР, 2JРС = 7.1Гц), 115.43 (С4-фуран), 134.19
прибавляли при интенсивном перемеши-вании
д (С3-фуран, 3JРС = 8.7 Гц), 147.42 д (С2-фуран, 2JРС =
13 ммоль хлористого тионила и 2 капли ДМФА.
60.1 Гц), 147.45 д (С2-фуран, 2JРС = 60.1 Гц), 147.79
Полученную смесь кипятили при перемешивании
(С5-фуран), 148.21 (С5-фуран), 187.38 д (С=О, 1JРС =
8 ч, затем отгоняли летучие вещества, остаток вы-
187.6 Гц). Спектр ЯМР 31Р (CDCl3): δР -2.31 м. д.
держивали в вакууме (1 мм рт. ст.) 1 ч при комнат-
ной температуре.
Диэтил-4-хлорметил-3-фуроилфосфонат (4).
Выход 98%, светло-коричневое масло. Спектр ЯМР
4-(Бутилтиометил)-3-фуроилхлорид
(23).
1Н (CDCl3), δ, м. д.: 1.38 т (6Н, СН3, JНН = 7.2 Гц),
Выход 96%, светло-желтое масло. Спектр ЯМР
4.21–4.29 м (4Н, СН2ОР ), 4.72 уш. с (2Н, СН2Cl),
1Н (CDCl3), δ, м. д.: 0.93 т (3Н, С4Н3-бутил, JНН =
7.56 д. т (1Н, Н5-фуран, JРН = 2.8, JНН = 1.4 Гц), 8.79
7.2 Гц), 1.42 секстет (2Н, С3Н2-бутил, JНН = 7.2 Гц),
д (1Н, Н2-фуран, JРН = 1.6 Гц). Спектр ЯМР 13С
1.58 квинтет (2Н, С2Н2-бутил, JНН = 7.2 Гц), 2.52
(CDCl3), δС, м. д.: 16.36 д (СН3-фосфонат, 2JРС =
т (2Н, С1Н2S-бутил, JНН = 7.2 Гц), 3.79 с (2Н,
5.7 Гц), 36.26 (СН2Cl), 64.27 д (СН2ОР, 2JРС = 7.1Гц),
фуран-СН2S), 7.49 д (1Н, Н5-фуран, JНН = 1.4 Гц),
122.15 д (С4-фуран, 3JРС = 10.8 Гц), 124.66 д (С3-
8.23 (1Н, Н2-фуран, JНН = 1.4 Гц). Спектр ЯМР 13С
фуран, 2JРС = 69.8 Гц), 143.28 (С5-фуран), 155.34
(CDCl3), δС, м. д.: 13.67 (С4Н3-бутил), 21.97 (С3Н2-
д (С2-фуран, 3JРС = 4.1 Гц), 194.10 д (С=О, 1JРС =
бутил), 24.70 (С1Н2S-бутил), 31.35 (С2Н2-бутил),
181.6 Гц). Спектр ЯМР 31Р (CDCl3): δР -3.69 м. д.
31.87 (фуран-СН2S), 123.06 (С4-фуран),
128.34
Диэтил-2-метил-5-хлор-3-фуроилфосфонат
(С3-фуран), 143.36 (С5-фуран), 154.47 (С2-фуран),
(6). Выход 96%, светло-коричневое масло. Спектр
159.18 (С=О).
ЯМР 1Н (CDCl3), δ, м. д.: 1.41 т (6Н, СН3, JНН =
2-(Бутилтиометил)-3-фуроилхлорид
(28).
7.0 Гц), 2.55 c (3Н, СН3-фуран), 4.27 д. к (4Н,
Выход 89%, светло-желтое масло. Спектр ЯМР
СН2ОР, JНН = 7.0, JРН = 14.8 Гц ), 6.95 с (1Н, Н4-
1Н (CDCl3), δ, м. д.: 0.91 т (3Н, С4Н3-бутил, JНН =
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.59
7.2 Гц), 1.39 секстет (2Н, С3Н2-бутил, JНН = 7.2 Гц), 1.56
(СН3-фуран), 16.34 д (СН3-фосфонат, 2JРС = 5.6 Гц),
квинтет (2Н, С2Н2-бутил, JНН = 7.2 Гц), 2.56 т (2Н,
64.05 д (СН2ОР, 2JРС = 7.1 Гц), 107.16 д (С4-фуран,
С1Н2S-бутил, JНН = 7.2 Гц), 4.01 с (2Н, фуран-
3JРС = 2.0 Гц), 122.06 д (С3-фуран, 2JРС =68.8Гц),
СН2S), 6.81 д (1Н, Н4-фуран, JНН = 2.0 Гц), 7.37
135.57 (С5-фуран), 160.36 д (С2-фуран, 3JРС = 14.5
д (1Н, Н5-фуран, JНН = 2.0 Гц). Спектр ЯМР 13С
Гц), 193.25 д (С=О, 1JРС = 184.2 Гц). Спектр ЯМР
(CDCl3), δС, м. д.: 13.62 (С4Н3-бутил), 21.91 (С3Н2-
31Р (CDCl3): δР -2.18 м. д.
бутил), 27.16 (С1Н2S-бутил), 31.35 (С2Н2-бутил),
Диэтил-2-метил-4-хлор-3-фуроилфосфонат
32.04 (фуран-СН2S), 112.78 (С4-фуран),
118.76
(9). Остаток после отгонки растворителей пере-
(С3-фуран), 141.90 (С5-фуран), 161.56 (С2-фуран),
гоняли в вакууме. Собирали фракцию с т. кип.
161.98 (С=О).
144-146°С (1 мм рт. ст.). Выход 37%, бесцветное
Реакция фуроилхлоридов с триэтилфосфи-
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.32 т (6Н,
том (общая методика). К раствору 10 ммоль со-
СН3, JНН = 7.0 Гц), 2.59 c (3Н, СН3-фуран), 4.10
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1227
д. к (4Н, СН2ОР, JНН = 7.0, JРН = 14.8 Гц), 7.06 с
Реакция гидрохлоридов хлорангидридов
(1Н, Н5-фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.:
(N-морфолинометил)фуранкарбоновых кислот с
14.74 (СН3-фуран), 16.36 д (СН3-фосфонат, 2JРС =
триэтилфосфитом (общая методика). К суспен-
5.7 Гц), 64.07 д (СН2ОР, 2JРС = 7.2 Гц), 121.16 (С4-
зии 10 ммоль гидрохлорида 14-16 в 30 мл бензола
фуран), 122.63 д (С3-фуран, 2JРС = 68.7 Гц), 142.75
прибавляли при перемешивании при комнатной
(С5-фуран), 162.54 д (С2-фуран, 3JРС = 14.5 Гц),
температуре 11 ммоль триэтиламина. Реакционную
193.12 д (С=О, 1JРС = 184.1 Гц). Спектр ЯМР 31Р
массу перемешивали 20 мин при комнатной темпе-
(CDCl3): δР -2.31 м. д. Масс-спектр, m/z: 303.0160
ратуре и прибавляли 10.2 ммоль триэтилфосфита.
[M + Na]+ (вычислено для С10Н14ClО5Р: 303.0167.
Полученную смесь перемешивали 3-4 ч и оставля-
ли на ночь. На следующий день отфильтровывали
Диэтил-4-(бутилтиометил)-3-фуроилфос-
гидрохлорид триэтиламина, фильтрат упаривали,
фонат (27). Выход 96%, желтое сиропообразное
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.89
при комнатной температуре.
т (3Н, С4Н3-бутил, JНН = 7.2 Гц), 1.31-1.41 м (8Н,
СН3-фосфонат + С3Н2-бутил), 1.55 квинтет (2Н,
Смешанный ангидрид
3-(N-морфолино-
С2Н2-бутил, JНН = 7.2 Гц), 2.49 т (2Н, С1Н2S-бутил,
метил)фуран-2-карбоновой и диэтилфосфорной
JНН = 7.2 Гц), 3.78 с (2Н, фуран-СН2S), 4.23 д. к
кислот
(20). Выход
78%, светло-коричневое
(4Н, СН2ОР, JНН = 7.2, JРН = 15.2 Гц), 7.22 д (1Н,
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.30 т
Н2-фуран, JРН = 1.6 Гц), 7.43 с (1Н, Н5-фуран).
(6Н, СН3, JНН = 7.0 Гц), 2.53 уш. с (4Н, NСН2-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.66 (С4Н3-
морфолин), 3.71 уш. с (4Н, ОСН2-морфолин), 3.84
бутил), 16.35 д (СН3-фосфонат, 2JРС = 5.6 Гц),
с (2Н, NСН2-фуран), 4.08 д. к (4Н, СН2ОР, JНН =
21.96 (С3Н2-бутил), 25.21 (С1Н2S-бутил),
31.42
7.0, JРН = 15.2 Гц), 6.76 уш. с (1Н, Н4-фуран), 7.42
(С2Н2-бутил), 31.79 (фуран-СН2S), 64.07 д (СН2ОР,
уш. с (1Н, Н5-фуран). Спектр ЯМР 13С (CDCl3), δС,
2JРС = 6.9 Гц), 122.37 д (С4-фуран, 3JРС = 11.1 Гц),
м. д.: 16.10 д (СН3-фосфонат, 2JРС = 6.7 Гц), 53.31
125.05 д (С3-фуран, 2JРС = 69.4 Гц), 142.31 д (С5-
(NСН2-фуран), 53.39 (NСН2-морфолин), 63.58 д
фуран, 3JРС = 1.1 Гц), 155.43 д (С2-фуран, 3JРС =
(СН2ОР, 2JРС = 5.8 Гц), 66.63 (ОСН2-морфолин),
4.1 Гц), 194.02 д (С=О, 1JРС = 179.4 Гц). Спектр
115.11 (С4-фуран), 128.28 (С3-фуран), 143.83 (С5-
ЯМР 31Р (CDCl3): δР -3.40 м. д.
фуран), 147.10 (С2-фуран), 153.51 (С=О). Спектр
Диэтил-2-(бутилтиометил)-3-фуроилфосфонат
ЯМР 31Р (CDCl3): δР -0.98 м. д.
(29). Выход 95%, желтое сиропообразное вещество.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.90 т (1.5Н, С4Н3-
Смешанный ангидрид
2-(N-морфолино-
бутил, JНН = 7.2 Гц), 0.91 т (1.5Н, С4Н3-бутил, JНН =
метил)фуран-3-карбоновой и диэтилфосфори-
7.2 Гц), 1.34 т (3Н, СН3, JНН = 7.2 Гц), 1.39 т (3Н,
стой кислот (21). Выход 65%, светло-коричневое
СН3, JНН = 7.2 Гц), 1.35-1.41 м (2Н, С3Н2-бутил),
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.28 т (6Н,
1.55 квинтет (1Н, С2Н2-бутил, JНН = 7.2 Гц), 1.56
СН3, JНН = 7.2 Гц), 2.57 т (4Н, NСН2-морфолин,
квинтет (1Н, С2Н2-бутил, JНН = 7.2 Гц), 2.54
J
= 4.4 Гц), 3.71 т (4Н, ОСН2-морфолин, JНН =
НН
т (1Н, С1Н2S-бутил, JНН = 7.2 Гц), 2.56 т (1Н, С1Н2S-
4.4 Гц ), 3.86 д. к (4Н, СН2ОР, JНН = 7.2, JРН =
бутил, JНН = 7.2 Гц), 4.00 с (1Н, фуран-СН2S), 4.01
14.8 Гц), 3.98 с (2Н, NСН2-фуран), 6.74 д (1Н, Н4-
с (1Н, фуран-СН2S), 4.26 д. к (4Н, СН2ОР, JНН = 7.2,
фуран, JНН = 2.0 Гц), 7.44 д (1Н, Н5-фуран, JНН =
JРН = 14.4 Гц), 6.80 д (1Н, Н4-фуран, JРН = 2.0 Гц),
2.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.90
7.21 д (1Н, Н5-фуран, JРН = 2.0 Гц). Спектр ЯМР
д (СН3-фосфонат, 2JРС = 5.0 Гц), 53.25 (NСН2-
13С (CDCl3), δС, м. д.: 13.61 (С4Н3-бутил), 16.40
морфолин), 53.34 (NСН2-фуран), 57.99 д (СН2ОР,
д (СН3-фосфонат, 2JРС = 5.7 Гц), 21.90 (С3Н2-
2JРС = 11.9 Гц), 66.76 (ОСН2-морфолин), 110.55
бутил), 21.92 (С3Н2-бутил), 27.14 (С1Н2S-бутил),
(С4-фуран), 115.47 (С3-фуран), 142.52 (С5-фуран),
27.61 (С1Н2S-бутил), 31.34 (С2Н2-бутил),
31.44
158.50 (С2-фуран), 160.54 (С=О). Спектр ЯМР 31Р
(С2Н2-бутил), 31.93 (фуран-СН2S), 32.03 (фуран-
(CDCl3): δР 138.75 м. д.
СН2S), 63.95 д (СН2ОР, 2JРС = 7.1 Гц), 111.41 д (С4-
Диэтил
4-(N-морфолинометил)-3-фуроилфос-
фуран, 3JРС = 2.6 Гц), 120.54 д (С3-фуран, 2JРС =
фонат (22). Выход 86%, светло-коричневое сиро-
68.6 Гц), 141.86 (С5-фуран), 160.40 д (С2-фуран,
пообразное вещество. Спектр ЯМР 1Н (CDCl3),
3JРС = 9.0 Гц), 193.94 д (С=О, 1JРС = 183.5 Гц).
δ, м. д.: 1.33 т (6Н, СН3, JНН = 7.2 Гц), 2.51 уш.
Спектр ЯМР 31Р (CDCl3): δР -2.09 м. д.
с (4Н, NСН2-морфолин), 3.64 уш. с (2Н, NСН2-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1228
ПЕВЗНЕР, СОКОЛОВА
фуран), 3.69 уш. с (4Н, ОСН2-морфолин), 4.10 д.
Реакция фуроилфосфоната 2 с азидом натрия.
к (4Н, СН2ОР, JНН = 7.2, JРН = 14.4 Гц), 7.44 с (1Н,
К раствору 0.93 г (3.3 ммоль) фуроилфосфоната 2
Н5-фуран), 8.14 д (1Н, Н5-фуран). Спектр ЯМР 13С
в 15 мл ацетона прибавляли при перемешивании
(CDCl3), δС, м. д.: 16.36 д (СН3-фосфонат, 2JРС =
0.43 г (6.6 ммоль) азида натрия и 0.05 г (0.3 ммоль)
5.5 Гц), 51.70 (NСН2-фуран), 53.48 (NСН2-морфолин),
иодистого калия. Полученную смесь перемешива-
53.54 (NСН2-морфолин), 63.61 д (СН2ОР, 2JРС =
ли при комнатной температуре в течение недели,
5.8 Гц), 66.94 (ОСН2-морфолин), 67.02 (ОСН2-
отфильтровывали неорганические соли, фильтрат
морфолин), 121.33 (С4-фуран), 125.59 д (С3-фуран,
упаривали. Остаток растворяли в 20 мл хлорофор-
ма, полученный раствор промывали 5 мл воды, 5 мл
2JРС = 69.4 Гц), 142.69 (С5-фуран), 155.24 д (С2-
раствора и сушили сульфатом натрия. Отгоняли
фуран, 3JРС = 4.1 Гц), 194.06 д (С=О, 1JРС =
хлороформ, остаток выдерживали в вакууме (1 мм
179.5 Гц). Спектр ЯМР 31Р (CDCl3): δР -3.19 м. д.
рт. ст.) 1 ч при комнатной температуре. Получали
Реакция хлорметилфуроилфосфонатов с ти-
1.10 г светло-коричневого масла, состоящего из
оцианатом калия (общая методика). К раствору
3-(азидометил)-2-фуроилазида 11 и диэтилфосфи-
10 ммоль хлорметилфуроилфосфоната
2,
4 в
та. По данным спектроскопии ЯМР 1Н, мольное
30 мл ацетонитрила прибавляли при комнатной тем-
соотношение компонентов 1:0.6. Расчетный выход
пературе и интенсивном перемешивании 20 ммоль
фуроилазида 11 70%.
тиоцианата калия и 1 ммоль иодистого калия.
Диэтилфосфит. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
Реакционную массу перемешивали при комнат-
1.32 т (6Н, СН3, JНН = 7.2 Гц), 4.29 д. к (4Н, СН2ОР,
ной температуре
24 ч, отфильтровывали оса-
JНН = 7.2, JРН = 16.0 Гц), 6.80 д (1Н, РН, JРН =
док, фильтрат упаривали. Остаток растворяли в
692.8 Гц). Спектр ЯМР 31Р (CDCl3): δР 7.35 м. д.
30 мл хлороформа, промывали 10 мл воды, 10 мл
раствора NaCl и сушили сульфатом натрия. После
3-(Азидометил)-2-фуроилазид (11). ИК спектр,
отгонки хлороформа остаток выдерживали в ва-
ν, см-1: 2102 (N3, азидометильная группа), 2141
кууме (1 мм рт. ст.) 1 ч при комнатной температуре.
(N3, ацилазид),
1687 (С=О). Спектр ЯМР
1Н
(CDCl3), δ, м. д.: 4.62 с (2Н, СН2N3), 6.65 уш. с
Диэтил-3-(тиоцианатометил)-2-фуроилфос-
(1Н, Н4-фуран), 7.54 уш. с (1Н, Н5-фуран). Спектр
фонат (10). Выход 83%, светло-коричневое масло.
ЯМР 13С (CDCl3), δС, м. д.: 45.64 (СН2N3), 113.68
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.28-1.38 м (6Н,
(С4-фуран), 131.71 (С3-фуран), 141.20 (С5-фуран),
СН3), 4.29 д. к (4Н, СН2ОР, JНН = 7.0, JРН = 14.8 Гц),
146.93 (С2-фуран), 162.90 (С=О). Спектр ЯМР 15N
4.29 с (2Н, СН2S), 6.76 д (1Н, Н4-фуран, JНН =
(CDCl3), δN, м. д.: 249 (N1-азидометил), 73 (N3-
1.6 Гц), 7.70 д (1Н, Н5-фуран, JНН = 1.6 Гц). Спектр
азидометил).
ЯМР 13С (CDCl3), δС, м. д.: 16.39 д (СН3-фосфонат,
2JРС = 5.7 Гц), 28.27 (СН2S), 64.66 д (СН2ОР,
Диэтил
4-(азидометил)-3-фуроилфосфонат
2JРС = 7.2 Гц), 111.67 (SCN), 114.69 д (С4-фуран,
(13). К раствору 2.60 г (9.2 ммоль) фуроилфос-
4JРС = 1.3 Гц), 131.40 д (С3-фуран, 3JРС = 8.4 Гц),
фоната 4 в 25 мл ацетонитрила прибавляли при
перемешивании 1.20 г (18.4 ммоль) азида натрия и
148.07 (С5-фуран), 148.19 д (С2-фуран, 2JРС =
59.6 Гц), 187.38 д (С=О, 1JРС = 188.0 Гц). Спектр
0.15 г (0.9 ммоль) иодистого калия. Реакционную
массу перемешивали 48 ч при комнатной темпе-
ЯМР 31Р (CDCl3): δР -2.68.
ратуре, затем отфильтровывали осадок. Фильтрат
Диэтил
4-(тиоцианатометил)-3-фуроилфос-
упаривали, остаток растворяли в 40 мл хлорофор-
фонат (12). Выход 99%, светло-коричневое масло.
ма и промывали 10 мл воды, затем 10 мл раство-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.37 т (6Н, СН3,
ра NaCl. После сушки сульфатом натрия отгоняли
JНН = 7.2 Гц), 4.19 с (2Н, СН2S), 4.21-4.28 м (4Н,
хлороформ, остаток выдерживали в вакууме
СН2ОР), 7.60 с (1Н, Н5-фуран),
8.82
(1Н, Н2-
(1 мм рт. ст.) 1 ч при комнатной температуре.
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.34 д
Выход 2.33 г (8.1 ммоль, 88%), светло-коричневое
(СН3-фосфонат, 2JРС = 5.7 Гц), 28.14 (СН2S), 64.36
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.36 т (6Н,
д (СН2ОР, 2JРС = 7.1 Гц), 112.29 (SCN), 118.99 д
СН3, JНН = 7.2 Гц), 4.08-4.18 м (4Н, СН2ОР), 4.49
(С4-фуран, 3JРС = 10.8 Гц), 123.88 д (С3-фуран,
с (2Н, СН2N3), 7.49 с (1Н, Н5-фуран), 8.80 (1Н, Н2-
2JРС = 68.5 Гц), 143.24 (С5-фуран), 155.77 д (С2-
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.32
фуран, 3JРС = 4.0 Гц), 194.71 д (С=О, 1JРС =
д (СН3-фосфонат, 2JРС = 5.6 Гц), 45.01 (СН2N3),
183.0 Гц). Спектр ЯМР 31Р (CDCl3): δР -3.22 м. д.
64.29 д (СН2ОР, 2JРС = 7.0 Гц), 119.66 д (С4-фуран,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1229
3JРС = 10.8 Гц), 124.81 д (С3-фуран, 2JРС = 69.4 Гц),
2JРС = 6.1 Гц), 21.91 (С3Н2-бутил), 27.03 (С1Н2S-
142.70 (С5-фуран), 155.44 д (С2-фуран, 3JРС = 4.5 Гц),
бутил), 30.45 (СН3-кетон), 31.35 (С2Н2-бутил),
194.22 д (С=О, 1JРС = 181.6 Гц). Спектр ЯМР 31Р
32.38 (фуран-СН2S),
62.95 д (СН2ОР, 2JРС =
(CDCl3): δР -3.71 м. д.
6.2 Гц), 112.09 д (С4-фуран, 3JРС = 2.6 Гц), 114.29
д (С3-фуран, 2JРС = 8.2 Гц), 131.98 д (=СН, 2JРС =
Реакция фуроилфосфонатов с резонанс-
2.6 Гц), 132.64 д (=СР, 1JРС = 178.1 Гц), 141.94
но-стабилизированными фосфоранами
32 и
(С5-фуран), 150.90 д (С2-фуран, 3JРС = 10.0 Гц),
36 (общая методика). К раствору 10 ммоль фу-
199.56 д (С=О, 3JРС = 22.1 Гц). Спектр ЯМР 31Р
роилфосфоната в 20 мл бензола прибавляли при
(CDCl3): δР 14.77 м. д.
перемешивании 11 ммоль фосфорана 32 или 36.
Полученную смесь кипятили при перемешивании
Этиловый эфир
3-(2-бутилтиометилфур-
9-10 ч, контролируя протекание реакции с помо-
3-ил)-3-(диэтоксифосфорил)акриловой кислоты
щью спектроскопии ЯМР 31Р. После исчезновения
(38) получали из фуроилфосфоната 29. Выход
сигнала ядра фосфора фуроилфосфоната реакци-
86%, желто-коричневое сиропообразное веще-
онную массу разбавляли 75 мл гексана, перемеши-
ство. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.85 т (1.5Н,
вали 30 мин и оставляли на ночь. На следующий
С4Н3-бутил, JНН = 7.2 Гц), 0.91 т (1.5Н, С4Н3-
день декантировали раствор, отгоняли бензол и
бутил, JНН = 7.2 Гц), 1.21 т (3Н, СН3-эфир, JНН =
гексан, остаток выдерживали в вакууме (1 мм рт. ст.)
7.2 Гц), 1.33 т (6Н, СН3, JНН = 7.2 Гц), 1.33-1.35
1 ч при комнатной температуре.
м (2Н, С3Н2-бутил), 1.48 квинтет (1Н, С2Н2-бутил,
J
= 7.2 Гц), 1.55 квинтет (1Н, С2Н2-бутил, JНН =
4-(3-Хлорметилфур-2-ил)-4-(диэтоксифос-
НН
форил)-бут-3-ен-2-он (33) получали из фуроил-
7.2 Гц), 2.47 т (1Н, С1Н2S-бутил, JНН = 7.2 Гц), 2.55
фосфоната 2. Выход 61%, светло-коричневое сиро-
т (1Н, С1Н2S-бутил, JНН = 7.2 Гц), 3.70 с (1Н,
фуран-СН2S), 3.74 к (1Н, СН2О-эфир, JНН = 7.2 Гц),
пообразное вещество. Спектр ЯМР 1Н (CDCl3), δ,
м. д.: 1.28-1.37 м (6Н, СН3-фосфонат), 2.05 с (3Н,
3.96 с (1Н, фуран-СН2S), 3.99 к (1Н, СН2О-эфир,
СН3-кетон), 4.07-4.18 м (4Н, СН2О-фосфонат),
JНН = 7.2 Гц), 4.09-4.20 м (4Н, СН2ОР), 6.37 д
(0.5Н, Н4-фуран, JРН = 2.0 Гц), 6.68 д (0.5Н, Н4-
4.49 с (2Н, CH2Cl), 6.57 уш. с (1Н, Н4-фуран), 7.13
д (1Н, =СН, JРН = 22.0 Гц), 7.52 уш. с (1Н, Н5-
фуран, JРН = 2.0 Гц), 6.89 д (1Н, =СН, JРН = 22.4 Гц),
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.26
7.26 д (0.5Н, Н5-фуран, JРН = 2.0 Гц), 7.38 д (0.5Н,
д (СН3-фосфонат, 2JРС = 6.9 Гц), 29.68 уш. с (СН3-
Н5-фуран, JРН = 2.0 Гц). Спектр ЯМР 13С (CDCl3),
кетон), 37.05 (CH2Cl), 63.24 д (СН2ОР, 2JРС =
δС, м. д.: 13.72 (С4Н3-бутил), 13.85 (С4Н3-бутил),
14.00 (СН3-эфир), 14.69 (СН3-эфир), 15.94 д (СН3-
5.9 Гц), 63.63 д (СН2ОР, 2JРС = 5.9 Гц), 112.98 д
(С4-фуран, 4JРС = 1.5 Гц), 123.37 д (С3-фуран, 3JРС =
фосфонат, 2JРС = 7.4 Гц), 16.37 д (СН3-фосфонат,
5.7 Гц), 128.97 д (=СР, 1JРС = 179.0 Гц), 131.77 д
2JРС = 6.3 Гц), 21.94 (С3Н2-бутил), 21.96 (С3Н2-
(=СН, 2JРС = 3.1 Гц), 143.95 д (С5-фуран, 3JРС =
бутил), 27.18 (С1Н2S-бутил), 27.27 (С1Н2S-бутил),
2.3 Гц), 144.54 д (С2-фуран, 3JРС = 7.3 Гц), 198.67
31.25 (С2Н2-бутил), 31.38 (С2Н2-бутил), 32.08 (фу-
д (С=О, 3JРС = 20.2 Гц). Спектр ЯМР 31Р (CDCl3):
ран-СН2S), 61.00 (СН2О-эфир), 62.97 д (СН2ОР,
δР 12.71 м. д.
2JРС = 6.2 Гц), 112.08 д (С4-фуран, 3JРС = 2.5 Гц),
114.34 д (С3-фуран, 2JРС = 8.2 Гц), 133.52 д (=СН,
4-(2-Бутилтиометилфур-3-ил)-4-(диэтоксифос-
2JРС = 11.7 Гц), 136.74 д (=СР, 1JРС = 177.8 Гц),
форил)бут-3-ен-2-он (37) получали из фуроил-
141.45 (С5-фуран), 150.00 д (С2-фуран, 3JРС = 10.2 Гц),
фос-фоната 29. Выход 80%, желто-коричневое
164.26 д (С=О, 3JРС = 28.3 Гц). Спектр ЯМР 31Р
сиропообразное вещество. Спектр ЯМР 1Н (CDCl3),
(CDCl3): δР 14.14 м. д.
δ, м. д.: 0.85 т (3Н, С4Н3-бутил, JНН = 7.2 Гц),
1.32 т (6Н, СН3, JНН = 7.2 Гц), 1.37 секстет (2Н,
4-(4-Хлорметилфур-3-ил)-4-(диэтоксифос-
С3Н2-бутил, JНН = 7.2 Гц), 1.55 квинтет (2Н, С2Н2-
форил)бут-3-ен-2-он (39) получали из фуроилфос-
бутил, JНН = 7.2 Гц), 2.12 с (СН3-кетон), 2.59 т
фоната 4. Выход 84%, коричневое сиропообразное
(2Н, С1Н2S-бутил, JНН = 7.2 Гц), 3.63 с (2Н, фу-
вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.31 т
ран-СН2S), 4.08-4.16 м (4Н, СН2ОР), 6.66 д (1Н, Н4-
(6Н, СН3-фосфонат, JНН = 7.2 Гц), 2.16 с (3Н, СН3-
фуран, JРН = 2.0 Гц), 7.01 д (1Н, =СН, JРН = 23.2 Гц),
кетон), 4.08-4.17 м (4Н, СН2О-фосфонат), 4.49 с
7.33 д (1Н, Н5-фуран, JРН = 2.0 Гц). Спектр ЯМР 13С
(2Н, CH2Cl), 7.08 д (1Н, =СН, JРН = 23.2 Гц), 7.34
(CDCl3), δС, м. д.: 13.67 (С4Н3-бутил), 15.92 д (СН3-
уш. с (1Н, Н5-фуран), 7.52 уш. с (1Н, Н5-фуран).
фосфонат, 2JРС = 7.5 Гц), 16.36 д (СН3-фосфонат,
Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.30 д (СН3-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1230
ПЕВЗНЕР, СОКОЛОВА
фосфонат, 2JРС = 6.3 Гц), 30.70 д (СН3-кетон, 4JРС =
бутил, JНН = 7.2 Гц), 2.15 с (СН3-кетон), 2.44 т
1.3 Гц), 36.03 (CH2Cl), 63.11 д (СН2ОР, 2JРС = 6.3 Гц),
(2Н, С1Н2S-бутил, JНН = 7.2 Гц), 3.49 с (2Н, фуран-
117.82 д (С3-фуран, 2JРС = 8.2 Гц), 122.74 д (С4-
СН2S), 4.13 д. к (4Н, СН2ОР, JНН = 7.3, JРН = 14.0 Гц),
фуран, 3JРС = 4.3 Гц), 130.91 д (=СР, 1JРС = 179.1
7.04 д (1Н, =СН, JРН = 23.2 Гц), 7.47 уш. с (1Н, Н5-
Гц), 131.95 д (=СН, 2JРС = 2.4 Гц), 142.26 д (С2-
фуран), 7.49 д (1Н, Н5-фуран, JРН = 2.8 Гц). Спектр
фуран, 3JРС = 7.3 Гц), 142.55 (С5-фуран), 199.00 д
ЯМР 13С (CDCl3), δС, м. д.: 13.67 (С4Н3-бутил),
(С=О, 3JРС = 21.5 Гц). Спектр ЯМР 31Р (CDCl3): δР
13.69 (С4Н3-бутил), 16.33 д (СН3-фосфонат, 2JРС =
14.22 м. д.
6.2 Гц), 21.96 (С3Н2-бутил), 24.96 (С1Н2S-бутил),
Этиловый эфир 3-(4-хлорметилфур-3-ил)-3-
30.57 д (СН3-кетон, 4JРС = 1.3 Гц), 31.23 (С2Н2-
(диэтоксифосфорил)акриловой кислоты
(40)
бутил), 31.43 (фуран-СН2S), 63.01 д (СН2ОР, 2JРС =
получали из фуроилфосфоната 4. Выход 91%, ко-
6.1 Гц), 118.33 д (С3-фуран, 2JРС = 8.3 Гц), 122.27
ричневое сиропообразное вещество. Спектр ЯМР
д (С4-фуран, 3JРС = 4.3 Гц), 131.58 д (=СР, 1JРС =
1Н (CDCl3), δ, м. д.: 1.17 т (3Н, СН3-эфир, JНН =
178.4 Гц), 131.96 д (=СН, 2JРС = 2.7 Гц), 141.66 (С5-
7.0 Гц), 1.29 т (6Н, СН3-фосфонат, JНН = 7.2 Гц),
фуран), 141.98 д (С2-фуран, 3JРС = 7.2 Гц), 199.15
д (С=О, 3JРС = 22.0 Гц). Спектр ЯМР 31Р (CDCl3): δР
4.06-4.13 м (6Н, СН2О-фосфонат, СН2О-эфир),
4.40 с (2Н, CH2Cl), 6.89 д (1Н, =СН, JРН =
14.67 м. д.
22.4 Гц), 7.32 с (1Н, Н5-фуран), 7.50 с (1Н, Н5-
Этиловый эфир 3-(4-бутилтиометилфур-3-ил)-3-
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.90
(диэтоксифосфорил)акриловой кислоты
(43)
(СН3-эфир), 16.30 д (СН3-фосфонат, 2JРС = 6.2 Гц),
получали из фуроилфосфоната 27. Выход 86%,
35.95 (CH2Cl), 61.10 (СН2О-эфир), 63.16 д (СН2ОР,
желто-коричневое сиропообразное вещество.
2JРС = 6.3 Гц), 122.94 д (С4-фуран, 3JРС = 5.1 Гц),
Спектр ЯМР 1Н (CDCl3), δ, м. д.: Спектр ЯМР 1Н
124.01 д (С3-фуран, 3JРС = 7.9 Гц), 134.01 д (=СН,
(CDCl3), δ, м. д.: 0.89 т (1.5Н, С4Н3-бутил, JНН = 7.2 Гц),
2JРС = 11.1 Гц), 135.34 д (=СР, 1JРС = 179.0 Гц),
1.19 т (3Н, СН3-эфир, JНН = 7.2 Гц), 1.36 секстет
141.61 д (С2-фуран, 3JРС = 6.1 Гц), 142.03 (С5-
(2Н, С3Н2-бутил, JНН = 7.2 Гц), 1.53 квинтет (2Н,
фуран), 164.06 д (С=О, 3JРС = 28.1 Гц). Спектр
С2Н2-бутил, JНН = 7.2 Гц), 2.45 т (2Н, С1Н2S-бутил,
ЯМР 31Р (CDCl3): δР 13.40 м. д.
J
= 7.2 Гц), 3.44 с (2Н, фуран-СН2S), 4.09-4.15
НН
4-(4-Тиоцианатометилфур-3-ил)-4-(диэтокси-
м (6Н, СН2ОР, СН2О-эфир), 6.88 д (1Н, =СН, JРН =
фосфорил)бут-3-ен-2-он (41) получали из фуро-
22.4 Гц), 7.45 уш. с (1Н, Н5-фуран), 7.47 д (1Н, Н2-
илфосфоната 12. Выход 54%, коричневое сиропо-
фуран, JРН = 2.8 Гц). Спектр ЯМР 13С (CDCl3), δС,
образное вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
м. д.: 13.69 (С4Н3-бутил), 13.95 (СН3-эфир), 16.34
1.34 т (6Н, СН3-фосфонат, JНН = 7.2 Гц), 2.20 с (3Н,
д (СН3-фосфонат, 2JРС = 6.1 Гц), 21.97 (С3Н2-
СН3-кетон), 4.10-4.19 м (4Н, СН2О-фосфонат),
бутил), 27.02 (С1Н2S-бутил), 31.30 (С2Н2-бутил),
4.14 с (2Н, CH2SCN), 7.09 д (1Н, =СН, JРН = 22.8 Гц),
31.67 (фуран-СН2S), 60.96 (СН2О-эфир), 63.03 д
7.63 уш. с (1Н, Н5-фуран), 7.71 уш. с (1Н, Н5-
(СН2ОР, 2JРС = 6.2 Гц), 118.23 д (С3-фуран, 2JРС =
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 16.37
7.3 Гц), 122.65 д (С4-фуран, 3JРС = 5.2 Гц), 133.61 д
д (СН3-фосфонат, 2JРС = 5.9 Гц), 28.21 (CH2SCN),
(=СН, 2JРС = 11.5 Гц), 135.87 д (=СР, 1JРС = 178.3 Гц),
30.81 д (СН3-кетон, 4JРС = 1.3 Гц), 63.32 д (СН2ОР,
141.17 (С5-фуран), 141.28 д (С2-фуран, 3JРС = 6.0 Гц),
2JРС = 6.5 Гц), 112.22 (SCN), 117.63 д (С3-фуран,
164.17 д (С=О, 3JРС = 28.4 Гц). Спектр ЯМР 31Р
2JРС = 8.6 Гц), 119.84 д (С4-фуран, 3JРС = 3.8 Гц),
(CDCl3): δР 13.90 м. д.
130.35 д (=СР, 1JРС = 180.3 Гц), 131.97 д (=СН, 2JРС =
4-(3-Тиоцианатометилфур-2-ил)-4-(диэт-
2.7 Гц), 142.73 д (С2-фуран, 3JРС = 8.0 Гц), 142.87
оксифосфорил)бут-3-ен-2-он (34). К раствору 0.55 г
(С5-фуран), 199.08 д (С=О, 3JРС = 21.0 Гц). Спектр
(1.7 ммоль) фосфоната 33 в 10 мл ацетонитрила при-
ЯМР 31Р (CDCl3): δР 13.82 м. д.
бавляли при комнатной тепературе 0.34 г (3.5 ммоль)
4-(4-Бутилтиометилфур-3-ил)-4-(диэтокси-
тиоцианата калия и 0.03 г (0.17 ммоль) иодистого
фосфорил)бут-3-ен-2-он (42) получали из фу-
калия. Полученную смесь перемешивали в течение
роилфосфоната 27. Выход 84%, желто-коричне-
суток при комнатной температуре, затем отфиль-
вое сиропообразное вещество. Спектр ЯМР 1Н
тровывали осадок, фильтрат упаривали. Остаток
(CDCl3), δ, м. д.: 0.90 т (3Н, С4Н3-бутил, JНН = 7.2 Гц),
растворяли в 20 мл хлороформа, промывали 5 мл
1.31 т (6Н, СН3, JНН = 7.2 Гц), 1.36 секстет (2Н,
воды, 5 мл раствора NaCl и сушили сульфатом на-
С3Н2-бутил, JНН = 7.2 Гц), 1.54 квинтет (2Н, С2Н2-
трия. Растворитель удаляли, остаток выдерживали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 2(3)-ФУРОИЛФОСФОНАТОВ
1231
в вакууме (1 мм рт. ст.) 1 ч при комнатной темпе-
ли при комнатной температуре в течение недели,
ратуре. Выход 0.32 г (54%), светло-коричневое си-
затем отфильтровывали осадок, фильтрат упарива-
ропообразное вещество. Спектр ЯМР 1Н (CDCl3),
ли. Остаток растворяли в 60 мл хлороформа, про-
δ, м. д.: 1.32 т (6Н, СН3-фосфонат, JНН 7.2 = Гц),
мывали 20 мл воды, 20 мл раствора NaCl и сушили
2.07 с (3Н, СН3-кетон), 4.09-4.17 м (4Н, СН2О-
сульфатом натрия. После удаления растворителя
фосфонат), 4.14 с (2Н, CH2SCN), 6.66 д (1Н, Н4-
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
фуран, JНН = 2.0 Гц), 7.07 д (1Н, =СН, JРН = 22.0 Гц),
при комнатной температуре. Выход 2.37 г (95%), свет-
7.50 д (1Н, Н5-фуран, JНН = 2.0 Гц). Спектр ЯМР
ло-коричневое сиропообразное вещество. Спектр
13С (CDCl3), δС, м. д.: 16.31 д (СН3-фосфонат, 2JРС =
ЯМР 1Н (CDCl3), δ, м. д.: 1.30 т (6Н, СН3-фосфонат,
5.9 Гц), 29.51 (CH2SCN), 30.96 (СН3-кетон), 63.26 д
J
= 7.2 Гц), 2.15 уш. с (3Н, СН3-кетон), 4.09-4.14
НН
(СН2ОР, 2JРС = 5.8 Гц), 112.68 (SCN), 113.07 д (С4-
м (4Н, СН2О-фосфонат), 4.18 уш. с (2Н, CH2N3),
фуран, 4JРС = 1.6 Гц), 121.07 д (С3-фуран, 3JРС =
7.14 д (1Н, =СН, JРН = 23.6 Гц), 7.36 уш. с (1Н,
4.6 Гц), 128.25 д (=СР, 1JРС = 181.0 Гц), 131.88 д
Н5-фуран), 7.41 уш. с (1Н, Н2-фуран). Спектр ЯМР
(=СН, 2JРС = 3.1 Гц), 144. 32 д (С5-фуран, 4JРС =
13С (CDCl3), δС, м. д.: 16.31 д (СН3-фосфонат, 2JРС =
2.3 Гц), 144.54 д (С2-фуран, 2JРС = 7.1 Гц), 198.92 д
6.0 Гц), 30.91 (СН3-кетон), 44.82 (CH2N3), 63.10 д
(С=О, 3JРС = 19.9 Гц). Спектр ЯМР 31Р (CDCl3): δР
(СН2ОР, 2JРС = 6.2 Гц), 117.75 д (С3-фуран, 2JРС =
12.45 м. д.
7.9 Гц), 120.57 д (С4-фуран, 3JРС = 4.7 Гц), 131.16 д
(=СР, 1JРС = 179.3 Гц), 131.93 д (=СН, 2JРС = 2.8 Гц),
4-(3-Азидометилфур-2-ил)-4-(диэтоксифос-
141.87 (С5-фуран), 142.11 д (С2-фуран, 3JРС =
форил)бут-3-ен-2-он (35). К раствору 0.52 г
6.9 Гц), 198.57 д (С=О, 3JРС = 21.6 Гц). Спектр ЯМР
(1.6 ммоль) фосфоната 33 в 10 мл ацетонитрила
31Р (CDCl3): δР 14.20 м. д.
прибавляли при комнатной температуре 0.21 г
Реакция хлорметильных производных 39, 40
(3.5 ммоль) азида натрия и 0.03 г (0.17 ммоль) ио-
с морфолином (общая методика). К раствору
дистого калия. Полученную смесь перемеши-ва-
10 ммоль хлорметилфурана 39 или 40 в 30 мл
ли 9 ч при 70°С, затем отфильтровывали осадок,
бензола прибавляли при перемешивании 20 ммоль
фильтрат упаривали. Остаток растворяли в
20
морфолина. Полученную смесь оставляли при ком-
мл хлороформа, промывали 5 мл воды, 5 мл рас-
натной температуре на 4 сут, затем экстраги-рова-
твора NaCl и сушили сульфатом натрия. После
удаления растворителя остаток выдержива-
ли 5%-ной соляной кислотой (3×15 мл). Экстракт
ли в вакууме (1 мм рт. ст.) 1 ч при комнатной
подщелачивали до рН = 9, прибавляя небольшими
порциями при перемешивании карбонат натрия.
температуре. Выход 0.20 г (38%), светло-коричневое
сиропообразное вещество. Спектр ЯМР 1Н (CDCl3),
Полученную смесь насыщали хлоридом натрия и
δ, м. д.: 1.35 т (6Н, СН3-фосфонат, JНН = 7.0 Гц),
экстрагировали хлороформом (3×20 мл). Экстракт
2.11 уш. с (3Н, СН3-кетон), 4.09-4.20 м (4Н, СН2О-
сушили сульфатом натрия, отгоняли хлороформ,
фосфонат), 4.25 уш. с (2Н, CH2N3), 6.61 д (1Н, Н4-
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч при
фуран, JНН = 1.2 Гц), 7.14 д (1Н, =СН, JРН = 22.4 Гц),
комнатной температуре.
7.58 д (1Н, Н5-фуран, JНН = 1.2 Гц). Спектр ЯМР
4-[4-(N-Морфолинометил)фур-3-ил]-4-(ди-
13С (CDCl3), δС, м. д.: 16.35 д (СН3-фосфонат, 2JРС =
этоксифосфорил)бут-3-ен-2-он (44) получали из
6.5 Гц), 30.97 (СН3-кетон), 45.57 (CH2N3), 63.66 д
соединения 39. Выход 85%, светло-коричневое си-
(СН2ОР, 2JРС = 5.4 Гц), 113.99 (С4-фуран), 121.75
ропообразное вещество. Спектр ЯМР 1Н (CDCl3),
д (С3-фуран, 3JРС = 4.7 Гц), 128.13 д (=СР, 1JРС =
δ, м. д.: 1.30 т (6Н, СН3-фосфонат, JНН = 7.2 Гц),
180.7 Гц), 131.81 д (=СН, 2JРС = 2.2 Гц), 144. 48 д
2.16 уш. с (3Н, СН3-кетон), 2.86 д (4Н, NСН2-
(С5-фуран, 4JРС = 2.8 Гц), 145.13 д (С2-фуран, 2JРС =
морфолин, JНН = 4.8 Гц), 3.19 с (2Н, NСН2-фуран),
7.2 Гц), 198.28 д (С=О, 3JРС = 20.9 Гц). Спектр
3.62 д (4Н, ОСН2-морфолин, JНН = 4.8 Гц), 4.05-
ЯМР 31Р (CDCl3): δР 12.87м. д.
4.15 м (4Н, СН2О-фосфонат), 6.98 д (1Н, =СН,
4-(4-Азидометилфур-3-ил)-4-(диэтоксифос-
JРН = 23.6 Гц), 7.38 уш. с (1Н, Н5-фуран), 7.39 д
форил)бут-3-ен-2-он (46). К раствору 2.45 г
(1Н, Н2-фуран, JНН = 1.6 Гц). Спектр ЯМР 13С
(7.6 ммоль) фосфоната 39 в 50 мл ацетона при-
(CDCl3), δС, м. д.: 16.34 д (СН3-фосфонат, 2JРС =
бавляли при комнатной температуре 1.00 г
6.1 Гц), 30.66 (СН3-кетон), 46.40 (NСН2-фуран),
(15.2 ммоль) азида натрия и 0.03 г (0.15 ммоль)
53.66 (NСН2-морфолин), 62.90 д (СН2ОР, 2JРС = 6.4 Гц),
иодистого калия. Полученную смесь перемешива-
66.84 (ОСН2-морфолин), 118.65 д (С3-фуран, 2JРС =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019
1232
ПЕВЗНЕР, СОКОЛОВА
7.8 Гц), 121.69 д (С4-фуран, 3JРС = 4.8 Гц), 132.03
пользованием оборудования Инжинирингового
д (=СН, 2JРС = 2.6 Гц), 132.06 д (=СР, 1JРС = 178.6 Гц),
центра Санкт-Петербургского государственного
141.05 д (С2-фуран, 3JРС = 8.5 Гц), 141.99 (С5-
технологического института и ресурсного центра
фуран), 198.77 д (С=О, 3JРС = 22.4 Гц). Спектр
Санкт-Петербургского государственного универси-
ЯМР 31Р (CDCl3): δР 14.89 м. д.
тета «Методы анализа состава вещества».
Этиловый эфир 3-[4-(N-морфолинометил)-
КОНФЛИКТ ИНТЕРЕСОВ
фур-3-ил]-3-(диэтоксифосфорил)акриловой
Авторы заявляют об отсутствии конфликта
кислоты (45) получали из соединения 40. Выход
интересов.
55%, светло-коричневое сиропообразное вещество.
СПИСОК ЛИТЕРАТУРЫ
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.18 т (3Н, СН3-
1. Певзнер Л.М., Поняев А.И. // ЖОХ. 2019. Т. 89. Вып. 1.
эфир), 1.29 т (6Н, СН3-фосфонат, JНН = 7.2 Гц),
С. 42. doi 10.1134/S0044460X19010086; Pevz-
2.85 д (4Н, NСН2-морфолин, JНН = 4.6 Гц), 3.22 с
ner L.M., Ponyaev A.I. // Russ. J. Gen. Chem. 2019.
(2Н, NСН2-фуран), 3.63 д (4Н, ОСН2-морфолин,
Vol. 89. N 1. P. 49. doi 10.1134/S1070363219010080.
JНН = 4.6 Гц), 4.04-4.15 м (6Н, СН2О-фосфонат,
2. Певзнер Л.М. // ЖОХ. 2019. Т. 89. Вып. 2. С. 244. doi
СН2О-эфир), 6.80 д (1Н, =СН, JНН = 22.8 Гц), 7.35
10.1134/S0044460X19020124; Pevzner L.M. // Russ.
уш. с (1Н, Н5-фуран), 7.38 уш. с (1Н, Н2-фуран).
J. Gen. Chem. 2019. Vol. 89. N 2. P. 244. doi 10.1134/
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.98 (СН3-
S1070363219020129.
эфир), 16.35 д (СН3-фосфонат, 2JРС = 6.2 Гц), 46.43
3. Pat. US 58409171998A (1998).
(NСН2-фуран),
53.60 (NСН2-морфолин),
60.87
4. Levy G.C., Lichter R.L. Nitrogen-15 Nuclear Magnetic
(СН2О-эфир), 62.90 д (СН2ОР, 2JРС = 6.1 Гц), 66.95
Resonance Spectroscopy. New York: Wiley Interscience,
(ОСН2-морфолин), 118.44 д (С3-фуран, 2JРС = 7.3 Гц),
P. 102.
121.51 д (С4-фуран, 3JРС = 5.2 Гц), 132.09 д (=СН,
5. Мельников В.В., Баева Л.Ф., Гидаспов Б.В. // Ж. прикл.
2JРС = 11.5 Гц), 136.12 д (=СР, 1JРС = 178.9 Гц), 141.01
спектр. 1973. Т. 18. Вып. 1. С. 87.
д (С2-фуран, 3JРС = 6.1 Гц), 141.35 (С5-фуран),
6. Певзнер Л.М. // ЖОХ. 2011. Т. 81. Вып. 1. С. 58;
164.17 д (С=О, 3JРС = 28.5 Гц). Спектр ЯМР 31Р
Pevzner L.M. // Russ. J. Gen. Chem. 2011. Vol. 81. N 1.
(CDCl3): δР 14.20 м. д.
P. 56. doi 10.1134/S1070363211010099
7. Пудовик А.И., Батыева Э.С., Низамов И.С., Замет-
ФОНДОВАЯ ПОДДЕРЖКА
динова Г.У., Альфонсов В.А. // Изв. АН СССР. 1988.
Работа выполнена в рамках базовой части
№ 2. С. 469; Pudovik A.I., Batyeva E.S., Nizamov I.S.,
государственного задания Министерства образо-
Zametdinova G.U., Al’fonsov V.A. // Bull. Acad. Sci.
вания и науки России (№ 4.5554.2017/8.9) с ис-
USSR. Div. Chem. Sci. 1988. Vol. 37. N 2. P. 389.
Synthesis and Some Reactions of 2(3)-Furoyl Phosphonates
Functionalyzed at the Neighboring Position of the Furan Ring
L. M. Pevzner* and N. B. Sokolova
St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received February 8, 2019; revised February 8, 2019; accepted February 14, 2019
Reactions of 2-and 3-furoyl chlorides having chloromethyl or butylthiomethyl group in the adjacent position of
the furan ring, and also of analogous N-morpholinomethylfuroyl chloride hydrochlorides with triethyl phosphite
are studied. Synthesized chloromethylfuroyl phosphonates in the reactions with sodium azide and potassium
thiocyanate form corresponding products of nucleophilic substitution in the case of 4-chloromethyl-3-furoyl
phosphonate. In the reaction of 3-chloromethyl-2-furoyl phosphonate with sodium azide simultaneously with
nucleophilic substitution cleavage of P-C bond takes place. Potassium thiocyanate in the reaction with this
substance forms 3-thiocyanatomethyl-2-furoyl phosphonate. All stabile furoyl phosphonates synthesized
enter the Wittig reaction with resonance-stabilized phosphoranes to give phosphorylated furylalkenes. If
these compounds contain chloromethyl group in the furan ring, they react with sodium azide and potassium
thiocyanate to give corresponding products of nucleophilic substitution. Analogously, in the reaction with
morpholine at room temperature aminomethyl derivatives are obtained.
Keywords: furoyl chlorides, Arbuzov reaction, furoyl phosphonates, Wittig reaction, nucleophilic substitution
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 8 2019