ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1327-1336
УДК 547.412.22:547.825:547.834.22
СИНТЕЗ И СВОЙСТВА НОВЫХ ФТОРСОДЕРЖАЩИХ
ПРОИЗВОДНЫХ ТИЕНО[2,3-b]ПИРИДИНА
2019 г. © Д. С. Бурыйa, В. В. Доценкоa, b, *, Н. А. Аксеновb, И. В. Аксеноваb
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
*e-mail: victor_dotsenko_@mail.ru
b Северо-Кавказский федеральный университет, Ставрополь, Россия
Поступило в Редакцию 21 марта 2019 г.
После доработки 21 марта 2019 г.
Принято к печати 27 марта 2019 г.
Цианотиоацетамид реагирует с 1,1,5,5-тетрафторацетилацетоном с образованием 4,6-бис(дифтор-
метил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила, алкилирование которого α-хлорацетамидами
приводит к 3-амино-4,6-бис(дифторметил)тиено[2,3-b]пиридин-2-карбоксамидам. Строение ключевых
соединений доказано с привлечением методов спектроскопии 2D ЯМР. Проведен анализ биологической
активности и биодоступности полученных соединений in silico.
Ключевые слова: цианотиоацетамид, реакция Гуарески-Торпа, циклизация по Торпу-Циглеру, тие-
но[2,3-b]пиридины, биоактивность in silico, органические фториды
DOI: 10.1134/S0044460X19090038
Одной из наиболее приоритетных задач, нахо-
Описанные в литературе достаточно многочис-
дящихся в постоянном фокусе внимания химиков,
ленные [20-35] примеры получения фторирован-
является поиск реагентов со специфическими осо-
ных производных тиено[2,3-b]пиридина 1 основы-
бенностями поведения. С этой точки зрения, фтор-
ваются на тандемной реакции S-алкилирования/
органические соединения представляются особен-
циклизации по Торпу-Циглеру фторированных
но перспективными объектами вследствие относи-
3-цианопиридин-2(1Н)-тионов
2. Последние, в
тельной синтетической доступности на базе стан-
свою очередь, получают реакцией цианотиоацета-
дартных методов, с одной стороны, и наличием
мида 3 [36] со фторсодержащими 1,3-диэлектро-
специфических свойств, обусловленных наличием
фильными реагентами - непредельными кетона-
атомов фтора - с другой. Замена атома водорода
ми, β-кетоэфирами либо 1,3-дикетонами (схема 1).
на фтор не приводит к существенному искажению
Стоит отметить, что в подавляющем большин-
геометрии системы, но дает существенное измене-
стве случаев исходными реагентами для синте-
ние физико-химических свойств и биологической
за соединений 2 являются наиболее доступные
активности [1-4]. Благодаря комплексу практиче-
соединения с трифторацетильным фрагментом,
ски полезных свойств и специфике химического
и разнообразие вводимых в структуру фториро-
поведения, химия фторпроизводных азагетероци-
ванных фрагментов за редкими исключениями
клов стала предметом пристального внимания (см.
[25, 31] ограничивается только трифторметильной
обзорные работы [5-12]).
группой. Необходимо также указать на широкий
В продолжение наших работ в области химии
спектр биологической активности фторсодер-
функционально замещенных производных тие-
жащих производных тиено[2,3-b]пиридина. Так,
но[2,3-b]пиридина [13-19] мы решили изучить
соединения 4 [22] и 5 [27] (схема 2) обнаружива-
возможность получения новых фторзамещенных
ют активность in vitro против вируса гепатита С.
тиенопиридинов и провести анализ in silico биоло-
Пиридотиенопиримидин 6 обладает противодиа-
гической активности и параметров биодоступно-
бетическими свойствами [24, 37]. Тиенопиридины
сти молекул.
7 [38, 39] и 8 [40] являются мощными ингибито-
1327
1328
БУРЫЙ и др.
Схема 1.
CN
CNEWGCH2Hlg,
CN
ɨɫɧɨɜɚɧɢɟ
F
F
H2N S
N
S
N S
EWG
H
3
2
NH2
ɨɫɧɨɜɚɧɢɟ
F
EWG
N S
1
EWG - ɷɥɟɤɬɪɨɧɨɚɤɰɟɩɬɨɪɧɵɣ ɡɚɦɟɫɬɢɬɟɥɶ
F
- ɮɬɨɪɫɨɞɟɪɠɚɳɢɣ ɡɚɦɟɫɬɢɬɟɥɶ
рами IκB киназы-β с перспективой использования
Ранее нами был описан способ получения
для лечения аутоиммунных заболеваний. Согласно
4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропири-
патентным данным, амиды 9 являются ингибито-
дин-3-карбонитрила 11, перспективного предше-
рами цитокина TNF-α с широким спектром дей-
ственника для получения фторсодержащих произ-
ствия [41], а трициклические соединения 10 об-
водных тиенопиридина, из цианотиоацетамида 3
наруживают свойства ингибиторов фосфодиэсте-
и тетрафторацетилацетона по реакции Гуарески-
разы-4 [42]. Актуальность исследований в данном
Торпа [46]. В связи с невысоким выходом соеди-
направлении обусловливается также весьма пер-
нения 11 по представленной в работе [46] проце-
спективным фармакологическим профилем само-
дуре, мы решили усовершенствовать методику
го
3-аминотиено[2,3-b]пиридинового фрагмента
получения пиридина 11 и изучить его трансфор-
[43-45].
мации в производные тиенопиридина. Обработкой
Схема 2.
CF3
OMe
NH2
CF3
NH2
CF3
O
H
O
N
Me
Ph
N S
R
NH OMe
N S
N N
N S
4
5
S
6
O
O
O
NH2
H2N
Ar
CF3
NH2
H2N
F
F
S
CF3
N
NH2
F3C
S
N
O
N NH
CH3
N
S
N
N
Ar
N S
NH2
N
RO
N
O
S
9
10
H
NR2
3C
O
8
7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СВОЙСТВА НОВЫХ ФТОРСОДЕРЖАЩИХ ПРОИЗВОДНЫХ
1329
Схема 3.
F
F
F
F
F
F
NH2
CN
CN
ClCH2C(O)NHR
O
O
KOH, ȾɆɎȺ
+
F
F
F
O
H2N S
N
S
N
S
NH
H
R
F
F
F
ɚ, ɛ
3
11
R = CONH2 (a), 2-CH3C6H3NHCO (ɛ).
тиона 11 хлорацетамидами в присутствии избыт-
7.07-7.81 м. д. (2JHF = 53.6-54.4 Гц). Смещение
ка щелочи были получены ранее не описанные
сигналов протонов групп NH2 и С4СНF2 в область
3-амино-4,6-бис(дифторметил)тиено[2,3-b]пири-
слабого поля (относительно сигналов водород-
дин-2-карбоксамиды 12a, б (схема 3).
ных аналогов соединений 12 и сигнала С6СНF2-
группы) может быть объяснено наличием водород-
Синтезированные соединения 12а и 12б пред-
ставляют собой порошкообразные вещества желто-
ной связи С4СНF2···H-NH. В спектрах ЯМР 13С
го цвета, легко растворимые в ацетоне или EtOAc.
наблюдаются характерные триплеты углеродов С4
Строение полученных соединений доказано с при-
(138.9-139.0 м. д., 2JCF = 22.8-23.5 Гц), С6 (151.7-
влечением методов спектроскопии ЯМР 1Н, 13С
152.0 м. д., 2JCF = 25.7 Гц), СНF2 (112.1-113.1 м. д.,
(DEPTQ), 19F, ИК спектроскопии, масс-спектро-
1JCF
= 238.4-239.2 Гц) и квинтет (мультиплет)
метрии высокого разрешения, а также методами
атома С5 при 112.9-113.2 м. д. В спектрах ЯМР
двумерной спектроскопии ЯМР (1Н-13С HSQC,
19F обнаруживаются два дублета при -111.7 и
1Н-13С HMBC, 1Н-15N HSQC, 1Н-15N HMBC)
-115.6 м. д., что хорошо коррелирует с литератур-
на примере
3-амино-4,6-бис(дифторметил)тие-
ными данными для других пиридинов с фрагмен-
но[2,3-b]пиридин-2-карбоксамида 12а (схема 4,
том СНF2 [25]. В ИК спектрах полученных соеди-
табл.
1). Характерной особенностью спектров
нений обнаруживаются характерные полосы по-
ЯМР 1Н соединений 12a, б является наличие двух
глощения функциональных групп, а также очень
триплетов дифторметильных групп в области
сильная полоса в области 1043-1034 см-1 (С-F).
Таблица 1. Основные корреляции в спектрах 2D ЯМР HSQC и HMBC 1H-13C и 1H-15N 3-амино-4,6-бис(дифторметил)-
тиено[2,3-b]пиридин-2-карбоксамида 12aa
δ, м. д.
δН, м. д.
1H-13C HSQC
1H-13C HMBC
1H-15N HSQC
1H-15N HMBC
103.3 (С2), 123.7 (С3а),
6.81 c (2Н, NН2)
-
64.6 (NH2)
-
144.7 (С3)
112.9* (С5),
7.17 т (1Н, С6СНF2)
113.1* (С6СНF2)
-
-
151.7 (С6)
7.58 уш. с (2Н, CONH2)
-
-
107.7 (CONH2)
-
112.9* (С5), 123.7 (С3а),
7.78 т (1Н, С4СНF2)
112.1* (С4СНF2)
-
-
138.9 (С4)
112.1* (С4СНF2), 113.1*
7.87 с (1Н, С5СН)
112.9* (С5)
(С6СНF2), 123.7 (С3а),
-
301.3 (NPy)
138.9 (С4), 151.7 (С6)
a Звездочкой обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР 13C DEPTQ (СН).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1330
БУРЫЙ и др.
Схема 4.
7.78
H
123.7
H
F
F
F
6.81
C
C
F
112.1
NH2
NH2
138.9
7.87
H
O
144.7
O
112.9
F
166.4
7.58
S
F
S
NH2
F
C
N
NH2
C
N
113.1
103.3
H
H
F
151.7
159.0
7.17
Известно, что замена атомов водорода на ато-
риям «правила пяти» Липински. Ни одно из фтор-
мы фтора приводит к увеличению липофильности
производных не показало положительных значе-
соединения и существенному изменению взаимо-
ний по критерию сходства с лекарством и высоких
действий протеин-лиганд [4]. Нами был проведен
(>0.5) значений показателя фармакологического
сравнительный анализ in silico биологической ак-
потенциала соединения. В то же время расчеты
тивности и параметров биодоступности молекул
указывают на низкую вероятность токсичности
фторпроизводных 11, 12a, б и их водородных ана-
для соединений 11 и 12a, б. Значение показате-
логов.
ля logS указывает на умеренную растворимость
соединений (табл. 2). При этом соединение 12б
Параметры сLogP
[рассчитанный логарифм
ожидаемо имеет наихудший показатель.
коэффициента распределения между н-октанолом
и водой log(coctanol/cwater)], растворимости (logS),
Параметр TPSA отражает площадь поверхности
площади топологической полярной поверхности
полярных частей молекулы. Увеличение TPSA свя-
(Topological Polar Surface Area, TPSA), токсиколо-
зано с уменьшением проникающей способности
гических параметров - рисков побочных эффектов
при прохождении через клеточную мембрану или
(мутагенные,
онкогенные,
репродуктивные
гематоэнцефалический барьер (ГЭБ), и в целом
эффекты), сходства с известными лекарственными
более низкое значение TPSA более благоприятно с
препаратами (drug-likeness), а также общей оценки
позиций сходства с лекарственным средством. Как
фармакологического потенциала соединения (drug
показывает расчет, все соединения соответствуют
score) рассчитаны с использованием программного
критерию TPSA ≤ 140 (табл. 2).
сервиса OSIRIS Property Explorer [47]. Данный
Для прогнозирования биологической актив-
программынй продукт позволяет провести
ности, вероятных мишеней и параметров ADMET
первичный анализ структуры на соответствие
(Absorption, Distribution, Metabolism, Excretion,
«правилу пяти» К. Липински (сLogP ≤ 5.0, мо-
Toxicity) использовали программные продукты
лекулярная масса (MW) ≤ 500, TPSA ≤ 140, чис-
SwissADME [51], SwissTargetPrediction [52], PASS
ло акцепторов водородных связей ≤ 10, доноров
Online [53] и Molinspiration Property Calculation
≤ 5) [48-50]. Расчетные данные, полученные с
Service [54]. По данным программного пакета
помощью OSIRIS Property Explorer, представлены
PASS Online, для соединений 11 и 12a, б с веро-
в табл. 2.
ятностью >0.8 ожидается противоартритное, ан-
Как можно заметить, для соединений 12a, б
тиаллергенное действие, а также активность в
в сравнении с водородными аналогами прогнози-
отношении аутоиммунных процессов. Для сое-
руется заметно более высокая липофильность,
динений 12a, б дополнительно прогнозируется
тогда как в случае соединения 11 наблюдается
анальгетический эффект. Расчет с использованием
обратная картина. Во всех случаях значение сLogP
пакета Molinspiration Property Calculation Service
не превышает 5.0, что указывает на вероятную
указывает на наиболее вероятную активность ти-
хорошую абсорбцию и проницаемость [48-50].
енопиридинов 12a, б в качестве ингибиторов ки-
Молекулярная масса всех исследуемых соедине-
наз (индекс Molinspiration bioactivity score -0.32 и
ний не превышает 400 Да, что соответствует крите-
-0.26 соответственно).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СВОЙСТВА НОВЫХ ФТОРСОДЕРЖАЩИХ ПРОИЗВОДНЫХ
1331
Таблица 2. Риски токсичности и физико-химические параметры соединений 11, 12a, б и их водородных аналогов
11-Н, 12a-Н, 12б-Н, спрогнозированные с помощью программы OSIRIS Property Explorer
Риск токсичностиa
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug likeness
drug Score
F F
-
-
-
-
0.19
-3.63
236
67.91
-7.03
0.438
CN
F
N
S
H
F
11
CH3
-
-
-
-
0.65
-2.69
164
67.91
-3.26
0.487
CN
H3C
N
S
H
11-H
F F
-
-
-
-
1.64
-4.54
293
110.2
-1.6
0.445
NH
2
O
F
S
NH
N
2
F
12a
CH3
NH2
-
-
-
-
0.93
-3.77
221
110.2
1.39
0.78
O
H3C
N
S
NH2
12a-H
F F
-
-
±
-
4.04
-6.31
383
96.25
-0.01
0.28
NH
2
O
F
S
NH
N
F
CH
3
ɛ
CH3
NH2
-
-
±
-
3.33
-5.54
311
96.25
3.03
0.47
O
S
NH
H3C
N
CH3
ɛɇ
a «+» - высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности; A - мутагенность, B - канцерогенность,
С - раздражающее действие, D - репродуктивные эффекты.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1332
БУРЫЙ и др.
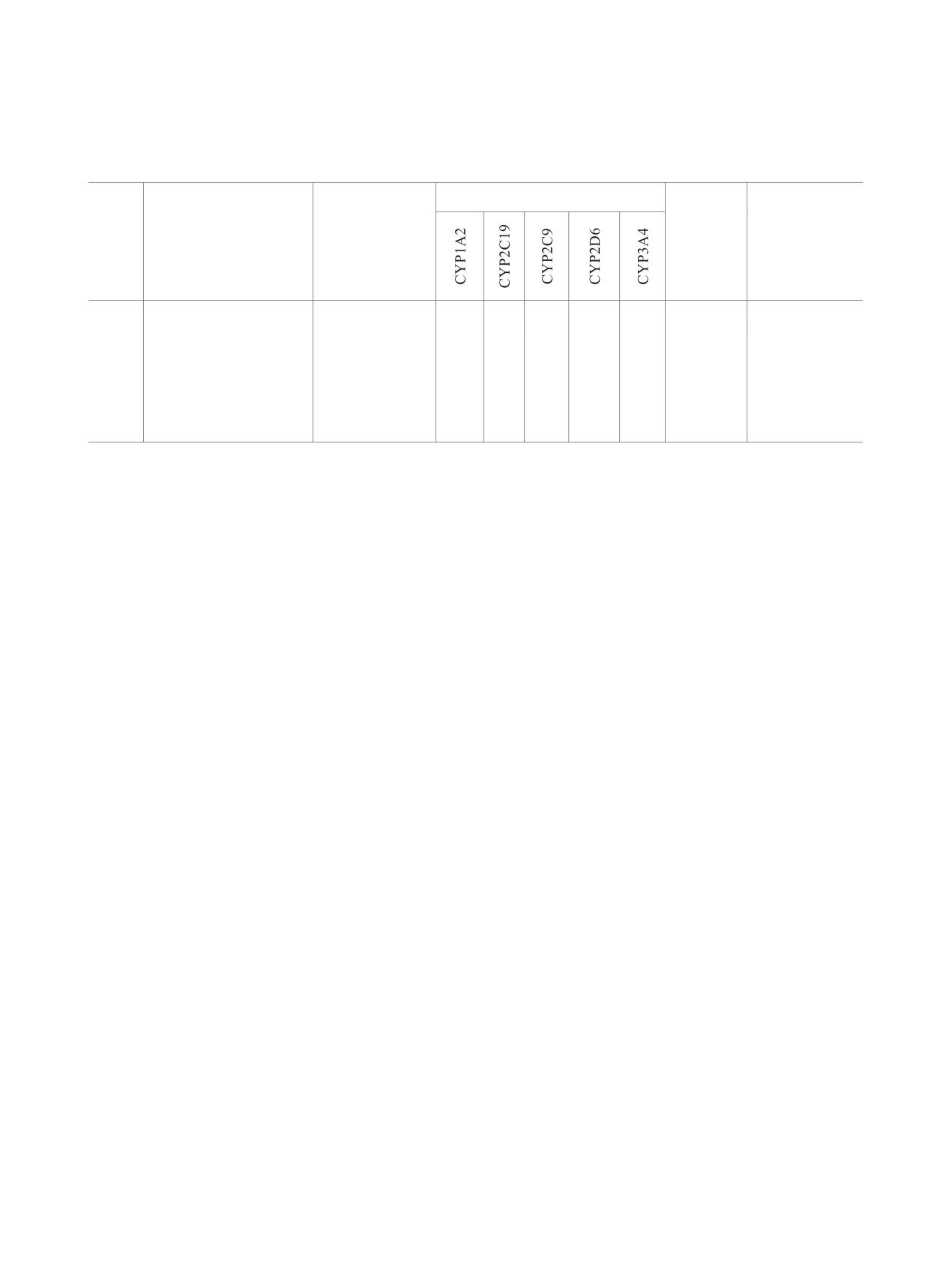
Таблица 3. Параметры ADMET и биологическая активность для соединений 11, 12а, б, рассчитанные с помощью
программных сервисов SwissADME и SwissTargetPrediction
Индекс
Ингибирование цитохромов Р450
биодоступности
Гастроинтестинальная
Проникновение
Вероятные
№
абсорбцияа
через ГЭБа
мишени
0.55
11
высокая
+
+
-
-
-
-
-
0.55
12a
высокая
-
+
-
-
-
-
МАРТ
0.55
12б
низкая
-
+
+
+
-
+
МАРТ,
MBNL1,
MBNL2,
MBNL3
а Знаком «+» или «-» показано наличие или отсутствие эффекта.
Для оединений
11 и
12а прогнозируется
ре Bruker Avance III HD 400MHz [400.17 (1Н),
высокая гастроинтеральная абсорбция, только
100.63 (13С), 40.55 (15N), 376.50 (19F)] в растворе
для соединения 11 - возможность проникновения
ДМСО-d6. В качестве стандарта использовали ТМС
через гематоэнцефалический барьер (табл.
3).
и остаточные сигналы растворителя (для спектров
По данным расчетов с использованием
15N - внешний стандарт СH3NO2, для спектров
SwissTargetPrediction,
наиболее вероятными
19F сигналы даны относительно СFCl3). ИК спек-
мишенями для тиенопиридина 12а являются тау-
тры регистрировали на ИК Фурье-спектрометре
белок (Microtubule-associated protein tau, MAPT),
Bruker Vertex 70 с приставкой НПВО на кристалле
для тиенопиридина 12б - тау-белок MAPT и
алмаза, спектральное разрешение ±4 см-1. Масс-
семейство белков MBNL (Muscleblind like splicing
спектры высокого разрешения (HRMS) получе-
regulator). Индекс биодоступности составляет
ны на времяпролетном масс-спектрометре Bruker
0.55 для всех соединений, что указывает на
maXis (ионизация распылением в электрическом
соответствие критериям Липински [55].
поле, ESI-TOF), растворитель - MeCN. Контроль
за чистотой полученных соединений осуществля-
Резюмируя вышесказанное, можно отметить,
ли методом ТСХ на пластинах Сорбфил-А, элюент
что предложенный в настоящей работе подход
может быть использован для получения новых
- ацетон-гексан (1:1), проявитель - пары иода, УФ
производных тиено[2,3-b]пиридина, содержащих
детектор.
фрагмент СHF2. Строение полученных соедине-
Цианотиоацетамид 3 получен пропусканием
ний детально изучено с привлечением комплек-
тока сероводорода через спиртовой раствор ма-
са спектральных методов. Проведенный in silico
лононитрила в пристутствии триэтиламина [56].
анализ параметров биологической активности и
1,1,5,5-Тетрафторацетилацетон был предоставлен
фармакологического потенциала молекул указы-
вает на существенные отличия фторсодержащих
4,6-Бис(дифторметил)-2-тиоксо-1,2-дигидро-
продуктов от водородных аналогов - в первую
пиридин-3-карбонитрил (11) получен по модифи-
очередь, по растворимости и липофильности, и
цированной процедуре [46]. К раствору 1,1,5,5-те-
позволяет оценивать дальнейшие исследования в
трафторацетилацетона (5.00 г, 29.06 ммоль) в
этой области как перспективные.
13 мл EtOH при интенсивном перемешивании в
токе азота добавляли цианотиоацетамид 3 (2.9 г,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
29.06 ммоль) и затем по каплям каталитическое
Спектры ЯМР регистрировали на прибо-
количество морфолина (0.3 мл). После раство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СВОЙСТВА НОВЫХ ФТОРСОДЕРЖАЩИХ ПРОИЗВОДНЫХ
1333
рения тиоамида 3 раствор перемешивали 6 ч в
7.91 с (1Н, С5СН), 9.67 уш. с (1Н, CONH). Спектр
атмосфере азота и оставляли на 72 ч при 4°С.
ЯМР 13С DEPTQ, δC, м. д.: 17.9* (Me), 103.2
Кристаллический осадок отфильтровывали, про-
(С2), 112.2* т (С4СНF2, 1JCF = 238.4 Гц), 113.1* т
мывали эфиром. Из маточного раствора при даль-
(С6СНF2, 1JCF = 239.2 Гц), 113.2* м (С5), 123.6 уш.
нейшем выдерживании получали дополнительное
с (С3а), 126.1* (СHAr), 126.4* (СHAr), 127.2* (СHAr),
количество продукта реакции. Суммарный выход
130.3* (СHAr), 134.4 (CAr), 135.9 (CAr), 139.0 (С4,
4.80 г (70%). Спектральные характеристики иден-
2JCF = 23.5 Гц), 145.2 (С3), 152.0 (С6, 2JCF = 25.7 Гц),
тичны представленным в работе [46].
159.3 (С7a), 163.4 (С=О). Спектр ЯМР 19F, δF, м. д.:
-115.6 д (С6СНF2, 2JHF = 54.5 Гц), -111.7 д
3-Амино-4,6-бис(дифторметил)тиено[2,3-b]-
пиридины (12a, б) (общая методика). Раствор
(С4СНF2, 2JHF = 53.1 Гц). Масс-спектр (HRMS
1.00 г
4,6-бис(дифторметил)-2-тиоксо-1,2-диги-
ESI-TOF), m/z: 406.0598 [M + Na]+ (вычислено для
C17H13F4N3NaOS: 406.0608).
дропиридин-3-карбонитрила
11
(4.23 ммоль) в
4 мл ДМФА при перемешивании и нагревании
ФОНДОВАЯ ПОДДЕРЖКА
последовательно обрабатывали 10%-ным водным
раствором KОН (2.2 мл, 4.25 ммоль), и затем
Работа выполнена при финансовой поддерж-
4.25 ммоль соответствующего α-хлорацетамида.
ке Министерства образования и науки РФ (проект
Смесь перемешивали 0.5 ч при 70°С, затем добав-
№ 4.5547.2017/8.9, В.В. Доценко, И.В. Аксенова;
ляли еще 2.2 мл 10%-ного KОН, перемешивали
проект № 4.1196.2017/4.6, Н.А. Аксенов), а также
еще 0.5 ч при 70°С и охлаждали. Осадок отфиль-
Российского фонда фундаментальных иссле-
тровывали, промывали EtOH и сушили. Получали
дований (проект 19-43-230007 р_а, Д.С. Бурый).
соединения 12a, б в аналитически чистом виде.
КОНФЛИКТ ИНТЕРЕСОВ
3-Амино-4,6-бис(дифторметил)тиено[2,3-b]-
Авторы заявляют об отсутствии конфликта
пиридин-2-карбоксамид (12a). Выход 72%, свет-
ло-желтый порошок. ИК спектр, ν, см-1: 3427,
интересов.
3392 с, 3346, 3294, 3149 ш (N-H), 1684 с (C=O),
СПИСОК ЛИТЕРАТУРЫ
1043 с (С-F). Спектр ЯМР 1Н, δ, м. д.: 6.81 уш.
1. Fluorine in medicinal chemistry and chemical biology /
с (2Н, NH2), 7.17 т (1Н, С6СНF2, 2JHF = 54.4 Гц),
Ed. I. Ojima. Chichester: John Wiley & Sons, 2009.
7.58 уш. с (2Н, CONH2), 7.78 т (1Н, С4СНF2, 2JHF =
624 p.
53.6 Гц), 7.87 с (1Н, С5СН). Спектр ЯМР 13С
2. Bégué J.P., Bonnet-Delpon D. Bioorganic and medic-
DEPTQ, δC, м. д.: 103.3 (С2), 112.1* т (С4СНF2,
inal chemistry of fluorine. Hoboken: John Wiley &
1JCF = 238.5 Гц), 112.9* квинтет (С5, 3JCF = 4.4 Гц),
Sons, 2008. 365 p.
113.1* т (С6СНF2, 1JCF = 239.2 Гц), 123.7 уш. с (С3а),
3. Chambers R.D. Fluorine in organic chemistry. Oxford:
138.9 (С4, 2JCF = 22.8 Гц), 144.7 (С3), 151.7 (С6, 2JCF =
Blackwell Publ. Ltd., 2004. 406 p.
25.7 Гц), 159.0 (С7a), 166.4 (С=О). *Сигналы
4. Böhm H.J., Banner D., Bendels S., Kansy M., Kuhn B.,
в противофазе. Спектр ЯМР
15N, δN, м. д.:
Müller K., Obst-Sander U., Stahl M. // ChemBioChem.
64.6 (NH2), 107.7 (CONH2), 301.3 (NPy). Спектр
2004. Vol. 5. N 5. P. 637. doi 10.1002/cbic.200301023
ЯМР 19F, δF, м. д.: -115.6 д (С6СНF2, 2JHF = 54.5 Гц),
5.
5-Membered Heterocycles and Macrocycles. In: Flu-
-111.7 д (С4СНF2, 2JHF = 53.1 Гц). Масс-спектр
orine in Heterocyclic Chemistry / Ed. V. Nenajdenko.
(HRMS ESI-TOF), m/z: 316.0140 [M + Na]+ (вычис-
Cham: Springer, 2014. Vol. 1. 681 p. doi 10.1007/978-
лено для C10H7F4N3NaOS: 316.0138).
3-319-04346-3
3-Амино-N-(2-метилфенил)-4,6-бис(ди-
6.
6-Membered Heterocycles. In: Fluorine in Heterocy-
фторметил)тиено[2,3-b]пиридин-2-карбокса-
clic Chemistry / Ed. V. Nenajdenko. Cham: Springer,
мид (12б). Выход 62%, желтый порошок. ИК
2014. Vol. 2. 760 p. doi 10.1007/978-3-319-04435-4
спектр, ν, см-1: 3445, 3418, 3331 уш. (N-H), 1657
7. Fluorinated Heterocyclic Compounds: Synthesis,
(C=O), 1034 c (С-F). Спектр ЯМР 1Н, δ, м. д.: 2.22
Chemistry, and Applications / Ed. V.A. Petrov. Hobo-
с (3H, Me), 6.84 уш. с (2Н, NH2), 7.07-7.34 м (5Н,
ken: John Wiley & Sons, 2009. 515 p.
С6СНF2 + HAr), 7.81 т (1Н, С4СНF2, 2JHF = 53.6 Гц),
8. Nenajdenko V.G., Balenkova E.S. // Arkivoc. 2011. Pt (i).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1334
БУРЫЙ и др.
P. 246. doi 10.3998/ark.5550190.0012.104
22. Wang N.Y., Zuo W.Q., Xu Y., Gao C., Zeng X.X.,
9. Nenajdenko V.G., Sanin A.V., Balenkova, E.S. // Mole-
Zhang L.D., You X.Y., Peng C.T., Shen Y., Yang S.Y.,
cules. 1997. Vol. 2. N 12. P. 186. doi 10.3390/21200186
Wei Y.Q., Yu L.T. // Bioorg. Med. Chem. Lett. 2014.
10. Фурин Г.Г. // ХГС. 2006. № 3. С. 323; Furin G.G. //
Vol. 24. N 6. P. 1581. doi 10.1016/j.bmcl.2014.01.075
Chem. Heterocycl. Compd. 2006. Vol. 42. N 3. P. 285.
23. Ho Y.W., Yao W.H. // Dyes and Pigments. 2006. Vol. 70.
doi 10.1007/s10593-006-0087-1
N 1. P. 60. doi 10.1016/j.dyepig.2005.04.009
11. Фурин Г.Г., Жужгов Э.Л. // ХГС. 2002. № 2.
24. Ma F., Liu J., Zhou T., Lei M., Chen J., Wang X., Zhang Y.,
С. 147; Furin G.G., Zhuzhgov E.L. // Chem. Het-
Shen X., Hu L. // Eur. J. Med. Chem. 2018. Vol. 152.
erocycl. Compd. 2002. Vol. 38. N 2. P. 129. doi
P. 307. doi 10.1016/j.ejmech.2018.04.028
10.1023/A:1015320822860
25. Rodinovskaya L.A., Shestopalov A.M., Gromova A.V.,
12. Elwahy A.H., Shaaban M.R. // Curr. Org. Synth. 2010.
Shestopalov A.A. // J. Comb. Chem. 2008. Vol. 10. N 2.
Vol. 7. N 5. P. 433. doi 10.2174/157017910792246117
P. 313. doi 10.1021/cc7001793
13. Доценко В.В., Кривоколыско С.Г., Кривоколыско Б.С.,
26. Rateb N.M. // J. Sulfur Chem. 2011. Vol. 32. N 6. P. 611.
Фролов К.А. // ЖОХ. 2018. Т. 88. № 4. С. 599; Do-
doi 10.1080/17415993.2011.628994
tsenko V.V., Krivokolysko S.G., Krivokolysko B.S., Fro-
27. Zuo W.Q., Wang N.Y., Zhu Y.X., Liu L., Xiao K.J.,
lov K.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 4.
Zhang L.D., Gao C., Liu Z.H., You X.Y., Shi Y.J.,
P. 682. doi 10.1134/S1070363218040114
Peng C.T., Ran К., Tang H., Yu L.T. // RSC Adv. 2016.
14. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // Men-
Vol. 6. N 46. P. 40277. doi 10.1039/C6RA01179A
deleev Commun. 2003. Vol. 13. N 6. P. 267. doi 10.1070/
28. Дяченко В.Д., Ткачев Р.П., Дяченко А.Д. // ЖОХ. 2009.
MC2003v013n06ABEH001851
Т. 79. № 1. С. 124; Dyachenko V.D., Tkachev R.P., Dy-
15. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // Men-
achenko A.D. // Russ. J. Gen. Chem. 2009. Vol. 79. N 1.
deleev Commun. 2004. Vol. 143. N 1. P. 30. doi 10.1070/
P. 121. doi 10.1134/S1070363209010186
MC2004v014n01ABEH001882
29. Никишин К.Г., Кислый В.П., Нестеров В.Н.,
16. Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
Шестопалов А.М., Стручков Ю.Т., Семенов В.В. //
Литвинов В.П. // Изв. АН. Сер. хим. 2002. № 8.
Изв. АН. Сер. хим. 1998. № 3. С. 482; Nikishin K.G.,
С. 1432; Dotsenko V.V., Krivokolysko S.G., Cher-
Kislyi V.P., Nesterov V.N., Shestopalov A.M., Struch-
nega A.N., Litvinov V.P. // Russ. Chem. Bull. 2002.
kov Y.T., Semenov V.V. // Russ. Chem. Bull. 1998.
Vol. 51. N 8. P. 1556. doi 10.1023/A:1020939712830
Vol. 47. N 3. P. 465. doi 10.1007/BF02495655
17. Доценко В.В., Кривоколыско С.Г., Литвинов В.П.,
30. Никишин К.Г., Нестеров В.Н., Кислый В.П.,
Чернега А.Н. // Изв. АН. Сер. хим. 2002. № 2.
Шестопалов А.М., Стручков Ю.Т., Семенов В.В. //
С. 339; Dotsenko V.V., Krivokolysko S.G., Litvinov V.P.,
Изв. АН. Сер. хим. 1998. № 4. С. 701; Nikishin K.G.,
Chernega A.N. // Russ. Chem. Bull. 2002. Vol. 51. N 2.
Nesterov V.N., Kislyi V.P., Shestopalov A.M., Struch-
P. 362. doi 10.1023/A:1015436500899
kov Y.T., Semenov V.V. // Russ. Chem. Bull. 1998.
18. Доценко В.В., Чигорина Е.А., Кривоколыско С.Г. //
Vol. 47. N 4. P. 698. doi 10.1007/BF02495978
ХГС. 2017. Т. 53. № 5. С. 626; Dotsenko V.V., Chi-
31. Родиновская Л.А., Федоров А.Е., Шестопалов А.М.,
gorina E.A., Krivokolysko S.G. // Chem. Heterocycl.
Беляков П.А., Никишин К.Г. // Изв. АН. Сер. хим.
Compd. 2017. Vol. 53. N 5. P. 626. doi 10.1007/s10593-
2013. № 10. С. 2214; Rodinovskaya L.A., Fedorov A.E.,
017-2103-z
Shestopalov A.M., Belyakov P.A., Nikishin K.G. // Russ.
19. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // Mon-
Chem. Bull. 2013. Vol. 62. N 10. P. 2214. doi 10.1007/
atsh. Chem. 2008. Vol. 139. N 3. P. 271. doi 10.1007/
s11172-013-0321-9
s00706-007-0784-1
32. Родиновская Л.А., Шаранин Ю.А., Литвинов В.П.,
20. Kumar G.S., Poornachandra Y., Reddy K.R., Kumar C.G.,
Шестопалов А.М., Промоненков В.К., Золота-
Narsaiah B. // Synth. Commun. 2017. Vol. 47. N 20.
рев Б.М., Мортиков В.Ю. // ЖОрХ. 1985. Т. 21. №
P. 1864. doi 10.1080/00397911.2017.1354379
11. С. 2439; Rodinovskaya L.A., Sharanin Yu.A.., Litvi-
21. Bakhite E.A., Abdel-Rahman A.E., Al-Taifi E.A. // Arab.
nov V.P., Shestopalov A.M., Promonenkov V.K., Zo-
J. Chem. 2014. Vol. 7. N 6. P. 936. doi 10.1016/j.arab-
lotarev B.M., Mortikov V.Yu. // J. Org. Chem. USSR.
jc.2014.05.035
1985. Vol. 21. N 11. P. 2230.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СВОЙСТВА НОВЫХ ФТОРСОДЕРЖАЩИХ ПРОИЗВОДНЫХ
1335
33. Artyomov V.A., Rodinovskaya L.A., Shestopalov A.M.,
45. Литвинов В.П., Доценко В.В., Кривоколыско С.Г.
Litvinov V.P. // Tetrahedron. 1996. Vol. 52. N 3. P. 1011.
Химия тиенопиридинов и родственных систем. М.:
doi 10.1016/0040-4020(95)00935-3
Наука, 2006. С. 6.
34. Kislyi V.P., Nikishin K.G., Kruglova E.Y., Shesto-
46. Бурый Д.С., Аксенов Н.А., Доценко В.В. // Фторные
palov A.M., Semenov V.V., Gakh A.A., Buchanan A.C.
заметки. 2018. № 4(119); Buryi D.S., Aksenov N.A.,
// Tetrahedron. 1996. Vol. 52. N 33. P. 10841. doi
Dotsenko V.V. // Fluorine Notes. 2018. N 4(119). doi
10.1016/0040-4020(96)00632-1
10.17677/fn20714807.2018.04.02
35. Shestopalov A.M., Kislyi V.P., Kruglova E.Y., Niki-
47. Sander T. OSIRIS Property Explorer, Idorsia Pharma-
shin K.G., Semenov V.V., Buchanan A.C., Gakh A.A. //
J. Comb. Chem. 2000. Vol. 2. N 1. P. 24. doi 10.1021/
istry.org/prog/peo/
cc990036r
48. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
36. Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. // Усп.
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
хим. 2018. Т. 87. № 1. С. 1; Dyachenko V.D., Dyachen-
10.1016/S0169-409X(96)00423-1
ko I.V., Nenajdenko V.G. // Russ. Chem. Rev. 2018.
49. Lipinski C.A. // Drug Discov. Today: Technol-
Vol. 87. N 1. P. 1. doi 10.1070/RCR4760
ogies. 2004. Vol. 1. N 4. P. 337. doi 10.1016/j.
37. Zhou T.T., Ma F., Shi X.F., Xu X., Du T., Guo X.D.,
ddtec.2004.11.007
Wang G.H., Yu L., Rukachaisirikul V., Hu L.H., Chen J.,
50. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Shen X. // J. Mol. Endocrin. 2017. Vol. 59. N 2. P. 151.
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
doi 10.1530/JME-17-0121
10.1016/j.addr.2012.09.019
38. Latli B., Eriksson M., Hrapchak M., Busacca C.A.,
51. Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
Senanayake C.H. // J. Label. Comp. Radiopharm. 2016.
Vol. 7. Article no. 42717. doi 10.1038/srep42717
Vol. 59. N 8. P. 300. doi 10.1002/jlcr.3398
52. Gfeller D., Grosdidier A., Wirth M., Daina A., Michie-
39. Ginn J.D., Sorcek R.J., Turner M.R., Young E.R.R. Pat.
lin O., Zoete V. // Nucl. Acids Res. 2014. Vol. 42. N W1.
US 2007293533 (2007).
P. W32. doi 10.1093/nar/gku293
40. Chen Z., Cirillo P.F., Disalvo D., Liu W., Marshall D.R.,
53. PASS Online, Laboratory for Structure-Function
Wu L., Young E.R.R. Pat. WO 2005056562 (2005).
Based Drug Design, Institute of Biomedical Chemistry
41. Reichelt C., Ludwig A., Leistner S. Pat. EP 1683799
(2006).
passonline/predict.php
42. Reichelt C., Ludwig A., Schulze A., Daghish M., Leist-
54. Molinspiration Property Calculation Service, Molinspira-
ner S., Kroedel A., Heinicke J. Pat. WO 2006010567
tion Cheminformatics, Slovak Republic, 2002. www.
(2006).
molinspiration.com
43. Литвинов В.П., Доценко В.В., Кривоколыско С.Г. //
55. Martin Y.C. // J. Med. Chem. 2005.Vol. 48. N 9. P. 3164.
Изв. АН. Сер. хим. 2005. № 4. С. 847; Litvinov V.P.,
Dotsenko V.V., Krivokolysko S.G. // Russ. Chem. Bull.
doi 10.1021/jm0492002
2005. Vol. 54. N 4. P. 864. doi 10.1007/s11172-005-
56. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
0333-1
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
44. Litvinov V.P., Dotsenko V.V., Krivokolysko S.G. // Adv.
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvi-
Heterocycl. Chem. 2007. Vol. 93. P. 117. doi 10.1016/
nov V.P. // Chem. Heterocycl. Compd. 2012. Vol. 48.
S0065-2725(06)93003-7
P. 309. doi 10.1007/s10593-012-0991-5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1336
БУРЫЙ и др.
Synthesis and Properties of New Fluorine-Containing
Thieno[2,3-b]pyridine Derivatives
D. S. Buryia, V. V. Dotsenkoa, b, *, N. A. Aksenovb, and I. V. Aksenovab
a Kuban State University, ul. Stavropolskaya 149, Krasnodar, 350040 Russia
*e-mail: victor_dotsenko_@mail.ru
b North Caucasian University, Stavropol, Russia
Received March 21, 2019; revised March 21, 2019; accepted March 27, 2019
Cyanothioacetamide reacts with 1,1,5,5-tetrafluoroacetylacetone to form 4,6-bis(difluoromethyl)-2-thioxo-
1,2-dihydropyridine-3-carbonitrile, the alkylation of which with α-chloroacetamides leads to 3-amino-4,6-
bis(difluoromethyl)thieno[2,3-b]pyridine-2-carboxamides. Structure of the key compounds was proven using
2D NMR spectroscopy methods. Analysis of the in silico biological activity and bioavailability of the obtained
compounds was performed.
Keywords: cyanothioacetamide, Guareschi-Thorpe reaction, Thorpe-Ziegler cyclization, thieno[2,3-b]-
pyridines, in silico bioactivity, organic fluorides
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019