ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1337-1345
УДК 546.185’221:547.779:547.816:547.849
НЕОЖИДАННЫЙ РЕЗУЛЬТАТ
ТИОФОСФОРИЛИРОВАНИЯ ПРОИЗВОДНОГО
6-АМИНОПИРАНО[2,3-c]ПИРАЗОЛ-5-КАРБОНИТРИЛА
© 2019 г. В. В. Доценкоa, b,*, В. А. Душенкоa, Н. А. Аксеновb, И. В. Аксеноваb, Е. Е. Нетребаc
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
*e-mail: victor_dotsenko_@mail.ru
b Северо-Кавказский федеральный университет, Ставрополь, Россия
c Таврическая академия Крымского федерального университета имени В. И. Вернадского, Симферополь, Россия
Поступило в Редакцию 21 марта 2019 г.
После доработки 21 марта 2019 г.
Принято к печати 15 апреля 2019 г.
Реакция 6-амино-3-метил-4-(2,4-дихлорфенил)-2,4-дигидропирано[2,3-c]пиразол-5-карбонитрила с
сульфидом фосфора в кипящем пиридине неожиданно приводит к образованию производного ранее не
описанной гетероциклической системы - [1,2]оксафосфинино[6,5-c]пиразола. Строение полученного
соединения доказано с привлечением методов спектроскопии 2D ЯМР и рентгеноструктурного анализа.
Ключевые слова: тиофосфорилирование, сульфид фосфора(V), пирано[2,3-c]пиразолы, 1,2-оксафос-
финины
DOI: 10.1134/S0044460X1909004X
6-Амино-2,4-дигидропирано[2,3-c]пиразол-
[1]. Вместе с тем наличие енаминонитрильного
5-карбонитрилы 1, обычно синтезируемые трех-
фрагмента в 6-амино-2,4-дигидропирано[2,3-c]пи-
компонентной конденсацией альдегидов с мало-
разол-5-карбонитрилов 1 делает этот класс соеди-
нонитрилом и пиразол-5-онами (схема 1), привле-
нений перспективным субстратом для дальнейших
кают постоянное внимание исследователей как
трансформаций. Известно, что тиофосфорилиро-
объекты исследования в силу исключительной
вание енаминонитрилов (орто-аминокарбонитри-
доступности и простоты получения, a также ши-
лов) с помощью P4S10 или реагента Лоуссона в об-
роких возможностей модификации их структуры.
щем случае приводит к образованию производных
Данному классу соединений и их структурным
1,3,2λ5-диазафосфинана [5-11]. Для 2-амино-3-ци-
аналогам 2-амино-3-циано-4Н-пиранового и -хро-
ано-4Н-пиранов и -хроменов такие реакции были
менового рядов присущ интересный профиль био-
описаны лишь в нескольких недавних работах.
логической активности (см. обзоры [1-4]).
Так, по имеющимся данным, в ходе подобного ти-
Однако, несмотря на доступность и препара-
офосфорилирования образуются конденсирован-
тивную легкость получения, химические превра-
ные с 4Н-пирановым или 4Н-хроменовым фраг-
щения соединений 1 относительно мало изучены
ментом производные 1,3,2λ5-диазафосфинана 2-4
Схема 1.
R3
R2
R2
R3CHO
CN
O
+
R1
N
CN
N N
N
O
NH2
R1
CN
1
1337
1338
ДОЦЕНКО и др.
Схема 2.
NH2
S
Ar
S
CN
O
Ɋɟɚɝɟɧɬ Ʌɨɭɫɫɨɧɚ,
O
NH
ɞɢɨɤɫɚɧ 12, ' ɱ
OCH3
Ar
P
[12]
O
N
H S
O O
2
Ph
S
Ph
H3C
H3C
CN
P4S10, Py, '
NH
NH
N
N
S
P
[13]
O
O
O
N
O
NH2
H
S-
3
Ar
S
Ar
H3C
H3C
Ɋɟɚɝɟɧɬ Ʌɨɭɫɫɨɧɚ ,
OCH3
CN
ɬɨɥɭɨɥ, '
NH
N
N
P
[14]
N
N
O
N
O
NH2
H
H
H S
4
O
Ar
O
Ar
NH
OCH3
Ɋɟɚɝɟɧɬ Ʌɨɭɫɫɨɧɚ,
CN
HN
MeCN,
' ɱ
HN
S
[15]
P
O
N
O NH2
O
N
O N
S
H
H
H
5
Ar
Ar
NH
OCH3
CN
Ɋɟɚɝɟɧɬ Ʌɨɭɫɫɨɧɚ,
MeCN,
' ɱ
S
[16]
P
O NH
2
O N
S
H
6
[12-14] или 1,3,2λ5-тиаазафосфинана 5, 6 [15, 16]
Продолжая исследования в области химии кон-
(схема 2). На перспективность работ в данном на-
денсированных производных диазафосфинана
правлении указывает тот факт, что соединения 6
[20], мы решили изучить взаимодействие 6-ами-
обладают многообещающей фунгицидной актив-
но-4-арил-3-метил-2,4-дигидропирано[2,3-c]пи-
ностью [16], а соединения 2 обладают противоо-
разол-5-карбонитрилов с сульфидом фосфора в
пухолевым действием и являются ингибиторами
кипящем пиридине с целью получения произво-
тирозиназы [12].
дных новой полициклической системы - пиразо-
Помимо этого, интерес к 1,3,2-диазафосфина-
ло[4',3':5,6]пирано[2,3-d][1,3,2]диазафосфинана
нам и вообще к 1,3,2-дигетерофосфинанам обу-
7 (cхема 3). В качестве модельного соединения
словлен известными примерами высокоактивных
нами был выбран 6-амино-3-метил-4-(2,4-дихлор-
противоопухолевых препаратов данного ряда [ци-
фенил)-2,4-дигидропирано[2,3-c]пиразол-5-кар-
клофосфан (циклофосфамид), иксотен, пергамид
бонитрил 8, который был синтезирован трехком-
и др.] [17-19].
понентной конденсацией
3-метилпиразол-5-она,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
НЕОЖИДАННЫЙ РЕЗУ
ЛЬТАТ ТИОФОСФОРИЛИРОВАНИЯ
1339
Схема 3.
CH3
H3C
Ar
HN
O
CHO
CN
N
CN
EtOH, ' 1.5 ɱ
+
+
HN
HN
74%
Cl
Cl
CN
N
O
NH
2
O
S
S
8
S
S
N
P
P
P4S10
+
+
N
S
N
Ar
S
H3C
Ar
H3C
CN
NH
P2S5·2Py
HN
S
HN
P
N
O
N
N
Ar = 2,4-Cl2C6H3
O
NH2
H SH
8
7
Ar
Ar
H3C
Ar
H3C
CN
H3C
CN
H
CN
+
CN
P2S5·2Py
Py
N
CN
HN
HN
S
HN
Py
S
P
PyPS3
N
CN
N
O
P
-
N
O
S
S
OH
HS
10
PS2Py
9
2,4-дихлорбензальдегида и малононитрила. Суль-
ная атака дицианометильного аниона на атом фос-
фид фосфора предварительно вводили в реакцию
фора приводит к замыканию 1,2-оксафосфинино-
с кипящим пиридином для образования аддук-
вого цикла. Следует отметить, что 1,2-оксафосфи-
та P2S5·2C5H5N [21, 22]. К нашему удивлению,
нины представляют относительно малоизученную
анализ полученного продукта реакции (ИК, ЯМР
гетероциклическую систему (недавние примеры
спектроскопия) обнаружил несоответствие с ожи-
получения и использования см. [23-26]), а система
даемой структурой 7. Прежде всего, в ИК спектре
[1,2]оксафосфинино[6,5-c]пиразола в литературе
полученного соединения отсутствовали полосы
до настоящего времени не описана.
поглощения, соответствующие валентным колеба-
Соединение 9 представляет собой желтый по-
ниям связей N-H и С=S, однако неожиданно обна-
рошок (после перекристаллизации из ацетона -
ружилась полоса поглощения несопряженной ни-
бледно-желтые кристаллы), растворимый при на-
трильной группы при 2237 см-1. Детальный анализ
гревании в ацетоне, диоксане, пиридине. Строение
спектров ЯМР, а также результаты РСА позволили
соединения 9 как производного [1,2]оксафосфи-
однозначно приписать полученному соединению
нино[6,5-c]пиразола подтверждается данными
структуру 5-метил-2-тиоксо-4-(2,4-дихлорфенил)-
ИК, ЯМР спектроскопии на ядрах 1Н, 31Р и 13С
3,3-дициано-3,4-дигидро[1,2]оксафосфинино-
(DEPTQ) (схема 4), а также результатами 2D ЯМР
[6,5-c]пиразол-2(6H)-тиолата пиридиния 9 (схема 3).
экспериментов
(1Н-13С HSQC,
1Н-13С HMBC,
Предполагаемый механизм образования соеди-
1Н-15N HMBC). Полный набор гетероядерных
нения 9, вероятно, включает образование ацикли-
корреляций 1Н-13С для структуры 9 представлен
ческого таутомера исходного пиранопиразола,
в табл. 1. Спектр ЯМР 31P соединения 9 содержит
динитрила
10. Последний тиофосфорилирует-
единственный сигнал при 99.47 м. д. В спектре
ся по атому кислорода аддуктом P2S5·2C5H5N.
ЯМР 1Н оксафосфинино[6,5-c]пиразола 9 наблю-
Последующая внутримолекулярная нуклеофиль-
даются характерные сигналы протонов катиона
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1340
ДОЦЕНКО и др.
Таблица 1. Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C соединения 9а
H
7
N
5
CH
H
N
6
3
7a
N
H
+
4a
O
Cl
12
3
4
P
-
CN
S
S
CN
Cl
Корреляции, δС, м. д.
δН, м. д.
HSQC
HMBC
1.44 c (3Н, СН3)
10.9* (CH3)
95.5 (C4a), 136.7 (C5), 155.0 (C7a)
5.56 д (1Н, H4)
41.5* (C4)
49.1 (C3), 95.5 (C4a), 113.9 (CN), 114.0 (CN), 132.2* (С6,
Ar), 132.7 (C1, Ar), 134.2 (C2, Ar), 155.0 (C7a)
7.53 д (1Н, H6-Ar)
132.2* (C6, Ar)
41.5* (C4), 132.7 (C1, Ar), 134.2 (C2, Ar)
7.57 д. д (1Н, H5-Ar)
128.1* (C5, Ar)
132.7 (C1, Ar), 134.9 (C4, Ar)
7.83 д (1Н, H3-Ar)
129.4* (C3, Ar)
128.1* (C5, Ar), 132.7 (С1, Ar), 134.2 (C2, Ar), 134.9 (C4,
Ar)
8.00-8.04 м (2Н, H3, H5, Py)
127.0* (C3, C5, Py)
127.0* (C3, C5, Py), 142.8* (C2, C6, Py), 145.6* (C4, Py)
8.54 м (1H, H4, Py, АВ2-система)
145.6* (C4, Py)
142.8* (C2, C6, Py)
8.90 д (2H, H2, H6, Py)
142.8* (C2, C6 Py)
127.0* (C3, C5 Py); 142.8* (C2, C6 Py); 145.6* (C4 Py)
12.19 уш. с (1Н, NH)
-
-
а Звездочкой обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР 13C DEPTQ (СН, СН3).
пиридиния [8.90 (H2,6), 8.54 (H4) и 8.00-8.04 м. д.
Py)/222.2 м. д. (N+-пиридиний). В спектре ЯМР
(H3,5)], метильного и 2,4-дихлорфенильного заме-
13С наблюдаются сигналы углеродов С3, двух СN-
стителей. Особенностью спектра является расще-
групп, C1 дихлорфенильного цикла, углеродов С4а
пление сигнала протона Н4 (5.56 м.д.) в дублет с
и С7а пиразольного цикла в виде дублетов вслед-
КССВ 3JPH = 4.7 Гц). В спектре ЯМР 1Н-15N HMBC
ствие спин-спинового взаимодействия с ядром 31P.
обнаруживаются кросс-пики 1.44 м. д. (СН3)/
По данным рентгеноструктурного анализа,
192.9 м. д. (N2-пиразол), 8.02 м. д. (H3,H5 Py)/
соединение 9 представляет собой соль органиче-
222.2 м. д. (N+-пиридиний), 8.90 м. д. (H2, H6,
ского катиона пиридиния и органического аниона
Схема 4.
136.7
12.19 H
1.44
H
10.9
N
N
CH
3
CH3
H
N
H
N
8.90
5.56
7.57
142.8
132.2
N
95.5
128.1
H
N
155.0
7.53
8.00-8.04
O
Cl
127.0
O
41.5
132.7
Cl
P
P
49.2
8.54
CN
7.83
145.6
127.0
129.4
134.9
S
CN
S S
CN
Cl
S
CN
Cl
134.2
113.9
114.0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
НЕОЖИДАННЫЙ РЕЗУ
ЛЬТАТ ТИОФОСФОРИЛИРОВАНИЯ
1341
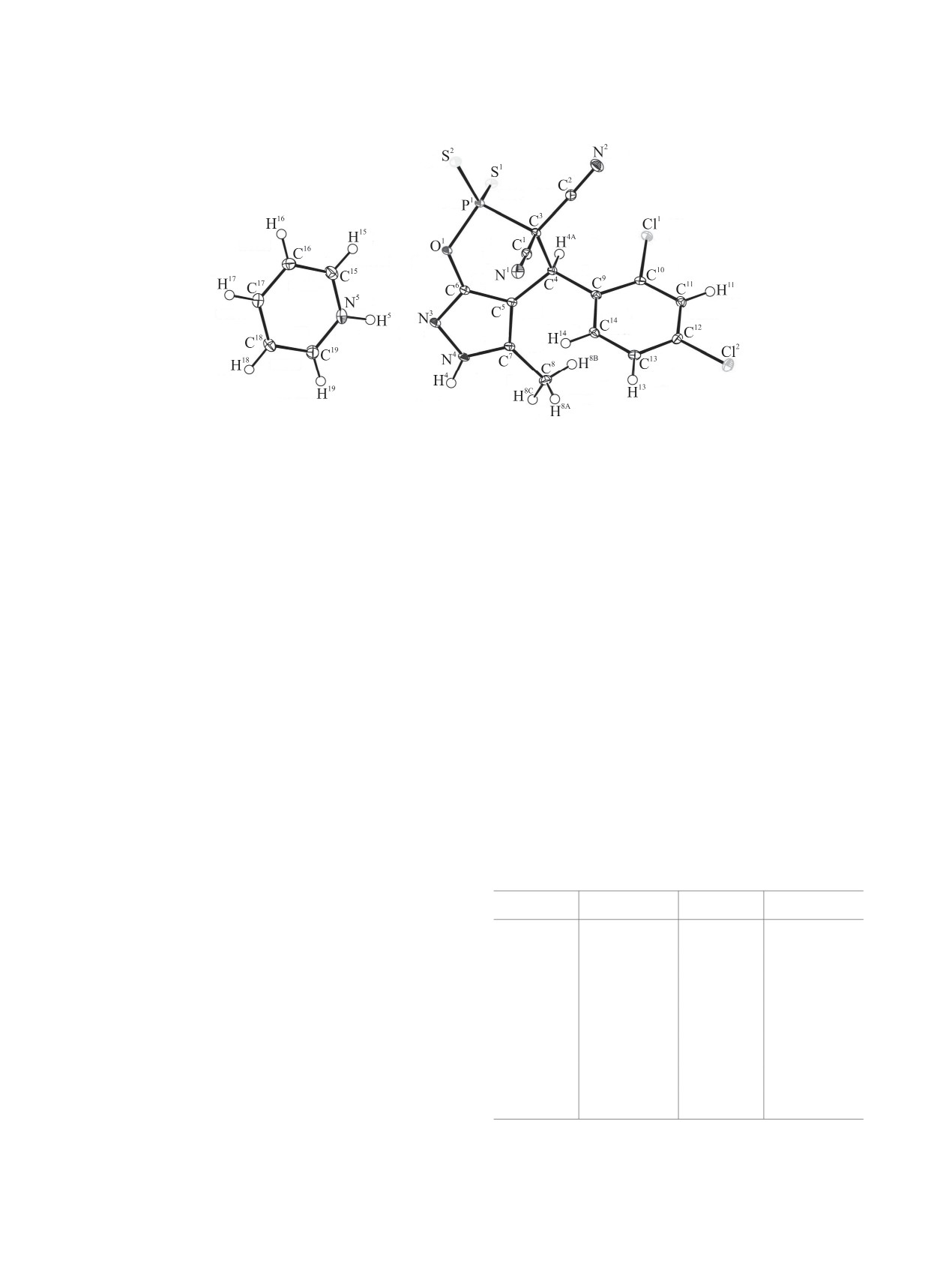
Рис. 1. Общий вид молекулы соединения 9 в представлении тепловыми эллипсоидами неводородных атомов 50%-ной
вероятности.
5-метил-2-тиоксо-4-(2,4-дихлорфенил)-3,3-дици-
сти цикла C9C10C11C12C13C14, отклонение состав-
ано-3,4-дигидро[1,2]оксафосфинино[6,5-c]пира-
ляет менее 0.025 Å.
зол-2(6H)-тиолата, [C5H5NH]+·[C14H8Cl2N4OPS2]-
В катионе пиридиния все атомы цикла лежат в
(рис.
1).
1,2-Оксафосфининовый цикл органи-
плоскости кольца C15C16C17C18C19N5, отклонение
ческого аниона имеет конформацию, промежу-
составляет менее 0.01 Å, кроме атома водорода
точную между ванной и креслом, с торсионными
H5, отклонение которго от плоскости составляет
углами: P1C3C4C5
-52.5(1), C3C4C5C6
24.5(2),
0.072 Å. Это объясняется участием атома водорода
C4C5C6O1 -8.3(3), C5C6O1P1 26.6(2), C6O1P1C3
H5 в формировании водородной связи между ато-
–48.0(1), C6O1P1C3 -48.0(1)°. Полиэдр атома фос-
мом азота N3 органического аниона и атомом азота
фора P1 имеет форму тетраэдра с основанием
N5 пиридиниевого катиона.
C3O1S2. Связи между атомом фосфора и атомами
Частицы в кристалле 9 объединены посред-
серы отличаются между собой и составляют P1-S1
ством межмолекулярных водородных связей.
1.9521(6) и P1-S2 1.9348(5) Å (табл. 2).
Структура стабилизируется взаимодействием ме-
Длина связи P1-S2 отвечает двойной связи
жмолекулярных водородных связей катион-анио-
(среднее значение длины P=S равно 1.94 Å [27]),
на N4-H4···S1 (табл. 3, рис. 2).
а длина связи P1-S1 имеет промежуточное значе-
ние между одинарной (2.14 Å) и двойной (1.94 Å)
Таблица 2. Некоторые длины связей и валентные углы
[27]. Это предполагает, что отрицательный заряд
в молекуле соединения 9
органического аниона делокализован на фрагмен-
Угол
ω, град
Связь
d, Å
те S-P-S. Длины связей в нитрильных фрагментах
практически одинаковы: N2≡C2 1.139(2) и N1≡C1
S2P1S1
123.26(3)
S2-P1
1.9348(5)
1.149(2) Å, C3-C2 1.475(2) и C3-C1 1.471(2) Å, угол
O1P1S2
106.59(4)
P1-S1
1.9521(6)
между ними составляет 109.6(1)°. Пиразольное
O1P1S1
110.94(5)
P1-O1
1.6486(11)
кольцо в структуре 9 практически плоское. Все не-
водородные атомы лежат в плоскости C6C5C7N4N3,
O1P1C3
96.29(6)
P1-C3
1.9250(16)
отклонение составляет менее 0.001 Å. Атом угле-
C3P1S2
110.00(5)
N5-H5
0.8800(3)
рода метильной группы С8 также принадлежит
плоскости пиразольного кольца, отклонение со-
C3P1S1
106.45(5)
ставляет менее 0.001 Å. Атомы хлора дихлорфе-
C6O1P1
117.48(10)
нильного заместителя также находятся на плоско-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1342
ДОЦЕНКО и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР регистрировали на приборе
Bruker Avance III HD 400MHz [400 (1Н), 162 (31P),
101 МГц (13С)] в растворе ДМСО-d6, в качестве
стандарта использовали остаточные сигналы рас-
творителя, в спектре ЯМР 31P - внешний стандарт,
85%-ную Н3PO4. ИК спектры регистрировали на
ИК Фурье-спектрометре Bruker Vertex 70 с при-
ставкой НПВО на кристалле алмаза, спектральное
разрешение ±4 см-1. Элементный анализ на C, H, N
проводили на приборе Carlo Erba 1106. Контроль за
чистотой полученных соединений осуществляли
методом ТСХ на пластинах Сорбфил-А, элюент -
ацетон-гексан (1:1), проявитель - пары иода, УФ
детектор.
Рис. 2. Фрагмент кристаллической упаковки соедине-
6-Амино-3-метил-4-(2,4-дихлорфенил)-2,4-
ния 9 вдоль направления (100).
дигидропирано[2,3-c]пиразол-5-карбонитрил
(8). Смесь 1.79 г (0.01 моль) 2,4-дихлорбензаль-
дегида, 0.66 г (0.01 моль) малононитрила, 0.98 г
Таким образом, нами впервые обнаружено ано-
(0.01 моль) 3-метилпиразол-5-она, 15 мл EtOH и
мальное протекание реакции тиофосфорилирова-
2 капель морфолина кипятили при перемешивании
ния производного 6-амино-5-цианопирано[2,3-c]-
1.5 ч до образования осадка белого цвета. Осадок
пиразола, приводящее к образованию произ-
отфильтровывали, промывали EtOH и сушили
водного ранее неизвестной гетероциклической
при 80°C. Выход 2.44 г (74%), белый порошок.
системы
-
[1,2]оксафосфинино[6,5-c]пиразола.
ИК спектр, ν, см-1: 3483, 3248, 3111 (N-H), 2183
Разительный контраст полученного результата с
(C≡N), 1639, 1587 (C=N, С=С). Спектр ЯМР 1Н, δ,
данными других работ [12-16] по тиофосфори-
м. д.: 1.78 с (3Н, СН3), 5.05 с (1Н, С4Н), 7.02 уш. с
лированию 2-амино-3-циано-4Н-пиранов, связан,
(2Н, NH2), 7.21 д (1H, H6-Ar, 3J = 8.3 Гц), 7.39 д. д
по нашему мнению, со специфическим тиофос-
(1H, H5-Ar, 3J = 8.3, 4J = 2.0 Гц), 7.58 д (1H, H3-Ar,
форилирующим действием аддукта P2S5·2C5H5N,
4J = 2.0 Гц), 12.17 уш. с (1Н, NH). Спектр ЯМР 13С
отличным от P4S10 и реагента Лоуссона, и со спец-
DEPTQ, δC, м. д.: 9.6* (СН3), 33.1* (C4H), 55.2 (C5),
ификой таутомерных превращений пиранопиразо-
96.4 (C3a), 120.4 (C≡N), 128.1* (C5H-Ar), 128.9*
лов. Доказательство данного положения, исследо-
(C6H-Ar), 132.15 (CCl, Ar), 132.17* (C3H, Ar), 132.8
вание возможностей и ограничений новой реак-
(CCl, Ar), 135.5 (C1Ar), 140.1 (C3), 154.9 (C7a), 161.4
ции, оптимизация условий, а также изучение пре-
(C6). *Сигналы в противофазе. Найдено, %: C
вращений продуктов реакции составляют предмет
52.40; H 3.27; N 17.42. C14H10Cl2N4О. Вычислено,
наших текущих исследований.
%: C 52.36; H 3.14; N 17.45.
Таблица 3. Геометрические параметры водородных связей в молекуле соединения 9а
Расстояние, Å
D-H···A
Угол D-H···A, град
D-H
H···A
D···A
C19-H19···S1i
0.93(3)
2.85(3)
3.6653(18)
147(2)
N5-H5···N3ii
0.88(3)
1.89(3)
2.748(2)
165(2)
N4-H4···S1iii
0.91(3)
2.42(3)
3.2469(14)
152(2)
а Симметрично эквивалентные позиции: i x, 0.5-y, 0.5+z; ii 2-x, 1-y, 1-z; iii 2-x, 0.5+y, 0.5-z.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
НЕОЖИДАННЫЙ РЕЗУ
ЛЬТАТ ТИОФОСФОРИЛИРОВАНИЯ
1343
5-Метил-2-тиоксо-4-(2,4-дихлорфенил)-3,3-
0.41×0.27×0.19 мм, моноклинная сингония, про-
дициано-3,4-дигидро-[1,2]оксафосфинино[6,5-
странственная группа P21/c, M = 494.34; параме-
c]пиразол-2(6H)-тиолат пиридиния (9). Раствор
тры элементарной ячейки: а = 7.47020(10) Å, b =
P4S10 (1.11 г, 2.5 ммоль) в абсолютном пиридине
15.3486(2) Å, с = 18.6525(3) Å, β = 99.508(2)o, V =
(20 мл) кипятили в течение 2 ч для образования
2109.26(5) Å3, Z = 4, dвыч = 1.557 г/см3, μ(CuKα) =
аддукта P2S5·2C5H5N. К полученному раствору ад-
5.535 мм-1, F(000) = 1008; область углов съемки
дукта добавляли раствор пирано[2,3-с]пиразола 8
θ = 3.751-76.150о, интервалы индексов отражений:
(0.8 г, 2.5 ммоль) в 10 мл абсолютного пиридина.
6 ≤ h ≤ -9, 19 ≤ k ≤ -19, 23 ≤ l ≤ -23; число изме-
Смесь кипятили в течение 6 ч. После охлаждения
ренных отражений - 21305, число независимых
реакционную смесь выливали в ледяную воду и
отражений - 4395 (Rint = 0.0521), число отраже-
аккуратно нейтрализовали 5%-ным раствором HCl
ний с I > 2σ(I) - 4138, число уточняемых параме-
до рН = 5. Образовавшийся осадок отфильтровы-
тров - 280, R-фактор [I > 2σ(I)]: R1 = 0.0310 (wR2 =
вали, промывали водой и перекристаллизовывали
0.0835), R-фактор по всем отражениям: R1 = 0.0327
из абсолютного диоксана. Выход 11%, желтый
(wR2 = 0.0850); GOOF по F2 - 1.047; Δρmax/Δρmin =
порошок. Для проведения РСА бледно-желтые
0.475/-0.411 еÅ-3. Некоторые длины связей и углы
кристаллы получали перекристаллизацией из рас-
в структуре 9 представлены в табл. 2. Результаты
твора в ацетоне путем медленного упаривания.
РСА соединения 9 депонированы в Кембриджский
ИК спектр, ν, см-1: 3417, 3202 (N-H), 2237 (C≡N),
банк структурных данных (CCDC 1861903).
1634, 1582 (С=N, С=С). Спектр ЯМР 1Н, δ, м. д.:
1.44 c (3Н, СН3), 4.56 д (1Н, Н4, 3JPH = 4.7 Гц),
ФОНДОВАЯ ПОДДЕРЖКА
7.53 д (1Н, H6-Ar, 3J = 8.6 Гц), 7.57 д. д (1Н, H5-Ar,
3J = 8.6, 4J = 1.7 Гц), 7.83 д (1Н, H3-Ar, 4J = 1.7 Гц),
Работа выполнена при поддержке Министерства
8.00-8.04 м (2Н, H3, H5, Py), 8.54 м (1H, H4, Py,
образования и науки РФ (проект № 4.5547.2017/8.9,
АВ2-система, 3J = 7.7 Гц), 8.90 д (2H, H2, H6, Py,
В.В. Доценко и И.В. Аксенова), а также Президента
3J = 5.6 Гц), 12.19 уш. с (1Н, NH). Сигнал протона
РФ в рамках государственной поддержки моло-
NH+ не проявляется, очевидно, вследствие дейте-
дых российских ученых - кандидатов наук (грант
рообмена. Спектр ЯМР 13С DEPTQ, δC, м. д.: 10.9*
№ МК-3089.2018.3).
(СН3), 41.5* уш. с (C4H), 49.2 д (С3, 1JPС = 35.2 Гц),
95.5 д (С4а, 3JPС = 7.3 Гц), 113.9 д (C≡N, 2JPС =
КОНФЛИКТ ИНТЕРЕСОВ
26.4 Гц), 114.0 д (C≡N, 2JPС = 32.3 Гц), 127.0* (C3,
Авторы заявляют об отсутствии конфликта
С5, Py), 128.1* (С5, Ar), 129.4* (С3, Ar), 132.2* (С6,
интересов.
Ar), 132.7 д (С1, Ar, 3JPС = 7.3 Гц), 134.2 (C2, Ar),
134.9 (C4, Ar), 136.7 (C5), 142.8* (C2, С6, Py), 145.6*
СПИСОК ЛИТЕРАТУРЫ
(C4, Py), 155.0 д (C7a, 3JPС = 5.9 Гц). Спектр ЯМР
31P: δР 99.47 м. д. Найдено, %: C 46.11; H 2.93; N
1. Myrboh B., Mecadon H., Rohman M.R., Rajbangshi M.,
14.15. C19H14Cl2N5OPS2. M = 494.36. Вычислено,
Kharkongor I., Laloo B.M., Kharbangar I., Kshiar B. //
%: C 46.16; H 2.85; N 14.17.
Org. Prep. Proced. Int. 2013. Vol. 45. N 4. P. 253. doi
10.1080/00304948.2013.798566
Рентгеноструктурный анализ выполняли на
2. Шаранин Ю.А., Гончаренко М.П., Литвинов В.П.
автоматическом четырехкружном дифрактометре
Agilent Super Nova, Dual, Cu at zero, Atlas S2 при
// Усп. хим. 1998. Т. 67. № 5. С. 442; Sharanin Yu.A.,
99.9(3) K. Структура расшифрована прямым ме-
Goncharenko M.P., Litvinov V.P. // Russ. Chem. Rev.
тодом в комплексе программ Olex2 [28] и ShelXD
1998. Vol. 67. N 5. P. 393. doi 10.1070/RC1998v-
[29] и уточнена с помощью пакета SHELXL [30].
067n05ABEH000371
Структура уточнена полноматричным МНК в ани-
3. Избранные методы синтеза и модификации гете-
зотропном приближении для неводородных ато-
роциклов / Под ред. В.Г. Карцева. М.: IBS PRESS,
мов по F2. Основные характеристики эксперимен-
2003. Т. 2. С. 534.
та и параметры элементарной ячейки 9: габитус
4. Advances in heterocyclic chemistry / Ed. A.R. Katritzky.
монокристалла призматический, размер кристалла
Oxford: Academic Press, 2011. Vol. 103. P. 175.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1344
ДОЦЕНКО и др.
5. Kozachenko A.P., Shablykin O.V., Gakh A.A., Rusa-
18. Нифантьев Э.Е., Завалишина А.И. // Усп. хим. 1982.
nov E.B., Brovarets V.S. // Heteroatom Chem. 2010.
Т. 51. №. 10. С. 1601; Nifant’ev E.E., Zavalishina A.I. //
Vol. 21. N 7. P. 492. doi 10.1002/hc.20638
Russ. Chem. Rev. 1982. Vol. 51. N 10. P. 921. doi
6. Khalladi K., Touil S. // J. Sulfur Chem. 2012. Vol. 33. N 1.
10.1070/RC1982v051n10ABEH002932
P. 27. doi 10.1080/17415993.2011.639021
19. Frank E., Wölfling J. // Curr. Org. Chem. 2007. Vol. 11.
7. Allouche F., Chabchoub F., Salem M., Kirsch, G. //
N 18. P. 1610. doi 10.2174/138527207783221228
Synth. Commun. 2011. Vol. 41. N 10. P. 1500. doi
20. Доценко В.В., Кривоколыско С.Г. // ХГС. 2012. № 12.
10.1080/00397911.2010.486516
С. 1987; Dotsenko V.V., Krivokolysko S.G. // Chem.
8. Нилов Д.Б., Кадушкин А.В., Соловьева Н.П., Шейн-
кер Ю.Н., Граник В.Г. // ХГС. 2004. № 1. С. 113; Ni-
Heterocycl. Compd. 2012. Vol. 48. N. 12. P. 1863. doi
lov D.B., Kadushkin A.V., Solov’eva N.P., Sheinker Y.N.,
10.1007/s10593-013-1220-6
Granik V.G. // Chem. Heterocycl. Compd. 2004. Vol. 40.
21. Meisel M., Grunze H. // Z. anorg. allg. Chem. 1967.
N 1. P. 106. doi 10.1023/B:COHC.0000023777.35950.cd
Bd 360. S. 277. doi 10.1002/zaac.19683600507
9. Nilov D.B., Kadushkin A.V., Solov’eva N.P., Sedov A.L.,
22. Bergman J., Pettersson B., Hasimbegovic V., Svens-
Granik, V.G. // Mendeleev Commun. 1996. Vol. 6. N 5.
son P.H. // J. Org. Chem. 2011. Vol. 76. N 6. P. 1546.
P. 191. doi 10.1070/MC1996v006n05ABEH000640
doi 10.1021/jo101865y
10. Нилов Д.Б., Кадушкин А.В., Граник В.Г. // Хим.-фарм.
23. Maigali S.S., Abd-El-Maksoud M.A., Soliman F.M. //
ж. 2004. Т. 38. № 8. С. 42; Nilov D.B., Kadushkin A.V.,
Arch. Pharm. 2011. Vol. 344. N 7. P. 442. doi 10.1002/
Granik V.G. // Pharm. Chem. J. 2004. Vol. 38. N 8. P. 451.
doi 10.1023/B:PHAC.0000048910.45523.b7
ardp.201000341
11. Elgazwy A.S.S.H., Soliman D.H. // Open Conf. Proc. J.
24. Nasibullin I.O., Nemtarev A.V., Mironov V.F. //
2013. Vol. 4. P.77. doi 10.2174/2210289201304010077
Mendeleev Commun. 2017. Vol. 27. N 2. P. 131. doi
12. Gardelly M., Trimech B., Belkacem M.A., Harbach M.,
10.1016/j.mencom.2017.03.007
Abdelwahed S., Mosbah A., Bouajila J., Jannet H.B. //
25. Ávila-Zárraga J.G., Pérez I., Beristain E., Gavilan I.,
Bioorg. Med. Chem. Lett. 2016. Vol. 26. N 10. P. 2450.
Romero M. // Synth. Commun. 2017. Vol. 47. N 4.
doi 10.1016/j.bmcl.2016.03.108
P. 364. doi 10.1080/00397911.2016.1265651
13. Ali T.E., Assiri M.A., Abdel-Kariem S.M., Ya-
hia I.S. // J. Sulfur Chem. 2018. doi 10.1080/
26. Wawrzyniak P., Kindermann M.K., Thede G.,
17415993.2018.1455837
Schulzke C., Jones P.G., Heinicke J.W. // Eur. J. Inorg.
14. Mohamed N.R., Khaireldin N.Y., Fahmy A.F., El-
Chem. 2017. Vol. 2017. N 29. P. 3580. doi 10.1002/
Sayed A.A. // J. Heterocycl. Chem. 2013. Vol. 50. N 6.
ejic.201700770
P. 1264. doi 10.1002/jhet.884
27. Burgi H.-B., Dunitz J.D. Structure correlation.
15. Younes S.H.H., Mohamed S.K., Albayati M.R. // Arch.
Weinheim: VCH, 1994. Vol. 2. P. 741.
Pharm. 2013. Vol. 346. N 10. P. 727. doi 10.1002/
28. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
ardp.201300171
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
16. Younes S.H., Mohamed S.K., Abdelhamid A.A., Ghat-
Vol. 42. P. 339. doi 10.1107/S0021889808042726
tas A.-B.A.G. // Int. J. Pharm. Sci. Rev. Res. 2013.
Vol. 23. N 2. P. 81.
29. Sheldrick G. M. // Acta Crystallogr. (A). 2008. Vol. 64.
P. 112. doi 10.1107/S0108767307043930
17. Gholivand K., Ghaziani F., Shariatinia Z., Dorosti N.,
Mirshahi M., Sarikhani S. // Med. Chem. Res. 2012.
30. Sheldrick G. M. // Acta Crystallogr. (C). 2015. Vol. 71.
Vol. 21. N 9. P. 2185. doi 10.1007/s00044-011-9737-7
P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
НЕОЖИДАННЫЙ РЕЗУ
ЛЬТАТ ТИОФОСФОРИЛИРОВАНИЯ
1345
Unexpected Result of Thiophosphorylation
of 6-Aminopyrano[2,3-c]pyrazole-5-carbonitrile Derivative
V. V. Dotsenkoa, b, *, V. A. Dushenkoa, N. A. Aksenovb, I. V. Aksenovab, and E. E. Netrebac
a Kuban State University, ul. Stavropolskaya 149, Krasnodar, 350040 Russia
*e-mail: victor_dotsenko_@mail.ru
b North Caucasian University, Stavropol, Russia
c V.I. Vernadskii Taurida Academy of the Crimean Federal University, Simferopol, Russia
Received March 21, 2019; revised March 21, 2019; accepted April 15, 2019
The reaction of 6-amino-3-methyl-4-(2,4-dichlorophenyl)-2,4-dihydropyrano[2,3-c]pyrazole-5-carbonitrile
with phosphorus sulfide in boiling pyridine unexpectedly leads to the formation of a not previously described
heterocyclic system - [1,2]oxaphosphinino[6,5-c]pyrazole derivative. Structure of the obtained compound was
proved using 2D NMR spectroscopy and X-ray diffraction analysis.
Keywords: thiophosphorylation, phosphorus(V) sulfide, pyrano[2,3-c]pyrazoles, 1,2-oxaphosphinines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019