ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1346-1351
УДК 547.759:547.752:547.8
СКЕЛЕТНОЕ РАЗНООБРАЗИЕ В КАТАЛИТИЧЕСКОМ
СИНТЕЗЕ (1,3-ОКСАЗАЦИКЛОАЛК-3-ИЛМЕТИЛ)-
ЗАМЕЩЕННЫХ ПИРРОЛОВ
© 2019 г. В. Р. Ахметоваa, b, *, Э. М. Бикбулатоваa, Р. В. Кунаковаb, К. Л. Аметас, А. Г. Ибрагимова
a Институт нефтехимии и катализа Уфимского федерального исследовательского центра Российской академии
наук, пр. Октября 141, Уфа, 450075 Россия
*e-mail: vnirara@mail.ru
b Уфимский государственный нефтяной технический университет, Уфа, Россия
с Университет науки и техники им. Моди, Раджастхан, Индия
Поступило в Редакцию 9 апреля 2019 г.
После доработки 9 апреля 2019 г.
Принято к печати 12 апреля 2019 г.
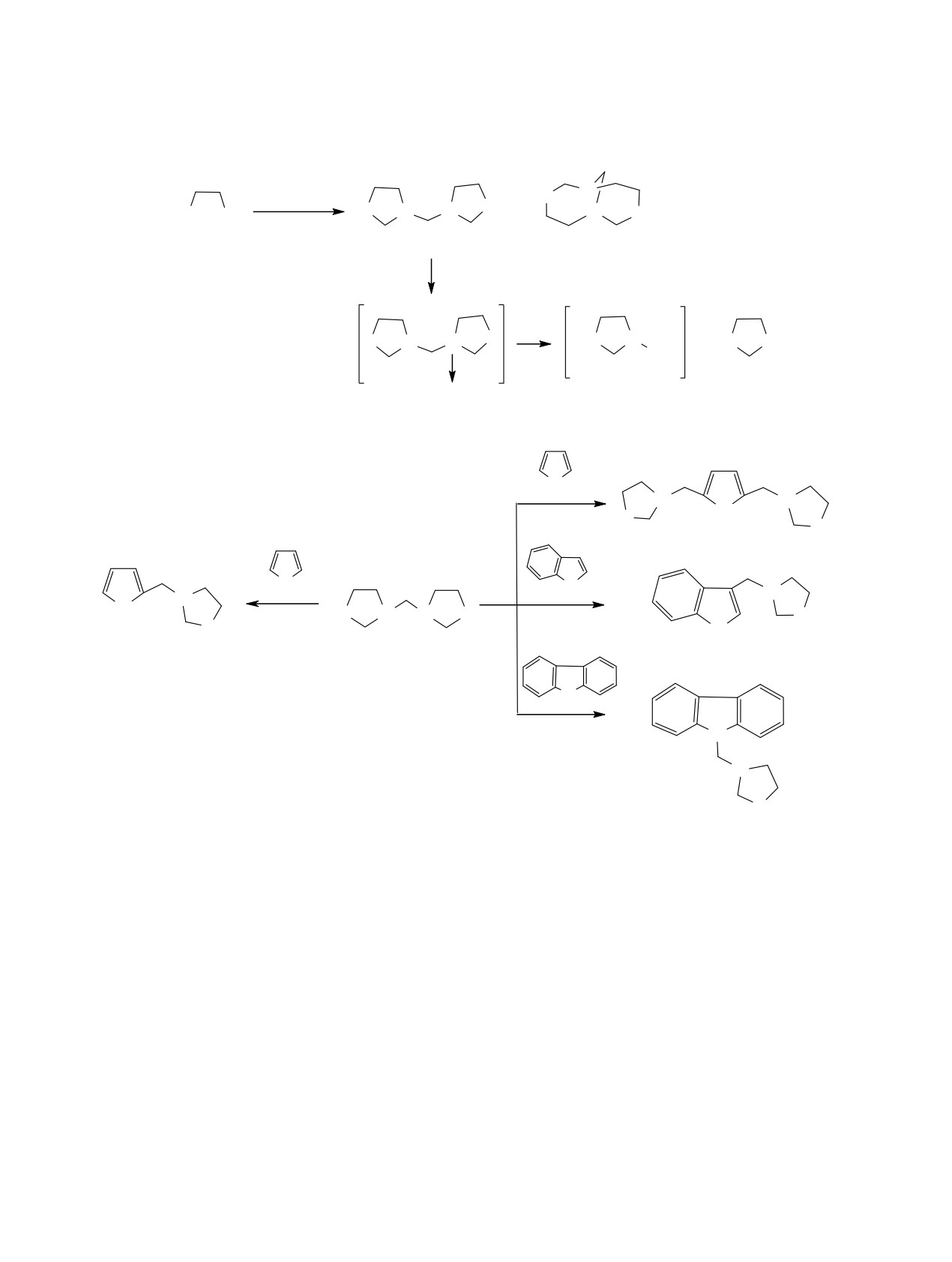
Получена серия ди- и триядерных производных пиррола на основе каталитической реакции СН-sp2-ами-
нометилирования пиррола бис(1,3-оксазациклоалк-3-ил)метанами в присутствии 5 мол% ZrOCl2.8Н2О.
Реакция проходит по положениям 2, 5 или 2 пиррола в зависимости от взятого количества аминомети-
лирующих реагентов, получаемых из формальдегида и α,ω-аминоспиртов (2-аминоэтан-1-ола, 3-ами-
нопропан-1-ола, 4-аминобутан-1-ола). Реакция аминометилирования индола бис(1,3-оксазолидин-3-ил)-
метаном проходит в положение 3. В случае карбазола в этих условиях протекает N-аминометилирование.
Ключевые слова: пиррол, индол, карбазол, аминоспирты, формальдегид, аминометилирование
DOI: 10.1134/S0044460X19090051
Ароматические соединения, включающие ди-
молекулы с пиррольным фармакофором (индол,
гидро- и тетрагидро-1,3-оксазольные фрагменты,
карболины, карбазол) перспективны как мульти-
обладают нейромедиаторными свойствами [1-4].
таргентные нейропротекторные вещества [7].
Для формирования фенилзамещенных 1,3-оксазо-
Нами предложен новый способ конструирова-
льных циклов, например в синтезе лекарственных
ния тетрагидро-1,3-изоксазолидин-3-илзамещен-
препаратов пемолина или аминорекса, использу-
ных пирролов, индолов и карбазолов на основе ре-
ют
[3+2]-циклоконденсацию α-функционализи-
акции аминометилирования в присутствии 5 мол%
рованного бензилового спирта с гуанидином или
ZrOCl2.8Н2О в качестве катализатора. Выбор ката-
[4+1]-циклоконденсацию с бромцианом
[2-4].
лизатора обусловлен его эффективностью в реак-
Конденсированные пирроло[1,2-c]оксазол-1-оны и
циях СН-sp2-аминометилирования пиррола и ин-
оксазоло[3,4-a]индол-1-оны были получены мно-
дола, а также N-аминометилирования карбазола
гостадийным способом [5]. Сведения о получении
[8].
1,3-оксазол-3-ил-, 1,3-оксазинан-3-ил- и 1,3-окса-
Аминометилирующий реагент - бис(1,3-оксазо-
зепан-3-илзамещенных пирролов отсутствуют.
лидин-3-ил)метан 1 - получен конденсацией 2-ами-
В продолжение исследований по синтезу новых
ноэтан-1-ола с параформом (схема 1) [9]. В смеси с
фармакологически активных производных ряда
бис(1,3-оксазолидин-3-ил)метаном 1 в результате
азолов [6] нами проведен синтез ди- и триядерных
межмолекулярной гетероциклизации двух моле-
соединений с пиррольными, тетрагидро-1,3-окса-
кул 2-аминоэтан-1-ола с 3 молями формальдегида
зольными циклами в молекулах, а также с их ше-
образуется бицикло[4.4.1]-1,6-диаза-3,8-диокса-
сти- и семичленными циклическими гомологами -
ундекан 2 (30-35%) [10]. Реакционноспособный
1,3-оксазинанами и 1,3-оксазепанами. Гибридные
бис(1,3-оксазолидин-3-ил)метан 1 в условиях ре-
1346
СКЕЛЕТНОЕ Р
АЗНООБРАЗИЕ В КАТАЛИТИЧЕСКОМ СИНТЕЗЕ
1347
Схема 1.
N
O
(CH2O)n,
C6H6
+
O
O N N
N O
H2N OH
H2O
2
1
[Zr]
+
H
O
+
O N N
O N
+
HN O
CH
2
A
[Zr]
Схема 2.
1/2
N
H
N
N
N
[Zr]
O
H
O
3
N
N
H
[Zr]
H
N
N
N
O
N
N O
O
H
[Zr]
[Zr]
O
N
H
4
1
5
N
H
[Zr]
N
N
O
6
акции, по-видимому, элиминирует молекулу окса-
3-илметил)-1Н-индол 5 (87%) и 9-(1,3-изоксазоли-
золидина с образованием аминометилирующего
дин-3-илметил)-9Н-карбазол 6 (52%).
интермедиата А.
Строение полученных соединений подтверж-
Катализируемое ZrOCl2.8Н2О взаимодействие
дено данными ЯМР 1Н, 13С, а также методом
пиррола с бис(1,3-оксазолидин-3-ил)метаном
1
масс-спектрометрии. В спектрах ЯМР 1Н сигналы
в соотношении
1:2 приводит к триядерному
протонов пиррольного цикла резонируют при 5.9
2,5-бис(1,3-изоксазолидин-3-илметил)-1Н-пирро-
(3) и 5.9, 6.7, 7.3 м. д. (4). Метиленовые протоны
лу 3 с выходом 65%. Селективно проходит реакция
между пиррольным и оксазолидиновым циклами
при соотношении реагент 1:пиррол = 1:1 с обра-
наблюдаются при 3.7 м. д., а протоны группы NH -
зованием диядерного производного - 2-(1,3-изок-
в области 7.20-9.35 м. д. Сигналы метиленовых
сазолидин-3-илметил)-1Н-пиррола 4 - c выходом
протонов оксазолидинового фрагмента, находя-
74% (схема 2). На основе индола и карбазола в
щиеся между атомами азота и кислорода, прояв-
этих условиях получены
3-(1,3-изоксазолидин-
ляются в виде уширенного синглета при 4.3 м. д.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1348
АХМЕТОВА и др.
Схема 3.
n
'
n
n
2
+
3CH2O
OH NH2
C6H6
O N N O
7, 8
[Zr]
C6H5CH3,
60oC
1/2
N
N
H
H
O
O
O
n
n
n
N
N
N
N
N
H
H
11, 12
9, 10
n = 1 (7, ൳, 11), 2 (8, 10, 12).
тогда как протоны фрагмента СН2СН2 оксазолиди-
вых протонов при 2.83 м. д. - с сигналом атомов
нового кольца проявляются в виде триплетов с J =
углерода при 49.2 м. д., триплет метиленовых про-
6.8 Гц, у атома азота - в области 3.0 м. д., а у атома
тонов при 3.82 м. д. - с сигналом атомов углерода
кислорода - при 3.8 м. д. В спектрах соединений 5
при 68.8 м. д.; уширенный синглет метиленовых
и 6 наряду с сигналами оксазолидинового кольца
протонов при 4.25 м.д. дает кросс-пик с сигналом
наблюдаются соответствующие сигналы атомов
атомов углерода при 84.4 м. д., синглет протонов
водорода ароматического кольца. В масс-спектре
ароматического кольца при 5.92 м. д. взаимодей-
(MALDI TOF/TOF) соединений 5-7 имеются ин-
ствует с сигналом атома углерода при 107.2 м. д.
тенсивные пики молекулярных ионов [М + Н]+.
В спектре 1Н-13С HMBC гетероядерные спин-
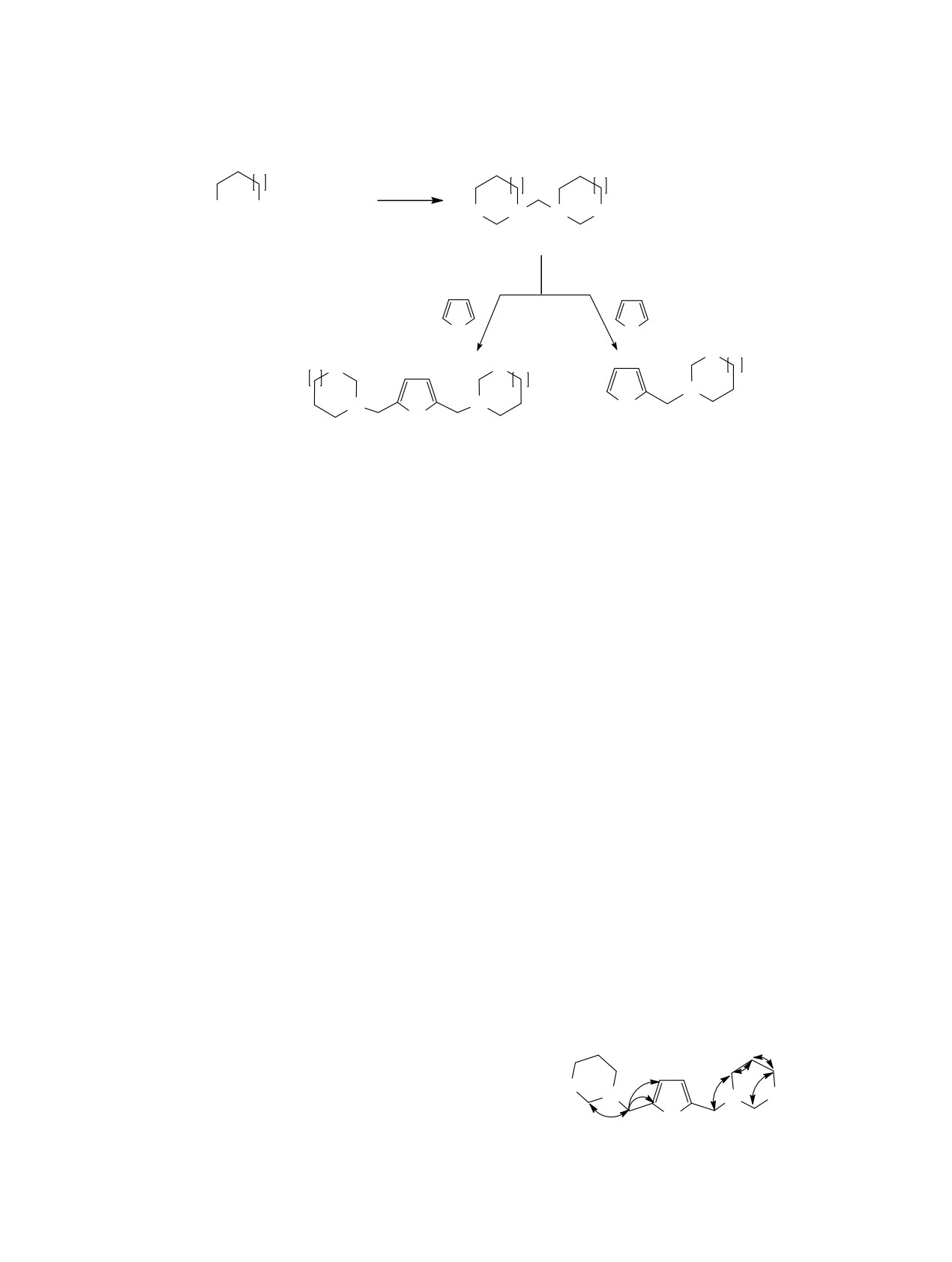
Предложенная методология была успешно
спиновые взаимодействия демонстрируются
реализована для синтеза разнообразных поли-
выраженными кросс-пиками между сигналами
гетероциклов - (1,3-оксазинан-3-ил- и 1,3-окса-
ациклических метиленовых протонов у атома азо-
зепан-3-ил)метилзамещенных пирролов
9-12 с
та при 3.74 м. д. с атомами углерода ароматическо-
использованием соединений 7 и 8, полученных
го кольца при 107.2 и 128.5 м. д., а также сигнала-
гетероциклизацией
3-аминопропан-1-ола или
ми ациклических метиленовых протонов у атома
4-аминобутан-1-ола с формальдегидом. Катализ
азота при 3.74 м. д. с углеродами окзазинанового
реакции СН-sp2-аминометилирования пиррола в
кольца при 49.2 и 84.4 м. д. (схема 4). Наблюдаются
присутствии 5 мол% ZrOCl2.8Н2О в зависимости
также кросс-пики между сигналами метиленовых
от соотношения реагентов 7(или 8):пиррол = 2:1
протонов оксазинанового фрагмента.
или 1:1 приводит к соответствующим три- или ди-
Соединения 3-5 растворимы в воде и поэтому
ядерным производным пиррола.
пригодны для использования в качестве биорегу-
В масс-спектрах соединений 9-12 присутству-
ляторов в водной среде. Для этих соединений из-
ют соответствующие пики положительных ионов
учена фунгицидная активность по методу диффу-
[М + Н]+. Для спектров ЯМР соединения 9 были
сделаны отнесения сигналов с использованием
Схема 4.
методик гетероядерной спектроскопии ЯМР. На
основании эксперимента HSQC найдены следу-
O
ющие корреляции: мультиплет метиленовых про-
N
N
O
тонов при 1.66 м. д. дает кросс-пик с сигналом
N
H
атома углерода при 22.03 м. д., триплет метилено-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СКЕЛЕТНОЕ Р
АЗНООБРАЗИЕ В КАТАЛИТИЧЕСКОМ СИНТЕЗЕ
1349
зии в агар [11]. В качестве тест-объектов использо-
Бис(1,3-оксазинан-3-ил)метан
(7). Выход
вали фитопатогенные грибы Fusarium oxysporum,
97%, бесцветная жидкость. Спектр ЯМР 1Н, δ,
Bipolaris sorokiniana и Rhizoctonia solani - возбуди-
м. д.: 1.56 м (4Н, СН2), 2.93 т (4Н, СH2N, J = 4.8
тели различных заболеваний сельскохозяйствен-
Гц), 3.65 с (4Н, ArСH2N), 3.78 т (2Н, СН2O, J = 4.8
ных культур. Соединение 3 оказывает фунгиста-
Гц), 4.32 с (4Н, NСH2O). Спектр ЯМР 13С, δС, м.
тическое действие на Rhizoctonia solani, задержи-
д.: 22.4 (CH2), 47.7 (СH2N), 68.0 (ArСH2N), 68.8
вает его развитие и способствует формированию
(СН2O), 82.9 (NСH2O). Масс-спектр, m/z: 187.1445
нетипичного мицелия. Остальные соединения не
[M + H]+ (вычислено для С9Н18N2O2: 186.1368).
оказывают воздействия на развитие микроскопи-
Бис(1,3-оксазепан-3-ил)метан
(8).
Выход
ческих грибков
92%, бесцветная жидкость. Спектр ЯМР 1Н, δ, м.
Таким образом, получена серия (1,3-оксазаци-
д.: 1.56 уш. с (4Н, СН2), 1.72 уш. с (4Н, СН2), 2.44
клоалк-3-илметил)производных пирролов на ос-
т (4Н, СH2N, J = 6.0 Гц), 3.65 с (4Н, ArСH2N), 3.78
нове формальдегида, α,ω-аминоспиртов и пиррола
д (2Н, СН2O, J = 6.0 Гц), 4.28 д (4Н, NСH2O, J =
путем катализируемой ZrOCl2. 8Н2О реакции СН-
6.1 Гц), 4.42 д (4Н, NСH2O, J = 6.1 Гц). Спектр ЯМР
sp2-аминометилирования пиррола по положениям
13С, δС, м. д.: 24.3 (CH2), 27.0 (CH2), 50.3 (СH2N),
2, 5 или 2 в зависимости от соотношения реаген-
62.2 (ArСH2N), 69.1 (СН2O), 83.8 (NСH2O). Масс-
тов. Аналогичная реакция с индолом проходит в
спектр, m/z: 215.1081 [M + H]+ (вычислено для
положение 3, а карбазол в этих условиях реагирует
С11Н22N2O2: 214.1681).
по атому N9.
Общая методика синтеза (оксазолидин-3-ил-
метил)-1Н-пирролов 3, 4. Смесь 0.07 мл (1 ммоль)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
пиррола, 0.16 г (1 ммоль, при получении соеди-
нения 4) или 0.32 г (2 ммоль, при получении со-
Масс-спектры в режиме MALDI регистриро-
единения 3), 3 мл толуола и 0.016 г (0.05 ммоль)
вали на спектрометре Bruker MALDI TOF/TOF
ZrOCl2∙8H2O перемешивали 6 ч при 60°С. После
Autoflex III, в качестве матрицы использовали си-
охлаждения реакционную смесь пропускали через
напиновую кислоту, пробу готовили методом вы-
слой SiO2.
сушивания капли вещества в хлороформе (1:10).
ИК спектры записывали на Фурье-спектрометре
2,5-Бис(оксазолидин-3-илметил)-1Н-пиррол
Bruker Vertex-70V в вазелиновом масле. Спектры
(3). Выход 65%, желтое масло. Спектр ЯМР 1Н, δ,
ЯМР 1Н, 13С регистрировали на спектрометре
м. д.: 3.00 т (4Н, ССН2N, J = 6.8 Гц), 3.68 уш. с (4Н,
Bruker Ascend III HD 500 (500, 125 МГц). рас-
СArСH2N), 3.79 т (4Н, ССН2О, J = 6.8 Гц), 4.32 уш.
творитель - CDCl3, внутренний стандарт - ТМС.
с (4Н, NСH2O), 5.94 д (2Н, СН2, J = 2.4 Гц), 7.20 с
Гомо- и гетероядерные двумерные эксперименты
(1Н, NH). Спектр ЯМР 13С, δС, м. д.: 51.03 (C6,12),
выполнены с использованием стандартных им-
55.05 (C 4,17), 63.03 (С5,16), 86.28 (С2,14), 107.20
пульсных последовательностей фирмы «Bruker».
(С10,11), 128.23 (C7,9). Масс-спектр, m/z: 238.298
Ход реакций контролировали методом ТСХ на
[M + H]+ (вычислено для С12Н19N3O2: 237.1477).
пластинах Sorbfil, элюент - гексан-EtOAc (1:2),
2-(Оксазолидин-3-илметил)-1Н-пиррол
(4).
проявление парами иода.
Выход 74%, желтое масло. Спектр ЯМР 1Н, δ, м. д.:
Общая методика синтеза соединений 1, 7,
3.02 т (2Н, ССН2N, J = 6.8 Гц), 3.68 уш. с (2Н,
8. Смесь 0.45 г (15 ммоль) параформальдегида и
СArСH2N), 3.81 т (2Н, ССН2О, J = 6.8 Гц), 4.30
10 ммоль соответствующего аминоспирта (2-ами-
уш. с (4Н, NСH2O); 5.91 с, 6.70 с и 7.34 c (3Н,
ноэтан-1-ола, 3-аминопропан-1-ола, 4-аминобутан-
СНAr), 7.20 с (1Н, NH). Спектр ЯМР 13С, δС, м.
д.: 51.03 (C6,12), 55.05 (C 4,17), 63.03 (С5,16), 86.28
1-ола) и 25 мл бензола кипятили с насадкой Дина-
Старка в течение 5 ч. После отгонки воды реакци-
(С2,14), 107.20 (С10,11), 128.23 (C7,9). Масс-спектр,
онную смесь охлаждали и упаривали. Целевые со-
m/z: 153.0956 [M + H]+ (вычислено для С8Н12N2O:
152.0950).
единения выделяли с выходами 70-100%. Физико-
химические характеристики соединения 1 соот-
3-(1,3-Оксазолидин-3-илметил)-1Н-индол
ветствовали приведенным в работе [9].
(5). Смесь 0.12 г (1 ммоль) индола, 0.16 г (1 ммоль)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1350
АХМЕТОВА и др.
бис(оксазолидин-3-ил)метана,
3 мл толуола и
117.7, 128.37 (СAr). Масс-спектр, m/z: 167.11 [M +
0.016 г (0.05 ммоль) ZrOCl2∙8H2O перемешивали
H]+ (вычислено для С9Н14N2O: 166.1106).
6 ч при 60°С. После охлаждения реакционную
2,5-Бис(1,3-оксазепан-3-илметил)-1Н-пир-
смесь пропускали через слой SiO2. Выход 87%,
рол (10) получали в условиях синтеза соедине-
желтое масло. Спектр ЯМР 1Н, δ, м. д.: 2.30 c (2Н,
ния 3 из пиррола и реагента 8 в соотношении 1:2.
ССН2N), 3.47 с (2Н, СH2O), 3.46 c (2СН2, NCH2O),
Выход 63%, желтое масло. Спектр ЯМР 1Н, δ, м. д.:
3.80 с (2Н, СH2N), 7.12-7.53 c (5НAr), 10.20 с (1Н,
1.55-1.60 м (4Н, СН2), 2.31 т (4Н, СH2N, J =
NH). Спектр ЯМР 13С, δC, м. д.: 49.03 (C6), 56.05
5.5 Гц), 3.73 с (4Н, ArСH2N), 3.82 т (4Н, СН2O,
(C4), 63.03 (С5), 89.28 (С2), 112.20 (С14), 112.39
J = 5.1 Гц), 4.25 с (4Н, NСH2O), 5.98 д (2Н, СН2,
(C7), 119.63 (C11), 120.34 (C12), 121.14 (C13), 126.19
J = 2.3 Гц), 9.7 с (1Н, NH). Спектр ЯМР 13С, δС, м. д.:
(C8), 127.23 (C15), 136.75 (C10). Масс-спектр, m/z:
24.3, 25.7 (CH2), 48.8 (СH2N), 49.2 (ArСH2N), 67.9
203.1322 [M + H]+ (вычислено для С12Н14N2O:
(СН2O), 84.4 (NСH2O); 107.2, 128.5 (CAr). Масс-
202.1106).
спектр, m/z: 294.4050 [M + H]+ (вычислено для
9-(1,3-Оксазолидин-3-илметил)-9H-карбазол
С16Н27N3O2: 293.2103).
(6) получали аналогично из 0.12 г (1 ммоль) карба-
2-(1,3-Оксазепан-3-илметил)-1H-пиррол (12)
зола, 0.16 г (1 ммоль) бис(оксазолидин-3-ил)мета-
получали в условиях синтеза соединений 5 и
на и 0.016 г (0.05 ммоль) ZrOCl2∙8H2O. Выход 69%,
6 из пиррола и реагента 8 в соотношении 1:1.
желтое масло. Спектр ЯМР 1Н, δ, м. д.: 3.10 т (2Н,
Выход 70%, желтое масло. Спектр ЯМР 1Н, δ, м.
ССН2N, J = 6.8 Гц), 3.70 т (2Н, ССН2О, J = 6.8 Гц),
д.: 1.54-1.61 м (2Н, СН2), 2.47 т (2Н, СH2N, J =
5.42 с (2Н, СArСH2N), 4.32 уш. с (4Н, NСH2O); 7.19
5.5 Гц), 3.75 с (2Н, ArСH2N), 3.87 т (2Н СH2N, J = 5.1
с, 7.18 с и 8.64 c (3Н, СНAr) Спектр ЯМР 13С, δC, м. д.:
Гц), 5.97 с (НAr), 6.54 c (НAr), 7.35 c (НAr), 9.1 с (1Н,
52.03 (CH2), 48.8 (СH2N), 63.6 (ArСH2N), 65.9
NH). Спектр ЯМР 13С, δC, м. д.: 24.3, 25.4 (CH2).
(СН2O), 85.0 (NСH2O); 109.2, 119.3, 120.5, 122.3,
49.3 (СH2N), 53.6 (ArСH2N), 70.8 (СН2O), 82.7
125.7, 143.4 (CAr). Масс-спектр, m/z: 252.1718 [M]+
(NСH2O); 107.5, 117.8, 128.4 (СAr). Масс-спектр,
(вычислено для С16Н16N2O: 252.1263).
m/z: 181.2781 [M + H]+ (вычислено для С10Н16N2O:
180.1263).
2,5-Бис(1,3-оксазинан-3-илметил)-1Н-пир-
рол (9) получали в условиях синтеза соединения 3
Авторы выражают благодарность Центру кол-
из пиррола и реагента 7 в соотношении 1:2. Выход
лективного пользования «Агидель» Институт не-
79%, желтое масло. Спектр ЯМР 1Н, δ, м. д.:
фтехимии и катализа Уфимского федерального
1.66 м (4Н, СН2), 2.83 т (4Н, СH2N, J = 5.5 Гц),
исследовательского центра РАН за структурные
3.74 с (4Н, ArСH2N), 3.82 т (4Н, СН2O, J = 5.1 Гц),
исследования соединений, а также Н.Ф. Галим-
4.25 с (4Н, NСH2O), 5.92 д (2Н, СН2, J = 2.3 Гц),
зяновой за изучение фунгицидной активности.
8.7 с (1Н, NH). Спектр ЯМР 13С, δС, м. д.: 22.03
ФОНДОВАЯ ПОДДЕРЖКА
(CH2), 48.8 (СH2N), 49.2 (ArСH2N), 67.9 (СН2O),
Работа выполнена при финансовой поддержке
84.4 (NСH2O); 107.2, 128.5 (CAr). Масс-спектр,
Российского фонда фундаментальных исследова-
m/z: 266.17 [M + H]+ (вычислено для С14Н23N3O2:
ний (проект № 17-43-020292р_а) и Академии наук
265.1790).
Республики Башкортостан в рамках проектной ча-
2-(1,3-Оксазинан-3-илметил)-1Н-пиррол (11)
сти госзадания (№ AAAA-A19-119022290010-9).
получали в условиях синтеза соединений 5 и 6 из
КОНФЛИКТ ИНТЕРЕСОВ
пиррола и реагента 7 в соотношении 1:1. Выход
80%, желтое масло. Спектр ЯМР 1Н, δ, м. д.: 1.61 м
Авторы заявляют об отсутствии конфликта
(2Н, СН2), 2.99 т (2Н, СH2N, J = 5.5 Гц), 3.74 с (2Н,
интересов.
ArСH2N), 3.85 т (2Н, СН2O, J = 5.1 Гц), 6.24 с (НAr),
СПИСОК ЛИТЕРАТУРЫ
6.76 c (НAr), 7.37 c (НAr), 9.4 с (1Н, NH). Спектр
ЯМР 13С, δAr, м. д.: 22.47 (CH2), 47.8 (СH2N),
1. Читил М., Фанг К.К., Хефферман М., Уипф П., Хоп-
68.0 (ArСH2N), 73.8 (СН2O), 83.0 (NСH2O); 107.7,
кинс С. Пат. РФ 2384574 (2008). РФ; Б. И. 2010. № 8.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СКЕЛЕТНОЕ Р
АЗНООБРАЗИЕ В КАТАЛИТИЧЕСКОМ СИНТЕЗЕ
1351
2. Willy M.E., Manda B., Shatin D., Drinkard C.R.,
8. Ахметова В.Р., Бикбулатова Э.М., Ахмадиев Н.С.,
Graham D.J. // J. Am. Acad. Child Adolesc. Psychiatr.
Яныбин B.M., Бойко Т.Ф., Кунакова Р.В., Ибраги-
2002. Vol. 41. N 7. P. 785. doi 10.1097/00004583-
мов А.Г. // ЖОрХ. 2018. Т. 54. Вып. 5. С. 699;
200207000-00009
Akhmetova V.R., Bikbulatova E.M., Akhmadiev N.S.,
3. Gaine S.P., Rubin L.J., Kmetzo J.J., Palevsky H.I.,
Yanybin V.M., Boiko T.F., Kunakova R.V., Ibragi-
Traill T.A. // CHEST. 2000. Vol. 118. N 5. P. 1496. doi
mov A.G. // Russ. J. Org. Chem. 2018. Vol. 54. N 5.
10.1378/chest.118.5.1496
P. 701. doi 10.1134/S1070428018050056
4. Kankaanpää A., Ellermaa S., Meririnne E., Hirsjärvi
9. Salas-Coronado R., Gálvez-Ruiz J. C., Guadarrama-
P., Seppälä T. // J. Pharm. Exp. Ther. 2002. Vol. 300.
Pérez C., Flores-Parr A. // Heterocycles. 2003. Vol. 60.
N 2. P. 450. doi 10.1124/jpet.300.2.450
N 5. P. 1111. doi 10.3987/COM-03-9713
5. Katritzky A.R., Singh S.K., Bobrov S. // J. Org. Chem.
10. Хабибуллина Г.Р., Яныбин B.M., Ибрагимов А.Г.,
2004. Vol. 69. N 26. P. 9313. doi 10.1021/jo0485334
Джемилев У.М. // ХГС. 2014. № 5. С. 788; Khabi-
6. Maksimov V., Zaynullin R., Akhmadiev N., Segura-
bullina G.P., Yanybin V.M., Ibragimov A.G., Dzhemi-
Ceniceros E. P., Martınez Hernandez J.L., Bikbulatova E.,
lev U.M. // Chem. Heterocycl. Compd. 2014. Vol. 50.
Akhmetova V., Kunakova R., Ramos R., Ilyina A. // Med.
P. 726. doi 10.1007/s10593-014-1527-y
Chem. Res. 2016. Vol. 25. P. 1384. doi 10.1007/s00044-
11. Ахметова В.Р., Бикбулатова Э.М., Ахмадиев Н.С.,
016-1574-2
Галимзянова Н.Ф., Кунакова Р.В., Ибрагимов А.Г. //
7. Соколов В.Б., Махаева Г.Ф., Аксиненко А.Ю., Гри-
ХГС. 2018. Т. 54. № 5. С. 520; Akhmetova V.R.,
горьев В.В., Шевцова Е.Ф., Бачурин С.О. // Изв.
Bikbulatova E.M., Akhmadiev N.S., Galimzyanova N.F.,
АН. Сер. хим. 2017. № 10. С. 1821; Sokolov V.B.,
Makhaeva G.F., Aksinenko A.Yu., Grigoriev V.V.,
Kunakova R.V., Ibragimov A.G. // Chem. Heterocycl.
Shevtsova E.F., Bachurin S.O. // Russ. Chem. Bull.
Compd. 2018. Vol. 54. N 5. P. 520. doi 10.1007/s10593-
2017. Vol. 66. N 10. P. 1821. doi 10.1021/jo0485334
018-2299-6
Skeletal Diversity in Catalytic Synthesis
of (1,3-Oxazacycloalk-3-ylmethyl)-Substituted Pyrroles
V. R. Akhmetovaa, b, *, E. M. Bikbulatovaa, R.V. Kunakovab, K. L. Ametac, and A. G. Ibragimova
a Institute of Petrochemistry and Catalysis, Ufa Federal Research Center of Russian Academy of Sciences,
pr. Oktyabrya 141, Ufa, 450075 Russia
*e-mail: vnirara@mail.ru
b Ufa State Petroleum Technical University, Ufa, Russia
с Department of Chemistry, School of Sciences, Mody University of Science and Technology, Rajasthan, India
Received April 9, 2019; revised April 9, 2019; accepted April 12, 2019
A series of di- and trinuclear pyrrole derivatives was prepared by the 5 mol % ZrOCl2·8Н2О-catalyzed
CH-sp2-aminomethylation reaction of pyrrole with bis(1,3-oxazacycloalk-3-yl)methanes. The reaction pro-
ceeds at the positions 2, 5 or 2 of pyrrole depending on the amount of aminomethylating reagents obtained from
formaldehyde and α,ω-amino alcohols (2-aminoethan-1-ol, 3-aminopropan-1-ol, 4-aminobutan-1-ol). The ami-
nomethylation reaction of indole with bis(1,3-oxazolidin-3-yl)methane proceeds at the position 3. In the case
of carbazole, N-aminomethylation proceeds under these conditions.
Keywords: pyrrole, indole, carbazole, amino alcohols, formaldehyde, aminomethylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019